このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
タンパク質 - タンパク質相互作用の阻害剤の開発を通じてREPLACE:アプリケーションの設計と開発非ATP競合CDK阻害剤に
要約
We describe implementation of the REPLACE strategy for targeting protein-protein interactions. REPLACE is an iterative strategy involving synthetic and computational approaches for the conversion of optimized peptidic inhibitors into drug like molecules.
要約
REPLACEより効果的にタンパク質 - タンパク質相互作用薬(PPI)を対象に開発されたユニークな戦略です。そのような結合部位とその潜在的な薬物標的の大部分を表すための阻害剤の同定のための改良された方法を提供することによって、利用可能な薬物標的の空間を拡張することを目的とします。この論文の主な目的は、計算と合成化学の手法を伴うREPLACE戦略の使用および適用の方法論的な概要を提供することを目的とします。 REPLACEは、抗腫瘍治療薬としての非ATP競合的サイクリン依存性キナーゼ(CDK)阻害剤の開発への応用を通して例示されます。 CDKはしばしば癌において調節解除されているので、薬剤開発のための重要な標的と考えられています。 S期におけるCDK2 /サイクリンAの阻害は、E2F1の経路を介したp53依存的に癌細胞の選択的アポトーシスを促進することが報告されています。サイクリンバインディンでのタンパク質 - タンパク質相互作用を標的G溝(CBG)は、転写のCDKを超える細胞周期の特異的阻害を可能にする手法です。 CBGは、CDKの基質および腫瘍抑制タンパク質由来のコンセンサス配列によって認識されるモチーフ(CBM)に結合するサイクリンと呼ばれます。 CBMは、以前に十分な活性(RRLIF)を保持ペンタペプチドに切り捨てられ、さらにその後p21Waf(HAKRRIF)からオクタペプチドに最適化されています。一般的に、ペプチドは、細胞透過性ではなく、代謝的に不安定なので、(計算濃縮を通じて部分的リガンドの代替と交換)を交換戦略は以上の薬物のような阻害剤を生成するために適用されています。戦略は、選択的に細胞周期CDK /サイクリン複合体を阻害断片ライゲーション阻害ペプチド(フリップ)の設計から始まります。フリップは上の交換に続いて、N末端(NCAPS)から開始して、反復的に小分子(キャッピング基)のような断片でHAKRRLIF / RRLIFの残基を置換することにより作製しましたC末端。これらの化合物は、抗腫瘍治療薬としての非ATP競合的CDK阻害剤の生成のためのポイントを開始しています。
概要
この記事では、それ以上の薬学的に関連する分子にタンパク質-タンパク質相互作用のペプチド性阻害剤を変換するための戦略REPLACE(計算濃縮用いた部分リガンド代替と交換)を適用したケーススタディでは、1〜3に記載されています 。 PPIは、潜在的な薬物標的の豊富なしかしunderexploitedソースを示しているが、既存の方法論は、これらが広くアクセス可能にするために大部分が不十分です。フラグメントベースの設計4、ハイスループットスクリーニング5,6は進歩を提供したステイプルペプチドを含む現在の戦略は、しかし、これらは、多くの場合、効果がありません。その結果、より多くの進歩と、より効率的なアプローチが必要とされます。 REPLACEは、完全に薬物様特性を改善したキナーゼ阻害剤の開発で確認し、抗腫瘍治療薬としてのさらなる開発の可能性を持っているされています。この戦略は、細胞の非ATP阻害剤の開発に例示されていますサイクルのCDKと次のように含む:1)サイクリン結合溝とHAKRRLIF / RRLIFの相互作用の3次元構造情報を取得します。 2)ペプチドの相互作用のための重要な結合決定基を決定します。一つ以上の結合決定基を含むペプチドN末端の3)切り捨て。 4)計算ペプチドの切断部分のための潜在的な小分子の選択肢(部分的リガンド代替、のPLA)の同定とその親ペプチドの重要な相互作用を保持します。 5)のPLAの合成または商業ソーシングは、以前削除されたペプチド残基(複数可)によって占有サブサイトと強く結合すると予測します。 6)固相合成を使用して切断されたペプチドへの最善のPLAの連結を通じてフリップの合成;細胞生存率アッセイにおけるさらなる特徴付けに続いてインビトロ結合または機能的アッセイ(CDK /サイクリンコンテキストで蛍光偏光)におけるフリップの7)テスト。 REPLACE strategの略図Yは、 図1に示されている。この論文では、REPLACE戦略の反復を議論して詳細に説明CDK2 /サイクリンAに適用されます。 CDK類は、直接または間接的に、腫瘍の大部分において調節解除されると考えられているので、適切な癌薬剤標的7と考えられています。 CDKは完全な活性化のためのサイクリンとの関連付けを必要とし、その後、細胞周期の調節に関与する重要な8蛋白質をリン酸化します。 CDKの二つの主要なグループは、細胞周期チェックポイントを制御アイソタイプ[G1 / S(CDK4 /サイクリンD、CDK6 /サイクリンDおよびCDK4 /サイクリンE)、S相(CDK2 /サイクリンA)、およびG2 / M(CDK1 /ありますサイクリンB)]とリン酸化を介したRNAポリメラーゼのレギュレータ(CDK7 /サイクリンH、CDK8 /サイクリンC、CDK9 /サイクリンT)。 E2F1転写因子は、次いでDNAに結合し、遺伝子転写を開始するDPタンパク質と複合体を形成する際に、S期の進行における重要なステップが発生します。 CDK2 /サイクリンAは、E2F1の転写を中和するために必要とされますリン酸化を介し活動によりE2F1-DP複合体およびその後の分解の放出をもたらします。 CDK2 /サイクリンAの阻害は、そのDNAに結合した状態が持続的活性化をもたらすでE2F1を維持すると考えられています。 E2F-1活性の結果として得られるレベルは、したがって、治療戦略を示唆したp53依存性アポトーシスを誘導するために必要な閾値を上回るだろう。無秩序なのp53およびpRb経路に、E2F-1の高レベルは、しばしば、癌細胞及びCDK2 /サイクリンAの阻害を生じる、腫瘍に選択的アポトーシスをもたらすはずであると検証さ癌標的7と考えることができます。
臨床的に研究さCDK阻害剤は、ヒトキノームより大きい500のプロテインキナーゼの中で反応性を横断する主要な高度に保存されたATP結合部位を標的とし、潜在的な効果と毒性9を左右に生じます。別のアプローチは、CBGを介して基板動員を標的とすることによって、非ATP競合阻害でありますサイクリン正の調節サブユニット上に存在し、したがってこれはATP結合部位10,11からはっきりと離れています。 CBGは、主に、サイクリンA、サイクリンDおよびサイクリンE中に存在する疎水性の溝であり、基板および腫瘍抑制に見出されるコンセンサス配列を認識することが示されています。単離されたペプチドとして、サイクリン結合モチーフ(CBM)は、CBGに結合し、細胞周期CDKのキナーゼ活性を阻害することが示されています。 CBMは、オクタペプチド(HAKRRLIF、CDK2 /サイクリンA、IC 50 0.07±0.02μM、CDK4 /サイクリンD、IC 50 0.88±0.34μM)および薬物のための分子量との間の良好な妥協を表すペンタペプチドにさらに切り捨てに最適化されています肖像および効力(RRLIF、CDK2 /サイクリンA、IC 50 1.01±0.17μM、 CDK4 /サイクリンD、IC 50 25.12±2.97μM)12,13。 CBGsはacidiにより架橋された大きな一次と二次小さい疎水性ポケットで構成されC領域は、(Glu220、Glu224およびAsp283を含みます)。 HAKRRLIFの重要な結合決定は、酸性領域とプライマリ親油性部位とLeu6とPhe8の相補性度の高いLys3の、Argを4と引数5の二次疎水性ポケット、イオン対と水素結合を有するAla2の相互作用が含まれます。 Ile7が主ポケットとの最適な接触を可能にするスペーサー残基として作用しながら加えて、多数の水素結合は、ペプチド骨格から寄与しています。 CBGとの結合様式とHAKRRLIFの相互作用は、図2に示されています。
CBM / CBGタンパク質-タンパク質相互作用を標的とすることは、CDK2 /サイクリンA、CDK2 /サイクリンE&CDK4 /サイクリンDのキナーゼ活性を阻害し、正常細胞を7に影響を与えずに 、これは、癌細胞のE2F1媒介アポトーシスを誘発する必要があります。 CBM由来ペプチドは、細胞周期のCDKの有効な阻害剤であるが、それは、それらの代謝に薬剤として有用である可能性は低いです不安定性と細胞透過性の一般的な不足。この目的のために、我々は、CDK2 /サイクリン阻害を介して調節解除されたE2F1を利用した抗腫瘍治療法のさらなる発展のためのより多くの薬剤様化合物にこれらの強力なペプチド性阻害剤を変換するために、REPLACE戦略を適用しています。以下のプロトコルは、サイクリン溝にREPLACEの適用に完成された作品をまとめたものです。まず第一に、HAKRRLIFのN末端テトラペプチドのための薬剤のようなキャッピング基の置換が同定されました。さらに、これらの群の改善は、REPLACEのための追加の検証試験で検討しました。これらの研究からの代表的な結果も提示されています。
プロトコル
潜在的な小分子キャッピング基の1計算の同定
注:原則として、ドッキングまたはファーマコフォア検索方法の様々な潜在的なキャッピング基を予測することができます。 REPLACEにおける計算の研究の主な目的は、置換されたアミノ酸の機能および相互作用を保持する小分子を同定することです。
- LigandFitドッキングプロトコル14の検証
注意:以前の研究では、ドッキング法(LigandFit 15、分子モデリングプログラムスイートのモジュール、ディスカバリー・スタジオ3.0)は、このアルゴリズムが知られているNCAPSの結合様式を再現するために、結果がで得られたことを示すのに十分であることを保証するために検証されました未知の化合物は、予測14です。
- 次の手順(1.2から1.5)を使用して、次のように、LigandFitのための最適なパラメータを識別:PLP1アンをポーズ生成のためのネルギーグリッド、ポーズの分析用に生成されたポーズやPLP1のスコアリング関数の最小化。
- 得られたコンホメーションを制限し、キャップされたペプチドに共有結合を形成するために適切なリガンドを位置決めするために、水素結合相互作用のためのフィルタとしてそれぞれTrp217およびGln254のインドール窒素とアミド窒素原子を設定します。
- デザインおよびCDK2 /サイクリン受容体(2UUE)にフラグメントの選択肢のライブラリをドッキング。合成とPLP1スコアリング、CBGとの相互作用フィルタと相補性との相互作用に基づく市販の調達のための潜在的なキャッピング・グループに優先順位を付けます。次のようにLigandFitドッキングに必要な各種のステップがあります。
- 受容体結合部位14の調製
- ソフトウェアでの可視化ウィンドウに:CDK2 /サイクリン結晶構造(2UUE PDB ID)をインポートします。この構造は、以前に同定されたFLIP 5-メチル-1-フェニル-1H- 1を含んでいます、2,4-トリアゾール-3-カルボキサミド(3,5- DCPT)RLIFサイクリン溝に結合している( 図3)。
- 残基RLIF(C末端)を削除するか、所定の位置に保ちます。ペプチド配列が保持されると、リガンドに対する相互作用のフィルタとして、ペプチドのN末端アミノ基を使用します。 「受容体 - リガンド相互作用」ツールから、N-キャップの表示/非表示サイト球から3,5- DCPT周りに球を作成します。球体は、リガンド - 受容体相互作用の結合中に発生させて結合部位に活性領域を定義するために作成されます。
- 「選択されたリガンドの量としてサイトを見つける」とタンパク質からリガンド3,5- DCPTを削除からさらに結合部位を定義します。作成した球内結合の量を定義するには、この手順を実行します。
- 水素結合のための相互作用フィルターとして残基Trp217およびGln254のインドール窒素とアミド窒素原子を設定します。 INTEだけポーズするように相互作用フィルタを設定します。セット残基の原子とRACTは、したがって、ドッキングされたポーズで重要な相互作用を維持し、ドッキングプロセス中にフィルタリングされます。
- リガンド14の調製
- 分子量500未満、二次ポケットで切り捨てられたペプチドおよびファンデルワールス相互作用のための適切な疎水性基(置換フェニル基)を含めるようにとの連結のためのカルボキシレート基の存在を含む基準に基づいて、100の潜在的なキャッピング・グループのライブラリーを設計します表1に示します 。
- HAKRRLIFの塩基性側鎖のイオン対相互作用を置換するために含まTrp217および置換基を有するペプチド水素結合相互作用を模倣するための複素環を選択します。カルボニル酸素は、親ペプチド( 表1)におけるペプチド骨格に類似Gln254のアミドの窒素原子と相互作用できるように、それぞれのアルデヒド分子のようなリガンドをドッキングします。
- ドキュメントの前に王は、低エネルギー立体構造に設計されたリガンドを最小限に抑え、「リガンドの準備」プロトコルを使用して適切なイオン化状態に準備します。ソフトウェアにインポートされる前に、スプレッドシートのためのChemDrawでの.sdfファイル形式でこれらの潜在的なN個のキャップを描画し、エクスポートします。
注:リガンドプロトコルを準備全てのリガンドを最小化するために使用され、それらの最低エネルギー状態にドッキングすると、イオン化有料原子に適用しました。デフォルトのパラメータは、このステップのために使用されます。
- サイクリンA 溝 14へのリガンドのドッキング
- ソフトウェアの受容体 - リガンド相互作用のプロトコルセットからLigandFitルーチンを選択します。このプロトコルの入力として受容し、準備されたリガンドを使用してください。
- エネルギーグリッドとしてこれらのランを選択PLP1の場合、それはエネルギーが最小と10と生成されたポーズの数はデフォルト値で、他のすべてのパラメータを残すことをするポーズを指定します。
注意:LigandFitですモンテカルロコンフォメーション探索アルゴリズムと組み合わされる形状ベースの比較のフィルタを使用して、タンパク質の活性部位に高い相補性、および潜在的な親和性のポーズを識別して生成することができるドッキング方法。ドッキングプログラムによって使用されるエネルギー・グリッドは、リガンド - 受容体相互作用および潜在的なポーズを発生させるための力場です。 PLP1は、具体的には、水素結合相互作用を優先し、PLP原子タイプは、各非水素リガンド原子または非水素原子を受容するために割り当てられている場合に、区分的線形の電位です。
- 結果の分析
- 最初のインスタンスでは、ディスプレイはビジュアライザプログラムでポーズして、PLP1スコアの値を降順でソート。候補リガンドに基づくドッキングリガンドの結合親和性を推定するためにこのようなPLP1などのスコアリング関数を使用する標的受容体構造の幾何学的形状と非共有結合相互作用をもたらします。
注:ここでは、PLP1スコアリング関数は、gで見出されましたこれは水素結合の推定値を含むように、最良の結果をアイブ。 - 2)サイクリン溝との相互作用フィルターと3)視覚的な相補性を満たし、視覚的に知られているキャッピング基2オングストローム未満(相対平均二乗偏差(RMSDを持つ)の値)を持つ1)重ね合わせ用の得点ポーズのトップ25%を分析。これは、正しくドッキングされていることで認められている(実験的構造と比較して)ポーズ<2オングストロームのRMSD値を持っています。
- 既知の構造活性相関と矛盾しない方法で、結合ポケットの効率的な充填を有すると定義されている視覚的な相補性、のためのポーズを調べます。対話フィルタは結合および/またはアミド結合形成のための適切な幾何学の潜在的なキャッピング基を配置するために必要とされるために重要であることが知られている分子間接触を必要とする原子の制約を含むように設定されています。 interactioと水素結合を作るの潜在的N-キャッピング基のドッキングしたポーズの三つの例n個のフィルタは、 図4に示されています。
- 最初のインスタンスでは、ディスプレイはビジュアライザプログラムでポーズして、PLP1スコアの値を降順でソート。候補リガンドに基づくドッキングリガンドの結合親和性を推定するためにこのようなPLP1などのスコアリング関数を使用する標的受容体構造の幾何学的形状と非共有結合相互作用をもたらします。
潜在的なN -cappingグループの2の合成とキャラクタリゼーション
- N-キャッピング基の合成。
- 得られた合成のために、すべての市販の出発物質、溶媒および試薬を使用しています。従来の有機合成化学(例えば図5 12,13)により潜在的なN-キャッピング基を合成します。
- 反応を監視するためにシリカゲル上の薄層クロマトグラフィー(TLC)を行います。
- 移動相中の出発物質、反応混合物(1 mg)を溶解し、毛細管を用いたTLCプレート上にスポット。
- (35:65の比率で酢酸エチルおよびヘキサン)、移動相を含むチャンバーにTLCプレートを置きます。移動相は、TLCプレートの90%に達すると、削除して空気プレートを乾燥します。
- 目に見えるスポットとして出発物質との反応混合物を検出するために、UV光を使用してください。カル全てのスポット(スポットと移動相が移動した距離の比)のR Fをculate。
注:出発物質のR fで見られるいかなる点が存在しない場合、反応が完了しました。
- 反応終了後、必要に応じて水性酸または塩基溶液を分液漏斗、洗浄に配置することにより、反応混合物を後処理。真空下で得られた粗生成物を、有機溶媒を収集し、ロータリーエバポレーターでそれを蒸発、乾燥。
- 適切な溶媒3-5 ml中の粗生成物500mgのを溶解し、シリカまたはRP18サンプの1グラムに加え、空気下で乾燥しました。 6%の酢酸エチルから始まる勾配ランでSNAP 100gのカラムを用いて(製造業者のプロトコルに従って)シリカ/ RP SNAPフラッシュカートリッジ中の粗生成物を含むサンプを配置し、自動化された高性能フラッシュクロマトグラフィーを用いて粗生成物を精製:94以上50%酢酸エチル、50%ヘキサン%のヘキサン15カラム体積。
- 乾燥するまで、すべての溶媒を蒸発させ、ロータリーエバポレーターを用いてフラッシュクロマトグラフィーで溶媒に回収精製された生成物を乾燥し、さらにすべての残留溶媒を除去するために真空下で生成物を乾燥させます。 NMR、MSおよび分析HPLCにより精製された生成物の特徴付けを行います。
- 1 H NMRおよび13 C NMRについては、適切な重水素化溶媒に溶解し、精製されたサンプルのおよそ10mgを秤量し、NMRスペクトルを記録するため2,14乾燥NMRチューブに内容物を移します。
- 高磁場NMR分光計(最小300メガヘルツ)で1 H NMRおよび13 C NMRスペクトルを記録します。 QTOF(飛行質量分析計のタンデム四重-1時)、エレクトロスプレーイオン化(ESI)またはVG 70S(二重収束磁場型質量分析計、EI)2,14を使用して質量スペクトルを取得します。
- ダイオードアレイ検出器を備えたHPLCによって生成物の純度を分析し、装備C18(2)100 A、250×4.6ミリメートル、分析のために5μmのカラム。 30分かけて60%アセトニトリル(0.1%トリフルオロ酢酸)に、100%の水(0.1%トリフルオロ酢酸)から始まる勾配ランを使用し、4分間の勾配を保持します。 226と254 nmの2,14でクロマトグラムを抽出します。
注意:評価された化合物の分析純度は> 95%でした。
フリップ2の生成3.固相合成
- Nに覆われたフリップの合成
- 次の手順を使用して、標準的な固相合成法により、n-キャップしたペプチド化合物を組み立てます。
- 2mlのO -Benzotriazole- N、N、N '、N' -テトラメチルウロニウムヘキサフルオロホスフェート(HBTU、221.93 mg)を4.4当量のC末端アミノ酸(Fmocの脱phe)の5当量を活性化します5分間DMF。ジイソプロピルエチルアミンの6当量(DIPEA、103.13を使用したリンク樹脂上のFmoc-PheをHBTU混合物をロードしますRTで1時間MG)。
- 10分間DMF 3ml中の20%ピペリジンを用いて、C末端残基からのFmoc保護基を除去します。カップル後続のアミノ酸 (例えば、のFmoc-Ileに、のFmoc-Leuの、のFmoc-Argを-PMC)ステップバイステップ。各ステップにおいて、DIPEA(103.13 mg)を、室温で1時間DMF 2ml中のHBTU(221.93 mg)を4.4当量の6当量を使用して、次のアミノ酸のカップル5当量。
- 洗浄サイクル前述のアミノ酸カップリングおよびFmoc脱保護工程の後(DMFのDCM + 5×10mlを5×10 ml)を適用します。ペプチドアセンブリの後、室温で1時間、2mlのDMF中のDIPEAの6当量(103.13 mg)を、およびHBTUの4.4同等物(221.93 mg)を使用して、カップルのN-キャッピング基。
- 側鎖保護基を除去し、そして切断する樹脂から反転する(5 TFA / H 2 O / TIPS:5:90)O / Nペプチドアセンブリが完了すると、2切断混合物のmlの反応混合物を処理します。冷ジエチルエーテル沈殿させると私で得られた生成物を粉砕しますロータリーエバポレーターでF必要な濃縮物。
- 次の手順を使用して、標準的な固相合成法により、n-キャップしたペプチド化合物を組み立てます。
- Nをかぶった-Cに覆われたフリップの合成
- Oと一緒に(16.1ミリグラム、0.02ミリモル)のジクロロメタン、および追加[4-(3-クロロフェノキシ)ピリジン-2-イル]メタンアミン(Cキャップ)秤量し、N末端 キャップをして、保護されたのArg-Leuのペプチドを溶解-ベンゾトリアゾールN、N、N '、N' -tetramethyluroniumニウムヘキサフルオロホスフェート(HBTU、16.7ミリグラム、0.02ミリモル)およびN、N-ジイソプロピルエチルアミン (DIPEA; 6.5ミリグラム、0.02ミリモル)。
- TLC / HPLCが出発物質の完全な消費を示すまで撹拌し、室温で反応を監視します。反応終了後、酢酸エチルと水の間で回転蒸発器と、パーティションを使用して、粗反応混合物を濃縮します。
- 水性および有機層を分離します。 1NのNaOH、1NのHCl、およびブラインで有機層を洗浄します。硫酸ナトリウム約1gで有機層を乾燥し、ロータリーエバポレーターで生成物を濃縮します。フィナ(:2.5:2.5のトリフルオロ酢酸/ H 2 O / TIPS 95)脱保護のためLLY切断混合物と製品のO / Nを扱います。
- すべての溶媒を除去するために乾燥を完了するために、ロータリーエバポレーターで濃縮必要冷ジエチルエーテルであれば、得られた生成物とを粉砕します。さらに、すべての残留溶媒を除去するために真空下で生成物を乾燥させます。
- フリップの精製および特性評価
- セミ分取逆相HPLC法を用いて、粗反転を精製します。精製されたフリップを凍結乾燥し、質量分析2,14を使用して、それらの分子量を特徴付けます。
- ダイオードアレイ検出器を備えたHPLCによってフリップの分析純度を測定し、C18(2)100 A、250×4.6ミリメートル、5μmのカラムを備えました。 95%H 2 O(0.1%トリフルオロ酢酸)/ 10%アセトニトリル(0.1%トリフルオロ酢酸)、35%のH 2 O(0.1%トリフルオロ酢酸)/ 65%アセトニトリル(0.1%trifluoroaceから出発する勾配法を使用しチック酸)を30分かけてとは、4分間の勾配を保持します。 226と254 nmのクロマトグラムを抽出します。
4.蛍光偏光競合結合2,14の決意のための結合アッセイ
- 以下の手順を使用して、黒色の384ウェル(138μl)をプレートでアッセイを行います。
- サンプル、トレーサーペプチド(4 nM)を、およびキナーゼ複合体希釈(CDK2 /サイクリンAを - 18 / mlの、CDK4 /サイクリンD - 37 / mlの)アッセイ緩衝液(25mMのHEPESのpHが7、10 mMの中で必要とされる濃度にNaCl、0.01%ノニデットP-40、1mMジチオスレイトール(DTT)。
- 384ウェルプレートの各ウェルに、追加します。CDK4D1またはCDK2CA(0.3μgの/ウェルに精製された組換えヒトキナーゼ複合体)、5μlの化合物溶液、30 nmのトレーサーペプチド(フルオレセイニル-AHX-PRO-ヴァルの5μlに5μlの-Lys-Argを-Argの-Leu-(3ClPhe)-Glyまたはフルオレセイニル-AHX-PRO-ヴァルのLys-Argの-Argの-Leuの-Pheの-Glyをトレーサーペプチド)。各DMSOを5μlの(6%)、ブフェを使用してくださいR、トレーサーおよび5μlのDMSO(6%)、キナーゼ複合体、対照ウェルとしてトレーサー
- すべての成分を加えた後、室温で1分(41.16 XG)を500 rpmでプレートを遠心分離し、次いで、室温で45分間撹拌しながらプレートをインキュベートします。マルチプレートリーダーと検出器を485nm / 535nmの励起/発光フィルターを装着し、ダイクロイックミラーを使用することで、プレートに、各ウェルの蛍光強度を読み取ります。
- 以下示す式を使用して、すべての試験サンプルの相対平均偏光(MP)を計算します。相対MPSとテスト濃度を相関させることによって、対数回帰により、IC 50値を決定します。
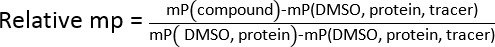
結果
サイクリン溝にHAKRRLIFの相互作用は 、図2に示されている。キー結合決定を表すペプチド残基が他の残基が小さい貢献12,13,18を提供してAla2、ARG4、Leu6とPhe8が含まれます。このケーススタディでREPLACE戦略は、主にAla2およびARG4の相互作用を模倣する、HAKRRLIFのN末端テトラペプチド中の残基のためのフラグメントの選択肢を見つけるために利用されてきました。潜...
ディスカッション
Targeting protein-protein interactions (PPI) in drug discovery is highly challenging as these typically involve a large shallow contact interface comprised of numerous and diffuse contacts19. Furthermore, peptidic compounds which inhibit PPI’s that are amenable to drug discovery are problematic due to their higher molecular mass, metabolic instability and poor bioavailability20. Current strategies that have been applied for the development of PPI inhibitors include design of proteomimetics and...
開示事項
The authors declare that they have no competing financial interests.
謝辞
We thank Dr’s. Douglas Pittman and Michael Wyatt for their assistance with cell culture and Dr Wyatt and Ms. Erin Anderson for help in development of the binding assays. We acknowledge Mike Walla and Bill Cotham in the Department of Chemistry and Biochemistry at the University of South Carolina for assistance with Mass Spectrometry, Helga Cohen and Dr. Perry Pellechia for NMR spectrometry. This work was funded by the National Institutes of Health through the research project grant, 5R01CA131368.
資料
| Name | Company | Catalog Number | Comments |
| Computational Chemistry | |||
| Accelyrs Discovery studio 3.0 | |||
| Dell Optiplex Workstations | |||
| Synthetic Organic Chemistry | |||
| Silica gel (GF-254 plates) for TLC, Biotage (Uppsala, Sweden) for flash chromatography, Waters Alliance 2695 HPLC with a 2996 diode-array detector and equipped with a C18 (2) 100 A, 250 x 4.6 mm, 5 μm column (Phenomenox Luna) for purity determination, 1H NMR and 13C NMR spectra were recorded with a Varian Mercury 300 and 400 Spectrometer, respectively. Mass spectra were measured with a Micromass QTOF (Tandem quadruple-1 time of flight mass spectrometer), electrospray ionization (ESI) and VG 70S (Double-focusing magnetic sector mass spectrometer, EI). | |||
| Flourescence Polarization Assay | |||
| 384 micro well plates, Micro pipets | Grenier Bio-one | 110256602 | |
| CDK4D1 and CDK2CA (well purified recombinant human kinase complex) | BPS Bio Sciences | 40094(CDK4/Cyclin D), 41101(CDK2/Cyclin A) | |
| assay buffer (25 nM HEPES pH 7, 10 mM NaCl, 0.01% Nonidet P-40, 1 mM dithiothretiol (DTT)) | |||
| 25 nM HEPES | CALBIOCHEM | 375368 | |
| NaCl | Fisher | 127838 | |
| Nonidet P-40 | US Biological | N3500 | |
| DTT | Aldrich | ||
| -70 °C freezer | Revco (Ultima II) | ||
| DTX880 multimode detector fitted with 485 nm/535 nm excitation/emission filters and a dichroic mirror suitable for fluorescein | Beckman Coulter, Brea, CA | ||
| Cell Culture | |||
| 96 well plates | Fisher | ||
| Frozen stocks of U2OS (osteosarcoma) and DU145 (prostate cancer) cell lines | ATCC | ||
| NU serum, DMEM media, trypsin, PEN/STRIP, MTT reagent | Fisher, Life technology, Alfa Aesar | ||
| Heamocytometer | VWR | ||
| -70 °C freezer | Revco (Ultima II) | ||
| Incubator | Thermo electron corporation | ||
| Centrifuge | Eppendorf | 5804 R | |
| Refrigerator 4-8 °C | Isotemp Fisher | ||
| DTX880 multimode detector fitted with 595 nm filter | Beckman Coulter, Brea, CA | ||
参考文献
- Andrews, M. J., et al. REPLACE: a strategy for iterative design of cyclin-binding groove inhibitors. Chembiochem. 7, 1909-1915 (2006).
- Liu, S., et al. Optimization of Non-ATP Competitive CDK/Cyclin Groove Inhibitors through REPLACE-Mediated Fragment Assembly. J Med Chem. 56, 1573-1582 (2013).
- McInnes, C., Bernstein, M., Desai, P. Chapter 29. Annual Reports in Medicinal Chemistry. 47, 459-474 (2012).
- Bower, J. F., Pannifer, A. Using fragment-based technologies to target protein-protein interactions. Curr Pharm Des. 18, 4685-4696 (2012).
- Makley, L. N., Gestwicki, J. E. Expanding the number of 'druggable' targets: non-enzymes and protein-protein interactions. Chemical biology, and drug design. 81, 22-32 (2013).
- Walensky, L. D., Bird, G. H. Hydrocarbon-Stapled Peptides: Principles, Practice, and Progress. J Med Chem. , (2014).
- Shapiro, G. I. Cyclin-dependent kinase pathways as targets for cancer treatment. J Clin Oncol. 24, 1770-1783 (2006).
- Thais, M., Sielecki, J. F. B., Enfield, P. A., Trainor, G. l. Cyclin dependant kinase inhibitors: Useful targets in cell cycle regulation. Journal of medicinal chemistry. 43, 1-18 (2000).
- Morphy, R. Selectively nonselective kinase inhibition: striking the right balance. J Med Chem. 53, 1413-1437 (2010).
- Chen, Y. N., et al. Selective killing of transformed cells by cyclin/cyclin-dependent kinase 2 antagonists. Proc Natl Acad Sci USA. 96, 4325-4329 (1999).
- Orzaez, M., Gortat, A., Mondragon, L., Bachs, O., Perez-Paya, E. ATP-noncompetitive inhibitors of CDK-cyclin complexes. ChemMedChem. 4, 19-24 (2009).
- Kontopidis, G., et al. Insights into cyclin groove recognition: complex crystal structures and inhibitor design through ligand exchange. Structure. 11, 1537-1546 (2003).
- McInnes, C., Andrews, M. J., Zheleva, D. I., Lane, D. P., Fischer, P. M. Peptidomimetic design of CDK inhibitors targeting the recruitment site of the cyclin subunit. Current medicinal chemistry. Anti-cancer agents. 3, 57-69 (2003).
- Premnath, P. N., et al. Fragment based discovery of arginine isosteres through REPLACE: towards non-ATP competitive CDK inhibitors. Bioorganic, and medicinal. 22, 616-622 (2014).
- Venkatachalam, C. M., Jiang, X., Oldfield, T., Waldman, M. LigandFit: a novel method for the shape-directed rapid docking of ligands to protein active sites. J Mol Graph Model. 21, 289-307 (2003).
- Mendoza, N., et al. Selective cyclin-dependent kinase 2/cyclin A antagonists that differ from ATP site inhibitors block tumor growth. Cancer Res. 63, 1020-1024 (2003).
- Denizot, F., Lang, R. Rapid colorimetric assay for cell growth and survival. Modifications to the tetrazolium dye procedure giving improved sensitivity and reliability. J Immunol Methods. 89, 271-277 (1986).
- Zheleva, D. I., et al. Highly potent p21(WAF1)-derived peptide inhibitors of CDK-mediated pRb phosphorylation: delineation and structural insight into their interactions with cyclin A. The journal of peptide research : official journal of the American Peptide Society. 60, 257-270 (2002).
- Ivanov, A. A., Khuri, K. F. R., Fu, H. Targeting protein-protein interactions as an anticancer strategy. Trends in Pharmacological Sciences. 34, (2013).
- Thayer, A. M. Improving peptides. Chemical and Engineering News. 89, 13-20 (2011).
- Yin, H., Hamilton, A. D. Strategies for targeting protein-protein interactions with synthetic agents. Angew Chem Int Ed Engl. 44, 4130-4163 (2005).
- Jubb, H., Higueruelo, A. P., Winter, A., Blundell, T. L. Structural biology and drug discovery for protein-protein interactions. Trends Pharmacol Sci. 33, 241-248 (2012).
- Cannon, J. B. Pharmaceutics and drug delivery aspects of heme and porphyrin therapy. J Pharm Sci. 82, 435-446 (1993).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved