Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Разработка ингибиторов белок-белковых взаимодействий через REPLACE: Приложение к проектированию и развитию Номера ATP Конкурсная CDK ингибиторов
В этой статье
Резюме
We describe implementation of the REPLACE strategy for targeting protein-protein interactions. REPLACE is an iterative strategy involving synthetic and computational approaches for the conversion of optimized peptidic inhibitors into drug like molecules.
Аннотация
REPLACE является уникальная стратегия разработана для более эффективного целевого белок-белковых взаимодействий (ИЦП). Она направлена на расширение доступной целевой препарат пространство, обеспечивая улучшенное методологию для идентификации ингибиторов для таких сайтов связывания и которые представляют большинство потенциальных мишеней для лекарственных средств. Основная цель данной работы заключается в предоставлении методологической обзор использования и применения REPLACE стратегии, которая включает в себя вычислительные и синтетические подходы химии. REPLACE иллюстрируется с помощью его применения к развитию не ATP конкурентоспособной циклинзависимых киназ (CDK) ингибиторов в качестве противоопухолевых терапии. CDKs часто дерегулирование рака и, следовательно, рассматриваются как важные цели для разработки лекарств. Ингибирование CDK2 / циклин А в S фазе, как сообщалось, способствуют селективной апоптоз раковых клеток в р53 независимым образом через E2F1 пути. Ориентация белок-белкового взаимодействия в циклин bindinг паз (ЦБС) является подход, который позволит специфическое ингибирование клеточного цикла в течение транскрипционных CDKs. ЦБС признан консенсусной последовательности, полученной из CDK субстратов и супрессоров опухоли белка называется циклин связывающий мотив (CBM). Сообщение Cell Broadcast ранее была оптимизирована с октапептидом от p21Waf (HAKRRIF), а затем дополнительно усекается до пентапептида сохраняя достаточную активность (RRLIF). Пептиды в общем не клетки проницаемыми, метаболически нестабильны и поэтому REPLACE (замена с частичным лиганда Альтернативы через Вычислительная обогащение) стратегии был применен для того, чтобы генерировать более ингибиторов наркотиков, как. Стратегия начинается с разработки фрагмента лигировали тормозных пептидов (переворачивает), которые селективно ингибируют клеточного цикла CDK / циклин комплексы. Переворачивает были получены путем итеративного замены остатков HAKRRLIF / RRLIF с фрагментом, как малых молекул (укупорки группы), начиная с N-конца (НКПД), с последующей заменой наС-конец. Эти соединения представляют собой отправную точку для генерации без АТФ конкурентных ингибиторов CDK в качестве противоопухолевых терапии.
Введение
В этой статье, на примере применения Replace (Замена с частичным использованием лигандов альтернатив вычислительную обогащение) стратегию, чтобы преобразовать пептидные ингибиторы белок-белковых взаимодействий в более фармацевтически соответствующих молекул описывается 1-3. В то время как ИПП представляют собой богатый источник, но недоиспользуются потенциальных мишеней для лекарственных средств, существующие методологии в значительной степени недостаточно, чтобы сделать эти широко доступны. Современные стратегии в том числе на основе фрагмента конструкция 4, высокопроизводительного скрининга 5 и скрепленных пептидов 6 предоставили авансы, однако они во многих случаях неэффективной. В результате, больше прогресса и более эффективные подходы. ЗАМЕНЫ была полностью подтверждена в развитии ингибиторов киназ, которые обладают улучшенными свойствами с наркотиками, как и у потенциал для дальнейшего развития в качестве противоопухолевых терапевтических. Эта стратегия проиллюстрировано в развитии не-АТФ ингибиторов клеткицикл CDKs и включает в себя следующее: 1) получение 3D структурную информацию о взаимодействиях HAKRRLIF / RRLIF с циклин связывания паз; 2) определение важных обязательных определителей для пептида взаимодействия; 3) усечение пептидов N-конца, содержащего один или более св зывани; 4) вычислительная идентификации потенциальных малых молекул альтернатив (частичные лиганд альтернативы, Plas) для усеченного части пептида и которые сохраняют основные взаимодействия исходного пептида; 5) синтез или коммерческой источников пла предсказал связать с жадностью к югу сайте ранее занимаемой удалены пептида остатка (ов); 6) синтез просматривает лигирования лучших лить с укороченным твердофазного синтеза пептидов с использованием; 7) проверка переворачивает в лабораторной связывания или функциональном анализе (поляризация флуоресценции в контексте / циклин CDK) с последующим дальнейшей характеристики в жизнеспособности клеток анализом. Схематическое представление ЗАМЕНИТЬ STRATEGу показано на рисунке 1. В этой статье итераций REPLACE стратегии обсуждаются и приложение к CDK2 / циклин А описан подробно. CDKs, как полагают, прямо или косвенно отменено в большинстве опухолей и, следовательно, считаются подходящими рака лекарственных препаратов 7. CDKs требует объединения с циклинов для полной активации, а затем фосфорилировать ключевых белков, участвующих в регуляции клеточного цикла 8. Две основные группы CDKs являются изотипы, которые контролируют контрольных точек клеточного цикла [G1 / S (CDK4 / циклин D, CDK6 / циклин D и CDK4 / циклин Е), S фаза (CDK2 / циклин А) и G2 / M (CDK1 / циклин В)] и регуляторы РНК-полимеразы посредством фосфорилирования (CDK7 / циклин Н, CDK8 / циклин C, CDK9 / циклин Т). Ключевой стадией в фазе прогрессирования S возникает, когда коэффициент E2F1 транскрипции образует комплекс с белком DP, который затем связывается с ДНК и инициирует транскрипцию гена. CDK2 / циклин А необходим для нейтрализации E2F1 транскрипциидеятельность посредством фосфорилирования что приводит к высвобождению комплекса E2F1-DP и его последующей деградации. Ингибирование CDK2 / циклин А, как полагают, поддерживать E2F1 в его ДНК связанное состояние приводит к постоянной активации. Полученный уровень E2F-1 активности превысит порога, необходимого, чтобы вызвать апоптоз p53 независимого поэтому предлагая терапевтическую стратегию. Благодаря дерегулированном p53 и PRB путей, высокие уровни E2F-1 часто встречаются в раковых клетках и ингибирование CDK2 / циклин А должно приводить к селективной апоптоза в опухолях и может рассматриваться в качестве утвержденного цели рака 7.
Клинически исследованные ингибиторы CDK целевой высоко консервативными ATP сайт связывания, ведущий к перекрестной реактивности среди протеинкиназ больше, чем 500 в человеческом kinome и потенциально порождая побочные эффекты и токсичность 9. Альтернативный подход не является АТФ конкурентное ингибирование путем охвата вербовки субстрата через ЦБСприсутствует на циклин положительной регуляторной субъединицы и который, следовательно, различны и далеки от АТФ сайт связывания 10,11. ЦБС в основном гидрофобный канавки присутствуют в циклин A, циклин D и циклин Е, и было показано, чтобы распознать консенсусную последовательность найти в субстратах и опухолевых супрессоров. В качестве выделенного пептида, циклин-связывающий мотив (СВМ) связывается с ЦБС и было показано, ингибируют активность киназы из CDKs клеточного цикла. Сообщение Cell Broadcast была оптимизирована с октапептидом (HAKRRLIF, CDK2 / циклин A IC 50 0,07 ± 0,02 мкМ, CDK4 / циклин D, IC 50 0,88 ± 0,34 мкм) и, кроме того, усеченная на пентапептида, представляющей собой хороший компромисс между молекулярной массой для лекарственной Сходство и потенция (RRLIF, CDK2 / циклин IC 50 1,01 ± 0,17 мкМ, CDK4 / циклин D, IC 50 ± 2,97 25,12 мкм) 12,13. В CBGs состоят из большого начального и среднего меньшего гидрофобного кармана, которые мостовом помощью ACIDIС-область (включает Glu220, Glu224 и Asp283). Ключевые связывания детерминанты включают HAKRRLIF взаимодействие Ala2 с вторичным гидрофобным карманных, ионных пар и водородных связей Lys3, Arg 4 и Arg5 с кислой области и высокой степенью комплементарности Leu6 и Phe8 с первичным липофильного сайта. Кроме того, многочисленные водородные связи вклад от позвоночника, а пептида Ile7 действует как разделительный остатка, позволяя оптимальный контакт с первичной кармане. Связывание режим и взаимодействия с HAKRRLIF ЦБС показано на рисунке 2.
Ориентация белок-белкового взаимодействия МУП / ЦБС будет препятствовать активность киназы CDK2 / циклин А, CDK2 / циклин E & CDK4 / циклин D, и это должно вызвать E2F1 опосредованного апоптоза раковых клеток, не затрагивая нормальные клетки 7. Несмотря на то, МД Пептиды являются эффективными ингибиторами клеточного цикла CDKs, то маловероятно, что они будут полезны в качестве лекарственных средств из-за их метаболическойнестабильность и общее отсутствие клеточной проницаемости. Для этого, мы применили Заменить стратегию для того, чтобы превратить эти мощные ингибиторы пептидные в более наркотиков, как соединений для дальнейшего развития противоопухолевых терапевтических эксплуататорских дерегулированный E2F1 через CDK2 / циклин A торможение. Следующий протокол обобщает работу, которая была завершена в применении заменит циклин канавки. В первую очередь, были определены наркотиков, как покрывать группы замены для N-концевого тетрапептида HAKRRLIF. Кроме того улучшения в этих группах были исследованы в качестве дополнительного исследования для проверки ЗАМЕНИТЬ. Представитель результаты этих исследований также представлены.
протокол
1. Вычислительная идентификации потенциальных маленькая молекула укупорки групп
Примечание: В принципе, разнообразие док или фармакофорным методов поиска могут быть использованы для прогнозирования потенциальных групп укупорки. Основная цель исследований в вычислительной ЗАМЕНЫ заключается в определении малых молекул, которые сохраняют особенности и взаимодействие аминокислот, которые замещены.
- Подтверждение LigandFit док протокола 14
Примечание: В предыдущих исследованиях, метод стыковки (LigandFit 15, модуль в молекулярной люкс программы моделирования, обнаружения Studio 3.0) был проверен, чтобы обеспечить, что этот алгоритм достаточно воспроизвести обязательные режимы известного НКПД и показать, что результаты, полученные для неизвестные соединения прогностическая 14.
- Используя следующие шаги (1,2 - 1,5), определить оптимальные параметры для LigandFit следующим образом: PLP1 ангии сетки для генерации позе, минимизации генерируемых позах и функции выигрыша PLP1 для анализа позах.
- Для того чтобы ограничить конформации, полученные и позиционировать лигандов соответственно для формирования ковалентной связи в ограничен пептида, установить азота индола и амида азота атомы Trp217 и Gln254 соответственно в качестве фильтров для взаимодействия водородных связей.
- Дизайн и док библиотеки альтернатив фрагментов в CDK2 / циклин A рецептор (2UUE). Приоритеты потенциальные группы укупорки для синтеза и коммерческой источников на основе скоринга, PLP1 взаимодействий с фильтрами взаимодействия и взаимодополняемости с ЦБС. Различные этапы, необходимые для стыковки LigandFit в следующем.
- Подготовка связывания рецептора сайте 14
- Импортировать CdK2 / циклин A кристаллическую структуру (PDB ID: 2UUE) в окне визуализации в программном обеспечении. Эта структура содержит ранее идентифицированную FLIP 5-метил-1-фенил-1Н-1, 2,4-триазол-3-карбоксамидо (3,5-DCPT) RLIF связан с циклин паз (фиг.3).
- Удалить или оставить на месте остатки RLIF (С-концевой). Когда пептидная последовательность сохраняется, использовать N-концевой аминогруппы пептида в качестве фильтра взаимодействия лиганда. Из "рецептор-лиганд" инструментов, создать сферу вокруг N-крышкой 3,5-DCPT из передачи сфере / Скрыть сайта. Сфера создается для определения активной области в сайте связывания, где лиганд-рецепторных взаимодействий разрешено произойти во время связывания.
- Определите сайт связывания дальше от "найти сайт, как объем выбранного лиганда" и удалить лиганда 3,5-DCPT от белка. Провести этот шаг, чтобы определить объем связывания в сфере создания.
- Установите индола азота и азота амидной атомов остатков Trp217 и Gln254 как фильтры для взаимодействия водородных связей. Установите фильтры взаимодействия, так что только те позы, которые InTeRACT с атомами набор остатков будут фильтроваться в процессе стыковки, поэтому, сохраняя важные взаимодействия в состыкованных позах.
- Подготовка лигандов 14
- Дизайн библиотеку 100 потенциальных групп укупорки на основе критериев, включающих молекулярной массой менее 500, наличием карбоксильной группой для лигирования с укороченной пептида и включения соответствующих гидрофобных групп (замещенную фенильную группу) для ван-дер-ваальсовых взаимодействия на вторичном кармане как показано в таблице 1.
- Выбор гетероциклические кольца для имитации пептид водородных связей взаимодействия с Trp217 и заместителей включены для замены ионов сопряжения взаимодействия основными боковыми цепями HAKRRLIF. Закрепление лиганды в виде соответствующих молекул альдегида, так что карбонильный кислород может взаимодействовать с атомом азота амидной Gln254 аналогичной пептидного остова в исходного пептида (таблица 1).
- До документЦарь, свести к минимуму, предназначенные лигандов к низкой энергией конформации и подготовить в соответствующем состоянии ионизации с помощью «подготовить лиганды" протокол. Нарисуйте и экспортировать эти потенциальные N шапки в формате SDF-файла в ChemDraw для таблицы до того, как импортировать в программу.
Примечание: Подготовка протокола лигандов используется, чтобы минимизировать все лиганды быть пристыкован к их нижних энергетических состояний и сборы ионизации были применены к действующим атомов. Параметры по умолчанию используются для этого шага.
- Стыковка лигандов в циклин паз 14
- Выбрать процедуру LigandFit от рецептор-лиганд протокола взаимодействия множества программного обеспечения. Используйте рецептор и подготовленные лигандов в качестве входных для этого протокола.
- Для этих опытах выберите PLP1 как энергосистемы, указать, что ставит быть сведены к минимуму энергии и что число генерируемых позах как 10. Оставьте все остальные параметры на значения по умолчанию.
Примечание: LigandFit являетсяспособ стыковки, которые могут идентифицировать и генерировать позы высокой комплементарности и потенциальной близости с активным сайтом белка с использованием формы на основе сравнения фильтр, который в сочетании с методом Монте-Карло алгоритма конформационные поиска. Сетка энергия, используемая в программе док является силовое поле для формирования лиганд-рецепторных взаимодействий и потенциальных позы. PLP1 кусочно линейный потенциал, который специально приоритеты водородных связей взаимодействия и где ПФУ тип атома назначается каждому неводородным атома лиганда или рецептора атома без водорода.
- Анализ результатов
- В первую очередь, показатель представляет в программе визуализатора, а затем Сортировка по убыванию значения счетом PLP1. Используйте забил функции, такие как PLP1 оценить аффинность связывания лиганда пристыкованного на основе кандидата лиганда представляют геометрию и нековалентную взаимодействие с целевой структуре рецептора.
Примечание: Здесь функция PLP1 скоринг было обнаружено гив лучшие результаты, так как включает оценку водородной связи. - Анализ визуально верхнюю 25% набранных позах для 1) наложимости с известным покрывая группы (имеющей СКО относительной средний квадрат отклонения () значение менее 2 а), 2) выполнены фильтры взаимодействия и 3) визуальный взаимодополняемости с циклин паз , Это принято в том, что правильно установлена представляют (по сравнению с экспериментальной структуры) имеет значение СКО <2 Å.
- Изучите позы для визуального взаимодополняемости, которая определяется как имеющий эффективное заполнение связывающего кармана таким образом, что согласуется с известными отношений структура-активность. Взаимодействие фильтры установлены в включают атом ограничений, которые требуют межмолекулярных контактов известные является критическим для связывания и / или требуются в положение потенциального покрывая группу в правильной геометрии для образования амидной связи. Три примера состыкованных позах потенциальных N-укупорки групп, делающих водородные связи с interactioп фильтры показано на рисунке 4.
- В первую очередь, показатель представляет в программе визуализатора, а затем Сортировка по убыванию значения счетом PLP1. Используйте забил функции, такие как PLP1 оценить аффинность связывания лиганда пристыкованного на основе кандидата лиганда представляют геометрию и нековалентную взаимодействие с целевой структуре рецептора.
2. Синтез и характеристика потенциальных N -capping групп
- Синтез N-укупорки групп.
- Для синтеза, использовать все коммерческие исходных материалов, растворителей и реагентов, полученного. Обобщить потенциальных N-укупорки группы обычным органической химии синтетических (рисунок 5 12,13 для примера).
- Выполнение тонкослойной хроматографии (ТСХ) на силикагеле для реакции мониторинг.
- Растворять исходные материалы и реакционную смесь (1 мг) в подвижной фазе, и определить их на ТСХ пластине с помощью капиллярных трубок.
- Поместите пластины тонкослойной хроматограммы, чтобы в камере, содержащей подвижную фазу (смесь этилацетата и гексана в соотношении 35:65). После того, как подвижная фаза достигает 90% ТСХ пластине, удалить и просушить на воздухе пластины.
- Использование ультрафиолетового света для обнаружения исходного материала и реакционных смесей, как видимых пятен. Кэлculate в R F всех точках (отношение расстояния, пройденного месте и подвижной фазы).
Примечание: Реакци завершена, когда нет пятна видно на R F исходного материала.
- После завершения реакции обработки реакционную смесь, поместив в делительную воронку и промывают водным кислоты или раствором основания в случае необходимости. Собирают органический растворитель выпаривают его в роторном испарителе и сушат полученный сырой продукт в вакууме.
- Растворить 500 мг сырого продукта в 3-5 мл подходящем растворителе и добавить к 1 г силикагеля или RP18 samplet и сухой атмосфере воздуха. Поместите samplet, содержащий неочищенный продукт в кремнезема / РП SNAP флэш картриджей и очистить сырой материал, используя автоматизированную высокую производительность флэш-хроматографии (в соответствии с протоколом производителя) с использованием в г колонку SNAP 100 с градиентом перспективе, начиная с 6% этилацетата: 94 % гексана 50% этилацетата и 50% гексанов в течение15 объемов колонки.
- Сушат очищенного продукта, собранной в растворителе из флэш-хроматографии с использованием роторного испарителя путем выпаривания весь растворитель досуха и дополнительной сушки продукта под вакуумом, чтобы удалить все остаточные растворители. Выполнение характеристику очищенного продукта с помощью ЯМР, МС и аналитической ВЭЖХ.
- Для 1Н ЯМР и 13С ЯМР, вес примерно 10 мг очищенного образца, растворить его в соответствующем дейтерированном растворителе, и передавать содержимое в сухом трубки ЯМР для записи спектров ЯМР 2,14.
- Запишите H ЯМР 1 и 13 С ЯМР спектры с высокой поле ЯМР-спектрометра (минимум 300 МГц). Приобретать масс-спектры, используя QTOF (Tandem-четверка 1 раз массового полета спектрометра), ионизации электрораспылением (ESI) или VG 70S (двойной фокусировкой масс-спектрометра с магнитным сектором, EI) 2,14.
- Анализ чистоты продуктов с помощью ВЭЖХ с диодно-матричным детектором и оснащенысодержание C18 (2) 100 А, 250 х 4,6 мм, 5 мкм колонка для анализа. Использовать градиент перспективе, начиная с 100% воды (0,1% трифторуксусной кислоты) до 60% ацетонитрила (0,1% трифторуксусной кислоты) в течение 30 мин и удерживать градиент в течение 4 мин. Извлеките хроматограммы при 226 нм и 254 2,14.
Примечание: Аналитические чистота оцененных соединений были> 95%.
3. Твердофазный синтез для генерации переворачивает 2
- Синтез N-ограничен переворачивает
- Соберите N-увенчанные пептидные соединения через стандартные методы синтеза в твердой фазе, используя следующие шаги.
- Активация 5 эквивалентов С-концевой аминокислоты (Fmoc-Phe) в 4,4 эквивалентов O -Benzotriazole- N, N, N ', N' тетраметил-урониевых-гексафтор-фосфат (HBTU, 221,93 мг) в 2 мл ДМФ в течение 5 мин. Загрузите HBTU смесь Fmoc-Phe на смолу Rink с использованием 6 эквивалентов диизопропилэтиламина (DIPEA, 103.13мг) в течение 1 ч при комнатной температуре.
- Удаления защитной группы Fmoc с C-концевого остатка с использованием 20% пиперидина в 3 мл ДМФА в течение 10 мин. Пара последующие аминокислоты (например, Fmoc-Ile, Leu Fmoc-, Fmoc-Arg-ПМК), шаг за шагом. На каждом этапе, пара 5 экв следующего аминокислоты с использованием 6 эквивалентов ДИПЭА (103,13 мг) и 4,4 эквивалентами HBTU (221,93 мг) в 2 мл ДМФА в течение 1 ч при комнатной температуре.
- Применение циклов стирки (5 х 10 мл ДМФ + 5 х 10 мл ДХМ), после связывания аминокислоты и Fmoc удаления защитных групп, описанных выше шагов. После сборки пептидной, пара N-укупорки групп с использованием 6 эквивалентов ДИПЭА (103,13 мг) и 4,4 эквивалентами HBTU (221,93 мг) в 2 мл ДМФА в течение 1 ч при комнатной температуре.
- По завершении сборки пептидной, лечения реакционной смеси с 2 мл смеси расщепления (90: 5: 5 ТФК / Н 2 О / TIPS) O / N, чтобы удалить защитные группы боковой цепи, и расщепляют переворачивает из смолы. Растирают полученного продукта с холодным диэтиловым эфиром, чтобы осадить и яF необходимо концентрат на роторном испарителе.
- Соберите N-увенчанные пептидные соединения через стандартные методы синтеза в твердой фазе, используя следующие шаги.
- Синтез N-ограничен-С вершины переворачивает
- Взвесить и растворяют N-терминальной закрывали и защищенный Arg-Leu пептид (16,1 мг, 0,02 ммоль) в дихлорметане, и добавляют [4- (3-хлорфенокси) пиридин-2-ил] метанамин (С-CAP) наряду с O - benzotriazole- N, N, N ', N' -tetramethyluronium гексафторфосфат (HBTU; 16,7 мг, 0,02 ммоль) и N, N-диизопропилэтиламин (DIPEA; 6,5 мг, 0,02 ммоль).
- Перемешать и контролировать реакцию при комнатной температуре, пока ТСХ / ВЭЖХ не покажет полное исчезновение исходного материала. После завершения реакции, концентрируют сырой реакционной смеси с помощью роторного испарителя, а затем раздел ли между этилацетатом и водой.
- Отделением водного и органического слоя; мыть органический слой 1н NaOH, 1 N HCl и насыщенным раствором соли. Сушат органический слой приблизительно 1 г сульфата натрия и концентрируют продукт в роторном испарителе. ФинаLLY лечить продукта O / N с смеси расщепления (95: 2,5: 2,5 трифторуксусной кислоты / H 2 O / СОВЕТЫ) для снятия защиты.
- Растирают полученного продукта с помощью холодного диэтилового эфира, при необходимости концентрат в роторном испарителе до полной сухости, чтобы удалить весь растворитель. Кроме сушки продукта под вакуумом, чтобы удалить все остаточные растворители.
- Очистка и характеристика переворачивает
- Очищают сырой переворачивает с помощью полуприцепов подготовительные методы ВЭЖХ с обращенной фазой. Лиофилизировать очищенные сальто и характеризуют их молекулярную массу с помощью масс-спектрометрии 2,14.
- Определить аналитическую чистоту переворачивает с помощью ВЭЖХ с диодно-матричным детектором и оснащен C18 (2) 100 А, 250 х 4,6 мм, 5 мкм колонка. Использование метода градиента, начиная с 95% Н 2 О (0,1% трифторуксусной кислоты) / 5% ацетонитрила (0,1% трифторуксусной кислоты) до 35% Н 2 О (0,1% трифторуксусной кислоты) / 65% ацетонитрила (0,1% trifluoroaceкрестики кислоты) в течение 30 мин и удерживайте градиент в течение 4 мин. Экстракт хроматограмм при 226 и 254 нм.
4. Поляризация флуоресценции Анализ связывания для определения конкурентного связывания 2,14
- Выполните анализ в черном 384-колодца (138 мкл) с использованием пластин следующую процедуру.
- Развести образцы, трассирующие пептиды (4 нм), киназы комплексов (CDK2 / циклин А - 18 мкг / мл, CDK4 / циклин D - 37 мкг / мл) до требуемой концентрации в буфере для анализа (25 мМ HEPES рН 7, 10 мМ NaCl, 0,01% Нонидет Р-40, 1 мМ дитиотреитола (ДТТ).
- В каждую лунку в 384-луночный планшет, добавьте: 5 мкл CDK4D1 или CDK2CA (0,3 мкг / лунку очищенного рекомбинантного человеческого киназа), 5 мкл раствора соединения, 5 мкл 30 нМ меченого пептида (fluoresceinyl-AHX-Pro-Val -Lys-Arg-Arg-Leu-(3ClPhe) -Gly или fluoresceinyl-Ahx-Pro-Val-Lys-Arg-Leu-Arg-Phe-Gly-трассирующей пептид). Использование 5 мкл каждого ДМСО (6%), BuffeR, трассирующей и 5 мкл ДМСО (6%), киназа, Tracer в качестве контрольных лунках
- После добавления всех компонентов, центрифугировать планшет при 500 оборотов в минуту в течение 1 мин (41,16 х г) при комнатной температуре и затем инкубируйте при перемешивании в течение 45 мин при комнатной температуре. Использование устройства многомодового пластины и детектор, установленный с 485 нм / 535 нм / возбуждение фильтров выбросов и дихроичного зеркала читать флуоресцеина интенсивность каждую лунку в пластины.
- Рассчитать относительную среднюю поляризацию (КП) для всех исследованных образцах, используя уравнение показывает ниже. Определите IC 50 значений от логарифмической регрессии путем сопоставления относительных депутатов и тестирования концентрации.
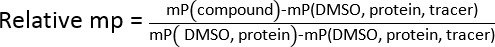
Результаты
Взаимодействия с HAKRRLIF циклин канавки показано на рисунке 2. Пептидные остатки, которые представляют основные обязательные детерминанты включают Ala2, arg4, Leu6 и Phe8 с другими остатки обеспечивая меньший вклад 12,13,18. В этом случае исследовании REPLACE стратегия была использована ?...
Обсуждение
Targeting protein-protein interactions (PPI) in drug discovery is highly challenging as these typically involve a large shallow contact interface comprised of numerous and diffuse contacts19. Furthermore, peptidic compounds which inhibit PPI’s that are amenable to drug discovery are problematic due to their higher molecular mass, metabolic instability and poor bioavailability20. Current strategies that have been applied for the development of PPI inhibitors include design of proteomimetics and...
Раскрытие информации
The authors declare that they have no competing financial interests.
Благодарности
We thank Dr’s. Douglas Pittman and Michael Wyatt for their assistance with cell culture and Dr Wyatt and Ms. Erin Anderson for help in development of the binding assays. We acknowledge Mike Walla and Bill Cotham in the Department of Chemistry and Biochemistry at the University of South Carolina for assistance with Mass Spectrometry, Helga Cohen and Dr. Perry Pellechia for NMR spectrometry. This work was funded by the National Institutes of Health through the research project grant, 5R01CA131368.
Материалы
| Name | Company | Catalog Number | Comments |
| Computational Chemistry | |||
| Accelyrs Discovery studio 3.0 | |||
| Dell Optiplex Workstations | |||
| Synthetic Organic Chemistry | |||
| Silica gel (GF-254 plates) for TLC, Biotage (Uppsala, Sweden) for flash chromatography, Waters Alliance 2695 HPLC with a 2996 diode-array detector and equipped with a C18 (2) 100 A, 250 x 4.6 mm, 5 μm column (Phenomenox Luna) for purity determination, 1H NMR and 13C NMR spectra were recorded with a Varian Mercury 300 and 400 Spectrometer, respectively. Mass spectra were measured with a Micromass QTOF (Tandem quadruple-1 time of flight mass spectrometer), electrospray ionization (ESI) and VG 70S (Double-focusing magnetic sector mass spectrometer, EI). | |||
| Flourescence Polarization Assay | |||
| 384 micro well plates, Micro pipets | Grenier Bio-one | 110256602 | |
| CDK4D1 and CDK2CA (well purified recombinant human kinase complex) | BPS Bio Sciences | 40094(CDK4/Cyclin D), 41101(CDK2/Cyclin A) | |
| assay buffer (25 nM HEPES pH 7, 10 mM NaCl, 0.01% Nonidet P-40, 1 mM dithiothretiol (DTT)) | |||
| 25 nM HEPES | CALBIOCHEM | 375368 | |
| NaCl | Fisher | 127838 | |
| Nonidet P-40 | US Biological | N3500 | |
| DTT | Aldrich | ||
| -70 °C freezer | Revco (Ultima II) | ||
| DTX880 multimode detector fitted with 485 nm/535 nm excitation/emission filters and a dichroic mirror suitable for fluorescein | Beckman Coulter, Brea, CA | ||
| Cell Culture | |||
| 96 well plates | Fisher | ||
| Frozen stocks of U2OS (osteosarcoma) and DU145 (prostate cancer) cell lines | ATCC | ||
| NU serum, DMEM media, trypsin, PEN/STRIP, MTT reagent | Fisher, Life technology, Alfa Aesar | ||
| Heamocytometer | VWR | ||
| -70 °C freezer | Revco (Ultima II) | ||
| Incubator | Thermo electron corporation | ||
| Centrifuge | Eppendorf | 5804 R | |
| Refrigerator 4-8 °C | Isotemp Fisher | ||
| DTX880 multimode detector fitted with 595 nm filter | Beckman Coulter, Brea, CA | ||
Ссылки
- Andrews, M. J., et al. REPLACE: a strategy for iterative design of cyclin-binding groove inhibitors. Chembiochem. 7, 1909-1915 (2006).
- Liu, S., et al. Optimization of Non-ATP Competitive CDK/Cyclin Groove Inhibitors through REPLACE-Mediated Fragment Assembly. J Med Chem. 56, 1573-1582 (2013).
- McInnes, C., Bernstein, M., Desai, P. Chapter 29. Annual Reports in Medicinal Chemistry. 47, 459-474 (2012).
- Bower, J. F., Pannifer, A. Using fragment-based technologies to target protein-protein interactions. Curr Pharm Des. 18, 4685-4696 (2012).
- Makley, L. N., Gestwicki, J. E. Expanding the number of 'druggable' targets: non-enzymes and protein-protein interactions. Chemical biology, and drug design. 81, 22-32 (2013).
- Walensky, L. D., Bird, G. H. Hydrocarbon-Stapled Peptides: Principles, Practice, and Progress. J Med Chem. , (2014).
- Shapiro, G. I. Cyclin-dependent kinase pathways as targets for cancer treatment. J Clin Oncol. 24, 1770-1783 (2006).
- Thais, M., Sielecki, J. F. B., Enfield, P. A., Trainor, G. l. Cyclin dependant kinase inhibitors: Useful targets in cell cycle regulation. Journal of medicinal chemistry. 43, 1-18 (2000).
- Morphy, R. Selectively nonselective kinase inhibition: striking the right balance. J Med Chem. 53, 1413-1437 (2010).
- Chen, Y. N., et al. Selective killing of transformed cells by cyclin/cyclin-dependent kinase 2 antagonists. Proc Natl Acad Sci USA. 96, 4325-4329 (1999).
- Orzaez, M., Gortat, A., Mondragon, L., Bachs, O., Perez-Paya, E. ATP-noncompetitive inhibitors of CDK-cyclin complexes. ChemMedChem. 4, 19-24 (2009).
- Kontopidis, G., et al. Insights into cyclin groove recognition: complex crystal structures and inhibitor design through ligand exchange. Structure. 11, 1537-1546 (2003).
- McInnes, C., Andrews, M. J., Zheleva, D. I., Lane, D. P., Fischer, P. M. Peptidomimetic design of CDK inhibitors targeting the recruitment site of the cyclin subunit. Current medicinal chemistry. Anti-cancer agents. 3, 57-69 (2003).
- Premnath, P. N., et al. Fragment based discovery of arginine isosteres through REPLACE: towards non-ATP competitive CDK inhibitors. Bioorganic, and medicinal. 22, 616-622 (2014).
- Venkatachalam, C. M., Jiang, X., Oldfield, T., Waldman, M. LigandFit: a novel method for the shape-directed rapid docking of ligands to protein active sites. J Mol Graph Model. 21, 289-307 (2003).
- Mendoza, N., et al. Selective cyclin-dependent kinase 2/cyclin A antagonists that differ from ATP site inhibitors block tumor growth. Cancer Res. 63, 1020-1024 (2003).
- Denizot, F., Lang, R. Rapid colorimetric assay for cell growth and survival. Modifications to the tetrazolium dye procedure giving improved sensitivity and reliability. J Immunol Methods. 89, 271-277 (1986).
- Zheleva, D. I., et al. Highly potent p21(WAF1)-derived peptide inhibitors of CDK-mediated pRb phosphorylation: delineation and structural insight into their interactions with cyclin A. The journal of peptide research : official journal of the American Peptide Society. 60, 257-270 (2002).
- Ivanov, A. A., Khuri, K. F. R., Fu, H. Targeting protein-protein interactions as an anticancer strategy. Trends in Pharmacological Sciences. 34, (2013).
- Thayer, A. M. Improving peptides. Chemical and Engineering News. 89, 13-20 (2011).
- Yin, H., Hamilton, A. D. Strategies for targeting protein-protein interactions with synthetic agents. Angew Chem Int Ed Engl. 44, 4130-4163 (2005).
- Jubb, H., Higueruelo, A. P., Winter, A., Blundell, T. L. Structural biology and drug discovery for protein-protein interactions. Trends Pharmacol Sci. 33, 241-248 (2012).
- Cannon, J. B. Pharmaceutics and drug delivery aspects of heme and porphyrin therapy. J Pharm Sci. 82, 435-446 (1993).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены