Method Article
具体的な感覚細胞の相関共焦点と3次元電子顕微鏡
要約
Here, we introduce a method, cocem3D, to unveil the ultrastructure of a specific cell in its native tissue by bridging confocal and serial block-face scanning electron microscopy.
要約
細胞の超微細構造の描写は、その機能を理解するために重要です。これは、腸上皮の腸内分泌細胞などの多様な細胞型からなる組織に拡散希少細胞タイプのために困難なプロジェクトであることができます。千:彼らは1の割合で他の上皮細胞に分散しているため、食品や細菌のこれらの胃腸のセンサは、勉強することが困難でした。近年、トランスジェニックレポーターマウスは、蛍光によって腸内分泌細胞を同定するために生成されています。それらの一つは、ペプチドYY-GFPマウスです。このマウスを用いて、共焦点およびシリアルブロック面の走査型電子顕微鏡を相関させる方法を開発しました。私たちはこの方法cocem3Dという名前で、組織内の特定の腸内分泌細胞を識別し、3Dで細胞の超微細構造を明らかにするためにそれを適用しました。 cocem3Dの分解能は、分泌小胞と小さい小器官を同定するために、ボリューム再ために細胞膜を区別するのに十分ですndering。 Cocem3Dは容易に天然の組織内の他の特定の細胞型の3次元超微細構造を研究するために適合させることができます。
概要
細胞内の生命は時間と空間で起こります。経時変化は、しばしば、超解像顕微鏡のような蛍光イメージング技術と組み合わせタイムラプス顕微鏡を用いて研究されています。スペースは、特に、細胞内小器官または細胞間相互作用の配置は、唯一のセルの微細構造を完全に考慮することによって導出することができます。細胞の微細構造の包括的なアカウントはC.のような、ゲノムが利用可能である場合には、ゲノム機能に明確さをもたらすことができます線虫1またはフラット板形動物門のtricoplaxのアドヘレン2 エレガンス 。連続切片の電子顕微鏡検査は、現在、効率的な再現性、時間、シリアルブロックフェイス走査電子顕微鏡3(SBEM)のような自動化された3次元電子顕微鏡技術の開発に安価なタスクのおかげです。
機能を解明するための構造情報の必要性は、特定のセル画では非常に明白ですこのようなニューロン、グリア、または感覚上皮細胞としての機能は、物理的な細胞間相互作用に依存するL型、。我々は、腸の内腔での栄養素からの感覚信号は、最終的欲求行動を調節する電気信号に導入されているかの解明に特に興味を持っています。回路は複雑であるが、栄養素が腸内分泌細胞と呼ばれる感覚上皮細胞に接触し、腸の壁に始まります。このような味覚細胞のような他の感覚上皮細胞とは異なり、腸内分泌細胞は、1千4-7つの割合で腸上皮全体に分散されています。したがって、それらは、特定し研究することが困難であった、そして長時間彼らは消化管ホルモンの供給源として観察しました。しかし、細胞特異的蛍光レポーターマウスの開発に、これらの細胞の複雑な感覚機能が浮上しています。これらのレポーターマウスの一つは、ペプチドYY-GFP(PyyGFP)マウスを使用して、我々はそのenteroendocrを発見しましたINE細胞は、我々はneuropodという名前の顕著な細胞質尾部を持っています。 neuropodsの出現は、細胞間コミュニケーションに保存された機能を示唆しました。したがって、我々は、腸内分泌細胞の超微細構造を文書化することにより、neuropodsの関数を導出することができると推論しました。
特定するのは困難である分散セルに付属物の構造を理解する必要性は、共焦点顕微鏡とSBEMを結合する方法を開発するための主な根拠でした。関心の細胞は、PyyGFP腸内分泌細胞特異的レポーターマウスを用いて同定しました。この方法は、私たちは腸内分泌細胞とそのneuropod全体の超微細構造を文書化することができました。 neuropodsの中で、我々は、腸溶性グリア8への物理的な関係を発見し、神経細胞の軸索の構造的特徴を発見し、外neuropods。実際、neuropodsは、これらの細胞の分泌機能において必須の役割を示唆しているすべての分泌小胞の約70%を含みます。上の建物構造データは、より最近では、これらのneuropodsを通じて、腸内分泌細胞と神経細胞が腸舌8,9で味細胞と同様の神経上皮の回路を形成し、神経支配することがわかりました。
構造データから生じ胃腸化学感覚のメカニズムのような特徴を暴くことは、この相関顕微鏡法を使用して収集しました。我々は、細胞は、非常に低い割合で組織内に分散している場合は特に、この方法は、細胞生物学の他の分野に有用であり得ると考えています。我々は、3次元(Cocem3D)における相関、共焦点およびシリアルブロックフェイス走査電子顕微鏡などの方法に言及しました。組織切開、共焦点顕微鏡、SBEMイメージング、SBEMと共焦点画像相関、および手動のセグメンテーション:メソッドは、以下の主要なステップから構成されています。相関が物理的ではなく、化学物質であるため、他の相関の方法と比較して、概念はかなり単純です。
プロトコル
全ての動物のケアと実験は、デューク大学施設内動物管理使用委員会によって承認されたプロトコルに従って行われました。
Cocem3Dは、以前に公開されたプロトコル10,11の組み合わせから茎とPyyGFPレポーターマウス12を使用して、特定の腸内分泌細胞を研究するために、ここで適用しました。この方法は、商業的に容易に入手可能なトランスジェニックレポーターマウスを用いて、関心のある他のセルに適用することができます。相関、共焦点顕微鏡、シリアルブロック面を走査型電子顕微鏡(SBEM)、及び3Dのレンダリングデータ:この方法は、3つのセクションに記載されています。
相関共焦点顕微鏡
このセクションの目的は、相関、共焦点とSBEMイメージングを可能にする寸法の遠位結腸からの組織セグメントを収穫することです。次のようにプロトコルは次のとおりです。
1.収穫組織
- 準備しますPBS中の50μg/ mlのヘパリン溶液10ml。
- ケタミンの10ミリリットル(100 mg / mlの)とキシラジンの1ミリリットル(20 mg / mlの)を混合することにより、キシラジン/ケタミン麻酔在庫を準備します。
- 0.1MのPBSで4:1をキシラジン/ケタミンの株式を希釈します。
- PBS中の4%パラホルムアルデヒドおよび0.1%グルタルアルデヒドを含む固定剤溶液100mlを準備します。
- キシラジン/ケタミン麻酔薬の致死量で6〜10週齢PyyGFPマウスを、麻酔。マウス体重の20グラム当たり0.15ミリリットルで腹腔内麻酔薬を注入します。
- 尾や足の指をつまんで、適切なマウスの麻酔を確認し、乾燥を防ぐために、目に軟膏を使用しています。
- 心臓内固定剤10を灌流する可変流量蠕動ポンプを使用してください。外科用ハサミ(12センチの長さ)を使用する腸、心臓、および肺を露出させるために腹腔を開き切りました。狭パターン湾曲鉗子(13センチ長)との心を持ち、蠕動ポンプから翼状針(19 G)を挿入し、I左心室NTO。すぐに、春ストレートはさみ(長さ4ミリメートル)と右心房をカット。 1分間のヘパリン溶液で最初に2ml /分の速度で灌流し、その後15分間氷冷固定液溶液でマウスの尾が完全に剛性になるまで。
注:これは、腸粘膜に小血管の破裂を防ぐために遅い速度で灌流するために非常に重要です。血管の破裂は、組織の超微細構造を損なうことになります。灌流が適切である場合、肝臓は3〜5分以内に色が淡い有効にしてください。 - 小さなハサミを使用して腹腔を開き、遠位直腸に盲腸との接合部から結腸全体を切除。氷冷PBSで組織を配置します。 PBSに沈めながら、小さな春のはさみで腸間膜に沿ってコロンを切り開い。
2.組織セグメントを解剖し、固定
- メスを使用して、遠位結腸から約6小さな組織セグメント(2 平方ミリメートル) で切断しました。シートO上でこれを行いますF歯科用ワックス及びPBSの数滴中に沈め。
- 4℃で3時間固定液中で組織セグメントをポスト修正。
3.マイクロ解剖組織ブロック
- PBS中の5%低融点アガロースを調製し、45℃の水浴中に保ちます。
- 標準サイズのティッシュテックCryomoldように、小さなプラスチック容器を使用して、5%の低融点アガロースで組織セグメントを埋め込みます。
- 振動刃ミクロトームに包埋切片をマウントし、氷冷PBSでバッファトレイを埋めます。
- 0.8振幅と0.04ミリメートル/秒の速度で300μmの組織片をカットします。注:この時点で、組織片をアガロースから除去されます。
- アガロースで300μmの組織片を再埋め込み、ビブラトームのブレードに垂直にミクロトームにマウント。
- ビブラトームを用いて、50μmの厚さで組織片を切断します。注:最終的な組織ブロックは、約300μm幅×50μmの厚さでなければなりません。これらのDimensionsは、腸内分泌細胞の厚さは15〜20ミクロンとneuropodの長さ30〜70 nmの間であることが示されたパイロット共焦点実験から最適化されています。電池の向きが組織ブロックの表面に平行である場合にはそのため、セル全体は、厚さ50μm、幅300μmの組織のブロック内に含まれる可能性があります。目的の組織および細胞タイプに応じて、これらの寸法を変え。
- 4℃でPBS中の組織ブロックを格納します。
4.共焦点イメージング
- 4,000:1でPBSにDAPIを希釈することにより核染色溶液を調製します。
- 5分間、DAPI核染色で組織ブロックをインキュベートします。注:DAPI染色は、共焦点とSBEM画像を相関させるために有用であるそれらの核によって区別個々の細胞を容易にします。
- 帯電したスライドガラス上にマウント組織ブロックは、PBSを数滴を追加し、カバースリップでそれらをカバーしています。
- 共焦点顕微鏡を使用して、ブロックを識別する興味のある無傷の絨毛およびPyyGFP細胞とSとzスタックに光学切片を得るためにそれらを画像化しました。
- 1μmの光学切片のzスタックを取得するために20X / 0.8ツァイスプランアポクロマート対物レンズを使用してください。
- zスタックのために細胞の位置を決定するために、対象の細胞、および微分干渉コントラスト(DIC)を局在化するために、他のセルとの関係を決定するために488nmの内在性GFPを405 nmで(DAPI)のためにチャネルを使用しますルーメン。
- 1024ピクセル以上の画像解像度を使用します。
アガロース5.埋め込みブロック
- PBS中の4%パラホルムアルデヒドおよび2.5%グルタルアルデヒドを含む固定液の10ミリリットルを準備します。
- 慎重に組織ブロックにダメージを与えることなく離れてガラススライドからカバースリップをスライドし、カバースリップの端にPBSを添加することにより、ガラススライドから組織ブロックを削除します。そして、1にスライドから組織ブロックを転送するために美術の絵筆を使用4%パラホルムアルデヒドおよび2.5%グルタルアルデヒド固定剤を含む0.5ミリリットルのマイクロチューブ。
- 4℃でのポストフィックス組織ブロックO / N。
- PBSに組織ブロックを転送します。そして、2枚のスライドガラスの間に、それらを挟んで5%低融点アガロースでフラットブロックを埋め込みます。
注:アガロースの薄層でブロックを埋め込み、染色の際に事後操作が容易になります。 - 広場にアガロースをカットし、上側のハンド側に切り込みを作ります。注:このステップは、後続のステップの配向を維持する必要があります。
- さらに処理するまで4℃でPBS 1.5 mlのマイクロ遠心チューブに保管ブロック。
シリアルブロックフェイス走査電子顕微鏡(SBEM)
このセクションでは、組織ブロックは、低倍率でSBEMを用いて調製し、画像化されます。ブロック面の調査画像は、目的の細胞を含む領域を識別するために、共焦点データと相関しています。地域一回識別され、組織は7ナノメートル/ピクセルと70nmのスライスの解像度で撮像されます。これが解決し、他の細胞小器官から大高密度コア分泌小胞を区別するのに十分でした。腸内分泌細胞では、小胞のこのタイプは、直径13で100から150nmの間で変化します。次のようにプロトコルは次のとおりです。
6.染色組織切片
- PBSから組織を除去し、0.1Mカコジル酸緩衝液で3回、各5分、すすぎます。
- 細胞膜14のコントラストを向上させるために0.1 Mカコジル酸緩衝液に溶解した0.1%のタンニン酸で1時間染色ブロック。
- 公開されたプロトコル11に従って、その後の染色および組織の脱水を行います。 Deerinckらに続いて。プロトコルは、これらの溶液を調製する:1)1%(w / v)のthiocarbonhydrazide(THC)。 2)アスパラギン酸溶液をリード。 3)1%酢酸ウラニル、および4)オスミウムtetraoxyde /フェロシアン化カリウム(のOsO 4 / Kフェロシアン化)。 4%のOsO 4と2倍を混ぜますのOsO 4 / Kフェロシアン化を行うために1:1の比率で[10ミリリットルのH 2 OにKフェロシアン化し、0.86グラムのNaカコジル酸を0.3グラム] Kフェロシアン化ストック。注:アガロース中に包埋された組織は染色中の取り扱いを容易にしたが。慎重に、その後の樹脂の浸透のためのアガロースを除去します。
- 0.1 Mカコジル酸緩衝液中のサンプル三回、5分毎に、リンスした後、4℃で2時間、OsO4 / Kフェロシアン化溶液を用いて染色。
- 60℃でそれぞれ、超純水で5分間3回すすぎ、そして30分間TCHと染色。
- RTで60分間、2%のOsO 4(なしKフェロシアン化)と超純水で3回、それぞれ5分間および汚れを洗い流します。超純水で再び3回、各5分洗浄します。
- 4℃で1%の酢酸ウラニルO / Nで染色。超純水で3回、各5分洗浄します。
- 60℃で30分間のリードアスパラギン酸で染色。超純水で3回、各5分洗浄します。
- solutioですすぐことにより、組織を脱水エタノール濃度の増加に伴って、NS。 50%、75%、85%、95%、絶対100%エタノールで2回、各5分洗浄します。終わりに、プロピレンオキシドを用いて2回、10分毎にセクションをすすぎます。
樹脂7.浸潤と埋め込み組織切片
- 商業avaialbleキットを用いて樹脂とブロックを潜入。エポン包埋キットを用いて樹脂に埋め込む組織。 48%のエポキシ樹脂の混合物を準備し、20%ミリリットルDDSA、30%ミリリットルNMA、および2%DMP30。 5分間激しく樹脂混合物を攪拌した後、気泡が表面に来ることができるように30分間真空中でミックスを置きます。
- 1のプロピレンオキシドと樹脂を混合:1の比率、激しく振ります。組織から最後の脱水すすぎを外し、プロピレンオキシドとの混合樹脂を追加します。回転子のO / Nでのサンプルと場所バイアルとキャップなしバイアルのままにします。次の日は、作りたてのエポン樹脂を追加し、回転装置で90分間混合します。
- それらを挟んでできるだけ平坦樹脂中に埋め込みブロック互いに15に付着するのを防止するために、液体離型剤を用いて硬化されたガラススライドの間です。
- ブロックが平坦に埋め込まれると、60℃でさらに48時間のブロックを治します。
- ブロックを解放するために離れてスライドを引き出します。
8.取り付けとイメージングのための組織ブロックをトリミング
- 解剖顕微鏡下で、ブロックをトリミングする前に、目的の細胞を含有する領域を同定する容易にするために、共焦点顕微鏡写真のものと樹脂に包埋組織ブロックの向きと一致しています。
- 手動ダウン〜500×500μmのブロック面に樹脂包埋ブロックをトリミング。
- 30分間導電性エポキシ、乾燥を含むピンのフラットブロックをマウントします。その後、60℃で、表面上に平らにブロックを置き、乾燥O / N。
- コート銀コロイド液でブロック。 COを容易にするために、直角ブロックのスライスを確保するために、組織切片フラットを維持シリアルブロック面と共焦点顕微鏡写真をrrelating。
9. SBEM
- 画像SBEMシステムを備えた走査型電子顕微鏡を用いてブロック(E .G。、3View)。
- 組織の顔がブロックから出てくるまで〜2μm刻み、切断時に初期厚さのセクションを設定します。
- ブロック全体の顔のsurver画像を取得。
- フィジーソフトウェアを使用して、固定および16を染色中にサンプルの反りのための共通分母とアカウントを生成するために、両方のシリアルブロック面と共焦点顕微鏡写真の測定を行います。
- 共焦点画像の座標に分母を乗じてブロック面上の関心領域の位置を確認します。参考として、微絨毛、杯細胞、または固有層の位置のように、他の構造的特徴を使用してください。
- で、目的の画像領域2.25 kVの高真空モードでは7nm /ピクセル(または15,147X倍率)。スライスの増分を設定してください70nm以下で。
- 生の16ビット.dm3形式でSBEMデータを収集します。
面分割のための10の最適化SBEM画像
- SBEMイメージは、8ビットの.TIFFに生.dm3形式から変換します。
- フィジー0.8ガウスぼかしフィルタを用いて画像を.TIFFフィルター。
- 元のサイズの25%に設定されたデータを縮小してセットを処理するのに必要なRAMメモリの量を最小限にするために.TIFFスタックとして保存します。
- 変換モードフィジーのプラグイン「SIFTと線形スタックアライメント」を使用してSBEM画像のスタックの位置を合わせ、「作物3D」プラグインを使用して切り取ら。注:トリミングをさらにセグメント化し、ボリュームレンダリングに必要なRAMメモリの量を低減するのに役立ちます。
3Dで描画データ
11.共焦点顕微鏡
- 「面」ツールのモードを上回る自動を使用して、Zスタックを再構築する。 図1D、RECを示しています絶対強度として0.126ミクロンで表面エリアの詳細、上の滑らかなオプションを使用して、各チャネルのonstruction、およびしきい値。
12.シリアルブロック面SEM
注:手動データセグメント化は非常に時間の手順を消費し、数週間かかることが手順を描画する機能に応じてです。 Bohórquez らに提示ビデオや数値のための分割。2014年8を手動で行われ、労働力の約500時間を要しました。これは、セグメント化プロセスを開始する前にレンダリングを必要とする基本的な機能に優先順位を付けることをお勧めします。手順は次のとおりです。
- 手動セグメントに50ミリ秒の描画モードで描画モードと「輪郭」オプションで「面」ツールを使用し、ボリュームが目的の細胞をレンダリング。
- スムーズなレンダリングまたはより高速なレンダリングのために、すべての5つのスライスにセルのすべてのスライス上の輪郭をトレースします。
- エクスポート最終イム300dpiの以上の解像度で「スナップショット」ツールを使用して年齢。
結果
ここで紹介する方法は、上皮の層内の特定の細胞の超微細構造を研究するために使用しました。この場合、目的の細胞は、とらえどころのない腸内分泌細胞です。 その場でそれらの同定は、細胞特異的蛍光レポーターマウスの開発にここ数年で可能でした。 2011年に、我々は、ホルモンPYYのプロモーターは緑色蛍光タンパク質17の発現を駆動するマウスを開発しました。このPyyGFPマウスでは、小腸および結腸の遠位部分の腸内分泌細胞は、容易にUV光下で識別されます。このマウスモデルは、腸内分泌細胞を含む組織ブロックを識別し、SBEMためにそれを処理するための基盤でした。相関法はcocem3Dとしてここに呼ばれ、以前に公開されたプロトコル10,11の上に建てられました。
組織ブロックの寸法を最適化することは、相関のために重要です。予備実験では、それは目的の細胞の全身を覆いながら組織ブロックに300ミクロンが長い×50ミクロンの厚SBEM画像の数を最小限に低減されることが決定した。 図1(a)は、振動羽根microtromeにを使用して切開の見逃しを示しています右の寸法を有する組織ブロックを得ます。少なくとも100ブロックは、関心のある無傷の細胞を有するものを選択するためにそれらを分類する前に取得されます。ブロックは、共焦点顕微鏡と画像のzスタックによって撮像され、選択された光学的にすべての1ミクロン( 図1BおよびC)を間隔を置いて配置されている。 図1Dは、マウスの回腸における腸内分泌細胞のボリュームレンダリングされた図を示しています。その顕著なneuropodは〜60ミクロンのために上皮細胞の下に延びています。
目的の細胞は、ブロック全体の顔のSBEMイメージと共焦点のzスタックを相関させることによって発見されました。例はPyyGFPの遠位結腸からブロックからここに提示されていますマウス。共焦点のzスタック( 図2A)を得た後、ブロックは、低融点アガロース( 図2B)の薄層に埋め込 まれています。これは、ブロックの後続の操作のために必要です。これはSBEMスライスの光スライスに合わせて可能な限り平坦なブロックの向きを維持することが重要です。 図2Cに、代表画像は、組織ブロックの全面で示されています。この図の一部は、以前にBohorquez らに出版された。2014年8。これは、その後、アカウントの組織のランドマークと寸法を考慮することにより、共焦点画像と相関していた。 図2Dは 、明らかに、ブロックの共焦点とSBEM画像の重ね合わせを示しています興味のある私たちの細胞の正確な位置。
セルが識別されると、SBEMイメージングは分泌小胞および他の細胞小器官を同定するのに十分に高い解像度で行われます。彼提示されたデータセットブロックの画像は、すべての70nmで採取したとして再画素当たり7 nmで画像化しました。データセットは、組織の深さ45ミクロンに及ぶ643の画像を含んでいました。数ミクロンは、低倍率での全体ブロック面の最初の撮影中に剃毛されています。生SBEMデータセットは.dm3形式で取得し、以降の処理のために.TIFFに転換しました。 SBEMスタックは、関心のある領域のみを含むようにフィジーのソフトウェアプラグイン「作物(3D)」ブロックを使用して、トリミングされました。これは、ボリュームレンダリングに必要なRAMメモリの量を減少させます。セルは、その位置と、分泌小胞によって識別され、IMARISソフトウェアを使用してセグメント化された。 図3は、腸内分泌細胞の3Dでレンダリングが含まれています。
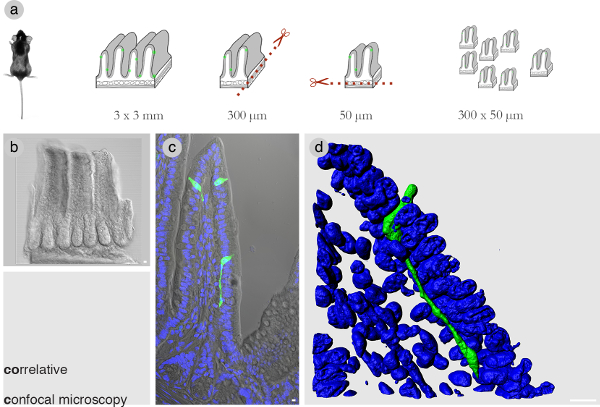
図1:相関、共焦点顕微鏡の一部を分析するための(A)のワークフロー。300×厚さ50μmの組織ブロックに腸組織。 (B)右の寸法の代表組織ブロック。マウス小腸からこれらのディメンションの組織ブロックは、コロン約8陰窩の場合には、約3絨毛をまたがっているか、ということに注意してください。 (C)目的の細胞を含む小腸で絨毛。 (D)IMARISソフトウェアを使用して3次元でレンダリング共焦点zスタックは、腸上皮の下に実行されている顕著なneuropodで腸内分泌細胞を示します。青= DAPI核染色。バー=10μmである。 この図の拡大版を表示するには、こちらをクリックしてください。
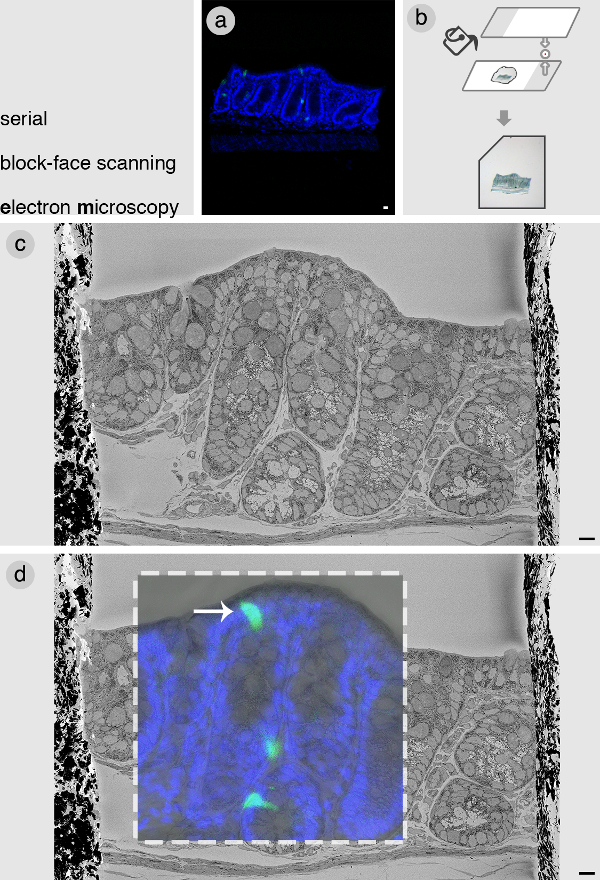
図2:SELEの連続ブロック面の走査型電子顕微鏡検査(A)共焦点画像興味のPyyGFPの腸内分泌細胞(緑)を含む大腸から組織ブロックをCTED。ブロックは、共焦点顕微鏡によって画像化されると、(B)は、その後、スライドガラスを使用して低融点アガロースで平坦に埋め込 まれます。アガロースで組織ブロックを埋め込むことは、その後の操作を容易にし、左の角のノッチが正しい方向にSBEM内のブロックをマウントすることができます。 (C)ブロックの顔のSBEM画像。 (D)利息(白矢印)の細胞を識別するためのSBEMと共焦点データの相関。この図のCとDの画像は、。Bohorquezらから変更2014年8されています。ブルーはDAPI核染色を=。バー=10μmである。 この図の拡大版を表示するには、こちらをクリックしてください。
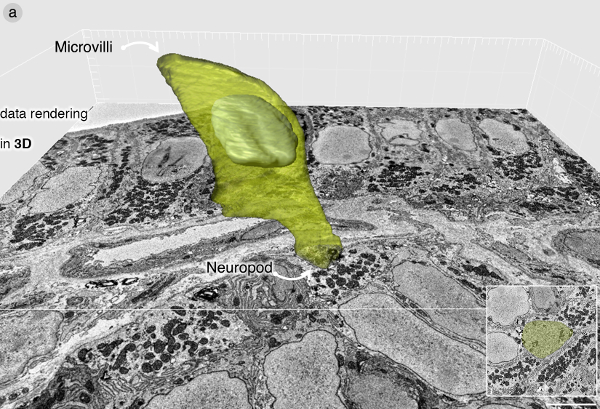
図3:IMARISソフトウェアを使用して腸内分泌細胞のデータは、3Dでレンダリング(A)ボリュームレンダリング。細胞は、分泌小胞を充填したneuropodが含まれています。腸内分泌細胞の超微細構造の完全な説明については、Bohórquez ら 、2014年8を参照してください。 この図の拡大版を表示するには、こちらをクリックしてください。
ディスカッション
胃腸chemosensationは、生物医学研究にエキサイティングな新しい分野として浮上しています。これは、腸内分泌細胞18内の機能味覚受容体の発見に大きな部分です。その後の研究は、腸内分泌細胞は、炭水化物、脂質、およびアミノ酸5,6,19,20などの栄養素のための特異的受容体を発現することを示しました。これらの発見のための触媒因子は、腸内分泌細胞は、蛍光20をラベル付けされたレポーターマウスの開発、となっています。我々は、遠位小腸および結腸17,21の腸内分泌細胞を研究するために、これらのマウスの1、PyyGFPマウスを開発しました。彼らは満腹22,23の誘導因子であり、どちらもPYYおよびグルカゴン様ペプチド1を分泌するので、これらの細胞は、関心対象です。このとき、これらの細胞の完全な超構造のアカウントは、我々は彼らのシグナル伝達機構を理解することが不可欠だと信じていたこれ、行方不明になりました。
ontentは ">ここでは、SBEMと共焦点顕微鏡を埋めるための視覚的方法を説明した。方法は、私たちは、腸内分泌細胞の完全な超微細構造を文書化することができCocem3D、と呼ばれている。我々は、これらの細胞が三含まneuropodを持っていることを報告しています細胞を腸これらneuropodsが物理的にニューロンに接続しても分泌小胞8のすべての四半期。neuropod内では、ニューロフィラメントと神経軸索のようなはるかにあり、neuropodsが腸内グリア細胞8に育まれています。さらに重要なこと、それは腸を支配し、コロン9。cocem3Dの強みの一つは、そのシンプルさです。共焦点によって結像さSBEMが組織内の特定の細胞の同定を容易にすることができるブロックに組織サンプルを減らします。分泌小胞および他の細胞小器官は、7ナノメートル/ピクセルの解像度で容易に識別することができます。 SBEMのセクションが破棄されているので、さらにプロセスへ特定のタンパク質を同定するために、組織の歌うこの時点ではオプションではありません。しかしながら、そのような組織ブロックからの切片が保存されているアトゥム24、などの方法の開発は、細胞中の特定のタンパク質の同定を可能にする可能性があります。腸内分泌細胞は、脳内の腸と満腹の食糧間の感覚のインターフェイスであるため、腸内分泌細胞に化学感覚受容体の特定の位置を決定することは、肥満のための薬物療法の開発のための重要な情報です。
開示事項
博士サティシュMedicettyはの従業員であり、Renovoの神経社から100%の給与を受けます。しかし、これは、データを共有すると、材料にJoveの方針の著者の遵守を変更しません。興味のある競合は、残りの著者のために宣言されていません。
謝辞
Our sincere appreciation is expressed to the following people: Drs. Sam Johnson and Benjamin Carlson of the Duke Light Microscopy Core Facility for their assistance with data visualization software, and Ms. Valerie Lapham and Dr. John M. Mackenzie, Jr. of the Center for Electron Microscopy at North Carolina State University for their advice on electron microscopy. We thank Dr. Elaine B. Bohórquez for her editorial assistance. Authors contributed in the following manner: DVB, SM, and RAL designed experiments and analyzed data. DVB performed experiments and FH performed manual rendering of data. SM is director of Renovo Neural, where SBEM data was acquired. DVB wrote the manuscript and all authors reviewed and edited the final manuscript. This work was supported by NIH grants R01DK091946 and Veterans Affairs grant I01BX002230 to RAL, and F32DK094704, to DVB.
資料
| Name | Company | Catalog Number | Comments |
| Phosphate buffered saline | Life technologies | 10010023 | |
| Heparin sodium salt | Sigma | H4784 | |
| Paraformaldehyde | Sigma | 158127 | 4%, freshly made in PBS, final pH 7.4 |
| Glutaraldehyde | Sigma | G5882 | |
| Dental wax | Electron Microscopy Sciences | 72660 | |
| Low-melting agarose | Life technologies | 16520-100 | 5%, freshly made in PBS |
| Standard Tissue-Tek Cryomold | Electron Microscopy Sciences | 62534-25 | |
| DAPI nuclear stain | Life technologies | D1306 | |
| Postively charged glass slides and coverslips | |||
| Fine art paintbrush #1 | |||
| Cacodylate buffer | Electron Microscopy Sciences | 11650 | |
| Tannic acid | Electron Microscopy Sciences | 21700 | |
| EMbed 812 kit | Electron Microscopy Sciences | 14120 | |
| Liquid releasing agent | Electron Microscopy Sciences | 70880 | |
| Liquid silver colloidal | Electron Microscopy Sciences | 12630 | |
| CircuitWorks conductive epoxy | ITW Chemtronics | CW2400 | |
| Variable flow peristaltic pump | VWR | 70730-064 | |
| VT1200S Vibrating blade microtome | Leica | ||
| Zeiss 780i confocal microscope | Carl Zeiss | ||
| Sigma VP Scanning Electron Microscope | Carl Zeiss | ||
| 3view system | Gatan | ||
| Renovo Neural Inc (Cleveland, OH) | http://www.renovoneural.com | Renovo provides 3d EM services | |
| Fiji software | Open access software | ||
| Computer station with 16 GB of RAM or more | |||
| Data visualization software Imaris 7.5 | Bitplane |
参考文献
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The structure of the nervous system of the nematode Caenorhabditis elegans. Philosophical transactions of the Royal Society of London. Series B, Biological. 314, 1-340 (1986).
- Smith, C. L., et al. Novel cell types, neurosecretory cells, and body plan of the early-diverging metazoan Trichoplax adhaerens. Current biology : CB. 24, 1565-1572 (2014).
- Denk, W., Horstmann, H. Serial block-face scanning electron microscopy to reconstruct three-dimensional tissue nanostructure. PLoS biology. 2, e329 (2004).
- Engelstoft, M. S., et al. Seven transmembrane G protein-coupled receptor repertoire of gastric ghrelin cells. Molecular metabolism. 2, 376-392 (2013).
- Chandra, R., et al. Immunoglobulin-like domain containing receptor 1 mediates fat-stimulated cholecystokinin secretion. The Journal of clinical investigation. 123, 3343-3352 (2013).
- Wang, Y., et al. Amino acids stimulate cholecystokinin release through the Ca2+-sensing receptor. Am J Physiol Gastrointest Liver Physiol. 300, G528-G537 (2011).
- Rogers, G. J., et al. Electrical activity-triggered glucagon-like peptide-1 secretion from primary murine L-cells. The Journal of physiology. 589, 1081-1093 (2011).
- Bohórquez, D. V., et al. An enteroendocrine cell-enteric glia connection revealed by 3D electron microscopy. PloS one. 9, e89881 (2014).
- Bohórquez, D. V., et al. Neuroepithelial circuit formed by innervation of sensory enteroendocrine cells. The Journal of clinical investigation. , (2015).
- Knott, G. W., Holtmaat, A., Trachtenberg, J. T., Svoboda, K., Welker, E. A protocol for preparing GFP-labeled neurons previously imaged in vivo and in slice preparations for light and electron microscopic analysis. Nature protocols. 4, 1145-1156 (2009).
- Deerinck, T., Bushong, E., Thor, A., Ellisman, M. . NCMIR methods for 3D EM: a new protocol for preparation of biological specimens for serial block face scanning electron microscopy. , (2010).
- Bohórquez, D. V., Chandra, R., Samsa, L. A., Vigna, S. R., Liddle, R. A. Characterization of basal pseudopod-like processes in ileal and colonic PYY cells. Journal of molecular histology. 42, 3-13 (2011).
- Nilsson, O., et al. Distribution and immunocytochemical colocalization of peptide YY and enteroglucagon in endocrine cells of the rabbit colon. Endocrinology. 129, 139-148 (1991).
- Mizuhira, V., Futaesaku, Y. New fixation method for biological membranes using tannic acids. Acta Histochem Cytochem. 5, 233-236 (1972).
- Reymond, O. L., Pickett-Heaps, J. D. A routine flat embedding method for electron microscopy of microorganisms allowing selection and precisely orientated sectioning of single cells by light microscopy. Journal of microscopy. 130, 79-84 (1983).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature. 9, 676-682 (2012).
- Bohórquez, D., Chandra, R., Samsa, L., Vigna, S., Liddle, R. Characterization of basal pseudopod-like processes in ileal and colonic PYY cells. J Mol Histol. 42, 3-13 (2011).
- Jang, H. J., et al. Gut-expressed gustducin and taste receptors regulate secretion of glucagon-like peptide-1. Proceedings of the National Academy of Sciences of the United States of America. 104, 15069-15074 (2007).
- Liou, A. P., et al. The G-protein-coupled receptor GPR40 directly mediates long-chain fatty acid-induced secretion of cholecystokinin. Gastroenterology. 140, 903-912 (2011).
- Reimann, F., et al. Glucose sensing in L cells: a primary cell study. Cell metabolism. 8, 532-539 (2008).
- Bohorquez, D. V., Liddle, R. A. Axon-like basal processes in enteroendocrine cells: characteristics and potential targets. Clinical and translational science. 4, 387-391 (2011).
- Batterham, R. L., et al. Gut hormone PYY(3-36) physiologically inhibits food intake. Nature. 418, 650-654 (2002).
- Flint, A., Raben, A., Astrup, A., Holst, J. J. Glucagon-like peptide 1 promotes satiety and suppresses energy intake in humans. The Journal of clinical investigation. 101, 515-520 (1998).
- Hayworth, K. J., et al. Imaging ATUM ultrathin section libraries with WaferMapper: a multi-scale approach to EM reconstruction of neural circuits. Frontiers in neural circuits. 8, 68 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved