Method Article
RAFT制御重合によるトライ成分蛍光グリコの容易かつ効率的な準備
要約
An efficient, three-step synthesis of RAFT-based fluorescent glycopolymers, consisting of glycomonomer preparation, copolymerization, and post-modification, is demonstrated. This protocol can be used to prepare RAFT-based statistical glycopolymers with desired structures.
要約
合成グリコは、様々な生化学的および生物医学研究の分野で使用される楽器と多彩なツールです。可逆的付加フラグメンテーション連鎖移動を使用して、よく制御された蛍光統計グリコの容易かつ効率的な合成の例は、(RAFT)ベースの重合が実証されています。 (2-アミノエチル)メタクリルアミド(AEMA) -合成は、ラクトビオとNとの反応により得られたβ-ガラクトース含有glycomonomer 2 lactobionamidoethylメタクリルアミドの製造から始まります。 2-Gluconamidoethylメタクリルアミド(GAEMA)は、端末βガラクトシドを欠く構造類似体として使用されています。 (2-ヒドロキシエチル)スペーサーとしてアクリルアミド、AEMAさらに蛍光標識のための標的として、およびglycomonomers - N:次のRAFT媒介性の共重合反応は、3つの異なるモノマーを含みます。水性系の耐性、反応に使用されるRAFT剤は、(4-シアノペンタン酸)-4-ジチオあります。低分散度(≤1.32)、予測可能な共重合体組成物、および重合の高い再現性、製品間で観察されました。蛍光ポリマーはAEMA上の第一級アミン官能基を標的とするカルボキシフルオレセインスクシンイミジルエステルとグリコを修飾することによって得られます。得られたグリコのレクチン結合特異性は、特定のglycoepitope認識レクチンでコーティングされ、対応するアガロースビーズでテストすることによって検証されます。必要に応じて、そのため合成の容易さ、製品組成物と反応の良好な再現性の厳密な制御のため、このプロトコルは、特定の構造や組成を有する他のRAFTベースグリコの準備に向けて翻訳することができます。
概要
過去20年間では、合成グリコとの研究は、レクチン認識1-3を処理するに焦点を当てて研究を含む感染性のメカニズムを調べることに大きな可能性を実証し、ゆっくりではあるが継続的な発展を遂げてきました。多価の糖部分を有する合成グリコが はるかに高いレクチン結合効能を発揮するので、一価の炭水化物と比較して、それらは糖鎖生物学の分野3で大きな需要です。臨床研究において特に興味深いのは、ヒトの呼吸器細胞表面および粘液糖タンパク質上で利用可能な炭水化物とレクチン結合によって媒介される細菌を特徴付ける蛍光グリコの使用です。初期のin vitro試験では 、細菌の結合試験で、市販のポリアクリルアミド系グリコを採用。これらのプローブのいくつかは有望な結果を示したが、入手性に関する懸念を提起し、両方のPOLにおけるロット間の差異ymer分子量とglycoepitopeコンテンツ。経済的で、実験室のプロトコルは、構造、コンテンツ、サイズ、および細菌レクチンを標的とする合成グリコの純度を十分に制御するために提供するであろうが開発されました。
グリコの適切な合成アプローチのための検索では、比較的新しい重合技術は、可逆的付加フラグメンテーション連鎖移動(RAFT)剤4を用いる制御されたラジカル重合のタイプを使用して試験しました。このようなRAFT試薬は、最近いくつかのグリコの準備5-7で使用されてきました。他のグリコ調製プロトコルと比較して、媒介RAFT重合は、モノマーの構造および反応条件は、水性溶液との潜在的な互換性、および所望のポリマー生成物8,9の低いサイズ分散度の様々な耐性を含むいくつかの利点を実証します。注目すべき興味深いのは、RAFT-BAを製造するためのプロトコルは、異なる機能10-13を有していてもよいの異なるモノマーの組成の制御を可能にするSED三成分グリコ。しかし、以前の研究努力のほとんどがアノマーペンダント炭水化物10を欠いていた、または採用のいずれか、多くの場合、単量体の配列における共重合体である統計的ポリマーとは異なる目的に役立つ共有結合したホモポリマーで構成されてトリブロック共重合体が得られる重合を、階段状残基は、統計的規則9-13に従ってください。
最近では、水性環境におけるチオカルボニルチオRAFT化合物(4-シアノペンタン酸)-4-ジチオ、特定のペンダント糖を含むRAFTベースの線形三成分統計グリコグループの準備と結合レクチン媒介性細菌への応用を採用テストは14を報告しました。視覚的な方法で提示され、この方法の全体的な目的は、三成分を調製することですRAFT制御共重合を介して統計蛍光グリコ。そのため、一段階重合プロトコル、ポリマーの長さおよび組成を微調整し、反応の高い再現性の容易さのため、このプロトコルは、容易に所望の構造を有するグリコの他のRAFTベースの合成に適用することができます。
プロトコル
Glycomonomer 2-Lactobionamidoethylメタクリルアミドの1合成
- 無水メタノール3.0mlの中にラクトビオン酸2gを溶解し、ゆっくりと溶液がちょうど曇っなるまで滴下様式で無水エタノールを追加し、その後、回転蒸発を介して溶媒を除去。
- もう一度、ゆっくりとその後回転蒸発を介して溶剤を蒸発させる、ちょうど曇っまで無水エタノールを追加し、無水メタノール3.0ミリリットルでは、ステップ1.1から、残留物を溶解し。ラクトビオノ-1,5-ラクトン(1.94グラム、98%収率)を得た。この手順を3回繰り返します。この製品は、次の反応に使用されるのに十分な純度です。
- Nにメタノール3.0ミリリットルにラクトビオ1.0gの追加- (2-アミノエチル)メタクリルアミド(AEMA、0.58グラム)と、ヒドロキノンモノメチルエーテル(MEHQ、1.0 mg)を、自己重合の阻害剤、メタノール2.0mlの中で、続いてトリエチルアミン1.0mlのこともできます。 48時間室温で撹拌しました。
- 脱イオンH 2 Oの20ミリリットル(DH 2を追加します。 O)、回転蒸発を介して乾燥するまで蒸発させることにより、メタノール、無料のトリエチルアミンを削除します。
- MEHQの1.0 mgの受信ビーカーに- (X 20ミリメートルの形、10ミリメートルOH)、残りのラクトビオン酸を除去するのdH 2 Oの20ミリリットルを追加するには、陰イオン交換カラムに通して、水溶液を通過させます。
- 回転蒸発を介して乾燥するまで蒸発させることによって、ステップ1.5で作製し、トリエチルアミンを削除します。
- のdH 2 Oの20ミリリットルを追加し、何のニンヒドリン反応性物質が検出されなくなるまで、ゆっくりと陽イオン交換樹脂(H +型)の1mgのアリコートを添加することにより、未反応のAEMAを削除します。エタノール溶液中の2%ニンヒドリンでプレートを噴霧次に、薄層クロマトグラフィープレートに適用し、各樹脂の添加後、溶液の1μlのアリコートを取ることによって除去を監視します。プレートは1分間、90℃に加熱されたときに、深い青色が発達することが観察されていない場合、エンドポイントに到達しました。
- 、フリットガラス漏斗を通して溶液を濾過試験管にろ液を移す、-80℃でサンプルを凍結し、その後凍結乾燥。
- 最少量のメタノールに凍結乾燥物質を溶解することによりサンプルからMEHQを削除(〜0.5mL)を、冷無水アセトンを追加し(-20°C、15mL)で生成物を沈殿させます。その後、オフホワイトの粉末(0.94グラム、68%収率)として2- lactobionamidoethylメタクリルアミド(LAEMA)を得、真空下でデシケーター中で沈殿物を乾燥、フリットガラス漏斗を用いて濾過することにより沈殿物を収集します。この製品は、次の反応に使用されるのに十分な純度です。
モノマー2-Gluconamidoethylメタクリルアミドの合成2。
注:ペンダント糖を持たない2 gluconamidoethylメタクリルアミドの調製(GAEMA)は、公開された方法から適応させた15。
- 溶液に、メタノール10mlに溶解しAEMAの2.0グラムを追加します。30mlのメタノール中のD-グルコノラクトン(1.6グラム)のと、攪拌しながら、ゆっくりとトリエチルアミン1.6ミリリットルを追加します。
- 24時間室温で反応を撹拌しました。
- フリットガラス漏斗を用いて、沈殿した生成物を濾過し、乾燥アセトン10mlで洗浄し、その後、10ミリリットルのイソプロパノールのそれぞれに沈殿物を3回すすいでください。真空下でデシケーター中に沈殿した生成物を乾燥させます。
3. RAFT糖鎖高分子の合成
- 商業N中に存在する阻害剤のMEHQ削除するには- (2-ヒドロキシエチル)アクリルアミド(HEAA)を、酸化アルミニウムナノ粒子を0.5gを添加することにより、続いて2ミリリットルのマイクロチューブにHEAAの1ミリリットルを追加します。 30秒間300×gでチューブを遠心し、次の反応に上層HEAAを使用しています。
- 慎重LAEMAの32.8 mgの(70.0マイクロモル)、AEMA 1.7mgの(10.5マイクロモル)とHEAA(270マイクロモル)の27.5μlを添加、すべては、このように、よく洗浄1ミリリットルのシュレンク管に、のdH 2 Oを0.4ミリリットルに溶解しますmonomを持ちます3:77 20のERモル比。
- 並行反応では、任意のペンダント糖を有さない対照ポリマーを製造するために、ステップ3.2においてLAEMAを使用する代わりに、反応にGAEMA 21.4ミリグラム(70.0マイクロモル)を置き換えます。
- それぞれのシュレンク管( すなわち 、3.2または3.3)に、順次(4-シアノペンタン酸)の0.53 mgのDMF50μlの-4-ジチオ(1.9マイクロモル、RAFT剤)、および250μgのを含むDMF50μlのを追加4,4'-アゾビス(4-シアノ吉草酸)(0.9マイクロモル、開始剤)。そっと指タッピングによって混合します。
- シュレンク管に含まれるコンテンツのドライアイスを使用する凍結:エタノール浴を(エタノール100ml中の75グラムドライアイス)を、10〜50ミリトールの範囲内に真空を適用し、その後、シュレンク弁を閉じ、ゆっくりとRTに解凍するためのソリューションを可能にします。さらに2回、この凍結避難融解サイクルを繰り返します。すべての試薬は、最後の雪解け後に溶解されていることを確認します。
- 密閉可能なプラスチック製のBAにシュレンク管を配置Gは、袋の空気を排気し、それを密封します。 70℃に予熱した水浴にシュレンク管の入った袋を移し、24時間インキュベートします。
- 慎重に準備透析バッグ(MWCO = 3,500)にシュレンク管にソリューションを転送し、最初の8時間のdH 2 Oを毎時間の変更、24時間のdH 2 O(10×2 L)に対して透析。透析後、試験管に透析チューブからのサンプルを転送-80℃でサンプルを凍結し、それを凍結乾燥。
注:得られた統計的ポリメタクリルアミド/アクリルアミド(ステップ3.3から)(ステップ3.2から)ペンダント4- O-β-D-ガラクトピラノシル-D-グルコンアミド(ラクト)またはD-グルコンを含む(PMA)コポリマー、それぞれ、得られました。説明の便宜上、これらの二つのグリコはそれぞれ、PMA-LAEMAとPMA-GAEMAと略記されています。
4.フルオロフォアでグリコのポスト変更
- それぞれ、リン酸緩衝生理食塩水(PBS、0.1Mリン酸ナトリウム、0.15 MのNaCl、pH7.5)を0.9 ml中に第一級アミン官能基の〜0.9マイクロモル含有グリコPMA-LAEMAまたはPMA-GAEMAの5.0 mgの溶解。
- 急速攪拌しながら徐々にソリューションにDMF100μlのカルボキシフルオレセインスクシンイミジルエステル0.6 mgの追加。ゆっくり室温で暗所で16時間反応をかき混ぜます。
- 光から保護しながら、準備された透析チューブ(MWCO = 3,500)に試料をロードし、透析液を最初の8時間ごとに時間を変更し、16時間のdH 2 O(2 L)に対して透析。透析後、試験管に透析チューブからのサンプルを転送-80℃でサンプルを凍結し、それを凍結乾燥。
注:以下の凍結乾燥、蛍光グリコPMA-LAEMAフルオレセインおよびPMA-GAEMAフルオレセインをそれぞれ得ます。
グリシンの5キャラクタリゼーション共重合体
- 数平均分子量(M n)、重量平均分子量(M w) を 、ゲル浸透クロマトグラフィー(GPC)ソフトウェア、GPCを備えた商業的HPLCシステム上のグリコの分散度(M w / M n) を決定します0.6ミリリットル/分で14の流速で溶離液として0.1 Mトリス/ 0.1 M塩化ナトリウム緩衝液(pH 7)を使用して、目的の分子量、及び屈折率検出器、適したカラム。 (:200-1,200,000 /モルMW)分子量標準としてポリエチレングリコール標準を使用してください。
- グリコ16内の第一級アミン官能基の実際の濃度を定量化します。発表された方法17に従って合成グリコの総炭水化物含有量を分析します。
- NMR分光法14でD 2 OにglycomonomersのLAEMA、GAEMAとグリコPMA-LAEMA、PMA-GAEMAの構造組成と純度のテストを実行。
レクチンコーティングされたアガロースビーズを有する合成グリコの6結合試験
- 1分間300×gでアメリカデイゴレクチン(ECL)でコーティングされたアガロースビーズの懸濁液、遠心分離機の50μlにPBS 1.5mlのを追加し、慎重に取り外し、上清を処分。このステップを2回繰り返し、その後、PBS 0.5mlの中でビーズを再懸濁します。
- 室温で1時間、ビーズ懸濁液にPBSの6μlのPMA-LAEMAフルオレセインまたはPMA-GAEMAフルオレセイン(ネガティブコントロール)の3μgのを追加し、混合物をインキュベート、暗所で。
- 0.2mlのPBSでPBSで3回、再懸濁ビーズを1.5 mlの混合物を洗います。 、免疫蛍光顕微鏡スライド(テフロンコート)のウェルに一定分量(4μl)をロードし、カバースリップでカバーし、FITCフィルターを使用して、蛍光顕微鏡により観察(励起波長:467から498 nmの発光波長:513- 566 nm)であり、tの結合を調べるために10倍の対物レンズ彼はビーズ14とグリコが 蛍光性。
結果
glycomonomerの合成
ラクトビオン酸はglycomonomersの製造のための一例として、本明細書中で使用されました。 LAEMA 11の合成に関する最初の報告でメソッドを使用して、不満足な純度で調製における多様な収率が観察されました。 1 H及び13 C NMR分光法( 図1)によって確認された安定した生成物の収率および高い純度を提供し、未反応の出発物質を除去するための陽イオンと陰イオン交換樹脂を使用して変更精製方法。
ラフトグリコ合成と蛍光団とグリコの後変性
段差RAFT重合によって調製ブロックグリコとは対照的に、このワンステップ共重合プロトコールは、ポリマー主鎖全体に均一glycomonomer分布を提供します。ここに示されているグリコはGLの20モル%を含有しycomonomer、スペーサとしてHEAAの77モル%、及び後修飾のための標的としてAEMAの3モル%( 図2参照 )。1 H-及び13 C-NMR分光法は、PMA-LAEMAおよびPMA-GAEMAの構造を確認( 図3および4)。図5に示すように、RAFTずに合成された糖鎖高分子のGPC溶出プロファイルに対してプロットしたときに、PMA-LAEMAとPMA-GAEMA両方がRAFTアプローチの有効性を証明し、低い分散度を有しています。予想されたように、PMA-GAEMAはM n を有するによるペンダント糖のPMA-GAEMAの欠如にPMA-LAEMAのそれよりも小さいです。炭水化物およびRAFTのグリコの内容第一級アミン官能基の分析は、生成物のグリコ中のモノマーの割合が媒介RAFT重合反応( 表1)に使用されるモノマーの開始の化学量論比と一致していることが明らかになりました。これは、単量体の厳密な制御を意味compositioNS合成グリコに、設計されます。
活性化されたフルオロフォアを有する第一級アミン官能基の反応は、タンパク質標識で広く使用される技術です。この技術は、カルボキシフルオレセインで精製されたグリコを標識するために、ここで使用しました。後修飾後、蛍光ポリマーが( 図6)を得ました。反応中のフルオレセイン標識ポリマーの分解は、GPC分析によって検出されなかった(データは示さず)。
レクチンでコーティングされたアガロースビーズと合成グリコの結合試験
実験に用いられる合成グリコのレクチン結合特異性を評価するために、既知の炭水化物結合特異性を有するレクチンコーティングされたアガロースビーズを使用した。 エリスリナ属稜-ガリレクチン(ECL)は、β-D-ガラクトシド向かっ結合特異性を有します。 図7Aは、明らかにそのPMA-LAEMA-FLを実証しますペンダント糖質としてβ-D-ガラクトシドを含んでuoresceinは、ECLレクチンとの強い結合を示しました。対照的に、ペンダント糖を持たないグリコPMA-GAEMAフルオレセインのECLへの結合は、負の、 図7Bに示されています。この結果は、合成された蛍光糖鎖高分子の結合有効性および親和性を例示しています。
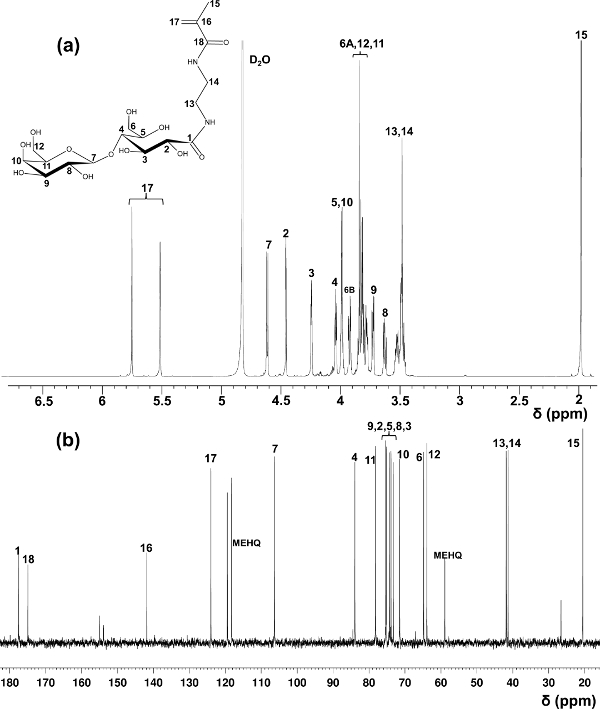
LAEMAための1 H-(a)および13 C-NMR(b)のスペクトル(D 2 O)を割り当てられた。(この図は、Wang らから変更されている。14) 図1. このの拡大版を表示するには、こちらをクリックしてください図。
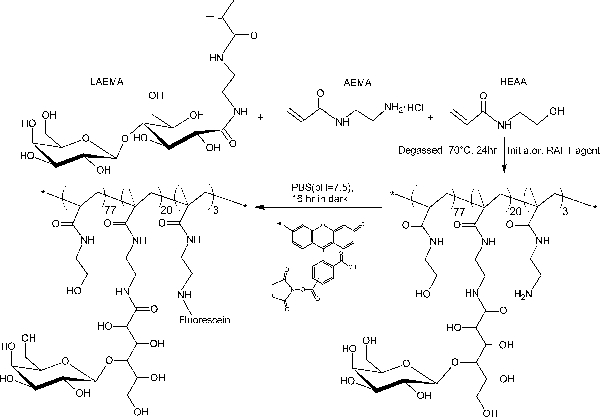
図2.ペンダント糖としてβガラクトシドを含む蛍光グリコPMA-LAEMAの合成の模式図。 この図の拡大版を表示するには、こちらをクリックしてください。
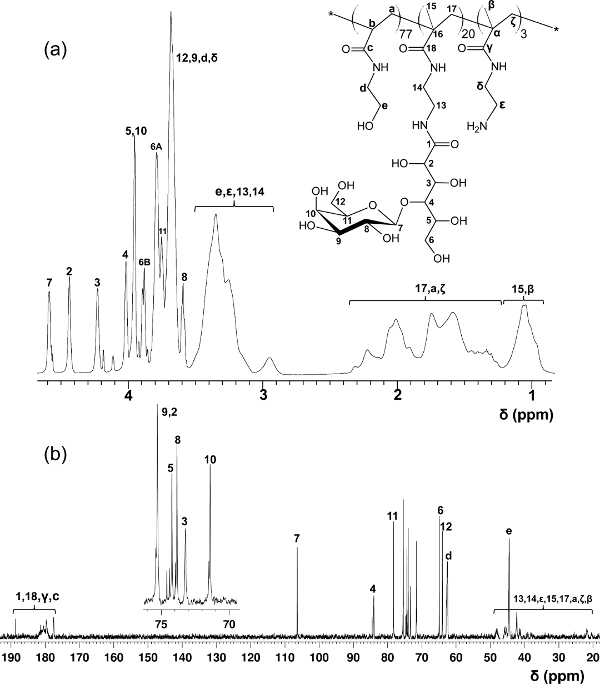
図3. PMA-LAEMAのグリコのための1 H-(A)及び13 C-NMR(B)スペクトル(D 2 O)を割り当てられた。(この図はら王から変更されている。14) 嘆願SEは、この図の拡大版をご覧になるにはこちらをクリックしてください。
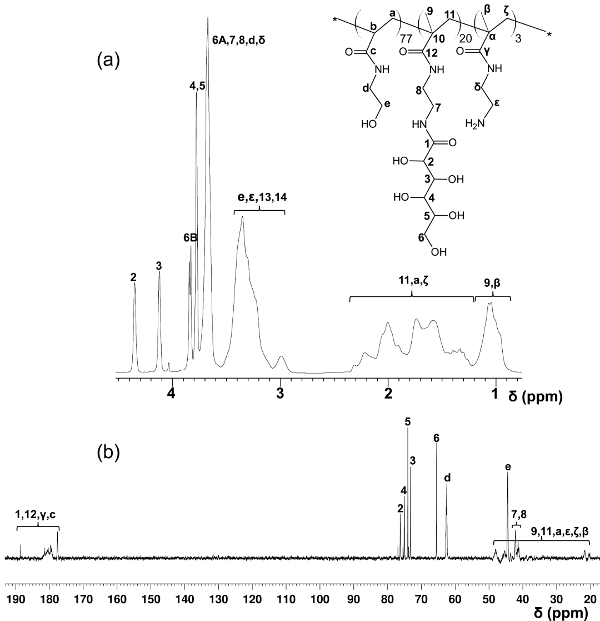
図4は、PMA-GAEMAための1 H-(A)及び13 C-NMR(B)スペクトル(D 2 O)を割り当てられた。(この図は、Wang らから変更されている。14) 拡大版を表示するには、こちらをクリックしてくださいこの図の。
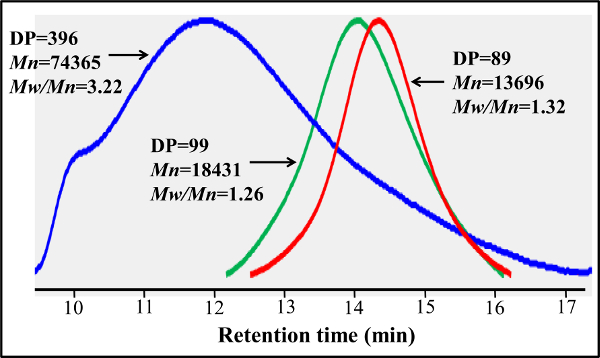
RAFTベースのPMA-GAEMAとPMA-LAEMAの図5.ゲル浸透クロマトグラフィーのトレースはでとRAFT剤を使用せずに作成した。RAFT剤(青)を用いずに調製PMA-LAEMA、RAFT-とは対照的に、ベースPMA-LAEMA(緑)は、はるかに低い分散度(M w / M n を )有します。 RAFTベースのPMA-GAEMA(赤)とPMA-LAEMAが同様のGPCプロファイルを持っているが、前者は何らかのペンダント糖の不在に小さいM n を有する。 この図の拡大版を表示するには、こちらをクリックしてください。

フルオロフォアと変更後の前と後図6 PMA-LAEMAを。白非標識グリコ(左チューブ)と比較して(A)、フルオレセイン標識PMA-LAEMAは、強い黄色(右チューブ)を示します。 (B)UV下では、非標識PMA-LAEMA(左チューブ、PBS中1mg / ml)で暗く、蛍光なしで提示し、フルオレセイン標識PMA-LAEMA(右チューブ、1 mg / mlのPBS中)を示すのに対し、強い緑色蛍光。://www.jove.com/files/ftp_upload/52922/52922fig4large.jpg「ターゲット= "_空白">この図の拡大版を表示するには、こちらをクリックしてください。
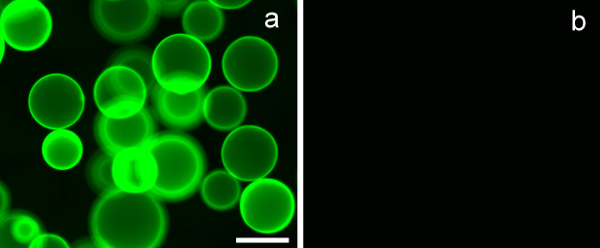
グリコはなく、ペンダント糖を有するれていないものを含む図7. アメリカデイゴレクチン(ECL)でコーティングされたアガロースビーズに結合β-D-ガラクトシド。(A)PMA-LAEMAフルオレセイン(3μgを)ECLとの結合の強い実証、何のペンダントβ-D-ガラクトシド残基を有していないのに対し、(B)において、PMA-GAEMA-フルオレセインは、何のレクチンでコーティングしたビーズとの結合を示さありませんでした。 スケールバー=100μmです。
表1は、ターゲティングの合成パラメータとグリコの実際の組成の値。A)の値をターゲットに、値がその製品の望まれます。 B)DP、重合度は、 C)NAは、利用できません。 この図の拡大版を表示するには、こちらをクリックしてください。
| DP B | 分散度 | glycomonomersの実際の内容 モル% | 第一級アミンの実際の内容 モル% | |
| 値をターゲット | 100 | <1.3 | 20 | 3 |
| PMA-LAEMA | 99 | 1.26 | 19 | 3.2 |
| PMA-GAEMA | 89 | 1.32 | NA C | 2.7 |
ディスカッション
RAFTベースのトライコンポーネント蛍光ペンダント炭水化物とないグリコ、およびレクチン結合試験におけるそれらの使用のための容易で効率的なプロトコルは、本報告書で示されています。プロトコルはglycomonomers LAEMAとGAEMAの準備から始まります。ワンステップRAFT制御共重合により、再現可能な収率、予測可能なモノマー組成及び低分散を有するグリコが得られます。カルボキシフルオレセインスクシンイミジルエステルとグリコの後変性後、得られたそれぞれの蛍光標識糖鎖高分子の結合は、レクチン結合特異性のために容易にテスト可能です。
その後の糖鎖高分子の合成に使用することになっているglycomonomersの初期取ステップでは、容易に入手可能ラクトビオン酸及びグルコノラクトンを利用しました。理論的には、目的の任意の炭水化物は、複合オリゴ糖の単糖から、converteすることができますグルコースのC6の第一級ヒドロキシル基に目的糖を結合させることによりglycomonomersにD。還元グルコース残基の酸化、及びラクトンへのその後の脱水後、次いで、生成物を容易に対応glycomonomerを形成するAEMA上の第一級アミンと反応させることができます。この経路のさらなる例は、最近の報告14に見ることができます。これは、任意の重合工程を開始する前に、MEHQ、強力な重合禁止剤は、使用直前にすべてのモノマーとglycomonomer調製物から除去しなければならないことに留意すべきです。これは、容易にMEHQが直ちに高収率で阻害剤を含まない生成物を沈殿させ、-20℃でアセトンで扱っ保有glycomonomerを溶解し、メタノールの最小量を使用することによって達成されます。
任意のラジカル重合方式に不可欠な、詳細及びモノマー純度に注意が強調されています。 RAFT重合系の典型的なように、で構成されラジカル源、RAFT試薬、モノマーおよび溶剤。この可視化のプレゼンテーションでは、単一ステップRAFT重合系は、水溶液中に三つの異なるモノマーを有する反応混合物から生成された統計的コポリマーの製造に焦点を当てたことが記載されています。二つの独立したRAFT媒介反応は一つのペンダントを持ってglycomonomerを利用するに提示され、結合しない炭水化物残基を有するポリオールを有する、炭水化物末端( すなわち、β-D-ガラクトース)、および他の非還元。両方RAFT媒介性の反応に共通するスペーサー分子として機能する単一のヒドロキシル基を有する単量体であった、もう一つはアミノ反応性フルオロフォア後修飾のための遊離アミンを有します。
反応混合物を環境中の酸素の存在が、RAFT媒介重合に有害であるので、レベルを追跡するためにその除去を容易にいくつかの凍結EVAを介して達成されますcuate融解サイクル、高真空下でシュレンク管反応容器を維持しつつ。
これは、必要に応じて、反応中の異なるモノマーのモル比を調整することができることに留意すべきです。また、使用されるRAFT剤の量を変えることにより、得られるポリマーの長さは、18を制御することができます。しかし、イニシエータにRAFT剤のモル比は、常に製品の低分散性を確保するために、2つ以上でなければなりません。これらの条件下では、共重合の進化は、安定であり、反応の再現性は非常に高いです。すなわち、一つは、それらの異なる重合速度に、統計コポリマー内のすべての参加のモノマーの完全均一な分布を求めることはほとんどありません、と述べています。ポリマー内の異なるモノマーの分布を特徴付けることはまだ非常に困難です。
修正後の方法は、ここに提示、両方簡単でよりamenablです他のプロトコルと比較して、蛍光標識の広い選択を使用する電子は、グリコ2,11を標識するために適用されます。これらは、水溶性アミン反応性フルオロフォア、量子ドット、ビオチン、およびその他の多くを含むであろう。合成された、標識されたグリコの結合特異性は、容易に検証可能な既知の結合親和性を有するレクチンを使用しています。何のペンダント糖を保有しないPMA-GAEMAは、適切なネガティブコントロールです。この経路を介して調製異なる蛍光標識を有するグリコ正常レクチン媒介細菌14を結合研究に使用されています。提示されているように、統計的な蛍光グリコのこの容易かつ効率的な準備がglycobiological研究の多種多様に大きな可能性を提供する必要があります。
開示事項
The authors have nothing to disclose.
謝辞
This work was supported by the Experiment Station Chemical Laboratories of the University of Missouri, and by the Cystic Fibrosis Association of Missouri.
資料
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| Lactobionic acid | Sigma-Aldrich | 153516 | |
| D-Gluconolactone | Sigma-Aldrich | G2164 | |
| N-(2-hydroxyethyl) acrylamide (HEAA) | Sigma-Aldrich | 697931 | |
| Orange II sodium salt | Sigma-Aldrich | O8126 | |
| Hydroquinone monomethyl ether (MEHQ) | Sigma-Aldrich | 54050 | Polymerization inhibitor |
| N-(2-aminoethyl) methacrylamide hydrochloride (AEMA) | Polysciences, Inc | 24833-5 | |
| Triethylamine | Fisher Scientific | BP-616 | |
| Anion-exchange resin IRN-78 hydroxide-form, 80 mesh | Sigma-Aldrich | 10343-U | |
| Cation-exchange resin 50Wx8, 200 mesh | Sigma-Aldrich | 217514 | |
| Aluminum oxide, ~150 mesh | Sigma-Aldrich | A1522 | Type WN-6, Neutral, Activity Grade Super I |
| Ninhydrin | Sigma-Aldrich | N4876 | An ethanol solution of 0.2% ninhydrin was used in the test |
| 4-Cyano-4-(phenylcarbonothioylthio)pentanoic acid | Sigma-Aldrich | 722995 | RAFT agent |
| 4,4′-Azobis(4-cyanovaleric acid) | Sigma-Aldrich | 11588 | Polymerization initiator |
| Carboxyfluorescein succinimidyl ester | Life Technologies | C1157 | |
| Erythrina Cristagalli lectin coated agarose bead | Vector Laboratories | AL-1143 | |
| Solvent | |||
| dH2O | Produced by Barnstead water purification system, 18 megOhm-cm | ||
| Isopropanol | Fisher Scientific | A461-4 | ACS grade or better |
| Methanol | Fisher Scientific | A454-4 | ACS grade or better |
| Absolute ethanol | Fisher Scientific | BP2818-100 | ACS grade or better |
| Dimethylformamide | Sigma-Aldrich | 22705 | ACS grade or better |
| Acetone | Fisher Scientific | A929-4 | ACS grade or better |
| Equipment | |||
| Dialysis membrane (MWCO: 3,500) | Spectrum Labs | 132720 | |
| Polyethylene glycol analytical standard standard | Sigma-Aldrich | O2393 | |
| Schlenk tube, 1 ml | Quark Glass | Customized | |
| TSK-GEL G4000 PWxl | Tosoh Bioscience | 8022 | Used for GPC analysis of the glycopolymers |
| Empower 3 with GPC/SEC package | Waters Corporation | ||
| Waters Alliance HPLC system | Waters Corporation | Equipped with refractive index detector (Waters 2414) and fluorescence detector (Waters 2475) | |
| Avance III 800 MHz NMR Spectrometer | Bruker Corporation | ||
| BX43 fluorescence microscope | Olympus Corporation | Used with FITC filter in the glycopolymer binding test | |
| Rotavap / Rotoevaporator | Heidolph | ||
| Fritted disc funnel | Fisher Scientific | 10-310-109 | |
| Lyophilizer | Labconco | ||
| Immunofluorescence microscope slide | Polysciences | 18357-1 | |
| Revco Ultima Plus -80 °C Freezer | Thermo Scientific | ||
| Plastic Vacuum Bag and Hand Pump | Ziploc | ||
| Vacuum Pump, Direct Drive, Maxima C Plus | Fisher Scientific | ||
| Vacuum Gauge | Sargent-Welch | ||
参考文献
- Scharfman, A., et al. Pseudomonas aeruginosa binds to neoglycoconjugates bearing mucin carbohydrate determinants and predominantly to sialyl-Lewis x conjugates. Glycobiology. 9 (8), 757-764 (1999).
- Song, E. H., et al. In vivo targeting of alveolar macrophages via RAFT-based glycopolymers. Biomaterials. 33 (28), 6889-6897 (2012).
- Wolfenden, M. L., Cloninger, M. J., Wang, B., Boons, G. .. -. J. Chapter 14. Multivalency in carbohydrate binding. Carbohydrate Recognition: Biological Problems, Methods, and Applications. , 349-370 (2011).
- Moad, G., Rizzardo, E., Thang, S. H. Radical addition-fragmentation chemistry in polymer synthesis. Polymer. 49 (5), 1079-1131 (2007).
- Spain, S. G., Gibson, M. I., Cameron, N. R. Recent advances in the synthesis of well-defined glycopolymers. J. Polym. Sci., Part A: Polym. Chem. 45 (11), 2059-2072 (2007).
- Bernard, J., Hao, X., Davis, T. P., Barner-Kowollik, C., Stenzel, M. H. Synthesis of various glycopolymer architectures via RAFT polymerization: From block copolymers to stars. Biomacromolecules. 7 (1), 232-238 (2006).
- Bulmus, V. RAFT polymerization mediated bioconjugation strategies. Polym. Chem. 2, 1463-1472 (2011).
- Ting, S. R. S., Chen, G., Stenzel, M. H. Synthesis of glycopolymers and their multivalent recognitions with lectins. Polymer Chemistry. 1, 1392-1412 (2010).
- Vazquez-Dorbatt, V., Lee, J., Lin, E. W., Maynard, H. D. Synthesis of glycopolymers by controlled radical polymerization techniques and their applications. Chembiochem. 13, 2478-2487 (2012).
- Jiang, X., Ahmed, M., Deng, Z., Narain, R. Biotinylated glyco-functionalized quantum dots: Synthesis, characterization, and cytotoxicity studies. Bioconjugate Chem. 20 (5), 994-1001 (2009).
- Deng, Z., Li, S., Jiang, X., Narain, R. Well-defined galactose-containing multi-functional copolymers and glyconanoparticles for biomolecular recognition processes. Macromolecules. 42 (17), 6393-6405 (2009).
- Qin, Z., et al. Galactosylated N-2-hydroxypropyl methacrylamide-b-N-3-guanidinopropyl methacrylamide block copolymers as hepatocyte-targeting gene carriers. Bioconjugate Chem. 22 (8), 1503-1512 (2011).
- Albertin, L., Wolnik, A., Ghadban, A., Dubreuil, F. Aqueous RAFT polymerization of N-acryloylmorpholine, synthesis of an ABA triblock glycopolymer and study of its self-association behavior. Macromol. Chem. Phys. 213 (17), 1768-1782 (2012).
- Wang, W., Chance, D. L., Mossine, V. V., Mawhinney, T. P. RAFT-based tri-component fluorescent glycopolymers: synthesis, characterization and application in lectin-mediated bacterial binding study. Glycoconj. J. 31 (2), 133-143 (2014).
- Deng, Z., Ahmed, M., Narain, R. Novel well-defined glycopolymers synthesized via the reversible addition fragmentation chain transfer process in aqueous media. J. Polymer Sci. Part A: Polym. Chem. 47 (2), 614-627 (2009).
- Noel, S., Liberelle, B., Robitaille, L., De Crescenzo, G. Quantification of primary amine groups available for subsequent biofunctionalization of polymer surfaces. Bioconjugate Chem. 22 (8), 1690-1699 (2011).
- Fox, A., Morgan, S. L., Gilbart, J., Biermann, C. J., McGinnis, G. D. Preparation of alditol acetates and their analysis by gas chromatography (GC) and mass spectrometry (MS). Analysis of Carbohydrates by GLC and MS. , 87-170 (1989).
- Thomas, D. B., et al. Kinetics and molecular weight control of the polymerization of acrylamide via RAFT. Macromolecules. 37 (24), 8941-8950 (2004).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved