Method Article
Préparation Facile et efficace de glycopolymères fluorescentes Tri-composants par polymérisation RAFT-contrôlée
Dans cet article
Résumé
An efficient, three-step synthesis of RAFT-based fluorescent glycopolymers, consisting of glycomonomer preparation, copolymerization, and post-modification, is demonstrated. This protocol can be used to prepare RAFT-based statistical glycopolymers with desired structures.
Résumé
Glycopolymères synthétiques sont des outils instrumentaux et polyvalents utilisés dans divers domaines de recherche biochimiques et biomédicales. Un exemple d'une synthèse facile et efficace de glycopolymères statistiques fluorescentes bien contrôlée à l'aide réversible par addition-fragmentation de transfert de chaîne (RAFT) à base de polymérisation est mise en évidence. La synthèse commence par la préparation de 2-glycomonomer lactobionamidoethyl méthacrylamide contenant un β-galactose obtenu par réaction de lactobionolactone et N - (2-aminoéthyl) méthacrylamide (AEMA). 2-méthacrylamide Gluconamidoethyl (GAEMA) est utilisé comme un analogue structural dépourvu de β-galactoside terminal. La réaction de copolymérisation RAFT médiée par suite comprend trois monomères différents: N - (2-hydroxyéthyl) acrylamide comme espaceur, AEMA comme cible pour de plus amples marquage par fluorescence, et les glycomonomers. Tolérant des systèmes aqueux, l'agent de RAFT utilisé dans la réaction est de (acide 4-cyano pentanoïque) -4-dithiobenzoate.Low dispersités (≤1.32), des compositions de copolymères prévisibles, et une grande reproductibilité des polymérisations ont été observés parmi les produits. Les polymères fluorescents sont obtenus en modifiant les glycopolymères avec l'ester de succinimidyle de carboxyfluorescéine ciblant les groupes fonctionnels de type amine primaire sur AEMA. spécificités de liaison de lectine des glycopolymères résultent sont vérifiées par l'essai avec des perles d'agarose correspondants revêtus de glycoepitope reconnaissant lectines spécifiques. En raison de la facilité de la synthèse, le contrôle serré des compositions de produits et la bonne reproductibilité de la réaction, ce protocole peuvent être traduits vers la préparation d'autres glycopolymères base-RAFT avec des structures et des compositions spécifiques, comme souhaité.
Introduction
Dans les deux dernières décennies, des enquêtes avec glycopolymères synthétiques ont connu un développement lent mais continu, ce qui démontre un potentiel important dans l'examen des mécanismes infectieuses telles que la recherche qui se concentre sur la reconnaissance lectine traite 1-3. Depuis glycopolymères synthétiques possédant des fragments de sucre polyvalents présentent beaucoup plus élevés efficacités de lectine de liaison, par rapport aux glucides monovalents, ils sont d'une grande demande dans le domaine de la glycobiologie 3. D'un intérêt particulier dans la recherche clinique est l'utilisation de glycopolymères fluorescents pour caractériser la liaison avec des glucides disponibles sur la surface des cellules respiratoires humaines et glycoprotéine muqueuse bactérienne de lectine-médiation. Début des études in vitro utilisé commercialement disponibles glycopolymères base de polyacrylamide dans des tests de liaison bactériennes. Plusieurs de ces sondes ont montré des résultats prometteurs, mais ont soulevé des préoccupations concernant les écarts, facilité d'obtention, et lot-à-lot à la fois polpoids moléculaire Ymer et le contenu de glycoepitope. Un protocole économique en laboratoire a été élaboré qui donnerait pour un contrôle satisfaisant de la teneur en structure, la taille, et la pureté de glycopolymères synthétiques ciblant lectines bactériennes.
A la recherche d'une approche synthétique appropriée à glycopolymères, une technique relativement nouvelle de polymérisation a été testé en utilisant un type de polymérisation radicalaire contrôlée qui employait réversible par addition-fragmentation de transfert de chaîne (RAFT) 4 agents. Ces réactifs RAFT ont été récemment utilisé dans quelques préparations glycopolymère 5-7. Par rapport aux autres protocoles de préparation de glycopolymère, des polymérisations RAFT médiée démontrent plusieurs avantages, y compris la tolérance à une variété de structures monomères et les conditions de réaction, la compatibilité potentielle avec des solutions aqueuses, et une faible dispersité de taille des produits polymères souhaités 8,9. D'intérêt considérable existe des protocoles pour la préparation du RAFT-baglycopolymères tri-composant SED, permettant le contrôle des compositions de monomères différents, dont chacun peut avoir des fonctions distinctes 10-13. Cependant, la plupart des travaux de recherche antérieurs soit manqué anomériques hydrates de carbone pendants 10, ou employer intensifié polymérisations en résultent dans les copolymères tri-séquencés, qui se composent d'homopolymères liés de manière covalente, qui servent souvent des fins différentes de celles des polymères statistiques qui sont des copolymères dans lesquels la séquence de monomère résidus suivent une règle statistique 9-13.
Récemment, en utilisant le composé du RAFT thiocarbonylthio (acide 4-cyano pentanoïque) -4-dithiobenzoate dans un environnement aqueux, la préparation d'un groupe de RAFT repose-glycopolymères statistiques tri-composant linéaires contenant des sucres suspensions spécifiques et leur application à la lectine à médiation par la liaison bactérienne des tests ont été signalés 14. L'objectif global de cette méthode, présentée d'une manière visuelle, est de préparer trois composantsglycopolymères fluorescentes statistiques via copolymérisation RAFT-contrôlée. En raison de la facilité du protocole de polymérisation en une seule étape, le contrôle précis sur la longueur et des compositions de polymères, et la grande reproductibilité de la réaction, ce protocole peut être facilement appliquée à d'autres synthèses sur la base de RAFT-glycopolymères avec structures désirées.
Protocole
1. Synthèse de Glycomonomer 2-Lactobionamidoethyl méthacrylamide
- Dissoudre 2 g d'acide lactobionique dans 3,0 ml de méthanol anhydre et ajouter lentement de l'éthanol absolu dans un sage mode goutte jusqu'à ce que la solution devient simplement nuageux, puis retirer les solvants via rotoévaporation.
- Dissoudre le résidu, de l'étape 1.1, dans 3,0 ml de méthanol anhydre et, une fois de plus, ajouter lentement de l'éthanol absolu jusqu'à tout trouble, puis évaporer les solvants via rotoévaporation. Répéter cette étape trois fois pour obtenir lactobiono-1,5-lactone (1,94 g, rendement de 98%). Ce produit est d'une pureté suffisante pour être utilisé dans les réactions suivantes.
- Ajouter 1,0 g de lactobionolactone dans 3,0 ml de methanol à N - (2-aminoéthyl) méthacrylamide (AEMA, 0,58 g) et de l'éther monométhylique d'hydroquinone (MEHQ, 1,0 mg), un inhibiteur d'auto-polymérisation, dans 2,0 ml de methanol, puis par 1,0 ml de triéthylamine. Agiter à température ambiante pendant 48 h.
- Ajouter 20 ml de H 2 O déminéralisée (DH 2 O) dans le ballon de réaction, puis retirez le méthanol et de triéthylamine libre par évaporation à sec via rotoévaporation.
- Pour éliminer l'acide lactobionique restant, ajouter 20 ml de dH 2 O, puis passer la solution aqueuse à travers une colonne d'échange d'anions (forme OH -, 10 mm x 20 mm) dans un bécher de réception contenant 1,0 mg de MEHQ.
- Retirer triéthylamine, produite à l'étape 1.5, en évaporant à sec via rotoévaporation.
- Ajouter 20 ml de dH 2 O et retirer réagi AEMA en ajoutant lentement 1 mg aliquotes de résine échangeuse de cations (forme H +) jusqu'à ce qu'il ne ninhydrine matériaux réactifs sont détectables. Surveiller le retrait en prenant 1 pl aliquotes de la solution après chaque addition de résine, en l'appliquant sur une plaque de Chromatographie en couche mince, puis la pulvérisation de la plaque avec un ninhydrine 2% dans une solution d'éthanol. Lorsque aucune couleur bleu profond est observé à se développer lorsque la plaque est chauffée à 90 ° C pendant 1 min, le point final a été atteint.
- filtre la solution à travers un entonnoir en verre fritté, transférer le filtrat dans un tube à essai, congeler l'échantillon à -80 ° C, puis lyophiliser.
- Retirer MEHQ de l'échantillon par dissolution de la matière lyophilisée dans un minimum de méthanol (~ 0,5 ml), puis ajouter de l'acétone anhydre froid (-20 ° C, 15 ml) pour précipiter le produit. Recueillir le précipité par filtration en utilisant un entonnoir en verre fritte, puis sécher le précipité dans un dessiccateur sous vide pour obtenir le 2-méthacrylamide lactobionamidoethyl (LAEMA) sous forme de poudre blanc cassé (0,94 g, rendement de 68%). Ce produit est d'une pureté suffisante pour être utilisé dans les réactions suivantes.
2. Synthèse de monomère 2-Gluconamidoethyl méthacrylamide
Note: La préparation de la 2-gluconamidoethyl méthacrylamide (GAEMA), qui ne possède pas un sucre pendentif, a été adapté à partir d'une méthode publiée 15.
- Ajouter 2,0 g de AEMA dissous dans 10 ml de methanol à une solutionde D-gluconolactone (1,6 g) dans 30 ml de methanol et, sous agitation, ajouter lentement 1,6 ml de triéthylamine.
- Agiter le mélange réactionnel à température ambiante pendant 24 h.
- Filtrer le produit précipité à l'aide d'un entonnoir en verre fritté et rincer le précipité trois fois avec 10 ml chacune d'isopropanol, puis laver avec 10 ml d'acétone. Sécher le produit précipité dans un dessiccateur sous vide.
3. RAFT glycopolymère Synthèse
- Pour retirer le MEHQ présent dans N commercial inhibiteur - (2-hydroxyéthyl) acrylamide (HEAA), ajouter 1 ml de HEAA dans un tube de microcentrifugation de 2 ml, puis on ajoute 0,5 g de nanoparticules d'oxyde d'aluminium. Centrifuger le tube à 300 g pendant 30 sec, et d'utiliser la couche supérieure HEAA dans la réaction suivante.
- Ajouter avec précaution 32,8 mg de LAEMA (70,0 pmol), 1,7 mg de AEMA (10,5 pmol) et 27,5 ul de HEAA (270 pmol), le tout dissous dans 0,4 ml de dH 2 O, dans un tube de Schlenk de 1 ml bien nettoyé, ainsi ayant une Monomer rapport molaire de 20: 3: 77.
- Dans une réaction parallèle, afin de produire des polymères de contrôle qui ne possèdent pas de sucre pendentif, au lieu d'utiliser LAEMA à l'étape 3.2, substituer 21,4 mg de GAEMA (70,0 pmol) dans la réaction.
- Pour le tube de Schlenk respective (ie, 3.2 ou 3.3), ajouter successivement 50 ul de DMF contenant 0,53 mg de (acide 4-cyanopentanoïque) -4-dithiobenzoate (1,9 pmol, l'agent RAFT), et 50 pi de DMF contenant 250 ug de 4,4-azobis- (acide 4-cyanovalérique) (0,9 pmol, initiateur). Mélanger délicatement par tapotement des doigts.
- Congeler le contenu contenues dans le tube de Schlenk employant une glace sèche: bain d'éthanol (75 g de glace sèche dans 100 ml d'éthanol), appliquer un vide au sein de 10-50 mTorr, puis fermez le robinet de Schlenk et permettre la solution de décongeler lentement à température ambiante . Répétez ce cycle gel-dégel évacuer deux fois de plus. Veiller à ce que tous les réactifs sont dissous après le dernier dégel.
- Placez le tube de Schlenk dans un ba plastique refermableg, évacuer l'air du sac, puis le sceller. Transférer le sac contenant le tube de Schlenk à un bain d'eau préchauffé à 70 ° C et incuber pendant 24 heures.
- Transférer avec précaution la solution dans le tube de Schlenk dans un sac de dialyse prêt (MWCO = 3,500), et on dialyse contre dH 2 O (2 x 10 L) pendant 24 heures, en changeant la dH 2 O toutes les heures pendant les 8 premières heures. Après dialyse, transférer l'échantillon du tube de dialyse dans un tube à essai, congeler l'échantillon à -80 ° C, puis il lyophiliser.
Remarque: La résultante statistique poly-méthacrylamide / acrylamide (PMA) des copolymères contenant pendentif 4- O -β-D-galactopyranosyl-D-gluconamide (lactobionamide) (de l'étape 3.2) ou D-gluconamide (de l'étape 3.3), respectivement, sont obtenu. Pour la commodité de la discussion, ces deux glycopolymères sont abrégés comme PMA-LAEMA et PMA-GAEMA, respectivement.
4. Post-modification de glycopolymères avec des fluorophores
- Dissoudre 5,0 mg de glycopolymère PMA-LAEMA ou PMA-GAEMA contenant ~ 0,9 umoles de groupes fonctionnels de type amine primaire dans 0,9 ml de solution saline tamponnée au phosphate (PBS, phosphate de sodium 0,1 M, 0,15 M de NaCl, pH 7,5), respectivement.
- Ajouter lentement 0,6 mg d'ester de succinimidyle de carboxyfluorescéine dans 100 pi de DMF à la solution sous agitation rapide. Incorporer délicatement les réactions pendant 16 heures dans l'obscurité à la température ambiante.
- Bien protégé de la lumière, de charger l'échantillon dans un tube de dialyse prêt (MWCO = 3,500) et dialyser contre dH 2 O (2 L) pendant 16 heures, en changeant la solution de dialyse toutes les heures pour les 8 premières heures. Après dialyse, transférer l'échantillon du tube de dialyse dans un tube à essai, congeler l'échantillon à -80 ° C, puis il lyophiliser.
Remarque: la suite de la lyophilisation, glycopolymères fluorescentes PMA-LAEMA-fluorescéine et PMA-GAEMA-fluorescéine, respectivement, sont obtenues.
5. Caractérisation de la Glycopolymères
- Calculer le nombre moyen de poids moléculaire (M n), le poids moléculaire moyen (M w) de poids et la dispersité (Mw / Mn) des glycopolymères sur un système de CLHP commercial équipé d'une Chromatographie par permeation de gel (GPC) logiciel, un GPC colonne convenable pour le poids moléculaire d'intérêt, et un détecteur d'indice de réfraction, en utilisant 0,1 M de tampon Tris / 0,1 M de chlorure de sodium (pH 7) comme éluant à un débit de 0,6 ml / min 14 d'écoulement. Utiliser les normes de polyéthylèneglycol comme étalons de poids moléculaire (PM: 200-1,200,000 g / mol).
- Quantifier les concentrations réelles de groupes fonctionnels amine primaire dans les glycopolymères 16. Analyser la teneur totale en glucides des glycopolymères synthétisés selon une méthode publiée 17.
- Effectuer des essais de composition de structure et la pureté du glycomonomers LAEMA, GAEMA et glycopolymères PMA-LAEMA, PMA-GAEMA dans D 2 O par spectroscopie RMN 14.
6. Les essais de liaison de l'glycopolymères synthétiques avec lectine billes revêtues d'agarose
- Ajouter 1,5 ml de PBS à 50 pi de suspension de Erythrina lectine (ECL) des billes d'agarose revêtues d'crista-galli, centrifuger à 300 g pendant 1 min, et soigneusement enlever et éliminer le surnageant. Répétez cette étape deux fois, puis remettre en suspension les perles dans 0,5 ml de PBS.
- Ajouter 3 pg de PMA-LAEMA-fluorescéine ou PMA-GAEMA-fluorescéine (contrôle négatif) dans 6 pi de PBS à la suspension des perles, et incuber les mélanges, dans l'obscurité, à température ambiante pendant 1 h.
- Laver les mélanges avec 1,5 ml de PBS trois fois et les billes de remettre en suspension dans 0,2 ml de PBS. Chargez une aliquote (4 pi) dans un puits sur une lame immunofluorescence de microscope (revêtement téflon), couvrir avec une lamelle, et d'observer par microscopie de fluorescence à l'aide d'un filtre FITC (excitation longueur d'onde: 467-498 nm, longueur d'émission: 513- 566 nm) et un objectif 10X pour examiner la liaison de til fluorescent glycopolymères avec les billes 14.
Résultats
Synthèse de glycomonomer
L'acide lactobionique a été utilisé ici comme exemple pour la préparation de glycomonomers. En utilisant des méthodes dans le rapport initial sur la synthèse de LAEMA 11, les rendements variés dans la préparation d'une pureté insatisfaisante ont été observés. Le procédé de purification modifié en utilisant des résines échangeuses de cations et d'anions pour éliminer la matière de départ qui n'a pas réagi offert le rendement du produit stable et de haute pureté, ce qui est confirmé par 1 H et 13 spectroscopie RMN C (figure 1).
La synthèse de glycopolymère RAFT et post-modification de glycopolymères avec des fluorophores
A la différence des blocs-glycopolymères préparés par des polymérisations RAFT en gradins, ce protocole de copolymérisation en une seule étape offre une distribution de glycomonomer uniforme tout au long de la chaîne principale du polymère. Les glycopolymères présentés ici contiennent 20% en moles de glycomonomer, 77% en moles de HEAA comme un élément d'espacement, et 3% en moles d'AEMA en tant que cible pour le post-modifications (voir figure 2). 1 H et 13 spectroscopie C-RMN ont confirmé les structures des PMA-LAEMA et PMA-GAEMA (figures 3 et 4). Comme le montre la Figure 5, lorsque comploté contre les profils d'élution de CPG de la glycopolymère synthétisé sans RAFT, deux PMA-LAEMA et PMA-GAEMA ont de faibles dispersités, preuve de l'efficacité de l'approche de RAFT. Comme prévu, PMA-GAEMA a une M n inférieure à celle du PMA-LAEMA en raison de l'absence de PMA-GAEMA d'un sucre suspension. L'analyse des hydrates de carbone et des groupes fonctionnels de type amine primaire contenu des glycopolymères RAFT a révélé que le rapport des monomères dans les glycopolymères sur les produits est en accord avec le rapport stoechiométrique de départ monomères mis en oeuvre dans la réaction de polymérisation RAFT médiation (tableau 1). Cela signifie un contrôle serré de la compositio de monomèrens dans les glycopolymères synthétisés, comme prévu.
La réaction de groupes fonctionnels amine primaire avec des fluorophores activés est une technique largement utilisée dans l'étiquetage de protéine. Cette technique a été utilisée ici pour identifier les glycopolymères purifiés avec carboxyfluorescéine. Après post-modification, polymères fluorescents ont été obtenues (figure 6). Aucune dégradation des polymères marquées à la fluorescéine dans la réaction a été détectée par analyse par GPC (données non présentées).
Reliure tests des glycopolymères synthétiques avec des perles d'agarose lectine-enduit
Pour évaluer la spécificité de la lectine de liaison des glycopolymères synthétisées, des billes d'agarose lectine couché avec la spécificité de liaison de glucides connue a été utilisé. Erythrina lectine de crista-galli (ECL), utilisé dans les expériences, a une spécificité de liaison vers β-D-galactoside. Figure 7A montre clairement que PMA-LAEMA-Flfluorescéine, qui contient des β-D-galactoside en tant que suspension d'hydrate de carbone, présente une forte liaison à la lectine ECL. En revanche, la liaison à la ECL du glycopolymère PMA-GAEMA-fluorescéine, qui ne possède pas un sucre suspension négative, est représentée sur la figure 7B. Ce résultat illustre l'efficacité de liaison et l'affinité de l'glycopolymère fluorescente synthétisé.
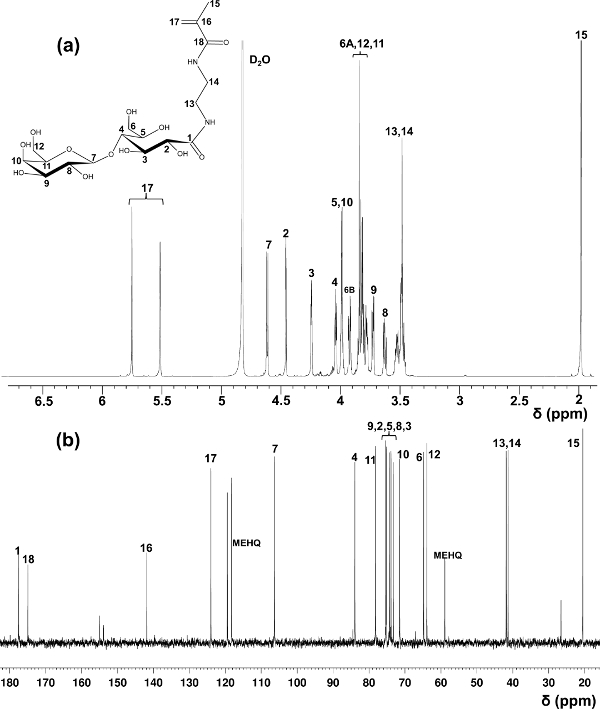
Figure 1. Assigné 1 H- (a) et 13 C-RMN (b) spectres (D 2 O) pour LAEMA. (Ce chiffre a été modifié depuis Wang et al. 14) S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
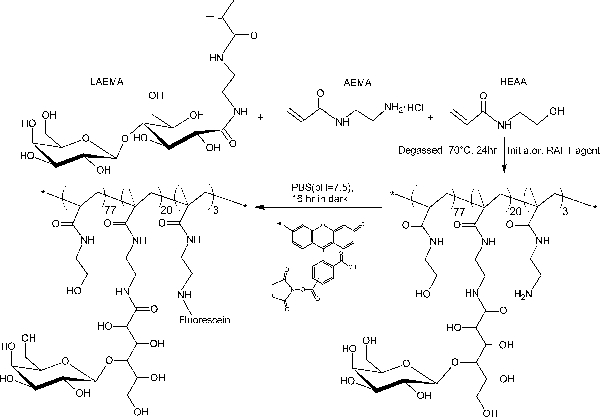
Figure 2. Représentation schématique de la synthèse de glycopolymère fluorescente PMA-LAEMA contenant β-galactoside que le sucre de pendentif. S'il vous plaît, cliquez ici pour voir une version plus grande de cette figure.
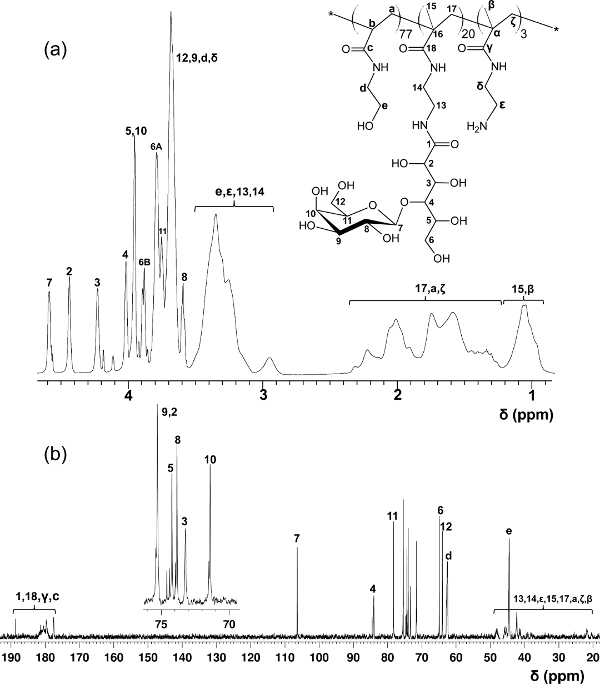
Figure 3. Assigné 1 H- (A) et 13 C-RMN (B) spectres (D 2 O) pour PMA-LAEMA glycopolymère. (Ce chiffre a été modifié depuis Wang et al. 14) PlaidoyerSE Cliquez ici pour voir une version plus grande de cette figure.
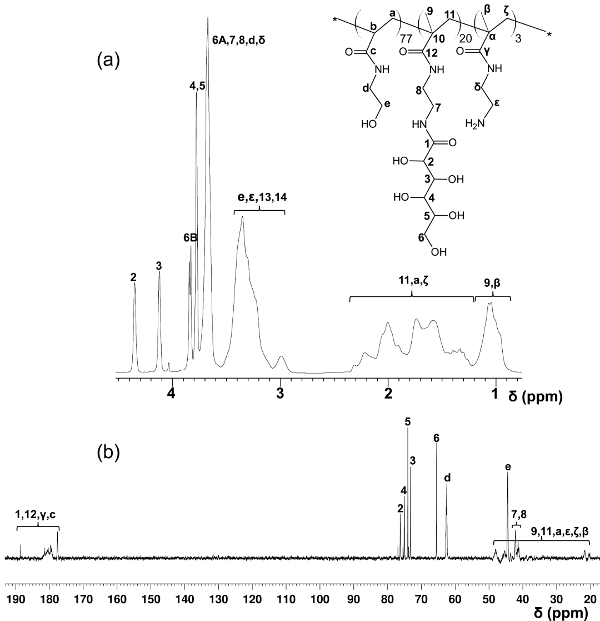
Figure 4. Assigné 1 H- (A) et 13 C-RMN (B) spectres (D 2 O) pour PMA-GAEMA. (Ce chiffre a été modifié depuis Wang et al. 14) S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
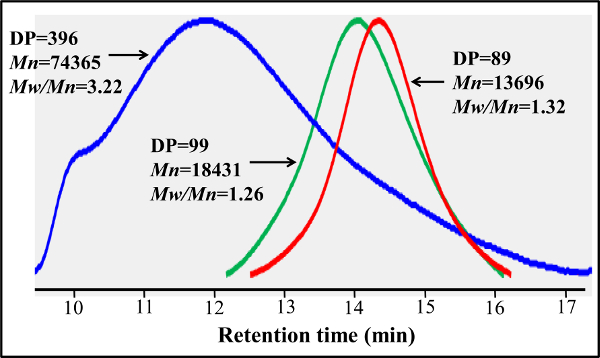
Figure 5. Gel traces de chromatographie de perméation de base-RAFT PMA-GAEMA et PMA-LAEMA préparés avec et sans l'aide de l'agent RAFT. Contrairement à la PMA-LAEMA préparé sans agent de RAFT (bleu), RAFT- PMA-LAEMA basé (vert) a une dispersité beaucoup plus faible (M w / M n). Base-RAFT PMA-GAEMA (rouge) et PMA-LAEMA avoir des profils similaires GPC, mais l'ancien a une plus petite M n raison de l'absence de sucres pendants. S'il vous plaît, cliquez ici pour voir une version plus grande de cette figure.

Figure 6. PMA-LAEMA avant et après post-modification avec fluorophore. (A) Par rapport à blanc glycopolymère non marqué (tube de gauche), marqué à la fluorescéine PMA-LAEMA montre une forte coloration jaune (tube à droite). (B) sous UV, non marqué PMA-LAEMA (tube de gauche, 1 mg / ml dans PBS) est sombre et présente avec aucune fluorescence, alors que PMA-LAEMA marqué à la fluorescéine (tube de droite, 1 mg / ml dans PBS) spectacles forte fluorescence verte.: //www.jove.com/files/ftp_upload/52922/52922fig4large.jpg "Target =" _ blank "> S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
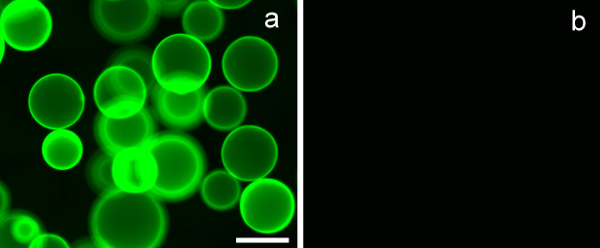
Figure 7. Erythrina crista-galli lectine (ECL) perles revêtues d'agarose lient β-D-galactoside contenant glycopolymères, et non pas ceux ne possédant pas un sucre pendentif. (A) PMA-LAEMA-fluorescéine (3 pg) ont montré une forte liaison avec ECL , alors que dans (B) PMA-GAEMA-fluorescéine, qui ne possède aucun résidu suspensions β-D-galactoside, a montré aucune liaison avec les perles de lectine-enduit. Barre d'échelle = 100 um.
Tableau 1. Valeurs ciblant un des paramètres de synthèse et des compositions réelles des glycopolymères. A) Ciblage des valeurs, quion souhaite des produits; b) DP, degré de polymérisation; c) NA, pas disponible. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
| DP b | Dispersité | Contenu réel de glycomonomers mol% | Contenu réel d'amine primaire mol% | |
| Ciblage des valeurs | 100 | <1,3 | 20 | 3 |
| PMA-LAEMA | 99 | 1.26 | 19 | 3.2 |
| PMA-GAEMA | 89 | 1.32 | NA c | 2.7 |
Discussion
Un protocole facile et efficace pour glycopolymères fluorescentes à base de RAFT tri-composant, avec et sans un glucide pendentif, et leur utilisation dans un test de lectine de liaison, est démontré dans ce rapport. Le protocole commence avec la préparation de glycomonomers LAEMA et GAEMA. Grâce à un RAFT contrôlée copolymérisation en une étape, avec un rendement reproductible glycopolymères, la composition de monomères et prévisible faible dispersité, sont obtenus. Après post-modification de glycopolymères avec ester carboxyfluorescéine succinimidyl, la liaison de l'glycopolymère marqué par fluorescence respective résultant est facilement vérifiable pour sa spécificité de la lectine de liaison.
Dans les étapes de préparation initiale des glycomonomers qui doivent être utilisés dans les synthèses ultérieures de glycopolymère, l'acide lactobionique facilement disponibles et ont été utilisés gluconolactone. En théorie, tous les glucides de l'intérêt, de monosaccharides à oligosaccharides complexes, peuvent être converted pour glycomonomers en conjuguant le sucre cible sur le groupe hydroxyle primaire en C6 de glucose. À la suite de l'oxydation du résidu de la réduction du glucose, et sa déshydratation subséquente à une lactone, le produit peut ensuite être facilement mis à réagir avec l'aminé primaire sur AEMA pour former le glycomonomer correspondant. D'autres exemples de cette route peut être vu dans un récent rapport 14. Il convient de noter que, avant d'entreprendre toute étape de polymérisation, MEHQ, un inhibiteur de polymérisation efficace, doit être retiré de toutes les préparations de monomères et glycomonomer juste avant l'utilisation. Cela est aisément réalisé en utilisant le minimum de méthanol pour dissoudre le glycomonomer qui possède MEHQ puis traiter immédiatement avec de l'acétone à -20 ° C pour précipiter le produit exempt d'inhibiteur avec un rendement élevé.
Essentiel dans tout régime de polymérisation radicalaire, attention au détail et des puretés monomères sont mis en évidence. Comme il est typique d'un système de polymérisation RAFT, il consiste àune source de radicaux, un agent de RAFT, un monomère et de solvant. Dans cette présentation visualisées, un système de polymérisation RAFT en une seule étape est décrite qui met l'accent sur la production de copolymères statistiques générées à partir d'un mélange réactionnel possédant trois monomères différents dans une solution aqueuse. Deux réactions de RAFT médiée par différents sont présentés dans lequel une glycomonomer utilise une suspension qui possède une, extrémité non réductrice d'hydrate de carbone (par exemple, β-D-galactose), et l'autre, possédant un polyol sans résidu hydrate de carbone lié. Commun aux deux réactions à médiation étaient RAFT des monomères possédant un groupe hydroxyle unique qui sert de molécule d'espacement, et un autre possédant une amine libre de post-modification avec un fluorophore amino-réactif.
Puisque la présence d'oxygène dans le mélange de réaction et de l'environnement est préjudiciable à la polymérisation RAFT médiation, son retrait de retracer les niveaux est facilement réalisée via plusieurs épisodes de gel-evaCuate-dégel cycles tout en maintenant le récipient de réaction en tube de Schlenk sous vide poussé.
Il convient de noter que le rapport molaire de monomères différents dans la réaction peut être ajustée selon les besoins. En outre, en faisant varier la quantité d'agent RAFT utilisé, la longueur des polymères obtenus peut être contrôlée 18. Cependant, le rapport molaire de l'agent de RAFT à l'initiateur doit toujours être supérieure à deux pour assurer la faible polydispersité du produit. Dans ces conditions, l'évolution de la copolymérisation est stable, et la reproductibilité de la réaction est très élevée. Cela étant dit, il est peu probable que l'on obtient une répartition totalement uniforme de tous les monomères participant à l'intérieur d'un copolymère statistique, en raison de leur vitesse de polymérisation différents. La caractérisation de la distribution des différents monomères dans le polymère est encore très difficile.
Le procédé de post-modification, présentée ici, est à la fois plus simple et plus amenable à l'utilisation d'un plus grand choix de marqueurs fluorescents, par rapport à d'autres protocoles appliqués aux glycopolymères d'étiquettes 2,11. Celles-ci comprennent la plupart des fluorophores réagissant avec les amines solubles dans l'eau, les points quantiques, biotine, et autres. Les spécificités de liaison des glycopolymères, marqués synthétisés sont facilement vérifiables utilisent lectines avec les affinités de liaison connus. PMA-GAEMA possédant pas de sucre pendentif est un contrôle négatif approprié. Glycopolymères avec différentes étiquettes fluorescentes préparés par cette voie ont été utilisés avec succès dans les enquêtes de la lectine à médiation bactérienne liaison 14. Comme présenté, cette préparation facile et efficace de glycopolymères fluorescentes statistiques devrait fournir un grand potentiel pour une grande variété de la recherche glycobiological.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
This work was supported by the Experiment Station Chemical Laboratories of the University of Missouri, and by the Cystic Fibrosis Association of Missouri.
matériels
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| Lactobionic acid | Sigma-Aldrich | 153516 | |
| D-Gluconolactone | Sigma-Aldrich | G2164 | |
| N-(2-hydroxyethyl) acrylamide (HEAA) | Sigma-Aldrich | 697931 | |
| Orange II sodium salt | Sigma-Aldrich | O8126 | |
| Hydroquinone monomethyl ether (MEHQ) | Sigma-Aldrich | 54050 | Polymerization inhibitor |
| N-(2-aminoethyl) methacrylamide hydrochloride (AEMA) | Polysciences, Inc | 24833-5 | |
| Triethylamine | Fisher Scientific | BP-616 | |
| Anion-exchange resin IRN-78 hydroxide-form, 80 mesh | Sigma-Aldrich | 10343-U | |
| Cation-exchange resin 50Wx8, 200 mesh | Sigma-Aldrich | 217514 | |
| Aluminum oxide, ~150 mesh | Sigma-Aldrich | A1522 | Type WN-6, Neutral, Activity Grade Super I |
| Ninhydrin | Sigma-Aldrich | N4876 | An ethanol solution of 0.2% ninhydrin was used in the test |
| 4-Cyano-4-(phenylcarbonothioylthio)pentanoic acid | Sigma-Aldrich | 722995 | RAFT agent |
| 4,4′-Azobis(4-cyanovaleric acid) | Sigma-Aldrich | 11588 | Polymerization initiator |
| Carboxyfluorescein succinimidyl ester | Life Technologies | C1157 | |
| Erythrina Cristagalli lectin coated agarose bead | Vector Laboratories | AL-1143 | |
| Solvent | |||
| dH2O | Produced by Barnstead water purification system, 18 megOhm-cm | ||
| Isopropanol | Fisher Scientific | A461-4 | ACS grade or better |
| Methanol | Fisher Scientific | A454-4 | ACS grade or better |
| Absolute ethanol | Fisher Scientific | BP2818-100 | ACS grade or better |
| Dimethylformamide | Sigma-Aldrich | 22705 | ACS grade or better |
| Acetone | Fisher Scientific | A929-4 | ACS grade or better |
| Equipment | |||
| Dialysis membrane (MWCO: 3,500) | Spectrum Labs | 132720 | |
| Polyethylene glycol analytical standard standard | Sigma-Aldrich | O2393 | |
| Schlenk tube, 1 ml | Quark Glass | Customized | |
| TSK-GEL G4000 PWxl | Tosoh Bioscience | 8022 | Used for GPC analysis of the glycopolymers |
| Empower 3 with GPC/SEC package | Waters Corporation | ||
| Waters Alliance HPLC system | Waters Corporation | Equipped with refractive index detector (Waters 2414) and fluorescence detector (Waters 2475) | |
| Avance III 800 MHz NMR Spectrometer | Bruker Corporation | ||
| BX43 fluorescence microscope | Olympus Corporation | Used with FITC filter in the glycopolymer binding test | |
| Rotavap / Rotoevaporator | Heidolph | ||
| Fritted disc funnel | Fisher Scientific | 10-310-109 | |
| Lyophilizer | Labconco | ||
| Immunofluorescence microscope slide | Polysciences | 18357-1 | |
| Revco Ultima Plus -80 °C Freezer | Thermo Scientific | ||
| Plastic Vacuum Bag and Hand Pump | Ziploc | ||
| Vacuum Pump, Direct Drive, Maxima C Plus | Fisher Scientific | ||
| Vacuum Gauge | Sargent-Welch | ||
Références
- Scharfman, A., et al. Pseudomonas aeruginosa binds to neoglycoconjugates bearing mucin carbohydrate determinants and predominantly to sialyl-Lewis x conjugates. Glycobiology. 9 (8), 757-764 (1999).
- Song, E. H., et al. In vivo targeting of alveolar macrophages via RAFT-based glycopolymers. Biomaterials. 33 (28), 6889-6897 (2012).
- Wolfenden, M. L., Cloninger, M. J., Wang, B., Boons, G. .. -. J. Chapter 14. Multivalency in carbohydrate binding. Carbohydrate Recognition: Biological Problems, Methods, and Applications. , 349-370 (2011).
- Moad, G., Rizzardo, E., Thang, S. H. Radical addition-fragmentation chemistry in polymer synthesis. Polymer. 49 (5), 1079-1131 (2007).
- Spain, S. G., Gibson, M. I., Cameron, N. R. Recent advances in the synthesis of well-defined glycopolymers. J. Polym. Sci., Part A: Polym. Chem. 45 (11), 2059-2072 (2007).
- Bernard, J., Hao, X., Davis, T. P., Barner-Kowollik, C., Stenzel, M. H. Synthesis of various glycopolymer architectures via RAFT polymerization: From block copolymers to stars. Biomacromolecules. 7 (1), 232-238 (2006).
- Bulmus, V. RAFT polymerization mediated bioconjugation strategies. Polym. Chem. 2, 1463-1472 (2011).
- Ting, S. R. S., Chen, G., Stenzel, M. H. Synthesis of glycopolymers and their multivalent recognitions with lectins. Polymer Chemistry. 1, 1392-1412 (2010).
- Vazquez-Dorbatt, V., Lee, J., Lin, E. W., Maynard, H. D. Synthesis of glycopolymers by controlled radical polymerization techniques and their applications. Chembiochem. 13, 2478-2487 (2012).
- Jiang, X., Ahmed, M., Deng, Z., Narain, R. Biotinylated glyco-functionalized quantum dots: Synthesis, characterization, and cytotoxicity studies. Bioconjugate Chem. 20 (5), 994-1001 (2009).
- Deng, Z., Li, S., Jiang, X., Narain, R. Well-defined galactose-containing multi-functional copolymers and glyconanoparticles for biomolecular recognition processes. Macromolecules. 42 (17), 6393-6405 (2009).
- Qin, Z., et al. Galactosylated N-2-hydroxypropyl methacrylamide-b-N-3-guanidinopropyl methacrylamide block copolymers as hepatocyte-targeting gene carriers. Bioconjugate Chem. 22 (8), 1503-1512 (2011).
- Albertin, L., Wolnik, A., Ghadban, A., Dubreuil, F. Aqueous RAFT polymerization of N-acryloylmorpholine, synthesis of an ABA triblock glycopolymer and study of its self-association behavior. Macromol. Chem. Phys. 213 (17), 1768-1782 (2012).
- Wang, W., Chance, D. L., Mossine, V. V., Mawhinney, T. P. RAFT-based tri-component fluorescent glycopolymers: synthesis, characterization and application in lectin-mediated bacterial binding study. Glycoconj. J. 31 (2), 133-143 (2014).
- Deng, Z., Ahmed, M., Narain, R. Novel well-defined glycopolymers synthesized via the reversible addition fragmentation chain transfer process in aqueous media. J. Polymer Sci. Part A: Polym. Chem. 47 (2), 614-627 (2009).
- Noel, S., Liberelle, B., Robitaille, L., De Crescenzo, G. Quantification of primary amine groups available for subsequent biofunctionalization of polymer surfaces. Bioconjugate Chem. 22 (8), 1690-1699 (2011).
- Fox, A., Morgan, S. L., Gilbart, J., Biermann, C. J., McGinnis, G. D. Preparation of alditol acetates and their analysis by gas chromatography (GC) and mass spectrometry (MS). Analysis of Carbohydrates by GLC and MS. , 87-170 (1989).
- Thomas, D. B., et al. Kinetics and molecular weight control of the polymerization of acrylamide via RAFT. Macromolecules. 37 (24), 8941-8950 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon