Method Article
Leichte und effiziente Herstellung von Tri-Komponente Fluorescent Glycopolymere über RAFT-kontrollierte Polymerisation
In diesem Artikel
Zusammenfassung
An efficient, three-step synthesis of RAFT-based fluorescent glycopolymers, consisting of glycomonomer preparation, copolymerization, and post-modification, is demonstrated. This protocol can be used to prepare RAFT-based statistical glycopolymers with desired structures.
Zusammenfassung
Synthetische Glycopolymere sind instrumental und vielseitige Werkzeuge in verschiedene biochemische und biomedizinische Forschung Bereichen eingesetzt. Ein Beispiel für eine einfache und effiziente Synthese von gut kontrollierten Fluoreszenz statistischen Glycopolymeren Verwendung reversible Additions-Fragmentierungs-Kettentransfer (RAFT) basierende Polymerisation wird demonstriert. Die Synthese beginnt mit der Herstellung von β-Galactose enthaltenden glycomonomer 2-lactobionamidoethyl Methacrylamid durch Reaktion Lactobionolacton und N erhalten - (2-Aminoethyl) -methacrylamid (AEMA). 2-Gluconamidoethyl methacrylamid (GAEMA) als strukturelles Analogon fehlt eine terminale β-galactosid verwendet wird. Die folgende RAFT-vermittelte Copolymerisationsreaktion umfasst drei verschiedene Monomere: N - (2-hydroxyethyl) acrylamid als Spacer, AEMA als Target zur weiteren Fluoreszenzmarkierung und die glycomonomers. Tolerant gegenüber wässrigen Systemen ist der RAFT-Mittels in der Reaktion (4-cyanopentansäure) -4-dithiobenzoat.Low Dispersitäten (≤1.32), berechenbar Copolymerzusammensetzungen und eine hohe Reproduzierbarkeit der Polymerisationen wurden unter den Produkten beobachtet. Fluoreszierende Polymere werden durch Modifizierung der Glycopolymere mit Carboxyfluorescein Succinimidylester gezielt die primären Aminfunktionen auf AEMA erhalten. Lektin-Bindungsspezifitäten der resultierenden Glycopolymere werden durch Tests mit entsprechenden Agarose-Kügelchen mit spezifischen glycoepitope Erkennen Lektine beschichtet verifiziert. Wegen der Leichtigkeit der Synthese, die strenge Kontrolle der Produktzusammensetzungen und die gute Reproduzierbarkeit der Reaktion, dieses Protokoll zur Herstellung von anderen RAFT-basierten Glycopolymeren mit spezifischen Strukturen und Zusammensetzungen umgesetzt werden, wie gewünscht.
Einleitung
In den vergangenen zwei Jahrzehnten haben Untersuchungen mit synthetischen Glycopolymere langsame, aber kontinuierliche Entwicklung durchgemacht, was zeigt, erhebliches Potenzial bei der Prüfung der Infektionsmechanismen, die Forschung, die auf Lektin-Erkennung verarbeitet 1-3 konzentriert sind. Da synthetische Glycopolymere besitzen mehrwertige Zuckereinheiten weisen wesentlich höhere Wirkungsgrade Lektin-Bindung im Vergleich zu monovalenten Kohlenhydraten, sind sie von der großen Nachfrage in der glycobiology Feld 3. Von besonderem Interesse in der klinischen Forschung ist die Verwendung von fluoreszierenden Glycopolymeren um das Lectin-vermittelte bakterielle Bindung mit Kohlenhydraten auf menschlichen Atemzelloberflächen und Schleimhäuten Glykoprotein vorhanden charakterisieren. Früh in-vitro-Studien eingesetzten handelsüblichen Polyacrylamidbasis Glycopolymere in Bakterienbindungstests. Mehrere dieser Proben zeigten vielversprechende Ergebnisse, aber Bedenken in Bezug auf, Zugänglichkeit, und viel zu viele Abweichungen sowohl polYmer Molekulargewicht und glycoepitope Inhalt. Eine wirtschaftliche in-Laborprotokoll entwickelt, das für eine zufriedenstellende Kontrolle der Strukturgehalt, der Größe und Reinheit des synthetischen Glycopolymeren Targeting bakteriellen Lektine bieten würde.
Auf der Suche nach einem geeigneten synthetischen Ansatz Glycopolymere, wurde eine relativ neue Polymerisationstechnik mit einer Art kontrollierte radikalische Polymerisation, die reversible Additions-Fragmentierungs-Kettentransfer (RAFT) Mittel 4 eingesetzt getestet. Solche RAFT-Reagenzien wurden vor kurzem in ein paar Glykopolymer Vorbereitungen 5-7 verwendet. Verglichen mit anderen Glykopolymer Herstellvorschriften, RAFT-vermittelte Polymerisationen zeigen mehrere Vorteile, einschließlich der Toleranz gegenüber einer Vielzahl von Monomerstrukturen und den Reaktionsbedingungen mögliche Kompatibilitäts mit wässrigen Lösungen und geringe Größe Dispersität der gewünschten Polymerprodukte 8,9. Von besonderem Interesse sind Protokolle für die Herstellung von RAFT-baSED trikomponentige Glycopolymeren und ermöglicht die Steuerung von Zusammensetzungen aus verschiedenen Monomeren, die jeweils unterschiedliche Funktionen 10-13 aufweisen. Allerdings sind die meisten der bisherigen Forschungsbemühungen entweder fehlten anomere Anhänger Kohlenhydrate 10 oder eingesetzt gestuften Polymerisationen was Triblockcopolymere, die aus kovalent verknüpften Homopolymere, die oft unterschiedlichen Zwecken dienen als statistischen Polymeren, die Copolymere sind, bestehen, in dem die Reihenfolge der Monomerzugabe Rückstände folgen eine statistische Regel 9-13.
Kurzem Einsatz der RAFT Thiocarbonylthio-Verbindung (4-cyanopentansäure) -4-dithiobenzoat in einer wässrigen Umgebung, die Herstellung einer Gruppe von RAFT-basierte lineare trikomponentige statistischen Glycopolymeren die bestimmte Pendel Zuckern und deren Anwendung in der Lectin-vermittelte bakterielle Bindungs Tests wurden 14 gemeldet. Das übergeordnete Ziel dieses Verfahrens, in eine visuelle Art und Weise präsentiert, ist die Dreikomponenten-Vorbereitungstatistische Fluoreszenz Glycopolymere über RAFT-Copolymerisation gesteuert. Wegen der Leichtigkeit der einstufigen Polymerisation Protokoll das feine Kontrolle über die Polymerlänge und Zusammensetzungen, und die hohe Reproduzierbarkeit der Reaktion, dieses Protokoll kann leicht auf andere RAFT-basierten Synthesen Glycopolymeren mit gewünschten Strukturen angewendet werden.
Protokoll
1. Synthese von 2-Glycomonomer Lactobionamidoethyl Methacrylamide
- Man löst 2 g Lactobionsäure in 3,0 ml wasserfreiem Methanol und langsam absolutem Ethanol in einer tropfenweise Mode, bis die Lösung gerade trüb, dann entfernen Sie die Lösungsmittel durch Rotationsverdampfung.
- Der Rückstand aus Schritt 1.1, in 3,0 ml wasserfreiem Methanol und erneut langsam absolutem Ethanol bis kurz bewölkt, dann verdunsten die Lösungsmittel durch Rotationsverdampfung. Wiederholen Sie diesen Schritt 3 mal zu Lactobiono-1,5-lacton (1,94 g, 98% Ausbeute) zu erhalten. Dieses Produkt ist von ausreichender Reinheit, um in den folgenden Reaktionen eingesetzt werden.
- Hinzuzufügen 1,0 g Lactobionolacton in 3,0 ml Methanol zu N - (2-Aminoethyl) -methacrylamid (AEMA, 0,58 g) und Hydrochinon (MEHQ, 1,0 mg), ein Inhibitor der Autopolymerisation, in 2,0 ml Methanol, gefolgt 1,0 ml Triethylamin gegeben. Es wird bei RT für 48 Stunden.
- In 20 ml VE-H 2 O (dH 2 O) in den Reaktionskolben, entfernen Sie dann das Methanol und kostenlos Triethylamin durch Verdunstung über Rotationsverdampfung zur Trockne ein.
- , Um alle verbleibenden Lactobionsäure entfernen, 20 ml dH 2 O, dann passieren die wässrige Lösung über eine Anionenaustauschersäule (OH - Form, 10 mm x 20 mm) in einen Aufnahmebecherglas mit 1,0 mg MEHQ.
- Triethylamin zu entfernen, wird in Schritt 1.5 hergestellten, durch Verdampfen über Rotationsverdampfung zur Trockne konzentriert.
- 20 ml dH 2 O und nicht reagiertes AEMA durch langsame Zugabe von 1 mg Aliquots von Kationenaustauschharz (H + -Form), bis keine Ninhydrin-reaktiven Materialien sind nachweisbar. Überwachung der Entfernung, indem 1 & mgr; l-Aliquots der Lösung, nachdem jedes Harz hinaus Anwendung auf einer Dünnschichtchromatographie Platte, dann Besprühen der Platte mit einer 2% Ninhydrin in Ethanol-Lösung. Wenn keine dunkelblaue Farbe beobachtet zu entwickeln, wenn die Platte auf 90 ° C für 1 min erwärmt wurde der Endpunkt erreicht ist.
- Die Lösung wird über eine Glasfritte, übertragen das Filtrat in ein Reagenzglas, frieren die Probe bei -80 ° C, und dann lyophilisiert.
- Entfernen MEHQ aus der Probe durch Auflösen des gefriergetrockneten Materials in einer minimalen Menge Methanol (~ 0,5 ml) und dann mit kaltem wasserfreiem Aceton (-20 ° C, 15 ml) wurde das Produkt auszufallen. Der Niederschlag wird durch Filtration unter Verwendung eines Glasfrittentrichter, dann Trocknen des Niederschlags in einem Exsikkator unter Vakuum zu 2-lactobionamidoethyl methacrylamid (LAEMA) als ein gebrochen weißes Pulver (0,94 g, 68% Ausbeute) zu erhalten. Dieses Produkt ist von ausreichender Reinheit, um in den folgenden Reaktionen eingesetzt werden.
2. Synthese von Monomer 2-Methacrylamid Gluconamidoethyl
Anmerkung: Die Herstellung von 2-gluconamidoethyl methacrylamid (GAEMA), die nicht einen Anhänger Zucker nicht besitzt, wurde aus einer publizierten Methode 15 angepasst.
- Es werden 2,0 g AEMA in 10 ml Methanol gelöst, um eine Lösungaus D-Gluconolacton (1,6 g) in 30 ml Methanol gelöst und unter Rühren langsam mit 1.6 ml Triethylamin versetzt.
- Die Reaktion wird bei Raumtemperatur für 24 Stunden.
- Filtern des ausgefällten Produkts unter Verwendung einer Glasfritte und spülen Sie den Niederschlag dreimal mit je 10 ml Isopropanol und dann mit 10 ml trockenem Aceton waschen. Man trocknet die ausgefallene Produkt in einem Exsikkator unter Vakuum.
3. RAFT Glycopolymer Synthesis
- Um den Inhibitor MEHQ in kommerziellen N vorhanden entfernen - (2-Hydroxyethyl) Acrylamid (HEAA), 1 ml HEAA zu einem 2 ml Mikrozentrifugenröhrchen, gefolgt von der Zugabe von 0,5 g Aluminiumoxid-Nanopartikeln. Zentrifugieren Sie die Röhrchen bei 300 xg für 30 Sekunden, und verwenden Sie die obere Schicht HEAA in der folgenden Reaktion.
- Vorsichtig werden 32,8 mg LAEMA (70,0 umol), 1,7 mg AEMA (10,5 umol) und 27,5 ul HEAA (270 umol), die alle in 0,4 ml dH 2 O gelöst, auf eine gut gereinigte 1 ml Schlenkrohr, wodurch mit einer monomER-Molverhältnis von 20: 3: 77.
- In einer parallelen Reaktion, um die Kontrolle zu Polymeren, die keine Anhänger Zucker besitzen, statt der Verwendung LAEMA in Schritt 3.2 zu produzieren, zu ersetzen 21,4 mg GAEMA (70,0 umol) in der Reaktion.
- An den jeweiligen Schlenkrohr (dh 3,2 oder 3,3), sequentiell hinzuzufügen 50 ul DMF, enthaltend 0,53 mg (4-cyanopentansäure) -4-dithiobenzoat (1,9 umol, RAFT Mittel) und 50 ul DMF, enthaltend 250 ug 4,4'-Azobis- (4-cyanovaleriansäure) (0,9 & mgr; mol, Initiator). Vorsichtig mischen durch Finger Klopfen.
- Frieren Sie den Inhalt in den Schlenk-Rohr enthielt Verwendung eines Trockeneis: Ethanol-Bad (75 g Trockeneis in 100 ml Ethanol), gelten ein Vakuum innerhalb von 10-50 mTorr, schließen Sie das Ventil Schlenk und erlauben die Lösung langsam auf RT auftauen . Wiederholen Sie diesen gefrier evacuate-Tau-Zyklus zweimal. Stellen Sie sicher, dass alle Reagenzien sind nach dem letzten Schneeschmelze aufgelöst.
- Legen Sie das Schlenk-Rohr in einen verschließbaren Plastik bag, evakuieren die Tasche der Luft, und dann verschließen Sie diese. Übertragen Sie den Beutel mit der Schlenkrohr auf einem Wasserbad bei 70 ° C vorgewärmt und Inkubation für 24 Stunden.
- Die Lösung in dem Schlenk-Rohr vorsichtig in eine vorbereitete Dialyseschlauch (MWCO = 3.500) und Dialyse gegen dH 2 O (10 x 2 L) für 24 Stunden, die Änderung der dH 2 O pro Stunde für die ersten 8 Std. Nach der Dialyse Übertragung der Probe aus dem Dialyseschlauch wird in ein Teströhrchen, frieren die Probe bei -80 ° C und anschließend gefriertrocknen.
Anmerkung: Das resultierende statistische Poly-Methacrylamid / Acrylamid (PMA) Copolymeren, die anhängende 4- O -β-D-galactopyranosyl-D-gluconamid (Lactobionamid) (aus Stufe 3.2) oder D-gluconamid (aus Stufe 3.3) sind jeweils erhalten. Zur Vereinfachung der Diskussion werden diese beiden Glycopolymeren als PMA-LAEMA und PMA-GAEMA jeweils abgekürzt.
4. Post-Modifikation Glycopolymere mit Fluorophore
- Man löst 5,0 mg Glykopolymer PMA-LAEMA oder PMA-GAEMA enthaltenden ~ 0,9 umol funktionelle primäre Amingruppen in 0,9 ml phosphatgepufferter Salzlösung (PBS, 0,1 M Natriumphosphat, 0,15 M NaCl, pH 7,5) auf.
- Werden langsam 0,6 mg Carboxyfluorescein-succinimidylester in 100 ul DMF zu den Lösungen unter schnellem Rühren. Rühren Sie leicht die Reaktionen für 16 Stunden im Dunkeln bei RT.
- Während vor Licht geschützt, laden Sie die Probe in eine vorbereitete Dialyseschlauch (MWCO = 3.500) und Dialyse gegen dH 2 O (2 l) für 16 Stunden, die Änderung der Dialyselösung pro Stunde für die ersten 8 Std. Nach der Dialyse Übertragung der Probe aus dem Dialyseschlauch wird in ein Teströhrchen, frieren die Probe bei -80 ° C und anschließend gefriertrocknen.
Anmerkung: Nach dem Lyophilisieren Fluoreszenz Glycopolymeren PMA-LAEMA-Fluorescein und PMA-GAEMA-Fluorescein bzw. erhalten werden.
5. Charakterisierung des GlyCopolymere
- Bestimmung der zahlenmittleren Molmasse (M n), das gewichtsmittlere Molekulargewicht (M w) und die Dispersität (Mw / Mn) der Glycopolymeren auf kommerzieller HPLC-System mit Gelpermeationschromatographie (GPC) Software, ein GPC ausgestattete Kolonne für das Molekulargewicht von Interesse und einem Brechungsindexdetektor, unter Verwendung von 0,1 M Tris / 0,1 M Natriumchloridpuffer (pH 7) als Laufmittel bei einer Flussrate von 0,6 ml / min 14. Verwenden Sie Polyethylenglykol-Standards als Molekulargewichtsstandards (MW: 200-1,200,000 g / mol).
- Quantifizierung der tatsächlichen Konzentrationen von primären Aminfunktionen in den Glycopolymeren 16. Analysieren Sie den Gesamtkohlenhydratgehalts der synthetisierten Glycopolymere nach einem veröffentlichten Verfahren 17.
- Führen Sie die Tests der strukturellen Zusammensetzung und Reinheit des glycomonomers LAEMA, GAEMA und Glycopolymere PMA-LAEMA, PMA-GAEMA in D 2 O durch NMR-Spektroskopie 14.
6. Bindungstests der Synthetic Glycopolymere mit Lektin beschichteten Agarosekügelchen
- In 1,5 ml PBS zu 50 ul Suspension von Erythrina crista-galli Lektin (ECL) beschichteten Agarosekügelchen, Zentrifuge bei 300 · g für 1 min, und entfernen Sie vorsichtig und entsorgen Sie den Überstand. Wiederholen Sie diesen Schritt zweimal, und dann Resuspendieren der Kügelchen in 0,5 ml PBS.
- Hinzuzufügen 3 ug PMA-LAEMA-Fluorescein oder PMA-GAEMA-Fluorescein (Negativkontrolle) in 6 & mgr; l PBS zu den Kügelchen enthaltenden Suspension, und Inkubation der Mischungen im Dunkeln bei Raumtemperatur für 1 Std.
- In 0,2 ml PBS waschen die Mischungen mit 1,5 ml PBS dreimal und Resuspension Perlen. Laden Sie eine Teilmenge (4 ul) in eine gut auf einem Immunfluoreszenz Mikroskop-Objektträger (Teflon-beschichtet), Deckel mit einem Deckglas, und beobachten durch Fluoreszenzmikroskopie unter Verwendung eines FITC-Filter (Anregungswellenlänge: 467-498 nm, Emissionswellenlänge: 513- 566 nm) und einem 10X-Objektiv zu prüfen, die die Bindung von ter fluoreszierend Glycopolymere mit den Kügelchen 14.
Ergebnisse
Synthese von glycomonomer
Lactobionsäure wurde hier als ein Beispiel für die Herstellung von glycomonomers verwendet. Mit Methoden im ersten Bericht über die Synthese von LAEMA 11 wurden variiert Ausbeuten bei der Herstellung mit unbefriedigende Reinheit beobachtet. Das modifizierte Reinigungsverfahren mit Kationen- und Anionenaustauscherharzen auf umgesetztes Ausgangsmaterial angeboten stabiles Produkt Ausbeute und hoher Reinheit, das durch 1 H und 13 C-NMR-Spektroskopie (Figur 1) bestätigt wird, zu entfernen.
RAFT Glykopolymer Synthese und nach der Modifikation der Glycopolymere mit Fluorophoren
Im Gegensatz zu den block Glycopolymere durch gestufte RAFT Polymerisationen hergestellt, bietet dieses Ein-Schritt-Copolymerisation Protokoll eine gleichmäßige Verteilung über die glycomonomer Polymergerüst. Die hier gezeigten Glycopolymere enthalten 20 Mol-% glycomonomer, 77 Mol-% HEAA als Abstandshalter, und 3 Mol-% AEMA als Ziel für die post-Modifikationen (siehe Abbildung 2). 1 H- und 13 C-NMR-Spektroskopie bestätigt, die Strukturen der PMA-LAEMA und PMA-GAEMA (Figuren 3 und 4). Wie in 5 gezeigt ist, wenn sie gegen den GPC Elutionsprofile Glykopolymer synthetisiert ohne RAFT aufgetragen, beide PMA-LAEMA und PMA-GAEMA haben niedrige Dispersionsgraden, zum Nachweis der Wirksamkeit der RAFT-Ansatz. Wie erwartet, hat PMA-GAEMA ein M n kleiner als die der PMA-LAEMA durch PMA-GAEMA Fehlen einer Pendel Zucker. Analyse der Kohlenhydrate und funktionelle primäre Amingruppen Gehalt der RAFT Glycopolymeren ergab, dass das Verhältnis von Monomeren in den Produkt Glycopolymeren ist konsistent mit dem stöchiometrischen Verhältnis ab dem RAFT-vermittelte Polymerisation (Tabelle 1) eingesetzten Monomeren. Dies bedeutet eine enge Kontrolle des Monomers compositions in den synthetisierten Glycopolymere, wie vorgesehen.
Umsetzung von primären Aminfunktionen mit aktivierten Fluorophoren ist eine weit verbreitete Technik, die in der Proteinmarkierung. Hier wurde diese Technik eingesetzt werden, um gereinigte Glycopolymere mit Carboxyfluorescein zu kennzeichnen. Nach Post-Modifikation wurden fluoreszierende Polymere erhalten (Abbildung 6). Kein Abbau der Fluorescein-markierten Polymeren in der Umsetzung wurde durch GPC-Analyse nachgewiesen (Daten nicht gezeigt).
Bindungstests der synthetischen Glycopolymere mit Lektin beschichteten Agarosekügelchen
Um die Lektin-Bindungsspezifität der synthetisierten Glycopolymeren Beurteilung Lektin-beschichteten Agarosekügelchen mit bekannter Kohlenhydratbindungsspezifität verwendet. Erythrina crista galli Lektin (ECL), die in den Experimenten verwendet wird, hat eine Bindungsspezifität gegenüber β-D-galactosid. 7A zeigt deutlich, dass PMA-LAEMA-FlFluorescein, das β-D-galactosid als Anhänger Kohlenhydrat enthält, zeigte eine starke Bindung mit dem ECL-Lektin. Im Gegensatz dazu ist die Bindung an die negativen ECL des Glykopolymer PMA-GAEMA-Fluorescein, das kein Anhänger Zucker nicht besitzt, ist in 7B gezeigt. Dieses Ergebnis veranschaulicht die Bindung Wirksamkeit und Affinität der synthetisierten fluoreszierenden Glykopolymer.
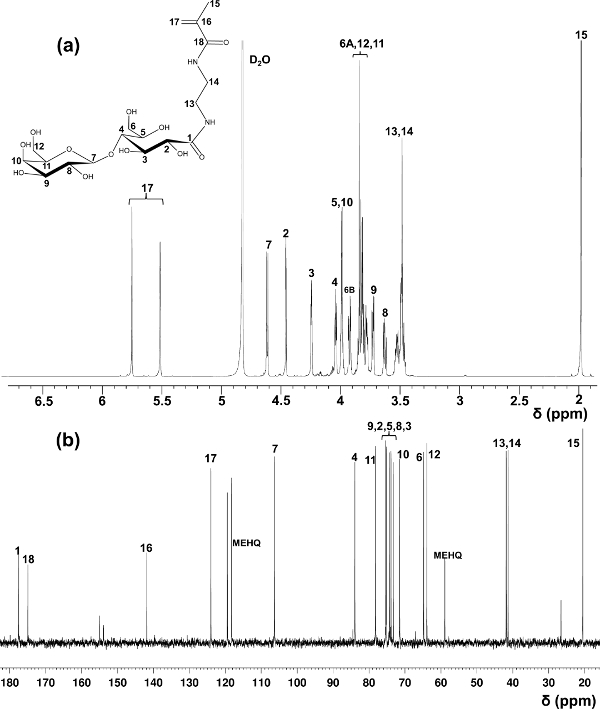
Abbildung 1. Assigned 1 H- (a) und 13 C-NMR (b) Spektren (D 2 O) für LAEMA. (Dieser Wert wurde von Wang verändert worden et al. 14) Bitte klicken Sie hier, um eine größere Version davon zu sehen Abbildung.
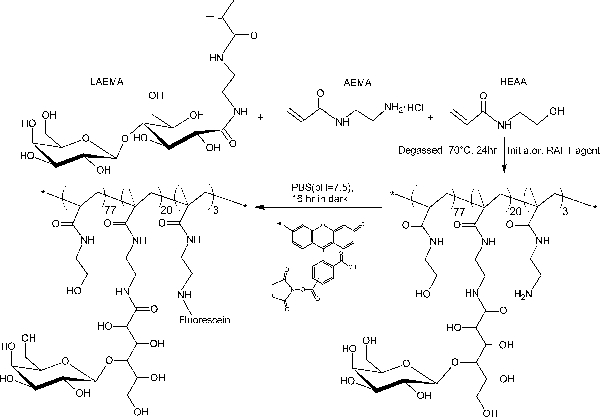
Abbildung 2. Schematische Darstellung der Synthese von fluoreszierenden Glykopolymer PMA-LAEMA haltigen β-galactosid als Anhänger Zucker. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
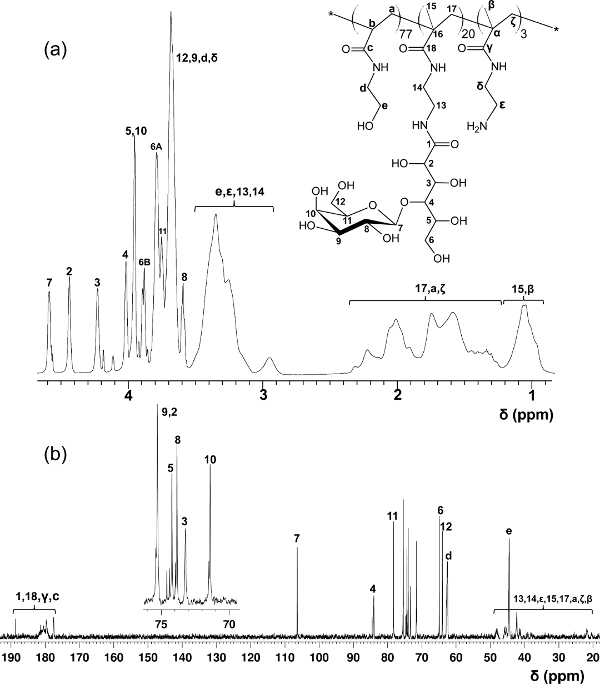
Abbildung 3. Zugewiesen 1 H- (A) und 13 C-NMR (B) Spektren (D 2 O) für PMA-LAEMA Glykopolymer. (Dieser Wert wurde von Wang verändert wurden 14 et al.) Please Klicken Sie hier, um eine größere Version dieser Figur zu sehen.
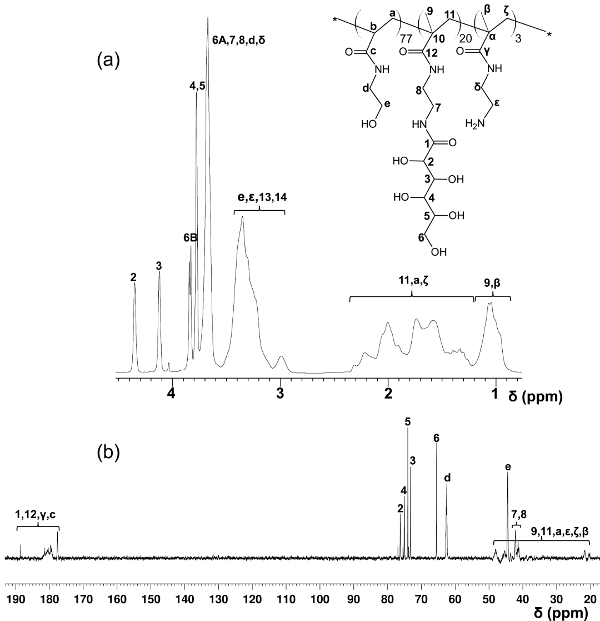
Abbildung 4. Zugewiesene 1 H- (A) und 13 C-NMR (B) Spektren (D 2 O) für PMA-GAEMA. (Dieser Wert wurde von Wang verändert worden et al. 14) Bitte klicken Sie hier, um eine größere Version zu sehen von dieser Figur.
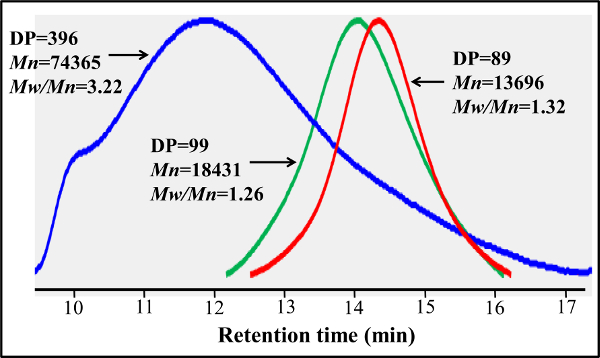
Abbildung 5. Die Gelpermeationschromatographie Spuren RAFT-basierten PMA-GAEMA und PMA-LAEMA mit und ohne Verwendung RAFT Mittels hergestellt. Im Gegensatz zu dem PMA-LAEMA ohne RAFT Mittel (blau), hergestellt, RAFT- basierend PMA-LAEMA (grün) hat eine viel geringere Dispersität (Mw / Mn). RAFT-basierte PMA-GAEMA (rot) und PMA-LAEMA haben ähnliche GPC-Profile, aber der ehemalige hat eine kleinere M n aufgrund der Abwesenheit von Anhänger Zucker. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 6. PMA-LAEMA vor und nach der post-Modifikation mit Fluorophor. (A) im Vergleich zu weiß nicht markierten Glykopolymer (links Rohr), zeigt fluoresceinmarkierten PMA-LAEMA eine starke gelbe Farbe (rechts Rohr). (B) unter UV, nicht markierten PMA-LAEMA (links Röhre, 1 mg / ml in PBS) dunkel ist und stellt ohne Fluoreszenz, wohingegen Fluorescein markierten PMA-LAEMA (rechte Rohr, 1 mg / ml in PBS) zeigt starke grüne Fluoreszenz.: //www.jove.com/files/ftp_upload/52922/52922fig4large.jpg "Target =" _ blank "> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
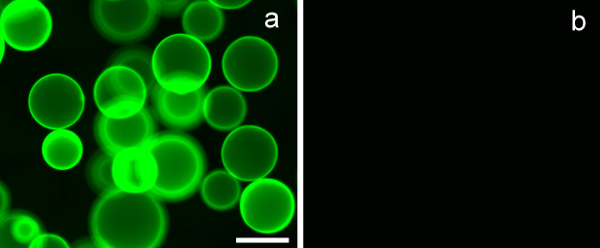
Abbildung 7. Erythrina crista-galli Lektin (ECL) beschichteten Agarosekügelchen binden β-D-galactosid enthält Glycopolymere, und nicht diejenigen, die nicht besitzen einen Anhänger Zucker. (A) PMA-LAEMA-Fluorescein (3 ug) zeigten eine starke Bindung mit ECL , während in (B) PMA-GAEMA-Fluorescein, die keine hängende β-D-galactosid-Rest besitzt, zeigte keine Bindung mit dem Lektin beschichteten Kügelchen. Maßstabsbalken = 100 & mgr; m.
Tabelle 1 Targeting-Werte ein synthetischer Parameter und tatsächlichen Zusammensetzungen der Glycopolymere. A) Targeting-Werte, Werte,werden von den Produkten gewünscht ist; b) DP, der Grad der Polymerisation; c) NA: nicht verfügbar. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
| DP b | Dispersität | Eigentlichen Inhalt glycomonomers mol% | Tatsächliche Gehalt an primären Amin mol% | |
| Targeting-Werte | 100 | <1,3 | 20 | 3 |
| PMA-LAEMA | 99 | 1.26 | 19 | 3.2 |
| PMA-GAEMA | 89 | 1.32 | NAc | 2.7 |
Diskussion
Eine einfache und effiziente Protokoll für RAFT-basierten trikomponentige Fluoreszenz Glycopolymeren, mit und ohne Anhänger Kohlenhydrat und ihre Verwendung in einer Lectin-Bindungstest wird in diesem Bericht gezeigt. Das Protokoll beginnt mit der Herstellung von glycomonomers LAEMA und GAEMA. Durch eine Ein-Schritt-RAFT-gesteuert Copolymerisation Glycopolymere mit reproduzierbaren Ausbeute, vorhersehbare Monomerzusammensetzung und niedrige Dispersität, erhalten. Folge einer nachträglichen Modifikation Glycopolymeren mit Carboxyfluorescein-succinimidylester, die Bindung des resultierenden entsprechenden fluoreszenzmarkierten Glykopolymer leicht testbare seiner Lectin-Bindungsspezifität.
In den anfänglichen Stufen der präparativen glycomonomers, die in den nachfolgenden Glykopolymer Synthesen eingesetzt werden sollen, wurden leicht verfügbar Lactobionsäure und Gluconolacton verwendet. In der Theorie keine Kohlenhydrate von Interesse, aus Monosacchariden, komplexe Oligosaccharide können converte seind zu glycomonomers durch Konjugieren des Ziel Zucker auf das primäre Hydroxylgruppe an C6 der Glucose. Nach der Oxidation des reduzierenden Glucoserest und dessen anschließende Dehydratisierung zu einem Lacton, das Produkt kann dann leicht umgesetzt werden, mit dem primären Amin auf AEMA die entsprechende glycomonomer bilden. Weitere Beispiele für diese Strecke kann in einem kürzlich veröffentlichten Bericht 14 zu sehen. Es sei darauf hingewiesen, dass vor dem Einleiten jeder Polymerisationsstufe MEHQ, einem potenten Polymerisationsinhibitor, muss von allen Monomer und glycomonomer Präparate unmittelbar vor der Verwendung entfernt werden kann. Dies wird leicht durch Verwendung der minimalen Menge an Methanol, die glycomonomer, die besitzt MEHQ dann sofort behandeln sie mit Aceton bei -20 ° C, um die Inhibitor-freie Produkt in hoher Ausbeute Niederschlag zu lösen erreicht.
Unerlässlich in jeder radikalische Polymerisation Schema, Liebe zum Detail und Monomer Reinheiten werden betont. Als typische eines RAFT Polymerisationssystem beträgt, es besteht auseine Radikalquelle, ein RAFT-Reagenz, ein Monomer und Lösungsmittel. In dieser Darstellung sichtbar wird ein einstufiges RAFT-Polymerisation System beschrieben, das auf die Herstellung von statistischen Copolymeren aus einem Reaktionsgemisch besitzt drei verschiedenen Monomeren in einer wässrigen Lösung erzeugt, fokussiert. Zwei separate RAFT-vermittelte Reaktionen werden vorgestellt, bei dem man eine glycomonomer dass ein Anhänger besitzt nutzt, nicht-reduzierenden Kohlenhydrat Terminus (dh β-D-Galactose) und die andere, die über ein Polyol ohne gebundener Kohlenhydratrest. Gemeinsam ist den beiden RAFT-vermittelte Reaktionen waren Monomeren, die über eine singuläre Hydroxylgruppe, die als ein Spacer-Molekül dient, und eine andere besitzt eine freie Amin für die post-Modifikation mit einer aminoreaktiven Fluorophors.
Da die Anwesenheit von Sauerstoff in der Reaktionsmischung und Umwelt schädlich RAFT-vermittelte Polymerisation ist, ist ihre Entfernung in den Spurenbereich leicht über mehrere gefrier eva bewerkstelligtcuate-Auftau-Zyklen, während die Schlenk-Rohr Reaktionsgefäß unter Hochvakuum.
Es sei darauf hingewiesen, dass das Molverhältnis der verschiedenen Monomere in der Reaktion kann nach Bedarf eingestellt werden kann. Auch kann durch Variation der Menge an RAFT Mittel verwendet wird, kann die Länge der resultierenden Polymeren gesteuert werden 18. Jedoch sollte das Molverhältnis der RAFT Mittel zu Initiator immer größer als zwei sein, um die niedrige Dispersität des Produkts sicherzustellen. Unter diesen Bedingungen ist die Entwicklung der Copolymerisation stationären und der Reproduzierbarkeit der Reaktion sehr hoch ist. Davon abgesehen, ist es unwahrscheinlich, daß man eine völlig gleichmäßige Verteilung aller beteiligten Monomere in einem statistischen Copolymer, aufgrund ihrer unterschiedlichen Geschwindigkeiten der Polymerisation. Charakterisierung der Verteilung der verschiedenen Monomeren im Polymer ist immer noch sehr schwierig.
Die Post-Modifikationsverfahren, hier vorgestellten ist sowohl einfacher als amenable die Verwendung einer breiteren Auswahl von Fluoreszenzmarkern, im Vergleich zu anderen Protokollen zu Label Glycopolymeren 2,11 aufgetragen. Diese würden viele der wasserlöslichen, aminreaktive Fluorophore, Quantenpunkten, Biotine und andere. Die Bindungsspezifitäten der synthetisierten, beschriftet Glycopolymere leicht nachprüfbar mit Lektine mit bekannter Bindungsaffinitäten. PMA-GAEMA besitzen keine Anhänger Zucker ist eine geeignete Negativkontrolle. Glycopolymeren mit unterschiedlichen fluoreszierenden Markierungen auf diesem Weg hergestellt wurden erfolgreich bei der Untersuchung von Lectin-vermittelte bakterielle Bindungs 14 eingesetzt. Wie dargestellt, sollte diese leichte und effiziente Herstellung von statistischen Fluoreszenz Glycopolymeren großes Potenzial, eine Vielzahl von glykobiologischen Forschung.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
This work was supported by the Experiment Station Chemical Laboratories of the University of Missouri, and by the Cystic Fibrosis Association of Missouri.
Materialien
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| Lactobionic acid | Sigma-Aldrich | 153516 | |
| D-Gluconolactone | Sigma-Aldrich | G2164 | |
| N-(2-hydroxyethyl) acrylamide (HEAA) | Sigma-Aldrich | 697931 | |
| Orange II sodium salt | Sigma-Aldrich | O8126 | |
| Hydroquinone monomethyl ether (MEHQ) | Sigma-Aldrich | 54050 | Polymerization inhibitor |
| N-(2-aminoethyl) methacrylamide hydrochloride (AEMA) | Polysciences, Inc | 24833-5 | |
| Triethylamine | Fisher Scientific | BP-616 | |
| Anion-exchange resin IRN-78 hydroxide-form, 80 mesh | Sigma-Aldrich | 10343-U | |
| Cation-exchange resin 50Wx8, 200 mesh | Sigma-Aldrich | 217514 | |
| Aluminum oxide, ~150 mesh | Sigma-Aldrich | A1522 | Type WN-6, Neutral, Activity Grade Super I |
| Ninhydrin | Sigma-Aldrich | N4876 | An ethanol solution of 0.2% ninhydrin was used in the test |
| 4-Cyano-4-(phenylcarbonothioylthio)pentanoic acid | Sigma-Aldrich | 722995 | RAFT agent |
| 4,4′-Azobis(4-cyanovaleric acid) | Sigma-Aldrich | 11588 | Polymerization initiator |
| Carboxyfluorescein succinimidyl ester | Life Technologies | C1157 | |
| Erythrina Cristagalli lectin coated agarose bead | Vector Laboratories | AL-1143 | |
| Solvent | |||
| dH2O | Produced by Barnstead water purification system, 18 megOhm-cm | ||
| Isopropanol | Fisher Scientific | A461-4 | ACS grade or better |
| Methanol | Fisher Scientific | A454-4 | ACS grade or better |
| Absolute ethanol | Fisher Scientific | BP2818-100 | ACS grade or better |
| Dimethylformamide | Sigma-Aldrich | 22705 | ACS grade or better |
| Acetone | Fisher Scientific | A929-4 | ACS grade or better |
| Equipment | |||
| Dialysis membrane (MWCO: 3,500) | Spectrum Labs | 132720 | |
| Polyethylene glycol analytical standard standard | Sigma-Aldrich | O2393 | |
| Schlenk tube, 1 ml | Quark Glass | Customized | |
| TSK-GEL G4000 PWxl | Tosoh Bioscience | 8022 | Used for GPC analysis of the glycopolymers |
| Empower 3 with GPC/SEC package | Waters Corporation | ||
| Waters Alliance HPLC system | Waters Corporation | Equipped with refractive index detector (Waters 2414) and fluorescence detector (Waters 2475) | |
| Avance III 800 MHz NMR Spectrometer | Bruker Corporation | ||
| BX43 fluorescence microscope | Olympus Corporation | Used with FITC filter in the glycopolymer binding test | |
| Rotavap / Rotoevaporator | Heidolph | ||
| Fritted disc funnel | Fisher Scientific | 10-310-109 | |
| Lyophilizer | Labconco | ||
| Immunofluorescence microscope slide | Polysciences | 18357-1 | |
| Revco Ultima Plus -80 °C Freezer | Thermo Scientific | ||
| Plastic Vacuum Bag and Hand Pump | Ziploc | ||
| Vacuum Pump, Direct Drive, Maxima C Plus | Fisher Scientific | ||
| Vacuum Gauge | Sargent-Welch | ||
Referenzen
- Scharfman, A., et al. Pseudomonas aeruginosa binds to neoglycoconjugates bearing mucin carbohydrate determinants and predominantly to sialyl-Lewis x conjugates. Glycobiology. 9 (8), 757-764 (1999).
- Song, E. H., et al. In vivo targeting of alveolar macrophages via RAFT-based glycopolymers. Biomaterials. 33 (28), 6889-6897 (2012).
- Wolfenden, M. L., Cloninger, M. J., Wang, B., Boons, G. .. -. J. Chapter 14. Multivalency in carbohydrate binding. Carbohydrate Recognition: Biological Problems, Methods, and Applications. , 349-370 (2011).
- Moad, G., Rizzardo, E., Thang, S. H. Radical addition-fragmentation chemistry in polymer synthesis. Polymer. 49 (5), 1079-1131 (2007).
- Spain, S. G., Gibson, M. I., Cameron, N. R. Recent advances in the synthesis of well-defined glycopolymers. J. Polym. Sci., Part A: Polym. Chem. 45 (11), 2059-2072 (2007).
- Bernard, J., Hao, X., Davis, T. P., Barner-Kowollik, C., Stenzel, M. H. Synthesis of various glycopolymer architectures via RAFT polymerization: From block copolymers to stars. Biomacromolecules. 7 (1), 232-238 (2006).
- Bulmus, V. RAFT polymerization mediated bioconjugation strategies. Polym. Chem. 2, 1463-1472 (2011).
- Ting, S. R. S., Chen, G., Stenzel, M. H. Synthesis of glycopolymers and their multivalent recognitions with lectins. Polymer Chemistry. 1, 1392-1412 (2010).
- Vazquez-Dorbatt, V., Lee, J., Lin, E. W., Maynard, H. D. Synthesis of glycopolymers by controlled radical polymerization techniques and their applications. Chembiochem. 13, 2478-2487 (2012).
- Jiang, X., Ahmed, M., Deng, Z., Narain, R. Biotinylated glyco-functionalized quantum dots: Synthesis, characterization, and cytotoxicity studies. Bioconjugate Chem. 20 (5), 994-1001 (2009).
- Deng, Z., Li, S., Jiang, X., Narain, R. Well-defined galactose-containing multi-functional copolymers and glyconanoparticles for biomolecular recognition processes. Macromolecules. 42 (17), 6393-6405 (2009).
- Qin, Z., et al. Galactosylated N-2-hydroxypropyl methacrylamide-b-N-3-guanidinopropyl methacrylamide block copolymers as hepatocyte-targeting gene carriers. Bioconjugate Chem. 22 (8), 1503-1512 (2011).
- Albertin, L., Wolnik, A., Ghadban, A., Dubreuil, F. Aqueous RAFT polymerization of N-acryloylmorpholine, synthesis of an ABA triblock glycopolymer and study of its self-association behavior. Macromol. Chem. Phys. 213 (17), 1768-1782 (2012).
- Wang, W., Chance, D. L., Mossine, V. V., Mawhinney, T. P. RAFT-based tri-component fluorescent glycopolymers: synthesis, characterization and application in lectin-mediated bacterial binding study. Glycoconj. J. 31 (2), 133-143 (2014).
- Deng, Z., Ahmed, M., Narain, R. Novel well-defined glycopolymers synthesized via the reversible addition fragmentation chain transfer process in aqueous media. J. Polymer Sci. Part A: Polym. Chem. 47 (2), 614-627 (2009).
- Noel, S., Liberelle, B., Robitaille, L., De Crescenzo, G. Quantification of primary amine groups available for subsequent biofunctionalization of polymer surfaces. Bioconjugate Chem. 22 (8), 1690-1699 (2011).
- Fox, A., Morgan, S. L., Gilbart, J., Biermann, C. J., McGinnis, G. D. Preparation of alditol acetates and their analysis by gas chromatography (GC) and mass spectrometry (MS). Analysis of Carbohydrates by GLC and MS. , 87-170 (1989).
- Thomas, D. B., et al. Kinetics and molecular weight control of the polymerization of acrylamide via RAFT. Macromolecules. 37 (24), 8941-8950 (2004).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten