Method Article
ジェル支援補水を使用した巨大なサイズのポリマーソームを形成します
要約
We present a protocol to rapidly form giant polymer vesicles (pGVs). Briefly, polymer solutions are dehydrated on dried agarose films adhered to coverslips. Rehydration of the polymer films results in rapid formation of pGVs. This method greatly advances the preparation of synthetic giant vesicles for direct applications in biomimetic studies.
要約
Polymer vesicles, or polymersomes, are being widely explored as synthetic analogs of lipid vesicles based on their stability, robustness, barrier properties, chemical versatility and tunable physical characteristics. Typical methods used to prepare giant-sized (> 4 µm) vesicles, however, are both time and labor intensive, yielding low numbers of intact polymersomes. Here, we present for the first time the use of gel-assisted rehydration for the rapid and high-yielding formation of giant (>4 µm) polymer vesicles (polymersomes). Using this method, polymersomes can be formed from a wide array of rehydration solutions including several different physiologically-compatible buffers and full cell culture media, making them readily useful for biomimicry studies. This technique is also capable of reliably producing polymersomes from different polymer compositions with far better yields and much less difficulty than traditional methods. Polymersome size is readily tunable by altering temperature during rehydration or adding membrane fluidizers to the polymer membrane, generating giant-sized polymersomes (>100 µm).
概要
合成セルサイズ、巨大な単層小胞(GUVs)の作成 は、人工細胞様システム1,2を生成するための枠組みを構築するために、異なる細胞過程のin vitroでの復興への関心が高まっています。脂質膜で構成GUVsは自然、生体膜の優れた模倣であるが、それらは環境変動に対して不安定であり、かなり短い貯蔵寿命を有します。これらの制限のために、両親媒性ブロックコポリマーは、ポリマー小胞、またはポリマーソームを形成する脂質模倣物として使用されています。 8 -この文脈の中で、ポリマーソームは、その増大した安定性3、化学的汎用性4,5及び修正物理的特性6にバイオミメティックセルシステムの開発に有利で す。
巨大なサイズのポリマーソームは、電鋳9とテンプレート再水和10、ワットの両方を含んで形成する現在の方法HICH、時間がかかり、労働集約型である特殊な装置を必要とし、無傷の巨大なポリマーソームの低収量を生産します。シンプルなゲルアシスト再水和法は、最近、脂質GUVs 11の産生のために開発されました。ここでは、制御されたサイズ、変化するポリマー組成物を有する巨大なポリマーソームを作成するために、ゲル支援再水和法の適応を説明し、様々なバッファー組成物です。
簡潔には、重量/体積標準のDNAゲル電気泳動アガロースフィルム1%のガラスカバースリップ上で脱水されています。クロロホルム中で調製したポリマー溶液を脱水アガロース膜を横切って拡散し、蒸発させました。完全に溶媒を除去した後、ポリマーフィルムは、適度な加熱(40〜70゜C)で選択した緩衝液中で再水和され、巨大な(> 4μm)の大きさのポリマーソームは、30分以内に形成されています。この方法は、急速に標準的な実験機器やreagenを使用して、十分に形成されたポリマーソームを完全に無傷の数百を生成します最小限のコストでTS。
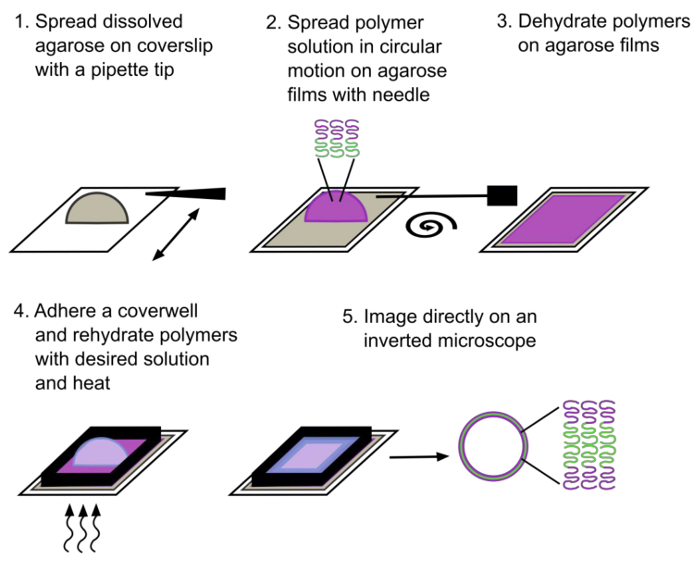
ゲルアシスト再水和方法を示す図1の回路図。ジブロック共重合体からなる巨大なポリマーソームは、再水和の約30分後に形成されています。親水性ブロックはマゼンタで示され、疎水性ブロックは緑で示されている。 この図の拡大版をご覧になるにはこちらをクリックしてください。
プロトコル
1.ポリマーおよびアガロースの準備
注意:手袋と白衣は、このプロトコルを通じて常に着用します。安全ゴーグルは、同様に、任意の有機溶媒または可能飛散を持つ任意の段階での作業時に必要とされています。
- クロロホルム中のポリマーの5 mg / mlで溶液を調製します。 B-ポリ(ブタジエン)(PEO-PBD、EO 22 -BD 37)が完全に溶解するガラスバイアルと旋回中のジブロック共重合体-固体のポリ(エチレンオキシド)の5 mgのクロロホルム1ミリリットルを追加します。化学ドラフト内でクロロホルムを使用して、すべての手順を実行します。
- 99.5モル%、非標識ポリマー中に0.5モル%の最終濃度で蛍光標識された脂質(購入済みクロロホルムに溶解)で混ぜます。
- 例えば、ピペット〜0の最終濃度は997.58μlのPEO-PBD、EO(2950ダルトンの分子量を有する)のクロロホルム22 -BD 37ポリマー中へのクロロホルム中1mg / mlの蛍光標識脂質の12μlの。標識された脂質を混合し5モル%、99.5モル%の重合体。
- -20℃でクロロホルム耐性蓋付きの気密バイアルに保管ソリューション。ここで、蓋のネジバイアルへのバイアルエッジで配管工のテープを巻き、バイアルに蓋を固定します。蓋の外側に配管工のテープの別の部分をラップし、最終的には最小限の蒸発を確実にするために、テープの外側にパラフィルムをラップします。
- 250ミリリットルの三角フラスコに50mlの水(または50ミリリットルの100mMスクロース)に0.5 mgの標準アガロースを混合することにより、1%w / vのアガロース溶液を作ります。 〜1分間の標準的な電子レンジでアガロース溶液を沸騰させる(または溶液のクリアで述べたように完全に溶解するまで)。
注:アガロース溶液を冷却し、数分後に使用されるか、または固化させ、記憶されていると同様の手順を使用して再溶解することができます。
2.アガロースフィルムの調製
- 目詰まりを防ぐために千μlのピペットチップのオフの端をカットします。切断されたチップを用いて、ピペット3メーカーから直接25ミリメートル角のガラスカバースリップ上に溶融アガロース溶液の00μlの。
- アガロースが堆積前にへ〜65-75℃に冷却させます。アガロースはあまりにもクールであれば、それは拡散プロセスの間に表面に凝集を開始します。アガロースは熱すぎる場合は逆に、それはより多くの表面にアガロースを接着するために拡散が必要になります。
- 手袋をした指でカバースリップのちょうど端を持ち、カバーガラスの表面に均等にアガロースを広めるために、別の千μlのピペットチップの長辺を使用しています。アガロースが完全に付着し、カバースリップを覆うまで前後にカバースリップ全体のピペットチップを移動します。
- アガロースを上に向けてパラフィルム片の上にアガロースでコーティングされたカバースリップを置きます。カバースリップの所望の数がコーティングされた後、少なくとも1時間、表面にアガロースを脱水し、37℃のインキュベーターにカバースリップでパラフィルムを配置します。
注:脱水アガロースの可視層の消失によって決定されます。カバーガラスは平坦で明確になります。フィルムは完全に脱水した後、店はアガロース表面は使い捨てプラスチックペトリ皿に上に向けてカバースリップ。
3.ポリマーフィルムの形成
- ピペット30μlをアガロースフィルム上にポリマー溶液を調製しました。
- 手袋をした指でカバースリップのちょうど端を持ち、円形の拡散運動を用いてアガロースフィルム全体のソリューションを広めるために18 G針の長辺を使用しています。溶液が蒸発するまで広がり続けます。
注意:針の尖端に注意してください。 - 上向きにプラスチックシャーレポリマー側のポリマーフィルムを配置し、アルミホイルで覆われた標準的な家の真空デシケーターにシャーレを入れ、完全に任意の残留溶媒を除去するために少なくとも1時間(ラベルされた脂質の光退色を防ぐため)。
ポルの4の形成ymersomes
- coverwellを接着、いずれかの自家製ポリジメチルシロキサン(PDMS)もポリマーフィルムでコーティングしたカバーガラスによく(〜ミドルの〜1cmの直径を有する硬化PDMS 0.5cmの厚さのブロックを打ち抜い)または市販の。タイトなシールがcoverwellとカバーガラスとの間に形成されるまで上向きにポリマーを有するポリマーでコーティングされたカバースリップ上にそっとcoverwellを押します。あまりにもハードキーを押しますと、カバーガラスを壊さないように注意してください。
- 室への200から500μlの再水和溶液(水は大丈夫ですが、バッファやマスコミの配列も動作します)を追加します(再水和量を付着coverwellのサイズに依存)。
- 再水和溶液の蒸発を減少させるために湿度室を作成します。ガラスシャーレの縁に沿って巻かれ、湿ったキムワイプを置きます。湿度チャンバー内に付着しcoverwellを有するポリマーフィルムを置き、蓋をカバーしています。光退色を最小限に抑えるためにアルミホイルでペトリ皿をカバーしています。場所ホットプレート上にペトリ皿は、少なくとも30分間、40℃に設定してください。
- ( 図5)が形成された小胞のサイズ24から70°Cから調整するために再水和の間にホットプレートの温度を調整します。この温度を超えて進むときに注意を使用する必要がありますので、70°Cは、アガロースのT mの近くにあります。
光退色後蛍光回復によりポリマーソームの5キャラクタリゼーション(FRAP)
- イメージングのための倒立顕微鏡に直接接着coverwellでカバースリップを移動します。
- ポリマー溶液中に含まれる蛍光脂質に基づいて適切なフィルタセットを選択します。ローダミン標識脂質はポリマー溶液にドープするために、25分の560 nmの励起フィルターと36分の607 nmの発光フィルター、または同等のフィルターセットを使用しています。
- ポリマーソームが付着されるカバーガラスの上面に集中する100Xの油浸対物レンズを使用してください。ポリマーソームは特にしている場合大きな(>20μM)または高分子フィルムが厚すぎると、低電力の目的( 例えば、40倍)は、より良いポリマーソームを可視化するために使用されるべきです。
- 蛍光顕微鏡を用いて、ポリマーソームを識別します。 > 5μmの直径を有する特徴的な中空の球状ベシクルによってポリマーソームを識別します。
- 調節可能なコンデンサーを含む蛍光顕微鏡で(FRAP)を光退色後蛍光回復を使用して、膜流動性を特徴づけます。付着自然と基板上のポリマーソームのタイトな梱包に、ポリマーソームの自然な動きは、FRAPイメージング品質を高めること、制限されています。
- 興味のあるポリマーソームに顕微鏡の焦点を合わせます。小さな領域にコンデンサーを閉じ、ポリマーソームのエッジが関心の撮像領域内にあることを確認してください。
- カメラの露出を増やして、すべてのNDフィルターを効果的に関心領域を光退色するために除去されていることを確認します。膜FLを許可します 30〜60秒、または蛍光強度が有意に減少するまで、光退色するuorescence強度。
- ランプの電源を切り、完全にコンデンサーを開きます。バック開始の設定への曝露を減少させ、すぐに画像を3分間、30秒ごとのキャプチャを開始。
- 標準的な方法12を使用して膜の拡散係数を計算します。漂白領域は3-5分以内に蛍光強度を回復する場合、これは、膜が液体であることを示しています。
ポリマーソームサイズの6キャラクタリゼーション
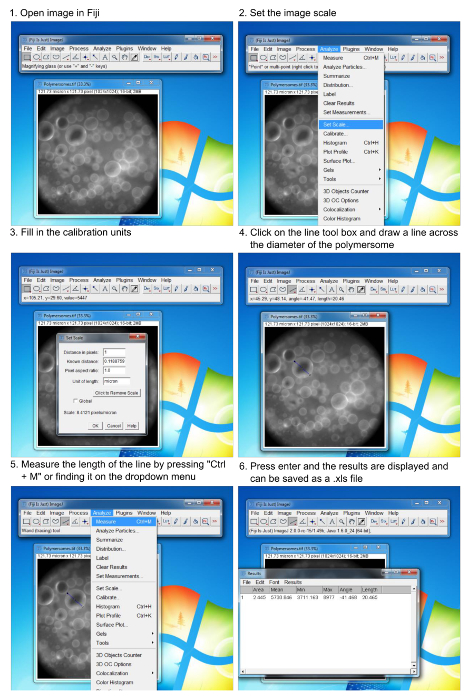
イメージングソフトウェアを使用して、ポリマーソームのサイズ分析のために、図6のプロセス。ステップバイステップの形成された小胞の直径を測定する方法について説明します。ユーザーが使用する顕微鏡のピクセル/μm単位のキャリブレーションユニットを知っている必要があります。ove.com/files/ftp_upload/54051/54051fig6large.jpg "ターゲット=" _空白 ">この図の拡大版をご覧になるにはこちらをクリックしてください。
- 画像解析ソフト13にポリマーソームの取得された画像を開きます。
- ボックスとクリック」セットのスケールを「ドロップダウン分析をクリックすることで、画像のスケールを設定します。
- 標準的な方法を用いて顕微鏡( すなわち、マイクロメートル)のスケールを調整します。
- キャリブレーション単位で入力し、「OK」をクリックします。
- ラインツールボックスをクリックして、小胞の直径にまたがる線を引きます。
- ボックスとクリック」対策を」ドロップダウン分析をクリックすることで、長さの測定を収集します。
- 上記の手順と測定データウィンドウに追加されるそれぞれの新しい測定以下の個別の小胞を測定し続けます。
- 各ラインを引き、上に引かれた線をインプリントするために長さを測定した後を押して "Ctrlキー+ D"画像は、簡単に分析された小胞を追跡すること。
結果
ポリマーソームは、( 図1)と、図2に示す一般的な実験装置上に概説した手順を使用して形成された。ポリマーソームは、脱イオン水( 図3)で再水和し、100Xオイル対物レンズを用いて落射蛍光における倒立顕微鏡で画像化しました。ポリマーソームが表示されていない場合、彼らは100Xの油浸対物レンズで取り込むには大きすぎるサイズで形成された可能性があることに注意してください。低電力の目的は、代わりに使用される必要があるかもしれません。ゲル支援再水和を使用する利点の1つは、再水和溶液の様々なポリマーソームの形成の多様性です。 図4に示すように、ポリマーソームは正常に、脱イオン水で完全な哺乳動物細胞培養培地、スクロース溶液二つ生理学的に関連の緩衝液(リン酸緩衝生理食塩水(PBS)またはTris緩衝化生理食塩水(TBS))を形成した。標準的な条件下で(再水和1時間40℃)での水で、〜より大きい70ポリマーソームは、典型的には、ビューの40×40μm2のフィールドごとに検出されました。ポリマーソームの表面の生産が均質ではありませんが、この代表的な収率で視野の数十があります。さらに、ポリマーソームは、少なくとも24時間、溶液中で安定でした。
ポリマーソームのサイズは容易に種々の温度でポリマーフィルムを再水和することによって調整しました。室温で脱イオン水に形成されたポリマーソームは2.9±0.7ミクロンの平均直径を有していました。再水和時の温度が上昇するにつれて、ポリマーソームの平均サイズは、( 表1)を増加させます。高温(> 60°C)、( 図5)μmの100よりもさらに大きなサイズで形成されたポリマーソームで。
すべての画像処理は、オープンソースのイメージングソフトウェア( 図6)を使用して完了しました。収集された画像は、ソフトウェアプログラムで開かれました。較正されたピクセルサイズを設定し、スケールボックスに入力されました。ラインツールを使用して、ラインが直径全体に描かれました。各個々の線が引かれた後、キャリブレーションの長さを測定し、結果ボックスに加えました。その後、データは選択肢( 例えば 、エクセル、プリズム、原産地など )の数学ソフトウェアにプロットすることができます
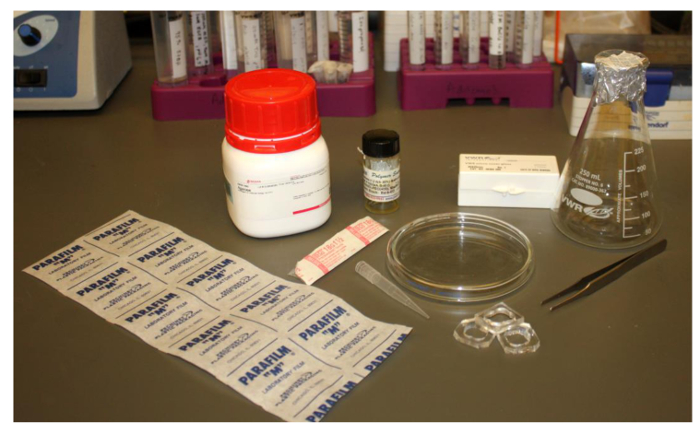
ポリマーソームの形成に必要な一般的で安価なラボ材料の図2.画像に必要な項目は以下のとおりです。パラフィルム、18.5 G針、クロロホルムまたは他の適切な溶媒中のポリマー、千μlのピペットチップ、三角フラスコ、ピンセット、アガロース、25ミリメートルの正方形カバースリップ、PDMSイメージング井戸とガラスシャーレ。 にはこちらをクリックしてくださいこの図の拡大版を表示します。

ゲルアシスト再水和法の図3.写真。アガロース溶存もフィルムコート全体をカバースリップするまで25ミリメートルの正方形のカバースリップ上に広がっています。カバーガラスは、その後、37℃のインキュベーターに入れて、フィルムが脱水されます。ポリマー溶液を脱水アガロースフィルム上に堆積され、円を描くように針を用いて拡散されます。カバーガラスは完全に任意の溶媒残留物を蒸発させるためにデシケーターのO / Nに置き、その後です。最後に、撮影室は、基板およびポリマーに接着されている選択肢の溶液で再水和し、ポリマーソームの形成を可能にするために40℃で少なくとも25分でペトリ皿に置かれている。 このの拡大版をご覧になるにはこちらをクリックしてください。図。 >
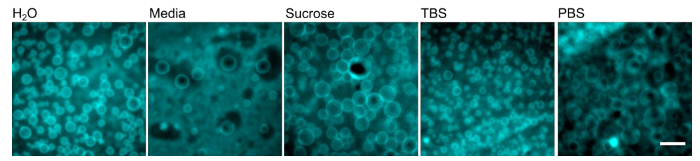
図4.ポリマーソームは、異なる緩衝液の様々な形成することができる。PEO-PBDポリマーフィルムは、1時間40℃で示されるバッファで再水和しました。スケールバー=10μmである。 この図の拡大版をご覧になるにはこちらをクリックしてください。
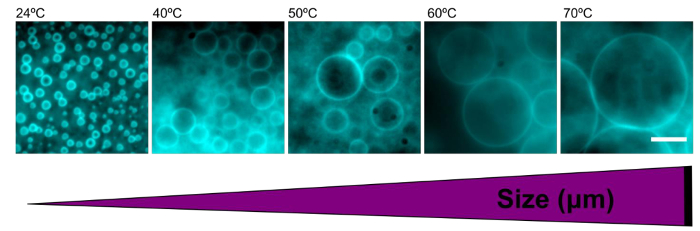
再水和の間に温度を上げる図5は、ポリマーソームのサイズが大きくなります。示された再水和温度で水に形成されたポリマーソームの代表的なエピ蛍光画像を。より大きなポリマーソーム内温度の上昇をもたらします。 =10μmのスケールバー。_blank ">この図の拡大版をご覧になるにはこちらをクリックしてください。
| 温度(℃) | 平均サイズ(ミクロン) |
| 24 | 2.93±0.7 |
| 40 | 5.76±2.5 |
| 50 | 6.65±2.4 |
| 60 | 11.46±5.8 |
| 70 | 14.04±7.0 |
表1は、計算された異なる温度条件ごとの水に100を超えるポリマーソームのために。平均直径を増加させたポリマーソームサイズの再水和の結果の間に温度を上げると、ここに描かれています。誤差は標準偏差です。
ディスカッション
ポリマーソームは、広く生体膜模倣として調査してきています。ポリマーの堅牢性と汎用性の特性は、膜機能化、長寿と調整された応答性を必要とする研究のためにそれらを広く魅力。巨大なサイズのポリマーソーム9,10(> 4ミクロン)を形成する従来の方法は、労働集約的であり、高価で特殊な装置を必要とします。ここで、我々は、最初に標準の安価な実験用試薬や機器を使用して、巨大なサイズのポリマーソームを形成するための、迅速な汎用性と堅牢な方法を提示します。
ゲル支援再水和を用いて、単層ポリマーソームを迅速に形成することができる(<30分)(細胞培養培地を含む)を再水和溶液の様々な異なるポリマーの様々な(データは示さず)。多重膜または非対称の小胞の形成は、この技術を用いて観察されませんでした。 B-ポリ( -この作業を通じて、我々は、ポリ(エチレンオキシド)を使用しブタジエン)(PEO-PBD、EO 22 -BD 37)中性のジブロック共重合体。 (帯電したジブロック共重合体を含む)多くの異なるポリマー組成物は、この方法(図示せず)を使用してうまく機能します。しかし、いくつかの市販のトリブロック共重合体と高分子量のジブロック共重合体(〜> 5,000ダルトン)の異なるポリマーソームを形成しません。この原稿での実験のすべてについて、標識された脂質の低濃度は、視覚化のみを目的としたポリマー溶液にドープしました。直接蛍光色素で官能化ポリマーを含む、視覚化するための他の方法を使用することもできます。蛍光顕微鏡は、より高い解像度を提供してもポリマーソームは、同様に、明視野顕微鏡で画像化することができます。
プロトコルへのほとんどのマイナーな修飾は、典型的には、結果を変更しません。例えば、カバーガラス上に広げ、ポリマー溶液の濃度の小さな差異は、ポリマーFの形成を変化させませんILMが形成されました。完全な濃度範囲が決定されなかったが、ポリマーソームの形成が正常にポリマーフィルム濃度( 例えば 、1から10 mg / mlで)の大規模な範囲で発生します。しかし、負のポリマーソーム形成に影響を与えるか、いくつかのプロトコルの変更があります。最も注目すべきは、(代わりに、正方形の)丸いガラスカバースリップは、ポリマーソームの非常に貧しい形成をもたらすことがあります。私たちは、実際にポリマーソームの形成を妨げるガラス上にアガロースの非常に均一な被膜にこれを属性。
この技術の最も注目すべき課題の一つは、高い収率で、表面からポリマーソームを回復する能力です。元の表面からポリマーソームを削除すると有利であることが可能な特定の場合があります。脱水ポリマーフィルムからの高いバックグラウンド蛍光を、個々のポリマーソームを除去し、カバースリップをきれいにするためにそれらを付着すると、結像品質と特性評価を増加します(パルティ)FRAP分析中にcularly。 (回収された小胞の数が当初形成されたものよりも著しく低いが)これを行うには、最後がカットされたピペットチップで穏やかにピペッティングは、表面からポリマーソームを脱着します。ポリマーソームは、次にポリマーソームは、新しいカバーガラスと相互作用できるように、修正されたカバースリップの表面上に配置することができます。一般的に、中性のPEO-PBDのポリマーソームのために、15分間オゾン処理をカバースリップポリマーソームは、イメージングのために表面に落下することができます。異なる表面改質は、異なるポリマーソームの組成物( 例えば、正または負にポリマーを荷電している)のために必要とされます。
このプロトコルで使用される大部分の材料は、うまく保存され、数日から数週間のために使用されます。固化したアガロースは、再沸騰アガロースも煮沸した後、凝集体を有する始める、または固化したアガロースを乾燥が開始されるまで再利用することができます。乾燥したアガロースフィルムとカバーガラスを保存し、使用することができます無期限( 例 えば 、数ヶ月)は、D。クロロホルムに溶解したポリマーは、数ヶ月間-20℃で保存することができます。ポリマーフィルムは、アガロース膜上で乾燥された後、しかし、フィルムは二週間(長期貯蔵を直接決定されなかった内ハウス真空下で保存し、使用する必要はなく、ポリマーフィルムより古い二つから形成されたポリマーソームにおける顕著な違いがあります週間)。
ここで提示ゲルアシスト再水和のプロトコルを使用して、均一状のポリマーソームの数百を標準装備し、安価な実験用試薬を使用して、労働者のわずか数時間で急速に形成されています。さらに、ポリマーソームは、生理学的緩衝液の様々な、異なるポリマー組成物( 図示せず)から形成することができる。この方法にマイナーな変更を負と科学者にゲルアシスト再水和に汎用性とアクセス可能な技術をレンダリング、ポリマーソームの形成を変化させませんテクニカル電子を変えますxpertise。
簡単に、細胞の大きさの規模で巨大なポリマーソームを作成する機能は、人工細胞様システムを構築するために不可欠です。これらのポリマーソームを作るためにゲルアシスト再水和の使用と汎用性の容易さは、強固な細胞膜模倣を作成するためのバイオミメティック分野での巨大な進歩を提供しています。例えば、この技術を用いて、異なる細胞内成分、細胞膜タンパク質および膜輸送タンパク質の組み込みを有するポリマーの官能化のカプセル化のための戦略は、ほんの数に名前を付けるために、ポリマーソームベースの人工的な細胞を構築するように設計することができます。
開示事項
Sandia National Laboratories is a multi-program laboratory managed and operated by Sandia Corporation, a wholly owned subsidiary of Lockheed Martin Corporation, for the U.S. Department of Energy's National Nuclear Security Administration under contract DE-AC04-94AL85000.
謝辞
We would like to gratefully acknowledge Dr. Ian M. Henderson, Andrew Gomez and Dr. Walter F. Paxton for their technical expertise, advice and help in this work. This work was supported by the U.S. Department of Energy, Office of Basic Energy Sciences, Division of Materials Sciences and Engineering (BES-MSE). ACG, DYS and GDB were supported by BES-MSE. This work was performed, in part, at the Center for Integrated Nanotechnologies, an Office of Science User Facility operated for the U.S. Department of Energy (DOE) Office of Science (user project number RA2015A0004, PI: ACG).
資料
| Name | Company | Catalog Number | Comments |
| 125 ml Erlenmeyer flask | VWR | 89000-360 | |
| 18 guage needle | VWR | BD-305196 | |
| 25 mm square coverslips | VWR | 48366-089 | |
| Agarose | Sigma | A9539 | A standard agarose for DNA gel electrophoresis |
| Chloroform | Sigma | 288306-2L | |
| Commerical coverwell | Electron Microscopy Sciences | 70336 | Press-to-Seal Silicone Isolators |
| Fiji Image Analysis Software | ImageJ | Free Download: http://fiji.sc/Fiji | |
| Glass vial with Teflon Lid | VWR | 66009-556 | 1.9 ml capacity, case of 144 |
| Liss-rhodamine B PE Lipid | Avanti Polar Lipids | 810150C | 1 mg of lipid at 1 mg/ml concentration in chloroform |
| Parafilm | VWR | 52858-000 | 10.2 cm x 38.1 m |
| poly(ethylene oxide)-b-poly(butadiene) or PEO-PBD (with a molecular weight of 2,940) | Polymer Source | P2904-BdEO | http://polymersource.com/dataSheet/P2904-BdEO.pdf |
| Pastic Petri Dish | VWR | 25384-092 | |
| Teflon tape | VWR | 300001-057 | 1/2" width |
参考文献
- Streicher, P., et al. Integrin reconstituted in GUVs: A biomimetic system to study initial steps of cell spreading. Biochim. Biophys. Acta. 1788 (10), 2291-2300 (2009).
- Paxton, W., Bouxsein, N. F., Henderson, I., Gomez, A., Bachand, G. Dynamic Assembly of Polymer Nanotube Networks via Kinesin Powered Microtubule Filaments. Nanoscale. , (2015).
- Bermudez, H., Brannan, A. K., Hammer, D. a., Bates, F. S., Discher, D. E. Molecular weight dependence of polymersome membrane structure, elasticity, and stability. Macromolecules. 35 (21), 8203-8208 (2002).
- Amos, R. C., Nazemi, A., Bonduelle, C. V., Gillies, E. R. Tuning polymersome surfaces: functionalization with dendritic groups. Soft Matter. 8 (21), 5947-5958 (2012).
- Egli, S., et al. Biocompatible functionalization of polymersome surfaces: A new approach to surface immobilization and cell targeting using polymersomes. J. Am. Chem. Soc. 133 (12), 4476-4483 (2011).
- Kim, K. T., Cornelissen, J. J. L. M., Nolte, R. J. M., Van Hest, J. C. M. A polymersome nanoreactor with controllable permeability induced by stimuli-responsive block copolymers. Adv. Mater. 21 (27), 2787-2791 (2009).
- Paxton, W. F., Price, D., Richardson, N. J. Hydroxide ion flux and pH-gradient driven ester hydrolysis in polymer vesicle reactors. Soft Matter. 9, 11295-11302 (2013).
- Henderson, I. M., Paxton, W. F. Salt, shake, fuse - Giant hybrid polymer/lipid vesicles through mechanically activated fusion. Angew. Chem. Int. Ed. 53 (13), 3372-3376 (2014).
- Discher, B. M. Polymersomes: Tough Vesicles Made from Diblock Copolymers. Science. 284 (5417), 1143-1146 (1999).
- Howse, J. R., et al. Templated formation of giant polymer vesicles with controlled size distributions. Nat Mat. 8 (6), 507-511 (2009).
- Horger, K. S., Estes, D. J., Capone, R., Mayer, M. Films of Agarose Enable Rapid Formation of Giant Liposomes in Solutions of Physiologic Ionic Strength Films of Agarose Enable Rapid Formation of Giant Liposomes in Solutions of Physiologic Ionic Strength. J. Am. Chem. Soc. , 1-24 (2009).
- Axelrod, D., Koppel, D. E., Schlessinger, J., Elson, E., Webb, W. W. Mobility measurement by analysis of fluorescence photobleaching recovery kinetics. Biophys. J. 16 (9), 1055-1069 (1976).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat meth. 9 (7), 676-682 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved