Method Article
Formare giganti di dimensioni Polymersomes Uso reidratazione Gel-assistita
In questo articolo
Riepilogo
We present a protocol to rapidly form giant polymer vesicles (pGVs). Briefly, polymer solutions are dehydrated on dried agarose films adhered to coverslips. Rehydration of the polymer films results in rapid formation of pGVs. This method greatly advances the preparation of synthetic giant vesicles for direct applications in biomimetic studies.
Abstract
Polymer vesicles, or polymersomes, are being widely explored as synthetic analogs of lipid vesicles based on their stability, robustness, barrier properties, chemical versatility and tunable physical characteristics. Typical methods used to prepare giant-sized (> 4 µm) vesicles, however, are both time and labor intensive, yielding low numbers of intact polymersomes. Here, we present for the first time the use of gel-assisted rehydration for the rapid and high-yielding formation of giant (>4 µm) polymer vesicles (polymersomes). Using this method, polymersomes can be formed from a wide array of rehydration solutions including several different physiologically-compatible buffers and full cell culture media, making them readily useful for biomimicry studies. This technique is also capable of reliably producing polymersomes from different polymer compositions with far better yields and much less difficulty than traditional methods. Polymersome size is readily tunable by altering temperature during rehydration or adding membrane fluidizers to the polymer membrane, generating giant-sized polymersomes (>100 µm).
Introduzione
Creazione di vescicole, sintetici cellulari dimensioni giganti unilamellari (GUVs) è di crescente interesse per la ricostruzione in vitro di diversi processi cellulari per costruire un quadro per la generazione di un alveolare 1,2 sistema artificiale. Mentre GUVs composti da membrane lipidiche sono ottimi imita di membrane biologiche, naturali, sono instabili contro le fluttuazioni ambientali e hanno una abbastanza breve durata. A causa di queste limitazioni, copolimeri a blocchi anfifilici sono stati usati come imita lipidi per formare vescicole polimeriche o polymersomes. In questo contesto, polymersomes sono vantaggiose nello sviluppo di sistemi cellulari biomimetici a causa della loro maggiore stabilità 3, versatilità chimica 4,5 e caratteristiche fisiche modificabili 6 - 8.
I metodi attuali per formare polymersomes giganti di dimensioni includono electroformation 9 e reidratazione su modelli 10, entrambi which sono in termini di tempo, attrezzature alta intensità di lavoro, richiedono specializzata e produrre basse rese di polymersomes giganti intatti. Un metodo semplice reidratazione gel assistita stato recentemente sviluppato per la produzione di lipidi GUVs 11. Qui, descriviamo un adattamento della tecnica reidratazione gel assistita per creare polymersomes giganti con differenti composizioni polimeriche, dimensione controllata e in varie composizioni tampone.
In breve, 1% w / v del gel DNA Films elettroforesi di agarosio standard sono disidratato su un vetrino di vetro. soluzioni polimeriche preparate in cloroformio sono poi diffuse in tutta la pellicola agarosio disidratati e lasciare evaporare. Dopo allontanamento del solvente completo, film polimerici vengono reidratate nel buffer di scelta con moderato riscaldamento (40-70 ° C) e gigante (> 4 micron) polymersomes dimensioni sono formati in 30 min. Questo metodo produce rapidamente centinaia di completamente intatte, polymersomes ben formate utilizzando attrezzature di laboratorio standard ed Reagents a costi minimi.
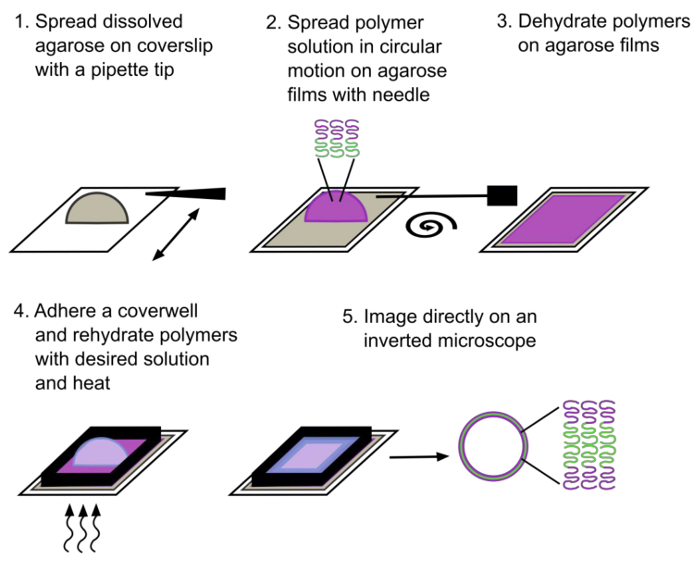
Figura 1. Schema raffigurante il metodo reidratazione gel assistita. Polymersomes giganti composte da un copolimero diblocco sono formate dopo ~ 30 minuti di reidratazione. Il blocco idrofilo è indicato in magenta e il blocco idrofobico è indicato in verde. Clicca qui per vedere una versione più grande di questa figura.
Protocollo
1. Polymer e agarosio Preparazione
Nota: guanti e un camice da laboratorio deve essere indossato in qualsiasi momento durante questo protocollo. Occhiali di sicurezza sono altresì tenuti durante il lavoro con qualsiasi solvente organico o qualsiasi passaggio con possibili spruzzi.
- Preparare a 5 mg / ml soluzione di polimero in cloroformio. Aggiungere 1 ml di cloroformio a 5 mg di poli solido (ossido di etilene) - poli b- (butadiene) (PEO-PBD, EO 22 -BD 37) diblock copolimero in una fiala di vetro e agitare per dissolvere completamente. Eseguire tutti i passaggi utilizzando cloroformio in una cappa.
- Mescolare in un lipide fluorescente (acquistato già disciolto in cloroformio) a 0,5 moli% concentrazione finale nel polimero marcato 99,5 moli%.
- Ad esempio, pipetta ~ 12 microlitri di 1 mg / ml lipide fluorescente in cloroformio nelle 997,58 microlitri PEO-PBD, EO 22 -BD 37 polimero in cloroformio (con un peso molecolare di 2.950 Daltons) per una concentrazione finale di 0.5 moli% di lipidi etichettato mescolati e 99,5 moli% di polimero.
- Conservare la soluzione in una fiala chiusa ermeticamente con un coperchio di cloroformio resistente a -20 ° C. Avvolgere idraulici nastro sul bordo fiala dove le viti coperchio sul flacone e fissare il coperchio sul flacone. Avvolgere un altro pezzo di nastro idraulici sulla parte esterna del coperchio e infine avvolgere Parafilm all'esterno del nastro per garantire un'evaporazione minima.
- Fare un 1% w / v soluzione di agarosio miscelando 0,5 mg agarosio standard 50 ml di acqua (o 50 ml 100 mM saccarosio) in una beuta da 250 ml. Far bollire la soluzione di agarosio in un forno a microonde standard per ~ 1 min (o fino a quando completamente sciolto come ha rilevato la compensazione della soluzione).
Nota: La soluzione di agarosio può essere utilizzato dopo pochi minuti di raffreddamento o lascia solidificare, immagazzinato e ri-fusa utilizzando la stessa procedura.
2. Agarosio Film Preparazione
- Tagliare l'estremità fuori di un puntale di 1.000 ml per evitare intasamenti. Utilizzando la punta di taglio, pipetta 300 ml di soluzione di agarosio fuso SU UN 25 millimetri coprioggetto di vetro quadrato direttamente dal produttore.
- Lasciare che il agarosio raffreddare a ~ 65-75 ° C prima della deposizione. Se l'agarosio è troppo freddo, inizierà a ciuffo sulla superficie durante il processo di diffusione. Viceversa, se l'agarosio è troppo caldo, che richiederà più diffondendo aderire l'agarosio alla superficie.
- Tenere solo il bordo del vetrino con dita guantate e utilizzare il lato lungo di un altro puntale 1.000 microlitri per diffondere l'agarosio in modo uniforme su tutta la superficie del vetrino. Spostare la punta della pipetta avanti e indietro attraverso il vetrino fino a quando l'agarosio aderisce completamente e copre il vetrino.
- Posizionare il vetrino agarosio rivestite su un pezzo di Parafilm con l'agarosio rivolto verso l'alto. Una volta che il numero desiderato di vetrini sono rivestiti, posizionare il Parafilm con i coprioggetti in un incubatore a 37 ° per disidratare l'agarosio sulla superficie per almeno 1 ora.
Nota: disidratazioneè determinata dalla scomparsa dello strato visibile di agarosio; il vetrino dovrebbe essere piatta e chiaro. Una volta che i film sono completamente disidratato, negozio coprioggetto con la superficie agarosio rivolta verso l'alto in una plastica monouso Petri.
Formazione 3. Polymer Film
- Pipettare 30 ml preparati soluzione polimerica sulla pellicola agarosio.
- Tenere solo il bordo del vetrino con dita guantate e utilizzare il lato lungo di un ago 18 G per diffondere la soluzione attraverso i film di agarosio con un movimento circolare diffusione. Continuare diffusione fino evapora la soluzione.
Nota: Fare attenzione la punta dell'ago. - Collocare le pellicole polimeriche in una piastra di Petri lato polimero plastico rivolto verso l'alto e mettere il piatto Petri in un essiccatore sotto vuoto casa serie, rivestiti in lamina di alluminio (per evitare photobleaching del lipide marcato) per almeno 1 ora per rimuovere completamente qualsiasi solvente residuo.
4. Formazione di Polymersomes
- Rispettare un coverwell, o un polidimetilsilossano fatto in casa (PDMS) e (un ~ 0,5 centimetri di spessore blocco di PDMS curato con ~ 1 cm di diametro di mezzo perforato) o di un disponibile in commercio ben al vetrino rivestito con il film polimerico. Premere il coverwell delicatamente sul vetrino polimero rivestito con il polimero rivolto verso l'alto fino ad ottenere una tenuta ottimale tra coverwell e il vetrino. Fare attenzione a non premere troppo forte e rompere il vetrino.
- Aggiungere 200-500 microlitri soluzione di reidratazione (acqua è soddisfacente, ma una serie di tamponi o media funziona anche) alla camera (volume reidratazione dipende dalla dimensione del coverwell aderito).
- Creare una camera umida per ridurre l'evaporazione della soluzione di reidratazione. Posizionare un laminato, Kimwipe bagnato lungo i bordi di un piatto di vetro Petri. Posizionare il film polimerico con l'coverwell aderito nella camera umida e coprire con un coperchio. Coprire la piastra di Petri con un foglio di alluminio per ridurre al minimo photobleaching. Postola piastra di Petri su una piastra calda impostata a 40 ° C per almeno 30 min.
- Regolare la temperatura della piastra calda durante la reidratazione dal 24-70 ° C per regolare la dimensione delle vescicole formate (Figura 5). 70 ° C si trova vicino alla T m del agarosio quindi deve essere usata cautela quando si procede al di là di questa temperatura.
5. Caratterizzazione di Polymersomes di Recupero della fluorescenza dopo photobleaching (FRAP)
- Spostare il vetrino con il aderito coverwell direttamente a un microscopio invertito per l'imaging.
- Scegliere il set di filtri appropriata in base al lipide fluorescente incluso nella soluzione polimerica. Per lipidi rodamina-etichettati drogati nelle soluzioni polimeriche, utilizzare un 560/25 nm filtro di eccitazione e di un filtro 607/36 nm di emissione, o set di filtri comparabili.
- Utilizzare un obiettivo olio 100X a concentrarsi sulla superficie superiore del vetrino in cui verranno rispettati i polymersomes. Se i polymersomes sono particolarmentegrande (> 20 micron) oppure se il film polimerico è troppo spesso, un obiettivo di potenza inferiore (ad esempio, 40X) deve essere utilizzato per visualizzare meglio i polymersomes.
- Identificare i polymersomes usando la microscopia a fluorescenza. Identificare polymersomes dalla caratteristica cava, vescicole sferico con un diametro> 5 micron.
- Caratterizzare fluidità di membrana con recupero di fluorescenza dopo photobleaching (FRAP) su un microscopio a fluorescenza contenente un condensatore regolabile. A causa della natura aderente e stretto imballaggio polymersomes sui substrati, movimento naturale delle polymersomes è limitata, aumentando la qualità delle immagini FRAP.
- Mettere a fuoco il microscopio sul polymersome di interesse. Chiudere il condensatore ad una piccola regione e assicurare che il bordo di un polymersome è all'interno della regione di imaging di interesse.
- Aumentare l'esposizione della fotocamera e garantiscono tutti i filtri a densità neutra vengono rimossi per photobleach efficacemente la regione di interesse. Lasciare che il fl membrana fluorescenza intensità per photobleach per 30-60 secondi o fino a quando l'intensità di fluorescenza è significativamente diminuita.
- Spegnere la lampada e aprire completamente il condensatore. Ridurre l'esposizione alle impostazioni di partenza e di iniziare immediatamente catturare immagini ogni 30 secondi per 3 min.
- Calcola coefficienti di diffusione a membrana utilizzando metodi standard 12. Se la regione sbiancato riacquista intensità di fluorescenza ai 3-5 min, ciò indica che la membrana è fluido.
6. Caratterizzazione di Polymersome Size
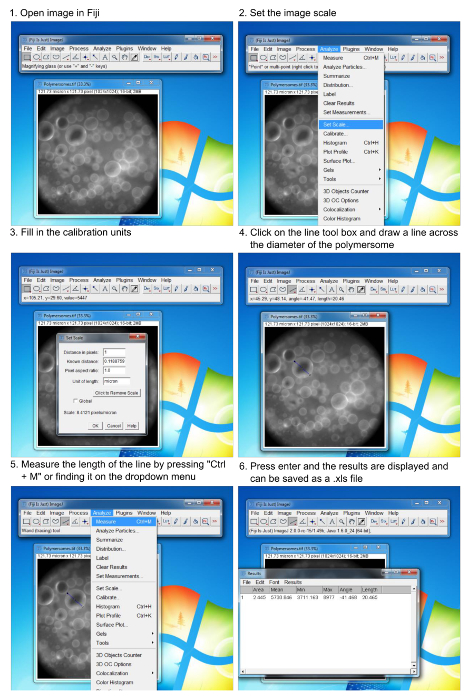
Figura 6. Procedimento per l'analisi delle dimensioni polymersomes utilizzando software di imaging. Passo-passo le istruzioni su come misurare il diametro delle vescicole formate. L'utente deve conoscere le unità di taratura in pixel / micron del microscopio utilizzato.ove.com/files/ftp_upload/54051/54051fig6large.jpg "target =" _ blank "> Clicca qui per vedere una versione più grande di questa figura.
- Aprire le immagini acquisite di polymersomes nell'immagine software di analisi 13.
- Impostare la scala per l'immagine cliccando sulla casella analizzano discesa e la "scala set" clic.
- Calibrare la scala per il microscopio usando metodi standard (ad esempio, un micrometro).
- Riempire le unità di calibrazione e fare clic su "OK".
- Fare clic sulla casella strumento a riga e tracciare una linea che attraversa il diametro di una vescicola.
- Raccogliere le misure di lunghezza, cliccando sulla casella analizzano discesa e facendo clic su "misura".
- Continuare misurazione vescicole individuali in seguito alla procedura di cui sopra ed ogni nuova misurazione sarà aggiunto alla finestra misurazioni dati.
- Premere il tasto "Ctrl + D" dopo aver disegnato ogni riga e misurando la lunghezza per imprimere la linea tracciata sulimmagine rendendo più facile per tenere traccia che le vescicole sono stati analizzati.
Risultati
Polymersomes sono formate utilizzando la procedura sopra descritta (figura 1) e l'equipaggiamento di laboratorio mostrato in Figura 2. Polymersomes stati reidratato con acqua deionizzata (Figura 3) e ripreso su un microscopio invertito in epifluorescenza con obiettivo olio 100X. Si noti che se polymersomes non sono visibili, potrebbero hanno formato con dimensioni troppo grandi per catturare con un obiettivo di olio 100X; un obiettivo di potenza inferiore può avere bisogno di essere utilizzato. Uno dei vantaggi di utilizzare reidratazione gel assistita è la versatilità di formare polymersomes in una varietà di soluzioni di reidratazione. Polymersomes sono formati successo in acqua deionizzata, un mezzo di coltura cellulare di mammifero piena, soluzioni di saccarosio e due soluzioni tampone fisiologicamente rilevanti (tampone fosfato salino (PBS) o soluzione salina tamponata con Tris (TBS)), come mostrato in Figura 4. In condizioni standard (reidratazionecon acqua a 40 ° C per 1 ora), maggiori di ~ 70 polymersomes trovano tipicamente a 40 x 40 micron 2 campo visivo. Mentre la produzione di superficie di polymersomes non è omogeneo, ci sono decine di campi di vista con questo resa rappresentativa. Inoltre, polymersomes erano stabili in soluzione per almeno 24 ore.
dimensione Polymersomes è stato facilmente messo a punto dalla reidratazione film polimerici a temperature variabili. Polymersomes formate in acqua deionizzata a RT avevano un diametro medio di 2,9 ± 0,7 micron. Come la temperatura aumenta durante la reidratazione, la dimensione media delle polymersomes aumenta anche (Tabella 1). Alle alte temperature (> 60 ° C), polymersomes formati con dimensioni ancora maggiore di 100 micron (Figura 5).
Tutto l'elaborazione delle immagini è stata completata utilizzando open-source software di imaging (Figura 6).Immagini raccolte sono stati aperti nel programma software. La dimensione dei pixel calibrata è stato stipulato scatola scala impostato. Utilizzando lo strumento linea, linee sono state elaborate attraverso i diametri. Dopo ogni singola linea è stata tracciata, la lunghezza calibrata è stata misurata e aggiunta alla casella di risultati. I dati possono poi essere tracciata nel software matematico di scelta (ad esempio, Excel, Prisma, origine, ecc)
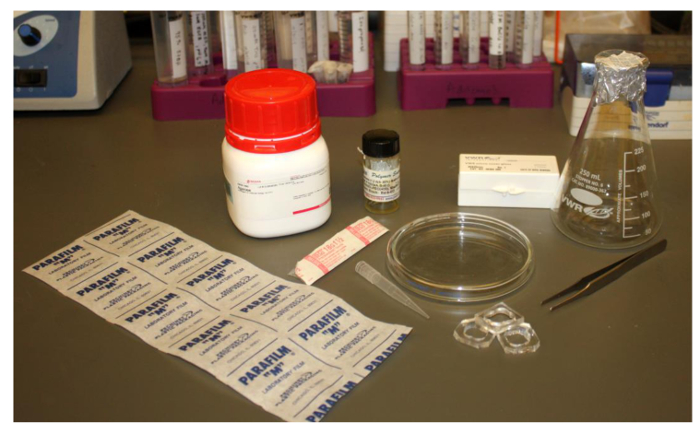
. Figura 2. Immagine dei materiali di laboratorio comuni e poco costosi necessari per la formazione di polymersomes Gli articoli richiesti sono: Parafilm, un 18,5 ago G, polimero in cloroformio o altro solvente appropriato, una pipetta punta 1.000 microlitri, una beuta, pinzette, agarosio, 25 mm coprioggetto quadrati, pozzi di imaging PDMS e un bicchiere capsula di Petri. cliccate qui pervisualizzare una versione più grande di questa figura.

Figura 3. Immagini del metodo reidratazione gel-assistita. Disciolto agarosio si sviluppa su un vetrino piazza 25 millimetri fino a un anche cappotti di film l'intera coprioggetto. Coprioggetto vengono poi messi in un incubatore a 37 ° e il film è disidratata. Una soluzione di polimero viene depositato sulla pellicola agarosio disidratati e diffondersi tramite un ago in un movimento circolare. Il vetrino viene poi posto in un essiccatore O / N di evaporare completamente eventuali residui di solvente. Infine, e camera di imaging viene fatto aderire al substrato e polimeri sono reidratato con soluzione di scelta e collocato in una capsula di Petri a 40 ° C per almeno 25 minuti per consentire la formazione di polymersomes. Fare click qui per visualizzare una versione più grande di questa figura. >
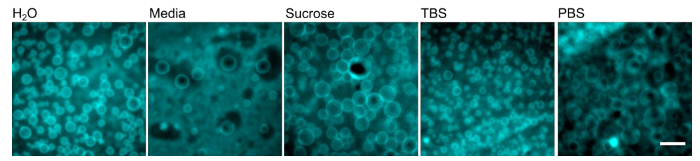
Figura 4. Polymersomes possono formare in una varietà di diversi tamponi. Pellicole polimeriche PEO-PBD state reidratate con il buffer indicato a 40 ° C per 1 ora. Barra di scala = 10 micron. Cliccate qui per vedere una versione più grande di questa figura.
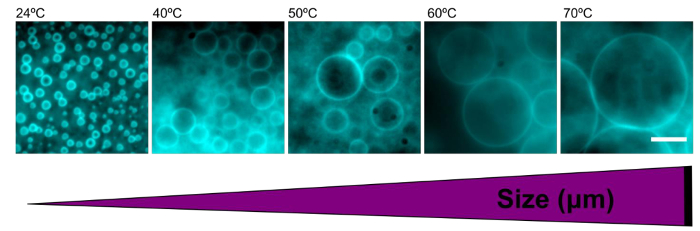
Figura 5. L'aumento della temperatura durante la reidratazione aumenta la dimensione delle polymersomes. Immagini epifluorescenza rappresentativi di polymersomes formate in acqua alle temperature indicate reidratazione. L'aumento di temperatura risultati in polymersomes più grandi. Barra di scala = 10 micron._blank "> Clicca qui per vedere una versione più grande di questa figura.
| Temperatura (° C) | Dimensione media (micron) |
| 24 | 2.93 ± 0.7 |
| 40 | 5.76 ± 2.5 |
| 50 | 6.65 ± 2.4 |
| 60 | 11.46 ± 5.8 |
| 70 | 14.04 ± 7.0 |
Tabella 1. L'aumento della temperatura durante la reidratazione risultati in aumento delle dimensioni polymersome. Diametri medio per superiore a 100 polymersomes in acqua per diverse condizioni di temperatura sono stati calcolati e sono raffigurati qui. Errore è la deviazione standard.
Discussione
Polymersomes stanno diventando ampiamente esplorati come imita membrana biologica. Le proprietà robuste e versatili di polimeri li rendono molto attraente per gli studi che richiedono funzionalizzazione della membrana, la longevità e la reattività sintonizzati. I metodi tradizionali per la formazione di giganti di dimensioni polymersomes 9,10 (> 4 micron) sono ad alta intensità di manodopera e richiedono costose attrezzature e specializzato. Qui vi presentiamo per la prima volta, un metodo rapido, versatile e robusta per la formazione di polymersomes giganti di dimensioni utilizzando reagenti di laboratorio a basso costo standard e attrezzature.
Utilizzando reidratazione gel assistita, polymersomes unilamellari possono essere formate rapidamente (<30 min), in una varietà di soluzioni di reidratazione (compresi mezzi di coltura cellulare) e con una varietà di diversi polimeri (dati non mostrati). La formazione di vescicole multilamellari o asimmetrici non è stato osservato utilizzando questa tecnica. In tutto questo lavoro, abbiamo utilizzato poli (ossido di etilene) - poli b- (butadiene) (PEO-PBD, EO 22 -BD 37) copolimero diblock neutro. Molte composizioni di polimeri diversi (compresi i copolimeri diblock cariche) funzionano bene con questo metodo (non mostrato). Tuttavia, alcuni copolimeri triblocco disponibili in commercio e superiori copolimeri peso molecolare diblock (~> 5.000 Dalton) non formano polymersomes distinti. Per tutti gli esperimenti in questo manoscritto, una bassa concentrazione di lipidi marcato è stato drogato nelle soluzioni polimeriche solo per scopi di visualizzazione. Altri metodi per la visualizzazione, compresi i polimeri funzionalizzati direttamente con un colorante fluorescente possono anche essere utilizzati. Polymersomes possono parimenti essere ripreso con la microscopia in campo chiaro, anche se la microscopia a fluorescenza fornisce una maggiore risoluzione.
La maggior parte delle piccole modifiche al protocollo di solito non alterano i risultati. Ad esempio, piccole differenze nella concentrazione della soluzione polimerica spargere sul coprioggetto non alterano la formazione del polimero film formata. Mentre la gamma completa concentrazione non è stato determinato, formazione polymersome avverrà con successo con una vasta gamma di concentrazioni film polimerico (per esempio, 1-10 mg / ml). Tuttavia, ci sono alcune modifiche di protocollo che influenzano negativamente la formazione polymersome. La più notevole è che vetrini rotondi (invece di quadrato) risultato in pessime formazione di polymersomes. Noi attribuiamo questo al estremamente strato uniforme di agarosio sul vetro che ostacola di fatto la formazione di polymersomes.
Una delle sfide più importanti di questa tecnica è la capacità di recuperare i polymersomes dalla superficie con una resa elevata. Ci sono alcuni casi in cui la rimozione delle polymersomes dalla superficie originale può essere vantaggioso. A causa della elevata fluorescenza di fondo del film polimerico disidratato, rimuovere singole polymersomes e aderendo loro di pulire coprioggetti aumenterà la qualità delle immagini e caratterizzazione (partilare durante l'analisi FRAP). Per fare questo, delicato pipettaggio con un puntale in cui alla fine è stata tagliata sarà desorbire le polymersomes dalla superficie (anche se il numero di vescicole recuperati è significativamente inferiore rispetto a quelli originariamente formate). Polymersomes possono quindi essere posizionati su superfici coprioggetto modificati, permettendo polymersome di interagire con il nuovo coprioggetto. In genere, per neutri polymersomes PEO-PBD, coprioggetto trattata con ozono per 15 minuti permettono alle polymersomes a cadere verso la superficie per l'imaging. Diverso modifica della superficie è necessario per diverse composizioni polymersome (ad esempio, negativamente o positivamente accusato polimeri).
La maggior parte dei materiali utilizzati in questo protocollo sono memorizzati con successo e utilizzati per giorni o settimane. L'agarosio solidificato può essere ribollita e riutilizzato fino alla agarosio comincia ad avere aggregati anche dopo l'ebollizione, o agarosio solidificato comincia ad asciugare. Coprioggetto con film agarosio secchi possono essere memorizzati e l'usod indeterminato (es mesi). Il polimero disciolto in cloroformio può essere conservato a -20 ° C per diversi mesi. Una volta che il film polimerico viene essiccato sui film agarosio, tuttavia, i film devono essere conservati sotto vuoto casa e utilizzati entro due settimane (conservazione a lungo termine non è stato determinato direttamente, ma ci sono differenze notevoli nella polymersomes formate da pellicole polimeriche più di due settimane).
Utilizzando il protocollo di reidratazione gel assistita presentato qui, centinaia di polymersomes a forma di uniforme si formano rapidamente con poche ore di lavoro con dotazioni di serie e reagenti di laboratorio a basso costo. Inoltre, polymersomes possono essere formati in una varietà di soluzioni tampone fisiologici e dalle differenti composizioni polimeriche (non mostrato). Eventuali modifiche minori metodo non modificano negativamente la formazione di polymersomes, rendendo reidratazione gel assistita una tecnica versatile e accessibile a scienziati variando tecnica expertise.
La possibilità di creare facilmente polymersomes giganti sulla scala dimensioni delle cellule è fondamentale per la costruzione di sistemi di celle simili artificiali. La facilità d'uso e la versatilità di reidratazione gel assistita per rendere questi polymersomes offre un grande progresso nel campo biomimetico per la creazione di solidi imita membrana cellulare. Ad esempio, utilizzando questa tecnica, strategie per l'incapsulamento delle diverse componenti intracellulari, funzionalizzazione del polimero con le proteine cellulari membrana e incorporazione di trasportatore di membrana, solo per citarne alcuni, può essere progettato per costruire cellule artificiali polymersome-based.
Divulgazioni
Sandia National Laboratories is a multi-program laboratory managed and operated by Sandia Corporation, a wholly owned subsidiary of Lockheed Martin Corporation, for the U.S. Department of Energy's National Nuclear Security Administration under contract DE-AC04-94AL85000.
Riconoscimenti
We would like to gratefully acknowledge Dr. Ian M. Henderson, Andrew Gomez and Dr. Walter F. Paxton for their technical expertise, advice and help in this work. This work was supported by the U.S. Department of Energy, Office of Basic Energy Sciences, Division of Materials Sciences and Engineering (BES-MSE). ACG, DYS and GDB were supported by BES-MSE. This work was performed, in part, at the Center for Integrated Nanotechnologies, an Office of Science User Facility operated for the U.S. Department of Energy (DOE) Office of Science (user project number RA2015A0004, PI: ACG).
Materiali
| Name | Company | Catalog Number | Comments |
| 125 ml Erlenmeyer flask | VWR | 89000-360 | |
| 18 guage needle | VWR | BD-305196 | |
| 25 mm square coverslips | VWR | 48366-089 | |
| Agarose | Sigma | A9539 | A standard agarose for DNA gel electrophoresis |
| Chloroform | Sigma | 288306-2L | |
| Commerical coverwell | Electron Microscopy Sciences | 70336 | Press-to-Seal Silicone Isolators |
| Fiji Image Analysis Software | ImageJ | Free Download: http://fiji.sc/Fiji | |
| Glass vial with Teflon Lid | VWR | 66009-556 | 1.9 ml capacity, case of 144 |
| Liss-rhodamine B PE Lipid | Avanti Polar Lipids | 810150C | 1 mg of lipid at 1 mg/ml concentration in chloroform |
| Parafilm | VWR | 52858-000 | 10.2 cm x 38.1 m |
| poly(ethylene oxide)-b-poly(butadiene) or PEO-PBD (with a molecular weight of 2,940) | Polymer Source | P2904-BdEO | http://polymersource.com/dataSheet/P2904-BdEO.pdf |
| Pastic Petri Dish | VWR | 25384-092 | |
| Teflon tape | VWR | 300001-057 | 1/2" width |
Riferimenti
- Streicher, P., et al. Integrin reconstituted in GUVs: A biomimetic system to study initial steps of cell spreading. Biochim. Biophys. Acta. 1788 (10), 2291-2300 (2009).
- Paxton, W., Bouxsein, N. F., Henderson, I., Gomez, A., Bachand, G. Dynamic Assembly of Polymer Nanotube Networks via Kinesin Powered Microtubule Filaments. Nanoscale. , (2015).
- Bermudez, H., Brannan, A. K., Hammer, D. a., Bates, F. S., Discher, D. E. Molecular weight dependence of polymersome membrane structure, elasticity, and stability. Macromolecules. 35 (21), 8203-8208 (2002).
- Amos, R. C., Nazemi, A., Bonduelle, C. V., Gillies, E. R. Tuning polymersome surfaces: functionalization with dendritic groups. Soft Matter. 8 (21), 5947-5958 (2012).
- Egli, S., et al. Biocompatible functionalization of polymersome surfaces: A new approach to surface immobilization and cell targeting using polymersomes. J. Am. Chem. Soc. 133 (12), 4476-4483 (2011).
- Kim, K. T., Cornelissen, J. J. L. M., Nolte, R. J. M., Van Hest, J. C. M. A polymersome nanoreactor with controllable permeability induced by stimuli-responsive block copolymers. Adv. Mater. 21 (27), 2787-2791 (2009).
- Paxton, W. F., Price, D., Richardson, N. J. Hydroxide ion flux and pH-gradient driven ester hydrolysis in polymer vesicle reactors. Soft Matter. 9, 11295-11302 (2013).
- Henderson, I. M., Paxton, W. F. Salt, shake, fuse - Giant hybrid polymer/lipid vesicles through mechanically activated fusion. Angew. Chem. Int. Ed. 53 (13), 3372-3376 (2014).
- Discher, B. M. Polymersomes: Tough Vesicles Made from Diblock Copolymers. Science. 284 (5417), 1143-1146 (1999).
- Howse, J. R., et al. Templated formation of giant polymer vesicles with controlled size distributions. Nat Mat. 8 (6), 507-511 (2009).
- Horger, K. S., Estes, D. J., Capone, R., Mayer, M. Films of Agarose Enable Rapid Formation of Giant Liposomes in Solutions of Physiologic Ionic Strength Films of Agarose Enable Rapid Formation of Giant Liposomes in Solutions of Physiologic Ionic Strength. J. Am. Chem. Soc. , 1-24 (2009).
- Axelrod, D., Koppel, D. E., Schlessinger, J., Elson, E., Webb, W. W. Mobility measurement by analysis of fluorescence photobleaching recovery kinetics. Biophys. J. 16 (9), 1055-1069 (1976).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat meth. 9 (7), 676-682 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon