Method Article
Formant géants de taille polymersomes Utilisation Réhydratation Gel-assisté
Dans cet article
Résumé
We present a protocol to rapidly form giant polymer vesicles (pGVs). Briefly, polymer solutions are dehydrated on dried agarose films adhered to coverslips. Rehydration of the polymer films results in rapid formation of pGVs. This method greatly advances the preparation of synthetic giant vesicles for direct applications in biomimetic studies.
Résumé
Polymer vesicles, or polymersomes, are being widely explored as synthetic analogs of lipid vesicles based on their stability, robustness, barrier properties, chemical versatility and tunable physical characteristics. Typical methods used to prepare giant-sized (> 4 µm) vesicles, however, are both time and labor intensive, yielding low numbers of intact polymersomes. Here, we present for the first time the use of gel-assisted rehydration for the rapid and high-yielding formation of giant (>4 µm) polymer vesicles (polymersomes). Using this method, polymersomes can be formed from a wide array of rehydration solutions including several different physiologically-compatible buffers and full cell culture media, making them readily useful for biomimicry studies. This technique is also capable of reliably producing polymersomes from different polymer compositions with far better yields and much less difficulty than traditional methods. Polymersome size is readily tunable by altering temperature during rehydration or adding membrane fluidizers to the polymer membrane, generating giant-sized polymersomes (>100 µm).
Introduction
Création de vésicules synthétiques cellulaires taille géantes unilamellaires (GUVs) est d' un intérêt croissant dans la reconstruction in vitro de différents processus cellulaires pour construire un cadre pour la génération d'un système 1,2 cellulaire comme artificielle. Bien que GUVs composés de membranes lipidiques sont excellentes, imite des membranes biologiques naturelles, ils sont instables contre les fluctuations de l'environnement et ont une durée de vie assez courte. En raison de ces limitations, les copolymères à blocs amphiphiles ont été utilisés comme mimétiques lipidiques pour former des vésicules de polymères, ou polymersomes. Dans ce contexte, polymersomes sont avantageux dans le développement de systèmes de cellules biomimétiques en raison de leur stabilité accrue 3, polyvalence chimique 4,5 et traits physiques modifiables 6 - 8.
Les méthodes actuelles pour former polymersomes géants de taille comprennent électroformation 9 et réhydratation templated 10, les deux wUEL sont temps, l'équipement de main-d'œuvre, exigent spécialisée et de produire de faibles rendements de polymersomes géants intacts. Procédé de réhydratation assistée gel simple a été récemment mis au point pour la production de lipides GUVs 11. Ici, nous décrivons une adaptation de la technique de réhydratation assistée gel pour créer polymersomes géantes avec des compositions de polymères différentes, la taille contrôlée, ainsi que dans diverses compositions tampons.
En bref, 1% p / v de films électrophorèse d'agarose de gel d'ADN standard sont déshydratés sur une lamelle de verre. solutions de polymère préparées dans du chloroforme sont ensuite répartis à travers le film d'agarose déshydraté et laisser évaporer. À la suite de l'élimination complète du solvant, les films polymères sont réhydratés dans le tampon de choix avec un chauffage modéré (40-70 ° C) et géant (> 4 pm) polymersomes taille sont formées dans les 30 minutes. Cette méthode produit rapidement des centaines de totalement intacts, polymersomes bien formés à l'aide de l'équipement et Reagen standard de laboratoirets à des coûts minimes.
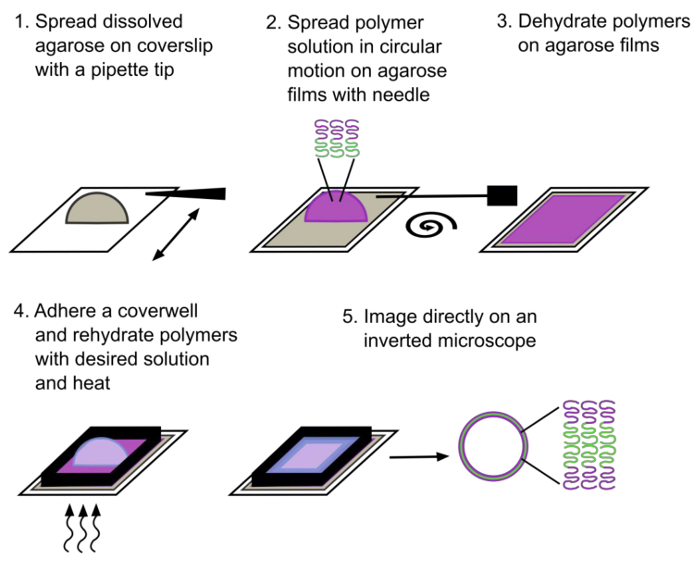
Figure 1. Représentation schématique illustrant le procédé de réhydratation assistée par un gel. Polymersomes géantes composées d'un copolymère à deux blocs sont formés après environ 30 minutes de réhydratation. Le bloc hydrophile est notée en magenta et le bloc hydrophobe est noté en vert. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Protocole
1. Préparation des polymères et Agarose
Remarque: Des gants et une blouse de laboratoire doit être porté en tout temps tout au long de ce protocole. Des lunettes de sécurité sont également nécessaires pendant le travail avec un solvant organique ou une étape avec possibilité d'éclaboussures.
- Préparer une / ml, solution de 5 mg de polymère dans le chloroforme. Ajouter 1 ml de chloroforme à 5 mg de poly solide (oxyde d'éthylène) - poly b- (butadiène) (PEO-PBD, EO 22 -BD 37) un copolymère diséquencé dans un flacon en verre et agiter pour dissoudre complètement. Effectuez toutes les étapes à l'aide de chloroforme dans une hotte chimique.
- Mélanger dans un lipide marqué par fluorescence (acheté déjà dissous dans du chloroforme) à un% 0,5 mol concentration finale en 99,5% en mole de polymère non marqué.
- Par exemple, une pipette ~ 12 pi de 1 mg / ml de lipide marqué par fluorescence dans du chloroforme dans 997,58 ul PEO-PBD, EO 22 -BD 37 polymère dans du chloroforme (ayant un poids moléculaire de 2950 Daltons) pour une concentration finale de 0.5% en mole de lipide marqué mélangés et 99,5% en moles de polymère.
- Conserver la solution dans un flacon hermétique avec un couvercle de chloroforme résistant à -20 ° C. Enveloppez plombiers bande sur le bord du flacon où les vis de couvercle sur le flacon et fixer le couvercle sur le flacon. Envelopper un autre morceau de ruban plombiers à l'extérieur du couvercle et enfin envelopper Parafilm à l'extérieur de la bande pour assurer une évaporation minimale.
- Préparer une solution à 1% en poids / volume d'agarose en mélangeant 0,5 mg standard d'agarose dans 50 ml d'eau (ou 50 ml de 100 mM de saccharose) dans un ballon Erlenmeyer de 250 ml. Faire bouillir la solution d'agarose dans un micro-ondes standard pour ~ 1 min (ou jusqu'à dissolution complète comme indiqué par la compensation de la solution).
Remarque: La solution d'agarose peut être utilisé après quelques minutes de refroidissement ou de se solidifier, stocké et refondu en utilisant la même procédure.
2. Agarose Film Préparation
- Coupez l'extrémité hors d'une pointe de pipette 1000 pi pour éviter le colmatage. Avec la pointe de coupe, pipette 300 pi de solution d'agarose fondu sur un carré de 25 mm lamelle de verre directement auprès du fabricant.
- Autoriser l'agarose refroidir à ~ 65-75 ° C avant le dépôt. Si l'agarose est trop cool, il va commencer à agglomérer sur la surface pendant le processus d'étalement. A l'inverse, si l'agarose est trop chaud, il faudra plus d'étalement pour faire adhérer l'agarose à la surface.
- Tenez juste le bord de la lamelle avec les doigts gantés et utiliser le bord long d'une autre pointe de la pipette 1000 pi pour répandre l'agarose uniformément sur toute la surface de la lamelle. Déplacez la pointe de pipette et d'autre de la lamelle jusqu'à ce que l'agarose adhère complètement et couvre la lamelle.
- Placer la lamelle d'agarose revêtue sur un morceau de parafilm avec l'agarose vers le haut. Une fois que le nombre désiré de lamelles sont recouvertes, placer le Parafilm avec les lamelles dans un incubateur à 37 ° par rapport à déshydrater l'agarose sur la surface pendant au moins 1 h.
Note: Déshydratationest déterminée par la disparition de la couche visible d'agarose; la lamelle devrait ressembler à plat et clair. Une fois que les films sont totalement déshydratés, stocker lamelles de la surface d'agarose orientée vers le haut dans une boîte de Petri en plastique jetable.
Formation 3. Polymer Film
- Pipette 30 pl préparés solution de polymère sur le film d'agarose.
- Tenez juste le bord de la lamelle avec les doigts gantés et utiliser le bord long d'une aiguille de 18 G pour étendre la solution à travers les films d'agarose en utilisant un mouvement circulaire d'étalement. Continuer de se propager jusqu'à ce que la solution est évaporée.
Remarque: Faites attention à l'extrémité pointue de l'aiguille. - Placez les films de polymère dans un côté de polymère de boîte de Petri en plastique vers le haut et mettre la boîte de Petri dans un dessiccateur maison vide standard recouvert de papier d'aluminium (pour éviter photoblanchiment du lipide marqué) pendant au moins 1 heure pour éliminer complètement tout solvant résiduel.
4. Formation de Polymersomes
- Adhérer un coverwell, soit un polydiméthylsiloxane fait maison (PDMS) bien (un ~ 0,5 cm d'épaisseur bloc de PDMS durcis avec ~ 1 cm de diamètre au milieu poinçonnés) ou disponible dans le commerce et à la lamelle revêtue du film de polymère. Appuyez sur la coverwell doucement sur la lamelle couvre-objet revêtu de polymère avec le polymère orienté vers le haut jusqu'à ce qu'un joint étanche est formé entre la coverwell et la lamelle. Veillez à ne pas appuyer trop fort et briser la lamelle.
- Ajouter 200-500 solution de réhydratation ul (l'eau est très bien, mais un tableau de tampons ou de médias travaille également) à la chambre (volume de réhydratation dépend de la taille de l'coverwell adhéré).
- Créer une chambre d'humidité pour réduire l'évaporation de la solution de réhydratation. Placez un Kimwipe humide roulé le long des bords d'une boîte de Pétri en verre. Placez le film de polymère avec le coverwell collé dans la chambre d'humidité et couvrez avec un couvercle. Couvrir la boîte de Pétri avec une feuille d'aluminium pour minimiser photoblanchiment. Endroitla boîte de Petri sur une plaque chauffante réglée à 40 ° C pendant au moins 30 min.
- Réglez la température de la plaque chauffante pendant la réhydratation 24-70 ° C pour régler la taille des vésicules formées (figure 5). 70 ° C est proche de la T m de l'agarose si la prudence doit être utilisé lors de poursuivre au - delà de cette température.
5. Caractérisation des polymersomes par Fluorescence Recovery après photoblanchiment (FRAP)
- Déplacer la lamelle avec le coverwell adhéré directement à un microscope inversé pour l'imagerie.
- Choisissez le jeu de filtres appropriés sur la base du lipide fluorescent inclus dans la solution de polymère. Pour les lipides marquées à la rhodamine dopées dans les solutions de polymère, en utilisant un filtre 560/25 nm d'excitation et un filtre d'émission 607/36 nm, ou d'ensembles de filtres comparables.
- Utiliser un objectif 100X à l'huile de se concentrer sur la surface supérieure de la lamelle couvre-objet, où les polymersomes seront respectées. Si les polymersomes sont particulièrementgrande taille (> 20 um) ou si le film de polymère est trop épaisse, un objectif de plus faible puissance (par exemple 40X) doit être utilisée pour mieux visualiser les polymersomes.
- Identifier les polymersomes en utilisant la microscopie à fluorescence. Identifier polymersomes par le creux, la vésicule sphérique caractéristique d'un diamètre> 5 um.
- Caractériser la fluidité de la membrane à l'aide de récupération de fluorescence après photoblanchiment (FRAP) sur un microscope à fluorescence comportant un condensateur réglable. En raison de la nature adhérente et l'emballage serré de polymersomes sur les substrats, le mouvement naturel des polymersomes est limitée, l'augmentation de la qualité de l'imagerie FRAP.
- Concentrez le microscope sur la polymersome d'intérêt. Fermer le condenseur à une petite région et de faire en sorte que le bord d'une polymersome se trouve dans la région d'imagerie d'intérêt.
- Augmenter l'exposition de la caméra et assurer que tous les filtres de densité neutre sont enlevés pour photobleach efficacement la région d'intérêt. Laisser la fl membrane intensité de fluorescence photobleach pendant 30 à 60 secondes ou jusqu'à ce que l'intensité de fluorescence est significativement diminuée.
- Éteignez la lampe et ouvrir complètement le condenseur. Diminuer l'exposition aux paramètres de départ et commencer immédiatement la capture d'images toutes les 30 secondes pendant 3 min.
- Calculer des coefficients de diffusion de la membrane en utilisant des procédés classiques 12. Si la région blanchie regagne l'intensité de fluorescence au sein de l'5/3 min, ce qui indique que la membrane est fluide.
6. Caractérisation des polymersome Taille
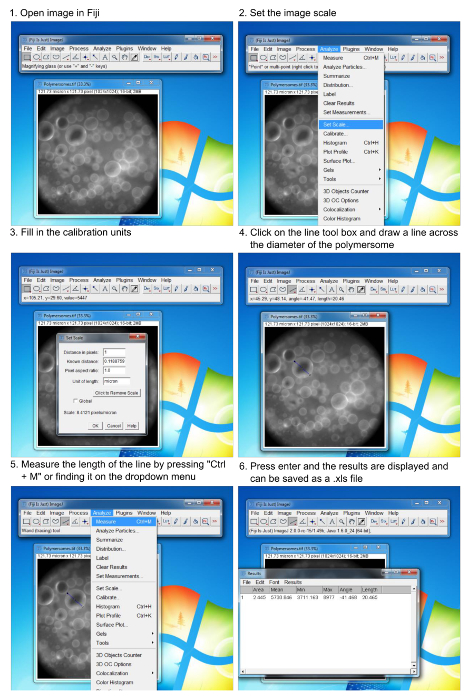
Figure 6. Procédé pour l'analyse de la taille de polymersomes en utilisant un logiciel d'imagerie. Étape par étape les instructions sur la façon de mesurer le diamètre des vésicules formées. L'utilisateur doit connaître les unités de calibrage en pixels / um du microscope utilisé.ove.com/files/ftp_upload/54051/54051fig6large.jpg "target =" _ blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
- Ouvrez les images de polymersomes acquises dans l' image logiciel d'analyse 13.
- Réglez l'échelle de l'image en cliquant sur la case analysent déroulant et en cliquant sur "échelle de jeu".
- Calibrer l'échelle pour le microscope en utilisant des méthodes standards (ie, un micromètre).
- Remplissez les unités de calibrage et cliquez sur "ok".
- Cliquez sur la boîte à outils en ligne et tracer une ligne couvrant le diamètre d'une vésicule.
- Collecter les mesures de longueur en cliquant sur la case analysent déroulante et en cliquant sur "mesure".
- Continuer la mesure de vésicules individuelles suivant la procédure ci-dessus et chaque nouvelle mesure sera ajoutée à la fenêtre de données de mesures.
- Appuyez sur "Ctrl + D" après le dessin de chaque ligne et de mesurer la longueur d'imprimer la ligne tracée sur laimage, la rendant plus facile à suivre qui vésicules ont été analysées.
Résultats
Polymersomes ont été formées en utilisant la procédure décrite ci - dessus (figure 1) et l'équipement de laboratoire usuel représenté sur la figure 2. Polymersomes ont été réhydratés avec de l' eau déminéralisée (figure 3) et imagée sur un microscope inversé à épifluorescence en utilisant un objectif de l' huile 100X. Notez que si polymersomes ne sont pas visibles, ils auraient formé à des tailles trop grandes pour capturer avec un objectif d'huile 100X; un objectif de plus faible puissance peut devoir être utilisés à la place. L'un des avantages de l'utilisation de la réhydratation assistée gel est la polyvalence de formation polymersomes dans une variété de solutions de réhydratation. Polymersomes ont été formés avec succès dans de l' eau déminéralisée, un milieu complet de culture de cellules de mammifère, des solutions de saccharose et deux solutions tampons physiologiquement pertinentes (tampon phosphate salin (PBS) ou une solution saline tamponnée au Tris (TBS)), comme illustré sur la figure 4. Dans des conditions standard (réhydratationavec de l' eau à 40 ° C pendant 1 heure), plus grande que ~ 70 polymersomes se trouvent généralement par 40 x 40 um 2 champ de vision. Alors que la production de surface de polymersomes est pas homogène, il y a des dizaines de champs de vision avec ce rendement représentatif. En outre, polymersomes étaient stables en solution pendant au moins 24 heures.
taille de polymersomes a été facilement réglé en réhydratant films de polymère à des températures variables. Polymersomes formés dans de l'eau déminéralisée à la température ambiante avaient un diamètre moyen de 2,9 ± 0,7 pm. Étant donné que les augmentations de température au cours de la réhydratation, la taille moyenne des polymersomes augmente également ( voir le tableau 1). A des températures élevées (> 60 ° C), polymersomes formés avec des tailles encore plus grande que 100 um (figure 5).
Tout traitement de l' image a été réalisée en utilisant open-source du logiciel d'imagerie (Figure 6).Des images recueillies ont été ouverts dans le programme logiciel. La taille de pixel calibré a été conclu mis boîte à grande échelle. Utilisation de l'outil de ligne, les lignes ont été tirées à travers les diamètres. Après chaque ligne a été établi, la longueur calibrée a été mesurée et ajoutée à la zone de résultats. Les données peuvent alors être tracée dans le logiciel mathématique de choix (par exemple, Excel, Prism, origine, etc.)
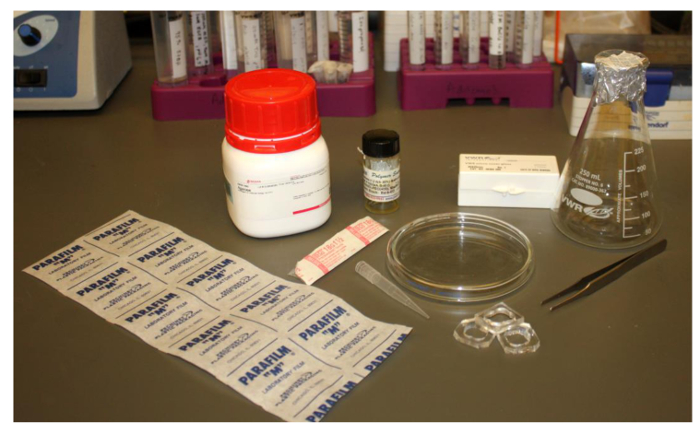
. Figure 2. Image du matériel de laboratoire commun et peu coûteux nécessaires à la formation de polymersomes Les éléments requis sont: Parafilm, 18,5 aiguille G, polymère dans le chloroforme ou un autre solvant approprié, une pointe de pipette 1000 pi, une fiole d' Erlenmeyer, pince à épiler, agarose, 25 mm lamelles carrés, PDMS puits d'imagerie et une boîte de Pétri en verre. S'il vous plaît cliquer ici pourvoir une version plus grande de cette figure.

Figure 3. Les photos de la méthode de réhydratation assistée gel. Dissous agarose est étalé sur une lamelle carré de 25 mm jusqu'à ce qu'un même manteaux de film l'ensemble lamelle. Lamelles sont ensuite placés dans un incubateur à 37 ° et le film est déshydraté. Une solution de polymère est déposée sur le film d'agarose déshydraté et étalée à l'aide d'une aiguille dans un mouvement circulaire. La lamelle est ensuite placer dans un dessiccateur O / N pour évaporer complètement tous les résidus de solvants. Enfin, et la chambre d'imagerie est collée sur le substrat et les polymères sont réhydraté avec une solution de choix et placé dans une boîte de Pétri à 40 ° C pendant moins de 25 min pour permettre la formation de polymersomes. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure. >
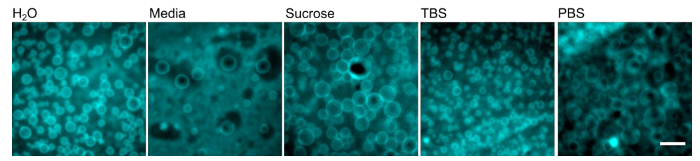
Figure 4. polymersomes peuvent se former dans une variété de différents tampons. Des films polymères PEO-PBD ont été réhydratés avec le tampon indiqué à 40 ° C pendant 1 heure. Barre d'échelle = 10 pm. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
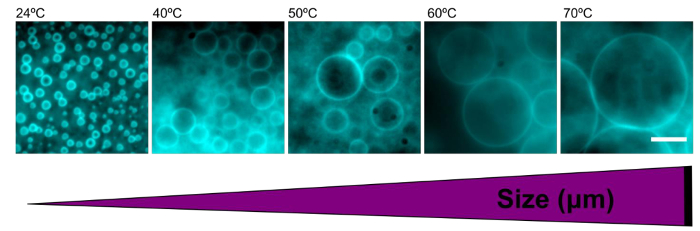
La Figure 5. L' augmentation de la température lors de la réhydratation augmente la taille des polymersomes. Épifluorescence images représentatives de polymersomes formés dans l' eau à la température de réhydratation indiquées. L'augmentation de température entraîne de plus grandes polymersomes. Barre d'échelle = 10 pm._blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
| Température (° C) | Taille moyenne (pm) |
| 24 | 2,93 ± 0,7 |
| 40 | 5,76 ± 2,5 |
| 50 | 6,65 ± 2,4 |
| 60 | 11,46 ± 5,8 |
| 70 | 14.04 ± 7,0 |
Tableau 1. L' augmentation de la température au cours des résultats de réhydratation en augmentation de la taille de polymersome. Diamètres moyenne pour plus de 100 polymersomes dans l' eau par différentes conditions de température ont été calculés et sont représentés ici. L'erreur est l'écart type.
Discussion
Polymersomes sont de plus largement étudiées en tant que mimétiques de la membrane biologique. Les propriétés robustes et polyvalents de polymères les rendent très attrayant pour les études nécessitant une fonctionnalisation de la membrane, la longévité et la réactivité à l'écoute. Les méthodes traditionnelles de formation de taille géante polymersomes 9,10 (> 4 um) sont de main-d'œuvre et nécessitent des équipements coûteux et spécialisés. Ici, nous présentons pour la première fois, une méthode rapide, polyvalent et robuste pour former polymersomes taille géantes en utilisant des réactifs de laboratoire peu coûteux et équipements standard.
En utilisant un gel de réhydratation assistée, polymersomes unilamellaires peuvent être formés rapidement (<30 min), dans une variété de solutions de réhydratation (y compris les milieux de culture cellulaire) et avec une variété de polymères différents (données non présentées). La formation de vésicules multilamellaires ou asymétriques n'a pas été observée en utilisant cette technique. Tout au long de ce travail, nous avons utilisé le poly (oxyde d'éthylène) - poly b- (butadiène) (PEO-PBM, EO 22 -BD 37) copolymère dibloc neutre. De nombreuses compositions de polymères différents (y compris les copolymères diblocs chargés) fonctionnent bien en utilisant cette méthode (non représenté). Cependant, certains copolymères triblocs disponibles dans le commerce et les copolymères de poids moléculaire élevé diblocs (~> 5000 Daltons) ne forment pas polymersomes distinctes. Pour toutes les expériences de ce manuscrit, une faible concentration de lipide marqué a été dopées dans les solutions de polymères uniquement à des fins de visualisation. D'autres procédés de visualisation, y compris les polymères fonctionnalisés directement avec un colorant fluorescent peuvent également être utilisés. Polymersomes peuvent également être visualisés en microscopie à champ clair, bien que la microscopie par fluorescence offre une plus grande résolution.
La plupart des modifications mineures au protocole généralement ne modifient pas les résultats. Par exemple, de petites différences dans la concentration de la solution de polymère étalé sur les lamelles ne modifient pas la formation du polymère film formé. Bien que la gamme de concentration complète n'a pas été déterminée, la formation de polymersome va se produire avec succès une large gamme de concentrations de films de polymère (par exemple, 1-10 mg / ml). Cependant, il y a quelques changements de protocole qui n'affectent négativement la formation polymersome. Le plus notable est que les lamelles de verre rondes (au lieu de carré) résultat en très mauvais formation de polymersomes. Nous attribuons cela à l'extrême, même couche d'agarose sur le verre qui empêche effectivement la formation de polymersomes.
L'un des défis les plus remarquables de cette technique est la possibilité de récupérer les polymersomes de la surface avec un rendement élevé. Il y a certains cas où la suppression des polymersomes de la surface d'origine peut être avantageux. En raison de la forte fluorescence de fond du film de polymère déshydraté, l'élimination polymersomes individuelles et les faire adhérer à nettoyer les lamelles augmente la qualité de l'imagerie et la caractérisation (particulièrement lors de l'analyse de FRAP). Pour ce faire, pipetage doux avec une pointe de pipette dans laquelle l'extrémité a été coupée va désorber les polymersomes de la surface (bien que le nombre de vésicules récupérées est significativement plus faible que ceux qui sont formés à l'origine). Polymersomes peuvent alors être placés sur des surfaces de lamelle modifiées, ce qui permet la polymersome d'interagir avec la nouvelle lamelle. Typiquement, pour les neutres polymersomes PEO-PBD, des lamelles couvre-traitée à l'ozone pendant 15 minutes permettent aux polymersomes de tomber vers le bas à la surface pour l'imagerie. Modification de surface différente est nécessaire pour différentes compositions de polymersome (par exemple, chargé négativement ou positivement les polymères).
La plupart des matériaux utilisés dans ce protocole sont stockés et utilisés avec succès pendant des jours ou des semaines. L'agarose solidifié peut être rebouillage et réutilisé jusqu'à ce que l'agarose commence à avoir des agrégats, même après l'ébullition, ou agarose solidifié commence à sécher. Lamelles avec des films d'agarose séchés peuvent être stockés et l'utilisationD indéfiniment (par exemple, des mois). Le polymère dissous dans le chloroforme peut être stocké à -20 ° C pendant plusieurs mois. Une fois le film de polymère est séché sur les films d'agarose, cependant, les films doivent être stockés sous le vide et utilisé dans les deux semaines (stockage à long terme n'a pas été déterminée directement, mais il existe des différences notables dans polymersomes formés à partir de films de polymère de plus de deux semaines).
En utilisant le protocole de réhydratation assistée gel présenté ici, des centaines de polymersomes-forme uniforme sont formés rapidement avec seulement quelques heures de travail en utilisant un équipement standard et réactifs de laboratoire peu coûteux. En outre, polymersomes peuvent être formés dans une variété de solutions de tampon physiologique et à partir de différentes compositions de polymère (non représenté). Des modifications mineures à la méthode ne modifient pas de façon négative la formation de polymersomes, ce qui rend la réhydratation assistée par un gel d' une technique souple et accessible aux scientifiques avec e variant techniquexpertise.
La possibilité de créer facilement polymersomes géants à l'échelle de la taille des cellules est essentielle pour la construction de systèmes analogues à des cellules artificielles. La facilité d'utilisation et la polyvalence de réhydratation assistée gel pour rendre ces polymersomes offre un énorme progrès dans le domaine biomimétique pour la création d'imite la membrane cellulaire robustes. Par exemple, en utilisant cette technique, les stratégies pour l'encapsulation des différents composants intracellulaires, fonctionnalisation du polymère avec des protéines et l'incorporation de protéines de transport membranaire membrane cellulaire, pour ne citer que quelques-uns, peuvent être conçus pour construire des cellules artificielles à base polymersome.
Déclarations de divulgation
Sandia National Laboratories is a multi-program laboratory managed and operated by Sandia Corporation, a wholly owned subsidiary of Lockheed Martin Corporation, for the U.S. Department of Energy's National Nuclear Security Administration under contract DE-AC04-94AL85000.
Remerciements
We would like to gratefully acknowledge Dr. Ian M. Henderson, Andrew Gomez and Dr. Walter F. Paxton for their technical expertise, advice and help in this work. This work was supported by the U.S. Department of Energy, Office of Basic Energy Sciences, Division of Materials Sciences and Engineering (BES-MSE). ACG, DYS and GDB were supported by BES-MSE. This work was performed, in part, at the Center for Integrated Nanotechnologies, an Office of Science User Facility operated for the U.S. Department of Energy (DOE) Office of Science (user project number RA2015A0004, PI: ACG).
matériels
| Name | Company | Catalog Number | Comments |
| 125 ml Erlenmeyer flask | VWR | 89000-360 | |
| 18 guage needle | VWR | BD-305196 | |
| 25 mm square coverslips | VWR | 48366-089 | |
| Agarose | Sigma | A9539 | A standard agarose for DNA gel electrophoresis |
| Chloroform | Sigma | 288306-2L | |
| Commerical coverwell | Electron Microscopy Sciences | 70336 | Press-to-Seal Silicone Isolators |
| Fiji Image Analysis Software | ImageJ | Free Download: http://fiji.sc/Fiji | |
| Glass vial with Teflon Lid | VWR | 66009-556 | 1.9 ml capacity, case of 144 |
| Liss-rhodamine B PE Lipid | Avanti Polar Lipids | 810150C | 1 mg of lipid at 1 mg/ml concentration in chloroform |
| Parafilm | VWR | 52858-000 | 10.2 cm x 38.1 m |
| poly(ethylene oxide)-b-poly(butadiene) or PEO-PBD (with a molecular weight of 2,940) | Polymer Source | P2904-BdEO | http://polymersource.com/dataSheet/P2904-BdEO.pdf |
| Pastic Petri Dish | VWR | 25384-092 | |
| Teflon tape | VWR | 300001-057 | 1/2" width |
Références
- Streicher, P., et al. Integrin reconstituted in GUVs: A biomimetic system to study initial steps of cell spreading. Biochim. Biophys. Acta. 1788 (10), 2291-2300 (2009).
- Paxton, W., Bouxsein, N. F., Henderson, I., Gomez, A., Bachand, G. Dynamic Assembly of Polymer Nanotube Networks via Kinesin Powered Microtubule Filaments. Nanoscale. , (2015).
- Bermudez, H., Brannan, A. K., Hammer, D. a., Bates, F. S., Discher, D. E. Molecular weight dependence of polymersome membrane structure, elasticity, and stability. Macromolecules. 35 (21), 8203-8208 (2002).
- Amos, R. C., Nazemi, A., Bonduelle, C. V., Gillies, E. R. Tuning polymersome surfaces: functionalization with dendritic groups. Soft Matter. 8 (21), 5947-5958 (2012).
- Egli, S., et al. Biocompatible functionalization of polymersome surfaces: A new approach to surface immobilization and cell targeting using polymersomes. J. Am. Chem. Soc. 133 (12), 4476-4483 (2011).
- Kim, K. T., Cornelissen, J. J. L. M., Nolte, R. J. M., Van Hest, J. C. M. A polymersome nanoreactor with controllable permeability induced by stimuli-responsive block copolymers. Adv. Mater. 21 (27), 2787-2791 (2009).
- Paxton, W. F., Price, D., Richardson, N. J. Hydroxide ion flux and pH-gradient driven ester hydrolysis in polymer vesicle reactors. Soft Matter. 9, 11295-11302 (2013).
- Henderson, I. M., Paxton, W. F. Salt, shake, fuse - Giant hybrid polymer/lipid vesicles through mechanically activated fusion. Angew. Chem. Int. Ed. 53 (13), 3372-3376 (2014).
- Discher, B. M. Polymersomes: Tough Vesicles Made from Diblock Copolymers. Science. 284 (5417), 1143-1146 (1999).
- Howse, J. R., et al. Templated formation of giant polymer vesicles with controlled size distributions. Nat Mat. 8 (6), 507-511 (2009).
- Horger, K. S., Estes, D. J., Capone, R., Mayer, M. Films of Agarose Enable Rapid Formation of Giant Liposomes in Solutions of Physiologic Ionic Strength Films of Agarose Enable Rapid Formation of Giant Liposomes in Solutions of Physiologic Ionic Strength. J. Am. Chem. Soc. , 1-24 (2009).
- Axelrod, D., Koppel, D. E., Schlessinger, J., Elson, E., Webb, W. W. Mobility measurement by analysis of fluorescence photobleaching recovery kinetics. Biophys. J. 16 (9), 1055-1069 (1976).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat meth. 9 (7), 676-682 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon