Method Article
以下のための遺伝学的および生化学的アプローチ
要約
Oligomerization of the ryanodine receptor, a homo-tetrameric ion channel mediating Ca2+ release from intracellular stores, is critical for skeletal and cardiac muscle contraction. Here, we present complementary in vivo and in vitro methods to detect protein self-association and determine homo-oligomer stoichiometry.
要約
Oligomerization is often a structural requirement for proteins to accomplish their specific cellular function. For instance, tetramerization of the ryanodine receptor (RyR) is necessary for the formation of a functional Ca2+ release channel pore. Here, we describe detailed protocols for the assessment of protein self-association, including yeast two-hybrid (Y2H), co-immunoprecipitation (co-IP) and chemical cross-linking assays. In the Y2H system, protein self-interaction is detected by β-galactosidase assay in yeast co-expressing GAL4 bait and target fusions of the test protein. Protein self-interaction is further assessed by co-IP using HA- and cMyc-tagged fusions of the test protein co-expressed in mammalian HEK293 cells. The precise stoichiometry of the protein homo-oligomer is examined by cross-linking and SDS-PAGE analysis following expression in HEK293 cells. Using these different but complementary techniques, we have consistently observed the self-association of the RyR N-terminal domain and demonstrated its intrinsic ability to form tetramers. These methods can be applied to protein-protein interaction and homo-oligomerization studies of other mammalian integral membrane proteins.
概要
骨格筋および心筋の収縮はのRyRにより媒介筋小胞体のCa 2+放出によって誘発されます。 4つの同一のサブユニットから成る機能チャネルと3の哺乳動物のRyRアイソフォームがあります。それぞれのRyRサブユニットは、大きな細胞質調節N末端 部分及び高コンダクタンスの Ca 2+の細孔を形成する膜貫通ドメインを含む小さなC末端部分から成ります。異常内およびサブユニット間相互作用は、のRyRチャネルの機能障害の根底にある神経筋や心臓障害1になります。 RyR構造に関与する特定のドメインの同定および特徴:機能の関係はのRyRの病態生理の理解のために、したがって重要です。
伝統的な生化学的タンパク質 - タンパク質相互作用の技術は、多くの場合、細菌中で産生され精製されたタンパク質の実質的な量を、必要とします。これはのRyR、非常に大きな膜pの場合には現実的ではありませんその組換えフラグメントが細菌発現および精製が容易に受け入れられないのに対し、〜5000個のアミノ酸からなるrotein。したがって、真核生物宿主細胞を含む代替的な発現系は、哺乳動物の内在性膜タンパク質のために必要とされます。我々は以前、まとめN末端 の四三の哺乳動物のRyRが2,3アイソフォーム間で保存されている構造的特徴であることを実証するためにY2H、共同IPおよび架橋アッセイを採用しています。重要なことは、我々は催不整脈性心疾患に関連した単一点変異は、N末端 の自己会合および機能不全のRyRチャネル4の結果を破壊することを見出しました。我々はまたのRyR細胞質のC末端尾部5と同様に、相同細胞内Ca 2+放出チャネル、イノシトール1,4,5-トリスリン酸受容体2のN末端 のオリゴマー化の研究にこれらの技術を適用しています。
Y2Hアッセイでは、interacti二つのタンパク質(XとY)の間に機能的な転写因子(GAL4)およびレポーター遺伝子6-9の続く活性化を再構成することによって測定されます。 DNA結合ドメイン(DNA-BD)/タンパク質Xの融合(ベイト)と活性化ドメイン(AD)/タンパク質Y 2つの異なるクローニングベクターは、GAL4の2つの物理的に分離、独立したドメインを有する2つの試験タンパク質の融合体を生成するために使用されます融合(ターゲット)。 Y2Hタンパク質がGAL4 DNA-BDと同じタンパク質のAD融合物を生成することによって、それ自体と相互作用するかどうかをテストするために使用することができます。遺伝的に改変されたY2H株はGAL4とGAL80欠損(GAL80タンパク質がGAL4のリプレッサーである)、ならびにTRP1およびLEU2が欠損(それぞれ、ベイトおよびプレイプラスミドのための栄養選択を提供するために)です。酵母核に、組換えDNA-BDとADペプチドは唯一の彼らの融合 'Xを通じてハイブリッドGAL4転写因子を生成するために物理的に近接させられる:Y int型eraction。このアプローチは、レポーター遺伝子(β-ガラクトシダーゼ(β-Gal)のためのLacZ符号化)と発色性(ヒスチジン生合成に必要な酵素のHIS3エンコーディング )原栄養の並列転写活性化を介してタンパク質-タンパク質相互作用を検出するための迅速な遺伝子スクリーニングを可能にします。 Y2Hの主な利点は、それが弱いまたは一過性のタンパク質-タンパク質相互作用を検出するin vivoアッセイであることです。また、検出は、餌と対象タンパク質の精製または特定の抗体の生成を必要とせず、簡単な(メディアヒスチジンを欠く中で)増殖選択の使用または比色の(β-Galの)アッセイを伴います。また、Y2Hはまた、ライブラリーのタンパク質のcDNAへの直接アクセスを与えるベイトタンパク質の新規の結合パートナー、ランダム未知のクローン(GAL4 ADに融合したcDNAライブラリークローン)のコレクションをスクリーニングすることができます。
Y2H観測を拡張するために、INDEPENDENT生化学的技術を使用することができます。共IP及びイムノブロッティングと組み合わせた架橋アッセイは、複雑なサンプル混合物中のタンパク質の関連を検出するために用いられる方法、 例えば 、全細胞溶解物10です。それらの主な利点は、組換えタンパク質の使用を必要とする他の方法とは異なり、天然の組織からのタンパク質 - タンパク質相互作用について報告することです。組換えタンパク質は、典型的には、彼らが正しいコンホメーションおよび翻訳後修飾を有する可能性がある哺乳動物細胞株、ならびに細胞内局在性に発現し、また使用することができます。共IPと架橋がインビトロアッセイは、均質化細胞を利用しているので、2つのタンパク質パートナーは、無傷の細胞11に共局在しているかどうかを確認する必要があります。我々は日常的に一過性リン酸カルシウム沈殿法2を用いて、哺乳動物の内在性膜および細胞質タンパク質を発現する哺乳動物HEK293細胞のトランスフェクションを使用し-4,12-14は、詳細にここで説明しました。これは、効率的に細胞内にプラスミドDNAを送達するための安価な方法ですが、それは特定の使用の細胞株および細胞コンフルエンスと同様に、プラスミドDNA 11,15の純度に依存しています。
共IPアッセイは、推定上の相互作用パートナー10,16の同時精製を可能にする非変性条件下での細胞溶解物からの関心の天然または組換えタンパク質の単離を伴います。タンパク質は、2つの異なるエピトープを有する2つの異なる融合物を生成することによって、それ自体と相互作用するかどうかをテストするために使用することができる2つの独立した抗体の使用、タンパク質Xの単離のための免疫沈降用抗体、およびタンパク質パートナーYの検出のためのイムノブロッティング抗体を必要としますタグ( 例えば 、HAおよびCMYC)。免疫沈降抗体は、プロテインAには、そのFc領域を介して結合した(プロテインG、抗体が発生した動物種に応じてか)されていますアガロース(またはセファロース)樹脂に結合しています。タンパク質Xは、抗体により沈殿させる:タンパク質 - 樹脂細胞溶解物、均質化された細胞の、すなわち界面活性剤可溶性分画とのインキュベーション後。タンパク質の免疫複合体は、SDSを含む緩衝液で溶出させ、続いてタンパク質Y 17の存在を検出するために抗体を用いるSDS-PAGEおよびイムノブロッティングにより分析します。共IPは、過剰非特異的結合を回避するために、界面活性剤、水溶性タンパク質を用いて実施されるべきです。 Y対10,16,18:洗剤とその濃度の選択だけでなく、洗浄回数は、各X用に最適化されるべきです。
架橋は、オリゴマータンパク質複合体の化学量論を決定するために使用されます。これは、隣接する相互作用プロトマーの間に共有結合を生成する化学反応に基づいており、従って、それはSDS-PAGEの分離の際、タンパク質のオリゴマー状態の保存を可能にします。多数の架橋レアージュがありますタンパク質、典型的には、第一級アミン、カルボン酸またはチオール基に異なる反応基をターゲットに様々な長さと化学のNTS。ここでは、(OHC(CH 2)3 CHO)、リジン残基19,20中に存在する遊離アミノ基と反応するいずれかの端部に2つのアルデヒド基を有するホモ二官能性架橋剤がグルタルアルデヒドの使用を記載しています。架橋は、付加物形成をもたらす濃度 - または時間依存的な様式で行われます。グルタルアルデヒドの反応は、ヒドラジン(H 2 NNH 2)で停止し、タンパク質試料をSDS-PAGEによって分析し、それらのオリゴマー化状態を評価するために17を免疫ブロッティングしています。私たちは、架橋がオリゴマー化を誘導するが、単に既存のタンパク質複合体との間で安定したブリッジを作成していないことに注意してください。架橋実験を実施する重要な考慮事項は、架橋剤の選択は、その濃度と反応時間19,20を含みます。
プロトコル
1.酵母ツーハイブリッド
- 酵母形質転換
- 次のメディアとバッファを準備します。
- が20g / Lペプトン、を10g / L酵母抽出物、の2%w / vのグルコース(オートクレーブ後に添加)および20グラム/ Lの寒天を混合することによって、酵母完全酵母抽出物 - ペプトン - デキストロース(YPD)培地を調製し(プレートのみ) ;オートクレーブで滅菌し、実験の日に新鮮なを使用しています。
- 酵母窒素ベース、1.6グラム/ロイシンおよびトリプトファンを欠くLドロップアウトサプリメント、2%wの6.7グラム/ Lを混合することにより(SD)培地(餌とターゲットプラスミドの両方で選択圧を維持するためにロイシンおよびトリプトファンを欠く)定義された酵母最小の合成を準備します(のみ板用)(オートクレーブ後に添加)/ vのグルコースとは20g / Lの寒天。オートクレーブで滅菌し、実験の日に新鮮なを使用しています。
- PEG(ポリエチレングリコール)3350 w / vの50%を準備します。室温で0.2μmのフィルターとストアを介して滅菌します。
- 100 mMトリス/ 10mMのEDTA(10×TE)を準備し、調整7.5のpHは、室温で0.2μmのフィルターとストアを介して滅菌します。
- 1 M酢酸リチウム(10×LiAc形質)を準備。室温で0.2μmのフィルターとストアを介して滅菌、CH 3 COOHで7.5にpHを調整します。
- YPDプレート上に凍結グリセロールストックを少量ストリーキングによってY2H株( 例えば、Y190)をリバイブ。酵母コロニーは直径〜2ミリメートルに達するまで30℃でインキュベートする(通常3から5日間、酵母株に依存)。
- コロニー - (直径3mm 2)単一の大規模で(1.5mlチューブ中)YPDの0.5ミリリットルを接種します。任意の塊を分散させる〜2分間激しくボルテックス。
- 50ミリリットルYPD培地を含む500mlフラスコに細胞懸濁液を転送します。定常期に到達するために酵母を250 rpmで振盪しながら18時間 - 16、30℃でインキュベートします。
- 転送4 - (1L三角フラスコ中)YPD 200mlに一晩培養物5mlを600nmで(OD 600での光学密度を生成するために、測定されました0.2の分光光度計)を使用して - 0.3(200ミリリットル)は20変換のために十分であろう。
- 細胞が中期対数期になるまで、250 rpmで振盪しながら30℃でインキュベートし、 すなわち 、OD 600 = 0.5から0.6まで(通常2から3時間)。
- 室温で5分間、1500×gで(50mlチューブで)遠心分離によって収穫酵母。 、上清を捨て一緒に滅菌H 2 Oおよびプールの5ミリリットルに各ペレットを再懸濁します。
- 室温で5分間、1500×gで遠心分離-Reおよび上清を捨てます。新たに調製し、滅菌1×LiAc形質/ TE 1ml中に再懸濁酵母ペレット。
注:準備の1時間以内に有能な酵母細胞を使用してください。 - 単一の変換のためのプラスミドDNAの200 ngのを追加することにより、(1.5 mlチューブで)プラスミドサンプルを準備し、または0.5 - 同時変換の各1μgのプラスミドDNA、および100μgのニシン精巣のキャリアDNAの(20分間煮沸し、上の冷却使用直前に氷)。
注: 例えば 、陽性対照を含め、酵母PVA3(p53タンパク質とGAL4 DNA-BD融合に符号化)とPTD1(SV40ラージT抗原とのGAL4 AD融合に符号化)で同時形質転換。 - 以下のための新たに調製し、有能な酵母懸濁液(ステップ1.1.8)を100μlおよび1×LiAc形質/ PEG溶液の600μlの(株式の8ミリリットルPEG 3350、株式TEの1ミリリットル、株式LiAc形質の1ミリリットル)、および渦を追加〜30秒。 200 rpmで振盪しながら30℃で30分間インキュベートします。
- ジメチルスルホキシド(10%v / vの最終濃度)の80μl加え、穏やかに反転させてよく混ぜます。 3分 - 42℃の水浴中で15分間熱ショックを毎2を混合しました。
- 酵母を回収するために室温で15秒間、14,000×gで2分間遠心分離するために氷上で細胞懸濁液を冷却。
- (餌とターゲットプラスミドの両方で選択圧を維持するために欠く培地ロイシン及びトリプトファン)選択的成長のための適切な最小限のSD培地プレート上に1×TEとプレートの100μl中に再懸濁細胞ペレット。
- 30でアップサイドダウンプレートをインキュベート( - 5日、通常4)コロニーは直径〜2ミリメートルになるまでC°。プレートは2のために4℃で保存することができます - 3週間。長期保存のために-80℃でグリセロールストックとストアを作ります。
注:その餌とターゲットタンパク質が17を免疫ブロット法により酵母で発現していることを確認し、別途酵母で発現した場合(第1.3節で説明したように、β-galアッセイによって)彼らは自律レポーター遺伝子の活性化を持っていないこと。
- 次のメディアとバッファを準備します。
- コロニーリフトフィルターペーパーのβ-Galのアッセイ
- 以下の緩衝液を準備します。
- 100mMのNa 2 HPO 4、40mMののNaH 2 PO 4、10mMの塩化カリウム、1mMの硫酸マグネシウムを含むZバッファを準備します。 pHを7.4に調整します。 RTでオートクレーブ処理し、ストアによって滅菌します。
- -20℃で暗所でN、N-ジメチルホルムアミド、店舗、N中の20mg / mlの5-ブロモ-4-クロロ-3-インドリルβ-D-ガラクトピラノシドを溶解させることによってX-Galのバッファを準備します。 Zバッファ/ X-Galの溶液を調製します。バッファを作りますZバッファに0.27%v / vのに0.33 mg / mlとし、βメルカプトエタノールでのX-galを混合して使用する前に。サンプルあたり2.5ミリリットルを使用してください。
- セルロース濾紙内部クリーン100ミリメートルプレートと所定の位置に新たに調製したZバッファ/ X-Galの溶液を2.5ミリリットルを追加します。
- 酵母コロニーがアッセイされると、プレートの表面上に新しいろ紙を置きます。静かにピンセットでプレート上にろ紙をこすると接続するためのコロニーについて〜5分間のままにします。
注:。 すなわち 、並列に陽性コントロールを処理し、酵母PVA3とPTD1で同時形質転換。 - (;常に厚い手袋とゴーグルを着用し、液体窒素は注意して取り扱ってください)ろ紙を持ち上げ、30秒間液体窒素のプールに(鉗子で)それを沈めます。 〜2分間、室温で凍結したろ紙の解凍をしてみましょう。
- 100ミリメートルプレート内部で予め浸漬濾紙の上にろ紙(コロニー側を上にして)を配置し、そして30℃でインキュベートします。
- 定期的に調べます青色のコロニーの外観(毎〜30分)。酵母Y190陽性コントロールプラスミド(PVA3 + PTD1)で同時形質転換は、60分(未発表の観察)内で青色に変わります。
注:弱い餌:標的相互作用は、(偽陽性の結果を与える可能性があり長時間のインキュベーション(> 8時間を避けるため))正の青色信号を生成するために数時間かかることがあります。最良の結果を得るために、新たに同時形質転換コロニー、 すなわちを使用し 、4 30℃で増殖させた- 。直径〜2ミリメートル、5日間。
- 以下の緩衝液を準備します。
- 液体培養β-Galのアッセイ
- 以下の緩衝液を準備します。
- 100mMのNa 2 HPO 4、40mMののNaH 2 PO 4、10mMの塩化カリウム、1mMの硫酸マグネシウムを含むZバッファを準備します。 RTでオートクレーブ処理し、ストアによって滅菌、pHを7.4に調整します。
1 MのNa 2 CO 3;室温で保管してください。 - Zバッファ/βメルカプトエタノールを準備します。 0.27パーセントのV /にβメルカプトエタノールを添加することにより、使用する前にバッファを作りますZバッファ内のV;サンプルあたり700μLを使用しています。 Zバッファ/ ONPG溶液を調製します。前バッファはZバッファでV / V 0.27パーセントで4 mg / mlとし、βメルカプトエタノールでONPG(o-ニトロフェニルβ-D-ガラク)を混合して使用するようにしてください。サンプルあたり160μLを使用しています。
- 100mMのNa 2 HPO 4、40mMののNaH 2 PO 4、10mMの塩化カリウム、1mMの硫酸マグネシウムを含むZバッファを準備します。 RTでオートクレーブ処理し、ストアによって滅菌、pHを7.4に調整します。
- 250 rpmで振盪しながら18時間 - 最小のSD培地の5ミリリットル(餌とターゲットプラスミドの両方で選択圧を維持するために、ロイシンおよびトリプトファンを欠く)を接種し、16、30℃でインキュベートし、単一のコロニーを使用してください。
注:アッセイ5つの別々のコロニー同じ餌とターゲットプラスミドで同時形質転換。 - 0.3 - OD 600 = 0.2を生成するために、新鮮なSD培地10mlに一晩培養物を十分に転送します。細胞が対数中期( - 0.6 OD 600 = 0.5)になるまで、250 rpmで振盪しながら30℃でインキュベートします。
- RTで2分間、14,000×gで1.5ミリリットルチューブと遠心分離機に酵母培養物の0.5ミリリットルを転送します。 CEを収穫するとき、正確なOD 600を記録LLS。 Zバッファの100μlの中でペレットを再懸濁し、これは、5倍の濃縮係数をもたらします。
- そしてその後、37℃の水浴中で3分解凍するために、液体窒素に入れチューブは〜1分間(常に厚手の手袋とゴーグルを着用し、液体窒素の注意を払って処理する必要があります)。細胞がオープン壊れていることを確認するために二回以上、この凍結融解サイクルを繰り返します。
- Zバッファー100μlで素管を設定します。
- Zバッファ/βメルカプトエタノールおよび/ ONPGサンプルとブランクのチューブにZバッファの160μlの700μlのを追加します。 30℃のインキュベーター中でタイマーと場所を開始します。
- 黄色が開発するために定期的に確認してください。発色を停止し、分単位での経過時間を記録するために1 MのNa 2 CO 3400μlのを追加します。酵母Y190陽性コントロールプラスミド(PVA3 + PTD1)で同時形質転換は、60分以内に黄色になります..
注:弱い餌:標的相互作用は、最高の再については正の黄色信号を生成するのに数時間かかる場合がありますsultsは、新たに同時形質転換したコロニーを使用し、すなわち 、4 30℃で増殖させた- 。5日〜直径2mm。 - 細胞破片をペレット化し、きれいなキュベットに上清を転送するために室温で5分間、14,000×gで遠心分離します。
- 分光光度計を使用して、( - 1.0 0.02の間であるべきである値)ブランクと比較したサンプルの420 nmの(420)での吸光度を測定します。
- 次の式に従って、O-ニトロフェノールおよびセル当たり毎分D-ガラクトースにONPGの1マイクロモルを加水分解する量として定義された1単位で、βガラクトシダーゼ単位を計算します。
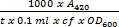 =βガラクトシダーゼユニット
=βガラクトシダーゼユニット
ここで、T:(分)のインキュベーションの経過時間。 CF: すなわちステップ1.4.8から濃縮係数、CF = 5;。 OD 600:細胞を回収しました。
- 以下の緩衝液を準備します。
哺乳動物細胞株で2タンパク質発現
- 哺乳動物細胞のトランスフェクション
- 次のメディアとバッファを準備します。
- 4.5g / Lグルコース、10%v / vのウシ胎児血清および2mM L-グルタミンを含むDMEMを混合することにより、増殖培地を準備。 4℃で0.2μmのフィルターとストアを介して滅菌します。
- 280ミリモルのNaCl、10mMの塩化カリウムを混合して2×Hepes緩衝生理食塩水(2×HBS)の調製1.5ミリモルのNa 2 HPO 4、12mMのグルコース、50mMのHEPES。 、7.05のpHを調整し、-20℃で0.2μmフィルターとストアを介して滅菌します。 -20℃で0.2μmフィルターとストアを介して、2.5MのCaCl 2滅菌を準備します。
- 60から70パーセントのコンフルエント次の日であるために100ミリメートルペトリ皿中の2×10 6 HEK293細胞-トランスフェクションの1日、シード1の前に。 5%CO 2の加湿インキュベーター中、37℃で18時間- 16のための文化。
- トランスフェクションの日に、新鮮な増殖培地10mlで古い培地とフィード細胞を除去します。
注意:これらは、細胞死を増加させることができるので、抗生物質は、トランスフェクション時に、培養培地から省略されています。 - 1.5ミリリットルチューブの内側(滅菌脱イオンH 2 Oで作られた)600μlの総容量(コトランスフェクション、二つのプラスミドの等モル比のために)プラスミドDNAの24μgのを希釈し、2.5 MのCaCl 260μlの。渦が混合します。
注:最高のトランスフェクション効率のために、プラスミドDNAは、最高純度のものでなければならない、 すなわち 、ABS 260 / ABS 280比=〜1.8を持っています。 - 常に激しくボルテックスで混合しながら2倍HBSの600μLを含む50 mlチューブに滴下し、プラスミドDNA /カルシウム溶液を追加します。リン酸カルシウム/プラスミドDNA複合体の形成を可能にするために室温で20分間インキュベートします。
- 20分間インキュベートした後、簡単にボルテックスし、溶液を100mmペトリ皿の全表面積を覆うように細胞に滴下し加えます。
- 5%CO 2中37℃で細胞をインキュベート 2。 〜6時間後に戻ってインキュベーター内で増殖培地と場所を変更します。
- 室温で3分間千×gの遠心分離により細胞を24時間トランスフェクション後に収穫し、上清を捨てます。必要になるまで細胞ペレットを-80℃で保存することができます。
注: - 72時間後、トランスフェクション発現は通常24をピーク。
- 次のメディアとバッファを準備します。
- 細胞均質化
- 以下の緩衝液を準備します。
- 150mMのNaCl、20 mMトリスを混合することにより、共同IPの均質化緩衝液を準備します。 pHを7.4に調整し、4℃で保存します。
- 5mMのヘペス、0.3 Mショ糖を混合することにより架橋均質化緩衝液を準備します。 pHを7.4に調整し、(任意の粒子を除去するために使用前にフィルター)、4℃で保存します。使用前にプロテアーゼ阻害剤を補足します。
- 1.5ミリリットルチューブの内側 - (600ミクロン425)と均質化緩衝液500μlで洗浄したガラスビーズ250μlのを追加します。短時間の遠心分離によってペレットガラスビーズパルス(5秒間千XG)、上清を除去します。もう一度この洗浄ステップを繰り返します。
- 氷冷均質化緩衝液500μl中(ステップ2.1.8から)再懸濁細胞ペレットとガラスビーズを含有するチューブに細胞懸濁液を転送します。
- 1ミリリットル注射器に取り付けられた細い針を介して、20継代(23 G、0.6×30ミリメートル)で氷上で細胞をホモジナイズします。チューブキャップを針で貫通それを介して、閉じたガラスビーズを介して激しく細胞懸濁液を分散させると。
- 4℃で10分間、1500×gで遠心分離し、核および破壊されていない細胞を除去し、ペレットを廃棄します。ポスト核分画を表す上清を保存し、共同-IPにまたはのような適切な架橋直接進みます。
- 以下の緩衝液を準備します。
3. インビトロ生化学的方法
- 免疫共沈降
- 以下の緩衝液を準備します。
- 秒で説明したように共同のIP均質化緩衝液を準備しますection 2.2.1.1。 20mMのトリス、150mMのNaCl、0.5%を混合することにより、IP緩衝液を調製(w / v)のCHAPS、2mMのジチオスレイトール(任意;ジチオスレイトールは、空気酸化に形成されている可能性があり、タンパク質凝集を減少させるために含めることができます)。 pHを7.4に調整し、4℃で保存します。
- 共同IPの均質化緩衝液中のV CHAPS / wの2%を準備。 4℃で保存します。
- 0.01%ワット/ブロモフェノールブルーV、2%(v / v)のβメルカプトエタノール(オプション)SDS、10%(v / v)のグリセロール、5mMのEDTA、w / vの60 mMトリス、2%を混合することにより、タンパク質ローディングバッファーを準備します。 pHを6.8に調整し、室温で保存します。
- 2.2節で説明したようにコンフルエント100ミリメートルペトリ皿(血球計数器を使用して数え〜8×10 6細胞HEK293場合、)から細胞をホモジナイズします。
- 絶えず混合しながら4℃で≥2時間、0.5%(2%ストックを使用して)CHAPSおよびインキュベーションとポスト核サブ細胞画分を可溶化します。不溶性materiをペレット化するために4℃で10分間20,000×gで遠心分離アルとは、ペレットを捨てます。上清と呼ばれる細胞溶解物を保存します。
注:洗浄剤と不溶性物質の除去を含めることは、非特異的結合を最小にするために絶対に必要です。中間体洗浄剤は、 例えば 、CHAPSまたはトリトンX-100は、0.2の濃度で、 - 1%、最も一般的に使用されます。 - 6 mg / mlでプロテインAまたはプロテインGアガロース(またはセファロース)ビーズの(IgG結合容量に応じて)二つの別々の1.5ミリリットルのチューブを準備し、〜20μlを添加します。 IP緩衝液200μlで洗浄します。
注:免疫沈降抗体を上昇させるために使用される動物種に応じて適切なのIg結合樹脂を選択してください。プロテインGは、プロテインAと比較したIgサブタイプのより広い範囲をバインドします。 - 4℃で2分間、1500×gで遠心分離することによってビーズを回復。 IP緩衝液で1回以上繰り返して洗浄し、IP緩衝液200μlでビーズを再懸濁します。
- (に免疫沈降抗体または非免疫IgGの1μgの(5 ngの/μl)を追加します。二つの別々のプロテインA / G含むチューブのようなネガティブコントロール)を提供しています。一定に混合しながら4℃で≥2時間インキュベートします。
注:必ず、免疫沈降抗体と同じ動物種で提起された非免疫IgGを用いたネガティブコントロールを処理します。 - 4℃で2分間、1500×gで遠心分離することによってビーズを回収し、注意深くピペッティングにより上清を捨てます。
- 抗体とプロテインA / Gビーズと2本のチューブのそれぞれに(ステップ3.1.3から)細胞溶解物の200μlのを転送します。抗原 - 抗体結合を可能にするために、一定に混合しながら4℃で≥2時間インキュベートします。
- ビーズを回収し、IP緩衝液200μlで洗浄します。混合しながら4℃で10分間インキュベートします。ビーズを回復し、(特異的および非特異的結合の両方を削減する複数回の洗浄を避ける)を2回以上を洗います。ピペットで注意深く上清を捨てます。
- immunoprecipitを溶出するタンパク質ローディング緩衝液30μlを追加atedタンパク質。 4°Cで2分間1500×gで遠心分離し、ビーズを破棄し、溶出した共同IPサンプルを含む上清を保存します。
- 成功したタンパク質X沈殿を確認するには、一定分量を含めるタンパク質Xの特異的な抗体と17をイムノブロッティングによって分析されるSDS-PAGEゲル上での共同のIP少量のサンプル(1/10、3μl)を読み込みます細胞溶解物は、試料中のタンパク質Xの発現を確認します。
- 独立したSDS-PAGEゲル上で共同IPサンプルの残り(9/10 番目 、27μl)をロードし、共沈タンパク質Yの存在をテストするには、タンパク質、Yに特異的な抗体と17をイムノブロッティングにより分析しますあなたの試料中のタンパク質Yの発現を確認するために、細胞溶解物のアリコートを含めます。
- 以下の緩衝液を準備します。
- 化学架橋
- 以下の緩衝液を準備します。
- セクション2.2.1.1で説明したように均質化緩衝液を架橋します。
- 5倍Pを準備SDS、50%(v / v)のグリセロール、0.05%重量/容量ブロモフェノールブルー、10%(v / v)のβメルカプトエタノール(オプション)25mMのEDTA、w / vの、10%を300 mMトリスを混合することによりroteinローディング緩衝液; pHを6.8に調整し、室温で保存します。使用前に50℃で暖かいです。
- 2.2節で説明したようにコンフルエント100ミリメートルペトリ皿(血球計数器を使用して数え〜8×10 6細胞HEK293場合、)から細胞をホモジナイズします。
注:スクロースは(0.3Mで)等浸透バッファを作成するために使用されます。塩は、 例えば 120 - 150mMのNaClまたはKClを関心のオリゴマータンパク質複合体に依存して、代わりに使用することができます。 - タンパク質凝集体をペレット化し、上清を保存するために、4℃で10分間20,000×gでポスト核サブ細胞画分を遠心。別々の0.5ミリリットルチューブに(典型的にはタンパク質の〜20μgの)20μlの各の8アリコートを取ります。
- 0.0025パーセント(v / v)のグルタルアルデヒドは、すべてのサンプルに追加し、タイマーを開始します。 8個のサンプルのそれぞれがglutaraldと反応してみましょうRTでehyde:0、2、5、10、15、20、30、60分。
注:グルタルアルデヒドは遊離アミンと反応する2アルデヒド基を有します。彼らはグルタルアルデヒドの反応を停止するので、第一級アミノ基とpH緩衝液または他の物質を使用しないでください。 - 2%(v / v)のヒドラジンと、指定した時刻にグルタルアルデヒドの反応を停止し、タンパク質を変性するために5倍のタンパク質ローディングバッファーの5μlを添加します。
- SDS-PAGEおよびイムノ17に進んでください。
- 以下の緩衝液を準備します。
結果
Y2Hシステムでは、餌は:餌の相互作用は、最初に(トリプトファン、ロイシンなど)、ヒスチジンを欠く培地中で酵母の増殖の選択によって試験され、その後、β-GAL酵素活性アッセイ( 図1)によって評価しました。獲物タンパク質相互作用:中ヒスチジンを欠く中で培養した酵母は、餌の強さに依存遅い成長率を持っています。 β-Galのアッセイは、(のみトリプトファンおよびロイシンを欠く培地で培養)酵母で行わいずれか後者の収量定量結果で、(寒天プレート)固体支持体上または液体培地で成長しています。我々は成功したRyR2内のドメイン-ドメイン相互作用だけでなく、新規タンパク質パートナー2-4,12,21,22を識別するためにY2Hを使用しています。例えば、我々は、N末端断片との相互作用のためのRyR2ペプチド配列の全長にわたる構築重複する一連のスクリーニング(AD4L:のRyR2残基1 - 906のGAL4 ADと融合)3コロニーリフトフィルター紙β-GalのアッセイはBT4Lのための鮮やかな青色の酵母コロニー産:AD4Lペア( 図2A)を 、AD4L自体と相互作用することを示す、すなわちBT4Lは(RyR2の残基1構築- GAL4と融合906 DNA-BD)。淡い青色のコロニーがBT8のために検出されました:極端なC末端ドメイン(BT8)との二弱い関連を示唆AD4Lペア、酵母、他の構築物で同時形質転換は、餌のための白、したがって、負のままであった:獲物タンパク質相互作用。液体β-Galのアッセイ( 図2B)で得られた定量的結果は、堅牢なBT4Lを示した:AD4L相互作用同等の強度でp53タンパク質(PVA3)およびSV40ラージT抗原(PTD1)間の既知の関連を、BT8に対し:AD4L相互作用を(<10%を対照と比較して)かなり弱かったです。
私たちは日常的に共同-IP実験( 図3)は、fを行いますY2H所見2-4,12-14,21-24を強化するための独立した生化学的ア ッセイとして、哺乳動物細胞株(HEK293)での一過性発現をollowing。 RyR2のN末端の自己相互作用を確認するために、RyR2の残基1をコードする二つの別々のプラスミド - CMYCまたはHAペプチドエピトープ(それぞれBT4L及びAD4L)のいずれかでタグ付け906は、リン酸カルシウム沈殿法を用いてHEK293細胞に同時トランスフェクトしました。 3。均質化した細胞の後の核画分を洗剤CHAPSで可溶化し、そして不溶性物質を、細胞溶解物を生成するために遠心分離によって除去しました。還元剤ジチオスレイトールで処理された細胞溶解物を、その後、HAタグ付きAD4Lを免疫沈降抗体HAおよびプロテインAセファロースビーズとインキュベートしました。 SDSを含む緩衝液で溶出共IP試料は、R、二つの別々のSDS-PAGEゲル(1/10と9/10 番目の分割)にロードおよびAB HAおよびAB CMYCを用いたイムノブロッティングにより分析しましたespectively。アブHAによるAD4Lの成功直接IP(〜100 kDa)がなく、非免疫ウサギIgG( 図4A)を使用して、負の制御では、イムノブロット法により確認しました。重要なことは、CMYCタグ付きBT4L(〜100 kDa)がなく、免疫沈降AD4L( 図4B)の不在下での負の制御では、唯一の抗体HA IPで回収しました。
Y2Hと共同IPアッセイは、RyR2のN末端の自己相互作用のための一貫性のある証拠を提供し、彼らはそれが唯一の二量体以上の複合体を形成する、すなわちかどうか、N末端ドメインのオリゴマー化状態に通知しませんでした。複合体が解離することに留意すべきであるとのみからなるサブユニットは、タンパク質 - タンパク質相互作用を廃止するためにSDS-のSDS-PAGE及び熱誘導タンパク質の変性によって検出されます。これを克服するために、我々は、化学的安定既存proteiをconjoins架橋( 図5)を使用しその分子量をSDS-PAGEのサイズ分離2-5で調べることができ、n個のオリゴマー、。例えば、還元剤ジチオスレイトールで処理CMYC-BT4Lを発現するHEK293細胞ホモジネートを、グルタルアルデヒドと反応し、抗体CMYC( 図6)を使用して、SDS-PAGEおよびイムノブロッティングによって分析しました。単量体(〜100 kDaの)に加えて、〜400キロダルトンの高分子量タンパク質バンドを、RyR2のN末端 の四量体の形成3を示し、時間依存的に検出されました。特に、四量体は、最小限の二量体と観察トリマーバンドで、優勢なオリゴマー種でした。 15%勾配SDS-PAGEゲル3 -その見かけの分子量を決定するために、BT4Lオリゴマーは4を介して分離しました。私たちは30の範囲でタンパク質スタンダードを用いた分子質量/ゲル遅延標準曲線生産 - 460 kDaのを、私たちは358 kDaで15であることがオリゴマーを算出した(n = 4)。この見かけの分子量は、内に配置さBT4L四量体と一致していますネイティブのRyR2チャネル内の4つのサブユニットの配列から予想されるように、むしろ直線状に比べて円形のファッションを閉じました。
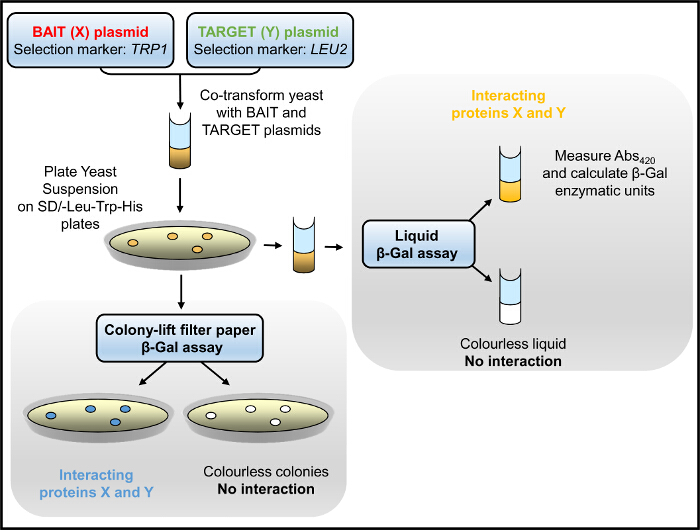
図1. Y2Hフローチャート。酵母、同時形質転換餌とターゲットプラスミドで、培地ヒスチジンを欠く中で成長するために選択および/ またはβ-Galの酵素活性についてアッセイされる。 この図の拡大版をご覧になるにはこちらをクリックしてください。
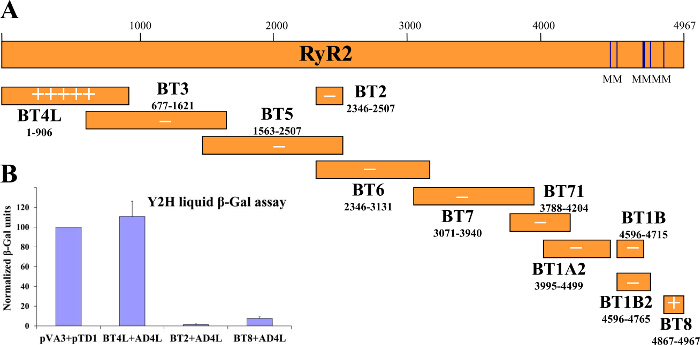
図2. Y2Hは、RyR2のN末端 ドメインの自己相互作用を示唆している。ためにY2H系で試験したヒトのRyR2重複タンパク質断片の(餌)シリーズを描いた(A)の回路図 RyR2のN末端AD4L(獲物)との相互作用が構築します。コロニーリフトフィルター紙β-Galのアッセイによって得られた定性的結果は、「+」倍数かで示されている" - "負の相互作用のための陽性対照に対して標準化(B)定量的液体β-Galのアッセイ(PVA3は、GAL4 DNA-BDをコードします。 p53タンパク質との融合; PTD1は、SV40ラージT抗原とのGAL4 AD融合をコードします)。 3から変更された。 この図の拡大版をご覧になるにはこちらをクリックしてください。
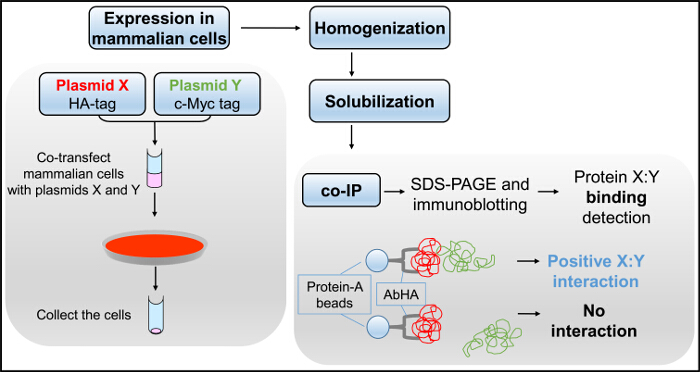
図3 のCo-IPフローチャート。哺乳動物細胞、プラスミドXとYとの同時トランスフェクションは、SDS-PAGEおよびイムノブロッティングに続いて、共IPアッセイにおいて使用される細胞溶解物を生成するために均質化し、界面活性剤で可溶化されています。F = "https://www.jove.com/files/ftp_upload/54271/54271fig3large.jpg"ターゲット= "_空白">この図の拡大版をご覧になるにはこちらをクリックしてください。
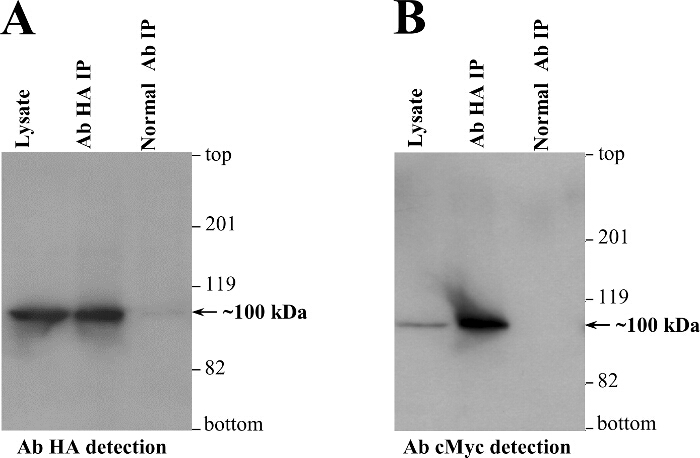
図4. 共同-IPは、哺乳動物細胞内のRyR2 N末端 ドメインの自己相互作用を示します。HEK293細胞は、CMYCタグ付き(BT4L)の一過性同時発現およびHAタグ(AD4L)のRyR2 N末端 ドメインの同時トランスフェクトしました(残基1から906)。陰性対照として、共同IPアッセイは非免疫ウサギIgGを用いて行ったのに対しAD4Lは、CHAPS可溶化及びジチオスレイトール処理したHEK293の溶解物からのAb HAを用いて免疫沈降させました。免疫沈降したタンパク質を、5分間85℃に加熱し、そして1/10またはIP試料の9/10 番目を装填別個の6%SDS-PAGEゲルを介して3時間20mAで分離しました。 polyvinyへ2時間80 Vで、以下のタンパク質の転送抗体HA(A)または抗体CMYC西洋ワサビペルオキシダーゼ結合抗マウスIgG、続いて、それぞれ、(B)、(1:10,000希釈)および増強化学発光検出:lideneジフルオリド膜は、免疫ブロット分析は、(千希釈1)を用いて行きました(1分間露光)。細胞溶解物のアリコートを、IP試料で処理体積の1/50には 、また、分子質量標準を提供するために含めました。 3から変更された。 この図の拡大版をご覧になるにはこちらをクリックしてください。
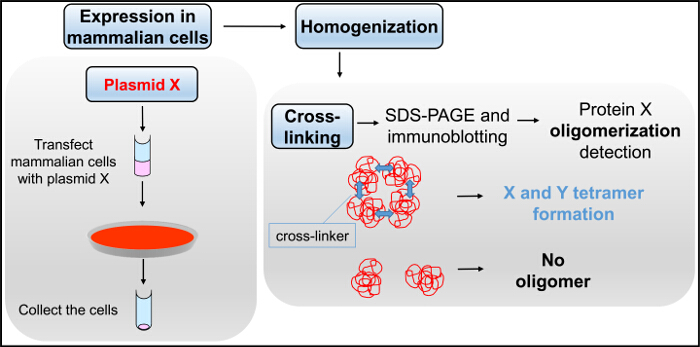
プラスミドXをトランスフェクトし、図5 の架橋フローチャート。哺乳動物細胞は、SDS-PA続いて、均質化および架橋アッセイでグルタルアルデヒドとの反応に供されますGEおよびイムノ。 この図の拡大版をご覧になるにはこちらをクリックしてください。
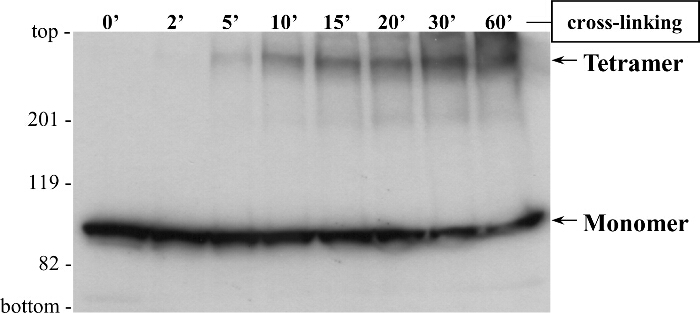
図6. 架橋は、RyR2のN末端 ドメイン四量体形成を示す HEK293細胞は、CMYCタグ付き(BT4L)のRyR2 N末端 ドメイン(残基1から906)の一過性発現のためにトランスフェクトしました。還元剤ジチオスレイトールで処理した細胞ホモジネートを、示された時間ポイントのグルタルアルデヒドを用いてインキュベートしました。サンプルを5分間85℃に加熱し、3時間20mAでSDS-PAGE(6%ゲル)により分離しました。西洋ワサビペルオキシダーゼ結合抗マウスIgG(1、続いて:(千希釈1)抗体CMYCをポリビニリデンジフルオリド膜上に2時間、80 Vでのタンパク質の転写後、免疫ブロット分析を用いて行きました。10,000希釈)および強化化学発光検出(1分間露光)。モノマー(M:〜100キロダルトン)と四量体(T)の形態は、矢印で示されています。 3から変更された。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
タンパク質のホモオリゴマーの形成は、転写因子、酵素、イオンチャンネルおよび受容体25,26の活性を調節する基本的な生物学的プロセスです。重要なことは、タンパク質のオリゴマー化はまた、神経変性および催不整脈心臓病4,27などの病理学的な意味を持ちます。この記事で概説した方法は、タンパク質の自己会合およびオリゴマー化を媒介するドメイン - ドメイン相互作用を同定するために使用されます。以下では、各プロトコル内の重要なステップでポイントして、我々は重要な考慮事項、制限事項およびトラブルシューティングについて説明します。
Y2H系は、その比較的高いスループットスクリーニング、使いやすさと再現性の高い結果の潜在的な相互作用タンパク質パートナーをスクリーニングするために最初に使用することができます。 Y2H手順は、標準的な(プレートまたはシェーカー)インキュベーター、ルーム封じ込め施設で微生物検査室で行われます。 FRの使用β-Galのアッセイで最高の結果を得るために、新たに(古い5日まで)酵母コロニーを増殖させ(ステップ1.2.3)を使用すべきであるのに対し、eshly調製したコンピテント細胞(ステップ1.1.8)は、高効率の酵母形質転換のために重要です。 GAL4以外の転写因子および/または代替/追加のレポーター遺伝子に基づいたシステムは、利用可能であるため、ベイトおよびプレイプラスミドは、適切なY2H株と一致する必要があります。
いくつかの株は、HIS3レポーター遺伝子7,8のいずれかの構成的発現をクエンチするために、3-アミノ-1,2,4-トリアゾール、HIS3タンパク質の競合的阻害剤の存在下で培養すべきです。餌とターゲット融合タンパク質の発現は、17を免疫ブロッティングによって確認する必要があります。場合餌に/餌の融合タンパク質は、酵母に対して毒性である、より低い許容タンパク質レベルはベイト/獲物発現が異なるプロモーターによって駆動される別のベクターにクローニングすることにより達成することができます。また、Tを確保するために不可欠です帽子餌/獲物の融合タンパク質は、自律的なレポーター遺伝子活性は表示されません。自律的なレポーター遺伝子の活性化は、2試験タンパク質のGAL4 DNA-BDとAD融合体を交換することにより、責任領域を除去するための構築物を修飾することによって救出することができます。それらが細胞内膜区画における融合タンパク質のミスフォールディングまたは誤局在を引き起こす可能性があるため、また、膜貫通ドメインは、より良好な餌/餌構築物から省略されています。実際、Y2H系の主な欠点は、餌とターゲットタンパク質は、偽陽性または偽陰性の相互作用6-9で、その結果、離れてそれらの生理学的細胞内位置から酵母核に局在し、潜在的に特定の翻訳後修飾を欠いているということです。
哺乳動物の異種発現系は、立体構造、翻訳後修飾および細胞内局在性の観点から、哺乳動物の内在性膜タンパク質の研究に適しています。最も広く使用される細胞のトランスフェクション法の一つは、主に最小限の設備および試薬11,15を必要とするリン酸カルシウム沈殿です。別の方法、すなわちエレクトロポレーション、リポソーム、カチオン性脂質およびポリマーは、使用される細胞株および構築物に依存して、より高いトランスフェクション効率をもたらすことができます。一般的に、トランスフェクション効率に影響を与える主な要因は、プラスミドDNAの質および細胞の健康/生存率です。最高純度の(260nmの/ 280nmの吸光度比〜1.8)と活発に分裂する細胞のプラスミドDNAを使用した場合に最良の結果が達成されます。外来DNAを取る能力が媒体11に曝露された細胞の表面領域に関連しているので、70%コンフルエンス(ステップ2.1.2) -細胞は、したがって、これ以上60以下でトランスフェクトされるべきです。さらに、トランスフェクション(ステップ2.1.3)中の培養培地中の抗生物質の含有が増加した細胞死の15のために推奨されません。
Fまたは特に、リン酸カルシウム沈殿、入念な準備及びpH調整(7.05まで正確に)2×HBS溶液を(ステップ2.1.1)、そして激しく混合(ステップ2.1.5)によりプラスミドDNA /カルシウム/リン酸複合体の適切な形成は、高効率トランスフェクションのための重要なステップ。一般的に、24内の一過性トランスフェクションピークによってタンパク質の発現 - 72時間。
細胞を回収したら、その後の手順は、プロテアーゼ活性を最小化するために4℃で実施しなければならない、およびプロテアーゼ阻害剤の添加が推奨されます。染色体DNAは、溶液粘度が増加し、非特異的結合を高めることができるので、細胞の均質化は、核を除去するための遠心分離工程が続くべきです。従って、等浸透圧緩衝液中で機械的手段により均質化は、通常、(0.3 M)のスクロースまたは(150 mM)のNaCl中で、好ましいです。一般に、スクロースベースの緩衝液は、タンパク質安定性を増強し、潜在的な非天然タンパク質凝集を減少させることが知られているが、Pのためにタンパク質表面上の基準の水和は、静電タンパク質間相互作用が好まれています。逆に、塩系緩衝剤は、より疎水性に基づく相互作用28に向かってバイアスを有する、タンパク質表面上の荷電したアミノ酸側鎖基の正味の電荷に影響を与えます。
共IPは、特に天然の組織からのタンパク質 - タンパク質相互作用を評価するための最も一般的に用いられる生化学アッセイです。その主な欠点は、IPおよびイムノ10,16,18で使用するために検証され、高度に特異的な抗体のための必要条件です。従って、組換えタンパク質は、多くの場合、 例えば 、ペプチドエピトープでタグ付けされている。、インフルエンザ赤血球凝集素(YPYDVPDYA)またはヒトCMYC(EQKLISEEDL)、高親和性特異的な抗体が市販されています。必要であれば、免疫沈降抗体は、化学的共沈PRを明瞭に免疫ブロッティング段階でその溶出および検出を回避するために、プロテインA樹脂に結合させることができます16 otein;これを達成するために、我々が正常に化学架橋剤3,3'-ジチオビス(sulfosuccinimidylpropionate)24を使用しています。適切な界面活性剤は、IP緩衝液中に含まれ、均質化細胞の不溶性物質は、非特異的結合(ステップ3.1.3)を最小化するために遠心分離によって除去されることが不可欠です。洗剤の選択と集中が重要な考慮事項です:強力な洗剤および/またはより高い濃度は、実質的に非特定の結合を減少させるだけでなく、X廃止することがあります。より低濃度またはより穏やかな洗剤は弱い相互作用が観察されることを可能にする一方で、Yのタンパク質相互作用をするがよいです過剰な非特異的結合をもたらします。中間強度の界面活性剤は、 例えば 、好ましい、トリトンX-100を0.5に- 1%の濃度です。さらに、非特異的結合を減少させるために、中性タンパク質(100μg/ mlの、例えば、ウシ血清アルブミン)をIP緩衝液中に含めることができ、および/ または細胞溶解物は、事前cleareすることができ単独のプロテインA樹脂とのインキュベーションの前でD。洗浄回数はX用に最適化されるべきである:Yのペアは、試験された、一般的にIPバッファ(ステップ3.1.9)で3 10分間の洗浄。いずれの場合も、免疫沈降抗体として、非免疫IgGと共IPサンプルは常に陰性対照(ステップ3.1.6)を提供するために並列に処理されるべきです。
化学的架橋の主な利点は、それがタンパク質のホモオリゴマーの化学量論組成に知らせることです。それは特殊な装置を必要とせず、それが相互作用するタンパク質19,20の間に熱的および化学的に安定な架橋を生成するので、グルタルアルデヒドは、一般的に使用される架橋剤です。これらは、化学反応を停止しますので、遊離アミノ基を有する化合物は、アッセイバッファ(ステップ3.2.1)から除外されるべきです。グルタルアルデヒド濃度と反応時間(ステップ3.2.4)は、関心のオリゴマータンパク質複合体のために最適化されるべきです。この技術の主な欠点、especi全細胞調製物に対して行わ味方場合、生物学的意義を欠く人工タンパク質凝集体を得ることができ、化学反応の非特異性です。
代替インビボで ( 例えば 、蛍光共鳴エネルギー転移、二分子蛍光又はルミネセンス相補性)およびインビトロ技術( 例えば 、サイズ排除クロマトグラフィー、分析的超遠心分離、等温滴定熱量測定)タンパク質の自己会合及び評価の特徴付けのために利用可能ですオリゴマーの化学量論29,30の。それぞれの方法は、独自の長所と短所があり、それは、タンパク質精製/安定性及び装置/試薬の利用可能性に応じて、特定のタンパク質の研究のために、より適切であり得ます。ここで詳細に説明した3つの相補的な方法、すなわちY2H、共IP及び架橋は、RyR2のホモoligomeための説得力のある証拠を提供するために組み合わせて使用されています分離および生体細胞内のrを形成。
開示事項
著者は宣言することは何もありません。
謝辞
この作品は、SZ(FS / 08/063とFS / 15/31494分の30)に英国心臓財団のフェローシップによってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| PART 1 yeast two-hybrid | |||
| Plate incubator | Hereaus | B6120 | Used at 30 °C |
| Orbital shaker incubator | New Brunswick Scientific | INNOVA 4300 | Used at 30 °C with shaking at 230 - 250 rpm |
| Spectrophotometer | Perkin Elmer | Lambda Bio+ | To measure OD600 of yeast culture; to measure Absorbance at 420 nm in liquid b-Gal assay |
| Matchmaker Two-Hybrid System 2 Kit | Takara Clontech | K1604-1 | Contains bait vector pGBKT7, prey vector pACT2 and yeast strain Y190 |
| Yeast Nitrogen Base | Sigma-Aldrich | Y0626 | To prepare minimal SD growh medium |
| Dropout supplement lacking leucine and tryptophan | Sigma-Aldrich | Y0750 | To prepare minimal SD growh medium |
| Dropout supplement lacking leucine, tryptophan, histidine | Sigma-Aldrich | Y2001 | To prepare minimal SD growh medium |
| Herring testes carrier DNA | Takara Clontech | 630440 | For yeast transformation |
| Whatman filter paper Grade 5 | Sigma-Aldrich | WHA1005070 | for use in colony-lift filter paper b-Gal assay |
| X-Gal (5-bromo-4-chloro-3-indolyl-β-D-galactopyranoside) | Sigma-Aldrich | B4252 | for use in colony-lift filter paper b-Gal assay |
| ONPG (o-nitrophenyl-β-D-galactopyranoside) | Sigma-Aldrich | N1127 | for use in liquid b-Gal assay |
| PART 2. Protein expression in a mammalian cell line | |||
| HEK293 cell line | ATCC | ATCC® CRL-1573™ | |
| Humidified incubator (5% CO2, 37 °C) | SANYO | MCO-18AIC | To culture mammalian cells |
| DMEM (Dulbecco's Modified Eagle's medium) | Invitrogen (ThermoFisher) | 41966 | To prepare growth medium for mammalian cells |
| Fetal Bovine Serum | Invitrogen (ThermoFisher) | 10500 | To prepare growth medium for mammalian cells |
| Glass beads | Sigma-Aldrich | G8772 | To homogenise cells |
| Needle 23 G (0.6 x 30 mm) | BD Microlance | 300700 | To homogenise cells |
| Protease inhibitor cocktail (Complete) | Roche | 11873508001 | To prevent proteolysis |
| PART 3. In vitro biochemical methods | |||
| Mini-PROTEAN Tetra Cell (SDS-PAGE system) | Bio-Rad | 1658000EDU | For polyacrylamide gel electrophoresis |
| Trans-Blot SD (Semi-dry transfer system) | Bio-Rad | 1703940 | For electrophoretic transfer |
| Compact X-ray film processor | Xograph | X4 | For use in immunoblotting |
| Glutaraldehyde | Sigma-Aldrich | G5882 | For use in chemical cross-linking |
| Protein-A sepharose beads | GE Healthcare Life Sciences | 17-5280-01 | For use in co-IP assay |
| Anti-HA (Y-11 rabbit polyclonal IgG) | Santa Cruz Biotechnology | sc-805 | For use in co-IP assay |
| Non-immune rabbit IgG | Santa Cruz Biotechnology | sc-2027 | For use in co-IP assay |
| Anti-cMyc (9E10 mouse monoclonal IgG) | Santa Cruz Biotechnology | sc-40 | For use in immunoblotting |
| Anti-HA (16B12 mouse monoclonal IgG) | Covance | MMS-101P | For use in immunoblotting |
| Anti-mouse IgG-HRP | Santa Cruz Biotechnology | sc-2005 | For use in immunoblotting |
| Hyperfilm ECL | GE Healthcare Life Sciences | 28906836 | For use in immunoblotting |
| ECL Western Blotting Substrate | Pierce (ThermoFisher) | 32106 | For use in immunoblotting |
参考文献
- Seidel, M., Lai, F. A., Zissimopoulos, S. Structural and functional interactions within ryanodine receptor. Biochem Soc Trans. 43 (3), 377-383 (2015).
- Zissimopoulos, S., Marsh, J., Stannard, L., Seidel, M., Lai, F. A. Amino-terminus oligomerisation is conserved in intracellular calcium release channels. Biochem J. 459 (2), 265-273 (2014).
- Zissimopoulos, S., et al. N-terminus oligomerization regulates the function of cardiac ryanodine receptors. J Cell Sci. 126 (Pt 21), 5042-5051 (2013).
- Seidel, M., Thomas, N. L., Williams, A. J., Lai, F. A., Zissimopoulos, S. Dantrolene rescues aberrant N-terminus inter-subunit interactions in mutant pro-arrhythmic cardiac ryanodine receptors. Cardiovasc Res. 105 (1), 118-128 (2015).
- Stewart, R., Zissimopoulos, S., Lai, F. Oligomerization of the cardiac ryanodine receptor C-terminal tail. Biochem J. 376, 795-799 (2003).
- Deane, C. M., Salwinski, L., Xenarios, I., Eisenberg, D. Protein interactions: two methods for assessment of the reliability of high throughput observations. Mol Cell Proteomics. 1 (5), 349-356 (2002).
- Fashena, S. J., Serebriiskii, I., Golemis, E. A. The continued evolution of two-hybrid screening approaches in yeast: how to outwit different preys with different baits. Gene. 250 (1-2), 1-14 (2000).
- Stynen, B., Tournu, H., Tavernier, J., Van Dijck, P. Diversity in genetic in vivo methods for protein-protein interaction studies: from the yeast two-hybrid system to the mammalian split-luciferase system. Microbiol Mol Biol Rev. 76 (2), 331-382 (2012).
- Yang, M., Wu, Z., Fields, S. Protein-peptide interactions analyzed with the yeast two-hybrid system. Nucleic Acids Res. 23 (7), 1152-1156 (1995).
- Elion, E. A. Chapter 8, Detection of protein-protein interactions by coprecipitation. Curr Protoc Immunol. , (2007).
- Kingston, R. E., Chen, C. A., Rose, J. K. Chapter 9, Calcium phosphate transfection. Curr Protoc Mol Biol. , (2003).
- Lam, A. K., Galione, A., Lai, F. A., Zissimopoulos, S. Hax-1 identified as a two-pore channel (TPC)-binding protein. FEBS letters. , (2013).
- Zissimopoulos, S., Lai, F. Interaction of FKBP12.6 with the cardiac ryanodine receptor C-terminal domain. J Biol Chem. 280, 5475-5485 (2005).
- Zissimopoulos, S., Thomas, N. L., Jamaluddin, W. W., Lai, F. A. FKBP12.6 binding of ryanodine receptors carrying mutations associated with arrhythmogenic cardiac disease. Biochem J. 419 (2), 273-278 (2009).
- Jordan, M., Wurm, F. Transfection of adherent and suspended cells by calcium phosphate. Methods. 33 (2), 136-143 (2004).
- Kaboord, B., Perr, M. Isolation of proteins and protein complexes by immunoprecipitation. Methods Mol Biol. 424, 349-364 (2008).
- Sambrook, J., Fritsch, E. F., Maniatis, T. . Molecular cloning: a laboratory manual. , (1989).
- Yang, W., Steen, H., Freeman, M. R. Proteomic approaches to the analysis of multiprotein signaling complexes. Proteomics. 8 (4), 832-851 (2008).
- Migneault, I., Dartiguenave, C., Bertrand, M. J., Waldron, K. C. Glutaraldehyde: behavior in aqueous solution, reaction with proteins, and application to enzyme crosslinking. Biotechniques. 37 (5), 790-796 (2004).
- Wine, Y., Cohen-Hadar, N., Freeman, A., Frolow, F. Elucidation of the mechanism and end products of glutaraldehyde crosslinking reaction by X-ray structure analysis. Biotechnol Bioeng. 98 (3), 711-718 (2007).
- Zissimopoulos, S., Lai, F. Central domain of the human cardiac muscle ryanodine receptor does not mediate interaction with FKBP12.6. Cell Biochem Biophys. 43, 203-220 (2005).
- Zissimopoulos, S., West, D., Williams, A., Lai, F. Ryanodine receptor interaction with the SNARE-associated protein snapin. J Cell Sci. 119, 2386-2397 (2006).
- Zissimopoulos, S., Docrat, N., Lai, F. Redox sensitivity of the ryanodine receptor interaction with FK506-binding protein. J Biol Chem. 282, 6976-6983 (2007).
- Zissimopoulos, S., Seifan, S., Maxwell, C., Williams, A. J., Lai, F. A. Disparities in the association of the ryanodine receptor and the FK506-binding proteins in mammalian heart. J Cell Sci. 125. 125 (Pt 7), 1759-1769 (2012).
- Ali, M. H., Imperiali, B. Protein oligomerization: how and why. Bioorg Med Chem. 13 (17), 5013-5020 (2005).
- Hashimoto, K., Panchenko, A. R. Mechanisms of protein oligomerization, the critical role of insertions and deletions in maintaining different oligomeric states. Proc Natl Acad Sci U S A. 107 (47), 20352-20357 (2010).
- Haass, C., Selkoe, D. J. Soluble protein oligomers in neurodegeneration: lessons from the Alzheimer's amyloid beta-peptide. Nat Rev Mol Cell Biol. 8 (2), 101-112 (2007).
- Chi, E. Y., Krishnan, S., Randolph, T. W., Carpenter, J. F. Physical stability of proteins in aqueous solution: mechanism and driving forces in nonnative protein aggregation. Pharm Res. 20 (9), 1325-1336 (2003).
- Gell, D. A., Grant, R. P., Mackay, J. P. The detection and quantitation of protein oligomerization. Adv Exp Med Biol. 747, 19-41 (2012).
- Kaczor, A. A., Selent, J. Oligomerization of G protein-coupled receptors: biochemical and biophysical methods. Curr Med Chem. 18 (30), 4606-4634 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved