Method Article
微生物集団に定着表面に空間的分離の監視
要約
進化のシナリオで品揃え(空間的分離)の役割は、空間分布の調整を可能にする制御された実験室での単純な微生物系を用いて調べることができます。創始細胞密度を変更することにより、様々な品揃えのレベルは、 枯草菌のコロニーバイオフィルム内の蛍光標識された菌株を使用して可視化することができます。
要約
Microbes provide an intriguing system to study social interaction among individuals within a population. The short generation times and relatively simple genetic modification procedures of microbes facilitate the development of the sociomicrobiology field. To assess the fitness of certain microbial species, selected strains or their genetically modified derivatives within one population, can be fluorescently labelled and tracked using microscopy adapted with appropriate fluorescence filters. Expanding colonies of diverse microbial species on agar media can be used to monitor the spatial distribution of cells producing distinctive fluorescent proteins.
Here, we present a detailed protocol for the use of green- and red-fluorescent protein producing bacterial strains to follow spatial arrangement during surface colonization, including flagellum-driven community movement (swarming), exopolysaccharide- and hydrophobin-dependent growth mediated spreading (sliding), and complex colony biofilm formation. Non-domesticated isolates of the Gram-positive bacterium, Bacillus subtilis can be utilized to scrutinize certain surface spreading traits and their effect on two-dimensional distribution on the agar-solidified medium. By altering the number of cells used to initiate colony biofilms, the assortment levels can be varied on a continuous scale. Time-lapse fluorescent microscopy can be used to witness the interaction between different phenotypes and genotypes at a certain assortment level and to determine the relative success of either.
概要
過去数十年間では、微生物は地球1,2上のさまざまな生態系に関連した社会的なコミュニティとして認識されています。一般的な実験室での実施に使用されるプランクトンの培養とは対照的に、環境中の微生物は、生態系の設定に応じて空間的なコミュニティ構造の多様な範囲を示しています。単純な微生物系は、社会的相互作用3,4の進化上の空間構造の結果を理解するために利用することができます。両方の真核生物と原核生物のモデル系を使用して、最後の2〜3年での出版物は、微生物群5-8内の協力の安定性に対する空間構造の影響を強調しました。さらに、微生物間の相互作用を義務付け、 例えば代謝クロス送り、またパートナー9-11相互作用の空間分布が変更される場合があります。これらの研究における空間構造の影響は、ほとんどそうに生息する表面付着した無茎細胞を用いて検討されています-calledバイオフィルムやコロニーに寒天培地の表面に成長しています。高い空間品揃えが生じる遺伝的浮動は、細胞分裂のエッジで栄養枯渇が特定のクローンlinages 12のための高いローカルの固定確率を引き起こす遺伝的ボトルネックの一連の展開結果を媒介微生物のコロニーで観察することができます。遺伝的浮動は、したがって、微生物のコロニーの空間的分離の役割を調べるために使用することができます。
環境では、バイオフィルムは、セルフプロデュースポリマーマトリックス13に囲まれた複数種のコミュニティです。バイオフィルムの構造、機能、および安定性は、細菌交換信号、マトリックス成分と資源の社会的相互作用の複雑なネットワークに依存し、または毒素および抗生物質を使用してスペースと栄養のために競う。 枯草菌の土壌に生息し、高度に組織化された開発したルート-コロニー形成細菌でありますバイオフィルムのコミュニティ14。社会と同様に昆虫、B.枯草菌細胞は、細胞外マトリックスの生産者と食い、運動性細胞、休眠胞子および他の細胞型15,16の亜集団を開発し、労働戦略の部門を採用します。分化プロセスは動的であり、環境条件17,18によって変化させることができます。
細菌による表面のコロニー形成の戦略は容易に増殖培地中の寒天濃度を変更することにより、実験室条件下で操作することができます。寒天(0.7から1パーセント寒天)は19-21群がっ呼ばれ、拡散鞭毛駆動コミュニティを促進する半固形ながら、低寒天レベル(0.2から0.3パーセント)では、アクティブな鞭毛を保有する細菌は、泳ぐことができます。鞭毛の非存在下では、特定の細菌株は、エキソポリサッカライドのマトリックス及び他の分泌されたハイドロフォビン化合物22-24によって促進すなわち成長従属人口拡大スライドを介して半固形培地上に移動することができます。最後に、細菌capablでありますハード寒天培地(1.2から2パーセント)14,17,25上のバイオフィルムの開発フォームアーキテクチャの複雑なコロニーの電子。これらの特性を正確に自然の生息地で、条件を調整することにより、実験室で検討されているが、これらの表面拡散戦略別の環境条件26に応じて徐々に1からトランジットかもしれません。単一の細胞ベースの運動性は、グラム陽性と陰性の両方の細菌27、Bの複雑なコロニーバイオフィルム中の気液界面でのバイオフィルムの開発の開始時に重要である一方で枯草菌は、鞭毛の運動28の削除による影響を受けません。 Bの開発時しかし、空間的な組織枯草菌のコロニーバイオフィルムは、バイオフィルム8を開始するために使用される細菌接種の密度に依存します。
ここでは、Bを使用します表面のコロニー形成時の空間的な分離は、集団レベルのmotiliのメカニズムに依存していることを示すために枯草菌TY( すなわち群がっまたはスライド)、およびコロニーバイオフィルムの開発は、創業者の細胞密度に依存しています。我々は継続的にマクロスケールでの微生物のバイオフィルムの成長、表面の植民地化と品揃えを監視するために適用することができ、蛍光顕微鏡ツールを提示します。さらに、定量法は、集団内の相対的なひずみ存在量を決定するために提示されています。
プロトコル
培養培地、半固体寒天およびバイオフィルムプレート、前培養の調製
- 群がるとスライドのための媒体の準備
- レノックスブロス(LB)を2g、120℃で20分間、100mLのイオン交換水に寒天、オートクレーブを0.7gを溶解します。実験間の再現性を向上させるために、少量(50〜ml)を使用してください。
- すぐに殺菌した後、少なくとも2時間、55℃のインキュベーター中で蒸発し、場所を減らすために培地ボトルのキャップを閉じます。
- 媒体温度が55℃に焼戻しした後、実験室の無菌フード下の90ミリメートルの直径のポリスチレンペトリ皿に寒天LB培地20ミリリットルを注ぎます。時間経過実験のために5mlのを直径35mmのポリスチレンペトリ皿当たり寒天LB培地を注ぎます。
- すぐに注いだ後ペトリ皿を閉じて、互いの上にこれ以上4以下のプレートをスタックし、寒天培地は、少なくとも1時間固化させます。
- 2xSGミディアムPコロニーバイオフィルムのための償い
- 栄養ブロスを1.6g、塩化カリウム0.2gをし、MgSO 4 7H 2 Oを0.05g、及び120℃で20分のための100mlのイオン交換水、オートクレーブ中で寒天を1.5gを溶解。実験間の再現性を向上させるために、少量(50〜ml)を使用してください。
- すぐに殺菌した後、少なくとも2時間、55℃のインキュベーター中での蒸発を低減し、ボトルを配置する培地ボトルのキャップを閉じます。
- 媒体温度が自己調整55°Cまで、1MのCa滅菌0.1 mlのフィルタを追加するには(NO 3)2溶液0.1mlのフィルタ100ミリモルのMnCl 2溶液を滅菌した後、0.1mlのフィルタを、1mMのFeSO 4溶液、0.5mlの滅菌しました滅菌20%グルコース溶液。
- 実験室で無菌フードでは、90ミリメートルの直径のポリスチレンペトリ皿当たり寒天2倍SG培地20ミリリットルを注ぎます。時間経過実験のために5mlのを直径35mmのポリスチレンペトリ皿当たり寒天LB培地を注ぎます。
- クロ電子ペトリすぐに注いだ後、互いの上に板を積み重ね皿ではなく、4つ以上のプレートと、少なくとも1時間固化する寒天培地をしましょう。
- スターター培養物の調製
注:B.ズブチリス 168は、構成的に以下に記載する方法で使用NCIB 3610誘導体株は緑色または赤色蛍光タンパク質を産生し、8,27前に説明されました。株は、-80°Cの冷凍庫で日常的に保存されます。- 3ミリリットルのLB培地中で-80℃のストックからスターター培養物を接種し、水平振とう(225 rpm)しながら37℃で(16-18時間)一晩インキュベートします。 B.の野生分離株として長く18時間よりも文化をインキュベートしないでください。 枯草菌は凝集及び試験管内のバイオフィルムを形成するほとんど傾向があります。
2.拡散表面のための蛍光標識細菌株の同時接種
- 群がるのための半固体寒天プレートの乾燥、Bのスライディング枯草菌 。
- 接種前に群がって、20分間スライドさせるための乾燥寒天プレート。層流フード内で発見され、乾燥プレート( 図1参照)。
注:細菌群がるとスライドは、半固形寒天培地の乾燥度に依存します。不十分な乾燥は鞭毛媒介水泳の結果寒天培地上の水の蓄積を可能にします。遊走の欠如で長時間乾燥時間をもたらします。
- 接種前に群がって、20分間スライドさせるための乾燥寒天プレート。層流フード内で発見され、乾燥プレート( 図1参照)。
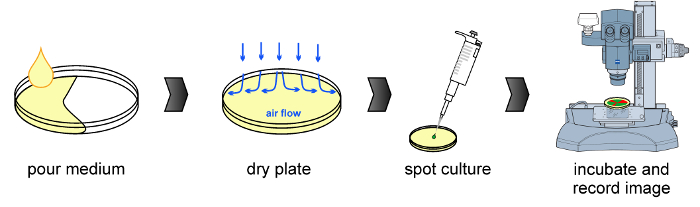
図1:実験ワークフロー共通の手順は(左から右へ)培養培地、プレートを乾燥させ、接種および蛍光顕微鏡検出の準備を含め、図に描かれている。 この図の拡大版をご覧になるにはこちらをクリックしてください。
- 共同接種群がるとスライドのための細菌培養物の
- 600 nmで一晩スターター培養物の光学密度を決定し、Bの密度正規化された緑色および赤色蛍光タンパク質産生株を混ぜます枯草菌 NCIB 3610または1.5ミリリットルの反応管でのΔの魔女誘導体 。例えば、軽度株2.ボルテックス(最大速度で3秒)のμlの([株2の一晩培養物のOD 600] / 100 * [株1の一晩培養物のOD 600])のために株を1100μlのを混ぜます均質な分布。
注:B.そのΔの魔女誘導体は、スライドのために使用されている間サブチリス NCIB 3610株は、スウォーミングを観察するために接種します。 - スポット予備乾燥プレートの真ん中に混合培養の2μlを( 図1を参照)、さらに接種後10分間プレートを乾燥させます。
- 37℃で培養するには、余分な水分が蓋の上にではなく、寒天表面上に凝縮することを可能にするため直立しました。
注:Bのインキュベーション時間群がる枯草菌は、一般的に 8-16時間の間です。一般的に、群れのエッジは、8時間で90ミリメートルペトリ皿の側面に達します。スライディングは遅いプロセスであり、インキュベーションの少なくとも16から42時間を必要とします。 36時間後、スライドフロントは90ミリメートルペトリ皿の側面に達します。 - タイムラプス実験のために、37℃に設定した予熱した段階のインキュベーションチャンバーに直径35mmのペトリ皿を置きます。ペトリ皿の蓋は実験期間を通して除去されたままであることを確認してください。インキュベーターの上に水分形成を回避するために40℃にステージインキュベーターのカバーを設定します。
- 600 nmで一晩スターター培養物の光学密度を決定し、Bの密度正規化された緑色および赤色蛍光タンパク質産生株を混ぜます枯草菌 NCIB 3610または1.5ミリリットルの反応管でのΔの魔女誘導体 。例えば、軽度株2.ボルテックス(最大速度で3秒)のμlの([株2の一晩培養物のOD 600] / 100 * [株1の一晩培養物のOD 600])のために株を1100μlのを混ぜます均質な分布。
3.異なる初期細胞密度を持つ蛍光標識細菌株の同時接種
- B.のコロニーバイオフィルム形成のための寒天プレートの乾燥枯草菌 。
- 層流にカバーせずにコロニーバイオフィルムの開発のためのプレートを乾燥接種前に15分間のフード。
注:湿度の上昇や水泳や群がる中の不十分な乾燥結果は29可能です。小さな生物膜コロニーに長すぎる結果を乾燥させます。
- 層流にカバーせずにコロニーバイオフィルムの開発のためのプレートを乾燥接種前に15分間のフード。
- コロニーバイオフィルム用の10倍希釈のスターター培養物の調製
- B.一晩スターター培養物を生産する緑色および赤色蛍光タンパク質100μlのミックス均質な分布のために1.5ミリリットルの反応管内の枯草菌 168と穏やかにボルテックス。 LB培地中で10倍希釈系列を調製します。
- スポット2非希釈のμlあるいは10 1、10 2、10 3、10 4は、バイオフィルム誘導培地を含むプレート上で混合培養物を希釈しました。
注:6~9バイオフィルムコロニーをコロニーが互いに等しい距離で分離されていることを考慮して、単一の90 mmのペトリ皿上で開始することができます。 - 余分な水分が蓋に凝縮することを可能にするために30℃で直立でプレートをインキュベートし、ない寒天表面上。
注:Bのインキュベーション時間枯草菌バイオフィルムは、1〜3日の間です。 B.の一般的に、コロニーバイオフィルム枯草菌は、2日間で、その平均サイズおよび複雑な構造に到達します。 - 時間経過実験では、直径35mmのペトリ皿の中央に単一の接種物を配置し、30℃に設定した予熱段階のインキュベーションチャンバー内の皿を置きます。ペトリ皿の上部が実験期間を通して除去されたままであることを確認してください。インキュベーターの上に水分形成を回避するために35℃にステージインキュベーターのカバーを設定します。
標識株の4蛍光顕微鏡検出
- イメージングのための機器の説明。
- 表面のコロニー形成および蛍光シグナルを検出するために、0.5X PlanApo目的を搭載した電動式蛍光ステレオズーム顕微鏡( 材料表での詳細なリストを参照)を使用し、2はLED冷光源(蛍光検出、可視光のための1つのための1)、GFP(50分の525 nmで40分の470 nmおよび発光での励起)とMRFP 629で25分の572 nmの発光にて(励起/用フィルターセット62ナノメートル)、及び高解像度の白黒カメラ。
- マルチチャンネルとタイムラプスモジュールを含むステレオズーム顕微鏡で利用可能な適切なソフトウェアと画像収集と処理を実行します。時間経過の実験では、アダプタ付きステレオズーム顕微鏡に取り付けられた標準的な加熱ステージインキュベーターを使用しています。
- 群がるとスライディング拡張のイメージング
- 90ミリメートルプレートの最大の可能な領域をキャプチャするために、最も低い倍率を使用してください。ラジアル細菌拡張および蛍光を監視するための可視フィールドの隅に接種(90ミリメートルのペトリ皿の中央)の原点を設定します。
- 蛍光信号の強度に応じて最適な露光時間を調整します。
注:構成的expreについてBのssed蛍光遺伝子枯草菌 、1.5と3秒で緑色及び赤色蛍光の露光時間は、それぞれ、使用することができます。さらに、10ミリ秒の露光時間は、可視光に適しています。
- 全体のバイオフィルムコロニーの検出を可能にする倍率を使用して、視野の真ん中にコロニーを調整します。
注:バイオフィルムコロニー中で蛍光シグナルを検出するために、最適な露光時間を拡張し群がっスライドとして蛍光タンパク質をコードする遺伝子の発現レベルに依存します。以下に代表的な結果を得るためには、緑と赤の蛍光は、それぞれ、1及び3秒の露光間隔を使用して検出しました。 - タイムラプスイメージングのために、一定の露光時間を用いて、一定の間隔で画像を取得します。
- 定量的データ分析のためのImageJソフトウェアによって認識されているファイル形式で画像を記録した蛍光実体を保存します。
5.ダット解析
- それぞれ異なる蛍光標識された菌株の占有面積を分析するために、BioVoxxelプラグインで拡張ImageJソフトウェアへの関心のファイルを開きます。
- のみのオプションが選択されていると、「オートスケール」「すべてのシリーズを開き、「どこで」バイオフォーマットインポートオプション」と呼ばれるウィンドウが表示されたら、「OK」をクリックして、ファイルを開きます。
注:ファイルは、3つの画像の積み重ねとして表示され、各チャネル1は、顕微鏡(緑色、赤色蛍光および明視野像)の画像を記録します。 - 「スタック」 - - 「イメージ」を選択することで、個々のチャンネルの画像にスタックを切り離しImageJのコントロールパネルの「画像にスタック」。
注:画像が表示され、1月3日(グリーンチャンネル)として番号付けされ、2月3日(赤チャネル)および3/3(明視野)。ここで、明視野像は、分析から除外されます。
- のみのオプションが選択されていると、「オートスケール」「すべてのシリーズを開き、「どこで」バイオフォーマットインポートオプション」と呼ばれるウィンドウが表示されたら、「OK」をクリックして、ファイルを開きます。
- 画像を分析するために、選択することによって、8ビットの画像にそれぞれ変換します「イメージ」 - 「タイプ」 - 「8ビット」。
- 「スケールの設定」 -ピクセル2の占有面積を決定するには、「分析」を使用して画像のスケールをリセットします。ウィンドウが異なるスケールオプションをポップアップ表示する場合は、「スケールを削除する場合にクリックします」を選択することによりスケールをリセットします。開いているすべての画像のスケールを除去するためのオプション「グローバル」を確認してください。
- 背景を削除するには、ImageJのコントロールパネルの「オーバル」ツールを使用して蛍光領域の外側の楕円形の領域(関心領域、ROI)を描きます。
- 背景楕円形のサイズは、すべての分析画像に対して同じであることを確実にするために、キーボードの[t]は、文字を経由してROIマネージャーに追加します。 「保存」オプション - 背景楕円形のROIは、「詳細」を介して保存することができる場所ROI Managerウィンドウが現れます。
- 「メジャー」 - 背景楕円形のROIが画像上に表示されている場合は、「分析」を選択することにより、領域の強度を測定します。
注:Aの結果とりわけ平均蛍光強度は、「平均」という欄に表示されるウィンドウが表示されます。 - 「プロセス」をクリックし、背景楕円形のROIの選択を解除することにより、画像から平均バックグラウンドの蛍光強度の値を減算 - "数学" - "引く"と測定値を挿入します。
- 「調整」 - - 「しきい値」オプションの「イメージ」を介して画像にしきい値を適用します。方法大津と白黒(B&W)を選択します。 「ダーク背景」オプションをチェックし、「適用」をクリックすることで、閾値を採用。
注:閾値以上の領域が白色で表示され、しきい値を下回る黒で表示されていることを二値画像への画像の変更。 - 「粒子の分析 "オプション - "分析 "を経由してしきい値以上のすべてのものを選択します。設定されたウィンドウでは、デフォルトのオプションを維持し、「結果の表示」および「Sを保ちますummarize総面積」「結果ウィンドウで要約して表示ラベルされたカラム内の占有面積を表示するには「OK」にチェックオプション。クリックしてください」。
結果
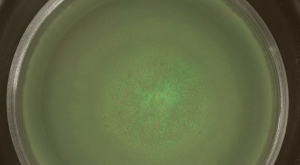
細菌集団の研究室システムは、生態や進化の質問を探索する魅力的なアプローチを提供します。ここで、Bの3つの表面植民地化モードが枯草菌は人口品揃えの外観を検査するために使用された、遺伝的に同一の分離が、蛍光標識された別の株、すなわち 。 B.の鞭毛依存集団表面移動である、群がっ枯草菌 、高度に混合された集団での結果。これら群がっコロニーでは、植民地化の領域が重複した緑色および赤色蛍光細菌は( 図2A参照します)。急速な表面のコロニー形成は、時間( ビデオ図1)に従うことができます。 B・ズブチリスの群がっ間、細胞の薄い層は、インキュベーションの数時間後に接種センターから展開する( 図2B参照)。
4752 / 54752fig2.jpg "/>
図2:Bの拡大を群がっ。接種前に1: 枯草菌群がっコロニーは、1を混合し、緑色と赤色の蛍光株が含まれています。 15時間後(A)、緑色および赤色蛍光(それぞれGFP及びRFPは)適切な蛍光フィルターを用いて検出しました。 (B)遊走Bの薄層の画像枯草菌は、ビデオ図1のスケールバー= 5ミリメートルから抽出された選択された時点で示されている。 この図の拡大版をご覧になるにはこちらをクリックしてください。
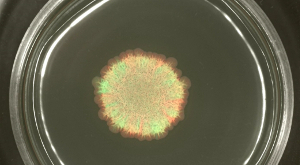
しかし、B.機能的な鞭毛を欠くが生産エキソポリサッカライド、ハイドロフォビンとサーファクチンの助けを借りて広がることができますされているサブチリス株は、異なって標識された株は、特定のデフに分離し、半固形寒天培地上にスポットしましたINEDセクタ( 図3Aを参照してください)。スライドコロニーの発達は、( 図3Bまたはビデオ図2を参照)の時間内に記録することができます。

図3:Bのスライディングコロニー。接種前に1: 枯草菌コロニーは、1を混合し、緑色と赤色の蛍光株が含まれています。 24時間後(A)、緑色および赤色蛍光(それぞれGFP及びRFPは)適切な蛍光フィルターを用いて検出しました。 (B)Bの画像をディスクをスライド枯草菌がビデオ図2.スケールバー= 5ミリメートルから抽出された選択された時点で示されている。 この図の拡大版をご覧になるにはこちらをクリックしてください。
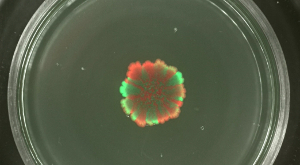
スウォーミングおよびSLIの品揃えレベルながら、コロニーを拡大鼎は、コロニーバイオフィルムにおける異なる蛍光標識株の空間的な分離は、出発細胞密度によって影響を受けることができ、変更できませんでした。ときBのコロニーバイオフィルム枯草菌は、混合集団の高い細胞密度で開始した、緑と赤の蛍光株はマイナー示したか、空間的な品揃えは( 図4を参照しません)。 biolfilmを開始するために細胞密度が低い逆に、透明な緑色及び赤色蛍光セクタは、蛍光顕微鏡によって検出することができました。品揃えのレベルは明らかに人口を開始するバイオフィルムの希釈レベルに依存していた。 ビデオ図3と4は、接種株の最低と最高の希釈用コロニーの拡大を提示します。

図4:Bのコロニーバイオフィルム中の品揃えレベル枯草菌で(:それぞれ、培養を開始希釈10 5倍に、非希釈上から下に)各種初期細胞密度は、緑と赤の蛍光株のコロニーバイオフィルムは、異なる初期細胞密度で接種し、2日後に示されています。スケールバー= 5ミリメートル。 この図の拡大版をご覧になるにはこちらをクリックしてください。
緑色および赤色蛍光の株の比率は、さらなる実験に使用した菌株の集団構造と競争力の定量的な特徴付けを可能にImageJソフトウェアを用いて定量することができます。
ビデオ図1:タイムラプスIMAGスウォーミングBのエス枯草菌は、1で開始:緑と赤の蛍光株の1ミックス(右クリックしてダウンロード。)ビデオは10時間の時間経過を示します。スケールバー= 7ミリメートル。

ビデオ図2:B.スライディングのタイムラプス画像枯草菌は、1で開始:緑と赤の蛍光株の1ミックス (右クリックしてダウンロード。)ビデオは24時間の時間経過を示します。スケールバー= 5ミリメートル。
ビデオ図3:Bのタイムラプス画像緑の1ミックス:1で開始枯草菌コロニーバイオフィルム-高い細胞密度で、赤色の蛍光株(右クリックしてダウンロード。)ビデオは、48時間の時間経過を示します。スケールバー= 5ミリメートル。
ビデオ図4:Bのタイムラプス画像低細胞密度で緑と赤の蛍光株の1ミックス:1で開始枯草菌コロニーバイオフィルム。 (右クリックしてダウンロード。)ビデオは、48時間の時間経過を示します。スケールバー= 5ミリメートル。
ディスカッション
細菌のための蛍光ツールボックスの利用可能性は、異種遺伝子発現30,31およびタンパク質局在32の研究だけでなく、人口8内の株の空間分布の分析だけでなく、容易にします。十分に異なる励起波長および発光波長を有する蛍光マーカーがはっきりと混合したときにそれ以外の場合は互いに区別できない2株をローカライズすることができます。記載されているプロトコルは、株または種間の混合培養における人口動態、 例えば競合実験または相乗作用を観察するために使用することができます。混合集団内の蛍光標識された株の相対的な存在量を決定する能力は、摺動、添付の遊走表面に制限、またはバイオフィルムコロニーだけでなく、浸水、フローセルまたは空気媒体インターフェースを含む他の多細胞生物膜システムのために使用することができるされていませんバイオフィルム27,33-35。
_content ">提示技術は、株やデザインコンペ実験の空間分布を検出するための強力なツールですが、それはまた、コロニーの拡大に次の遺伝子発現の不均一性を可能にする。ここで説明する培養条件は、 枯草菌との拡張のための正確なパラメータに適用されます寒天培地は、他の種や菌株20の最適化を必要とするかもしれません。インキュベーションチャンバー内のサンプルを配置するイメージングが時間内に人口動態に従うように実験を可能にしながら、注意がインキュベーション中に室内の湿度レベルに与えられるべきです。株は、互いに区別することができる蛍光マーカーを発現するように、ここで説明された技術も検討菌株の遺伝子改変を必要とします。また、個別の励起および発光スペクトルを持つ以外に、選択した2つの蛍光マーカーは、同様の定量を持っていることをお勧めしますUMの収量と同等のレベルで発現される(放出され吸収された光子のすなわち比)。また、時間の相対強度の変化を測定することができ、実験の初期の時点に対して正規化。相対的な増加または減少は、異なる量子効率を有する異なる蛍光団の間で比較することができます。提示された実験システムでは、別の緑色および赤色蛍光タンパク質は、Bで検出することができる最適な蛍光対を選択するために、以前に36,37を試験しました。 枯草菌 。最適な露光時間は各蛍光タンパク質試料について決定されるべきです。特定の細胞密度または細胞の複数の層は、集団内で効率的に信号を検出する必要がある場合があります。特定の蛍光タンパク質は、非効率的な発現および/またはタンパク質の翻訳、したがって、低量子収率に起因する細菌細胞に低強度を有する可能性があります。このような非効率な蛍光マーカーでしRシステムの感度を引き出すと、励起光によっておそらく細胞毒性を生じる細菌株を検出するのに必要な時間を延長します。蛍光強度は、それに応じて、蛍光レポーターをコードする遺伝子を発現するために使用されるプロモーターを改変することによって改変することができます。高すぎる発現レベルは、細菌にとって有害フィットネスコストにつながる蛍光タンパク質の不必要な過剰産生につながる可能性があります。競合実験を行う場合、1は、細胞内の特定の蛍光タンパク質生産のコストを考慮する必要があります。蛍光マーカーが競っ株またはどこ彼らの蛍光マーカーのみが異なる2同質遺伝子型株は互いに競っている間で交換された対照実験は、常に一つのマーカーに向かって任意のバイアスを決定するために必要とされています。細胞内の蛍光タンパク質の寿命はまた、測定された強度に影響を与える可能性があります。また、特定の細菌種の自己蛍光sがここで説明する以外の異なる蛍光マーカーの使用が必要な場合があります。
正確には明確な細菌株の空間分布や存在量を決定するために、第二の蛍光マーカーおよびその逆のための蛍光フィルターを使用しつつ、第1の蛍光タンパク質由来のバックグラウンド信号を個別に一つだけのマーカーを生産する細菌を含む(モノカルチャーのサンプルでテストする必要があります)。これは、蛍光シグナル強度を重複の減算を可能にします。実体顕微鏡で拡大コロニー上からの蛍光信号を記録するように重要なことは、提示プロトコルは、二次元の空間的配置を決定するために便利です。拡大する細菌集団のアーキテクチャは、( すなわち、しわ状の構造は、より高い局所蛍光強度を表示する複数のセルが含まれる場合があります)、様々な蛍光レベルにつながる可能性があります。そのため、画像の説明分析は、D空間分布ではなく、特定のロケーション内の株の豊かさをetermines。前のプロトコルは、細菌コロニー38に人口動態の20または蛍光イメージングを群がっための試料調製を説明するが、我々のプロトコルは、これらの技術を組み合わせています。人口構造の三次元解像度( 例えば、共焦点レーザー走査顕微鏡39,40または構造化照明顕微鏡41)の観察を可能にする他の顕微鏡技術が向上する構造の複雑さの試料に適用することができます。これらの追加の技術はまた、実体顕微鏡を使用して利用できない株31の単一の細胞ベースの検出をサポートしています。
開示事項
著者は、彼らが競合する金融利害関係を持たないことを宣言します。
謝辞
この作品は、ドイツ学術協会(DFG)から助成金KO4741 / 3-1によって賄われていました。さらに、Á.TKの研究室では、マリー・キュリーSkłodowskaキャリア・インテグレーション・グラント(PheHetBacBiofilm)によってサポートされ、DFGからKO4741 / 2-1を付与しました。 TH、AD、RG-M。、及びEMは、それぞれ、国際マックス・プランク研究所の学校、アレクサンダー・フォン・フンボルト財団、ConsejoナシオナルデCiencia YTecnologìa、ドイツ学術交流会(CONACyT-DAAD)、およびJSMC奨学金によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| Lennox Broth (LB) | Carl Roth GmbH | X964 | |
| Agar-agar, Kobe I | Carl Roth GmbH | 5210 | |
| Petri dish (90 mm diameter) | any | NA | Use Petri dishes without ventillation cams |
| Petri dish (35 mm diameter) | any | NA | Use Petri dishes without ventillation cams |
| Difco Nutrient Broth | BD Europe | 234000 | |
| KCl | any | NA | |
| MgSO,4 7H2O | any | NA | |
| Ca(NO3)2 4H2O | any | NA | |
| MnCl24H2O | any | NA | |
| FeSO4 | any | NA | |
| D-Glucose | any | NA | |
| Fluorescence AxioZoom V16 time-lapse microscope | Carl Zeiss Microscopy GmbH | see bellow detailed description | |
| AxioZoom V16 Microscope body | Carl Zeiss Microscopy GmbH | 435080 9030 000 | |
| Phototube Z 100:0 for Axio Zoom V16 | Carl Zeiss Microscopy GmbH | 435180 9020 000 | without eyepieces |
| Fluar Illuminator Z mot Fluorescence intermediate tube for Axio Zoom.V16 | Carl Zeiss Microscopy GmbH | 435180 9060 000 | |
| Controller EMS 3 | Carl Zeiss Microscopy GmbH | 435610 9010 000 | |
| System Control Panel SYCOP 3 | Carl Zeiss Microscopy GmbH | 435611 9010 000 | |
| Reflector module Z | Carl Zeiss Microscopy GmbH | 435180 9160 000 | For Fluar Illuminator Z mot on Axio Zoom.V16 and SYCOP 3 |
| Filter set 38 HE eGFP shift free (E) | Carl Zeiss Microscopy GmbH | 489038 9901 000 | EX BP 470/40, BS FT 495, EM BP 525/50 |
| Filter set 63 HE mRFP shift free (E) | Carl Zeiss Microscopy GmbH | 489063 0000 000 | EX BP 572/25, BS FT 590, EM BP 629/62 |
| Mount S | Carl Zeiss Microscopy GmbH | 435402 0000 000 | |
| Objektive PlanApo Z 0,5x/0,125 FWD 114 mm | Carl Zeiss Microscopy GmbH | 435280 9050 000 | 164 mm parfocal length; M62x0.75 thread at front |
| Coarse/fine drive with profile column | Carl Zeiss Microscopy GmbH | 435400 0000 000 | 490 mm, 10 kg load capacity, compatible with stand bases 300/450 |
| Stand base 450 | Carl Zeiss Microscopy GmbH | 435430 9902 000 | |
| Cold-light source Zeiss CL 9000 LED CAN | Carl Zeiss Microscopy GmbH | 435700 9000 000 | |
| CAN-bus cable | Carl Zeiss Microscopy GmbH | 457411 9011 000 | 2.5 m length |
| Slit-ring illuminator | Carl Zeiss Microscopy GmbH | 417075 9010 000 | d = 66 mm |
| Flexible light guide 1500 | Carl Zeiss Microscopy GmbH | 417063 9901 000 | 8/1,000 mm |
| Illumination Adapter for light guide | Carl Zeiss Microscopy GmbH | 000000 1370 927 | |
| Lightguide HXP with liquid fill | Carl Zeiss Microscopy GmbH | 000000 0482 760 | ø3 mm x 2,000 mm |
| Camera Adapter 60N-C | Carl Zeiss Microscopy GmbH | 426113 0000 000 | 2/3" 0.63X |
| High Resolution Microscopy Camera AxioCam MRm Rev. 3 FireWire | Carl Zeiss Microscopy GmbH | 426509 9901 000 | |
| AxioCam FireWire Trigger Cable Set | Carl Zeiss Microscopy GmbH | 426506 0002 000 | for direct shutter synchronization |
| ZEN pro 2012 | Carl Zeiss Microscopy GmbH | 410135 1002 120 | Blue edition, requires min. Windows 7 64-bit |
| ZEN Module Time Lapse | Carl Zeiss Microscopy GmbH | 410136 1031 110 | |
| Standard Heating Stage Top Incubator | Tokai Hit | INUL-MS1-F1 | |
| Zeiss Stereo Microscope Base Adapter | Tokai Hit | MS-V12 | |
| Softwares | |||
| ImageJ | National Institute of Health, Bethesda, MD, USA | v 1.49m | |
| BioVoxxel plugin | BioVoxxel | http://www.biovoxxel.de/development/ |
参考文献
- Nadell, C. D., Xavier, J. B., Foster, K. R. The sociobiology of biofilms. FEMS Microbiol Rev. 33 (1), 206-224 (2009).
- West, S. A., Griffin, A. S., Gardner, A., Diggle, S. P. Social evolution theory for microorganisms. Nat Rev Microbiol. 4 (8), 597-607 (2006).
- Kovács, &. #. 1. 9. 3. ;. T. Impact of spatial distribution on the development of mutualism in microbes. Front Microbiol. 5, 649 (2014).
- Martin, M., Hölscher, T., Dragoš, A., Cooper, V. S., Kovács, &. #. 1. 9. 3. ;. T. Laboratory evolution of microbial interactions in bacterial biofilms. J Bacteriol. , (2016).
- Drescher, K., Nadell, C. D., Stone, H. A., Wingreen, N. S., Bassler, B. L. Solutions to the public goods dilemma in bacterial biofilms. Curr Biol. 24 (1), 50-55 (2014).
- Momeni, B., Waite, A. J., Shou, W. Spatial self-organization favors heterotypic cooperation over cheating. Elife. 2, e00960 (2013).
- van Dyken, J. D., Müller, M. J., Mack, K. M., Desai, M. M. Spatial population expansion promotes the evolution of cooperation in an experimental Prisoner's Dilemma. Curr Biol. 23 (10), 919-923 (2013).
- van Gestel, J., Weissing, F. J., Kuipers, O. P., Kovács, &. #. 1. 9. 3. ;. T. Density of founder cells affects spatial pattern formation and cooperation in Bacillus subtilis biofilms. ISME J. 8 (10), 2069-2079 (2014).
- Momeni, B., Brileya, K. A., Fields, M. W., Shou, W. Strong inter-population cooperation leads to partner intermixing in microbial communities. Elife. 2, e00230 (2013).
- Müller, M. J., Neugeboren, B. I., Nelson, D. R., Murray, A. W. Genetic drift opposes mutualism during spatial population expansion. Proc Natl Acad Sci U S A. 111 (3), 1037-1042 (2014).
- Pande, S., et al. Privatization of cooperative benefits stabilizes mutualistic cross-feeding interactions in spatially structured environments. ISME J. 10, 1413-1423 (2016).
- Hallatschek, O., Hersen, P., Ramanathan, S., Nelson, D. R. Genetic drift at expanding frontiers promotes gene segregation. Proc Natl Acad Sci U S A. 104 (50), 19926-19930 (2007).
- Flemming, H. C., Wingender, J. The biofilm matrix. Nat Rev Microbiol. 8 (9), 623-633 (2010).
- Vlamakis, H., Chai, Y., Beauregard, P., Losick, R., Kolter, R. Sticking together: building a biofilm the Bacillus subtilis way. Nat Rev Microbiol. 11 (3), 157-168 (2013).
- Lopez, D., Kolter, R. Extracellular signals that define distinct and coexisting cell fates in Bacillus subtilis. FEMS Microbiol Rev. 34 (2), 134-149 (2010).
- Lopez, D., Vlamakis, H., Kolter, R. Generation of multiple cell types in Bacillus subtilis. FEMS Microbiol Rev. 33 (1), 152-163 (2009).
- Mhatre, E., Monterrosa, R. G., Kovács, &. #. 1. 9. 3. ;. T. From environmental signals to regulators: Modulation of biofilm development in Gram-positive bacteria. J Basic Microbiol. , (2014).
- Zhang, W., et al. Nutrient depletion in Bacillus subtilis biofilms triggers matrix production. New J Physics. 16, 015028 (2014).
- Kearns, D. B. A field guide to bacterial swarming motility. Nat Rev Microbiol. 8 (9), 634-644 (2010).
- Morales-Soto, N., et al. Preparation, imaging, and quantification of bacterial surface motility assays. J Vis Exp. (98), (2015).
- Angelini, T. E., Roper, M., Kolter, R., Weitz, D. A., Brenner, M. P. Bacillus subtilis spreads by surfing on waves of surfactant. Proc Natl Acad Sci U S A. 106 (43), 18109-18113 (2009).
- Grau, R. R., et al. A Duo of Potassium-Responsive Histidine Kinases Govern the Multicellular Destiny of Bacillus subtilis. MBio. 6 (4), e00581 (2015).
- Park, S. Y., Pontes, M. H., Groisman, E. A. Flagella-independent surface motility in Salmonella enterica serovar Typhimurium. Proc Natl Acad Sci U S A. 112 (6), 1850-1855 (2015).
- van Gestel, J., Vlamakis, H., Kolter, R. From cell differentiation to cell collectives: Bacillus subtilis uses division of labor to migrate. PLoS Biol. 13 (4), e1002141 (2015).
- Abee, T., Kovács, &. #. 1. 9. 3. ;. T., Kuipers, O. P., van der Veen, S. Biofilm formation and dispersal in Gram-positive bacteria. Curr Opin Biotechnol. 22 (2), 172-179 (2011).
- Kovács, &. #. 1. 9. 3. ;. T. Bacterial differentiation via gradual activation of global regulators. Curr Genet. 62 (1), 125-128 (2016).
- Hölscher, T., et al. Motility, chemotaxis and aerotaxis contribute to competitiveness during bacterial pellicle biofilm development. J Mol Biol. 427 (23), 3695-3708 (2015).
- Seminara, A., et al. Osmotic spreading of Bacillus subtilis biofilms driven by an extracellular matrix. Proc Natl Acad Sci U S A. 109 (4), 1116-1121 (2012).
- Patrick, J. E., Kearns, D. B. Laboratory strains of Bacillus subtilis do not exhibit swarming motility. J Bacteriol. 191 (22), 7129-7133 (2009).
- de Jong, I. G., Beilharz, K., Kuipers, O. P., Veening, J. W. Live Cell Imaging of Bacillus subtilis and Streptococcus pneumoniae using Automated Time-lapse Microscopy. J Vis Exp. (53), e3145 (2011).
- Garcia-Betancur, J. C., Yepes, A., Schneider, J., Lopez, D. Single-cell analysis of Bacillus subtilis biofilms using fluorescence microscopy and flow cytometry. J Vis Exp. (60), (2012).
- Turnbull, L., et al. Super-resolution imaging of the cytokinetic Z ring in live bacteria using fast 3D-structured illumination microscopy (f3D-SIM). J Vis Exp. (91), e51469 (2014).
- Barken, K. B., et al. Roles of type IV pili, flagellum-mediated motility and extracellular DNA in the formation of mature multicellular structures in Pseudomonas aeruginosa biofilms. Environ Microbiol. 10 (9), 2331-2343 (2008).
- Oliveira, N. M., et al. Biofilm formation as a response to ecological competition. PLoS Biol. 13 (7), e1002191 (2015).
- Wang, X., et al. Probing phenotypic growth in expanding Bacillus subtilis biofilms. Appl Microbiol Biotechnol. 100, 4607-4615 (2016).
- Detert Oude Weme, R. G., et al. Single cell FRET analysis for the identification of optimal FRET-pairs in Bacillus subtilis using a prototype MEM-FLIM system. PLoS One. 10 (4), e0123239 (2015).
- Overkamp, W., et al. Benchmarking various green fluorescent protein variants in Bacillus subtilis, Streptococcus pneumoniae, and Lactococcus lactis for live cell imaging. Appl Environ Microbiol. 79 (20), 6481-6490 (2013).
- Stannek, L., Egelkamp, R., Gunka, K., Commichau, F. M. Monitoring intraspecies competition in a bacterial cell population by cocultivation of fluorescently labelled strains. J Vis Exp. (83), e51196 (2014).
- Bridier, A., Briandet, R. Contribution of confocal laser scanning microscopy in deciphering biofilm tridimensional structure and reactivity. Methods Mol Biol. 1147, 255-266 (2014).
- Khajotia, S. S., Smart, K. H., Pilula, M., Thompson, D. M. Concurrent quantification of cellular and extracellular components of biofilms. J Vis Exp. (82), e50639 (2013).
- Neu, T. R., Lawrence, J. R. Innovative techniques, sensors, and approaches for imaging biofilms at different scales. Trends Microbiol. 23 (4), 233-242 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved