Method Article
Yüzey koloniler Mikrobiyal Populasyonlarında Mekansal Ayrışma İzleme
Bu Makalede
Özet
evrim senaryolarda çeşitler (mekansal ayrışmanın) rolü mekansal dağılımı ayarı kontrollü izin laboratuvarda basit mikrobik sistemler kullanılarak incelenebilir. Kurucu hücre yoğunluğu değiştirerek, çeşitli çeşitler seviyeleri, Bacillus subtilis, koloni biyofilm floresan etiketli bakteriyel suşlar kullanılarak görüntülenebilir.
Özet
Microbes provide an intriguing system to study social interaction among individuals within a population. The short generation times and relatively simple genetic modification procedures of microbes facilitate the development of the sociomicrobiology field. To assess the fitness of certain microbial species, selected strains or their genetically modified derivatives within one population, can be fluorescently labelled and tracked using microscopy adapted with appropriate fluorescence filters. Expanding colonies of diverse microbial species on agar media can be used to monitor the spatial distribution of cells producing distinctive fluorescent proteins.
Here, we present a detailed protocol for the use of green- and red-fluorescent protein producing bacterial strains to follow spatial arrangement during surface colonization, including flagellum-driven community movement (swarming), exopolysaccharide- and hydrophobin-dependent growth mediated spreading (sliding), and complex colony biofilm formation. Non-domesticated isolates of the Gram-positive bacterium, Bacillus subtilis can be utilized to scrutinize certain surface spreading traits and their effect on two-dimensional distribution on the agar-solidified medium. By altering the number of cells used to initiate colony biofilms, the assortment levels can be varied on a continuous scale. Time-lapse fluorescent microscopy can be used to witness the interaction between different phenotypes and genotypes at a certain assortment level and to determine the relative success of either.
Giriş
Son yıllarda, mikroplar yeryüzünde 1,2 çeşitli ekosistemlere ile ilişkili sosyal topluluklar olarak kabul edilmiştir. Genel laboratuvar uygulamada kullanılan planktonik kültürleri aksine, ortamda mikroplar ekolojik ortamda bağlı mekansal topluluğu yapılar çok çeşitli göstermektedir. Basit mikrobiyal sistemleri sosyal etkileşimler 3,4 evriminde mekansal yapıların sonucu anlamak için kullanılabilir. Hem ökaryot ve prokaryot modeli sistemleri kullanılarak son 2-3 yıl içinde Yayınları mikrobiyal nüfus 5-8 içinde işbirliğinin istikrar üzerindeki mekansal yapıların etkisini vurguladı. Buna ek olarak, aynı zamanda etkileşim ortakları 9-11 mekansal dağılımını değiştirebilir olabilir, örneğin, mikroplar arasında metabolik çapraz besleme etkileşimleri zorunlu. Bu çalışmalarda mekansal yapısının etkisi çoğunlukla bu yüzden yaşayan yüzey ekli sesil hücreler kullanılarak incelenmiştir-bunlara biyofilmler veya koloniler bir agar ortamı yüzeyinde büyüyen. Yüksek uzaysal çeşitler ile sonuçlanan genetik sürüklenme mikrobiyal koloniler görülebilir yerlerde bazı klonal linages 12 yüksek yerel sabitleme olasılığını yol açan genetik darboğazları serisinin bir hücre bölünmesi aracılı genişleme sonuçlarının kenarında besin tükenmesi. Genetik sürüklenme Bu nedenle mikrobiyal koloniler mekansal ayrışmanın rolünü incelemek için kullanılabilir.
Ortamda, biyofilm kendi ürettiği polimerik matris 13 ile çevrili multispecies topluluklardır. Biyofilm yapısı, işlevi ve istikrar bakteri alışverişi sinyalleri, matris bileşenleri ve kaynakları ya da alanı için rekabet ve toksinler ve antibiyotikler kullanarak besin. Bacillus subtilis son derece organize geliştirir konut ve kök-kolonize bakteri toprak sosyal etkileşimlerin karmaşık bir ağ bağlıdır biyofilm topluluklar 14. Sosyal benzer bir şekildeBöcekler, B. subtilis hücreleri hücre dışı matriks üretici ve yamyamlar, hareketli hücreler, uyuyan sporlar ve diğer hücre tipleri 15,16 subpopülasyonunun geliştirilmesi, emek stratejisinin bir bölümü kullanır. Farklılaşma süreci dinamik ve çevre koşullarına 17,18 tarafından değiştirilebilir.
bakteriler tarafından yüzey kolonizasyon Stratejileri kolayca büyüme ortamında agar konsantrasyonu değiştirerek laboratuvar koşullarında manipüle edilebilir. Yarı-katı agar (0,7-1% ağar) kamçı tahrik topluluk 19-21 swarming denilen, yayılan kolaylaştırır iken düşük agar seviyelerde (0.2-0.3%) at, aktif kamçı barındıran bakteri, yüzmek mümkün. Flagellum'un yokluğunda, belirli bir bakteri türleri, ekzopolisakkarit matris ve salgılanan hidrofobin bileşikleri 22-24 kolaylaştırılmıştır, yani büyüme göre popülasyon artışı kayma ile yan-katı ortam üzerinde hareket etmek mümkündür. Son olarak, capabl bakteri olanSert agar ortamında (1.2-2%) 14,17,25 üzerinde biyofilm geliştirme formu mimari kompleks kolonilerin e. Bu özellikler tam doğal yaşam ortamlarında, koşulları ayarlayarak laboratuarda incelenir iken bu yüzey yayılan stratejiler başka çevresel koşullara bağlı olarak 26 kademeli birinden geçiş olabilir. Tek hücre bazlı motilite, Gram-pozitif ve negatif hem bakteri 27 B kompleks koloni biyofilm hava-sıvı arayüzü biyofilm gelişiminin başlatılması sırasında kritik iken subtilis Flagellar motilite 28 silinmesi etkilenmez. B. gelişimi sırasında Bununla birlikte, mekansal organizasyon subtilis koloni biyofilm biyofilm 8 başlatmak için kullanılan bakteriyel inokulum yoğunluğuna bağlıdır.
Burada, B. kullanın subtilis yüzey kolonizasyon sırasında mekansal ayrışma nüfus düzeyi motilite mekanizması bağlıdır göstermek içinTy (yani kaynaşan veya sürme) ve koloni biyofilm gelişimi kurucu hücre yoğunluğuna bağlıdır. Biz sürekli makro ölçekte mikrobiyal biyofilm büyümesi, yüzey kolonizasyon ve ürün yelpazesine izlemek için uygulanabilecek bir floresan mikroskop aracı sunuyoruz. Dahası, bir miktar yöntemi popülasyonunda göreli gerilme bolluk belirlemek için sunulmuştur.
Protokol
Kültür Medya, Yarı-katı Ağar ve Biyofilm plakaları, Ön kültürlerin hazırlanması 1.
- Swarming ve Kayar orta Hazırlık
- Lenox Broth (LB) 2 g ve 120 ° C de 20 dakika boyunca 100 mi, iyon-değişimli su içinde agar-agar ve otoklav 0.7 g çözündürülür. deneyler arasında yeniden iyileştirmek için küçük hacimli (50-200 ml) kullanın.
- Hemen Sterilizasyon sonrasında, en az 2 saat süreyle 55 ° C kuluçka makinesi içinde buharlaştırma ve yeri azaltmak üzere, aracın şişenin kapağını kapatın.
- ortam sıcaklığı, 55 ° C'ye kadar temperlenmiş sonra, bir laboratuar steril bir başlık altında 90 mm çapında bir polistiren Petri kabı içine 20 ml agar LB ortamı dökün. hızlandırılmış deneyler için, 35 mm çapında bir polistiren Petri çanağı başına 5 ml agar LB ortamı dökün.
- Hemen döküldükten sonra petri kapatın birbirinin üstüne en fazla 4 tabak yığını ve agar ortamı en az 1 saat süreyle katılaşmaya edelim.
- 2xSG Orta PKoloni Biyofilmler için tazminat
- Nutrient Broth 1.6 g, KCI 0.2 g, MgSO 4 0.05 g 7H 2 O ve 120 ° C 'de 20 dakika boyunca 100 mi, iyon-değişimli su içinde agar-agar ve otoklav 1.5 g çözündürülür. deneyler arasında yeniden iyileştirmek için küçük hacimli (50-200 ml) kullanın.
- Hemen Sterilizasyon sonrasında, en az 2 saat süreyle 55 ° C kuluçka makinesi içinde buharlaşmasını azaltmak ve şişe yerleştirin orta şişenin kapağını kapatın.
- Orta sıcaklık kendiliğinden ayarlanan 55 ° C olan sonra 1 M Ca steril 0.1 mi filtre ekle (3) 2 çözeltisi, 0.1 mi filtre 0.1 mi filtre 1 mM FeSO 4 çözeltisi ve 0.5 ml steril 100 mM MnCI2 solüsyonu sterilize steril% 20 glükoz çözeltisi.
- Bir laboratuar steril bir muhafaza içinde, 90 mm çapında bir polistiren Petri çanağı başına 20 mi agar 2x SG orta dökün. hızlandırılmış deneyler için, 35 mm çapında bir polistiren Petri çanağı başına 5 ml agar LB ortamı dökün.
- Clos, Dökümden hemen sonra, petri e birbirinin plaka yığını, ancak en fazla 4 plakaları ve agar ortamı en az 1 saat boyunca katılaşmaya sağlar.
- Starter Kültürlerin Hazırlanması
NOT: B. subtilis 168, kurucu aşağıda tarif edilen yöntemlerde kullanılan NCIB 3610 türevi suşları sera veya kırmızı-floresan proteinleri üretmek ve 8,27 daha önce tarif edilmiştir. Suşları -80 ° C derin dondurucuda rutin saklanır.- 3 mi LB ortamında -80 ° C stoklarından başlatıcı kültürlerin aşılanmasında ve yatay bir çalkalama (225 rpm) ile 37 ° C'de (16-18 saat), gece boyunca inkübe edilir. Vahşi B. izolatları olarak 18 saat daha uzun kültür inkübe etmeyin subtilis toplamak ve deney tüpünde bir biyofilm oluşturmak için çoğunlukla yatkındır.
Yüzey Fluoresan bakımından etiketlenmiş Bakteriyel Suşlarının 2. Eş-aşılama Yayılma
- Swarming için Yarı katı Agar Tabaklar kurutulması veB. Sürme subtilis.
- kaynaşan ve aşılama öncesinde 20 dakika boyunca kayar Kuru agar plakaları. Laminer akış kaputu ele geçen kuru plakalar (Şekil 1).
Not: Bakteriyel kaynaşma ve kayma yan-katı agar ortamı kuruyana bağlıdır. Yetersiz kurutma kamçı aracılı yüzme sonuçlanan agar ortamı üzerinde su birikmesini sağlar. kaynıyordu eksikliği Uzamış kurutma süresi sonuçları.
- kaynaşan ve aşılama öncesinde 20 dakika boyunca kayar Kuru agar plakaları. Laminer akış kaputu ele geçen kuru plakalar (Şekil 1).
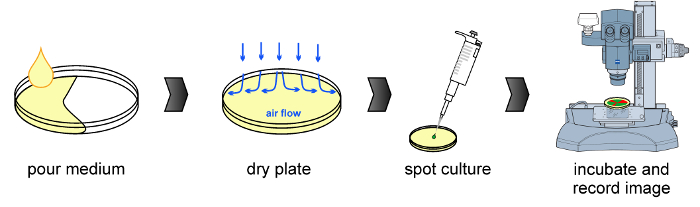
Şekil 1:.. Deneysel iş akışı ortak prosedür (soldan sağa) plaka, aşılama ve floresan mikroskopi algılama kurutma, kültür ortamının hazırlanması da dahil olmak üzere, şekilde tasvir edilmiştir , bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
- Eş aşılamaSwarming ve Sürme Bakteriyel Kültürlerin
- 600 nm gecede starter kültürlerin optik yoğunlukları belirlemek ve B yoğunluğu normalize yeşil-kırmızı-floresan protein üreten suşlar mix subtilis NCIB 3610 veya 1.5 ml'lik tepkime tüpü içinde kendi Δ YY türevidir. Örneğin, hafif gerilme 2. vorteks (maksimum hızda 3 sn) ul ([streyn 2 gece boyunca bir kültürü OD600] / 100 * [suş 1 gece boyunca bir kültürü OD600]) için olan gerginlik 1 100 ul karıştırın homojen dağılımı.
NOT: B. bunların Δ kocakarı türevleri sürgülü için kullanılır ise subtilis NCIB 3610 suşları swarming gözlemlemek için aşılanır. - Noktası önceden kurutulmuş bir levhanın ortasında karışık bir kültür 2 ul (Şekil 1 'e bakınız) ve ayrıca aşılamadan sonra, 10 dakika boyunca plaka kurutun.
- 37 ° C'de inkübe aşırı nem kapağındaki ve agar yüzeyi üzerinde yoğunlaşmasına izin upright'a.
Not: B için İnkübasyon süresi subtilis kaynaşma 8-16 saat arasında, tipik olarak. Genellikle, sürünün kenarı 8 saat 90 mm Petri kabı yan ulaşır. Kayar daha yavaş bir süreçtir ve kuluçkalama en az 16-42 saat gerektirir. 36 saat sonra, sürgülü ön 90 mm Petri kabı yan ulaşır. - hızlandırılmış deneyler için, 37 ° C 'ye ayarlanmış önceden ısıtılmış bir aşamalı inkübasyon odası içinde 35 mm çapında Petri kapları yerleştirin. Petri kabı kapağı deney süresi boyunca kaldırıldı kalır emin olun. kuluçka üstündeki nem oluşumunu engelleyecek şekilde 40 ° C sahne kuvöz kapağını ayarlayın.
- 600 nm gecede starter kültürlerin optik yoğunlukları belirlemek ve B yoğunluğu normalize yeşil-kırmızı-floresan protein üreten suşlar mix subtilis NCIB 3610 veya 1.5 ml'lik tepkime tüpü içinde kendi Δ YY türevidir. Örneğin, hafif gerilme 2. vorteks (maksimum hızda 3 sn) ul ([streyn 2 gece boyunca bir kültürü OD600] / 100 * [suş 1 gece boyunca bir kültürü OD600]) için olan gerginlik 1 100 ul karıştırın homojen dağılımı.
Farklı Başlangıç Hücre Sıklıklarında ile Fluoresan bakımından etiketlenmiş Bakteriyel Suşlarının 3. Eş-aşılama
- B. Colony Biyofilm Oluşumunun için Ağar Tabaklar Kurutma subtilis.
- laminer akışta kapaksız koloni biyofilm gelişimi için plakaları kurulayıninokülasyondan önce 15 dakika için başlık.
NOT: artan nem ve yüzme ya da kaynıyordu Yetersiz kurutma sonuçları 29 mümkün olabilir. küçük biyofilm kolonilerinde çok uzun sonuçların Kurutma.
- laminer akışta kapaksız koloni biyofilm gelişimi için plakaları kurulayıninokülasyondan önce 15 dakika için başlık.
- Koloni Biyofilmler için 10-kat seyreltilmiş Starter Kültür hazırlanması
- B. gecede starter kültür üreten yeşil-kırmızı-floresan protein 100 ul karıştırın homojen dağıtımı için 1.5 ml'lik tepkime tüpü içinde subtilis 168 ve hafif vorteks. LB ortamında 10 katlı bir seyreltme serisi hazırlanır.
- Seyreltilmiş olmayan ya da 10 1 10 2 Spot 2 ul, 10 3, biyofilm uyaran orta içeren plaka üzerinde 10 4 seyreltilmiş karışık kültürler.
NOT: 6 ila 9 biyofilm koloniler koloniler birbirine eşit mesafede ayrılır dikkate alarak, tek bir 90 mm Petri kabı başlatılabilir. - 30 ° C'de inkübe edin fazla nem kapak üzerinde yoğunlaşmasına izin dik olarakdeğil agar yüzeyinde.
NOT: B. için inkübasyon süresi subtilis biyofilm 3-1 arası gündür. Genel olarak, B koloni biyofilm subtilis 2 gün içinde ortalama büyüklüğü ve karmaşık bir yapıya ulaşır. - hızlandırılmış deneyler için, 35 mm çapında bir Petri tabağına ortasında tek bir inokulum yerleştirin ve 30 ° C 'ye ayarlanmış önceden ısıtılmış bir aşamalı inkübasyon odası içinde çanak yerleştirin. Petri kabı üst deney süresi boyunca kaldırıldı kalır emin olun. kuluçka üstündeki nem oluşumunu engelleyecek şekilde 35 ° C sahne kuvöz kapağını ayarlayın.
Etiketli Suşlarının 4. Floresan Mikroskopi Algılama
- Görüntüleme için donatım Açıklama.
- Yüzey kolonizasyonu ve floresan sinyali algılamak için, 0.5x PlanApo Amaç ile donatılmış bir motorlu floresan stereo zoom mikroskop (Malzeme Tablo ayrıntılı listeye bakınız) kullanın, iki LEDSoğuk ışık kaynakları (floresans saptama için bir ve görünür ışık için), filtre setleri 629 GFP (eksitasyon 470/40 nm ve emisyon 525/50 nm de) 572/25 nm ve MRFP (uyarma ve emisyon için / 62 nm) ve yüksek çözünürlüklü siyah-beyaz kamera.
- Çok kanallı ve zaman atlamalı modülleri dahil stereo zoom mikroskop için uygun yazılım ile görüntü elde etme ve işleme gerçekleştirin. zaman atlamalı deney için, bir adaptör ile stereo zoom mikroskop monte standart bir ısıtma aşaması inkübatör kullanın.
- Kaynıyordu ve Kayar Genişletme görüntüleme
- 90 mm levha mümkün olan en büyük alanını yakalamak için en düşük büyütme kullanın. radyal bakteriyel genişleme ve floresan izlenmesi görebilir alanın köşesine aşılama kökeni (90 mm Petri kabı orta) ayarlayın.
- floresan sinyal gücüne bağlı olarak optimum pozlama süresini ayarlayın.
NOT: yapısal Expre içinB. ssed floresans genleri yeşil-subtilis ve 1.5 ve 3 saniye maruz bırakma süreleri ile kırmızı floresans sırasıyla kullanılabilir. Buna ek olarak, 10 milisaniye kalma süresi görünür ışık için uygundur.
- Bütün biyofilm koloninin algılanmasını sağlar büyütme kullanın ve görüş alanının ortasında koloni ayarlayın.
NOT: swarming ve açılımları sürgülü gelince, en uygun pozlama süreleri biyofilm kolonilerinde floresan sinyalleri algılamak için floresan protein kodlayan genlerin ifadesi düzeyine bağlıdır. Aşağıdaki Örnek sonuçlar için, sera ve kırmızı floresans sırasıyla 1 ve 3 sn pozlama aralıkları kullanılarak tespit edildi. - Time-lapse görüntüleme için sabit pozlama süreleri kullanarak belirli aralıklarla görüntüleri elde edebilir.
- Nicel veri analizi için ImageJ yazılım tarafından tanınan bir dosya biçiminde floresan stereomikroskopta kaydedilen görüntüleri kaydedin.
5. Datbir Analiz
- her biri farklı etiketli floresan zorlanma tarafından işgal alanı analiz etmek için, bir BioVoxxel eklentisi ile genişletilmiş ImageJ yazılım ilgi dosyasını açın.
- tek seçenekleri seçilir ve "AutoScale" "Tüm dizi aç" nerede "Biyo-Biçimleri Alma Seçenekleri" denilen bir penceresi açıldığında, "Tamam" tuşuna basarak dosyayı açın.
NOT: dosyaları üç görüntüler, mikroskop (sera, kırmızı-floresan ve parlak alan görüntüleri) bir görüntü kaydetmek için kullanılan her kanal için tek bir yığın olarak görüntülenir. - "Yığınlar" - - "Image" seçeneğini seçerek tek tek kanal görüntüleri içine yığını ayırın ImageJ kontrol panelindeki "Görüntüler Stack".
NOT: Görüntüler ortaya çıkar ve 1/3 (yeşil kanal) olarak numaralandırılır, 2/3 (kırmızı kanal) ve 3/3 (parlak alan). Burada, parlak alan görüntü analizi hariç tutulur.
- tek seçenekleri seçilir ve "AutoScale" "Tüm dizi aç" nerede "Biyo-Biçimleri Alma Seçenekleri" denilen bir penceresi açıldığında, "Tamam" tuşuna basarak dosyayı açın.
- görüntüleri analiz etmek, seçerek bir 8-bit görüntü içine her dönüşümü"Resim" - "Tür" - "8-bit".
- "Ölçeği ayarla" - piksel 2 işgal alanı belirlemek için, "Analiz" kullanarak görüntüleri ölçeğini sıfırlayın. Bir pencere farklı ölçek seçenekleri ile açılır, "Scale çıkarmak için tıklayın" seçerek ölçek sıfırlayın. Tüm açık görüntüler için ölçek kaldırma seçeneği "Küresel" seçeneğini işaretleyin.
- arka planı kaldırmak için, ImageJ kontrol panelindeki "Oval" aracını kullanarak floresan sahasının hemen dışında bir oval alana (faiz bölge, YG) çizin.
- Arka plan oval boyutu tüm analiz görüntüler için aynı olduğundan emin olmak için, klavyenin [t] karakteri aracılığıyla ROI yöneticisi ekleyin. "Kaydet" seçenekleri - arka plan oval ROI "Diğer" aracılığıyla kaydedilebilir burada A ROI Yöneticisi penceresi gelir.
- "Tedbir" - Arka plan oval ROI resmin üzerine görünmüyorsa, "Analiz" seçerek alanın yoğunluğunu ölçmek.
NOT: Sonuçlardiğerleri arasında ortalama floresan yoğunluğu "Mean" etiketli sütununda görüntülenen nerede penceresi görüntülenir. - "Math" - - "Çıkart" ve ölçülen değer ekleyerek "Süreç" tıklayarak, arka plan oval ROI seçimini kaldırarak görüntü ortalama arka plan floresan yoğunluğu değerini çıkartın.
- "Ayarlama" - - "Eşik" seçeneği "Image" yoluyla görüntüye bir eşik uygulayın. yöntemi Otsu ve siyah-beyaz (B & W) seçin. "Karanlık arka plan" seçeneğini işaretleyin ve "Uygula" tıklayarak eşiğini kullanır.
NOT: eşiği siyah gösterilmiştir altında eşiğin üstünde alan beyaz ve gösterilen bir ikili görüntü görüntü değişir. - "Parçacıklar Analiz" seçeneği - "Analiz" üzerinden eşiğin üzerinde her şeyi seçin. ayarları ile penceresinde, varsayılan seçenekleri tutmak ve "S" sonuçlarını görüntüle "tutmak veummarize Toplam Alan "" sonuç penceresinde özet ve ekran etiketli sütunda işgal alanı görüntülemek için "OK" işaretli seçenekleri. Click ".
Sonuçlar
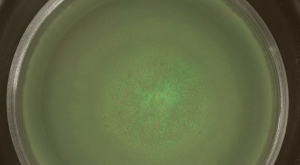
Bakteriyel nüfusun Laboratuvar sistemleri ekolojik ya da evrimsel soruları keşfetmek için cazip bir yaklaşım sağlamak. B. Burada, üç yüzey kolonizasyon modları subtilis, nüfus çeşitliliği görünümünü incelemek için kullanılan genetik olarak özdeş ayrılmasını, yani ancak suşları floresan farklı etiketli. B. bir kamçı bağımlı toplu yüzey hareketi olan kaynıyordu subtilis oldukça karışık bir popülasyon ile sonuçlanır. Bu swarming kolonilerde, sömürgeleştirilmiş alanlar örtüşen edildi yeşil-kırmızı-floresan bakteriler (Şekil 2A). Hızlı yüzey kolonizasyon zaman (Video Şekil 1) takip edilebilir. B subtilis kaynaşan sırasında, hücreler, ince bir tabaka inkübasyon birkaç saat sonra aşılama merkezi genişler (Şekil 2B).
4752 / 54752fig2.jpg "/>
Şekil 2: B. genişleme swarming . inokülasyon öncesinde 1: subtilis kaynaşan koloni 1 karıştırılmıştır sera ve kırmızı flüoresan suşlar içermektedir. (Sırasıyla GFP ve RFP) 15 saat, sera ve kırmızı floresans sonra (A), uygun flüoresan filtreler ile tespit edildi. (B) kaynaşma B ince bir tabaka görüntüleri subtilis video Şekil 1. Ölçek çubuğu = 5 mm çıkarılan seçilen zaman noktalarında gösterilmektedir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
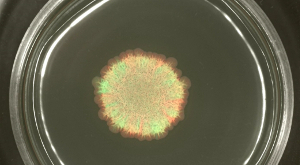
Bununla birlikte, B. Fonksiyonel kamçı eksik ama üretilen ekzopolisakkarit, hidrofobin ve sürfaktin yardımıyla yaymak için edebiliyoruz subtilis suşları, yarı-katı agar ortamı üzerinde lekeli, farklı etiketli suşları belirli def ayrıldıined sektörler (Şekil 3A bakınız). Sürgülü koloninin gelişimi (Şekil 3B veya Video Şekil 2) zamanında kaydedilebilir.

Şekil 3: B. koloni Sürme . inokülasyon öncesinde 1: subtilis koloni 1 karıştırılmıştır sera ve kırmızı flüoresan suşlar içermektedir. (Sırasıyla GFP ve RFP), 24 saat, sera ve kırmızı floresans sonra (A), uygun flüoresan filtreler ile tespit edildi. (B) B. görselleri diski sürgülü subtilis video Şekil 2. Ölçek çubuğu = 5 mm çıkarılan seçilen zaman noktalarında gösterilmektedir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
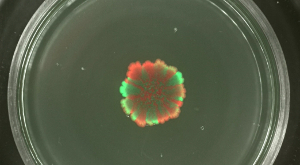
kaynıyordu ve sli çeşitler seviyelerinde ikending genişleyen koloniler modifiye edilemeyen, koloni biyofilm farklı etiketli floresan suşları mekansal ayrışma başlangıç hücre yoğunlukları etkilenmiş olabilir. Ne zaman B. kolonisi biyofilm subtilis karışık nüfusu yüksek hücre yoğunluğu ile başlatılan, sera ve kırmızı-floresan suşları küçük gösterdi ya da hiç uzaysal çeşitler (Şekil 4). biolfilm başlatmak için hücre yoğunluğu düşük tersine, açık yeşil-ve kırmızı floresans alanları floresan mikroskobu ile tespit edilebilir. Çeşitler seviyesi. Video Şekil 3 ve 4 aşılanmış suşların düşük ve en yüksek seyreltme için koloni genişleme mevcut biyofilm başlatan nüfusun seyreltme seviyesine açıkça bağımlı oldu.

Şekil 4: B. koloni biyofilmlerinde Ürün Çeşitliliği seviye en subtilis. (: sırasıyla kültürleri başlatılması seyreltildi 10 5 kez olmayan seyreltildi yukarıdan aşağıya), çeşitli başlangıç hücre yoğunluğu sera ve kırmızı floresans kolonilerini biyofilm farklı başlangıç hücre yoğunlukları ile aşılanmıştır 2 gün sonra gösterilmektedir. Ölçek çubuğu = 5 mm. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
yeşil-ve kırmızı flüoresan suşların oranı başka deneyler için kullanılan suşlar nüfus yapısı ve rekabet gücünü kantitatif nitelenebilmesine olanak veren ImageJ yazılımı kullanılarak belirlenebilir.
Video Şekil 1: Zaman atlamalı imagswarming B. es subtilis 1 ile başlatılan:. sera ve kırmızı floresan suşları 1 karışımı (Sağ indirmek için tıklayın.) Bu video 10 saat bir zaman sürecini gösterir. Ölçek çubuğu = 7 mm.

Video Şekil 2: B. Kayma Zaman atlamalı görüntüleri subtilis 1 ile başlatılan:. sera ve kırmızı floresan suşları 1 karışımı (Sağ indirmek için tıklayın.) Video 24 saatlik bir zaman sürecini gösterir. Ölçek çubuğu = 5 mm.
Video Şekil 3: B. Zaman atlamalı görüntüleri Yeşil 1 karışımı: subtilis koloni biyofilm 1 ile başlatılan-. Ve yüksek hücre yoğunluklarında kırmızı floresan suşları (Sağ indirmek için tıklayın.) Bu video 48 saat bir zaman sürecini gösterir. Ölçek çubuğu = 5 mm.
Video Şekil 4: B. Zaman atlamalı görüntüleri düşük hücre yoğunluklarında yeşil-kırmızı-floresan suşları 1 karışımı: subtilis koloni biyofilm 1 ile başlattı. (Sağ indirmek için tıklayın.) Video 48 saat bir zaman sürecini gösterir. Ölçek çubuğu = 5 mm.
Tartışmalar
Bakteriler için bir floresan araç kutusunun durumu heterojen gen ifadesi 30,31 ve protein lokalizasyonu 32 çalışma, aynı zamanda bir nüfus 8 içinde suşları mekansal dağılımı analizi sadece kolaylaştırır. yeterince farklı uyarım ve emisyon dalga boyları ile floresan belirteçler belirgin karıştırıldığında, aksi birbirinden ayırt edilemez iki soy lokalize sağlar. Açıklanan protokol suşları veya türlerin arasında karışık kültürlerinde popülasyon dinamikleri, örneğin rekabet eden veya sinerjizm gözlemlemek için kullanılabilir. floresan karışık bir popülasyonda suşları etiketli bolluklarının belirleme yeteneği bağlı kayar kaynaşma, veya biyofilm koloniler yüzey ile sınırlı değildir, ancak su altında dahil, hücre ya da hava orta arayüzü akış diğer çok-biyofilm sistemleri için de kullanılabilir 27,33-35 biyofilmlerde.
_content "> sunulan teknik suşları ve tasarım yarışması deneyleri mekansal dağılımını tespit etmek için güçlü bir araçtır, aynı zamanda genişleyen koloniler halinde gen ifade heterojenite takip verir. Burada anlatılan kültürleme koşulları B. subtilis ve genişleme için kesin parametreler için geçerlidir agar ortamı, diğer türler veya suşlar 20 için optimizasyonu gerektirebilir. bir inkübasyon odası içine numuneler yerleştirilerek görüntüleme zamanında popülasyon dinamiklerini takip deneyci izin ise, dikkat inkübasyon sırasında oda içindeki nem oranı verilmelidir rağmen.suşları birbirinden ayırt edilebilir flüoresan belirteçler için burada tarif edilen teknikler de incelenmiştir bakteri suşlarının genetik değişiklik gerektirir. Ayrıca, farklı uyarma ve emisyon spektrumları sahip yanı sıra, seçilen iki floresan belirteçler benzer kant olması önerilirum verimleri ve karşılaştırılabilir düzeyde ifade edilir (yayılan emilen foton yani oranı). Buna ek olarak, zaman içinde nispi yoğunluk değişiklikleri ölçülebilir ve bir deneyin bir erken zaman noktası normalize. göreceli artış veya azalma daha sonra farklı kuantum verimliliği ile farklı fluorophores arasında mukayese edilebilir. Sunulan deneysel sistem için farklı sera kırmızı fluoresan proteinleri B. tespit edilebilir en uygun flüoresan çiftleri için seçmek için daha önce 36,37 test edildi subtilis. Optimal maruz kalma süresi, her floresan proteini ve numune için tespit edilmelidir. Bazı hücre yoğunlukları veya hücrelerin çok katmanlı nüfus içinde verimli bir şekilde sinyali tespit etmek için gerekli olabilir. Bazı floresan proteinleri verimsiz ekspresyonu ve / veya protein çeviri ve böylece düşük kuantum verimi bakteri hücrelerinde düşük yoğunlukları sahip olabilir. Bu tür etkisiz fluoresan markörler olabilir Rsistemin duyarlılığını educe ve muhtemelen uyarım ışığı ile sitotoksisite sonuçlanan bakteri türleri tespit etmek için gerekli olan süreyi uzatmak. floresan şiddetleri buna göre flüoresan raportör geni kodlayan ifade etmek için kullanılan promotör değiştirilmesiyle değiştirilebilir. çok yüksek bir ifade seviyesi bakteri için zararlı Spor maliyetlerin floresan protein gereksiz fazla üretimi ile sonuçlanabilir. Yarışma deneyleri yaparken, bir hücrelerde özellikle floresan protein üretim maliyetini göz önünde bulundurmalıdır. floresan belirteçler yarıştı suşları ya da nerede kendi floresan belirteçler sadece farklı iki izogenik suşları birbirlerine karşı yarıştı edilir arasında takas edilir kontrol deneyleri, her zaman bir işaretleyici yönelik herhangi bir önyargı belirlemek için gereklidir. hücrelerin içinde floresan proteinleri ömürleri de ölçülen yoğunluğu etkileyebilir. Bazı bakteriyel ağaç cinsinden Ayrıca otofloresans burada açıklanan dışındaki farklı floresan belirteçlerin kullanımını gerektirebilir.
tam farklı bakteri türlerinin mekansal dağılımları ve bolluklarını belirlemek için, ikinci floresan işaretleyici ve tersi için floresan filtre kullanırken ilk floresan proteini kaynaklı arka plan sinyali tek tek işaretleyici üreten bakterileri içeren (monokültür numuneler üzerinde test edilmelidir ). Bu flüoresan sinyal yoğunlukları örtüşen çıkarma sağlar. stereomikroskop genişleyen koloni üzerinde floresans sinyali tespit da önemlisi, sunulan protokolü iki boyutlu uzamsal düzenlemesini belirlemek için uygundur. Genişleyen bakteri nüfusunun mimarisi (yani kırışıklık benzeri yapılar daha yüksek yerel floresan yoğunlukları görüntülendiği daha fazla hücre içerebilir) değişen floresan seviyeleri neden olabilir. Bu nedenle, görüntülerin tarif edilen analiz dmekansal dağılımı, ancak belli bir konumdaki suşları bolluğu etermines. Önceki protokoller bakteri kolonilerinin 38 nüfus dinamikleri 20 veya floresan görüntüleme swarming için numune hazırlama tarif, ama bizim protokol bu teknikleri birleştirir. Nüfus yapısının üç boyutlu çözünürlük (örn konfokal lazer tarama mikroskopisi 39,40 veya yapılandırılmış aydınlatma mikroskopisi 41) gözlem izin Diğer mikroskopi teknikleri artan yapısal karmaşıklığı ile örnekler için uygulanabilir. Bu ek teknikler de stereomicroscopes kullanarak mevcut değildir suşları 31 tek hücre bazlı algılama destekler.
Açıklamalar
Yazarlar hiçbir rakip mali çıkarları olduğunu beyan ederim.
Teşekkürler
Bu çalışma, Deutsche Forschungsgemeinschaft (DFG) den hibe KO4741 / 3-1 tarafından finanse edildi. Dahası, Á.TK laboratuar Marie Skłodowska Curie kariyer entegrasyon hibe (PheHetBacBiofilm) tarafından desteklenen ve DFG gelen KO4741 / 2-1 hibe edildi. TH, AD, RG-M., Ve EM sırasıyla Uluslararası Max Planck Research School, Alexander von Humboldt vakıf, Consejo Nacional de Ciencia y Tecnologia-Alman Akademik Değişim Servisi (DAAD CONACyT-), ve JSMC burs, tarafından desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Lennox Broth (LB) | Carl Roth GmbH | X964 | |
| Agar-agar, Kobe I | Carl Roth GmbH | 5210 | |
| Petri dish (90 mm diameter) | any | NA | Use Petri dishes without ventillation cams |
| Petri dish (35 mm diameter) | any | NA | Use Petri dishes without ventillation cams |
| Difco Nutrient Broth | BD Europe | 234000 | |
| KCl | any | NA | |
| MgSO,4 7H2O | any | NA | |
| Ca(NO3)2 4H2O | any | NA | |
| MnCl24H2O | any | NA | |
| FeSO4 | any | NA | |
| D-Glucose | any | NA | |
| Fluorescence AxioZoom V16 time-lapse microscope | Carl Zeiss Microscopy GmbH | see bellow detailed description | |
| AxioZoom V16 Microscope body | Carl Zeiss Microscopy GmbH | 435080 9030 000 | |
| Phototube Z 100:0 for Axio Zoom V16 | Carl Zeiss Microscopy GmbH | 435180 9020 000 | without eyepieces |
| Fluar Illuminator Z mot Fluorescence intermediate tube for Axio Zoom.V16 | Carl Zeiss Microscopy GmbH | 435180 9060 000 | |
| Controller EMS 3 | Carl Zeiss Microscopy GmbH | 435610 9010 000 | |
| System Control Panel SYCOP 3 | Carl Zeiss Microscopy GmbH | 435611 9010 000 | |
| Reflector module Z | Carl Zeiss Microscopy GmbH | 435180 9160 000 | For Fluar Illuminator Z mot on Axio Zoom.V16 and SYCOP 3 |
| Filter set 38 HE eGFP shift free (E) | Carl Zeiss Microscopy GmbH | 489038 9901 000 | EX BP 470/40, BS FT 495, EM BP 525/50 |
| Filter set 63 HE mRFP shift free (E) | Carl Zeiss Microscopy GmbH | 489063 0000 000 | EX BP 572/25, BS FT 590, EM BP 629/62 |
| Mount S | Carl Zeiss Microscopy GmbH | 435402 0000 000 | |
| Objektive PlanApo Z 0,5x/0,125 FWD 114 mm | Carl Zeiss Microscopy GmbH | 435280 9050 000 | 164 mm parfocal length; M62x0.75 thread at front |
| Coarse/fine drive with profile column | Carl Zeiss Microscopy GmbH | 435400 0000 000 | 490 mm, 10 kg load capacity, compatible with stand bases 300/450 |
| Stand base 450 | Carl Zeiss Microscopy GmbH | 435430 9902 000 | |
| Cold-light source Zeiss CL 9000 LED CAN | Carl Zeiss Microscopy GmbH | 435700 9000 000 | |
| CAN-bus cable | Carl Zeiss Microscopy GmbH | 457411 9011 000 | 2.5 m length |
| Slit-ring illuminator | Carl Zeiss Microscopy GmbH | 417075 9010 000 | d = 66 mm |
| Flexible light guide 1500 | Carl Zeiss Microscopy GmbH | 417063 9901 000 | 8/1,000 mm |
| Illumination Adapter for light guide | Carl Zeiss Microscopy GmbH | 000000 1370 927 | |
| Lightguide HXP with liquid fill | Carl Zeiss Microscopy GmbH | 000000 0482 760 | ø3 mm x 2,000 mm |
| Camera Adapter 60N-C | Carl Zeiss Microscopy GmbH | 426113 0000 000 | 2/3" 0.63X |
| High Resolution Microscopy Camera AxioCam MRm Rev. 3 FireWire | Carl Zeiss Microscopy GmbH | 426509 9901 000 | |
| AxioCam FireWire Trigger Cable Set | Carl Zeiss Microscopy GmbH | 426506 0002 000 | for direct shutter synchronization |
| ZEN pro 2012 | Carl Zeiss Microscopy GmbH | 410135 1002 120 | Blue edition, requires min. Windows 7 64-bit |
| ZEN Module Time Lapse | Carl Zeiss Microscopy GmbH | 410136 1031 110 | |
| Standard Heating Stage Top Incubator | Tokai Hit | INUL-MS1-F1 | |
| Zeiss Stereo Microscope Base Adapter | Tokai Hit | MS-V12 | |
| Softwares | |||
| ImageJ | National Institute of Health, Bethesda, MD, USA | v 1.49m | |
| BioVoxxel plugin | BioVoxxel | http://www.biovoxxel.de/development/ |
Referanslar
- Nadell, C. D., Xavier, J. B., Foster, K. R. The sociobiology of biofilms. FEMS Microbiol Rev. 33 (1), 206-224 (2009).
- West, S. A., Griffin, A. S., Gardner, A., Diggle, S. P. Social evolution theory for microorganisms. Nat Rev Microbiol. 4 (8), 597-607 (2006).
- Kovács, &. #. 1. 9. 3. ;. T. Impact of spatial distribution on the development of mutualism in microbes. Front Microbiol. 5, 649 (2014).
- Martin, M., Hölscher, T., Dragoš, A., Cooper, V. S., Kovács, &. #. 1. 9. 3. ;. T. Laboratory evolution of microbial interactions in bacterial biofilms. J Bacteriol. , (2016).
- Drescher, K., Nadell, C. D., Stone, H. A., Wingreen, N. S., Bassler, B. L. Solutions to the public goods dilemma in bacterial biofilms. Curr Biol. 24 (1), 50-55 (2014).
- Momeni, B., Waite, A. J., Shou, W. Spatial self-organization favors heterotypic cooperation over cheating. Elife. 2, e00960 (2013).
- van Dyken, J. D., Müller, M. J., Mack, K. M., Desai, M. M. Spatial population expansion promotes the evolution of cooperation in an experimental Prisoner's Dilemma. Curr Biol. 23 (10), 919-923 (2013).
- van Gestel, J., Weissing, F. J., Kuipers, O. P., Kovács, &. #. 1. 9. 3. ;. T. Density of founder cells affects spatial pattern formation and cooperation in Bacillus subtilis biofilms. ISME J. 8 (10), 2069-2079 (2014).
- Momeni, B., Brileya, K. A., Fields, M. W., Shou, W. Strong inter-population cooperation leads to partner intermixing in microbial communities. Elife. 2, e00230 (2013).
- Müller, M. J., Neugeboren, B. I., Nelson, D. R., Murray, A. W. Genetic drift opposes mutualism during spatial population expansion. Proc Natl Acad Sci U S A. 111 (3), 1037-1042 (2014).
- Pande, S., et al. Privatization of cooperative benefits stabilizes mutualistic cross-feeding interactions in spatially structured environments. ISME J. 10, 1413-1423 (2016).
- Hallatschek, O., Hersen, P., Ramanathan, S., Nelson, D. R. Genetic drift at expanding frontiers promotes gene segregation. Proc Natl Acad Sci U S A. 104 (50), 19926-19930 (2007).
- Flemming, H. C., Wingender, J. The biofilm matrix. Nat Rev Microbiol. 8 (9), 623-633 (2010).
- Vlamakis, H., Chai, Y., Beauregard, P., Losick, R., Kolter, R. Sticking together: building a biofilm the Bacillus subtilis way. Nat Rev Microbiol. 11 (3), 157-168 (2013).
- Lopez, D., Kolter, R. Extracellular signals that define distinct and coexisting cell fates in Bacillus subtilis. FEMS Microbiol Rev. 34 (2), 134-149 (2010).
- Lopez, D., Vlamakis, H., Kolter, R. Generation of multiple cell types in Bacillus subtilis. FEMS Microbiol Rev. 33 (1), 152-163 (2009).
- Mhatre, E., Monterrosa, R. G., Kovács, &. #. 1. 9. 3. ;. T. From environmental signals to regulators: Modulation of biofilm development in Gram-positive bacteria. J Basic Microbiol. , (2014).
- Zhang, W., et al. Nutrient depletion in Bacillus subtilis biofilms triggers matrix production. New J Physics. 16, 015028 (2014).
- Kearns, D. B. A field guide to bacterial swarming motility. Nat Rev Microbiol. 8 (9), 634-644 (2010).
- Morales-Soto, N., et al. Preparation, imaging, and quantification of bacterial surface motility assays. J Vis Exp. (98), (2015).
- Angelini, T. E., Roper, M., Kolter, R., Weitz, D. A., Brenner, M. P. Bacillus subtilis spreads by surfing on waves of surfactant. Proc Natl Acad Sci U S A. 106 (43), 18109-18113 (2009).
- Grau, R. R., et al. A Duo of Potassium-Responsive Histidine Kinases Govern the Multicellular Destiny of Bacillus subtilis. MBio. 6 (4), e00581 (2015).
- Park, S. Y., Pontes, M. H., Groisman, E. A. Flagella-independent surface motility in Salmonella enterica serovar Typhimurium. Proc Natl Acad Sci U S A. 112 (6), 1850-1855 (2015).
- van Gestel, J., Vlamakis, H., Kolter, R. From cell differentiation to cell collectives: Bacillus subtilis uses division of labor to migrate. PLoS Biol. 13 (4), e1002141 (2015).
- Abee, T., Kovács, &. #. 1. 9. 3. ;. T., Kuipers, O. P., van der Veen, S. Biofilm formation and dispersal in Gram-positive bacteria. Curr Opin Biotechnol. 22 (2), 172-179 (2011).
- Kovács, &. #. 1. 9. 3. ;. T. Bacterial differentiation via gradual activation of global regulators. Curr Genet. 62 (1), 125-128 (2016).
- Hölscher, T., et al. Motility, chemotaxis and aerotaxis contribute to competitiveness during bacterial pellicle biofilm development. J Mol Biol. 427 (23), 3695-3708 (2015).
- Seminara, A., et al. Osmotic spreading of Bacillus subtilis biofilms driven by an extracellular matrix. Proc Natl Acad Sci U S A. 109 (4), 1116-1121 (2012).
- Patrick, J. E., Kearns, D. B. Laboratory strains of Bacillus subtilis do not exhibit swarming motility. J Bacteriol. 191 (22), 7129-7133 (2009).
- de Jong, I. G., Beilharz, K., Kuipers, O. P., Veening, J. W. Live Cell Imaging of Bacillus subtilis and Streptococcus pneumoniae using Automated Time-lapse Microscopy. J Vis Exp. (53), e3145 (2011).
- Garcia-Betancur, J. C., Yepes, A., Schneider, J., Lopez, D. Single-cell analysis of Bacillus subtilis biofilms using fluorescence microscopy and flow cytometry. J Vis Exp. (60), (2012).
- Turnbull, L., et al. Super-resolution imaging of the cytokinetic Z ring in live bacteria using fast 3D-structured illumination microscopy (f3D-SIM). J Vis Exp. (91), e51469 (2014).
- Barken, K. B., et al. Roles of type IV pili, flagellum-mediated motility and extracellular DNA in the formation of mature multicellular structures in Pseudomonas aeruginosa biofilms. Environ Microbiol. 10 (9), 2331-2343 (2008).
- Oliveira, N. M., et al. Biofilm formation as a response to ecological competition. PLoS Biol. 13 (7), e1002191 (2015).
- Wang, X., et al. Probing phenotypic growth in expanding Bacillus subtilis biofilms. Appl Microbiol Biotechnol. 100, 4607-4615 (2016).
- Detert Oude Weme, R. G., et al. Single cell FRET analysis for the identification of optimal FRET-pairs in Bacillus subtilis using a prototype MEM-FLIM system. PLoS One. 10 (4), e0123239 (2015).
- Overkamp, W., et al. Benchmarking various green fluorescent protein variants in Bacillus subtilis, Streptococcus pneumoniae, and Lactococcus lactis for live cell imaging. Appl Environ Microbiol. 79 (20), 6481-6490 (2013).
- Stannek, L., Egelkamp, R., Gunka, K., Commichau, F. M. Monitoring intraspecies competition in a bacterial cell population by cocultivation of fluorescently labelled strains. J Vis Exp. (83), e51196 (2014).
- Bridier, A., Briandet, R. Contribution of confocal laser scanning microscopy in deciphering biofilm tridimensional structure and reactivity. Methods Mol Biol. 1147, 255-266 (2014).
- Khajotia, S. S., Smart, K. H., Pilula, M., Thompson, D. M. Concurrent quantification of cellular and extracellular components of biofilms. J Vis Exp. (82), e50639 (2013).
- Neu, T. R., Lawrence, J. R. Innovative techniques, sensors, and approaches for imaging biofilms at different scales. Trends Microbiol. 23 (4), 233-242 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır