Method Article
ヒト好中球由来の巨大食細胞の新規亜集団の開発および同定
要約
ここで取得し、好中球由来の巨大食細胞の新たに特徴付け亜集団を同定するための方法を説明します。これらの細胞は、新鮮なヒト血液好中球からの文化の中で開発し、食作用、オートファジー、非常に大きなサイズ、および拡張寿命を特徴とします。この方法はさらに、このユニークな好中球由来の亜集団を調査することが不可欠です。
要約
好中球(PMN)は、最高の病原体および微生物の侵入に対する彼らの貪食機能のために知られています。彼らは、白血球の中で最も短い半減期を有し、それらの非活性状態に恒常的にアポトーシスにコミットしています。炎症を解決するために、炎症部位に補充すると、彼らは強力な抗菌殺害と細胞傷害性分子の配列を生成します。これらの強力な細胞傷害性分子は制御不能な様式で放出されている場合しかし、彼らは周囲の組織に損傷を与えることができます。しかし近年では、好中球汎用性がますます可塑性および免疫調節機能を実証することによって、証明されます。最近、このような顆粒球コロニー刺激因子(GM-CSF)/インターロイキン(IL)-4、サイトカイン/増殖因子を添加せずに、標準的な培養条件下で自然に発症する新しい好中球由来の亜集団を同定しました。好中球の残党の彼らの貪食能力が大幅に自分を高めるために貢献します非常にサイズ;したがって、彼らは巨大な食細胞(Gφ)と名付けました。好中球とは異なり、Gφは長い文化に住んでいたされています。彼らは、CD分類を表現(CD)好中球マーカーCD66b / CD63 / CD15 / CD11bの/ミエロペルオキシダーゼ(MPO)/好中球エラスターゼ(NE)、および単球系統マーカーCD14 / CD16 / CD163及び樹状CD1c / CD141マーカーを欠いています。彼らはまた、ラテックスおよびザイモサンをアップ取り、オプソニン化ザイモサンおよびPMAで刺激に酸化バーストによって応答します。 Gφはまた、スカベンジャーは、CD68 / CD36を受容体発現し、好中球とは異なり、酸化低密度リポタンパク質(oxLDLの)を内面化。また、新鮮な好中球、または単球培養とは異なり、それらは増大した活性酸素種(ROS)産生によってoxLDLの取り込みに応答します。さらに、これらの食細胞は、オートファジーの活性化を示し、微小管関連タンパク質1軽鎖3B(LC3B)コーティングされた空胞が含まれています。特異的阻害剤を使用することは、食作用およびオートファジーの両方がprerequisiであることは明らかですその開発と依存ROSオキシダーゼ可能性NADPHのためのTES。ここでは長寿命、好中球由来の食細胞の培養中の細胞、それらの同定とそれらの現在知られている特徴のこの新たな亜集団を調製するための方法が記載されています。このプロトコルは、さらにその重要性および機能を調べるためにGφを取得し、特徴づけるために必須です。
概要
多形核好中球(PMN)は、細胞傷害性分子の広い範囲を生成することにより、病原体の侵入に対する防御の最前線として、血液中の白血球の最大の人口を構成しています。伝統的な見方は、長い病原体および有害粒子のクリアランスの感染症と援助を戦うために急性の炎症部位に到着する最初のものである血液の循環、短命、専門の食細胞のそれとなっています。 1は 、非活性化状態では、好中球は、アポトーシスに対して恒常的にコミットしています。炎症部位への血液から移行する場合は、好中球は、炎症を解決するために活性化を受けています。これらは貪食ならびに好中球エラスターゼ(NE)と強力な殺菌活性を有するカテプシンなどの細胞傷害性分子などの活性酸素種(ROS)、溶菌酵素の配列を生成することによって、微生物の侵入殺します。トラップ病原体にするために、好中球はまた、細胞外トラップ(ネットを解放します)抗菌性ペプチドおよび様々な溶解酵素を含む核クロマチンのスレッドで構成されています。しかし、好中球からのこれらの細胞傷害性分子の制御されないリリースではまた、炎症反応を永続し、周囲の組織への損傷を誘発する可能性があります。 2したがって、マクロファージによるアポトーシス好中球の効果的なクリアランス(Mφ)及び樹状細胞(DC)は、炎症を解決することが重要です。 3、4、5、6
近年ではしかし、それは、好中球は、その機能がはるかに食作用および病原体の死滅を超えた汎用性の高い細胞であることが次第に明らかになっています。プライミングまたは活性化を受けていることで6、7、好中球の可塑性は徐々に注目を集めています。例えば、細菌およびマイコバクテリア挑戦好中球に示されました免疫調節性応答の存在を示唆し、インターロイキン(IL)-10を分泌し、炎症反応を制御します。 8分裂後の好中球は、Mφ様細胞、または消化ので、サイトカインおよび増殖因子、9、10で処理した場合、抗原断片を提示し、先天性および適応の統合に重要な役割を提供することにより、DC様細胞に分化するトランスに示されました反応。 図3に示すように 、成長因子で6活性化は、12、11、炎症部位およびMφ/ DCクリアランスシステムが不十分または圧倒され、特に、炎症、3、9の解像度でデブリの除去を促進することにより、アポトーシス性好中球または細胞破片の飲み込みを促進しました再助けるために潜在的な「自主規制」を示唆しています炎症反応を解きます。これは、アポトーシス以来、細胞毒性化合物の細胞外放出を阻害し、従って周囲の組織への損傷を防ぐことができ、規制自己死の一形態です。 6
長期生存は、好中球活性化の他の特徴であり、そのような顆粒球コロニー刺激因子(G-CSF)、顆粒球マクロファージコロニー刺激因子(GM-CSF)、インターフェロンなどの炎症性サイトカイン(のような種々の宿主由来の因子で処理することによって実証されましたIFN)-γ、腫瘍壊死因子(TNF)-αおよび/または病原体由来の生成物、従って、好中球は、それらの生存応答を調節することを可能にします。 図6は、実際には、好中球の生存率は、その可塑性のための前提条件であり、食作用を実行する能力と関連していました。 図6において 、13は、したがって、それはまたdepen表現型および機能の変化と関連付けることが示されました好中球の寿命延長に関与する新たなタンパク質の合成を誘導することによってアップレギュレートされた遺伝子発現にDED、およびアポトーシスを減少しました。 10
短命であり、恒常的に培養中にアポトーシスを受ける、または寿命を延長している上記のサイトカイン/増殖因子活性化好中球、好中球とは異なり、我々は最近、長期の標準的な培養中で自発的に発症する好中球の新しい、小さな亜集団を同定しました外部からのサイトカインや成長因子を追加することなく、新たに単離したヒト血液好中球からの条件。文献に以前に記載されていなかった14これらの好中球由来の細胞は、巨大食細胞(Gφ)と名付けました。 Gφが培養中の寿命を延長している、彼らは完全には5-7日以内に開発されており、ユニークな形態学的特徴、表現型発現および機能によって特徴づけられます。彼らは非常にautophagoによる拡大されます死んで好中球の残党のcytosis、空胞、およびファゴリソソームを含んでいます。 Gφは、特定の好中球顆粒マーカーを発現-分化のクラスター(CD)66bと、アズール顆粒マーカー-などのCD11b、NE、CD15、NADPHオキシダーゼサブユニットgp91- PHOXとp22-としてCD63およびミエロペルオキシダーゼ(MPO)と追加の好中球マーカーをPHOX、およびオートファジーのマーカー-LC3BII。 14、15機能的に、それら積極ラテックスビーズ及びザイモサン粒子アップ取り、ザイモサンおよびホルボール12-ミリステート13-アセテート(PMA)刺激に応答してROSを生成します。興味深いことに、新鮮な好中球とは異なり、Gφも集中スカベンジャー受容体CD68およびCD36を発現し、巻き取りは、低密度リポタンパク質(oxLDLの)を酸化し、oxLDLを用いた刺激に応答して、ROSを生成します。さらに、Gφは、単球系統マーカーCD14、CD16およびCD163または樹状マーカーCD1cおよびCD141を欠いています。また、PHAgocytosisとオートファジー、おそらく機能的なNADPHオキシダーゼは、その開発のための前提条件です。これは、貪食阻害剤のcytochalsinのB、オートファジー阻害剤3-メチルアデニン(3-MA)およびバフィロマイシン(BafA1)とNADPHオキシダーゼ阻害剤、以来 - ジフェニレンヨードニウム(DPI) - その発展を妨げました。さらに、単球/好中球共培養ならびにそれらの発展を妨げて断続的低酸素への曝露、持続的低酸素症への好中球の適応は明らかであったのに対し。 14,15文化の中で彼らの提案の開発を本論文では図1【選択プロトコルに示されているステップバイステップを新たに単離した循環ヒト血液好中球、その開発、同定およびいくつかの基本的な特性からGφの製造を記載しています。このプロトコルは、さらにcharacterizするために、広いスペクトルと、これらの新たに記載され、魅力的な好中球由来Gφの役割を調査し、明らかにするために使用することができますその重要性とその潜在的な機能を電子。
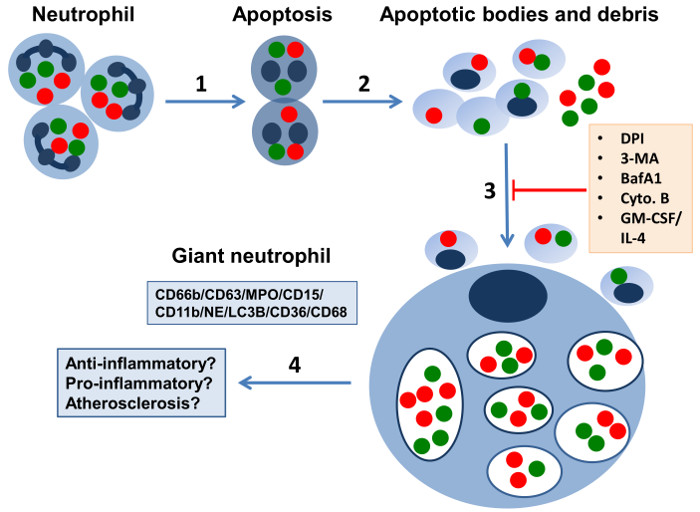
図1:7 日好中球培養における巨大細胞開発の略図。炎症部位でのオートファジー機構をトリガ核破片、顆粒(緑色と赤色のドット)を含む断片、および他の細胞内成分を(1)、好中球は、アポトーシス細胞死を起こし、かつ(2)離型膜囲まれていることが示唆されています。 (3)巨大食細胞(Gφ)機能NADPH oxidase.Theyを維持しながら、アポトーシス小体と好中球の破片を内在化によるサイトカインまたは成長因子を欠い長期好中球培養において開発は、様々な好中球CD66b + / CD63 + / MPO + / CD15 + / CD11bの+によって特徴づけられます/ NEマーカー、顆粒および細胞の破片、およびスカベンジャー受容体CD36とCD68を囲む大きなファゴソーム。ギガビット1;ほとんどはまた、様々な粒子や酸化LDLを内在化することができる細胞を、単核およびROSを生成しています。 Gφを充填液胞の膜は、オートファジー、巨大な食細胞の形成の間に厳密な関連性を示唆している、(濃い青でマーク)LC3B、オートファゴソーム膜のマーカーを含みます。 Gφは、GM-CSF / IL-4を含む培地中で開発することはありません。また、このようなNADPHオキシダーゼ阻害剤としての阻害剤 - ジフェニレンヨードニウム(DPI)、オートファジー阻害剤3-メチルアデニン(3-MA)およびバフィロマイシン(BafA1)および食作用阻害剤サイトカラシンB(。CYTO B)は、それらの形成を廃止します。 (4)in vivoでの潜在的なGφ機能が(この図は、我々の調査結果14に基づいて、15およびBによって付随論説から変更されたされた抗または前炎症性特性およびアテローム性動脈硬化のプロセスへの参加を含んでいてもよいですerton 20)。 この図の拡大版をご覧になるにはこちらをクリックしてください。
プロトコル
プロトコルは、ヘルシンキ宣言に従ってローカル人権委員会によって承認され、すべての参加者は、インフォームドコンセントフォームに署名しました。
1.好中球の単離および培養におけるGφの開発
注:すべてのステップは、バイオセーフティ層流フード内で滅菌組織グレードのリポポリサッカライド(LPS)フリー・ソリューションを使用して実行する必要があります。ロズウェルパーク記念研究所(RPMI)-1640培地に抗生物質、サイトカインまたは成長因子を追加しないでください。
- 無菌頭皮静脈セットを使用して、若い健康な成人から少なくとも40ミリリットルを静脈血を入手します。エチレンジアミン四酢酸K 3塩(K 3 EDTA)を含有するバキュテナーチューブに血液を描画し、穏やかに混合します。室温で血液を保管してください。
- 1.119および1.077グラム/ mlでポリスを使用して2段階の不連続密度勾配により好中球を分離します。使用する前に室温にソリューションを持参してください。
注:遠心分離の間に、赤血球細胞(赤血球)が急速ポリスや堆積物によって集約されます。好中球はポリス-1077 / 1119インタフェース( 図2を参照)で、ちょうど赤血球の上に発見されたのに対し、単核細胞(単球/リンパ球)は、上部プラズマとの間に見出される/、-1077インタフェースをポリス。このメソッドは、同じ個体から単核細胞および好中球の同時分離を可能にします。
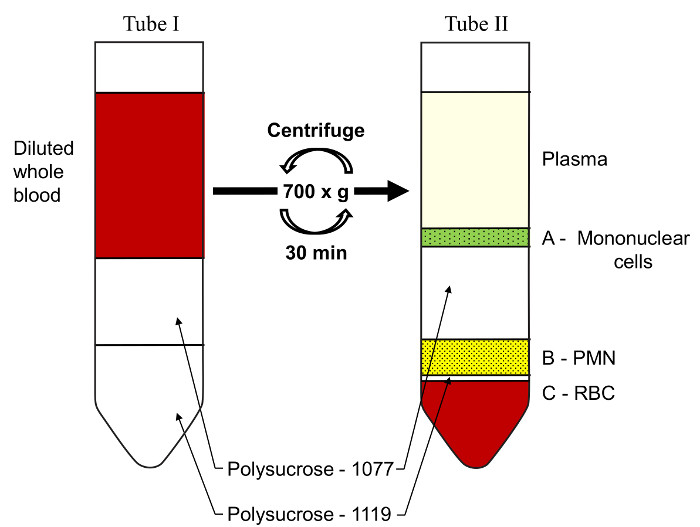
図2:ヒト全血からの好中球の単離。 1.077グラムでのポリスクロースは、/ mlを慎重に不連続勾配を形成するために、ポリスクロース、1.119グラム/ミリリットルの上に階層化されています。希釈された全血はその後ポリス-1.077の上に階層化されています。チューブは、すぐにブレーキなしで、室温で、30分間、700×gで遠心分離に供されます。三つの異なるバンドが注目されます。 (A)単核細胞を、(B)、多形核細胞(PMN)チューブの底部に、および(C)赤血球(RBC)。 この図の拡大版をご覧になるにはこちらをクリックしてください。
- 50ミリリットル滅菌ポリプロピレンコニカル遠心管の底に12ミリリットルポリスクロース-1119を追加します。
- 慎重ポリス-1119にポリスクロース-1077の12ミリリットルをレイヤー。
- 2%熱不活性化ウシ胎児血清(HI-FCS)を含有するイオンを含まないリン酸緩衝生理食塩水で24血液mlの最終容量(PBS)、12 mlの全血 - 10を希釈します。慎重にチューブの上部勾配に希釈した全血の24ミリリットルをレイヤー。
- ブレーキなし - (24°C 20)、室温で30分間、700×gで遠心分離します。
注:より低い温度での遠心分離は、細胞凝集と貧しい回復をもたらすことができます。 - 慎重に遠心分離機からチューブを取り外しwithoutは、勾配を乱します。二つの不透明な層が観察されるべきである(A:単核細胞およびB:PMN、 図2に示されています)。
- 吸引し、チューブに層A転送(または廃棄)上記0.5センチメートルこの層からの細胞に流体を捨てるには、「単核」と記されました。
- 吸引し、層B上記0.5センチメートル「PMN」と表示されたチューブに、この層から細胞を転送するには、残りの流体アップを廃棄します。
- プールの各2勾配管からのPMN及びPBS 30 mlの最終体積に2%HI-FCSを含む洗浄します。 200×gで12分間遠心し、上清を除去し、廃棄します。
- 静かに1ミリリットルの無菌ピペットチップで内外に描画することによってペレットを再懸濁しながら、赤血球(RBC)を、汚染を取り除くために、低張0.2%の氷冷滅菌のNaClの3ミリリットルを追加します。 30秒間、氷上で保管してください。
- 30秒後、チューブに滅菌1.6%氷冷のNaClの3ミリリットルを追加することによって、等張性を復元します。
- 等張食塩水の6ミリリットルに、6メートルを追加2%HI-FCSと12分間250×gで遠心分離を補っ予め温めた(37℃)RPMI-1640培地のリットル。上清を捨てます。 PMNペレットは、RBC汚染のクリーンでなければなりません。
注:RBCによって汚染された場合は、PMNペレットは赤みがかっを表示されます。 - いくつかの汚染RBCが残っている場合、繰り返しは9と10回以上繰り返します。
- 10%HI-FCSを添加した4ミリリットルRPMI-1640中で細胞ペレットを再懸濁し、トリパンブルー排除によってその濃度及び生存率を決定するために、細胞をカウントします。
- 1.25濃度調整- 1.5×10 6 PMN / mlの(実験的なニーズに応じて)、および1.0 mLの/ウェルで24ウェルプレートをプレート。
注:月グリューネ・ギムザ染色し、光学顕微鏡により評価されるように顆粒球集団における好中球の純度は常に95%を超えました。 - 播種後、内のセルを配置 37℃、加湿5%CO 2インキュベーター。
- そっとの半分を吸引することによって、3日毎に培地交換してください培地および10%HI-FCSを補充した新鮮なRPMI-1640培地を同じ体積を加えます。 HI-FCSで使用LPSを含まない溶液と化合物と低LPSレベル(0.05 ngの/ ml以下)。
注:文化の中で発展Gφは、しっかりと培養皿に付着しない、激しい洗濯も開発し、細胞を洗い流すことができるので、穏やかな培地交換が不可欠です。血液ドナーに応じて、PMN培養後4日 - Gφの外観は3で顕著です。 Gφのサイズが非常に大きい場合、培養中で7日 - ここに記載の分析およびアッセイのほとんどは、6との間で行われています。 RPMI-1640培地に10ng / mLのLPS文化の中でGφ発展に影響を与えなかった - 1の添加があることに留意されたいです。 14
2.共焦点レーザー走査顕微鏡
- 新たに単離した好中球からの、および7日に開発Gφ培養物からのサイトスピン16を準備します(セクション1で調製しました)。
注:静かに培地の半分を除去し、様々な分析のための皿にGφの濃度を増大させるために。 Gφは、光学顕微鏡下での媒体を調べることによって除去培地中に検出されていないことを確認してください。そして、集中的に軽く付着しGφを除去するために、残りの培地をピペット。 200×gで10分間、培地を遠心分離し、そして100でペレットを再懸濁 - 120μlの培地。- 各スライドのための細胞を含む培地120μlの - 100を使用してください。各治療から重複または三重スライドを準備します。 84×gで7分間スピン。
- 紡糸セルを乾燥し、化学フード下で10分間室温で4%パラホルムアルデヒドで細胞を固定。 PBSで洗浄3回(1回の洗浄あたり数秒〜100マイクロリットル)。細胞内染色のために、室温で10分間0.5%トリトンX-100 PBS中で細胞を透過処理し、PBSで5回洗浄します。
注:すべての段階で、適切な緩衝液/液voluを使用私は、スライド上の細胞の周囲をカバーします。細胞の周囲を決定するための疎水性のバリアペンを使用してください。
注意:パラホルムアルデヒドは有毒です。皮膚や眼との接触を避けます。適切な個人保護具を着用します。 - RPMI-1640培地中で、10%正常ヤギ血清でブロック細胞と4ºCで、または40分間、室温で一晩インキュベートします。 PBSで洗浄します。
- 100希釈(〜100μl)を:単一の抗体(Ab)または1で、マウスおよびウサギ一次抗体(ABS)の組み合わせでインキュベートします。 4°Cで - (20時間18)で一晩インキュベートします。
注:ここでは、マウスモノクローナルAbは含ま:抗CD14、抗CD63、抗CD66b、抗CD1c、抗CD15、および抗チトクロームB-245軽鎖(p22- phoxの識別 )。ウサギポリクローナルAbは含ま:抗CD68、抗CD36、抗LC3B、抗ミエロペルオキシダーゼ、抗好中球エラスターゼ(NE)、および抗のNox2 / gp91- PHOXの腹筋を。アイソタイプコントロールは、精製マウスIgG1およびIgG2、およびウサギIgGが含まれていました。 Prepar製造元の指示に従ってABS及びeは細胞の周囲をカバーするために、適切な容量(約100μl)を使用します。 - 細胞を洗浄し、1/400二次抗体Cy2と-CF(488A)結合ヤギ抗ウサギIgG(緑)でインキュベート/またはCy5(CF 647)結合ヤギ抗マウスIgG 40室温で(赤)分。
注:製造元の指示に従って腹筋を希釈し、準備します。 - 洗浄後、核染色のために4 '、6-ジアミジノ-2-フェニルインドール(DAPI)を含む、マウンティング培地の一滴でスライドをマウントし、すぐにカバースリップを置きます。
- 蛍光顕微鏡およびプランアポ40X液浸油の対物レンズを用いて共焦点レーザー走査システムによってスライドを分析します。スライドの調製後2時間に30分以内に分析を実行するか、または4℃で一晩おきます。
- セル領域とイメージングソフトウェア( 例えばイメージJ)を用いて蛍光強度を算出します。共局在、資格のためのMandersオーバーラップ係数(MOC)17を用いてソフトウェアによってntify。
注:MOCと細胞のみ> 0.6は、有意な共局在と細胞とみなすことができます。
- セル領域とイメージングソフトウェア( 例えばイメージJ)を用いて蛍光強度を算出します。共局在、資格のためのMandersオーバーラップ係数(MOC)17を用いてソフトウェアによってntify。
内皮細胞アクロスPMNの3遊出:巨大食細胞に対するIL-8の影響(Gφ)の形成
注:使用して24ウェル透過性細胞培養は、細胞遊出アッセイのために挿入されます。
- コートを50μg/ mlの濃度で150μlのフィブロネクチンとのインサートの上部チャンバを、室温で30分間保ちます。
- 上部チャンバーに追加5×10 4 EA.hy926内皮細胞/ウェル、策定ダルベッコ改変イーグル培地(完全増殖培地)150μlの中に再懸濁しました。
注:内皮単層は、使用前にコンフルエントであることを確認してください。 - 下部チャンバーに、完全増殖培地の700μLを追加します。
- 透過性を配置細胞培養は5%CO 2中で37℃でクラスタトレイ培養2日間EA.hy926内皮細胞に挿入します。
注:(セクション1で説明したように)並行して、二日目に新鮮なPMNを準備します。 - 2日後、インサートの下部及び上部チャンバーに培地を交換してください。
- 下部チャンバーに、50 nMの/ mlの最終濃度で10%IH-FCSおよびインターロイキン(IL)-8を補充したRPMI-1640培地を加えます。下部チャンバーを制御するために、IL-8を追加しないでください。
- 各上部チャンバーに、10%IH-FCSを補充したRPMI-1640培地100μlで10 6の新鮮なPMNを追加します。
- 90分間、5%CO 2中で37℃でクラスタトレイをインキュベートします。
- 90分間のインキュベーション後、別々に上部及び下部チャンバーから細胞を除去し、それぞれの亜集団を数えます。追加された全細胞の割合として各チャンバ内の細胞を発現します。
注:慎重上位CHAMBから細胞を除去内皮細胞を除去回避し、滅菌チューブに転送するために、穏やかにピペッティングすることにより、小胞体。ピペットで下部チャンバーから細胞を取り出して、第二の滅菌チューブに500μlの転送と下部チャンバーを洗浄します。 - プールの手順14で指定された成長因子を含まない7日間transmigrating(下室)と非遊走(上室)PMN画や文化それぞれのいくつかのウェルから10 6個の細胞- 16(セクション1)。
- スライド16上に細胞をスピンし、セクション2に記載されているように、共焦点顕微鏡によって各培養条件で開発した細胞を分析します。
結果
文化における好中球自家食作用および開発
好中球の自家食作用および培養7日以内にGφへのそれらの開発は、 図3と図 4に示されています。日4によって- 7、そのサイズは15、大幅に拡大したと蛍光膜の汚れと好中球共培養後autophagosytosisは、90分には早くも明らかであった(赤PKH-26を、;、緑PKH-67)。この好中球亜集団の対照として14は 、いくつかの好中球の培養物はまた、GM-CSF / IL-4で処理しました。前述したように培養14日 - サイトカイン処理した細胞は、7以内のサイズに増加しました。 18、19しかし、以前にB報告されているように、Gφよりも小さかったとDC様細胞( 図5)に似た細胞質の突起を持っていました yのオーラーら。 19はまた、GM-CSF / IL-4で処理した細胞は陰性であったか、低CD66bの発現を有し、15は明らかに同様の形態学的および潜在的な機能の違いを実証します。
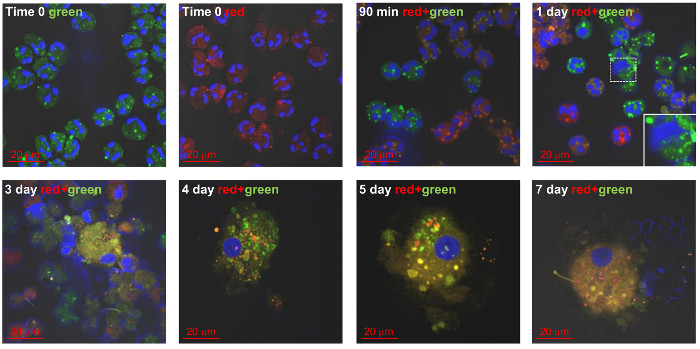
図3: 文化発展巨大食細胞における自家食作用(Gφ)。新たに単離し精製した好中球は、PKH-67(緑)で標識またはPKH-26(赤)、膜蛍光染料をゼロ時間で、その後、共培養し、7日まで追跡しました。細胞をスライドガラス上にスピンし、核をDAPIで染色し、試料を共焦点顕微鏡によって分析しました。自家食作用は、共培養の90分後にすでに顕著です。黄色に赤と緑のマージとオレンジが開発Gφに明らかです。ファイル/ ftp_upload / 54826 / 54826fig3large.jpg "ターゲット=" _空白"> この図の拡大版をご覧になるにはこちらをクリックしてください。
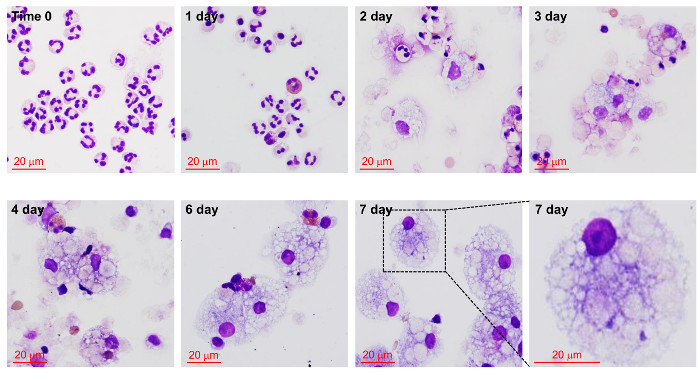
図4: 文化における巨大食細胞(Gφ)の開発。新たに単離し精製した好中球は、培養7日まで追跡しました。細胞は、指示された時間間隔でスライドガラス上にスピン月グリューネバルト - ギムザで染色し、明視野顕微鏡で分析しました。少数の好酸球との個別の比較のために提示されています。好酸球の大きさは、文化の中で変わらないことに注意してください。倍率100倍の油。 この図の拡大版をご覧になるにはこちらをクリックしてください。
キープtogether.withinページ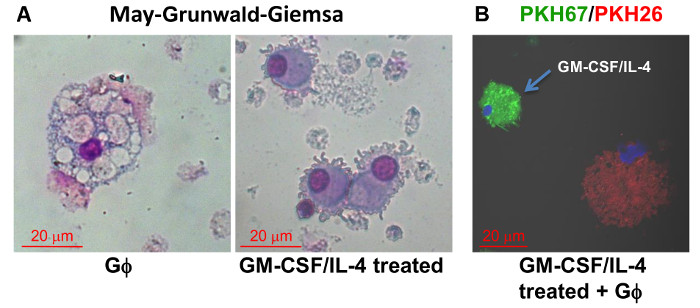
図5: 文化に好中球を処理した 巨大食細胞(Gの φ)およびGM-CSF / IL の開発の比較 。 (A)月グリュンワルド・ギムザは7日間(Gφ)なしで培養し、GM-CSF / IL-4と好中球を染色しました。サンプルは、明視野顕微鏡で分析しました。倍率、X40。培地で培養して開発細胞は、GM-CSF / IL-4を示し広範囲の細胞質突起を補充しなくGφより小さい。 (B)新たに単離した好中球は、PKH-26(赤)色素で標識し、培養し、サイトカインを含まない培地中で7日間、またはGM-CSF / IL-4のために添加した培地でPKH-67(緑)色素で標識し、培養しました7日。 1比率と共培養2時間:そして、開発した細胞は1で混合しました。細胞を共焦点MICRによって固定され、分析されましたoscopy。この図は、基準から変更されています。 15 この図の拡大版をご覧になるにはこちらをクリックしてください。
さらにGφ開発の過程を調べるために、それらの形態学的変化はまた、タイムラプス顕微鏡により追跡しました。ビデオ-1(4日目に3日目)およびビデオ-2(5日目の4日目)は、精製された好中球の培養におけるその開発を実証します。これらGφは、非接着性または制限された運動能力と軽く付着しており、積極的に好中球の残骸と破片を周囲の摂取します。ビデオ-3では、単球由来MφとGφの動きは、混合単球/好中球培養で比較されます。 Mφは積極的に(左、非標識細胞)をクロールします。 Gφ(右)は、明るいPKH-26標識された細胞です。
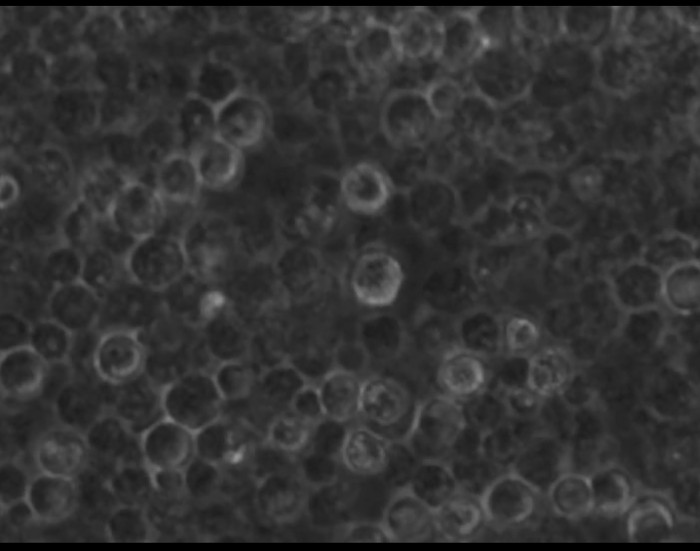
ビデオ-1は: -タイムラプス顕微鏡による4日間3で精製PMN培養における巨大食細胞の開発を示します。好中球は、タイムラプスmicroscopy.Theタイムラプス顕微鏡システムにより、4日目に3日目からの培養中、追跡されたステージ上のインキュベーターで、倒立電動蛍光顕微鏡、および高解像度のB / W CCDカメラで構成されています。タイムラプスの撮像の取得は10分毎に採取しました。もともと参照14に発表されたこのビデオを見るにはこちらをクリックしてください。
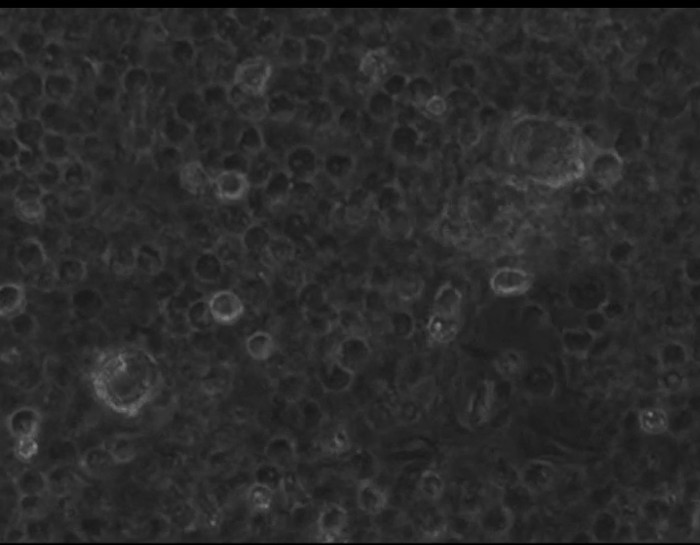
ビデオ-2:TI - 5日4上で精製したPMN文化における巨大食細胞の開発を実証私-経過顕微鏡。 好中球は、タイムラプス顕微鏡により5日目に4日目から培養中のアップを追跡しました。タイムラプス顕微鏡システムは、ステージ上のインキュベーターで倒立電動蛍光顕微鏡、および高解像度のB / W CCDカメラで構成されています。タイムラプスの撮像の取得は10分毎に採取しました。 このビデオを見るにはこちらをクリックしてください。
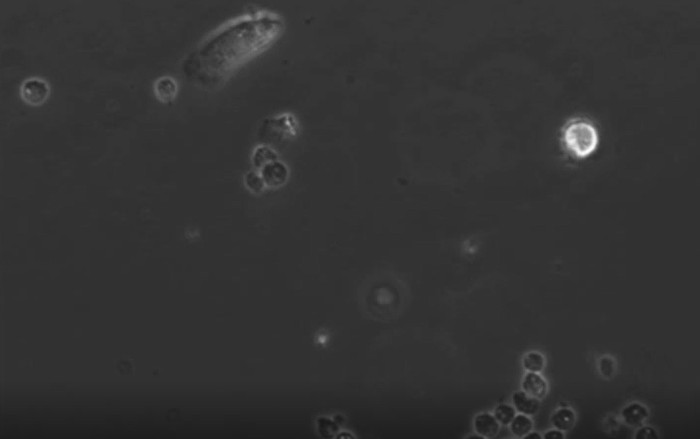
ビデオ-3:巨大食細胞との共培養で開発マクロファージ。単球/好中球共培養5日目まで4日からタイムラプス顕微鏡によりアップが続きました。単球由来マクロファージ(左)。明るい(PKH-26染色細胞)、好中球由来の巨大食細胞(右)。ビデオのためのタイムラプス顕微鏡システムは、倒立電動式蛍光MICRで構成されていますステージ上のインキュベーターとOSCOPE、および高解像度のB / W CCDカメラ、。タイムラプスの撮像の取得は10分毎に採取しました。もともと参照14に発表されたこのビデオを見るにはこちらをクリックしてください。
巨大食細胞におけるマーカーの発現
Gφの好中球の起源は、以下の好中球のマーカーCD66b / CD63 / MPO / NE / CD15( 図6)の陽性発現によって確認しました。オートファジーのマーカーの存在を実証し、CD68とCD36、および(LC3BII 15としてウエスタンブロット法によって識別される)に含まれるLC3Bコーティングされた空胞と集計- GφもNADPHオキシダーゼ、oxLDLのスカベンジャー受容体を発現しました。しかし、それらは単球系統(CD14、CD16およびCD163)陰性であったとdendritIC細胞(CD1cおよびCD141)マーカー、Gφは単球を汚染から生じなかったことを示唆しています。

図6: 培養7日後に巨大食細胞(Gφ)で好中球、単球や樹状細胞のための様々なマーカーの発現。好中球の特定の顆粒マーカーCD66b、アズール親和性顆粒マーカーのCD63とMPO、好中球エラスターゼ及びCD15の陽性発現。樹状CD1cおよびCD141マーカーおよび単球系統マーカーCD14、CD16およびCD163について陰性で表現。また、Gφは、オートファジーのマーカーLC3Bを表明し、スカベンジャー受容体CD68とCD36とNADPHオキシダーゼサブユニットgp91-phoxの/ P22-phoxのサブユニット。核をDAPIで染色し、そしてサンプルを共焦点顕微鏡によって分析しました。この図は参照から変更されています。 14 P>、15 この図の拡大版をご覧になるにはこちらをクリックしてください。
Gφの機能 - NADPHオキシダーゼの活性化、ROS生産と食作用:
ラテックスビーズの食作用およびオプソニン化ザイモサンはGφで明らかでした。 Gφはまた、基礎ROS( 図7A)を生成し、酸化的バースト( 図7B-D)によってザイモサンおよびPMA刺激に応答しました。しかしながら、単球または好中球とは異なり、GφはoxLDLの刺激に応答してもROSを生成し、オイルレッドO( 図7B、F)で染色しました。注目すべきは、NADPHオキシダーゼ阻害剤との新鮮な好中球の治療 - DPI、ROSの産生を阻害したが、またPだけでなく、ROSシグナリングがGφ形成に必須であることを示唆し、培養物中Gφ形成をrevented。 14、15

図7: 酸化的バースト、食作用、およびoxLDLの取り込み巨大食細胞(Gφ)によります。 (A)基礎ROS生産はGφのリソソームに明らかです。 (B)酸化LDL(oxLDLの)、PMAおよびザイモサンに応答して、ROS産生(ザイモサン粒子が明記されています)。なしとPMA(スライドが染色されていないですが、インサートは月グリュンワルド・ギムザで染色されている)で呼吸バースト活性を示すGφにおける(C)ニトロブルーテトラゾリウム(NBT)試験。 (D)NBT試験と月グリューネバルト・ギムザは、NADPHオキシダーゼおよびROSを阻害PMAおよびPMA / DPIでGφを染色しました。 Lの(E)貪食PKH-26(赤)染色された細胞におけるATEXおよびIgGオプソニン化ザイモサン。未処理およびoxLDLのGφを扱わにおける(F)オイルレッドO染色。この図は参照から変更されています。 14、15 この図の拡大版をご覧になるにはこちらをクリックしてください。
内皮細胞アクロスPMNの輪廻
Gφに発展する可能性の好中球の亜集団を同定するために、内皮細胞単層を介して好中球の遊走は、( 図8A)を決定しました。 90分後、好中球の62.3±12.2パーセントは、下部コンパートメントにIL-8に向かって内皮細胞を通って遊出。注目すべきは、非移行好中球分画から開発した細胞に対し、好中球の遊出集団からのみ開発CD66b / CD15 / LC3Bのための正Gφは、好中球マーカーのサイズが小さく、陰性であったCD66b / CD15( 図8B、8C) 。
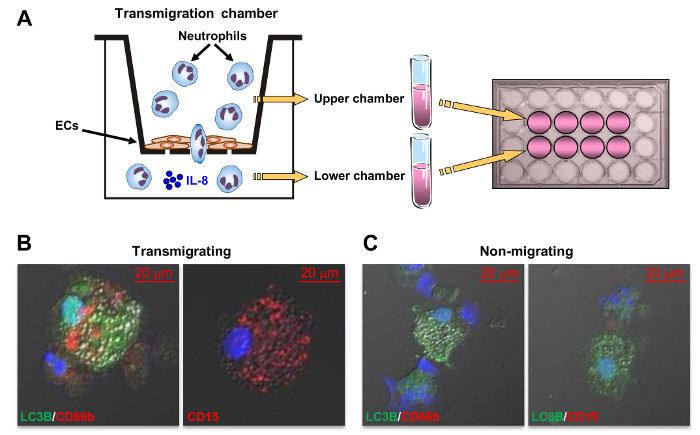
図8: 巨大食細胞(Gφ)形成に内皮細胞を介したIL-8依存PMN遊出の効果。 (A)IL-8に向かって内皮細胞単層(ECS)を横切って、好中球の遊出アッセイを示すスキーム。このアッセイは、急性の炎症部位への好中球の動員のためのモデルと考えることができます。 (手順3で指定された)細胞遊走アッセイでは、(B)を transmigratingと非移動(C)、好中球のFRAC - (C B)ンは、(プロトコル1のように)、成長因子を含まない7日間培養しました。その後、細胞をガラススライド上にスピンコートし、共焦点顕微鏡法により分析しました。固定した細胞をCD66b(赤)、LC3B(緑)、CD15(赤)について染色しました。核はDAPI(青)で染色しました。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
巨大食細胞(Gφ)は、CD66b / CD15 / CD63 / MPO / NEなどの基本的かつ具体的な好中球マーカーを発現する好中球由来細胞の新たに定義された亜集団です。好中球由来の食細胞のこのタイプは、前文献に記載されていませんでした。短命であり、アポトーシスを受ける好中球とは異なり、Gφは、アネキシンV陰性であり、拡張寿命を表示します。しかし、好中球のように、Gφは、粒子を内在化し、それらの粒子へとPMAに応じて、NADPHオキシダーゼ依存ROSを生成します。しかし、oxLDLのを内在し、その結果、ROSを生成する能力はGφのユニークな機能です。 14
多くの要因は、培養におけるそれらの発展に影響を与えることが示されました。増殖培地中の外部のサイトカインまたは成長因子の欠如が必須である(具体的にはGM-CSF / IL-4)。しかし、IL-8に向けて好中球の移行は、そのdevのそれらの間の識別率を証明しましたGφに駆け落ちし、なかったもの。また、アポトーシスの好中球に起因するデブリの内在化は、オートファジータンパク質(LC3B)の発現および機能的NADPHオキシダーゼは、すべてのそれらの阻害はGφ形成( 図1)を防止するため、その開発のために不可欠であることが示されました。どうやら、好中球から生じるこれらの巨細胞の開発は、単球/マクロファージ系に巨細胞形成を特徴づけるものとは異なります。好中球Gφは、ここで説明する一方で、多様な慢性炎症性疾患に関連した多核巨細胞後者の形式、20、21は 、めったにしかし、(時には第二のセルの残党を飲み込むことにより、自家食作用を介して開発し、その開発を通じて、主にモノ有核まま、14核)を観察することができます。また、コントロールの数は、彼らの好中球の起源を確立:(1)expreライブセルイメージングや時間によって証明されるように、樹状及び単球系統マーカーの特定neutropilicマーカーおよび不在のssion、単球/ PMN共培養中の(2)その妨げ開発、マクロファージからの文化の移動(3)それらの異なるパターン( -lapse顕微鏡)、純粋なCD15 + / CD14からプラスチック皿および(5)その開発に14(4)それらの光順守-フローサイトメトリーによって取得されたPMN。
インビトロ同定された機能のいくつかは、私たちに、in vivoでそのポテンシャル関数の手がかりを与える可能性があります。自然免疫シグナル伝達経路と規制の相互作用を介して炎症を減少させることに貢献するオートファジータンパク質、22 - -これらはすべて例えば、Gφの能力は、好中球顆粒および破片、大きな空胞の存在、及び発現LC3Bを大量に消費しますサポート捕捉能力。など、これらの知見はまた、GφはMφ/ DCシステムが不十分または圧倒され、炎症部位で機能する可能性があることを示し、従って、炎症の解決に貢献します。この概念は、混合単球/好中球培養においてGφの開発が阻害されるという事実によってサポートされる可能性があります。 14はまた、Gφは、oxLDLのスカベンジャー受容体(CD36、CD68)を発現するのoxLDLを内部、およびそれに反応してROSを生成し、それらは炎症を解決するために、アテローム性動脈硬化症のプロセスに関与していることを示すことができることを考えます。 GφのみがIL-8に向かって移行し、好中球、及びIL-8は、急性の炎症部位への好中球動員を表す向かって内皮細胞単層を通過する好中球」遊出から発展するので、この発見はまた、抗炎症性機能をサポートすることができます。逆に、特定の炎症状態でGφのパフォーマンスがあたりに寄与し、したがって、顆粒成分およびROSを放電することを可能かもしれません一貫した炎症および組織損傷。 20しかし 、全体的に、彼らの自己貪食能力がGφはおそらく炎症反応を減少させるのではなく、それを永続に関与していることを示しています。
興味深いことに、我々は最近、ヒトアテローム性動脈硬化プラーク中のGφの存在を同定しました。 (準備中)。しかし、質問の大多数が解明されずに残っています。例えば、Gφのプロまたは抗炎症性ですか? in vitroまたはin vivoでそれらの形成と機能を決定する要因は何ですか? Gφに彼らの開発を容易にその前駆細胞は、特定のどの好中球亜集団のですか?彼らは、特定の病状とすると関連付けられていますか?総称して、その起源とポテンシャル関数についての興味深い質問を装いました。
しかし、プロトコル内の重要なステップと落とし穴は心に留めておくべきです。 Gφiの開発における重要なステップサイトカイン、成長因子や抗生物質を欠く培地中で純粋な好中球を培養します。■。もう一つの重要なステップは、Gφは、汚染単球から開発し、Gφの好中球の原点を確認することを排除することです。マーカー-したがって、不連続勾配によって血液分離の後、好中球は、さらに、顆粒球ゲーティングおよびCD15 + / CD14を用いたフローサイトメトリーによる精製の追加の工程に供しました。開発Gφをさらに精製この工程を行わなかったものと異なっていなかった分離、フローサイトメトリーによって精製した好中球から得られました。したがって、実験の大部分は、さらなる細胞喪失による精製のフローサイトメトリー工程なしで行われました。注目すべきは、いくつかのまれにいくつかの好酸球は、培養中で注目されました。その大きさは、培養期間を通じて変化しないままでした。我々はまた、多くの方法があるがことに注意してくださいヒト血液からの好中球の分離のために、ここで説明する方法は、我々が採用唯一の方法であるため、我々は、好中球の分離のため、他の利用可能な方法によってGφ開発を比較することはできません。
Gφを調査の主要な落とし穴は、様々な生化学的アッセイに適した純粋なGφ人口の十分な数を得ることができないことに起因します。それは私たちの実験が行われた条件では基本的に不可能です。まず、Gφの収率は低いです。 200Gφが献血に応じて、培養中で7日後に発症- 1.0×10 6からPMNは約100播種しました。第二に、それは皿の中の残りの好中球の破片からの文化の中で開発されたGφを分離するために、現時点では基本的に困難です。これらの制限は、生化学的または分子生物学的方法により細胞を分析することは事実上不可能ました。したがって、このプロトコルは、光を用いてGφ識別及び機能を説明するに集束されますそして、共焦点顕微鏡。文化の中でGφへの好中球からの彼らの形態変換は、ライブセルイメージングとタイムラプス顕微鏡検査を行いました。 図14は、明らかに、はるかに大きな血液容量は、生化学的または分子生物学的方法を実装し、低い収率を得皿中の好中球」破片から生存Gφ分離を克服するために必要とされ得ます。
要約すると、我々は最近、文化の中で初めて好中球由来の長命の食細胞の亜集団をGφの開発を記載しています。上記の二つの主要な制限が克服されるべきであるので、これは文化の中でGφを得るために現在利用可能な唯一の方法は、ある(Gφの低収量は、培養で得られた培養中の好中球の破片から開発Gφを分離することができないこと皿)。それでも、このプロトコルで提示それらの調製および同定は、essentiaですさらにGφの潜在的な重要性と機能を調べるために、炎症反応や好中球の生物学と可塑性に関心のある科学者のためのリットル。
開示事項
著者らは、開示することは何もありません。
謝辞
著者らは、共焦点顕微鏡研究と彼女の貴重な助けのために博士エディスSussの-トビーに感謝します。この研究は、移民の吸収と計画のための委員会の省KAMEAプログラム(LDとAP)の枠組みの下での高等教育審議会の予算によってサポートされていました。また、感謝レディ・デイビス財団ポスドク研究フェローシップ(OR)からの研究員のサポートを認めます。
資料
| Name | Company | Catalog Number | Comments |
| Sterile scalp vein set (21GX3/4) | Bio Diagnostics Ltd. | # 20080312 | A strile needle for venipancture |
| VACUETTE HOLDEX Single-Use Holder PP | Greiner Bio-One | # 450263 | For securing during venipuncture |
| VACUETTE Tube K3E K3EDTA (16 x 100/9 mL) | Greiner Bio-One | # 455036 | Sterile tube for blood collection |
| Nunclon MultiDish (24 well x 1 ml) | Thermo Scientific | # 142475 | |
| Polypropylene conical centrifuge tube (50 ml) | Greiner Bio-One | # E14103PJ | |
| Transwell-24 well (transmigration assay) | Corning | # CA-3415 | Polycarbonate membrane, 6.5 mm diameter, 3 μm pores) |
| RPMI-1640 medium | BioIndustries | # 01-100-1A | Do not add antibiotics |
| EA.hy926 (ATCC CRL2922) | BioIndustries | # CRL-2922 | |
| ATCC-formulated Dulbecco’s Modified Eagle’s Medium | BioIndustries | # 302002 | complete growth medium |
| Polysucrose - Histopaque1119 | Sigma-Aldrich | # 1119-1 | Tissue culture grade |
| Polysucrose - Histopaque1077 | Sigma-Aldrich | # 1077-1 | Tissue culture grade |
| Phosphate buffered saline (PBS) - ion free | BioIndustries | # 02-023-1A | Cell biology and molecular biology grade |
| Heat inactivated Fetal calf serum (HI-FCS) | BioIndustries | # 04-121-1B | Cell biology grade or tissue culture grade, low LPS |
| NaCl | Sigma | # S3014 | Molecular biology grade, suitable for cell culture |
| Paraformaldehyde, 16% | Electron Microscopy Sciences | # 15710 | Cell bology grade or tissue culture grade (only 16% PFA) |
| Triton X-100 | Sigma-Aldrich | # 9002-93-1 | Molecular biology grade |
| Normal Goat Serum | BioIndustries | # 04-009-1 | Cell biology and molecular biology grade |
| Trypan blue | BioIndustries | # 031021B | Tissue culture grade |
| May-Grünwald | Sigma-Aldrich | # MG500 | Cell biology grade-(procedure No GS-10) |
| Giemsa stain Kit | Sigma | # 48900 | Cell biololgy grade-(procedure No GS-10) |
| Fibronectin | BioIndustries | # 03090105 | |
| Human Interleukin-8 (CXCL8) | PeproTech | # 200-08-5 | |
| Anti-CD14 (clone 5A3B11B5) | Santa Cruz Biotechnologies | # sc-58951 | Mouse IgG2b; expressed by monocytes |
| Anti-CD63 (clone MX-49.129.5) | Santa Cruz Biotechnologies | # sc-5275 | Mouse IgG1; expressed by neutrophils |
| Anti-CD66b (clone 80H3) | AbD Serotec | # MCA216 | Mouse IgG1; expressed by neutrophils |
| Anti-CD1c (BDCA-1) (clone AD5-8E7) | MACS Miltenyi Biotec | # 130-090-695 | Mouse IgG2a; expressed by dendritic cells |
| Anti-CD15 (clone MY-1) | Abcam | # ab754 | Mouse IgM; expressed by neutrophils |
| Anti-Cytochrome b-245 Light Chain (p22-phox) (clone 44.1) | BioLegend | # 650001 | Mouse IgG2a; to recognize neutrophil NADPH oxidase complex |
| Anti-CD68 | Protein Tech | # 16192-1-AP | Rabbit IgG; to recognize oxLDL scavenger receptor |
| Anti-LC3B | Sigma | # L7543 | Rabbit IgG |
| Anti-Myeloperoxidase | Abcam | # ab45977 | Rabbit IgG |
| Anti-Neutrophil elastase | Calbiochem | # 481001 | Rabbit IgG |
| Anti-NOX2 (gp91-phox) | Abcam | # ab131083 | Rabbit IgG |
| Anti-CD36 (SR-B3) | Novus Biologicals | # NB400-144 | Rabbit IgG |
| Purified Mouse IgG1, κ Isotype Control (clone MG1-45) | BioLegend | # 401401 | Antibody used as isotype control |
| Purified Mouse IgG2a, κ Isotype Control (clone MOPC-173) | BioLegend | # 400263 | Antibody used as isotype control |
| Normal rabbit IgG | Santa Cruz Biotechnologies | # sc-2027 | Antibody used as isotype control |
| CF488A Goat Anti-Rabbit IgG (H+L) | Biotium | # 20012 | Anti-Rabbit IgG with the green fluorescent dye CF488A |
| CF647 Goat Anti-Rabbit IgG (H+L) | Biotium | # 20043 | Anti-Rabbit IgG with the red fluorescent dye CF647 |
| CF488A Goat Anti-Mouse IgG (H+L) | Biotium | # 20010 | Anti-Mouse IgG with the green fluorescent dye CF488A |
| CF647 Goat Anti-Mouse IgG (H+L) | Biotium | # 20040 | Anti-Mouse IgG with the red fluorescent dye CF647 |
| Fluorescent Mounting Medium with DAPI | Vectashield H-1000; Vector Lab Inc. | # E19-18 | Nuclear staining |
| Confocal laser scanning microscope (LSM 700) | Carl Zeiss | Ser.# 3523000380 | Plan Apo 40X immersion oil objective |
| Zeiss CLSM software (ZEN 2010) | Carl Zeiss MicroImaging GmbH | version 6.0 | For colocalization analysis |
| ImageJ software | Wayne Rasband, NIH, USA | version 1.49k | For determination of cell areas and fluorescence intensity |
| Light microscope (Axiovert 25) | Carl Zeiss | Ser.# 201060153 | Examination of cells in culture |
| Centrifuge (Megafuge 1.0 R) | Heraeus Instruments | # D-37520 | Cells separation from blood; cytospins preparation |
| Inverted fluorescent microscope (Zeiss Axio Observer Z.1) | Carl Zeiss | Ser.# 3834001470 | Demonstration of giant phagocytes development |
| Temperature-controlled incubation system (Cube&Box) | Life Imaging Services | Temperature control system for microscopes | |
| High resolution digital CCD camera (AxioCam HRm) | Carl Zeiss | Ser.# 117090279 | For capturing high-contrast image data from an examined cell objects |
| Hydrophobic barrier pen (Elite PAP Pen) | Diagnostic Biosystems | # K039 | For defining cell perimeter for immunoflourescence staining |
参考文献
- Borregaard, N. Neutrophils, from marrow to microbes. Immunity. 33, 657-670 (2010).
- Silva, M. T., Correia-Neves, M. Neutrophils and macrophages: the main partners of phagocyte cell systems. Front. Immunol. 3, 174 (2012).
- Cowburn, A. S., Condliffe, A. M., Farahi, N., Summers, C., Chilvers, E. R. Advances in neutrophil biology: clinical implications. Chest. 134, 606-612 (2008).
- Duffin, R., Leitch, A. E., Fox, S., Haslett, C., Rossi, A. G. Targeting granulocyte apoptosis: mechanisms, models, and therapies. Immunol. Rev. 236, 28-40 (2010).
- Silva, M. T. Macrophage phagocytosis of neutrophils at inflammatory/infectious foci: a cooperative mechanism in the control of infection and infectious inflammation. J. Leukoc. Biol. 89, 675-683 (2011).
- Witko-Sarsat, V., Pederzoli-Ribeil, M., Hirsch, E., Sozzani, S., Cassatella, M. A. Regulating neutrophil apoptosis: new players enter the game. Trends Immunol. 32, 117-124 (2011).
- Cassatella, M. A., Locati, M., Mantovani, A. Never underestimate the power of a neutrophil. Immunity. 31, 698-700 (2009).
- Zhang, X., Majlessi, L., Deriaud, E., Leclerc, C., Lo-Man, R. Coactivation of Syk kinase and MyD88 adaptor protein pathways by bacteria promotes regulatory properties of neutrophils. Immunity. 31, 761-771 (2009).
- Araki, H., et al. Reprogramming of human postmitotic neutrophils into macrophages by growth factors. Blood. 103, 2973-2980 (2004).
- Iking-Konert, C., et al. Up-regulation of the dendritic cell marker CD83 on polymorphonuclear neutrophils (PMN): divergent expression in acute bacterial infections and chronic inflammatory disease. Clin. Exp. Immunol. 130, 501-508 (2002).
- Rydell-Tormanen, K., Uller, L., Erjefalt, J. S. Neutrophil cannibalism--a back up when the macrophage clearance system is insufficient. Resp. Res. 7, 143 (2006).
- Esmann, L., et al. Phagocytosis of apoptotic cells by neutrophil granulocytes: diminished proinflammatory neutrophil functions in the presence of apoptotic cells. J. Immunol. 184, 391-400 (2010).
- Nordenfelt, P., Tapper, H. Phagosome dynamics during phagocytosis by neutrophils. J. Leukoc. Biol. 90, 271-284 (2011).
- Dyugovskaya, L., Berger, S., Polyakov, A., Lavie, L. The development of giant phagocytes in long-term neutrophil cultures. J. Leukoc. Biol. 96, 511-521 (2014).
- Dyugovskaya, L., Berger, S., Polyakov, A., Lavie, P., Lavie, L. Intermittent Hypoxia Affects the Spontaneous Differentiation In Vitro of Human Neutrophils into Long-Lived Giant Phatocytes. Oxid. Med. Cell. Longev. , 9636937 (2016).
- Mihalache, C. C., et al. Inflammation-associated autophagy-related programmed necrotic death of human neutrophils characterized by organelle fusion events. J. Immunol. 186, 6532-6542 (2011).
- Manders, E. M. M., Verbeek, F. J., Aten, J. A. Measurement of Colocalization of Objects in Dual-Color Confocal Images. J. Microsc. 169, 375-382 (1993).
- Matsushima, H., et al. Neutrophil differentiation into a unique hybrid population exhibiting dual phenotype and functionality of neutrophils and dendritic cells. Blood. 121, 1677-1689 (2013).
- Oehler, L., et al. Neutrophil granulocyte-committed cells can be driven to acquire dendritic cell characteristics. J. Exp. Med. 187, 1019-1028 (1998).
- Berton, G. Editorial: Gigantism: a new way to prolong neutrophil life. J. Leukoc. Biol. 96, 505-506 (2014).
- Milde, R., et al. Multinucleated Giant Cells Are Specialized for Complement-Mediated Phagocytosis and Large Target Destruction. Cell. Rep. 13, 1937-1948 (2015).
- Deretic, V., Saitoh, T., Akira, S. Autophagy in infection, inflammation and immunity. Nat. Rev. Immunol. 13, 722-737 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved