このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
神経化学的マーカーのためのビオシチンで満たされたと加工セクションの免疫染色
要約
このプロトコルは、ビオシチン充填およびその後の免疫組織化学的後処理を使用して電気生理学的記録の中にパッチを適用したニューロンの形態学的回復のための方法を提示しています。我々は、染色し、カバーガラスをした厚いビオシチン充填された部分は、後に第二次抗体日または数ヶ月で再染色することができることを示しています。
要約
パッチクランプ法を用いて細胞の電気生理学的記録は、発射パターンに基づいて、異なる神経形式の識別のために許可されています。記録電極におけるビオサイチン/ neurobiotinを含めることは、樹状樹枝状分岐し、記録ニューロンの軸索によって標的領域を決定するために必要な形態学的な詳細の事後の回復を可能にします。しかし、明確な神経化学的アイデンティティと機能を備えた形態学的に類似した神経細胞の存在を考えると、細胞型特異的タンパク質のための免疫組織化学的染色は、決定的に神経細胞を識別することが不可欠です。ネットワーク接続を維持するために、生理学的な記録のために脳切片を、300ミクロン以上の厚さで製造されます。しかし、この厚さは、多くの場合、組織の切除を必要とする、抗体の浸透の問題に起因する免疫組織学的後処理を妨げます。スライスの切除は、しばしばresul、挑戦的な芸術であります組織および細胞の形態の喪失ティン、そこから電気生理学的データが使用できないデータをレンダリングし、得られました。ニューロンマーカーの選択におけるデータ損失やガイドを制限する形態の回復以来、私たちは、二次免疫染色に続いて最初の細胞形態を回復する戦略を採用しています。私たちは、生理学的記録と神経化学的同一性を決定するためにセクションの再染色が続く形態の回復のためのその後のシリアル免疫染色、中に充填ビオサイチンする実用的なアプローチを紹介します。我々は、(PFA)パラホルムアルデヒドで固定し、染色し、そしてカバーガラスをビオシチンを充填したセクションは、削除され、2回目以降の一次抗体日で再染色することができると報告しています。この再染色は、カバースリップの除去、緩衝液中のセクションの洗浄、および神経化学的アイデンティティを明らかに一次および二次抗体のインキュベーションを必要とします。この方法は、DATを除去するために有利です。形態を回復し、形態学に基づいてテストされる神経化学的マーカーを絞ることができないことによる損失。
概要
脳は、その個々の神経要素の構造的および機能的特性の多様性のために知られています。脳機能と病理学の明確なニューロンタイプの役割を理解することは、特性評価および神経細胞の明確な同定を必要とします。軸索樹枝状のパターンが潜在的なシナプス後の標的を識別しながら、構造的に、SOMATO樹状の場所で定義された形態学的特徴は、与えられたニューロンが受ける潜在的な入力を決定します。ニューロンの構造的多様性は、ラモン・Yカハールの精液の組織学的研究1の時代から高く評価されています。単一細胞記録技術の出現は、構造的に異なるニューロンはまた、発火パターンおよびシナプスの特性の違いを示すことが明らかになりました。構造や生理機能の多様性は、GABA作動性抑制性ニューロン2,3に特に明らかです。また、structurallことがますます明らかになってきていますyの同様のニューロンは、異なる神経化学的マーカーを発現し、機能の違い4に対応する表示することができます。同様に、同じ神経化学的マーカーとニューロンは異なる構造と機能5-10を持つことができます 。したがって、実際には、ネットワーク内のニューロンの機能特性の解析とその役割は、両方の形態学的および神経化学的アイデンティティを定義することを伴います。さらには特定の神経化学的マーカーを標的レポーターマウス株の出現と、免疫組織学11に基づいて、形態およびサブタイプの同一性を決定することがしばしば必要です。
急性脳スライスに記録されている細胞を特徴付けるために使用される標準的な方法は、記録時のビオシチンまたはneurobiotinでそれらを埋める録音以下のパラホルムアルデヒド(PFA)でセクションを修正し、形態および神経化学を明らかにするために、免疫組織化学を使用することです。スライス生理学のためのセクションの厚さは、典型的には300μmであるので、以上、最も抗体は、その深さを介してすべての道を貫通しないので、そのスライスはビオサイチンと神経化学的マーカー12-14のための同時免疫染色を可能にするために、60μm以下に再区分する必要があります。残念ながら、切除は面倒です。切片中の組織のリスク損失。および形態学的再構成を複雑に、組織の収縮を差動につながることができます。さらに、形態学の予備知識は、細胞によって発現される可能性のある候補マーカーを絞り込む助けることができます。我々は最初の形態の回収のために、その後、潜在的な神経化学的マーカーの同定のためのセクションのシリアル処理を可能にするために、標準的なビオサイチン免疫組織学プロトコルを変更しました。
免疫組織化学は、組織または細胞中の抗原の分布の研究であり、酵素、蛍光標識、放射性元素、金コロイド粒子15を用いて可視化することができます。手続きの私具体的に可視化するための一次抗体を標的とする蛍光二次抗体の使用に続いて一つ以上の特定の抗原を、タグおよび増幅するために一次抗体を使用してnvolves。重複せず、それぞれの二次抗体の蛍光スペクトルを区別する必要性のために、抗原の唯一の限定された数を同時に検査することができます。従って、形態学の予備知識は、細胞分類の候補神経化学的マーカーを選択するのに有用であり得ます。概念的には、すでに染色切片のシリアル処理の背後にある論理的根拠は、1つのタンパク質またはペプチドを免疫標識することは構造的に独立したペプチド16のための抗原性及びその後の免疫標識を妨害してはならないことを前提としています。干渉の欠如は、抗原上の特定のタンパク質のエピトープに対する抗体の結合によるものであるため、同じ組織内の複数の抗原の同時染色を可能にします。抗原の数reveale免疫染色により、Dは、蛍光二次抗体の非重複スペクトルの必要性によって、および交差反応17,18を除去するように、異なる種において産生された抗体を用いて個々の抗原を標的とする必要性によって制限されます。これは、マウントされたセクション上の1つまたは複数の抗原のための免疫標識が完了した後に報告されていない第二の抗原に対する免疫染色、我々の知る限り、相互作用することができる二つの異なる抗体を用いたシリアルではなく、同時標識の背後にある理由は、ですが。ここでは、以前に染色し、取り付けられたセクションのシリアル免疫染色のための方法を説明します。私たちは詳細厚い部分でのタンパク質/ペプチドマーカーについて染色した形態の回復のためのシリアル免疫標識手順については、このプロセスをしながら、同様の手順は、薄い組織切片だけでなく、標準的に使用することができます。加えて、我々は取り除くために、ビオシチン、プロセスを記録したニューロンを埋めるための実践的なアプローチを説明します私たちの最近の研究6,8に示されるように、神経細胞の軸索と樹状突起アーバーの充填を最適化するために、録画の終了時にセルからの電極。
ここで説明する手順の最も重要な利点は、記録された細胞の形態が完全に切除またはスライス免疫染色しようとする前に回収して画像化することができるということです。ある種の抗体の浸透の問題は、二次免疫染色のために切除スライスにそれが必要なレンダリングかもしれないが、ここで詳述される手順は、複数のセクションから複雑なニューロンを再構築する必要がなくなると復興を損なうことができ、組織の損失と収縮差に起因する問題を回避するであろう切除以下。付加的な利点は、プロセスが免疫染色とビオシチンで満たされたニューロンが回収されたスライスに再切片を制限することによって、コスト、時間、労力、そして高価な抗体を削減することです。最も実用的な側面は、広告です上記の技術を使用する前に、染色切片ヶ月で行うことができditional免疫染色。具体的には、形態の回復はかなりの細胞からの生理学的データを伴う細胞型の基本的な形態学的特徴付けを得ることができないために廃棄されていることの可能性を減少させます。
プロトコル
1.ビオシチンは電気生理学の間に充填
注:読者は、ここでは詳述されていない基本的なパッチクランプ記録技術および計測19-22、のための代替エネルギー源を参照することができます。ここで説明する手順は、パッチクランプ記録のための装置及び手順が既に確立されていることを前提とし、その説明はビオシチン充填し、事後免疫染色を関連する詳細に限定されます。本稿に記載されているすべての実験は、ラットで行いました。
- 350μmの23 -ビブラトームを用いて、300の厚さで所望の領域のライブ脳切片を作製。
- 内部液6の1 mLにビオサイチン2mgのを追加することにより、0.2%のビオシチンを含む内部溶液を調製します。ビオシチンが完全に溶解するまで15分 - 最良の結果を得るために、10のための内部液を超音波処理します。次に、0.2&を備えた1 mLのシリンジ内の内部液をロード#160; microloaderに添付μmの細孔径のポリプロピレン製フィルターチップ。内部液中のMg-ATPおよびNa-GTPの安定性を維持するために冷たいパックでこのローディングシリンジを保管してください。
注:グルコン酸カリウムを含む内部溶液(126 mMのK-グルコン酸塩は、4のKCl、10mMのHEPES、4 mMののMg-ATP、0.3mMののNa-GTP、および10mMクレアチンリン酸)は、特定の神経化学的マーカーの回復のために最適です、免疫標識の間に、パルブアルブミンを含みます。我々の経験では、セシウムや塩素系内部のソリューションを使用すると、特定の神経化学的マーカーのための免疫染色を回復する能力を低下させます。 Neurobiotinまたは細胞不透過性は、ビオシチンでアレクサフルオロフォアを結合固定可能極性トレーサーはビオシチンの代替として使用することができます。 - 赤外線微分干渉コントラスト下では、記録のための適切な細胞を可視化します。軸索の中断を最小限にするために、 "アプローチ" Fを使用して、その軸に沿ってピペットを下げることによって、細胞体に近づきますほとんどのマイクロマニピュレーターで利用可能な慰め。パッチクランプ生理学プロトコル19-22を用いた赤外線微分干渉コントラスト下のホールセル記録を確立します。
注:それは軸索を切断するように、推定される軸索の方向からセルに接近避け、切断端( 図1の緑色の矢印)でブレブとして可視化しました。また、高いバックグラウンド染色になりますビオシチンの流出を最小限にするために、細胞に接近しながら記録ピペットに高い正の圧力をかけることは避けてください。
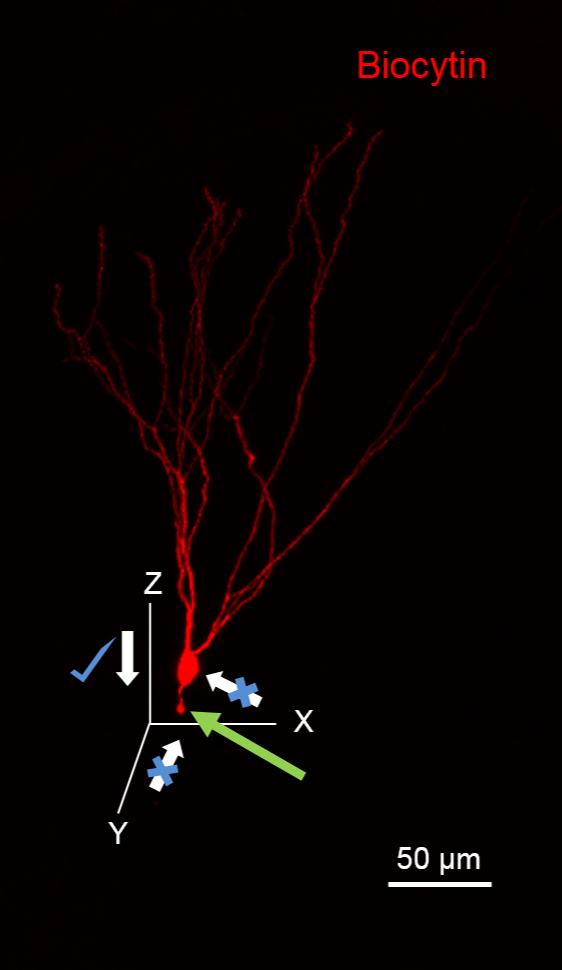
図1.ビオサイチン塗りつぶしのための細胞へのアプローチのために飛行機を推奨しました。画像は(594結合ストレプトアビジンを使用して、赤で)顆粒細胞(GC)ビオシチンを明らかにするように処理されている記録中ビオシチンでいっぱいを示しています。 GCは、XY平面に向い、その樹状突起を有しています。切断された顆粒細胞に注目してくださいXY平面に沿ってピペットの動きに起因する軸索(緑の矢印)。 XZ平面に沿って、このニューロンに近づくように理想的であることに注意してください。スケールバー:50μmです。
- 電圧クランプ構成では、小さな(5 MV)に応答した全細胞容量と直列抵抗、短い(30ミリ秒)の電圧を決定する電気生理学的データ収集および分析ソフトウェアのバスモードでの膜の試験機能を使用して使用して手順。これはビオシチン充填を可能にするために、全細胞記録条件の成立を保証します。
- 必要に応じていずれかの電流または電圧クランプモードでの生理的録音を行っています。 34℃で> 10分の最小記録時間が理想的です。
注:より長い記録時間は、室温で行われた研究のために必要とされてもよいです。 - 生理学的記録が完了すると、ゆっくりと(Z軸に沿って)上方に交互に、小さなステップで記録ピペットを移動させることによって、パッチクランプの設定を再確立し外向きに電圧クランプモード(X軸に沿って)。
- 同時に、容量過渡現象の損失と直線に電流応答の崩壊、細胞の再シールを示すと外外の確立を可視化する「膜テスト」機能を使用して、容量と入力抵抗を監視ピペット先端のパッチ。脱分極電位(-40 mVの)で細胞を保持することは、再シールプロセスを容易にします。
注:細胞の除去のためのこの手順は、通常、相馬と樹状突起の完全な回復を確実にします。この手順の実行中またはピペットから細胞を分離しながら記録ピペットに正の圧力を加えないでください。スライスで記録された細胞の細胞体の可視化に成功離脱を示しています。細胞破片または切り離し先端の終わりに膜パッチの存在は、典型的には相馬の転位を示し、完全な細胞形態を得られません。 - アフト遠位樹状突起と軸索のプロセスに色素の輸送を確保するために5分 - 小胞体細胞からピペットを取り外し、3の録音室にスライスを保持しています。
- 固定のために、4%PFAを含む24ウェルプレートにスライスを転送します。
注意:PFAは、発がん性、および手袋、フェイスマスクなど、適切な個人保護具を、である、皮膚の炎症や吸入を避けるために使用する必要があります。 PFAは可燃性で、火災の手の届かないところに保管しなければなりません。 PFAは、ドレインで処分されることはありませんし、化学廃棄物として収集する必要があります。 PFA固定は、トランスファーピペットを含む生理学のセットアップの汚染を避けるために、ライブスライス標本のために利用領域から分離されなければなりません。 - 24から48時間のPFA固定後、免疫染色の前に貯蔵のために0.1 Mリン酸緩衝生理食塩水(PBS)にスライスを転送します。
注:理想的には、回復と免疫ビオシチン染色あたりものの、すぐに固定した後に行われている最高の時固定利回り良い結果の7日間内に形成されました。固定日後および90をかけて行う染色のために、0.05%アジ化ナトリウム - スライスは0.02でPBSに維持することができます。 PFA中で一晩固定が最も抗体については適切に機能しますが、いくつかの抗体が固定液中でのインキュベーションの持続時間が減少すると最適に動作することが可能です。 48時間以上のためのPFAで固定は、抗原の可用性が低下し、神経化学的マーカーのための成功した二次免疫染色の可能性を減少させます。
注意:アジ化ナトリウムは非常に危険と皮膚や目にまたは経口摂取または吸入時に接触した際に刺激性です。重度の過剰暴露すると死に至ることができます。化合物の発がん性や変異原性は知られていません。手袋、スプラッシュゴーグル、白衣、および防塵マスクなど、適切な個人保護具を使用してください。アジ化ナトリウムは、ドレインで処分されることはありませんし、化学廃棄物として収集する必要があります。
(1日目)
注:以下の免疫染色手順は自由に浮動セクションのためのものであり、全てのインキュベーションステップのためのシェーカー上で低速(2回転/分、rpm)で連続振とうが必要です。
- 0.1 M PBS(pH値= 7.4)で10分間ずつ組織3回洗浄します。
注:0.1次のようにM PBSは、商業的に購入するか、または実験室で作製することができる(1 Lになる):1中のNaCl 8gの、塩化カリウム0.2gをし 、Na 2 HPO 4 1.44gの、およびKH 2 PO 4 0.24gのdH 2 0のL。
注記:所望の神経化学的マーカーが知られている場合、タンパク質/ペプチドのための染色はビオシチン染色と同時に行うことができる(2.2ステップ - 2.4)。のみビオシチンのために染色した場合、2.5に進みます。 - オプション:10%が血清ブロッキングブロック(BSを、室温で1時間、PBS中0.3%トリトンX-100中に希釈した正常ヤギ血清(NGS))。
注:各ウェルがすべき溶液の同一量を受け取ります。 500μL/ウェル - 推奨量は250〜です。ブロッキング血清の選択は、二次抗体( 例えば、NGSを色素結合体化ヤギ抗(それぞれの一次抗体種)のために使用される)が発生される種に基づいています。必要がセクションを免疫染色するために、異なる種で育った二次抗体を使用する必要が生じた場合は、ステップ(2)をブロック内の各正常血清の10%および一次および二次抗体インキュベーションステップの各正常血清の3%を含みます。 - (オプション)一次抗体のセクションをインキュベートし、RT O / Nで0.1 M PBS中0.3%トリトンX-100、および3%BSとCB 1 R(ポリクローナル、モルモット)。 CB 1 Rは、カンナビノイド受容体タイプ1の発現を同定するために使用されます。
注:このステップはオプションとビオシチン充填を明らかにする必要はありません。 図2は、第1の染色処理中にビオサイチンとCB 1 R用のラベルの付いたセクションを示しています。 O / NのincuRTでbationは、一次抗体のほとんどのために十分です。インキュベーションの5日-しかし、CB 1 Rを含む、特定の一次抗体は、3が必要です。インキュベーションは長く1 dよりにする必要がある場合はトリトンX-100は、スライスを透過することができ、室温で長時間のインキュベーション中の組織の崩壊につながることができますので、それを4℃でインキュベートすることをお勧めします。二次抗体の特異性の対照として、実験の各シリーズの少なくとも1つのセクションでは、一次抗体を欠く陰性コントロールを含めます。陰性対照は、一次抗体を省略したが、0.3%トリトンX-100 PBS及びBS M 0.1で添加します。
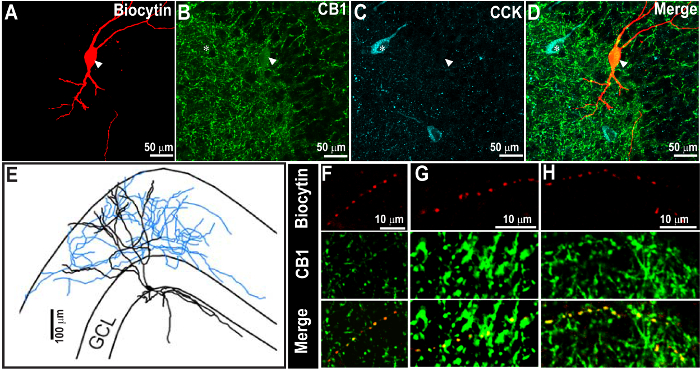
図2. 成功CCK染色ビオサイチン染色およびCの回復に続いて1週間が 受容体タイプ1(CB 1 R)を annabinoid - <強い>ラベリング。 (A - C)60Xでの共焦点画像はビオシチンで満たされたニューロン(A)と矢印で示されているCB 1 R免疫反応性(B)を示します。同じセクションでは、1週間(C)の後にCCK免疫染色のために処理しました。画像のオーバーレイがDで示されています。 CCKの免疫反応性は、遠赤用いて明らかにしたとシアンで擬似着色しました。 (E)ビオサイチンおよびCB 1 R染色があっても第二CCK免疫染色後に明らかであることをA.ノートでビオシチンで満たされた細胞の形態学的再建。また、CB 1 RおよびCCKの免疫染色パターンの予想される分布に注意してください。 (F - H)細胞からの軸索の拡大像、Aのように、ビオシチン及び軸索(矢頭)におけるCB 1 Rの近い共局在を示しています。スケールバー:50μmの( - D)、100ミクロン(E)、および10ミクロン( F - H)。画像はゆうらから再生されます。 2015年9。 この図の拡大版をご覧になるにはこちらをクリックしてください。
(2日目)
- 脳切片を0.1 M PBS(pH値= 7.4)で10分間ずつ3倍洗います。
- ストレプトアビジン赤い色素複合体のセクションをインキュベート(濃度:1:1,000;励起:可視赤色スペクトルの発光と594ナノメートル)で4°COで0.1 M PBS中0.3%トリトンX-100および3%BSと/ N暗い(アルミホイルで包んで)ビオシチンを明らかにしました。ステップ2.3における任意の一次インキュベーションを以下の場合は、上記のインキュベーションと:;(緑で488 nmおよび発光励起500:1濃度)、:オプションの二次抗体、ヤギ抗モルモットを含めます。
注:オプションの一次抗体染色(ステップ2.3)が実行された場合に限り、二次抗体が必要とされるであろう。 、STREをビオシチンを視覚化するために、それは( - 3図1)について詳細に、より良いコントラストでより細かい軸索を可視化するのに役立ちますように、赤色に発光スペクトルを有するptavidin -フルオロフォアコンジュゲートは、推奨されます。二重または三重免疫染色の間、お互いに二次抗体の交差反応性を避けるために、二次抗体をシリアル方式で次々に加える(抗体の連続添加の間、2時間間隔で十分です)。 図3Aは、オプションの一次抗体染色せずに処理され、切除前に撮像されたビオシチンで満たされたセルを示します。
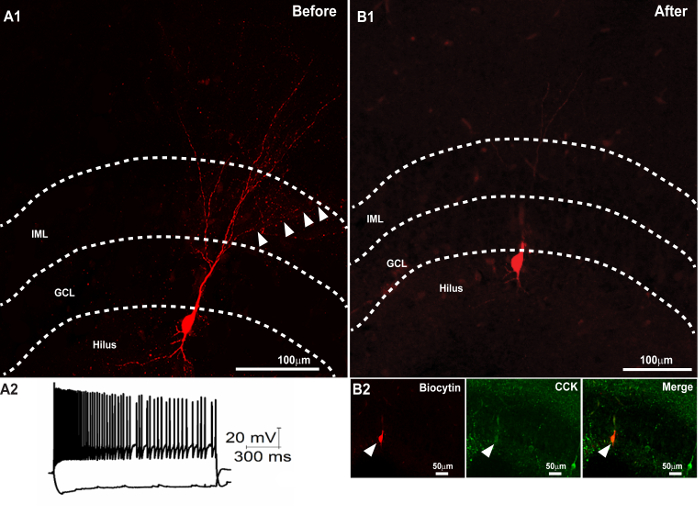
ビオシチン形態と切除の回復次の 図3. 成功したセカンド免疫染色。ビオシチンで満たされた細胞の樹状形態の回復を示す300μmのスライスの(A1)の共焦点画像。 (<500と-100 pAの現在の注射に応答するニューロンの強い> A2)膜の電圧トレース。取り付けおよびイメージング後の(A1)で300μmの部分を切除した後に得られた50μmのセクションにビオシチンで満たされたソーマの(B)の回復。 (B2)、薄膜部のその後の免疫染色は、CCK(中央のパネル)とのビオシチンで満たされたソーマ(右パネル)の共局在を明らかにしました。マージされた画像は、右側のパネルに示されています。スケールバー:50μmです。パネルA2はゆうらからの許可を得て複製されます。 、プレス25インチ この図の拡大版をご覧になるにはこちらをクリックしてください。
(3日目)
- 洗浄脳切片を0.1 M PBS液(pH = 7.4)で、各10分間の3倍。
- 蛍光を保護するために、将来的に再染色を容易にするために、秒マウント水性マウンティング培地中のションと明確なマニキュアでカバースリップの端をシールします。
注:これは、スライド、金型の蔓延、およびガラススライドからマウント媒体の漏洩に起因する組織の脱水からネイルポリッシュを除去するのに困難を避けるために、可能な限り早期にセクションをrestainするのが最善です。微生物汚染は、PBS中の0.02%アジ化ナトリウムを使用することによって防止することができます。
注意:これは、水と接触しているときにアジ化ナトリウムは、非常に有毒で、可燃性です。有害化学物質の取り扱いや廃棄のための標準操作手順を参照してください。
(日数4から7) - 594での励起および488 nmのとし、緑に赤と神経化学的マーカー(CB 1 R)でビオシチンで満たされたニューロンを明らかにするために20Xや40Xの倍率で共焦点イメージングを実行します。 ( 図2)を colabeling評価します。
- 光退色を避けるために100ミリ秒未満にカメラの露出を設定し、obta全体ニューロンの軸索と樹状突起アーバーの共焦点画像スタックインチ使用する共焦点画像スタックとニューロントレーシングソフトウェアパッケージは、ニューロン形態を再構成します。
第一次抗体の3染色
注: - 10 D秒免疫染色工程は、第一の染色後90 Dを行うことができる一方、第2の一次抗体染色が7内で行われる場合、最適な染色が達成されます。
(7後- 90 D)
- 綿棒にアセトンを適用し、スライドガラスのオフにマニキュアを取り除きます。
- 先の細いピンセットを使って慎重にカバースリップを削除し、セクションに0.1 M PBSを数滴を入れました。
- 慎重に細かいペイントブラシを使用したスライドからセクションを削除し、24のために0.1 M PBSでそれらを洗う- 4 O℃で、低光の中でアルミ箔で覆われたシェーカー上で48時間
注:とのセクションをカバーすることが重要です光退色を避けるためluminum箔。 - 10分ごとに0.1 M PBSに次の日に2回 - 封入剤の完全な除去を確実にするために、セクション1を洗います。
- 1 D( 図2)のための第一次抗体(マウスモノクローナル抗体);:1,000:1濃度例えば、コレシストキニン、特定のGABA作動性介在ニューロンに見られる神経ペプチド(CCK)でインキュベーションを続行します。
注:この手順は2.3のステップに似ていますが、異なる抗体を使用しています。また、ブロッキング工程は、再染色の際に省略されています。 - 0.1 M PBS(pH値= 7.4)で10分間ずつ脳切片を3回洗浄します。
- フォア結合二次抗体ヤギ抗マウスとステイン(濃度:1:500;励起波長:647 nm)を、二次抗体の励起 - 発光スペクトルは、ストレプトアビジン(濃度と重ならないことを確認すること:1:1,000;励起波長:594 nm)での前免疫蛍光汚れ。
- 水性マウント媒体中のセクションをマウントして、明確なマニキュアでカバースリップの端をシールします。
注:蛍光を保護するために不透明な収納ボックスに4°Cでのセクションを保管してください。
結果
正常に完了すると、セクションでは、ビオサイチンフィルと免疫標識は、ステップ2で行われ、共焦点またはエピ蛍光顕微鏡を用いて画像化することができる保持します。また、処理されたセクションはまた、図2に示すセクションでは、ステップ3で、その後の処理中に標識された抗原のための免疫染色が表示され、肉厚部(300ミクロン)でビオシチンで?...
ディスカッション
プロトコル内の重要なステップ
ビオシチンでパッチを適用する細胞を充填することは形態の完全な回復を確実にするために最も重要なステップです。細胞の完全な回復のために、スライス中のプロセスの切断を最小限に抑えるために、最適なスライスの向きを選択することが重要です。この配向は検査中の回路および細胞タイプに基づいて異なる場合があ?...
開示事項
著者らは、開示することは何もありません。
謝辞
著者らは、VSにNIH / NINDS R01 NS069861とNJCBIR CBIR14IRG024からの支援を感謝したいです
資料
| Name | Company | Catalog Number | Comments |
| NaCl | Sigma | S7653 | Immunostaining |
| KCl | Fluka | 60129 | Immunostaining |
| Na2HPO4 | Sigma | S7907 | Immunostaining |
| KH2PO4 | Sigma | 229806 | Immunostaining |
| Triton X-100 | Sigma | T8787 | Immunostaining |
| Guinea pig anti CB1 | Sigma | Af530-1 | Immunostaining |
| Mouse anti CCK | CURE, UCLA | courtesy of G. Ohning | Immunostaining |
| Rabbit anti Parvalbumin | Swant | PV27 | Immunostaining |
| Streptavidin, Alexa Fluor conjugate | Molecular Probes | S11227 | Immunostaining |
| Normal goat serum (NGS) | Sigma | G9023 | Immunostaining |
| Vectashield | Vector Labs | H-1000 | Immunostaining |
| Secondary Antibodies | Invitogen Molecular probes | Alexa Fluor conjugated dyes | Immunostaining |
| Labnet orbit low speed shaker | Bioexpress | S-2030-LS | Immunostaining |
| Forceps | Dumont | 11231-30 | Immunostaining |
| Slide folders | EMS | 71520 | Immunostaining |
| Vibratome VT 1200 S | Leica | 14048142066 | Electrophysiology |
| Multiclamp 700B amplifier | Molecular devices | Multiclamp 700B | Electrophysiology |
| pCLAMP 10 Software | Molecular devices | pCLAMP 10 | Electrophysiology |
| Digitizer | Molecular Devices | Digidata 1440 digitizer | Electrophysiology |
| Filter tips | Nalgene | 171-0020 | Electrophysiology |
| Sonicator | Fisher Scientific | 15-335-100 | Electrophysiology |
| Microloaders | Eppendorf | 930001007 | Electrophysiology |
| Biocytin | Sigma | B4261 | Electrophysiology |
参考文献
- Garcia-Lopez, P., Garcia-Marin, V., Freire, M. The histological slides and drawings of cajal. Front Neuroanat. 4, 9 (2010).
- Klausberger, T., Somogyi, P. Neuronal diversity and temporal dynamics: the unity of hippocampal circuit operations. Science. 321 (5885), 53-57 (2008).
- Petilla Interneuron Nomenclature, G., et al. Petilla terminology: nomenclature of features of GABAergic interneurons of the cerebral cortex. Nat Rev Neurosci. 9 (7), 557-568 (2008).
- Armstrong, C., Soltesz, I. Basket cell dichotomy in microcircuit function. J Physiol. 590 (4), 683-694 (2012).
- Povysheva, N. V., Zaitsev, A. V., Gonzalez-Burgos, G., Lewis, D. A. Electrophysiological heterogeneity of fast-spiking interneurons: chandelier versus basket cells. PLoS One. 8 (8), e70553 (2013).
- Gupta, A., Elgammal, F. S., Proddutur, A., Shah, S., Santhakumar, V. Decrease in tonic inhibition contributes to increase in dentate semilunar granule cell excitability after brain injury. J Neurosci. 32 (7), 2523-2537 (2012).
- Fish, K. N., Hoftman, G. D., Sheikh, W., Kitchens, M., Lewis, D. A. Parvalbumin-containing chandelier and basket cell boutons have distinctive modes of maturation in monkey prefrontal cortex. J Neurosci. 33 (19), 8352-8358 (2013).
- Yu, J., Swietek, B., Proddutur, A., Santhakumar, V. Dentate cannabinoid-sensitive interneurons undergo unique and selective strengthening of mutual synaptic inhibition in experimental epilepsy. Neurobiol Dis. 89, 23-35 (2016).
- Yu, J., Swietek, B., Proddutur, A., Santhakumar, V. Dentate total molecular layer interneurons mediate cannabinoid-sensitive inhibition. Hippocampus. 25 (8), 884-889 (2015).
- Varga, C., et al. Functional fission of parvalbumin interneuron classes during fast network events. Elife. 3, (2014).
- Kawashima, T., Okuno, H., Bito, H. A new era for functional labeling of neurons: activity-dependent promoters have come of age. Neural Circuits Revealed. , 109 (2015).
- Krook-Magnuson, E., Luu, L., Lee, S. H., Varga, C., Soltesz, I. Ivy and neurogliaform interneurons are a major target of mu-opioid receptor modulation. J Neurosci. 31 (42), 14861-14870 (2011).
- Szabadics, J., Soltesz, I. Functional specificity of mossy fiber innervation of GABAergic cells in the hippocampus. J Neurosci. 29 (13), 4239-4251 (2009).
- Iball, J., Ali, A. B. Endocannabinoid Release Modulates Electrical Coupling between CCK Cells Connected via Chemical and Electrical Synapses in CA1. Front Neural Circuits. 5, 17 (2011).
- Chen, X., Cho, D. -. B., Yang, P. -. C. Double staining immunohistochemistry. N Am J Med Sci. 2 (5), 241-245 (2010).
- Ranjan, A. K., et al. Cellular detection of multiple antigens at single cell resolution using antibodies generated from the same species. Journal of immunological. 379 (1), 42-47 (2012).
- Fuccillo, D. A., Sever, J. L. . Concepts in Viral Pathogenesis II. , 324-330 (1986).
- Buchwalow, I. B., Minin, E. A., Boecker, W. A multicolor fluorescence immunostaining technique for simultaneous antigen targeting. Acta Histochem. 107 (2), 143-148 (2005).
- Qi, G., Radnikow, G., Feldmeyer, D. Electrophysiological and morphological characterization of neuronal microcircuits in acute brain slices using paired patch-clamp recordings. JoVE (Journal of Visualized Experiments. (95), e52358 (2015).
- Walz, W. . Patch-clamp analysis : advanced techniques. 2nd edn. , (2007).
- Molnar, P. . Patch-clamp methods and protocols. 403, (2007).
- Martina, M., Taverna, S. . Patch-clamp methods and protocols. , (2014).
- Booker, S. A., Song, J., Vida, I. Whole-cell patch-clamp recordings from morphologically- and neurochemically-identified hippocampal interneurons). J Vis Exp. (91), e51706 (2014).
- Jinno, S., Kosaka, T. Immunocytochemical characterization of hippocamposeptal projecting GABAergic nonprincipal neurons in the mouse brain: a retrograde labeling study. Brain research. 945 (2), 219-231 (2002).
- Yu, J., Proddutur, A., Swietek, B., Elgammal, F. S., Santhakumar, V. Functional Reduction in Cannabinoid-Sensitive Heterotypic Inhibition of Dentate Basket Cells in Epilepsy: Impact on Network Rhythms. Cereb Cortex. , (2015).
- Proddutur, A., Yu, J., Elgammal, F. S., Santhakumar, V. Seizure-induced alterations in fast-spiking basket cell GABA currents modulate frequency and coherence of gamma oscillation in network simulations. Chaos. 23 (4), 046109 (2013).
- Scharfman, H. E. Differentiation of rat dentate neurons by morphology and electrophysiology in hippocampal slices: granule cells, spiny hilar cells and aspiny 'fast-spiking' cells. Epilepsy Res Suppl. 7, 93-109 (1992).
- Tasker, J. G., Hoffman, N. W., Dudek, F. E. Comparison of three intracellular markers for combined electrophysiological, morphological and immunohistochemical analyses. J Neurosci Methods. 38 (2-3), 129-143 (1991).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved