Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Immunocoloration des articles biocytine remplis et transformés pour neurochimiques Marqueurs
Dans cet article
Résumé
Ce protocole présente un procédé pour la récupération morphologique des neurones corrigés lors des enregistrements électrophysiologiques en utilisant le remplissage de la biocytine et de post-traitement immunohistochimique ultérieure. Nous montrons que les sections de biocytin rempli d'épaisseur qui ont été colorées et sous une lamelle peuvent être recolorées avec un deuxième jours ou des mois d'anticorps primaires plus tard.
Résumé
Enregistrements électrophysiologiques des cellules en utilisant la technique du patch clamp ont permis l'identification de différents types de neurones en fonction des modèles de tir. L'inclusion de biocytin / neurobiotin dans l'électrode d'enregistrement permet la récupération post-hoc des détails morphologiques, qui sont nécessaires pour déterminer l'arborisation dendritique et les régions ciblées par les axones des neurones enregistrés. Toutefois, étant donné la présence de neurones morphologiquement similaires avec des identités et des fonctions neurochimiques distinctes, la coloration immunohistochimique pour les protéines cellule de type spécifique est essentiel d'identifier définitivement les neurones. Pour maintenir la connectivité de réseau, des sections de cerveau pour les enregistrements physiologiques sont préparées à une épaisseur de 300 um ou plus. Toutefois, cette épaisseur empêche souvent le post-traitement immunohistochimique à cause de problèmes avec la pénétration de l'anticorps, ce qui nécessite la résection du tissu. Résection de tranches est un art difficile, Resul souventtion de la perte de tissu et de la morphologie des cellules à partir desquelles les données électrophysiologiques ont été obtenus, ce qui rend les données inutilisable. Etant donné que la récupération de la morphologie limiterait la perte de données et le guide dans le choix des marqueurs neuronaux, nous avons adopté une stratégie de récupération de la morphologie des cellules en premier, suivi par immunocoloration secondaire. Nous introduisons une approche pratique pour biocytin remplissage pendant les enregistrements physiologiques et immunocoloration série subséquente pour la récupération de la morphologie, suivie par la recoloration des sections pour déterminer l'identité neurochimique. Nous rapportons que les articles qui ont été remplis avec biocytin, fixés avec du paraformaldehyde (PFA), colorées, et sous une lamelle peuvent être enlevés et recolorées avec un deuxième jours d'anticorps primaires plus tard. Cette recoloration implique la suppression de la lamelle couvre-objet, le lavage des coupes dans une solution tampon et l'incubation des anticorps primaires et secondaires afin de révéler l'identité neurochimique. Le procédé est avantageux pour l'élimination datune perte due à l'incapacité de recouvrer la morphologie et pour réduire la liste des marqueurs neurochimiques à tester sur la base de la morphologie.
Introduction
Le cerveau est connue pour la diversité dans les caractéristiques structurelles et fonctionnelles de ses éléments neuronaux individuels. Comprendre les rôles des types de neurones distincts dans le fonctionnement du cerveau et de la pathologie nécessite la caractérisation et l'identification sans ambiguïté des neurones. Structurellement, les caractéristiques morphologiques définies par emplacement somato-dendritique déterminent les entrées potentielles qu'un neurone donné reçoit, tandis que le modèle d'arborisation axonale identifie des cibles postsynaptiques potentiels. La diversité structurelle des neurones a été apprécié depuis les journées d'études histologiques séminales de Ramón y Cajal 1. L'avènement des techniques d'enregistrement monocellulaires ont révélé que les neurones structurellement distincts présentent également des différences dans les schémas de mise à feu et des caractéristiques synaptiques. La diversité dans la structure et la physiologie est particulièrement évidente dans GABAergiques neurones inhibiteurs 2,3. En outre, il est devenu de plus en plus évident que structurally neurones similaires peuvent exprimer différents marqueurs neurochimiques et montrent des différences fonctionnelles 4 correspondantes. De même, les neurones avec les mêmes marqueurs neurochimiques peuvent avoir des structures et des fonctions 5-10 distinctes. Ainsi, en pratique, l'analyse des caractéristiques fonctionnelles des neurones et leur rôle dans le réseau implique de définir les deux identités morphologiques et neurochimiques. Même avec l'arrivée des lignées de souris rapporteurs de ciblage de marqueurs neurochimiques spécifiques, il est souvent nécessaire de déterminer la morphologie et l' identité des sous - types sur la base de 11 immunohistologie.
La méthode standard utilisée pour caractériser les cellules enregistrées dans des tranches de cerveau aiguë est de les remplir avec biocytin ou neurobiotin lors de l'enregistrement, de fixer les sections de paraformaldehyde (PFA) après les enregistrements, et utiliser l'immunohistochimie pour révéler la morphologie et la neurochimie. Comme l'épaisseur des sections pour la tranche de la physiologie sont généralement 300 umou plus, et parce que la plupart des anticorps ne parviennent pas à pénétrer tout au long de cette profondeur, les tranches doivent être re-coupe de 60 um ou moins pour permettre immunocoloration simultanée biocytine et des marqueurs neurochimiques 12-14. Malheureusement, la résection est laborieuse; les risques de perte de tissu pendant la coupe; et peut conduire à une différence de retrait des tissus, ce qui complique les reconstitutions morphologiques. En outre, la connaissance préalable de la morphologie pourrait aider à réduire les marqueurs candidats qui sont susceptibles d'être exprimé par les cellules. Nous avons modifié les protocoles de immunohistologiques biocytin standards pour permettre le traitement de série de premières sections pour la récupération de la morphologie et ensuite pour l'identification de marqueurs neurochimiques potentiels.
L' immunohistochimie est l'étude de la distribution des antigènes dans des tissus ou cellules et peut être visualisé en utilisant une enzyme, des marqueurs fluorescents, les éléments radioactifs, ou des particules colloïdales d'or 15. La procédure impl quent l'utilisation d'anticorps primaires pour marquer spécifiquement et amplifier un ou plusieurs antigènes spécifiques, suivie par l'utilisation d'anticorps secondaires fluorescents de ciblage de l'anticorps primaire pour la visualisation. En raison de la nécessité de distinguer les spectres de fluorescence de chaque anticorps secondaire sans chevauchement, seul un nombre limité d'antigènes peut être examinée simultanément. Ainsi, la connaissance préalable de la morphologie pourrait être utile dans le choix des candidats marqueurs neurochimiques pour la classification des cellules. Conceptuellement, la raison d'un traitement en série des sections déjà colorées est basé sur la prémisse que immunomarquage pour une protéine ou un peptide ne doit pas interférer avec antigénicité et immunomarquage subséquente pour un peptide structurellement indépendante 16. Cette absence d'interférence est due à la liaison des anticorps à un épitope de la protéine spécifique d'un antigène et permet la coloration simultanée des antigènes multiples dans le même tissu par conséquent. Le nombre d'antigènes Revealed par immunocoloration est limitée par la nécessité pour les spectres de non-chevauchement des anticorps secondaires fluorescents et par la nécessité de cibler des antigènes individuels avec des anticorps dirigés dans différentes espèces de façon à éliminer la réactivité croisée 17,18. Bien que ce soit le raisonnement derrière l'étiquetage série plutôt que simultanée avec deux anticorps différents qui peuvent interagir, à notre connaissance, immunocoloration pour un second antigène n'a pas été signalée après l'achèvement de immunomarquage pour un ou plusieurs antigènes sur des tronçons montés. Ici, nous décrivons une méthode pour immunocoloration série de sections précédemment colorées et montées. Alors que nous détaillons ce processus pour une procédure de immunomarquage série pour la récupération de la morphologie suivie d'une coloration des marqueurs de protéine / peptide dans des sections épaisses, les mêmes procédures peuvent être utilisées dans la norme, des sections minces histologiques ainsi. En outre, nous décrivons une approche pratique pour remplir les neurones enregistrés avec biocytin et le processus pour déloger lal' électrode de la cellule lors de l' achèvement des enregistrements afin d' optimiser le remplissage du axonale et arborisation dendritique des neurones, tels que présentés dans notre récent travail de 6,8.
L'avantage le plus important de la procédure décrite ici est que la morphologie de la cellule enregistrée peut être entièrement récupérée et imagée avant de tenter de résection ou immunocoloration des tranches. Bien que des problèmes avec la pénétration de certains anticorps peuvent rendre nécessaire de tranches de résection pour immunocoloration secondaire, les procédures détaillées ici éliminerait la nécessité de reconstruire les neurones complexes à partir de plusieurs sections et éviterait les problèmes dus à la perte de tissus et de retrait différentiel, ce qui peut compromettre la reconstruction suivant la résection. Un avantage supplémentaire est que le processus permettra de réduire le coût, le temps, l'effort, et des anticorps coûteux en limitant immunocoloration et re-sectionnant à des tranches dans lequel les neurones biocytin remplis sont récupérés. L'aspect le plus pratique est l'annonceimmunocoloration tradi- qui peut être effectuée sur des coupes colorées mois avant d'utiliser la technique mentionnée ci-dessus. En particulier, la récupération de la morphologie réduirait considérablement le risque que les données physiologiques à partir des cellules sont rejetées en raison d'une incapacité à obtenir une caractérisation morphologique de base du type de cellule.
Protocole
1. biocytine remplissage pendant électrophysiologie
REMARQUE: Les lecteurs peuvent se référer à d' autres sources pour les techniques de base de patch-clamp enregistrement et l' instrumentation 19-22, qui ne sont pas élaborés sur ici. Les étapes détaillées ici supposent que le matériel et les procédures pour les enregistrements de patch-clamp sont déjà établis, et la description seront limités aux détails relatifs à biocytin-remplissage et immunocoloration post-hoc. Toutes les expériences décrites dans ce manuscrit ont été réalisées sur des rats.
- En utilisant un vibratome, prépare des coupes de cerveau en direct de la région désirée à une épaisseur de 300-350 um 23.
- Préparer une solution interne contenant 0,2% biocytine en ajoutant 2 mg de biocytine à 1 ml de solution interne 6. Pour de meilleurs résultats, sonication la solution interne pendant 10 - 15 min jusqu'à ce que le biocytin se dissout complètement. Ensuite, charger la solution interne dans une seringue de 1 ml munie d'un 0,2 &# 160; um pore bout filtre taille de polypropylène attaché à un microloader. Gardez cette charge seringue sur une compresse froide pour maintenir la stabilité du Mg-ATP et de Na-GTP dans la solution interne.
NOTE: Un gluconate de potassium solution interne contenant (126 mM K-gluconate, 4 mM de KCl, 10 mM de HEPES, 4 mM Mg-ATP, 0,3 mM Na-GTP et mM phosphocréatine 10) est optimale pour la récupération de certains marqueurs neurochimiques, y compris parvalbumine, au cours immunomarquage. Dans notre expérience, en utilisant des solutions internes et césium à base de chlorure réduit la capacité de récupérer immunocoloration pour certains marqueurs neurochimiques. Neurobiotin ou, peut être fixé, traceur polaire cellule impermeant combinant un fluorophore Alexa avec biocytine peuvent être utilisés comme une alternative à la biocytine. - Sous infrarouge contraste d'interférence différentiel, de visualiser la cellule appropriée pour l'enregistrement. Pour réduire au minimum toute perturbation de l'axone, l'approche du corps de la cellule en diminuant la pipette le long de son axe en utilisant la "méthode" fOnction disponible dans la plupart des micromanipulateurs. Mettre en place des enregistrements de cellules entières sous différentiel infrarouge contraste d' interférence en utilisant des protocoles de physiologie patch-clamp 19-22.
REMARQUE: Évitez de vous approcher de la cellule de la direction de l'axone putative, car il sectionner l'axone, visualisé comme une bulle à l'extrémité coupée (flèche verte dans la figure 1). Aussi, évitez d'appliquer une pression positive élevée à la pipette d'enregistrement tout en se rapprochant de la cellule pour minimiser le déversement de biocytin, ce qui se traduira en arrière-plan de haute coloration.
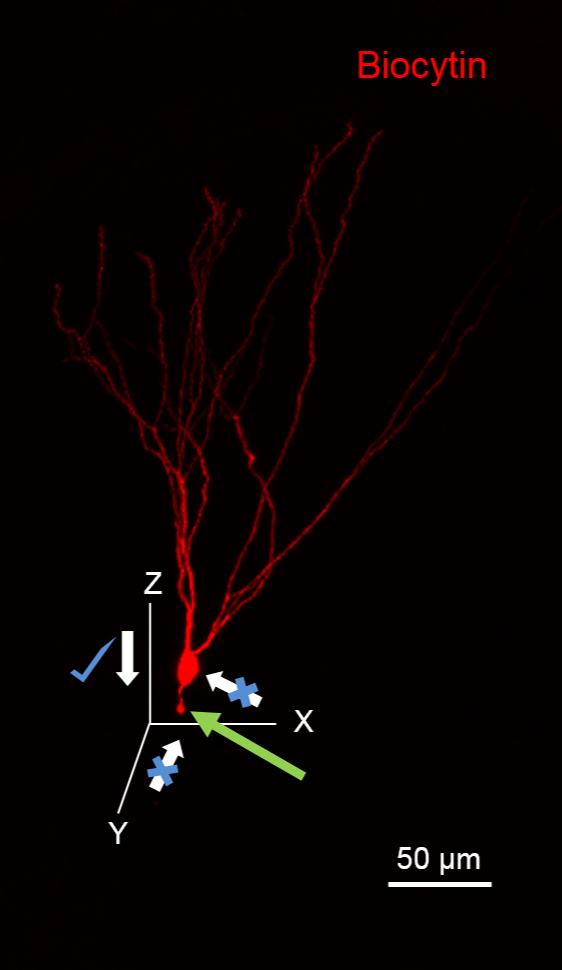
Figure 1. Suggestions Avion pour approcher les cellules pour biocytine Fills. L'image illustre une cellule de granule (GC) remplir de biocytin lors de l'enregistrement qui a été traité pour révéler biocytin (en rouge à l'aide de la streptavidine 594-conjugué). Le CPG a ses dendrites orientées dans le plan XY. Remarquez la cellule de granule rompuaxone (flèche verte) en raison du mouvement de la pipette le long du plan XY. A noter qu'il est idéal pour aborder ce neurone dans le plan XZ. Barre d'échelle: 50 um.
- Dans la configuration de la pince de tension, déterminer la capacité de la cellule entière et la résistance série en réponse à une petite chambre (5 mV), condensé (30 ms), la tension d'étapes à l'aide de l'utilisation de la fonction de test de la membrane en mode bain dans une acquisition de données d'électrophysiologie et un logiciel d'analyse. Cela permettra d'assurer la mise en place des conditions d'enregistrement à cellules entières pour permettre biocytin-remplissage.
- Effectuer des enregistrements physiologiques en mode soit current- ou voltage-clamp au besoin. Une durée minimale d'enregistrement> 10 min à 34 ° C est idéale.
NOTE: durées d'enregistrement peuvent être nécessaires pour des études réalisées à la température ambiante. - À la fin des enregistrements physiologiques, rétablir la configuration patch-clamp en déplaçant lentement la pipette d'enregistrement par petites étapes, en alternance vers le haut (le long de l'axe Z), etvers l'extérieur (le long de l'axe X) en mode voltage-clamp.
- surveiller simultanément la capacité de résistance et d'entrée en utilisant la fonction "test membrane" pour visualiser la perte de transitoires capacitifs et l'effondrement des réponses actuelles à une ligne droite, ce qui indique la ré-étanchéité de la cellule et la mise en place d'un extérieur-extérieur patcher à la pointe de la pipette. Tenir la cellule à un potentiel dépolarisée (-40 mV) facilitera le processus de re-étanchéité.
REMARQUE: cette procédure pour le prélèvement d'une cellule assure généralement la récupération complète du soma et les dendrites. Ne pas appliquer une pression positive à la pipette d'enregistrement au cours de cette procédure ou en détachant la cellule de la pipette. Visualisation du soma de la cellule enregistrée dans la tranche indique le désengagement réussi. La présence de débris cellulaires ou d'une pièce de membrane à l'extrémité de la pointe détachée indique généralement la dislocation du soma et ne donnera pas la morphologie cellulaire complète. - à l'arrièreer détachement de la pipette de la cellule, de retenir la tranche dans la chambre d'enregistrement pendant 3 - 5 min pour assurer le transport du colorant sur dendritique distal et les processus axonaux.
- Transférer les tranches sur une plaque de 24 puits contenant 4% de PFA pour la fixation.
ATTENTION: PFA est cancérigène, et de l' équipement de protection individuelle approprié, y compris des gants et un masque facial, doit être utilisé pour éviter les irritations de la peau et l' inhalation. PFA est inflammable et doit être gardé hors de portée du feu. PFA est jamais disposé dans le drain et doivent être collectés comme des déchets chimiques. PFA fixation doit être isolé des zones utilisées pour la préparation de tranche en direct pour éviter la contamination de la configuration de la physiologie, y compris pipettes de transfert. - 24 - 48 h après PFA fixation, transférer les tranches à 0,1 M Saline tamponnée au phosphate (PBS) pour le stockage avant immunocoloration.
NOTE: Idéalement, biocytin récupération et immunocoloration sont mieux lorsqu'il est effectué peu de temps après la fixation, bien que par coloration formé dans les 7 j de fixation donne de bons résultats. Les tranches peuvent être maintenues dans du PBS avec 0,02 - azoture de sodium à 0,05% pour la coloration effectuée jusqu'à et plus de 90 jours après la fixation. Bien que la fixation d'une nuit en PFA fonctionne bien pour la plupart des anticorps, il est possible que certains anticorps fonctionnent mieux lorsque la durée d'incubation dans le fixatif est réduite. Fixation en PFA pendant plus de 48 heures réduit la disponibilité d'antigènes et diminue les chances de succès de l'immunocoloration secondaire pour les marqueurs neurochimiques.
ATTENTION: L' azoture de sodium est extrêmement dangereux et irritant au contact avec la peau ou les yeux , ou lors de l' ingestion ou par inhalation. surexposition sévère peut entraîner la mort. La cancérogénicité et la mutagénicité du composé ne sont pas connus. Utiliser un équipement de protection individuelle approprié, y compris des gants, des lunettes de protection, une blouse et un masque à poussière. L'azoture de sodium est jamais disposé dans le drain et doivent être collectés comme des déchets chimiques.
(Jour 1)
REMARQUE: La procédure d'immunocoloration suivante est pour les sections flottantes et nécessite agitation continue à une vitesse faible (2 tours / min, vitesse de rotation) sur un agitateur pour toutes les étapes d'incubation.
- Laver le tissu 3x pendant 10 minutes chacun dans du PBS 0,1 M (pH = 7,4).
REMARQUE: 0,1 M de PBS peut être acheté ou mis dans le commerce dans le laboratoire de la manière suivante ( en fait 1 L): 8 g de NaCl, 0,2 g de KCl, 1,44 g de Na 2 HPO 4 et 0,24 g de KH 2 PO 4 en 1 L de dH 2 0.
NOTE: Si le marqueur neurochimique souhaité est connu, la coloration pour une protéine / peptide peut être réalisée simultanément avec biocytin coloration (étapes 02.02 à 02.04). Si la coloration pour biocytin seulement, passez à l'étape 2.5. - EN OPTION: Bloc avec 10% de sérum de blocage (BS; sérum normal de chèvre (NGS) dilué dans 0,3% de Triton X-100 dans du PBS pendant 1 h à température ambiante).
NOTE: Chaque puits doitrecevoir le même volume de la solution; le volume recommandé est compris entre 250 - 500 pl / puits. La sélection du sérum de blocage est basée sur l'espèce dans laquelle les anticorps secondaires sont élevés (par exemple, l' END est utilisé pour la teinture de chèvre conjugué anti - (espèces d'anticorps primaires respectives)). Si le besoin se fait sentir d'utiliser des anticorps secondaires posées dans différentes espèces immunocoloration sections, comprennent 10% de chaque sérum normal dans le blocage de l'étape (2) et 3% de chaque sérum normal pour les étapes primaires et secondaires anticorps incubation. - ( EN OPTION) Incuber les sections en anticorps primaire, CB 1 R (polyclonaux, cochon Guinée) avec 0,3% de Triton X-100, et 3% BS en PBS 0,1 M à TA O / N. CB R 1 est utilisé pour identifier une expression de type récepteur cannabinoïde.
REMARQUE: Cette étape est facultative et non obligatoire pour révéler le remplissage biocytin. La figure 2 illustre une section marquée pour biocytine et CB 1 R au cours du premier processus de coloration. O / N incubation à la température ambiante est suffisante pour la plupart des anticorps primaires; cependant, certains anticorps primaires, y compris CB 1 R, nécessitent 3-5 jours d'incubation. Si l'incubation doit être supérieure à 1 d, il est recommandé de laisser incuber à 4 ° C, parce que le Triton X-100 peut perméabiliser les tranches et peut conduire à la désagrégation du tissu pendant une incubation prolongée à la température ambiante. Inclure un contrôle négatif manquant anticorps primaire dans au moins une section pour chaque série d'expériences en tant que contrôle de la spécificité de l'anticorps secondaire. Pour les contrôles négatifs, l'anticorps primaire est omis, mais le Triton X-100 à 0,3% dans du PBS 0,1 M et BS sont ajoutés.
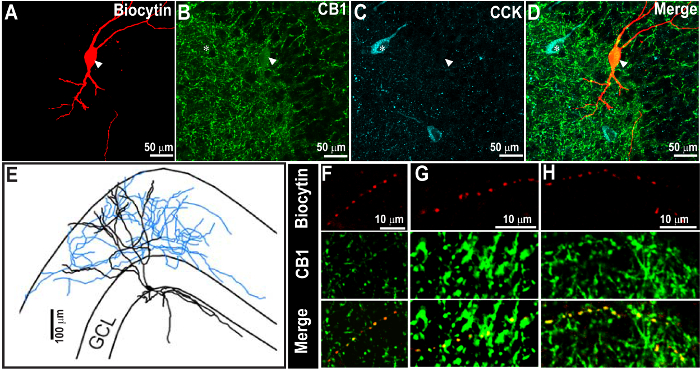
Figure 2. Succès CCK Coloration 1 semaine Après la récupération de biocytine Coloration et C annabinoid Receptor Type 1 (CB 1 R) - étiquetage. (A - C) des images confocales à 60X montrant le neurone biocytine rempli (A) et CB 1 R immunoréactivité (B), indiqué par la flèche. Le même article a été traité pour CCK immunocoloration après 1 semaine (C). La superposition des images est représenté dans D. CCK immunoréactivité a été révélé à l'aide rouge lointain et a été pseudo-colorée en cyan. (E) de reconstruction morphologique de la cellule remplie biocytine dans A. On notera que la biocytine et CB 1 R coloration sont visibles même après la deuxième immunocoloration CCK. A noter également la distribution attendue de CB 1 R et les modèles de immunocoloration CCK. (F - H) image grossie de l'axone de la cellule, comme dans Un spectacle proche co-localisation de biocytin et CB 1 R dans les axones (têtes de flèches). Barre d' échelle: 50 um (A - D), 100 um (E), et 10 um ( F - H). Les images sont reproduites à partir Yu et al. 2015 9. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
(Jour 2)
- Laver le cerveau des sections 3x pendant 10 minutes chacun dans du PBS 0,1 M (pH = 7,4).
- Incuber les sections dans de la streptavidine conjuguée à un colorant rouge (concentration: 1: 1000, excitation: 594 nm avec une émission dans le rouge visible), avec 0,3% de Triton X-100 et 3% de BS en PBS 0,1 M à 4 ° CO / N, dans la foncé (enveloppé dans une feuille d'aluminium) pour révéler le biocytin. OPTION: Inclure un anticorps secondaire de chèvre anti-cochon Guinée (concentration: 1: 500; excitation: 488 nm et une émission en vert), avec l'incubation ci-dessus si la suite de l'incubation primaire facultative à l'étape 2.3.
NOTE: L'anticorps secondaire sera nécessaire que si la coloration de l'anticorps primaire en option (étape 2.3) est effectuée. Pour visualiser biocytin, un streconjugué ptavidin-fluorophore avec un spectre d'émission en rouge est recommandé, car il permet de visualiser les axones plus fines en détail et avec un meilleur contraste (figures 1 - 3). Lors immunocoloration double ou triple, afin d'éviter une réactivité croisée d'anticorps secondaires les uns aux autres, ajouter des anticorps secondaires, l'un après l'autre d'une manière sérielle (2 h d'intervalle entre les additions en série de l'anticorps est suffisant). La figure 3A illustre une cellule biocytin remplie traitées sans la coloration d'anticorps primaire optionnelle et imagé avant la résection.
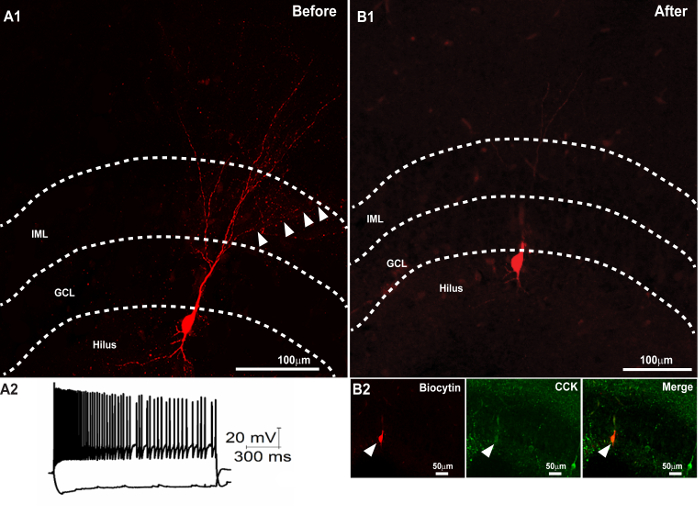
Figure 3. Deuxième immunocoloration réussie après la récupération de biocytine Morphologie et résection. (A1) l' image confocale d'une tranche de 300 um montrant la récupération de la morphologie dendritique d'une cellule biocytin remplie. ( A2) des traces de tension de membrane du neurone en réponse à +500 et -100 injections de courant de l' AP. (B) La récupération du soma biocytin rempli dans une section de 50 um obtenue après résection de la section (en A1) 300 um après le montage et l' imagerie. (B2) immunocoloration ultérieure de la section mince a révélé colocalisation du soma biocytin rempli ( à droite) avec CCK (panneau du milieu). L'image fusionnée est illustrée dans le panneau de droite. Barre d'échelle: 50 um. Panneau A2 est reproduit avec la permission de Yu et al. , Dans la presse 25. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
(Jour 3)
- coupes de cerveau lavage 3x pendant 10 minutes chacun dans du PBS 0,1 M (pH = 7,4).
- Pour protéger la fluorescence et de faciliter re-coloration à l'avenir, monter le sections dans un milieu de montage à base aqueuse et sceller les bords de la lamelle avec du vernis à ongles transparent.
NOTE: Il est préférable de recolorer sections le plus tôt possible pour éviter des difficultés à enlever le vernis à ongles de la diapositive, moisissures, et la déshydratation des tissus en raison d'une fuite du milieu de montage de la lame de verre. la contamination microbienne peut être évité en utilisant l'azoture de sodium à 0,02% dans du PBS.
ATTENTION: L' azoture de sodium est très toxique et inflammable lorsqu'il est en contact avec l' eau. S'il vous plaît se référer aux procédures d'exploitation standard pour le traitement et l'élimination des produits chimiques dangereux.
(Jours 4 - 7) - Effectuer l' imagerie confocale avec une excitation à 594 et 488 nm et à un grossissement de 20X ou 40X pour révéler les neurones biocytin remplis dans les marqueurs rouges et neurochimiques (CB 1 R) en vert. Évaluer co - marquage (Figure 2).
- Réglez l'exposition de l'appareil à moins de 100 ms pour éviter photoblanchiment et bénéficier du droitdans des piles d'images confocale des tonnelles axonales et dendritiques de l'ensemble du neurone. Utilisez confocale piles d'images et de progiciels de neurones de traçage pour reconstruire la morphologie neuronale.
3. La coloration du deuxième anticorps primaire
REMARQUE: Alors que la deuxième étape immunocoloration peut être effectué 90 jours après la première coloration, coloration optimale est obtenue si la seconde coloration d'anticorps primaire est effectuée dans 7-10 d.
(Après 7-90 d)
- Appliquer l'acétone pour un coton-tige et dénuder le vernis à ongles hors de la lame de verre.
- Enlever les lamelles soigneusement en utilisant une pince à pointe fine et de mettre quelques gouttes de 0,1 M PBS sur les sections.
- Retirez délicatement les sections de la diapositive à l' aide d' un pinceau fin et lavez - les dans 0,1 M PBS pendant 24 - 48 h sur un agitateur recouvert de papier d'aluminium en basse lumière à 4 o C.
NOTE: Il est essentiel de couvrir les sections avec unune feuille de luminum pour éviter photoblanchiment. - Pour assurer le retrait complet du support de montage, les sections de lavage 1 - 2x le jour suivant dans 0,1 M de PBS pendant 10 minutes à chaque fois.
- Procéder à une incubation dans le deuxième anticorps primaire (par exemple, la cholécystokinine, un neuropeptide trouvé dans certains interneurones GABAergiques (CCK; concentration: 1: 1000; anticorps monoclonal de souris)) pour 1 d (figure 2).
NOTE: Cette procédure est similaire à l'étape 2.3, mais utilise un anticorps différent. En outre, l'étape de blocage est omis lors de re-coloration. - Laver les coupes de cerveau trois fois pendant 10 minutes chacun dans du PBS 0,1 M (pH = 7,4).
- Colorer avec la chèvre d'anticorps secondaire anti-souris fluorophore conjugué (concentration: 1: 500; excitation longueur d'onde: 647 nm), en veillant à ce que les spectres d'excitation-émission de l'anticorps secondaire ne se chevauchent pas avec de la streptavidine (concentration: 1: 1000; excitation longueur d'onde: 594 nm) et immunofluorescence avanttaches.
- Monter les sections dans un milieu de montage aqueux et sceller les bords de la lamelle avec du vernis à ongles transparent.
REMARQUE: Conservez les sections à 4 ° C dans une boîte de stockage opaque pour protéger la fluorescence.
Résultats
En cas de réussite, les sections conservent le remplissage et la biocytine immunomarquage effectué à l'étape 2 et peuvent être imagés en utilisant confocale ou par microscopie à épifluorescence. En outre, les sections traitées montrent également une immunocoloration pour l'antigène marqué au cours du traitement ultérieur dans l' étape 3. Dans la section illustrée à la figure 2, la morphologie d'un neurone biocytine rempli dans une section ...
Discussion
Étapes critiques dans le Protocole
Remplir la cellule patché avec biocytin est l'étape la plus cruciale pour assurer la récupération complète de la morphologie. Pour la récupération complète de la cellule, il est essentiel de choisir une orientation de tranche optimale pour minimiser la rupture des processus pendant le tranchage. Cette orientation peut varier en fonction du circuit et de type de cellule en cours d'examen. Ensuite, il est essentiel de prévoi...
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
Les auteurs tiennent à remercier le soutien du NIH / NINDS R01 NS069861 et NJCBIR CBIR14IRG024 à VS.
matériels
| Name | Company | Catalog Number | Comments |
| NaCl | Sigma | S7653 | Immunostaining |
| KCl | Fluka | 60129 | Immunostaining |
| Na2HPO4 | Sigma | S7907 | Immunostaining |
| KH2PO4 | Sigma | 229806 | Immunostaining |
| Triton X-100 | Sigma | T8787 | Immunostaining |
| Guinea pig anti CB1 | Sigma | Af530-1 | Immunostaining |
| Mouse anti CCK | CURE, UCLA | courtesy of G. Ohning | Immunostaining |
| Rabbit anti Parvalbumin | Swant | PV27 | Immunostaining |
| Streptavidin, Alexa Fluor conjugate | Molecular Probes | S11227 | Immunostaining |
| Normal goat serum (NGS) | Sigma | G9023 | Immunostaining |
| Vectashield | Vector Labs | H-1000 | Immunostaining |
| Secondary Antibodies | Invitogen Molecular probes | Alexa Fluor conjugated dyes | Immunostaining |
| Labnet orbit low speed shaker | Bioexpress | S-2030-LS | Immunostaining |
| Forceps | Dumont | 11231-30 | Immunostaining |
| Slide folders | EMS | 71520 | Immunostaining |
| Vibratome VT 1200 S | Leica | 14048142066 | Electrophysiology |
| Multiclamp 700B amplifier | Molecular devices | Multiclamp 700B | Electrophysiology |
| pCLAMP 10 Software | Molecular devices | pCLAMP 10 | Electrophysiology |
| Digitizer | Molecular Devices | Digidata 1440 digitizer | Electrophysiology |
| Filter tips | Nalgene | 171-0020 | Electrophysiology |
| Sonicator | Fisher Scientific | 15-335-100 | Electrophysiology |
| Microloaders | Eppendorf | 930001007 | Electrophysiology |
| Biocytin | Sigma | B4261 | Electrophysiology |
Références
- Garcia-Lopez, P., Garcia-Marin, V., Freire, M. The histological slides and drawings of cajal. Front Neuroanat. 4, 9 (2010).
- Klausberger, T., Somogyi, P. Neuronal diversity and temporal dynamics: the unity of hippocampal circuit operations. Science. 321 (5885), 53-57 (2008).
- Petilla Interneuron Nomenclature, G., et al. Petilla terminology: nomenclature of features of GABAergic interneurons of the cerebral cortex. Nat Rev Neurosci. 9 (7), 557-568 (2008).
- Armstrong, C., Soltesz, I. Basket cell dichotomy in microcircuit function. J Physiol. 590 (4), 683-694 (2012).
- Povysheva, N. V., Zaitsev, A. V., Gonzalez-Burgos, G., Lewis, D. A. Electrophysiological heterogeneity of fast-spiking interneurons: chandelier versus basket cells. PLoS One. 8 (8), e70553 (2013).
- Gupta, A., Elgammal, F. S., Proddutur, A., Shah, S., Santhakumar, V. Decrease in tonic inhibition contributes to increase in dentate semilunar granule cell excitability after brain injury. J Neurosci. 32 (7), 2523-2537 (2012).
- Fish, K. N., Hoftman, G. D., Sheikh, W., Kitchens, M., Lewis, D. A. Parvalbumin-containing chandelier and basket cell boutons have distinctive modes of maturation in monkey prefrontal cortex. J Neurosci. 33 (19), 8352-8358 (2013).
- Yu, J., Swietek, B., Proddutur, A., Santhakumar, V. Dentate cannabinoid-sensitive interneurons undergo unique and selective strengthening of mutual synaptic inhibition in experimental epilepsy. Neurobiol Dis. 89, 23-35 (2016).
- Yu, J., Swietek, B., Proddutur, A., Santhakumar, V. Dentate total molecular layer interneurons mediate cannabinoid-sensitive inhibition. Hippocampus. 25 (8), 884-889 (2015).
- Varga, C., et al. Functional fission of parvalbumin interneuron classes during fast network events. Elife. 3, (2014).
- Kawashima, T., Okuno, H., Bito, H. A new era for functional labeling of neurons: activity-dependent promoters have come of age. Neural Circuits Revealed. , 109 (2015).
- Krook-Magnuson, E., Luu, L., Lee, S. H., Varga, C., Soltesz, I. Ivy and neurogliaform interneurons are a major target of mu-opioid receptor modulation. J Neurosci. 31 (42), 14861-14870 (2011).
- Szabadics, J., Soltesz, I. Functional specificity of mossy fiber innervation of GABAergic cells in the hippocampus. J Neurosci. 29 (13), 4239-4251 (2009).
- Iball, J., Ali, A. B. Endocannabinoid Release Modulates Electrical Coupling between CCK Cells Connected via Chemical and Electrical Synapses in CA1. Front Neural Circuits. 5, 17 (2011).
- Chen, X., Cho, D. -. B., Yang, P. -. C. Double staining immunohistochemistry. N Am J Med Sci. 2 (5), 241-245 (2010).
- Ranjan, A. K., et al. Cellular detection of multiple antigens at single cell resolution using antibodies generated from the same species. Journal of immunological. 379 (1), 42-47 (2012).
- Fuccillo, D. A., Sever, J. L. . Concepts in Viral Pathogenesis II. , 324-330 (1986).
- Buchwalow, I. B., Minin, E. A., Boecker, W. A multicolor fluorescence immunostaining technique for simultaneous antigen targeting. Acta Histochem. 107 (2), 143-148 (2005).
- Qi, G., Radnikow, G., Feldmeyer, D. Electrophysiological and morphological characterization of neuronal microcircuits in acute brain slices using paired patch-clamp recordings. JoVE (Journal of Visualized Experiments. (95), e52358 (2015).
- Walz, W. . Patch-clamp analysis : advanced techniques. 2nd edn. , (2007).
- Molnar, P. . Patch-clamp methods and protocols. 403, (2007).
- Martina, M., Taverna, S. . Patch-clamp methods and protocols. , (2014).
- Booker, S. A., Song, J., Vida, I. Whole-cell patch-clamp recordings from morphologically- and neurochemically-identified hippocampal interneurons). J Vis Exp. (91), e51706 (2014).
- Jinno, S., Kosaka, T. Immunocytochemical characterization of hippocamposeptal projecting GABAergic nonprincipal neurons in the mouse brain: a retrograde labeling study. Brain research. 945 (2), 219-231 (2002).
- Yu, J., Proddutur, A., Swietek, B., Elgammal, F. S., Santhakumar, V. Functional Reduction in Cannabinoid-Sensitive Heterotypic Inhibition of Dentate Basket Cells in Epilepsy: Impact on Network Rhythms. Cereb Cortex. , (2015).
- Proddutur, A., Yu, J., Elgammal, F. S., Santhakumar, V. Seizure-induced alterations in fast-spiking basket cell GABA currents modulate frequency and coherence of gamma oscillation in network simulations. Chaos. 23 (4), 046109 (2013).
- Scharfman, H. E. Differentiation of rat dentate neurons by morphology and electrophysiology in hippocampal slices: granule cells, spiny hilar cells and aspiny 'fast-spiking' cells. Epilepsy Res Suppl. 7, 93-109 (1992).
- Tasker, J. G., Hoffman, N. W., Dudek, F. E. Comparison of three intracellular markers for combined electrophysiological, morphological and immunohistochemical analyses. J Neurosci Methods. 38 (2-3), 129-143 (1991).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon