JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
신경 화학적 마커에 대한 Biocytin 충전 및 가공 섹션의 면역 염색
요약
이 프로토콜은 biocytin 충전 및 후속 면역 후 처리를 사용하여 전기 생리 녹음하는 동안 패치 신경 세포의 형태 학적 복구를위한 방법을 제시한다. 우리는 염색 coverslipped 된 두꺼운 biocytin 채워진 부분은 나중에 두 번째 차 항체 일 개월 restained 될 수 있음을 보여줍니다.
초록
패치 클램프 기술을 이용하여 세포의 전기 생리 학적 기록 소성 패턴에 따라 다른 유형의 연결의 식별을 허용했다. 기록 전극의 biocytin / neurobiotin의 포함은 수지상 arborization 및 기록 된 신경 세포의 축삭의 대상 지역을 결정하는 데 필요한 형태 세부 사항의 사후 복구를 허용합니다. 그러나, 별개의 신경 화학적 정체성과 기능, 세포 형 특정 단백질에 대한 면역 조직 화학 염색과 형태 학적으로 유사한 신경 세포의 존재 주어진 결정적으로 신경 세포를 식별하는 데 필수적이다. 네트워크 연결성을 유지하기 위해, 기록 용 생리 뇌 절편을 300㎛ 이상의 두께로 제조된다. 그러나,이 두께는 종종 조직의 resectioning을 필요로 인해 항체 침투 문제에 면역 조직 후 처리를 방해한다. 조각의 Resectioning 종종 있습니다 END_STRONG_1, 도전적인 예술이다조직 및 세포 형태의 손실이 팅되는 전기 생리 데이터를 사용할 수 없게 된 데이터를 렌더링을 얻었다. 신경 마커의 선택에서의 데이터 손실과 가이드를 제한 할 형태의 복구 이후, 우리는 보조 면역이어서 제 1 셀 형태를 회수하는 전략을 채택 하였다. 우리는 생리 녹음 및 신경 화학적 정체성을 결정하는 섹션의 restaining 다음 형태의 회복에 대한 후속 직렬 면역 염색 동안 충전 biocytin하는 실용적인 접근 방식을 소개합니다. 우리는 (PFA) 파라 포름 알데히드로 고정 스테인드 및 coverslipped biocytin으로 가득 차 있었다 섹션을 제거하고 나중에 두 번째 차 항체 일에 restained 될 수 있음을보고한다. 이 restaining은 커버 슬립을 제거, 완충액 섹션 세정 및 신경 화학적 신원을 공개하는 일차 및 이차 항체의 배양을 수반한다. 상기 방법은 DAT를 제거하는 것이 유리하다형태를 복구 할 수 없기 때문 및 신경 화학적 마커를 좁혀에 대한 손실은 형태에 따라 시험한다.
서문
뇌는 개별의 연결 요소의 구조적 및 기능적 특성의 다양성 알려져있다. 뇌 기능과 병리에 뚜렷한 신경 세포 유형의 역할을 이해하는 것은 특성화 및 신경 세포의 명확한 식별이 필요합니다. 축삭 arborization의 패턴이 잠재적 인 시냅스 대상을 식별하는 동안 구조적으로, somato-수지상 위치에 의해 정의 된 형태 학적 특징은, 특정 신경 세포가받는 잠재적 입력을 결정합니다. 신경 세포의 구조적 다양성은 라몬 Y Cajal의 정액 조직 학적 연구 1 일부터 평가되고있다. 단일 셀에 기록하는 기술의 출현은 구조적으로 구별되는 신경 또한 소성 패턴 및 시냅스 특성의 차이를 보여주는 것으로 나타났다. 구조와 생리의 다양성은 GABA 성 억제 신경 2,3에 특히 분명하다. 또한, structurall 것이 점차 명백되었다Y 유사한 신경 기능의 차이 4 해당하는 다른 신경 화학적 마커와 쇼를 표현할 수 있습니다. 마찬가지로, 동일한 신경 화학적 마커 뉴런은 별개의 구조와 기능 5-10을 가질 수 있습니다. 따라서, 실제로, 네트워크 내의 뉴런의 기능적 특성 분석 및 그들의 역할은 두 형태 학적 및 신경 화학적 ID를 정의 수반한다. 비록 특정 신경 화학적 마커 타겟팅 리포터 마우스 라인의 출현으로는 면역 조직학 (11)에 기초하여 형태 및 하위 유형 식별을 결정하는 것이 필요하다.
급성 뇌 조각에 기록 된 세포의 특성을하는 데 사용되는 표준 방법은 녹화 중에 biocytin 또는 neurobiotin로 채우기 녹음 다음 파라 포름 알데히드의 섹션 (PFA)를 해결하고, 형태 및 신경 화학을 나타 내기 위해 면역 조직 화학 염색을 사용하는 것입니다. 슬라이스 생리학에 대한 부분의 두께 때문에 300 μm의는 전형적으로대부분의 항체는 그 깊이 끝까지 관통하지 이상, 때문에 또는, 조각 및 신경 화학적 biocytin 마커 12-14 동시 면역 있도록 60 ㎛ 이하로 다시 구분 될 필요가있다. 불행하게도, resectioning는 힘든이다 절편 동안 조직의 손실 위험; 및 형태 학적 재구성을 복잡하게, 조직의 수축을 차동으로 이어질 수 있습니다. 또한, 형태에 대한 사전 지식은 세포에 의해 표현 될 가능성이 후보 마커를 좁힐 수 있습니다. 우리는 첫 번째 형태의 복구를 위해 다음 잠재적 인 신경 화학적 마커의 식별 섹션의 시리얼 처리 할 수 있도록 표준 biocytin 면역 조직학 프로토콜을 수정했습니다.
면역 조직은 조직 또는 세포 항원 분포 연구이며, 효소, 형광 라벨, 방사성 원소, 금 콜로이드 입자 (15)를 이용하여 가시화 될 수있다. 프로 시저 전특히 시각화 차 항체를 표적 형광 이차 항체를 이용하여 다음에 하나 이상의 특정 항원 태그와 증폭 차 항체를 사용하여 nvolves. 오버랩없이 각각의 이차 항체의 형광 스펙트럼을 구별 할 필요성으로 인해, 항원의 제한된 수를 동시에 검사 할 수있다. 따라서, 형태의 사전 지식은 세포 분류에 대한 후보 신경 화학적 마커를 선택하는데 도움이 될 수 있습니다. 개념적으로, 이미 묻은 부분의 직렬 처리 뒤에 이론적 근거는 하나의 단백질 또는 펩티드에 대한 immunolabeling하는 것은 구조적으로 독립적 인 펩티드 (16)에 대한 항원 및 후속 immunolabeling을 방해해서는 안 전제에 기초한다. 간섭의 결여는 항원의 특정 단백질 에피토프에 대한 항체의 결합에 기인하고, 따라서 동일한 조직에서 여러 항원의 동시 염색을 허용한다. 항원의 수 reveale면역 염색에 의한 D는 형광 이차 항체의 비 중첩 스펙트럼에 대한 필요성에 의해 교차 - 반응성 (17, 18)을 제거하기 위해 다른 종에서 발생하는 개별 항체 항원을 표적 할 필요성에 의해 제한된다. 이 마운트 부에 하나 이상의 항원 immunolabeling 완료 후보고되지 않은 초 항원에 대한 면역 염색, 우리의 지식에 상호 작용할 수있는 두 가지 항체 직렬 아닌 동시 라벨 뒤에 추론된다. 여기서는 미리 염색 장착 섹션 직렬 면역 염색하는 방법을 설명한다. 우리가 상세히 두꺼운 부분 단백질 / 펩티드 마커 염색 하였다 형태의 복구를위한 직렬 immunolabeling 과정이 공정 동안 동일한 절차가 얇은 부분뿐만 아니라 조직 학적 기준에 사용될 수있다. 또한, 우리는 biocytin하고을 제거하는 공정에 기록 된 뉴런을 채우기 위해 실용적인 접근 방식을 설명최근 우리의 작업 6,8-에서 제시된 바와 같이 기록이 완료되면 전지에서 전극의 축색 뉴런의 수지상 아버의 충전을 최적화한다.
여기에 기재된 절차의 가장 중요한 장점은, 기록 셀의 형태가 완전히 회수 절제술 또는 슬라이스 발현 사이 전에 이미징 될 수 있다는 것이다. 특정 항체의 침투에 문제가 차 면역을위한 절제 슬라이스가 필요 없게 될 수도 있지만, 여기에 설명 된 절차는 여러 부분에서 복잡한 뉴런을 재구성 할 필요를 제거 할 재건을 손상 할 수있는 조직의 감량 및 차등 수축으로 인한 문제를 방지 할 resectioning를 다음과 같습니다. 추가 장점은 공정이 면역 및 biocytin 채워진 뉴런 회수되는 슬라이스 재 절편을 제한함으로써 비용, 시간, 노력 및 비용이 항체를 줄일 수 있다는 것이다. 가장 실용적인 목적은 광고입니다전술 한 기술을 사용하여 이전 섹션 염색 개월에 수행 될 수 ditional 면역. 특히, 형태의 회복이 현저하게 세포로부터 생리적 데이터 인해 셀 타입의 기본적인 형태 학적 특성을 얻을 수 없기으로 폐기되도록 전위를 감소시킨다.
프로토콜
전기 생리학 중 1 Biocytin 필링
참고 : 독자가 여기에 정교하지 않는 기본적인 패치 클램프 녹음 기술과 계측 19-22, 대체 소스를 참조 할 수 있습니다. 여기에 설명 된 단계는 패치 클램프 녹음 용 장비 및 절차가 이미 설치되어 있다고 가정하고 설명을 biocytin-작성하고 사후 면역 염색 관련 세부 사항에 제한됩니다. 이 원고에 설명 된 모든 실험 쥐에서 수행되었다.
- 350 μm의 23 - vibratome를 사용하여, (300)의 두께로 원하는 영역의 실제 뇌 섹션을 준비한다.
- 내부 솔루션 (6) 1 ㎖에 biocytin 2 mg을 추가하여 0.2 % biocytin을 포함하는 내부 솔루션을 준비합니다. biocytin이 완전히 용해 될 때까지 15 분 - 최상의 결과를 얻으려면, 10 내부 용액을 초음파 처리. 다음에, 0.2가 장착 된 1 mL의 주사기의 내부 용액로드# 160; μm의 기공 크기의 폴리 프로필렌 필터 팁은 microloader에 연결합니다. 내부 용액에서의 Mg-ATP와 나-GTP의 안정성을 유지하기 위해 차가운 팩이 로딩 주사기를 유지합니다.
참고 : 내부 솔루션을 포함하는 칼륨 글루코 네이트는 (126 mM의 K-글루코 네이트, 4 밀리미터의 KCl, 10 mM의 HEPES, 4 mM의 마그네슘 - ATP, 0.3 밀리미터 나-GTP, 10 MM의 크레아틴 인산), 특정 신경 화학적 지표의 회복에 최적입니다 immunolabeling 동안 parvalbumin 등. 우리의 경험에 의하면, cesium- 및 염화 기반 내부 솔루션을 사용하여 특정 신경 화학적 마커에 대한 면역 염색 복구 할 수있는 능력을 감소시킨다. Neurobiotin 또는 biocytin와 함께 알렉사 형광을 결합 세포 impermeant, 정착, 극성 추적은 biocytin에 대한 대안으로 사용할 수 있습니다. - 적외선 미분 간섭 대비에서 기록에 대한 적절한 셀을 시각화. 축삭의 중단을 최소화하기 위해, "접근"F를 사용하여 그 축에 피펫을 낮춤으로써 전지 본체에 접근대부분의 미세 조작기에서 사용할 수있는 기름 부음. 패치 클램프 생리학 프로토콜 19-22를 사용하여 적외선 미분 간섭 대비에서 전체 셀 녹음을 설정합니다.
참고 :이 절단 끝 (그림 1의 녹색 화살표)에서 여과포로 시각화 축삭을 절단 바와 같이, 추정 축삭의 방향에서 셀에 접근하지 마십시오. 또한, 높은 배경 염색 발생합니다 biocytin의 유출을 최소화하기 위해 세포에 접근하면서 기록 피펫으로 높은 긍정적 인 압력을 가하지 마십시오.
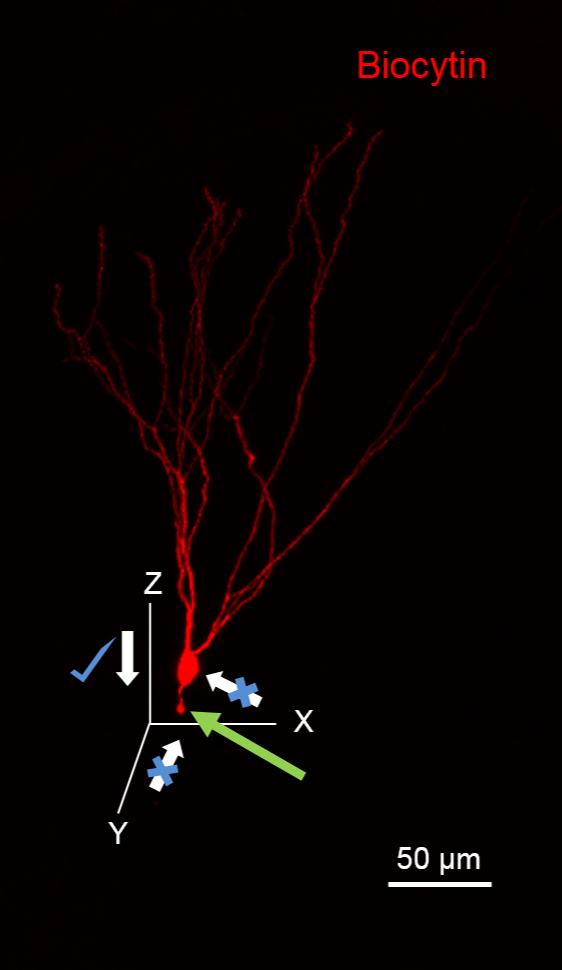
그림 1. Biocytin 채우기 위해 세포 접근을 위해 비행기를 제안했다. 이미지는 (594 - 복합 스트렙 타비 딘을 사용하여 빨간색)는 과립 세포 (GC) biocytin를 공개 처리 된 녹화 중 biocytin 채우기를 보여줍니다. GC는 XY 평면 배향의 돌기를 갖는다. 절단 된 과립 세포를 주목하라축삭 인해 XY 평면을 따라 피펫 운동 (녹색 화살표). 이 XZ 평면을 따라이 신경 세포에 접근하는 적합합니다. 스케일 바 : 50 μm의.
- 전압 클램프 구성에서, 작은 (5 MV)에 응답하여 전체 전지 용량과 직렬 저항, 짧은 (30 밀리 초)의 전압을 결정하는이 전기 생리학 데이터 획득 및 분석 소프트웨어 목욕 모드 멤브레인 시험 기능을 이용하여 단계. 이것은 biocytin 필링 있도록 전체 셀 기록 조건의 설정을 보장한다.
- 필요에 따라 하나 전류 또는 전압 클램프 모드에서 생리 녹음을 실시한다. 34 ° C에서> 10 분의 최소 촬영 시간은 이상적이다.
주 : 긴 기록 시간은 상온에서의 연구를 위해 필요할 수있다. - 생리 녹화 종료 후 천천히 (Z 축을 따라) 상방 교번 작은 단계에서의 기록 피펫 이동하여 패치 - 클램프 구성을 재 수립외부 전압 클램프 모드 (x 축을 따라).
- 동시에, 셀의 재 밀봉 및 외기 OUT-의 확립을 나타내는 용량 과도 손실 직선 현재 응답의 붕괴를 시각화하기 위해 "막 시험"기능을 사용 용량과, 입력 저항을 모니터링 피펫 팁에 패치. 탈 분극 전위 (-40 MV)에서 셀을 잡고 다시 밀봉 과정을 촉진 할 것이다.
주 : 세포의 제거를위한이 절차는 일반적 소마와 돌기의 완전한 복구를 보장한다. 이 절차를 수행하는 동안 또는 피펫에서 세포를 분리하는 동안 기록 피펫에 긍정적 인 압력을 가하지 마십시오. 슬라이스에 기록 된 셀의 소마의 시각화에 성공 해제를 나타냅니다. 세포 파편 또는 분리 팁 끝에 막 패치의 존재는 일반적 소마의 전위를 나타내며, 전체 세포 형태를 얻을 수 없다. - 선미말단 축색 돌기 및 프로세스 염료의 전송을 위해 5 분 - 세포로부터 피펫을 분리 ER, 3 기록 챔버 내의 슬라이스를 유지한다.
- 고정 용 4 % PFA를 포함하는 24 웰 플레이트에 슬라이스 전송.
주의 : PFA는 발암 성, 장갑과 얼굴에 마스크를 포함하여 적절한 개인 보호 장비이며, 피부 자극과 흡입을 방지하기 위해 사용되어야합니다. PFA는 가연성 및 화재의 손이 닿지 않는 곳에 보관해야합니다. PFA는 드레인에서의 배치되지 않습니다 및 화학 폐기물로 수집해야합니다. PFA 고정이 전달 피펫을 포함하는 생리 설정의 오염을 피하기 위해 실제 슬라이스 제조에 이용되는 영역으로부터 격리되어야한다. - 24-48 시간 PFA 고정 후 면역 염색 전에 스토리지 0.1 M 인산 완충 식염수 (PBS)로 슬라이스 옮긴다.
참고 : 이상적으로, 복구 및 면역 biocytin 염색 당했지만, 곧 고정 후 수행되는 가장 좋은 때 고정 금리 좋은 결과를 7 일 이내 내에 형성. 정착 후 90 일까지 동안 수행 염색 0.05 % 아 지드 화 나트륨 - 조각 0.02 PBS로 유지 될 수있다. PFA 하룻밤 고정 항체가 가장 잘 작동하지만,이 정착액의 배양 기간이 감소 될 때 어떤 항체는 가장 적합한 것이 가능하다. 48 이상의 시간 동안 PFA의 고정은 항원의 가용성을 감소시키고 신경 화학적 마커 성공 차 면역 염색의 기회를 감소.
주의 : 나트륨 아 지드은 매우 위험하고 섭취 또는 흡입 피부 나 눈 또는시 접촉시 자극이다. 심한 과다 노출은 사망을 초래할 수 있습니다. 화합물의 발암 성 및 돌연변이는 알려져 있지 않다. 장갑, 고글, 실험실 코트, 그리고 먼지가 호흡기를 포함하여 적절한 개인 보호 장비를 사용합니다. 아 지드 화 나트륨은 드레인에서의 배치되지 않습니다 및 화학 폐기물로 수집해야합니다.
(주 1)
참고 : 다음 면역 염색 절차는 무료 부동 섹션위한 모든 배양 단계 쉐이커에 저속 (2 회전 / 분, RPM) 진탕 연속이 필요합니다.
- 0.1 M PBS (PH = 7.4)에서 10 분 각각에 대한 조직의 3 배를 씻으십시오.
참고 : 염화나트륨 8 g, KCl을 0.2 g, 나 2 HPO 4 1.44 g, 및 KH 2의 0.24 g PO 4 1에서 다음과 같이 0.1 M PBS 상업적 실험실에서 구입하거나 할 수있다 (1 L한다) DH 2 0 L.
주의 : 원하는 신경 화학적 마커가 알려진 경우 단백질 염색 / 펩티드 biocytin 염색과 동시에 행할 수있다 (단계 2.2 - 2.4). 만 biocytin에 대한 염색 경우 2.5 단계로 진행합니다. - OPTIONAL : 10 % 혈청으로 차단 블록 (BS를, RT에서 1 시간 동안 PBS에서 0.3 % 트리톤 X-100으로 희석 된 정상 염소 혈청 (NGS)).
주 : 각 잘한다용액의 동일한 용적을 수신하고; / 잘 500 μL - 권장 용량은 250 사이입니다. 블로킹 혈청의 선택 2 차 항체 (예를 들면, 염료는 NGS 접합 염소 항 - (각 일차 항체 종)에 사용된다) 발생되는 종에 기초한다. 필요성 섹션 발현 사이 위해 다른 종에서 발생하는 이차 항체를 사용하여 발생하는 경우, 단계 (2)를 차단 각 정상 혈청의 10 % 및 일차 및 이차 항체 인큐베이션 단계는 각각 정상 혈청의 3 %를 포함한다. - (선택 사항) 차 항체의 섹션을 품어, RT O / N에서 0.1 M PBS에서 0.3 % 트리톤 X-100, 3 % BS와 CB (1) R (폴리 클로 날, 기니피그). CB (1) R은 칸 나비 노이드 수용체 타입 1 식을 식별하는 데 사용됩니다.
참고 :이 단계는 선택 사항이며, biocytin 충전을 공개 할 필요가 없습니다. 도 2는 제 염색 과정 biocytin 1 및 CB R 표지 단면을 도시한다. O / N의 인큐RT에서 bation는 기본 항체의 대부분 충분하다; 배양의 5 D - 그러나, CB (1) R을 포함하여 특정 차 항체는, 3이 필요합니다. 배양이 이상 1 라 할 필요가있는 경우,이 트리톤 X-100 조각을 Permeabilize 하시려면 수 있으며, 상온에서 장기간 배양하는 동안 조직의 붕괴로 이어질 수 있기 때문에 4 ℃에서 배양하는 것이 좋습니다. 이차 항체의 특이성에 대한 제어와 같은 실험의 각 시리즈에 대한 하나 이상의 섹션에 차 항체가없는 음성 대조군을 포함합니다. 음성 대조군의 경우, 일차 항체는 생략하지만, 0.3 % 트리톤 0.1 M PBS에서 X-100 및 BS가 부가된다.
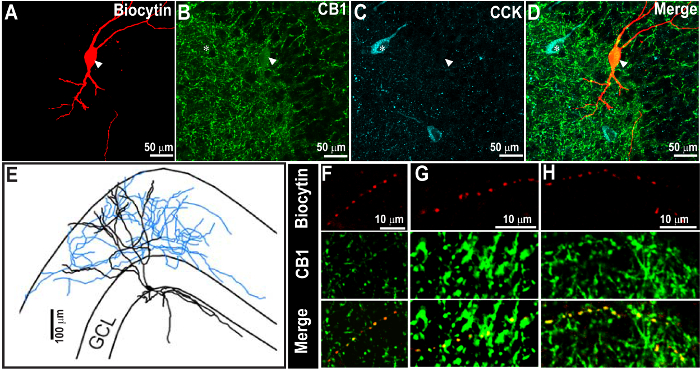
그림 2. 성공적인 CCK 염색 Biocytin 염색과 C의 복구 후 1 주이 수용체 1 형 (CB (1) R)를 annabinoid - <강한> 표지. (A - C)가 화살표로 나타낸 biocytin 채워진 신경 세포 (A) 및 CB 1 R 면역 (B)를 도시 60X에서 공 촛점 이미지. 동일한 섹션 일주 (C) 후 CCK 면역 염색을 위해 처리 하였다. 이미지의 오버레이 D에 도시된다. CCK 면역 반응은 원적외선 사용하여 밝혀졌다 시안에 의사 색깔했다. (E)를 biocytin 및 CB (1) R 염색도 두 번째 CCK의 면역 염색 후 분명 것을 A. 노트에서 biocytin 채워진 세포의 형태 학적 재구성. 또한 CB (1) R 및 CCK의 면역 염색 패턴의 예상 분포를 확인합니다. (F - H) A의 같은 세포의 축삭의 확대 이미지, biocytin의 쇼 긴밀한 협력 현지화 및 축삭의 CB (1) R (화살표 머리). 스케일 바 : 50 μm의 (A - D) 100 μm의 (E) 및 10 ㎛의 ( F - H). 이미지는 유 등의 알에서 재생된다. 2015 9. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
(주 2)
- 0.1 M PBS (PH = 7.4) 섹션 10 분 각각 3 배 뇌를 씻으십시오.
- 스트렙 타비 딘 빨간색 염료 복합체의 섹션을 품어 (농도 : 1 : 1,000, 여자 : 가시 붉은 스펙트럼에서 방출과 594 nm의)를 4 ° CO 0.1 M PBS에서 0.3 % 트리톤 X-100과 3 % BS와 / N 어두운 (알루미늄 호일에 싸서)을 biocytin을 표시합니다. 단계 2.3에서 옵션 차 배양을 다음과 같은 경우 위의 배양과 : (녹색에서 488 nm의 및 배출 여기 500 : 1의 농도) : 선택 사항 이차 항체, 염소 방지 기니 돼지를 포함합니다.
참고 : 차 항체는 선택 사양 차 항체 염색 (2.3 단계)을 수행하는 경우에만 필요합니다. 하는 헤어 구조 강화를 biocytin를 시각화하는 방법이 (- 3 그림 1) 상세하고 더 나은 콘트라스트 미세한 축삭을 시각화하는 데 도움으로 빨간색 발광 스펙트럼과 ptavidin - 형광 복합체 좋습니다. 이중 또는 삼중 면역 동안 서로 이차 항체의 교차 - 반응성을 방지하기 위해, 직렬 방식 (항체의 연속 첨가와 2 시간 간격이 충분하다)의 다른 한 후 이차 항체를 하나씩 추가한다. 도 3a는 선택 사양 차 항체 염색없이 처리 및 resectioning 이전 군데 biocytin 채워진 셀을 보여줍니다.
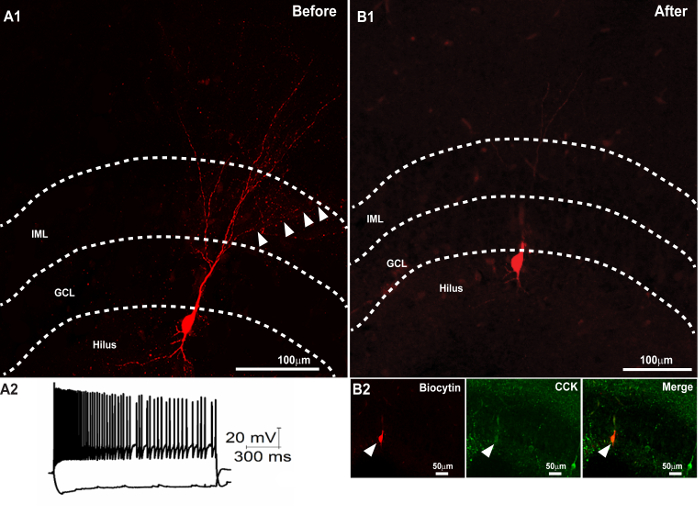
그림 3. Biocytin 형태와 Resectioning의 복구 다음과 같은 성공적인 두 번째로 면역 염색. biocytin 채워진 세포의 수지상 형태의 회복을 나타내는 300 μm의 슬라이스 (A1) 공 촛점 이미지입니다. (<500 -100는 pA 전류 주입에 응답하여 신경 세포의 강한> A2) 막 전압 추적. 설치 및 이미징 후 (A1)에 300 μm의 섹션을 resectioning 후의 50 μm의 섹션에서 biocytin 가득 소마의 (B) 복구. (B2) 얇은 부분의 후속 면역 염색은 CCK (중간 패널)와 biocytin 가득 소마 (오른쪽 패널)의 colocalization을 한 것으로 밝혀졌습니다. 병합 된 이미지가 오른쪽 패널에 도시되어있다. 스케일 바 : 50 μm의. 패널 A2는 유 등의 등의 허가 재생된다. 키를 눌러 이십오인치 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
(주 3)
- 세척 뇌 섹션 0.1 M PBS (PH = 7.4)에서 10 분마다 배.
- 형광을 보호하고 향후 재 염색을 용이하게하기 위해 상기 초 마운트수성 기반 장착 매체 TIONS 및 클리어 매니큐어와 커버 슬립의 가장자리를 밀봉.
참고 :이 때문에 유리 슬라이드에서 설치 매체의 누설 슬라이드, 곰팡이 감염, 조직의 탈수에서 매니큐어 제거에 어려움을 피하기 위해 가능한 한 빨리 섹션을 restain하는 것이 가장 좋습니다. 미생물 오염은 PBS에 0.02 % 소듐 아 지드를 사용하여 방지 될 수있다.
주의 : 물과 접촉하는 경우에 아 지드 화 나트륨은 매우 독성 및 인화성. 유해 화학 물질의 취급 및 폐기를위한 표준 운영 절차를 참조하십시오.
(일 4-7) - 594 및 488 nm에서 녹색에서 빨간색과 신경 화학적 마커 (CB (1) R)에 biocytin 가득 뉴런을 공개하는 20 배 또는 40 배의 배율로 여기에 촛점 이미징을 수행합니다. (그림 2) colabeling 평가합니다.
- 광표백과 obta을 피하기 위해 미만 100 밀리 카메라 노출 설정전체 신경 세포의 축삭과 수상 돌기 아버의 공 초점 이미지 스택입니다. 를 사용하여 공 초점 이미지 스택 및 신경 세포 추적 소프트웨어 패키지는 신경 세포의 형태를 재구성합니다.
두 번째 차 항체 3. 염색
주 : 제 면역 염색 단계는 상기 제 염색 후 90 D를 수행 할 수 있지만, 제 차 항체 염색 7 내에서 수행되는 경우, 최적의 염색이 달성 - 10 D.
(7 후 - 90 D)
- 면봉에 아세톤을 적용하고 유리 슬라이드의 오프 매니큐어를 제거.
- 좋은 팁 집게를 사용하여 조심스럽게 커버 슬립을 제거하고 섹션에 0.1 M PBS 몇 방울을 넣어.
- 조심스럽게 좋은 페인트 브러시를 사용하여 슬라이드에서 섹션을 제거하고 24 0.1 M PBS로 씻어 - 4 O C.에서 낮은 조명에서 알루미늄 호일에 덮여 통에 48 시간
참고 : 그것은으로 섹션을 충당하기 위해 매우 중요하다luminum 박 photobleaching에 방지 할 수 있습니다. - 10 분마다 0.1 M PBS에서 다음 날에 2 배 - 설치 매체의 완전한 제거를 보장하기 위해, 섹션 1을 씻는다.
- 두 번째 차 항체에 부화를 진행합니다 (예를 들어, 콜레시스토키닌, 특정 GABA 성에서의 interneurons (CCK에서 발견되는 신경 펩타이드; 농도 : 1 : 1000, 마우스 단일 클론 항체) 1) D (그림 2)에 대한.
참고 :이 절차는 2.3 단계와 비슷하지만 다른 항체를 사용합니다. 또한, 차단 단계를 재 염색 과정을 생략한다. - 0.1 M PBS (PH = 7.4)에서 10 분마다 뇌 부분을 세 번 씻으십시오.
- 형광 접합 된 이차 항체를 염소 항 - 마우스 얼룩 (농도 1 : 500; 여기 파장 : 647 ㎚) 이차 항체의 여기 발광 스펙트럼 스트렙 (농도와 중복되지 않는 것을 확인한 : 1 : 1000; 여기 파장 : 594 ㎚) 전에 면역얼룩.
- 수성 장착 매체의 섹션을 탑재하고 명확한 매니큐어로 커버 슬립의 가장자리를 밀봉.
참고 : 형광을 보호하기 위해 불투명 저장 상자에 4 ° C에서 섹션을 저장합니다.
결과
성공적으로 완료되면, 섹션은 biocytin 채우기와 immunolabeling 2 단계에서 수행 공 촛점 또는 표면 형광 현미경을 사용하여 이미지화 할 수있다 유지한다. 또한, 처리 된 부분도 그림 2 절에서 3 단계에서 후속 처리하는 동안 표시된 항원에 대한 면역 염색을 보여줍니다, 두꺼운 부분 (300 μm의)에서 biocytin 가득한 신경 세포의 형태는 스트렙 타비 딘을 사용하여 밝혀?...
토론
프로토콜 내에서 중요한 단계
biocytin으로 패치 된 셀을 작성하는 형태의 완전한 복구를 보장 할 수있는 가장 중요한 단계입니다. 셀의 전체 복구를 들어, 슬라이싱하는 동안 프로세스의 절단을 최소화하는 최적의 슬라이스 방향을 선택하는 것이 필수적이다. 이 방향은 시험중인 회로 및 세포 유형에 따라 다를 수 있습니다. 다음으로, 상기 biocytin가 축삭 돌기 및 ...
공개
저자는 공개 아무것도 없어.
감사의 말
저자는 VS.에 NIH / NINDS R01 NS069861 및 NJCBIR CBIR14IRG024의 지원을 인정하고 싶습니다
자료
| Name | Company | Catalog Number | Comments |
| NaCl | Sigma | S7653 | Immunostaining |
| KCl | Fluka | 60129 | Immunostaining |
| Na2HPO4 | Sigma | S7907 | Immunostaining |
| KH2PO4 | Sigma | 229806 | Immunostaining |
| Triton X-100 | Sigma | T8787 | Immunostaining |
| Guinea pig anti CB1 | Sigma | Af530-1 | Immunostaining |
| Mouse anti CCK | CURE, UCLA | courtesy of G. Ohning | Immunostaining |
| Rabbit anti Parvalbumin | Swant | PV27 | Immunostaining |
| Streptavidin, Alexa Fluor conjugate | Molecular Probes | S11227 | Immunostaining |
| Normal goat serum (NGS) | Sigma | G9023 | Immunostaining |
| Vectashield | Vector Labs | H-1000 | Immunostaining |
| Secondary Antibodies | Invitogen Molecular probes | Alexa Fluor conjugated dyes | Immunostaining |
| Labnet orbit low speed shaker | Bioexpress | S-2030-LS | Immunostaining |
| Forceps | Dumont | 11231-30 | Immunostaining |
| Slide folders | EMS | 71520 | Immunostaining |
| Vibratome VT 1200 S | Leica | 14048142066 | Electrophysiology |
| Multiclamp 700B amplifier | Molecular devices | Multiclamp 700B | Electrophysiology |
| pCLAMP 10 Software | Molecular devices | pCLAMP 10 | Electrophysiology |
| Digitizer | Molecular Devices | Digidata 1440 digitizer | Electrophysiology |
| Filter tips | Nalgene | 171-0020 | Electrophysiology |
| Sonicator | Fisher Scientific | 15-335-100 | Electrophysiology |
| Microloaders | Eppendorf | 930001007 | Electrophysiology |
| Biocytin | Sigma | B4261 | Electrophysiology |
참고문헌
- Garcia-Lopez, P., Garcia-Marin, V., Freire, M. The histological slides and drawings of cajal. Front Neuroanat. 4, 9 (2010).
- Klausberger, T., Somogyi, P. Neuronal diversity and temporal dynamics: the unity of hippocampal circuit operations. Science. 321 (5885), 53-57 (2008).
- Petilla Interneuron Nomenclature, G., et al. Petilla terminology: nomenclature of features of GABAergic interneurons of the cerebral cortex. Nat Rev Neurosci. 9 (7), 557-568 (2008).
- Armstrong, C., Soltesz, I. Basket cell dichotomy in microcircuit function. J Physiol. 590 (4), 683-694 (2012).
- Povysheva, N. V., Zaitsev, A. V., Gonzalez-Burgos, G., Lewis, D. A. Electrophysiological heterogeneity of fast-spiking interneurons: chandelier versus basket cells. PLoS One. 8 (8), e70553 (2013).
- Gupta, A., Elgammal, F. S., Proddutur, A., Shah, S., Santhakumar, V. Decrease in tonic inhibition contributes to increase in dentate semilunar granule cell excitability after brain injury. J Neurosci. 32 (7), 2523-2537 (2012).
- Fish, K. N., Hoftman, G. D., Sheikh, W., Kitchens, M., Lewis, D. A. Parvalbumin-containing chandelier and basket cell boutons have distinctive modes of maturation in monkey prefrontal cortex. J Neurosci. 33 (19), 8352-8358 (2013).
- Yu, J., Swietek, B., Proddutur, A., Santhakumar, V. Dentate cannabinoid-sensitive interneurons undergo unique and selective strengthening of mutual synaptic inhibition in experimental epilepsy. Neurobiol Dis. 89, 23-35 (2016).
- Yu, J., Swietek, B., Proddutur, A., Santhakumar, V. Dentate total molecular layer interneurons mediate cannabinoid-sensitive inhibition. Hippocampus. 25 (8), 884-889 (2015).
- Varga, C., et al. Functional fission of parvalbumin interneuron classes during fast network events. Elife. 3, (2014).
- Kawashima, T., Okuno, H., Bito, H. A new era for functional labeling of neurons: activity-dependent promoters have come of age. Neural Circuits Revealed. , 109 (2015).
- Krook-Magnuson, E., Luu, L., Lee, S. H., Varga, C., Soltesz, I. Ivy and neurogliaform interneurons are a major target of mu-opioid receptor modulation. J Neurosci. 31 (42), 14861-14870 (2011).
- Szabadics, J., Soltesz, I. Functional specificity of mossy fiber innervation of GABAergic cells in the hippocampus. J Neurosci. 29 (13), 4239-4251 (2009).
- Iball, J., Ali, A. B. Endocannabinoid Release Modulates Electrical Coupling between CCK Cells Connected via Chemical and Electrical Synapses in CA1. Front Neural Circuits. 5, 17 (2011).
- Chen, X., Cho, D. -. B., Yang, P. -. C. Double staining immunohistochemistry. N Am J Med Sci. 2 (5), 241-245 (2010).
- Ranjan, A. K., et al. Cellular detection of multiple antigens at single cell resolution using antibodies generated from the same species. Journal of immunological. 379 (1), 42-47 (2012).
- Fuccillo, D. A., Sever, J. L. . Concepts in Viral Pathogenesis II. , 324-330 (1986).
- Buchwalow, I. B., Minin, E. A., Boecker, W. A multicolor fluorescence immunostaining technique for simultaneous antigen targeting. Acta Histochem. 107 (2), 143-148 (2005).
- Qi, G., Radnikow, G., Feldmeyer, D. Electrophysiological and morphological characterization of neuronal microcircuits in acute brain slices using paired patch-clamp recordings. JoVE (Journal of Visualized Experiments. (95), e52358 (2015).
- Walz, W. . Patch-clamp analysis : advanced techniques. 2nd edn. , (2007).
- Molnar, P. . Patch-clamp methods and protocols. 403, (2007).
- Martina, M., Taverna, S. . Patch-clamp methods and protocols. , (2014).
- Booker, S. A., Song, J., Vida, I. Whole-cell patch-clamp recordings from morphologically- and neurochemically-identified hippocampal interneurons). J Vis Exp. (91), e51706 (2014).
- Jinno, S., Kosaka, T. Immunocytochemical characterization of hippocamposeptal projecting GABAergic nonprincipal neurons in the mouse brain: a retrograde labeling study. Brain research. 945 (2), 219-231 (2002).
- Yu, J., Proddutur, A., Swietek, B., Elgammal, F. S., Santhakumar, V. Functional Reduction in Cannabinoid-Sensitive Heterotypic Inhibition of Dentate Basket Cells in Epilepsy: Impact on Network Rhythms. Cereb Cortex. , (2015).
- Proddutur, A., Yu, J., Elgammal, F. S., Santhakumar, V. Seizure-induced alterations in fast-spiking basket cell GABA currents modulate frequency and coherence of gamma oscillation in network simulations. Chaos. 23 (4), 046109 (2013).
- Scharfman, H. E. Differentiation of rat dentate neurons by morphology and electrophysiology in hippocampal slices: granule cells, spiny hilar cells and aspiny 'fast-spiking' cells. Epilepsy Res Suppl. 7, 93-109 (1992).
- Tasker, J. G., Hoffman, N. W., Dudek, F. E. Comparison of three intracellular markers for combined electrophysiological, morphological and immunohistochemical analyses. J Neurosci Methods. 38 (2-3), 129-143 (1991).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유