È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Immunocolorazione delle sezioni biocitina-riempite e trasformati per neurochimici Marcatori
In questo articolo
Riepilogo
Questo protocollo presenta un metodo per il recupero morfologica dei neuroni rattoppati durante le registrazioni elettrofisiologiche utilizzando riempimento biocitina e successiva postprocessing immunoistochimica. Abbiamo dimostrato che spesse sezioni biocitina-riempita che erano macchiate e coprioggetto possono essere ricolorate con un secondo giorni di anticorpi primari o mesi dopo.
Abstract
registrazioni elettrofisiologiche di cellule utilizzando la tecnica del patch clamp hanno permesso l'identificazione di diversi tipi neuronali basate su modelli di cottura. L'inclusione di biocitina / neurobiotin nel elettrodo di registrazione permette il recupero post-hoc dei dettagli morfologici, che sono necessari per determinare la arborizzazione dendritiche e le regioni interessate dagli assoni dei neuroni registrati. Tuttavia, data la presenza di neuroni morfologicamente simili con identità distinte neurochimiche e funzioni, colorazione immunoistochimica per le proteine-specifica delle cellule-tipo è essenziale per identificare definitivamente i neuroni. Per mantenere la connettività di rete, sezioni di cervello per le registrazioni fisiologiche sono preparati ad uno spessore di 300 micron o superiore. Tuttavia, questo spessore spesso ostacola la post-elaborazione immunoistologiche causa di problemi con la penetrazione degli anticorpi, che richiede la resezione del tessuto. Resezione di fette è un'arte difficile, spesso Resulting nella perdita di tessuto e la morfologia delle cellule da cui sono stati ottenuti i dati elettrofisiologici, rendendo i dati inutilizzabili. Poiché il recupero della morfologia limiterebbe perdita di dati e guida nella scelta dei marcatori neuronali, abbiamo adottato una strategia di recuperare morfologia cellulare prima, seguita da immunocolorazione secondaria. Introduciamo un approccio pratico per biocitina riempimento durante le registrazioni fisiologiche e successiva immunostaining seriale per il recupero di morfologia, seguita dalla restaining delle sezioni per determinare l'identità neurochimico. Si segnala che le sezioni che erano pieni di biocitina, fissate con paraformaldeide (PFA), macchiati, e coprioggetto possono essere rimossi e ricolorate con un secondo anticorpo primario giorni successivi. Questo restaining comporta la rimozione del vetrino, il lavaggio delle sezioni in una soluzione tampone, e l'incubazione di anticorpi primari e secondari per rivelare l'identità neurochimico. Il metodo è vantaggioso per eliminare datuna perdita a causa di una incapacità di recuperare la morfologia e per restringendo i marcatori neurochimici da sottoporre a test sulla base di morfologia.
Introduzione
Il cervello è noto per la diversità nelle caratteristiche strutturali e funzionali dei singoli elementi neuronali. La comprensione dei ruoli di tipi neuronali distinti in funzione del cervello e patologia richiede caratterizzazione e identificazione univoca dei neuroni. Strutturalmente, le caratteristiche morfologiche definite dalla posizione somato-dendritiche determinare il potenziale di input che riceve un dato neurone, mentre il modello di arborization assonale identifica potenziali obiettivi post-sinaptici. La diversità strutturale dei neuroni è stato apprezzato fin dai tempi di seminali studi istologici di Ramon y Cajal 1. L'avvento di tecniche di registrazione unicellulari ha rivelato che i neuroni strutturalmente distinti mostrano anche differenze nei modelli di cottura e le caratteristiche sinaptiche. La diversità nella struttura e la fisiologia è particolarmente evidente nei neuroni inibitori GABAergici 2,3. Inoltre, è diventato sempre più evidente che strutturalmentey neuroni simili possono esprimere diversi marcatori neurochimici e spettacolo corrispondenti differenze funzionali 4. Analogamente, neuroni con gli stessi marcatori neurochimici possono avere strutture e funzioni 5-10 distinte. Pertanto, in pratica, l'analisi delle caratteristiche funzionali dei neuroni e il loro ruolo nella rete comporta che definisce sia le identità morfologici e neurochimici. Anche con l'avvento di linee di topo giornalista targeting specifici marcatori neurochimici, spesso è necessario determinare la morfologia e all'identità sottotipo basato su immunoistologia 11.
Il metodo standard utilizzato per caratterizzare le cellule registrati in fettine di cervello acuto è di riempirli con biocitina o neurobiotin durante la registrazione, fissare le sezioni in paraformaldeide (PFA) seguendo le registrazioni, e utilizzare immunoistochimica per rivelare la morfologia e la neurochimica. Dal momento che lo spessore delle sezioni per fetta fisiologia sono in genere a 300 microno più, e perché la maggior parte degli anticorpi non riescono a penetrare fino in quella profondità, le fette devono essere ri-sezionato a 60 micron o meno per consentire immunostaining simultaneo per biocitina e marcatori neurochimici 12-14. Purtroppo, resezione è laboriosa; rischia la perdita di tessuto durante il sezionamento; e può portare a differenziale restringimento dei tessuti, complicando ricostruzioni morfologiche. Inoltre, la conoscenza preventiva della morfologia potrebbe aiutare a restringere i marcatori candidati che sono suscettibili di essere espressa dalle cellule. Abbiamo modificato i protocolli biocitina Immunoistologia standard per consentire l'elaborazione seriale sezioni prima per il recupero della morfologia e poi per l'identificazione di potenziali marcatori neurochimici.
Immunoistochimica è lo studio della distribuzione dell'antigene nei tessuti o cellule e possono essere visualizzati con un enzima, etichette fluorescenti, elementi radioattivi, o particelle colloidali in oro 15. La Proceduranvolves utilizzando anticorpi primari per etichettare specificamente e amplificare uno o più specifici antigeni, seguito dall'uso di anticorpi secondari fluorescenti rivolte l'anticorpo primario per la visualizzazione. A causa della necessità di distinguere gli spettri di fluorescenza di ciascun anticorpo secondario senza sovrapposizione, solo un numero limitato di antigeni può essere esaminato contemporaneamente. Così, la conoscenza preventiva della morfologia potrebbe essere utile nella scelta dei candidati marcatori neurochimici per la classificazione delle cellule. Concettualmente, la logica alla base di elaborazione di serie di sezioni già colorate si basa sulla premessa che immunomarcatura per una proteina o peptide non dovrebbe interferire con antigenicità e successiva immunomarcatura per un peptide strutturalmente indipendente 16. Questa mancanza di interferenza è dovuta al legame di anticorpi ad un specifico epitopo della proteina su un antigene e consente la colorazione simultanea di più antigeni nello stesso tessuto conseguenza. Il numero di antigeni Revealed mediante immunocolorazione è limitata dalla necessità di spettri non sovrapposizione degli anticorpi secondari fluorescenti e dalla necessità di indirizzare i singoli antigeni con anticorpi in specie diverse in modo da eliminare reattività crociata 17,18. Mentre questo è il ragionamento che sta dietro l'etichettatura di serie, piuttosto che simultaneamente con due anticorpi distinte che possono interagire, a nostra conoscenza, immunocolorazione per un secondo l'antigene non è stata riportata dopo il completamento del immunomarcatura per uno o più antigeni sulle sezioni montate. Qui, descriviamo un metodo per immunocolorazione serie di sezioni precedentemente colorate e montati. Mentre dettaglio questo processo per una procedura immunomarcatura seriale per il recupero della morfologia seguita dalla colorazione per i marcatori di proteine / peptidi in sezioni spesse, le stesse procedure possono essere utilizzati in serie, sottili sezioni istologiche pure. Inoltre, si descrive un approccio pratico per riempire neuroni registrati con biocitina e il processo per rimuovere laelettrodo dalla cella al termine di registrazioni per ottimizzare il riempimento del assonale e arbors dendritiche di neuroni, come presentato nel nostro recente 6,8 lavoro.
Il vantaggio più importante del procedimento qui descritto è che la morfologia della cellula registrato può essere completamente recuperato e ripreso prima di tentare di resezione o immunostain le fette. Anche se possono rendere necessario fette di resezione per immunostaining secondaria problemi con la penetrazione di alcuni anticorpi, le procedure descritte qui eliminerebbe la necessità di ricostruire i neuroni complessi da più sezioni e sarebbe evitare problemi dovuti alla perdita di tessuto ed il restringimento del differenziale, che possono compromettere la ricostruzione dopo resezione. Un ulteriore vantaggio è che il processo sarà ridurre i costi, tempo, fatica, e gli anticorpi costosi limitando immunoistochimica e ri-sezionamento a fette in cui vengono recuperati i neuroni biocitina-riempita. L'aspetto più pratico è la pubblicitàimmunostaining dizionale che può essere eseguita su sezioni colorate mesi prima di utilizzare la tecnica di cui sopra. In particolare, il recupero della morfologia ridurrebbe considerevolmente il potenziale che i dati fisiologici dalle cellule vengono scartati a causa dell'impossibilità di ottenere una caratterizzazione morfologica di base del tipo di cellula.
Protocollo
1. riempimento biocitina durante Elettrofisiologia
NOTA: I lettori possono fare riferimento a fonti alternative per le tecniche di base di patch-clamp registrazione e strumentazione 19-22, che non sono elaborati su qui. I passi descritti qui si presuppone che l'apparecchiatura e le procedure per le registrazioni di patch-clamp sono già stabiliti, e la descrizione saranno limitati ai dettagli relativi alla biocitina-riempimento e immunocolorazione post-hoc. Tutti gli esperimenti descritti in questo manoscritto sono stati eseguiti su ratti.
- Utilizzando un vibratomo, preparare sezioni di cervello vivi della regione desiderata in uno spessore 300 - 350 micron 23.
- Preparare una soluzione interna contenente 0,2% biocitina con l'aggiunta di 2 mg di biocitina a 1 ml di soluzione interna 6. Per ottenere risultati ottimali, sonicare la soluzione interna per 10 - 15 minuti fino a quando la biocitina scioglie completamente. Successivamente, caricare la soluzione interna in una siringa da 1 ml con 0,2 &# 160; micron pori del filtro dimensione polipropilene punta attaccato ad un microloader. Tenere questo loading siringa su un impacco freddo per mantenere la stabilità del Mg-ATP e Na-GTP nella soluzione interna.
NOTA: Una gluconato di potassio soluzione interna contenente (126 mM K-gluconato, 4 mM KCl, 10 mM HEPES, 4 mM Mg-ATP, 0,3 mM Na-GTP, e 10 mM fosfocreatina) è ottimale per il recupero di alcuni marcatori neurochimici, compresi parvalbumina, durante immunomarcatura. Nella nostra esperienza, utilizzando cesium- e delle soluzioni interne basate cloruri riduce la capacità di recuperare immunocolorazione per alcuni marcatori neurochimici. Neurobiotin o, risolvibile, tracciante polare cellule impermeant combinando un Alexa Fluoroforo con biocitina possono essere utilizzati come alternativa al biocitina. - Sotto infrarossi contrasto interferenziale differenziale, visualizzare la cella appropriata per la registrazione. Per minimizzare le perturbazioni dell'assone, avvicinarsi al corpo cellulare abbassando la pipetta lungo il suo asse mediante il "metodo" funzione disponibile nella maggior parte dei micromanipolatori. Stabilire registrazioni cellule intere sotto differenziale a raggi infrarossi contrasto interferenziale utilizzando protocolli fisiologia patch-clamp 19-22.
NOTA: Evitare avvicina la cella dalla direzione dell'assone putativo, come sarà recidere l'assone, visualizzato come una bozza al fine taglio (freccia verde in figura 1). Inoltre, evitare di applicare l'alta pressione positiva alla pipetta di registrazione mentre si avvicina alla cella di ridurre al minimo la fuoriuscita di biocitina, che si tradurrà in background ad alto colorazione.
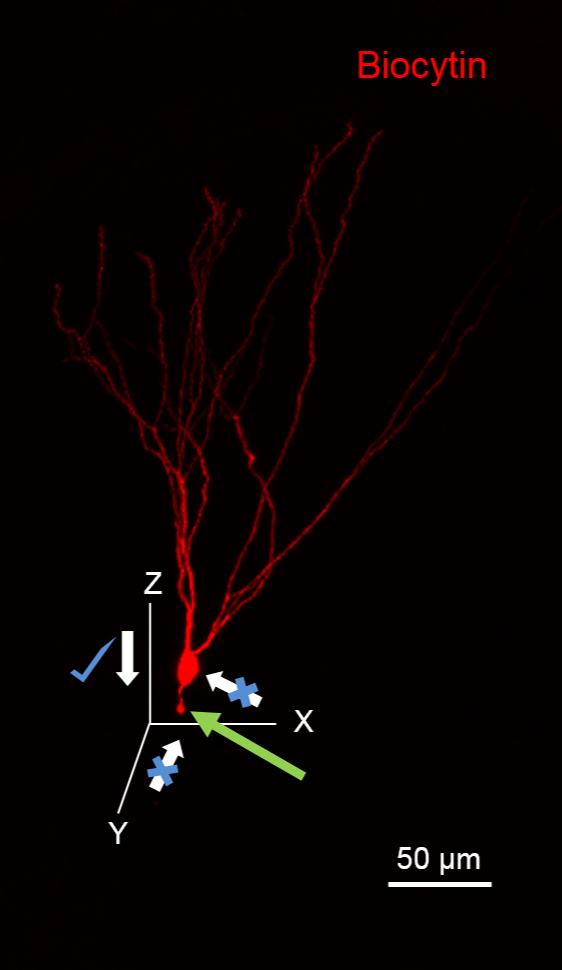
Figura 1. suggerito aereo per l'avvicinamento cellule per biocitina riempimenti. L'immagine illustra una cella granuli (GC) riempire con biocitina durante la registrazione che è stato elaborato per rivelare biocitina (in rosso con streptavidina 594-coniugato). Il GC ha i suoi dendriti orientati nel piano XY. Si noti la cella di granuli recisoassone (freccia verde) dovute al movimento pipetta lungo il piano XY. Si noti che è ideale per avvicinarsi a questo neurone lungo il piano XZ. barra della scala: 50 micron.
- Nella configurazione morsetto di tensione, determinare la capacità whole-cell e resistenza serie in risposta a piccolo (5 mV), breve (30 ms) di isolamento procedura utilizzando il utilizzando la funzione di test a membrana in modalità bagno in un acquisizione dati elettrofisiologia e software di analisi. Ciò garantirà la creazione di condizioni di registrazione a cellule per consentire biocitina riempimento.
- Condurre registrazioni fisiologiche in modalità sia current- o tensione-clamp, se necessario. Un tempo minimo di registrazione> 10 min a 34 ° C è ideale.
NOTA: più lunghi tempi di registrazione possono essere necessari per gli studi eseguiti a temperatura ambiente. - Al termine delle registrazioni fisiologiche, ristabilire la configurazione patch-clamp muovendo lentamente la pipetta di registrazione a piccoli passi, alternando alto (lungo l'asse Z) everso l'esterno (lungo l'asse X) in modo tensione-clamp.
- Contemporaneamente monitorare la resistenza capacità e di ingresso utilizzando la funzione di "test a membrana" per visualizzare la perdita di transienti capacitivi e il crollo delle risposte attuali a una linea retta, che indica la ri-sigillatura della cella e la creazione di un fuori-uscita rattoppare sulla punta della pipetta. Tenendo il cellulare ad un potenziale depolarizzata (-40 mV) faciliterà il processo di ri-sigillatura.
NOTA: Questa procedura per la rimozione di una cella assicura tipicamente il completo recupero del soma e dendriti. Non applicare pressione positiva alla pipetta registrazione durante questa procedura o mentre staccando la cella dalla pipetta. Visualizzazione della soma della cellula registrata nella fetta indica disimpegno successo. La presenza di detriti cellulari o di una patch membrana all'estremità della punta distaccata indica tipicamente dislocazione del soma e non produrrà completa morfologia cellulare. - A poppaer staccare la pipetta dalla cella, mantenere la fetta nella camera di registrazione da 3 - 5 minuti per assicurare il trasporto del colorante dendritica distale e processi assonale.
- Trasferire le fettine di un 24-pozzetti contenente 4% PFA per il fissaggio.
ATTENZIONE: PFA è cancerogeno, e dispositivi di protezione adeguati, compresi i guanti e una mascherina, deve essere utilizzato per evitare l'irritazione della pelle e l'inalazione. PFA è infiammabile e deve essere tenuto fuori dalla portata di fuoco. PFA non è mai smaltiti nello scarico e deve essere raccolto come rifiuti chimici. PFA fissazione deve essere isolato dalle aree utilizzate per la preparazione fetta vivo per evitare la contaminazione del setup fisiologia, tra pipette. - 24 - 48 ore dopo la fissazione in PFA, trasferire le fette di 0,1 Saline M fosfato-tamponata (PBS) per lo stoccaggio prima dell'immunocolorazione.
NOTA: Idealmente, biocitina recupero e immunostaining sono meglio se effettuata subito dopo la fissazione, anche se per la colorazione formata entro 7 d dei rendimenti di fissaggio buoni risultati. Fette possono essere mantenuti in PBS con 0,02 - sodio azide 0,05% per la colorazione eseguita fino ad oltre 90 giorni dopo la fissazione. Sebbene fissaggio notte in PFA funziona bene per la maggior parte degli anticorpi, è possibile che alcuni anticorpi funzionano meglio quando la durata dell'incubazione nel fissativo è ridotta. Fissazione in PFA per oltre 48 ore riduce la disponibilità di antigeni e diminuisce le probabilità di successo immunostaining secondario per i marcatori neurochimici.
ATTENZIONE: Il sodio azide è estremamente pericolosa e irritante al contatto con la pelle o con gli occhi o su ingestione o inalazione. Grave sovraesposizione può causare la morte. La cancerogenicità e mutagenicità del composto non sono noti. Utilizzare dispositivi di protezione adeguati compresi guanti, occhiali antispruzzo, un camice da laboratorio, e un respiratore polvere. La sodio azide è mai smaltiti nello scarico e deve essere raccolto come rifiuti chimici.
(Giorno 1)
NOTA: La seguente procedura immunocolorazione è per le sezioni free-floating e richiede agitazione continua a bassa velocità (2 giri / min, rpm) su un agitatore per tutte le fasi di incubazione.
- Lavare 3x tessuto per 10 minuti ciascuno in PBS 0,1 M (pH = 7,4).
NOTA: 0,1 M PBS può essere commercialmente acquistato o realizzato in laboratorio come segue (fa 1 L): 8 g di NaCl, 0,2 g di KCl, 1,44 g di Na 2 HPO 4, e 0,24 g di KH 2 PO 4 in 1 L di dH 2 0.
NOTA: Se il marker neurochimici desiderato è noto, la colorazione per una proteina / peptide può essere effettuata contemporaneamente alla biocitina colorazione (passi 2,2-2,4). Se la colorazione per biocitina solo, passare al punto 2.5. - OPTIONAL: blocco con 10% siero di blocco (BS; siero di capra normale (NGS) diluito in 0,3% Triton X-100 in PBS per 1 ora a RT).
NOTA: Ogni bene dovrebbericevere lo stesso volume della soluzione; il volume consigliato è tra i 250 - 500 microlitri / pozzetto. La selezione del siero di blocco si basa sulla specie nelle quali vengono sollevate gli anticorpi secondari (ad esempio, NGS è utilizzato per tinture capra coniugato anti- (specie corrispondenti anticorpo primario)). In caso di necessità di utilizzare anticorpi secondari sollevati in diverse specie immunostain sezioni, comprendono il 10% di ciascun siero normale nel bloccare stadio (2) e 3% di ciascun siero normale per i passaggi di incubazione anticorpi primari e secondari. - (FACOLTATIVO) Incubare le sezioni in anticorpo primario, CB 1 R (policlonale, cavia) con 0,3% Triton X-100, e il 3% in BS 0,1 M PBS a RT O / N. CB 1 R viene utilizzato per identificare cannabinoidi recettore di tipo 1 di espressione.
NOTA: questo passaggio è facoltativo e non necessario per rivelare il ripieno biocitina. La figura 2 illustra una sezione denominata per biocitina e CB 1 R durante il primo processo di colorazione. O / N incubation a RT è sufficiente per la maggior parte degli anticorpi primari; tuttavia, alcuni anticorpi primari, comprese CB 1 R, richiedono 3 - 5 d dell'incubazione. Se l'incubazione deve essere superiore a 1 d, si raccomanda di incubare a 4 ° C perché Triton X-100 può permeabilize fette e può portare alla disintegrazione del tessuto durante l'incubazione prolungata a temperatura ambiente. Includere un controllo negativo privo anticorpo primario in almeno una sezione per ogni serie di esperimenti come controllo per la specificità dell'anticorpo secondario. Per controlli negativi, l'anticorpo primario viene omesso, ma si aggiungono 0,3% Triton X-100 in PBS 0,1 M e BS.
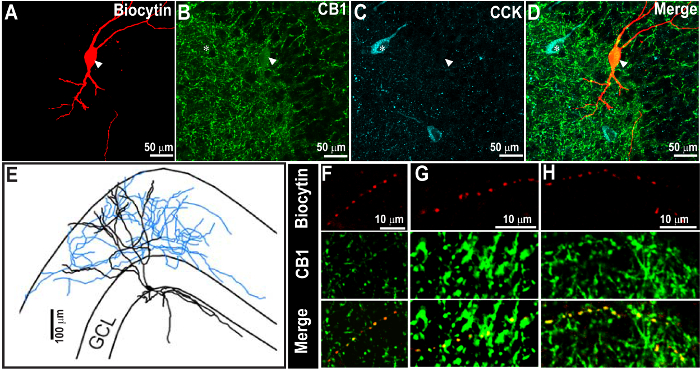
Figura 2. Il successo CCK colorazione 1 settimana dopo il recupero di biocitina colorazione e C annabinoid recettore di tipo 1 (CB 1 R) - etichettatura. (A - C) immagini confocale a 60X mostrano il neurone biocitina-riempita (A) e CB 1 R immunoreattività (B), indicato dalla freccia. La stessa sezione è stato elaborato per CCK immunocolorazione dopo 1 settimana (C). La sovrapposizione delle immagini è mostrato in D. CCK immunoreattività è stato rivelato con estrema rosso ed è stato pseudo-colorato in ciano. (E) la ricostruzione morfologica della cellula biocitina pieno in A. Si noti che il biocitina e CB 1 R colorazione sono evidenti anche dopo la seconda immunocolorazione CCK. Da notare anche la distribuzione prevista di CB 1 R e modelli di immunoistochimica CCK. (F - H) immagine ingrandita della assone dalla cella, come in A, spettacolo stretta co-localizzazione di biocitina e CB 1 R a assoni (punte di freccia). Barra della scala: 50 micron (A - D), 100 micron (E), e 10 micron ( F - H). Le immagini vengono riprodotte da Yu et al. 2015 9. Clicca qui per vedere una versione più grande di questa figura.
(Giorno 2)
- Lavare il cervello sezioni 3x per 10 minuti ciascuno in 0,1 M PBS (pH = 7.4).
- Incubare le sezioni in streptavidina coniugato con colorante rosso (concentrazione: 1: 1.000; eccitazione: 594 nm con emissione nello spettro visibile rosso) con 0,3% Triton X-100 e 3% BS in 0.1 M PBS a 4 ° CO / N nel scuro (avvolto in un foglio di alluminio) per rivelare il biocitina. OPTIONAL: Includere un anticorpo secondario, capra porcellino d'India anti-(concentrazione: 1: 500; eccitazione: 488 nm ed emissione in verde), con l'incubazione di cui sopra, se a seguito di incubazione primaria opzionale al punto 2.3.
NOTA: Anticorpo secondario sarà necessario solo se viene eseguita la colorazione anticorpo primario opzionale (passo 2.3). Per visualizzare biocitina, un streSi raccomanda coniugato ptavidin-fluoroforo con uno spettro di emissione in rosso, in quanto aiuta a visualizzare gli assoni sottili in dettaglio e con una migliore contrasto (figure 1 - 3). Durante immunostaining doppia o tripla, al fine di evitare la cross-reattività di anticorpi secondari con l'altro, aggiungere anticorpi secondari uno dopo l'altro in modo seriale (2 h intervallo tra le aggiunte seriali degli anticorpi è sufficiente). La figura 3A illustra una cella biocitina pieno elaborati senza l'opzionale colorazione anticorpo primario e ripreso prima resezione.
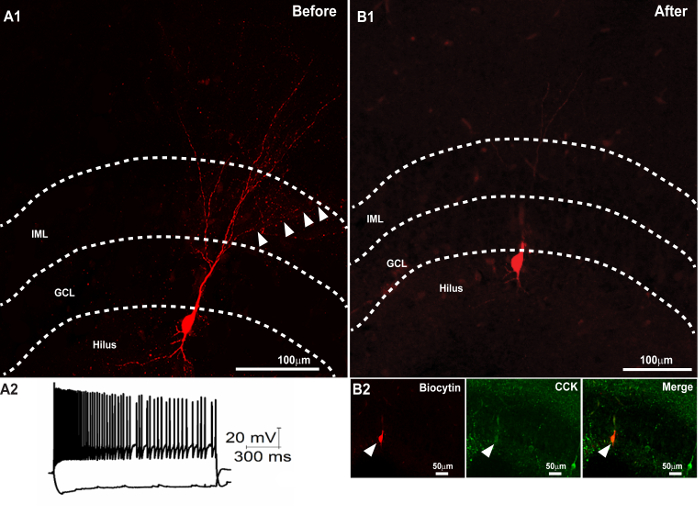
Figura 3. Il successo secondo Immunocolorazione a seguito della ripresa di biocitina Morfologia e resezione. (A1) confocale immagine di una fetta di 300 micron che mostra il recupero della morfologia dendritica di una cella biocitina-riempita. ( A2) tracce di tensione membrana del neurone in risposta a +500 e -100 pA iniezioni di corrente. (B) Il recupero del soma biocitina pieno in una sezione di 50 micron ottenuto dopo resezione della sezione 300 micron (in A1) dopo il montaggio e l'imaging. (B2) immunocolorazione successiva della sezione sottile rivelato colocalization del soma biocitina-riempita (pannello di destra) con CCK (pannello centrale). L'immagine fusa è illustrato nel pannello di destra. barra della scala: 50 micron. Pannello di A2 è riprodotto con il permesso di Yu et al. , In corso di stampa 25. Clicca qui per vedere una versione più grande di questa figura.
(3 ° giorno)
- sezioni di cervello Lavare 3x per 10 minuti ciascuno in 0,1 M PBS (pH = 7.4).
- Per proteggere la fluorescenza e per facilitare la nuova colorazione in futuro, montare il seczioni in un mezzo di montaggio a base acquosa e sigillare i bordi del coprioggetto con smalto trasparente.
NOTA: E 'meglio restain sezioni più presto possibile per evitare difficoltà nel rimuovere lo smalto dalla diapositiva, muffa infestazione, e la disidratazione dei tessuti a causa di perdite della soluzione di montaggio dal vetrino. La contaminazione microbica può essere evitato utilizzando lo 0,02% di sodio azide in PBS.
ATTENZIONE: Sodio azide è altamente tossico e infiammabile quando è in contatto con l'acqua. Si prega di fare riferimento alle procedure operative standard per la manipolazione e lo smaltimento di sostanze chimiche pericolose.
(Giorni 4 - 7) - Eseguire confocale con eccitazione a 594 e 488 nm e con un ingrandimento di 20X o 40X per rivelare i neuroni biocitina e indimenticabile a indicatori rossi e neurochimici (CB 1 R) in verde. Valutare colabeling (Figura 2).
- Impostare la esposizione della fotocamera per meno di 100 ms per evitare photobleaching e obtain pile di immagini confocali dei mandrini assonale e dendritiche dell'intero neurone. Utilizzare pile di immagini confocale e neurone tracciamento pacchetti software per ricostruire la morfologia neuronale.
3. La colorazione del secondo anticorpo primario
NOTA: Mentre il secondo passo immunocolorazione può essere eseguita 90 d dopo la prima colorazione, colorazione ottimale si ottiene quando il secondo colorazione anticorpo primario viene eseguita nei 7 - 10 d.
(Dopo 7-90 d)
- Applicare acetone per un batuffolo di cotone e spogliare lo smalto off del vetrino.
- Rimuovere il vetrino con cura utilizzando una pinza sottile-punta e mettere un paio di gocce di 0,1 M PBS sulle sezioni.
- Rimuovere con attenzione le sezioni dal vetrino utilizzando un pennello fine e lavarli in 0,1 M PBS per 24 - 48 h su un agitatore ricoperto di un foglio di alluminio in condizioni di scarsa luce a 4 ° C.
NOTA: E 'fondamentale per coprire le sezioni con unstagnola luminum per evitare photobleaching. - Per garantire la completa rimozione del mezzo di montaggio, lavare sezioni 1 - 2x il giorno successivo in 0.1 M PBS per 10 minuti ciascuno.
- Procedere con incubazione nel secondo anticorpo primario (ad esempio, colecistochinina, un neuropeptide presente in alcuni interneuroni GABAergici (CCK; concentrazione: 1: 1.000; anticorpi monoclonali di topo)) per 1 d (Figura 2).
NOTA: Questa procedura è simile al punto 2.3, ma utilizza un anticorpo diverso. Inoltre, la fase di bloccaggio viene omesso durante ri-colorazione. - Lavare le sezioni di cervello tre volte per 10 minuti ciascuno in 0.1 M PBS (pH = 7,4).
- Macchia con l'anticorpo secondario di capra anti-topo fluoroforo coniugato (concentrazione: 1: 500; eccitazione lunghezza d'onda: 647 nm), facendo in modo che gli spettri di eccitazione-emissione della anticorpo secondario non si sovrappongono con streptavidina (concentrazione: 1: 1.000; eccitazione lunghezza d'onda: 594 nm) e prima immunofluorescenzamacchie.
- Montare le sezioni in mezzo di montaggio acquoso e sigillare i bordi del vetrino con smalto trasparente.
NOTA: Salva le sezioni a 4 ° C in un bauletto opaca per proteggere la fluorescenza.
Risultati
In caso di superamento, sezioni mantengono il riempimento biocitina e il immunomarcatura eseguite nella fase 2 e può essere ripreso con confocale o epifluorescenza. Inoltre, sezioni trasformati mostrerà anche immunostaining per l'antigene marcato durante la successiva trasformazione nel passaggio 3. Nella sezione illustrata nella figura 2, la morfologia di un neurone biocitina pieno in una sezione di spessore (300 micron) è stato rivelato utilizzando streptavidina...
Discussione
I passaggi critici all'interno del protocollo
Riempire la cella patchato con biocitina è il passo più importante per garantire il pieno recupero della morfologia. Per il recupero completo della cella, è essenziale selezionare un orientamento ottimale fetta di minimizzare la rottura dei processi durante affettatura. Questo orientamento può variare in base al tipo di circuito e la cella in esame. Quindi, è essenziale per dare il tempo sufficiente per la biocitina di d...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori vorrebbero riconoscere il sostegno da NIH / NINDS R01 NS069861 e NJCBIR CBIR14IRG024 di VS.
Materiali
| Name | Company | Catalog Number | Comments |
| NaCl | Sigma | S7653 | Immunostaining |
| KCl | Fluka | 60129 | Immunostaining |
| Na2HPO4 | Sigma | S7907 | Immunostaining |
| KH2PO4 | Sigma | 229806 | Immunostaining |
| Triton X-100 | Sigma | T8787 | Immunostaining |
| Guinea pig anti CB1 | Sigma | Af530-1 | Immunostaining |
| Mouse anti CCK | CURE, UCLA | courtesy of G. Ohning | Immunostaining |
| Rabbit anti Parvalbumin | Swant | PV27 | Immunostaining |
| Streptavidin, Alexa Fluor conjugate | Molecular Probes | S11227 | Immunostaining |
| Normal goat serum (NGS) | Sigma | G9023 | Immunostaining |
| Vectashield | Vector Labs | H-1000 | Immunostaining |
| Secondary Antibodies | Invitogen Molecular probes | Alexa Fluor conjugated dyes | Immunostaining |
| Labnet orbit low speed shaker | Bioexpress | S-2030-LS | Immunostaining |
| Forceps | Dumont | 11231-30 | Immunostaining |
| Slide folders | EMS | 71520 | Immunostaining |
| Vibratome VT 1200 S | Leica | 14048142066 | Electrophysiology |
| Multiclamp 700B amplifier | Molecular devices | Multiclamp 700B | Electrophysiology |
| pCLAMP 10 Software | Molecular devices | pCLAMP 10 | Electrophysiology |
| Digitizer | Molecular Devices | Digidata 1440 digitizer | Electrophysiology |
| Filter tips | Nalgene | 171-0020 | Electrophysiology |
| Sonicator | Fisher Scientific | 15-335-100 | Electrophysiology |
| Microloaders | Eppendorf | 930001007 | Electrophysiology |
| Biocytin | Sigma | B4261 | Electrophysiology |
Riferimenti
- Garcia-Lopez, P., Garcia-Marin, V., Freire, M. The histological slides and drawings of cajal. Front Neuroanat. 4, 9 (2010).
- Klausberger, T., Somogyi, P. Neuronal diversity and temporal dynamics: the unity of hippocampal circuit operations. Science. 321 (5885), 53-57 (2008).
- Petilla Interneuron Nomenclature, G., et al. Petilla terminology: nomenclature of features of GABAergic interneurons of the cerebral cortex. Nat Rev Neurosci. 9 (7), 557-568 (2008).
- Armstrong, C., Soltesz, I. Basket cell dichotomy in microcircuit function. J Physiol. 590 (4), 683-694 (2012).
- Povysheva, N. V., Zaitsev, A. V., Gonzalez-Burgos, G., Lewis, D. A. Electrophysiological heterogeneity of fast-spiking interneurons: chandelier versus basket cells. PLoS One. 8 (8), e70553 (2013).
- Gupta, A., Elgammal, F. S., Proddutur, A., Shah, S., Santhakumar, V. Decrease in tonic inhibition contributes to increase in dentate semilunar granule cell excitability after brain injury. J Neurosci. 32 (7), 2523-2537 (2012).
- Fish, K. N., Hoftman, G. D., Sheikh, W., Kitchens, M., Lewis, D. A. Parvalbumin-containing chandelier and basket cell boutons have distinctive modes of maturation in monkey prefrontal cortex. J Neurosci. 33 (19), 8352-8358 (2013).
- Yu, J., Swietek, B., Proddutur, A., Santhakumar, V. Dentate cannabinoid-sensitive interneurons undergo unique and selective strengthening of mutual synaptic inhibition in experimental epilepsy. Neurobiol Dis. 89, 23-35 (2016).
- Yu, J., Swietek, B., Proddutur, A., Santhakumar, V. Dentate total molecular layer interneurons mediate cannabinoid-sensitive inhibition. Hippocampus. 25 (8), 884-889 (2015).
- Varga, C., et al. Functional fission of parvalbumin interneuron classes during fast network events. Elife. 3, (2014).
- Kawashima, T., Okuno, H., Bito, H. A new era for functional labeling of neurons: activity-dependent promoters have come of age. Neural Circuits Revealed. , 109 (2015).
- Krook-Magnuson, E., Luu, L., Lee, S. H., Varga, C., Soltesz, I. Ivy and neurogliaform interneurons are a major target of mu-opioid receptor modulation. J Neurosci. 31 (42), 14861-14870 (2011).
- Szabadics, J., Soltesz, I. Functional specificity of mossy fiber innervation of GABAergic cells in the hippocampus. J Neurosci. 29 (13), 4239-4251 (2009).
- Iball, J., Ali, A. B. Endocannabinoid Release Modulates Electrical Coupling between CCK Cells Connected via Chemical and Electrical Synapses in CA1. Front Neural Circuits. 5, 17 (2011).
- Chen, X., Cho, D. -. B., Yang, P. -. C. Double staining immunohistochemistry. N Am J Med Sci. 2 (5), 241-245 (2010).
- Ranjan, A. K., et al. Cellular detection of multiple antigens at single cell resolution using antibodies generated from the same species. Journal of immunological. 379 (1), 42-47 (2012).
- Fuccillo, D. A., Sever, J. L. . Concepts in Viral Pathogenesis II. , 324-330 (1986).
- Buchwalow, I. B., Minin, E. A., Boecker, W. A multicolor fluorescence immunostaining technique for simultaneous antigen targeting. Acta Histochem. 107 (2), 143-148 (2005).
- Qi, G., Radnikow, G., Feldmeyer, D. Electrophysiological and morphological characterization of neuronal microcircuits in acute brain slices using paired patch-clamp recordings. JoVE (Journal of Visualized Experiments. (95), e52358 (2015).
- Walz, W. . Patch-clamp analysis : advanced techniques. 2nd edn. , (2007).
- Molnar, P. . Patch-clamp methods and protocols. 403, (2007).
- Martina, M., Taverna, S. . Patch-clamp methods and protocols. , (2014).
- Booker, S. A., Song, J., Vida, I. Whole-cell patch-clamp recordings from morphologically- and neurochemically-identified hippocampal interneurons). J Vis Exp. (91), e51706 (2014).
- Jinno, S., Kosaka, T. Immunocytochemical characterization of hippocamposeptal projecting GABAergic nonprincipal neurons in the mouse brain: a retrograde labeling study. Brain research. 945 (2), 219-231 (2002).
- Yu, J., Proddutur, A., Swietek, B., Elgammal, F. S., Santhakumar, V. Functional Reduction in Cannabinoid-Sensitive Heterotypic Inhibition of Dentate Basket Cells in Epilepsy: Impact on Network Rhythms. Cereb Cortex. , (2015).
- Proddutur, A., Yu, J., Elgammal, F. S., Santhakumar, V. Seizure-induced alterations in fast-spiking basket cell GABA currents modulate frequency and coherence of gamma oscillation in network simulations. Chaos. 23 (4), 046109 (2013).
- Scharfman, H. E. Differentiation of rat dentate neurons by morphology and electrophysiology in hippocampal slices: granule cells, spiny hilar cells and aspiny 'fast-spiking' cells. Epilepsy Res Suppl. 7, 93-109 (1992).
- Tasker, J. G., Hoffman, N. W., Dudek, F. E. Comparison of three intracellular markers for combined electrophysiological, morphological and immunohistochemical analyses. J Neurosci Methods. 38 (2-3), 129-143 (1991).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon