このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
糖尿病マウスの精巣上体脂肪細胞における膵島支持骨格移植
要約
このプロトコルは、マウス島の単離および脱細胞化された骨格上への播種を実証する。足場支持膵島を、ストレプトゾトシン(STZ)誘発糖尿病マウスの精巣上体脂肪パッドに移植した。島は移植部位で生存し、高血糖状態を逆転させた。
要約
膵島移植は、1型糖尿病の治療に有効であることが臨床的に証明されている。しかしながら、現在の肝内移植戦略は、急性の全血反応を招き、膵島移植が不十分になる可能性がある。ここでは、糖尿病マウスモデルにおける肝外移植部位(epididymal fat pad(EFP))における膵島の移植のための堅牢なプロトコールを報告する。 C57BL / 6Jマウスから高収率で膵島を単離および精製するためのプロトコール、ならびに脱細胞化足場(DCS)上に膵島を播種し、それらを糖尿病にした同系C57BL / 6JマウスのEFP部位に移植することによって実施される移植方法が記載されているストレプトゾトシンによる。 500島を含むDCS移植片は10日以内に高血糖状態を逆転させたが、DCSを有さない自由島は少なくとも30日間必要であった。正常血糖は移植片が外植されるまで3ヶ月まで維持された。結論として、DCSは島の生着をtEFPの肝外部位であり、容易に回収することができ、骨格材料を調べるための再現可能で有用なプラットフォームならびに成功した島移植に必要な他の移植パラメータを提供することができる。
概要
1型真性糖尿病(T1D)は、膵島細胞が免疫系によって切除され、患者が一生の間、外因性インスリンの注射に依存する自己免疫性内分泌障害である。エドモントンプロトコールは、膵島移植の臨床研究における画期的な成果である。膵島を門脈から注入し、肝内サイト1に移植した。しかし、不十分な供与膵島の供給源と膵島生着の不十分な2つの主な障害は、膵島移植の大きな成功を妨げる2 。通常、1人の患者の高血糖状態を逆転させるために、3つの死体ドナーから膵島を採取する必要がある。これは、膵島単離手順の低い収率および移植後の膵島損失に起因する。特に、移植後の島は酸素が豊富な血液に浸されていたが、血液と直接接触すると、しばしば即座の血液媒介性の炎症が誘発された島の急激な喪失を引き起こす可能性のある腐敗反応(IBMIR)を引き起こす可能性がある。長期的には、患者の膵島の漸減が、最初の年に90%に達する可能性があり、2および5で30%および10%に低下することができる臨床群における糖尿病の逆転率の低下を説明すると考えられる移植後の年数3 。
肝臓外の部位での膵島移植は、膵島の血液との直接的な接触を減少させる一方で、肝臓内注入に比べてより限定された位置に移植物を閉じ込める魅力的な戦略であった。過去数年にわたり、腎臓のカプセル、眼、筋肉、脂肪パッド、皮下の空間で研究が行われ、これらの部位の島は生存し、正常血糖を回復させることが示されている4 。さらに、これらの部位の島は回収可能であり、生検またはさらなる置換処置の可能性もある。体外循環それゆえに、臨床移植にとって大きな可能性を秘めています5 。
生体材料に基づく足場は、細胞移植および組織工学のために集中的に研究されてきた。三次元(3D)スカフォールドは、通常、多孔質構造を含み、生物活性キューの制御された放出を提供するために、細胞の空間構造/組織を生成するための細胞テンプレートとして、またはリザーバとして役立ち得る。骨格はまた、EFP中の移植膵島へのポリ(グリコリド-L-ラクチド) 6 、ポリ(ジメチルシロキサン) 7および熱可塑性ポリ(ウレタン) 8などのポリマー材料から作製されている。膵島の直接移植に比べて、足場の使用は、機械的保護とMODUを提供し、腹腔9、10に膵島の漏れを防止することによって膵島損失を低減することが見出されました局所炎症反応を惹起する。したがって、足場は、移植部位での島移植を促進するために開発されてもよい7 。
この研究では、DCSを用いたマウスモデルで実施された、EFPにおける膵島移植のパラダイムを実証するつもりである。細胞外マトリックスから誘導された足場は、近年、合成産物と比較して優れた生体適合性およびより天然の多孔質構造のために大きな関心を集めている。ここでは、C57BL / 6Jマウスから高収量で膵島を得るための強力な単離プロトコールについて述べる。ウシ心膜から処理したDCSに膵島を播種し、同系糖尿病モデルで移植片をEFPに移植した。マウスの正常血糖は10日以内に達成され、移植片の除去まで100日まで維持された。
プロトコル
すべての実験は、北京大学機関動物実験および使用委員会(IACUC、IACUC no。COE-LuoY-1)によって承認された。
1.アイスアイソレーション
- 試薬と装置の準備。
- HBSS中のコラゲナーゼP粉末(2U / mg)を再構成して5mg / mL溶液を作製し、それを0.22μmフィルターを通してろ過して細菌を除去する。コラゲナーゼPの0.6 mLアリコート溶液を15 mLコニカルチューブに入れ、-20°Cで保存します。
注:使用中、各アリコートをHBSSで希釈して、最終濃度0.5mg / mLまたは1U / mL(3匹のマウスを処置するのに十分)の6mLの作業溶液を得る。作業溶液を氷上に置いて直ちに1時間以内に使用します。追加の使用のために、作業中のソリューションを復元または再固定するべきではありません。 - HBSSにFBS(2.5%)とP / S(1%)を添加して中和溶液を調製する。溶液を氷上に保つ。中和液60mLを調製するt 6マウス。
- 膵島培養培地には、D-グルコース(7mM)、FBS(10%)およびP / S(1%)をRPMI 1640培地に加える。
- 手術器具を115℃で30分間、15psiの圧力でオートクレーブ処理する。
- HBSS中のコラゲナーゼP粉末(2U / mg)を再構成して5mg / mL溶液を作製し、それを0.22μmフィルターを通してろ過して細菌を除去する。コラゲナーゼPの0.6 mLアリコート溶液を15 mLコニカルチューブに入れ、-20°Cで保存します。
- 膵臓の膨張。
- 6匹のマウス(12週齢)のために、ステップ1.1.1に明記されているように、コラゲナーゼ作業溶液12mLを調製する。 10mLシリンジに9mLの作業溶液を満たし、シリンジを27G静脈注射針に接続する。シリンジを氷上に保管し、1時間以内に溶液を使用する。
- 頚椎脱臼により安楽死させる。マウスをペイントタオルの仰臥位に置き、尾がオペレータの方を向くようにします。全身を70%エタノールでスプレーして完全に濡らします。
- 生殖器領域から開始し、解剖のはさみと鉗子を使用して、横隔膜まで伸びるV切開を行う。腹腔を完全に明らかにするために胸の上に皮膚を折りたたむ。
- 移動マウスの右側に腸があり、膵臓と総胆管が露出する。十二指腸を鉗子で慎重に掴んで、胆管が緊張するまで引き上げます ( 図1A -1およびA-2 )。
- 肝臓に通じる門脈および胆管を見つける。顕微鏡的な止血クランプで門脈および胆管を締め付ける。
注:クランプは過度の出血やコラゲナーゼの肝臓への侵入を防ぎます。 - まだ鉗子で腸を保持している間、胆管と十二指腸をつなぐ膨大部の位置を見つける。 27Gの静脈内針を大胆管の中に挿入します ( 図1B -1およびB-2 )。
- カニューレが胆管を通っているかどうかを確認するために、約200μLのコラゲナーゼ作業溶液を分注する。コラゲナーゼ溶液がダクトを充填し始める場合( 図1C-1及びC2)、針が管の内腔です。動脈止血クランプを用いて針を含むダクトセグメントをクランプし、残り2分間の溶液を1分以内にゆっくりと一定の速度で分配する( 図2A -1 、 A-2およびB-1 )。
注:ダクトを取り囲む組織が膨張し始めると( 図2B -2 )、ニードルは胆管の壁を突き刺し、ニードルの位置を変えて胆管を再びカニューレに挿入する必要があります。同様に、十二指腸が膨張し始めると( 図2C -1およびC-2 )、動脈止血クランプを調節し、胆管を再度カニューレ挿入する必要がある。コラゲナーゼ溶液が膵臓を満たしているので、十二指腸近傍の組織が最初に膨張し、続いてレジオnは膵尾付近にある。島の収量を最大にするためには、膵尾(脾臓葉)の灌流が重要である。 - 膵臓が完全に膨張した後( 図2C -1 )、腸をマウスの左側に押し、下行結腸から始めて膵臓を除去する。鉗子を使用して腸を持ち上げ、別の鉗子のペアで膵臓から分離します。胃の上部から外れるまで膵臓を引き続き除去する。最後に、腹部から膵臓を持ち上げ、残りの脾臓からそれを切り取る。
注:除去プロセス中に消化が続行されるので、分離全体を迅速に実行する必要があります。 - 膵臓を空の15mLコニカルチューブに入れ、氷上に放置する。残りのマウスについて上記の手順を繰り返します。すべての膵臓は、コラゲナーゼPによる過剰消化を防ぐために、直ちにステップ1.3に従うことによって1時間以内にさらに処理しなければならない。/ li>
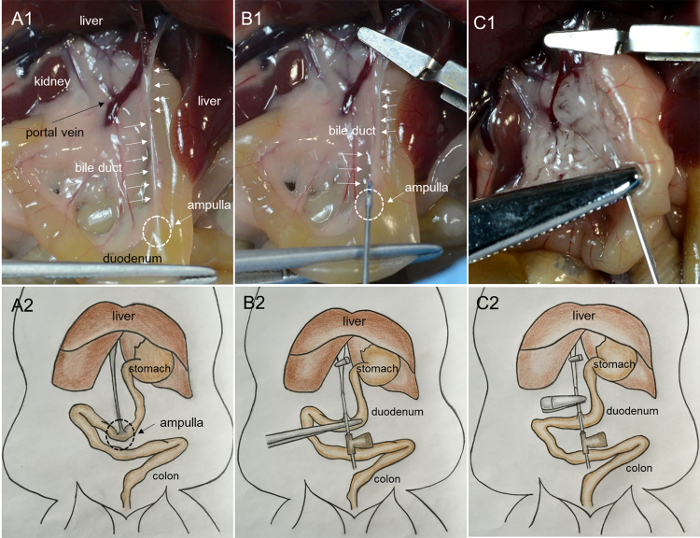
図1: 胆管のカニューレ挿入およびコラゲナーゼ溶液を用いた膵臓の灌流を示す写真。 ( A1 )胆管が緊張するまで十二指腸を引っ張る。 (膨張:十二指腸の表面上の三角形、乳白色の領域;胆管:表面上の紐のような乳状構造)。 ( B1 )アンプルから胆管に針を挿入する。 ( C1 )酵素を注入して膵臓を膨らませる。 ( A2、B2、およびC2 )それぞれA1、B1、およびC1に示す手順の漫画画像。 この図の拡大版を見るには、ここをクリックしてください。
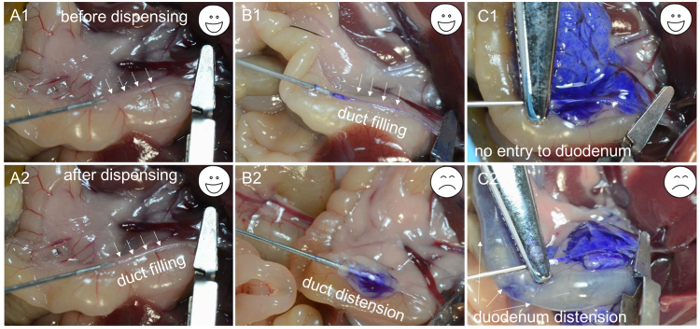
図2: カニューレ挿入のトラブルシューティング ( A1 )胆管の管腔内に挿入された針先端部。 ( A2 )酵素溶液で満たされたダクト。 ( B1 )胆管の内腔に挿入された針、および青色染料で満たされた管。 ( B2 )不適切なカニューレ挿入のために、針は胆管の下にあり、青色染料を投与した後に膨張したカプセルのみが観察される。 ( C1 )成功したカニューレ挿入は、膵臓の膨張によって証明される。 ( C2 )不適切な締め付けのために、青色染料が十二指腸に入り、膨張を引き起こす。 この図の拡大版を見るには、ここをクリックしてください。
- <強い>膵島の消化と浄化。
- 灌流した膵臓を含む円錐管を37℃で17分間インキュベートする。
注:インキュベーション時間は、動物の年齢および種によって変化し得る。 - 中和溶液7 mLを添加し、チューブを氷上に置いて消化を終了する。
- 微細な組織粒子が得られるまで、管を激しく振盪する( 例えば、 10秒で 20回)ことにより組織を解離させる。
注:膵臓が完全に解離しない場合、島の収量は低くなります。 - 消化された組織サンプルを0.5 mmの金網でろ過して、消化されていない組織チャンクを取り除きます。新たな50mLコニカルチューブに島懸濁液を集める。
- 230xgおよび4℃で3分間チューブを遠心分離し、上清を注意深く注ぎ、組織ペレットを乱さないでください。
- 4mLのポリスクロース密度勾配の3匹のマウスからのペレットを静かにボルテックスするか、またはpサスペンションを上下に数回上下に動かします。ゆっくりと4mLのHBSSをチューブの側面からポリスクロース溶液の上部にピペットで移す。
注記:2つのソリューションは、鮮明なインタフェースを持つよく分離されたレイヤーである必要があります。
注:HBSSの添加は、底部のポリスクロース密度勾配を乱すことなく、注意して行う必要があります。 - 非常に遅い加速速度を選択して、サスペンションを900 xgおよび4°Cで20分間遠心します。ブレーキなしで遠心分離を終了する。
注:これは、外分泌細胞から膵島を精製するための工程であり、ほとんどの膵島はポリスクロースとHBSSの層の間の界面に移動し、大部分の外分泌細胞は底に沈着する。 - 大口径の15 mLピペットを使用して、8 mLの上清溶液の全体を除去する。溶液を逆さまの70μmのストレーナーに通します。
注:膵島は、ストレーナーによってさらに精製され、保持され、外分泌細胞フィルタを通過します。
注意:polysucorse密度勾配は細胞毒性です。ろ過は島がポリスクロースを取り除くのを助けるでしょう。 - 冷中和溶液2 mLを35 mmペトリ皿に注ぎます。セルストレーナーを裏返しに反転させ、溶液中の膵島を保持する表面を浸し、ゆっくりと振り、膵島を解放する。
- 白い先端を有する20μLのピペットを用いて、島の中で島を手で選ぶ。
注:膵島は黄色がかったコンパクトな細胞凝集体であり( 図3A )、夾雑する外分泌組織または細胞は、解剖顕微鏡下で黒っぽくゆるい構造を有する。 - 培養培地2mLを含む35mmディッシュに約200の小島を置き、5%CO 2を供給したインキュベーターで37℃で12時間インキュベートする。
注:通常、150-300島は12週齢のC57BL / 6Jマウス1匹から採取することができます。島は、培養中に凝集物を形成する傾向があり、大きな膵島(>300μm)は中枢壊死の影響を受けやすい( 図1B 、挿入図)。サスペンションをよく振って、ディッシュ内の島を均等に分配し、凝集を減らします。
- 灌流した膵臓を含む円錐管を37℃で17分間インキュベートする。
2.足場上での島の培養
注:DCSは、約79%の多孔度、約0.6mmの厚さ、および12〜300μmの範囲の孔径を有する。
- 足場を7 mmディスクに切断し、70%エタノールに浸し、HBSSで洗浄する。足場を24ウェル組織培養インサートに入れる。
注:一晩の培養後に新鮮な島が回収されると、島は滑らかな境界で明るくタイトに見えます( 図3B )。 - 皿を振り、白い先端の20μLピペットを使用して皿の中心から膵島を集める。ピペットを使用して島を足場(250の島/足場)に移し、2mLの培地を井戸移植の12時間前に膵島を培養する。
3. EFPサイトでの島移植
- レシピエントマウスにおける糖尿病誘発。
- C57BL / 6Jマウス(10週齢以上)を、水が供給されているが食べ物のない新しいケージに入れる。糖尿病の誘発の10時間前にマウスを速める。
- 0.1Mクエン酸と0.1Mクエン酸ナトリウムを混合することにより、4.2〜4.5のpH値を有する緩衝溶液を調製する。新たに調製した緩衝液にSTZ(10mg / mL)を溶解し、それを0.22μmフィルターに通して滅菌する。
注:STZは光感受性であり、10分以内に活性を失う。注射直前に新鮮なSTZ溶液を調製してください。 - 各C57BL / 6Jマウスについて、140〜150mg / kgの用量で各マウスにSTZを腹腔内注射する。
注:用量は、動物の年齢および種によって異なる。小規模な線量最適化を行うことをお勧めします最初の実験を開始する前に、与えられた種のためのst。 - 尾静脈血を収集し、STZ注射後2、3、および4日目にグルコースメーターで血糖をモニターする。
注:動物が2日間連続して高血糖(非空腹時血糖> 16.7 mM)である場合、島移植の準備が整います。
- アイレットのEFP部位への移植。
- ペントバルビタールを腹腔内(50mg / kg)送達してマウスを麻酔する。マウスをペイントタオルの仰臥位に置き、尾がオペレータの方を向くようにします。切開部位の周りから毛皮を除去するために腹部を広範囲に剃る。 4つの四肢をテープで覆い、交互のアルコールとヨードフォアワイプを完全に皮膚を綿棒で切って切開部位を滅菌します。マウスを滅菌ドレープで覆い、切開領域へのアクセスのみを許可する。腹壁を通って7mmの切開を正中線、生殖器領域に近い。
注:手袋を含む手術中に使用されるすべての器具は無菌でなければなりません。 - 鉗子を使って腹腔からEFPを静かにつかみ、取り除く。湿った滅菌ガーゼ上にEFPを広げる。島を含む足場をEFP上に置き、移植片を包むようにEFPを折り畳む。吸収可能な6-0縫合糸でEFPを縫合することにより、島とEFPとの間の直接接触を確保する。浸した綿棒を使用して滅菌生理食塩水でEFPの表面を湿らせ、EFPが乾燥するのを防止する。
- ゆっくりとEFPを腹腔内に戻す。腹膜壁を縫合し、真皮層を創傷クリップで締め付けて切開部を閉じる。
- ブプレノルフィン(0.1mg / kg)を鎮痛剤として皮下注射する。
- 脱水を防ぐために1mLの生理食塩水を皮下注射する。
- マウスが麻酔から回復するまで、加熱パッド上のケージにマウスを置く。
- 非空腹時血糖値をチェックする尾静脈から血液を採取することにより、2日後に細胞を吸う。グラフトを回収する場合は、上記の移植手順を繰り返し、EFPを静かに引き出し、3-0縫合を使用して、副睾丸に隣接する脂肪パッドの末端を結紮し、血管を閉塞し、EFP移植片を外植し、組織学のために保存する。
注:膵島を摘出することは、移植片の機能を確認するために、レシピエントマウスを3日以内に再び高血糖にさせるべきである。
- ペントバルビタールを腹腔内(50mg / kg)送達してマウスを麻酔する。マウスをペイントタオルの仰臥位に置き、尾がオペレータの方を向くようにします。切開部位の周りから毛皮を除去するために腹部を広範囲に剃る。 4つの四肢をテープで覆い、交互のアルコールとヨードフォアワイプを完全に皮膚を綿棒で切って切開部位を滅菌します。マウスを滅菌ドレープで覆い、切開領域へのアクセスのみを許可する。腹壁を通って7mmの切開を正中線、生殖器領域に近い。
結果
顕微鏡止血クランプを使用して実施されたクランプ法は、縫合ライゲーション法と比較して簡単で時間が節約できます。 6匹のマウスから約1,200個の膵島を単離および精製するのに約4時間を要した。新たに単離された島は、典型的には、光学顕微鏡( 図3A )下で粗い周辺部を有していた。島が分離プロセスから回収されると、それらは明るくて?...
ディスカッション
膵臓の灌流および消化時間は、膵島の収量および品質に影響を及ぼす2つの重要なパラメーターである。 Moskalewskiは最初に、細かいモルモット膵臓を消化するための粗コラゲナーゼ混合物の使用を報告した11 。 Lacy ら膵臓を灌流するためのダクト系への酵素の注入を報告した。これは膵島収量を大幅に増加させた12 。酵素の導管潅流がより均一消化み...
開示事項
著者は何も開示することはない。
謝辞
著者はGuanhao BiotechのWei Zhangに脱細胞化された足場を提供してくれたことに感謝したいと思います。私たちは、ポン・ホン・ポンに感謝しています。この研究は、中国国立自然科学財団(プロジェクトNo.31322021)によって財政的に支援されました。
資料
| Name | Company | Catalog Number | Comments |
| Dissecting scissor | Ningbo Medical | ||
| Forceps | Ningbo Medical | ||
| 0.5 mm diameter wire mesh | Ningbo Medical | ||
| 70 μm cell strainer | Falcon | 352350 | |
| Artery hemostatic clamp | Ningbo Medical | ||
| Microscopic hemostatic clamp | Ningbo Medical | ||
| Hemostatic forceps | Ningbo Medical | ||
| Absorbable 6-0 PGLA sutures | JINHUAN | With needle | |
| Wound clip | Ningbo Medical | ||
| Cotton swab | Ningbo Medical | ||
| Gauze | Ningbo Medical | ||
| Sterile drapes | Ningbo Medical | ||
| 10mL syringe | JINGHUAN | ||
| 1 mL syringe | JINGHUAN | ||
| 27G intravenous needle | JINGHUAN | 0.45x15 RWSB | |
| 1.5 mL Eppendorf tube | Axygen | ||
| 15mL conical tube | Corning | 430791 | |
| 50mL conical tube | Corning | 430829 | |
| 35mm Non-treated Peri-dishes | Corning | 430588 | |
| Transwell | Corning | 3422 | |
| 0.22 μm filter | Pall | PN4612 | |
| 10 mL serological pipet | Corning | 4488 | |
| Pipet filler S1 | Thermo Scientific | 9501 | |
| Pipette (2-20μL) | Axygen | AP-20 | AXYPETTM |
| Dissecting microscope | Olympus | SZ61 | |
| Centrifuge | Eppendorf | 5810R | |
| Hank’s balanced salt solution | Gibco | C14175500CP | |
| Collagenase P | Roche | COLLP-RO | |
| Histopaque 1077 | Sigma | 10771 | |
| RPMI 1640 | Gibco | 11879-20 | |
| FBS | Gibco | 16000-044 | |
| D-glucose | Gibco | A24940-01 | |
| Glucose meter | Roche | ACCU-CHEK | |
| Penicillin-streptomycin | Gibco | 15140-122 | |
| Streptozotocin | Sigma | V900890 | VetecTM |
| Chloral hydrate | J&K | C0073 | |
| Sodium citrate | Sigma | 71497 | |
| Citric acid | Sigma | C2404 | |
| Iodophors | Ningbo Medical | ||
| C57BL/6J, 10-12 weeks old | VitalRiver | Beijing, China | |
| Decellularized scaffold | Guanhao Biotec | 131102 | Guangzhou, China |
参考文献
- Shapiro, A. M., et al. Islet transplantation in seven patients with type 1 diabetes mellitus using a glucocorticoid-free immunosuppressive regimen. N Engl J Med. 343, 230-238 (2000).
- Shapiro, A. M. J., et al. International Trial of the Edmonton Protocol for Islet Transplantation. N Engl J Med. 355, 1318-1330 (2006).
- Ryan, E. A., et al. Five-year follow-up after clinical islet transplantation. Diabetes. 54, 2060-2069 (2005).
- Merani, S., Toso, C., Emamaullee, J., Shapiro, A. M. Optimal implantation site for pancreatic islet transplantation. Br J Surg. 95, 1449-1461 (2008).
- Schmidt, C. Pancreatic islets find a new transplant home in the omentum. Nat Biotechnol. 35 (1), (2017).
- Dufour, J. M., et al. Development of an ectopic site for islet transplantation, using biodegradable scaffolds. Tissue Eng. 11, 1323-1331 (2005).
- Weaver, J. D., et al. Controlled Release of Dexamethasone from Organosilicone Constructs for Local Modulation of Inflammation in Islet Transplantation. Tissue Eng Part A. 21, 2250-2261 (2015).
- Wang, K., et al. From Micro to Macro: The Hierarchical Design in a Micropatterned Scaffold for Cell Assembling and Transplantation. Adv Mater. 29, (2017).
- Blomeier, H., et al. Polymer Scaffolds as Synthetic Microenvironments for Extrahepatic Islet Transplantation. Transplantation. 82, 452-459 (2006).
- Gibly, R. F., et al. Extrahepatic islet transplantation with microporous polymer scaffolds in syngeneic mouse and allogeneic porcine models. Biomaterials. 32, 9677-9684 (2011).
- Moskalewski, S. Isolation and Culture of the Islets of Langerhans of the Guinea Pig. Gen Comp Endocrinol. 5, 342-353 (1965).
- Lacy, P. E., Kostianovsky, M. Method for the isolation of intact islets of Langerhans from the rat pancreas. Diabetes. 16, 35-39 (1967).
- Zmuda, E. J., Powell, C. A., Hai, T. A Method for Murine Islet Isolation and Subcapsular Kidney Transplantation. J Vis Exp. (50), (2011).
- Li, D. S., Yuan, Y. H., Tu, H. J., Liang, Q. L., Dai, L. J. A protocol for islet isolation from mouse pancreas. Nat Protoc. 4, 1649-1652 (2009).
- Stull, N. D., Breite, A., McCarthy, R., Tersey, S. A., Mirmira, R. G. Mouse Islet of Langerhans Isolation using a Combination of Purified Collagenase and Neutral Protease. J Vis Exp. (67), (2012).
- Sakata, N., Yoshimatsu, G., Tsuchiya, H., Egawa, S., Unno, M. Animal models of diabetes mellitus for islet transplantation. Exp Diabetes Res. , 256707 (2012).
- Schmidt, C. Pancreatic islets find a new transplant home in the omentum. Nat Biotech. 35, 8-8 (2017).
- Londono, R., Badylak, S. F. Biologic scaffolds for regenerative medicine: mechanisms of in vivo remodeling. Ann Biomed Eng. 43, 577-592 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved