Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Подмороженная трансплантация островков в эпидидимальной жировой клетке диабетических мышей
В этой статье
Резюме
Этот протокол демонстрирует изоляцию мышиного островка и посев на дезаклеарном эшафоте. Осадки, поддерживаемые эшафотом, трансплантировали в эпидидимальную жировую площадку стрептозотоцина (STZ) -индуцированных диабетических мышей. Островки выживали на участке трансплантации и меняли гипергликемическое состояние.
Аннотация
Было доказано, что трансплантация островков эффективна при лечении диабета 1 типа. Тем не менее, нынешняя стратегия внутрипеченочной трансплантации может иметь острую реакцию цельной крови и приводить к плохому приживлению островков. Здесь мы сообщаем о надежном протоколе для трансплантации островков на внепеченочном участке трансплантации - эпидидимальной жировой подушке (EFP) - в модели диабетической мыши. Описан протокол для выделения и очистки островков с высоким выходом от мышей C57BL / 6J, а также метод трансплантации, выполняемый посевными островками на дезаклеарный каркас (DCS) и имплантация их на сайт EFP у сингенных мышей C57BL / 6J, которые были диабетическими Стрептозотоцином. Трансплантат DCS, содержащий 500 островков, перевернул гипергликемическое состояние в течение 10 дней, в то время как свободные островки без DCS требовали не менее 30 дней. Нормогликемия поддерживалась на срок до 3 месяцев, пока не был эксплантирован трансплантат. В заключение DCS усилило приживление островков в tОн внепеченочный сайт EFP, который можно легко получить и может обеспечить воспроизводимую и полезную платформу для исследования материалов лесов, а также другие параметры трансплантации, необходимые для успешного приживления островков.
Введение
Сахарный диабет 1 типа (T1D) является аутоиммунным эндокринным расстройством, в котором островковые клетки удаляются иммунной системой, что делает пациентов зависимыми от инъекции экзогенного инсулина на всю жизнь. Протокол Эдмонтона представляет собой веху в клинических исследованиях трансплантации островков; Островки вводили через портальную вену и трансплантировали на внутрипеченочном участке 1 . Однако два основных препятствия - неадекватные источники островков-доноров и плохое приживление островков - препятствуют широкому успеху трансплантации островков 2 . Как правило, островки необходимо собирать у трех доноров трупы, чтобы отменить гипергликемическое состояние одного пациента; Это связано с низким выходом процедур изоляции островков и потерями островков после трансплантации. В частности, хотя островки после трансплантации были омыты богатой кислородом кровью, прямой контакт с кровью часто вызывал мгновенную опосредованную кровью инфаркта(IBMIR), что может вызвать острую потерю островков. В долгосрочной перспективе считается, что постепенная потеря островков у пациентов объясняла снижение показателей реверсии диабета в клинических группах, которые могли достичь 90% в первый год и снизились до 30% и 10% на 2 и 5 Лет после трансплантации, соответственно 3 .
Трансплантация островков на внепеченочных участках была привлекательной стратегией для уменьшения прямого контакта островков с кровью, ограничивая трансплантацию до более определяемых мест по сравнению с внутрипеченочной инфузией. В последние годы исследования были проведены в капсулах для почек, глазных мышцах, мышцах, жировых клетках и подкожных клетках, что свидетельствует о том, что островки на этих участках способны выжить и функционировать для восстановления нормогликемии 4 . Кроме того, островки на этих участках извлекаются, что позволяет проводить биопсию или даже для дальнейших процедур замены. ВнепеченочныеПоэтому он демонстрирует большой потенциал для клинической трансплантации 5 .
Исследования на основе биоматериалов интенсивно изучались для трансплантации клеток и тканевой инженерии. Трехмерные (3D) леса обычно содержат пористые структуры и могут служить в качестве клеточных шаблонов для создания пространственной структуры / организации клеток или в качестве резервуаров для обеспечения контролируемого высвобождения биоактивных сигналов. Леса также были изготовлены из полимерных материалов, таких как поли (гликолид-L-лактид) 6 , поли (диметилсилоксана) 7 и термопластичный поли (уретан) 8 , в трансплантационные островки в EFP. Было обнаружено, что по сравнению с прямой трансплантацией островков было обнаружено, что использование подмостей уменьшает потери островков, предотвращая утечку островков во внутрибрюшинную полость 9 , 10 , обеспечивая механическую защиту и модулюЛокализуя местную воспалительную реакцию. Таким образом, строительные леса могут быть разработаны для содействия приживлению островков на участках трансплантации 7 .
В этом исследовании мы намерены продемонстрировать парадигму трансплантации островков в EFP, проводимую в моделях мышей с использованием DCS. Леса, полученные из внеклеточных матриц, в последние годы вызвали большой интерес благодаря превосходной биосовместимости и более естественным пористым структурам по сравнению с синтетическими продуктами. Здесь мы описываем надежный протокол изоляции для получения островков поджелудочной железы с высоким выходом у мышей C57BL / 6J. DCS, обработанные из бычьего перикарда, затем засевали островками, и трансплантаты были трансплантированы в EFP в сингенных диабетических моделях. Нормогликемия у мышей была достигнута в течение 10 дней и поддерживалась до 100 дней до удаления трансплантатов.
протокол
Все эксперименты были одобрены Комитетом по институциональному уходу и использованию животных в Пекине (IACUC, IACUC no COE-LuoY-1).
1. Изоляция островков
- Подготовка реагентов и оборудования.
- Восстановить порошок коллагеназы P (2 ед. / Мг) в HBSS для приготовления раствора 5 мг / мл и фильтровать его через фильтр 0,22 мкм для удаления бактерий. Подготовьте 0,6 мл-аликвотные растворы коллагеназы Р в 15-мл конических пробирках и храните при -20 ° C.
ПРИМЕЧАНИЕ. Во время использования каждую аликвоту разбавляют HBSS с получением 6 мл рабочих растворов с конечными концентрациями 0,5 мг / мл или 1 ед. / Мл (достаточно для лечения 3 мышей). Рабочий раствор хранится на льду для немедленного использования в течение 1 часа. Рабочее решение не должно быть восстановлено или повторно заморожено для дополнительного использования. - Подготовьте раствор нейтрализации путем добавления FBS (2,5%) и P / S (1%) в HBSS; Держите раствор на льду. Подготовьте 60 мл нейтрализующего раствора для обработкиT 6 мышей.
- Для культуральной среды островка добавляют D-глюкозу (7 мМ), FBS (10%) и P / S (1%) в среду RPMI 1640.
- Автоклав хирургических инструментов при 115 ° C в течение 30 минут и 15 фунтов на квадратный дюйм давления.
- Восстановить порошок коллагеназы P (2 ед. / Мг) в HBSS для приготовления раствора 5 мг / мл и фильтровать его через фильтр 0,22 мкм для удаления бактерий. Подготовьте 0,6 мл-аликвотные растворы коллагеназы Р в 15-мл конических пробирках и храните при -20 ° C.
- Инфляция поджелудочной железы.
- Подготовьте 12 мл рабочего раствора коллагеназы, как указано на шаге 1.1.1, для 6 мышей (12 недель). Заполните 10 мл шприца 9 мл рабочего раствора и соедините шприц с внутривенной иглой 27 G. Храните шприц на льду и используйте раствор в течение 1 часа.
- Усыплять мышцы шейным дислокацией. Поместите мышь в лежачее положение на бумажном полотенце, хвост указывает на оператора. Распылите все тело 70% этанолом, сделав его полностью влажным.
- Сделайте V-разрез, начиная с области гениталий и распространяясь на диафрагму, используя ножницы для вскрытия и щипцы. Сложите кожу над сундуком, чтобы полностью открыть брюшную полость.
- ПереехатьКишечника с правой стороны мыши и выставить поджелудочную железу и общий желчный проток. Прихватите двенадцатиперстной кишку осторожно с помощью щипцов и потяните ее до тех пор, пока желчный канал не станет тугим ( рис. 1А- 1 и А-2 ).
- Найти портал вены и желчных протоков, ведущих в печень. Закрепите портальную вену и желчный канал микроскопическим гемостатическим зажимом.
ПРИМЕЧАНИЕ. Зажим предотвращает чрезмерное кровотечение и попадание коллагеназы в печень. - Пока держите кисть с помощью щипцов, найдите расположение ампулы, соединяющей желчный проток и двенадцатиперстную кишку. Вставьте 27G внутривенную иглу в общий желчный проток через ампулу ( рис. 1B -1 и B-2 ).
- Внесите около 200 мкл рабочего раствора коллагеназы, чтобы проверить, полностью ли канюлирование проходит через желчный канал. Если раствор коллагеназы начинает заполнять канал ( Рисунок 1C- 1 и C2 ), игла находится в просвете канала; Зажмите сегмент канала, содержащий иглу, используя гемостатический зажим артерии и распределите оставшуюся часть 2 мл раствора с медленной и постоянной скоростью в течение 1 мин ( рис. 2А- 1 , А-2 и В-1 ).
ПРИМЕЧАНИЕ. Если ткань, окружающая канал, начинает раздуваться ( рис. 2B -2 ), игла пробивается сквозь стенку желчного протока, что делает необходимым переместить иглу и снова попытаться выполнить канюлирование желчного протока. Аналогично, если двенадцатиперстная кишка начинает накачиваться ( рис. 2C- 1 и C-2 ), необходимо отрегулировать гемостатический зажим артерии, и желчный канал повторно канюлировать. Когда раствор коллагеназы заполняет поджелудочную железу, ткань около двенадцатиперстной кишки сначала раздувается, а затем регистрируетсяN около хвоста поджелудочной железы. Перфузия хвоста поджелудочной железы (селезеночная лопасть) важна для максимизации выхода островков. - После полной инфляции поджелудочной железы ( рис. 2С- 1 ) подтолкните кишечник к левой стороне мыши и удалите поджелудочную железу, начиная с нисходящей ободочной кишки. Используйте щипцы, чтобы поднять кишку и отделить ее от поджелудочной железы с помощью другой пары щипцов. Продолжайте снимать поджелудочную железу, пока она не будет прикреплена к верхней части желудка. Наконец, поднимите поджелудочную железу из брюшной полости и освободите ее от остальной селезенки.
ПРИМЕЧАНИЕ. Все разделение следует выполнять быстро, так как расщепление продолжается во время процесса удаления. - Поместите поджелудочную железу в пустую 15-мл коническую трубку и оставьте на льду. Повторите описанную выше процедуру для оставшихся мышей. Все поджелудочную железу следует дополнительно обработать в течение 1 часа, быстро следуя шагу 1.3, чтобы предотвратить чрезмерное переваривание коллагеназой P.
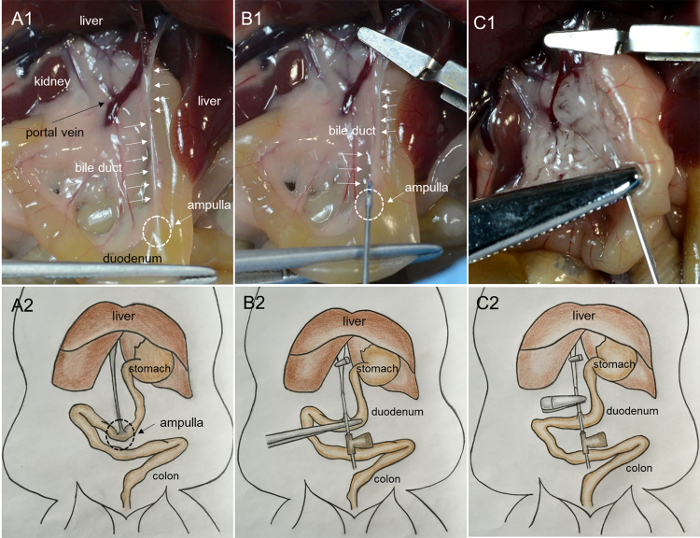
Рисунок 1: Фотографии, показывающие канюлю желчного протока и перфузию поджелудочной железы с помощью растворов коллагеназы. ( A1 ) Вытягивание двенадцатиперстной кишки до тех пор, пока желчный проток не станет напряженным. (Ампула: треугольная, молочная область на поверхности двенадцатиперстной кишки, желчный проток: пуховидная молочная структура на поверхности). ( B1 ) Вставка иглы в желчный проток из ампулы. ( C1 ) Надувание поджелудочной железы инъекцией фермента. ( A2, B2 и C2 ) Мультяшные изображения процедур, показанных в A1, B1 и C1, соответственно. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
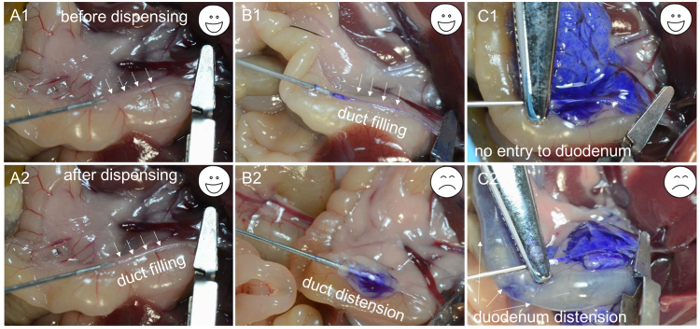
Рисунок 2: Устранение неполадок для канюлирования. ( A1 ) Кончик иглы вставлен в просвет желчного протока. ( A2 ) Канал, заполненный ферментными растворами. ( B1 ) Игла вставлена в просвет желчного протока, а канал заполнен синим красителем. ( B2 ) Из-за неправильной канюлирования игла находится под желчным протоком, и после раздачи синего красителя наблюдается только накачанная капсула. ( C1 ) Успешная канюляция подтверждается растяжением поджелудочной железы. ( C2 ) Из-за неправильного зажима синий краска входит в двенадцатиперстную кишку и вызывает вздутие. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- <Сильный> Пищеварение и очистка островков.
- Инкубируйте конические пробирки, содержащие перфузированную поджелудочную железу при 37 ° С в течение 17 мин.
ПРИМЕЧАНИЕ. Время инкубации может варьироваться в зависимости от возраста и видов животных. - Прекратите расщепление, добавив 7 мл нейтрализующего раствора и положив трубки на лед.
- Диссоцианируйте ткань, энергично встряхивая пробирки ( например, 20 раз за 10 с) до получения мелких частиц ткани.
ПРИМЕЧАНИЕ. Выход островки будет низким, если поджелудочная железа полностью не будет диссоциировать. - Отфильтруйте расщепленные образцы тканей с помощью проволочной сетки толщиной 0,5 мм, чтобы удалить любые непереваренные кусочки ткани. Соберите суспензии островков в новой конической трубке 50 мл.
- Центрифугируйте пробирки в течение 3 минут при 230 xg и 4 ° C и аккуратно вылейте надосадочную жидкость, не нарушая тканевые гранулы.
- Ресуспендируют гранулы от 3 мышей в 4 мл градиента плотности полисухарозы, слегка встряхивая или pIpetting подвеска вверх и вниз несколько раз. Медленно пипетируйте 4 мл HBSS по бокам трубки до верхней части растворов полисухарозы.
ПРИМЕЧАНИЕ. Два решения должны быть хорошо разделены слоями с четким интерфейсом.
ПРИМЕЧАНИЕ. Добавление HBSS должно выполняться с осторожностью, не нарушая градиент плотности полисухарозы на дне. - Центрифугируйте суспензию в течение 20 минут при 900 xg и 4 ° C, выбирая очень медленную скорость ускорения. Завершите центрифугирование без тормоза.
ПРИМЕЧАНИЕ. Это шаг для очистки островков от экзокринных клеток, причем большинство островков мигрируют к границе между слоями полисахарозы и HBSS и большинством экзокринных клеток, оседающих на дне. - Удалите весь раствор супернатантов с 8 мл, используя пипетку с большим объемом 15 мл. Проходите решения через инвертированный фильтр на 70 мкм.
ПРИМЕЧАНИЕ. Островки будут дополнительно очищены и сохранены фильтром, в то время как экзокринные клеткиБудет проходить через фильтр.
Осторожно: градиент плотности полисускорса токсичен клетками; Фильтрация поможет островкам избавиться от полисухарозы. - Внесите 2 мл раствора для нейтрализации холодной воды в 35-миллиметровую чашку Петри. Инвертируйте сетчатый фильтр прямо вверх, опустите поверхность, удерживая островки в растворе, и осторожно встряхните, чтобы освободить островки.
- С помощью пипетки размером 20 мкл с белым наконечником вытащите островки под микроскоп.
ПРИМЕЧАНИЕ. Островки представляют собой желтоватые, компактные клеточные агрегаты ( рис. 3А ), в то время как загрязняющая экзокринная ткань или клетки имеют черноватую и рыхлую структуру под рассекающим микроскопом. - Поместите около 200 островков в 35-миллиметровую чашку с 2 мл культуральной среды и инкубируйте при 37 ° С в инкубаторе, снабженном 5% СО 2 в течение 12 часов.
ПРИМЕЧАНИЕ. Обычно 150-300 островков можно собирать у одной 12-недельной мыши C57BL / 6J. Острова склонны к образованию агрегатов во время культуры,И большие островки (> 300 мкм) восприимчивы к центральному некрозу ( рис. 1В , вставка). Встряхните суспензию, чтобы равномерно распределить островки в блюде и уменьшить скопление.
- Инкубируйте конические пробирки, содержащие перфузированную поджелудочную железу при 37 ° С в течение 17 мин.
2. Культура островков на Лесах
ПРИМЕЧАНИЕ. DCS имеет пористость около 79%, толщину около 0,6 мм и размер пор от 12 до 300 мкм.
- Вырежьте леса в 7-миллиметровые диски, смочите их в 70% этаноле и промойте их HBSS. Поместите строительные леса в 24-луночные вставки для культуры тканей.
ПРИМЕЧАНИЕ. Когда свежие островки восстанавливаются после ночной культуры, островки кажутся яркими и плотными, с гладкими границами ( рисунок 3B ). - Переверните блюдо и соберите островки из центра блюда, используя пипетку 20 мкл с белым кончиком. Перенесите островки на леса (250 островков / леса) с помощью пипетки и добавьте 2 мл культуральной среды кКолодец. Культура островков за 12 ч до трансплантации.
3. Трансплантация островков на сайте EFP
- Индуцирование диабета у реципиентных мышей.
- Поместите мышей C57BL / 6J (более 10 недель) в свежую клетку с водой, но без пищи. Быстро мышей в течение 10 ч перед индукцией диабета.
- Подготовьте буферные растворы с рН 4,2-4,5 путем смешивания 0,1 М лимонной кислоты с 0,1 М цитратом натрия. Растворить STZ (10 мг / мл) в свежеприготовленном буфере и стерилизовать раствор, пропуская его через фильтр 0,22 мкм.
ПРИМЕЧАНИЕ: STZ чувствительна к свету и теряет активность в течение 10 мин; Всегда готовите свежие STZ-раствор прямо перед инъекцией. - Инъецируйте каждую мышь внутрибрюшинно STZ в дозе 140-150 мг / кг для каждой мыши C57BL / 6J.
ПРИМЕЧАНИЕ. Доза варьируется в зависимости от возраста и видов животных. Рекомендуется проводить мелкомасштабную оптимизацию дозы teДля данного вида перед началом формального эксперимента. - Соберите кровь хвостовой вены и контролируйте уровень глюкозы в крови с помощью глюкометра в день 2, 3 и 4 после инъекции STZ.
ПРИМЕЧАНИЕ. Когда животные подвергаются гипергликемическому (уровень глюкозы в крови натощак> 16,7 мМ) в течение двух последовательных дней, они готовы к трансплантации островков.
- Трансплантация островков на сайт EFP.
- Анестезируйте мышей с пентобарбиталом, поставленным внутрибрюшинно (50 мг / кг). Поместите мышь в лежачее положение на бумажном полотенце, хвост указывает на оператора. Широко брить живот, чтобы удалить мех вокруг участка разреза. Наденьте ленту на четыре конечности и полностью протирайте кожу чередующимся спиртом, а салфетки йодофора перемещаются круговым способом для стерилизации участка разреза. Нанесите мышь стерильной драпировкой, разрешая доступ только к области разреза. Сделайте разрез на 7 мм через перитонеальную стенкуСредней линии, близкой к области гениталий.
ПРИМЕЧАНИЕ. Все инструменты, используемые во время операции, включая перчатки, должны быть стерильными. - Аккуратно возьмите и удалите EFP из брюшной полости с помощью щипцов. Распределите EFP на смоченной стерильной марле. Поместите эшафот, содержащий островки, в EFP и сложите EFP, чтобы обернуть трансплантат. Обеспечьте прямой контакт между островками и EFP, зашив EFP с помощью абсорбируемых швов 6-0. Смочите поверхность EFP стерильным физиологическим раствором, используя пропитанный ватный тампон, чтобы предотвратить высыхание EFP.
- Осторожно поместите EFP обратно в брюшную полость. Закройте разрез, зашив перитонеальную стенку и закрепив дермальный слой раневыми зажимами.
- Внедрить бупренорфин (0,1 мг / кг) подкожно в качестве анальгетика.
- Внесите 1 мл физиологического раствора подкожно, чтобы предотвратить обезвоживание.
- Поместите мышь в клетку на нагревательной подушке, пока мышь не восстановится от анестезии.
- Проверьте уровень глюкозы, не находящийся натощакЧерез два дня, собирая кровь из хвостовой вены. Если вы извлекаете трансплантат, повторите описанные выше процедуры трансплантации, аккуратно вытащите EFP, используйте шов 3-0 для лигирования конца жировой прокладки, прилегающей к эпидидимису, закрывайте кровеносные сосуды, эксплантируйте трансплантат EFP и сохраните его для гистологии ,
ПРИМЕЧАНИЕ. Объяснение островков должно снова вызвать гипергликемию реципиента мышей в течение 3 дней, подтверждая функцию трансплантата.
- Анестезируйте мышей с пентобарбиталом, поставленным внутрибрюшинно (50 мг / кг). Поместите мышь в лежачее положение на бумажном полотенце, хвост указывает на оператора. Широко брить живот, чтобы удалить мех вокруг участка разреза. Наденьте ленту на четыре конечности и полностью протирайте кожу чередующимся спиртом, а салфетки йодофора перемещаются круговым способом для стерилизации участка разреза. Нанесите мышь стерильной драпировкой, разрешая доступ только к области разреза. Сделайте разрез на 7 мм через перитонеальную стенкуСредней линии, близкой к области гениталий.
Результаты
Наш метод зажима, выполненный с использованием микроскопического гемостатического зажима, прост и экономичен по времени по сравнению с методом лигирования швов. Прошло около 4 часов, чтобы выделить и очистить около 1200 островков от 6 мышей. Недавно выделенные островки ...
Обсуждение
Перфузия поджелудочной железы и время переваривания являются двумя ключевыми параметрами, которые влияют на выход и качество остэка. Moskalewski впервые сообщило об использовании сырой смеси коллагеназы для переваривания поджелудочной железы поджелудочной железы морской свинки
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы хотели бы поблагодарить Вэй Чжан из Guanhao Biotech за предоставление декоративных лесов. Мы благодарим Сяо-хон Пэн за полезные обсуждения. Это исследование было финансово поддержано Национальным фондом естественных наук Китая (проект №31322021).
Материалы
| Name | Company | Catalog Number | Comments |
| Dissecting scissor | Ningbo Medical | ||
| Forceps | Ningbo Medical | ||
| 0.5 mm diameter wire mesh | Ningbo Medical | ||
| 70 μm cell strainer | Falcon | 352350 | |
| Artery hemostatic clamp | Ningbo Medical | ||
| Microscopic hemostatic clamp | Ningbo Medical | ||
| Hemostatic forceps | Ningbo Medical | ||
| Absorbable 6-0 PGLA sutures | JINHUAN | With needle | |
| Wound clip | Ningbo Medical | ||
| Cotton swab | Ningbo Medical | ||
| Gauze | Ningbo Medical | ||
| Sterile drapes | Ningbo Medical | ||
| 10mL syringe | JINGHUAN | ||
| 1 mL syringe | JINGHUAN | ||
| 27G intravenous needle | JINGHUAN | 0.45x15 RWSB | |
| 1.5 mL Eppendorf tube | Axygen | ||
| 15mL conical tube | Corning | 430791 | |
| 50mL conical tube | Corning | 430829 | |
| 35mm Non-treated Peri-dishes | Corning | 430588 | |
| Transwell | Corning | 3422 | |
| 0.22 μm filter | Pall | PN4612 | |
| 10 mL serological pipet | Corning | 4488 | |
| Pipet filler S1 | Thermo Scientific | 9501 | |
| Pipette (2-20μL) | Axygen | AP-20 | AXYPETTM |
| Dissecting microscope | Olympus | SZ61 | |
| Centrifuge | Eppendorf | 5810R | |
| Hank’s balanced salt solution | Gibco | C14175500CP | |
| Collagenase P | Roche | COLLP-RO | |
| Histopaque 1077 | Sigma | 10771 | |
| RPMI 1640 | Gibco | 11879-20 | |
| FBS | Gibco | 16000-044 | |
| D-glucose | Gibco | A24940-01 | |
| Glucose meter | Roche | ACCU-CHEK | |
| Penicillin-streptomycin | Gibco | 15140-122 | |
| Streptozotocin | Sigma | V900890 | VetecTM |
| Chloral hydrate | J&K | C0073 | |
| Sodium citrate | Sigma | 71497 | |
| Citric acid | Sigma | C2404 | |
| Iodophors | Ningbo Medical | ||
| C57BL/6J, 10-12 weeks old | VitalRiver | Beijing, China | |
| Decellularized scaffold | Guanhao Biotec | 131102 | Guangzhou, China |
Ссылки
- Shapiro, A. M., et al. Islet transplantation in seven patients with type 1 diabetes mellitus using a glucocorticoid-free immunosuppressive regimen. N Engl J Med. 343, 230-238 (2000).
- Shapiro, A. M. J., et al. International Trial of the Edmonton Protocol for Islet Transplantation. N Engl J Med. 355, 1318-1330 (2006).
- Ryan, E. A., et al. Five-year follow-up after clinical islet transplantation. Diabetes. 54, 2060-2069 (2005).
- Merani, S., Toso, C., Emamaullee, J., Shapiro, A. M. Optimal implantation site for pancreatic islet transplantation. Br J Surg. 95, 1449-1461 (2008).
- Schmidt, C. Pancreatic islets find a new transplant home in the omentum. Nat Biotechnol. 35 (1), (2017).
- Dufour, J. M., et al. Development of an ectopic site for islet transplantation, using biodegradable scaffolds. Tissue Eng. 11, 1323-1331 (2005).
- Weaver, J. D., et al. Controlled Release of Dexamethasone from Organosilicone Constructs for Local Modulation of Inflammation in Islet Transplantation. Tissue Eng Part A. 21, 2250-2261 (2015).
- Wang, K., et al. From Micro to Macro: The Hierarchical Design in a Micropatterned Scaffold for Cell Assembling and Transplantation. Adv Mater. 29, (2017).
- Blomeier, H., et al. Polymer Scaffolds as Synthetic Microenvironments for Extrahepatic Islet Transplantation. Transplantation. 82, 452-459 (2006).
- Gibly, R. F., et al. Extrahepatic islet transplantation with microporous polymer scaffolds in syngeneic mouse and allogeneic porcine models. Biomaterials. 32, 9677-9684 (2011).
- Moskalewski, S. Isolation and Culture of the Islets of Langerhans of the Guinea Pig. Gen Comp Endocrinol. 5, 342-353 (1965).
- Lacy, P. E., Kostianovsky, M. Method for the isolation of intact islets of Langerhans from the rat pancreas. Diabetes. 16, 35-39 (1967).
- Zmuda, E. J., Powell, C. A., Hai, T. A Method for Murine Islet Isolation and Subcapsular Kidney Transplantation. J Vis Exp. (50), (2011).
- Li, D. S., Yuan, Y. H., Tu, H. J., Liang, Q. L., Dai, L. J. A protocol for islet isolation from mouse pancreas. Nat Protoc. 4, 1649-1652 (2009).
- Stull, N. D., Breite, A., McCarthy, R., Tersey, S. A., Mirmira, R. G. Mouse Islet of Langerhans Isolation using a Combination of Purified Collagenase and Neutral Protease. J Vis Exp. (67), (2012).
- Sakata, N., Yoshimatsu, G., Tsuchiya, H., Egawa, S., Unno, M. Animal models of diabetes mellitus for islet transplantation. Exp Diabetes Res. , 256707 (2012).
- Schmidt, C. Pancreatic islets find a new transplant home in the omentum. Nat Biotech. 35, 8-8 (2017).
- Londono, R., Badylak, S. F. Biologic scaffolds for regenerative medicine: mechanisms of in vivo remodeling. Ann Biomed Eng. 43, 577-592 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены