Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Transplantation soutenue d'échafaudage d'îlots dans la pate épididimale de souris diabétiques
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole démontre l'isolation des îlots murins et le semis sur un échafaud décellularisé. Les îlots soutenus par des échafaudages ont été transplantés dans la pate épididymique des souris diabétiques induites par la streptozotocine (STZ). Les îlots ont survécu au site de transplantation et ont inversé l'état hyperglycémique.
Résumé
La transplantation d'islet a été cliniquement prouvée pour être efficace dans le traitement du diabète de type 1. Cependant, la stratégie actuelle de transplantation intra-hépatique peut entraîner des réactions aigues du sang total et entraîner une mauvaise greffe d'îlot. Ici, nous signalons un protocole robuste pour la transplantation d'îlots sur le site de transplantation extrahépatique - le tampon gras épididymal (EFP) - sur un modèle de souris diabétique. Un protocole d'isolement et de purification des îlots aux rendements élevés de souris C57BL / 6J est décrit, ainsi qu'une méthode de transplantation réalisée par ensemencement d'îlots sur un échafaud décellularisé (DCS) et l'implantation au site EFP dans des souris C57BL / 6J syngéniques rendues diabétiques Par streptozotocine. Le greffon DCS contenant 500 îlots a inversé l'état hyperglycémiant dans les 10 jours, alors que les îlots libres sans DCS nécessitaient au moins 30 jours. La normoglycémie a été maintenue jusqu'à 3 mois jusqu'à ce que le greffon soit explanté. En conclusion, DCS a amélioré la greffe d'îlots en tLe site extrahépatique de l'EFP, qui pourrait facilement être récupéré et pourrait fournir une plate-forme reproductible et utile pour l'étude des matériaux d'échafaudage, ainsi que d'autres paramètres de transplantation requis pour une greffe d'îlot réussie.
Introduction
Le diabète mellitus de type 1 (T1D) est un trouble endocrinien auto-immune dans lequel les cellules d'îlot sont éliminées par le système immunitaire, ce qui rend les patients dépendants de l'injection d'insuline exogène pendant toute leur vie. Le protocole d'Edmonton représente un jalon dans les études cliniques de transplantation d'îlots; Les îlots ont été infusés à travers la veine porte et ont été transplantés au site intra-hépatique 1 . Cependant, deux principaux obstacles - sources insuffisantes d'îlots de donneurs et de greffe d'islet pauvres - empêchent le grand succès de la transplantation d'îlots 2 . Habituellement, les îlots doivent être collectés auprès de trois donneurs cadavériques pour inverser l'état hyperglycémique d'un patient; Ceci est dû au faible rendement des procédures d'isolement et à la perte d'îlot après la transplantation. En particulier, bien que les îlots post-transplantation soient baignés dans du sang riche en oxygène, le contact direct avec le sang a souvent provoqué l'inflammation induite par le sang instantané(IBMIR), ce qui pourrait provoquer une perte aigüe des îlots. À long terme, on pense que la perte progressive d'îlots chez les patients représentait la baisse des taux d'inversion du diabète dans les groupes cliniques, qui pourrait atteindre 90% en première année et a diminué à 30% et 10% par 2 et 5 Ans après la transplantation, respectivement 3 .
La transplantation d'islet sur des sites extra-hépatiques a été une stratégie attrayante pour réduire le contact direct des îlots avec du sang tout en confinant les transplantations à des endroits plus définissables par rapport à la perfusion intra-hépatique. Des études ont été menées dans la capsule du rein, des yeux, des muscles, des graisses et des espaces sous-cutanés au cours des dernières années, ce qui montre que les îlots sur ces sites peuvent survivre et fonctionner pour restaurer la normoglycémie 4 . En outre, les îlots sur ces sites sont récupérables, ce qui permet une biopsie ou même pour d'autres procédures de remplacement. Extraheptique sPar conséquent, il existe un grand potentiel de transplantation clinique 5 .
Des échafaudages à base de biomatériaux ont été intensément étudiés pour la transplantation cellulaire et l'ingénierie tissulaire. Les échafaudages tridimensionnels (3D) contiennent généralement des structures poreuses et peuvent servir de modèles cellulaires pour générer une structure spatiale / organisation de cellules ou des réservoirs pour fournir la libération contrôlée de repères bioactifs. Les échafaudages ont également été fabriqués à partir de matériaux polymères tels que le poly (glycolide-L-lactide) 6 , le poly (diméthylsiloxane) 7 et le poly (uréthane) thermoplastique 8 , pour transplanter les îlots dans l'EFP. Par rapport à la transplantation directe d'îlots, on a constaté l'utilisation d'échafaudages pour réduire la perte d'îlots en empêchant la fuite d'îlots dans la cavité intrapéritonéale 9 , 10 , en fournissant une protection mécanique et une moduLiant la réaction inflammatoire locale. Les échafaudages peuvent donc être développés pour favoriser la greffe d'islet sur les sites de transplantation 7 .
Dans cette étude, nous avons l'intention de démontrer un paradigme de la transplantation d'îlots dans l'EFP, réalisée dans des modèles de souris utilisant un DCS. Les échafaudages dérivés de matrices extracellulaires ont suscité un grand intérêt au cours des dernières années en raison de la biocompatibilité supérieure et des structures poreuses plus naturelles par rapport aux produits synthétiques. Ici, nous décrivons un protocole d'isolement robuste pour obtenir des îlots pancréatiques à des rendements élevés chez les souris C57BL / 6J. Les DCS fabriqués à partir du péricarde bovin ont ensuite été ensemencés avec des îlots et les greffes ont été transplantés à l'EFP dans des modèles diabétiques syngéniques. La normoglycémie chez la souris a été obtenue dans les 10 jours et a été maintenue jusqu'à 100 jours, jusqu'à l'élimination des greffons.
Protocole
Toutes les expériences ont été approuvées par le Comité institutionnel des soins et de l'utilisation des animaux de l'Université de Pékin (IACUC, numéro IACUC, COE-LuoY-1).
1. Isolation des îlots
- Préparation de réactifs et d'équipements.
- Reconstituer la poudre de colagénase P (2 U / mg) dans HBSS pour obtenir une solution de 5 mg / ml et filtrer à travers un filtre de 0,22 μm pour éliminer les bactéries. Préparer des solutions aliquotes de 0,6 ml de collagénase P dans des tubes coniques de 15 ml et conserver à -20 ° C.
REMARQUE: Pendant l'utilisation, chaque portion aliquote est diluée avec HBSS pour donner des solutions de travail de 6 ml avec des concentrations finales de 0,5 mg / mL, ou 1 U / mL (assez pour traiter 3 souris). La solution de travail est conservée sur de la glace pour une utilisation immédiate dans les 1 h. La solution de travail ne doit pas être restaurée ou ré-congelée pour une utilisation supplémentaire. - Préparez une solution de neutralisation en ajoutant FBS (2,5%) et P / S (1%) dans HBSS; Garder la solution sur la glace. Préparer 60 mL de solution de neutralisation à TreaT 6 souris.
- Pour le milieu de culture d'îlots, ajouter D-glucose (7 mM), FBS (10%) et P / S (1%) au milieu RPMI 1640.
- Autoclavez les instruments chirurgicaux à 115 ° C pendant 30 min et 15 psi de pression.
- Reconstituer la poudre de colagénase P (2 U / mg) dans HBSS pour obtenir une solution de 5 mg / ml et filtrer à travers un filtre de 0,22 μm pour éliminer les bactéries. Préparer des solutions aliquotes de 0,6 ml de collagénase P dans des tubes coniques de 15 ml et conserver à -20 ° C.
- Inflation du pancréas.
- Préparer 12 ml de solution de collagénase, comme spécifié à l'étape 1.1.1, pour 6 souris (12 semaines). Remplissez la seringue de 10 ml avec 9 ml de solution de travail et connectez la seringue à l'aiguille intraveineuse 27 G. Rangez la seringue sur glace et utilisez la solution dans les 1 h.
- Euthanasier la souris par dislocation cervicale. Placez la souris en position couchée sur une serviette en papier, la queue pointant vers l'opérateur. Pulvériser le corps entier avec 70% d'éthanol, en le rendant complètement humide.
- Faire une incision en V, à partir de la zone génitale et s'étendant jusqu'au diaphragme, à l'aide de ciseaux à dissection et de pinceaux. Pliez la peau sur le coffre pour révéler complètement la cavité abdominale.
- Bouge toiL'intestin sur le côté droit de la souris et exposer le pancréas et la voie biliaire commune. Prenez soigneusement le duodénum avec une pince et tirez-le jusqu'à ce que la voie biliaire soit tendue ( Figure 1A -1 et A-2 ).
- Trouvez la veine porteuse et la voie biliaire menant au foie. Serrer la veine porteuse et la voie biliaire avec une pince microscopique hémostatique.
REMARQUE: Le serrage empêche le saignement excessif et l'entrée de la collagénase dans le foie. - Tout en maintenant l'intestin avec la pince, trouvez l'emplacement de l'ampoule qui relie la voie biliaire et le duodénum. Insérez l'aiguille intraveineuse 27G dans la voie biliaire commune à travers l'ampoule ( Figure 1B -1 et B-2 ).
- Dispensez environ 200 μl de solution de collagénase pour vérifier si la canulation est complètement traversant la voie biliaire. Si la solution de collagénase commence à remplir le conduit ( Figure 1C- 1 et C2 ), l'aiguille se trouve dans la lumière du conduit; Serrer le segment de conduit contenant l'aiguille en utilisant une pince hémostatique de l'artère et distribuer le reste des 2 mL de solution à un rythme lent et constant en 1 min ( Figure 2A -1 , A-2 et B-1 ).
REMARQUE: Si le tissu entourant le conduit commence à se gonfler ( Figure 2B -2 ), l'aiguille a poussé à travers la paroi de la voie biliaire, ce qui oblige à repositionner l'aiguille et à essayer de calmer la voie biliaire à nouveau. De même, si le duodénum commence à se gonfler ( Figure 2C -1 et C-2 ), la pince hémostatique de l'artère doit être ajustée et le canal biliaire re-canulé. Comme la solution de collagénase remplit le pancréas, le tissu près du duodénum se gonfle d'abord, suivi du regioN près de la queue pancréatique. La perfusion de la queue pancréatique (le lobe splénique) est importante pour maximiser le rendement en islet. - Après le gonflement complet du pancréas ( Figure 2C -1 ), pousser l'intestin vers le côté gauche de la souris et retirer le pancréas en commençant par le côlon descendant. Utilisez la pince pour soulever l'intestin et la séparer du pancréas avec une autre pince. Continuez à retirer le pancréas jusqu'à ce qu'il soit déconnecté du haut de l'estomac. Enfin, soulevez le pancréas hors de l'abdomen et décroissez-le de la rate restante.
NOTE: Toute la séparation doit être effectuée rapidement, car la digestion continue pendant le processus de suppression. - Placez le pancréas dans un tube conique vide de 15 ml et laissez-le sur de la glace. Répétez la procédure ci-dessus pour les autres souris. Tout le pancréas devrait être traité ultérieurement dans les 1 heure immédiatement après l'étape 1.3 afin d'éviter une sur-digestion par collagénase P.
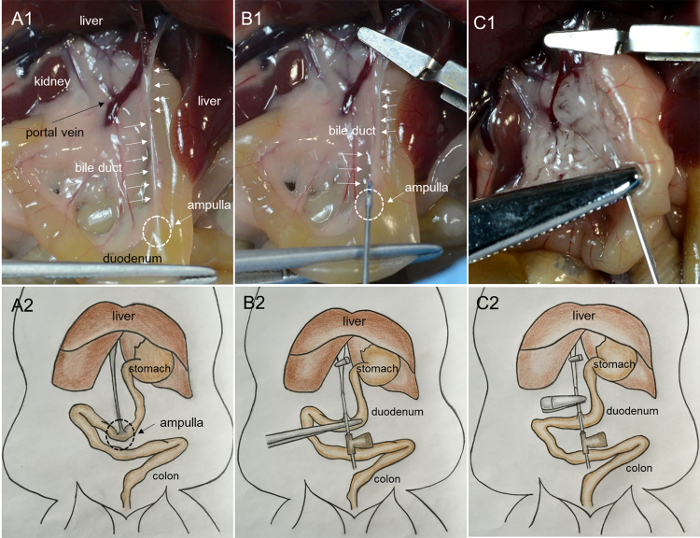
Figure 1: Photographies montrant la canulation de la voie biliaire et la perfusion du pancréas avec des solutions de collagénase. ( A1 ) Tirant le duodénum jusqu'à ce que la voie biliaire soit tendue. (Ampoule: la zone triangulaire et laiteuse à la surface du duodénum, le conduit biliaire: la structure laiteuse en forme de cordon à la surface). ( B1 ) Insertion de l'aiguille dans la voie biliaire de l'ampoule. ( C1 ) Gonflement du pancréas avec l'injection d'enzyme. ( A2, B2 et C2 ) Images de dessin animé des procédures indiquées respectivement en A1, B1 et C1. Cliquez ici pour voir une version plus grande de ce chiffre.
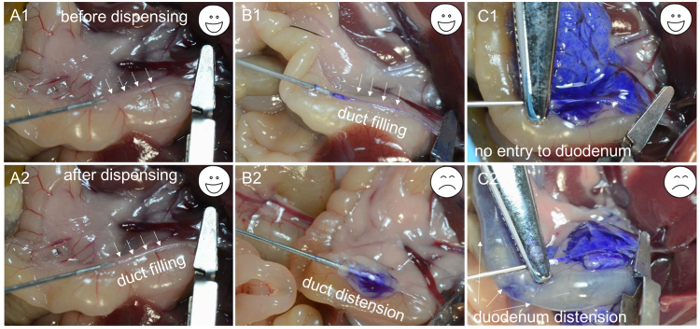
Figure 2: Dépannage pour la canulation. ( A1 ) La pointe de l'aiguille insérée dans la lumière de la voie biliaire. ( A2 ) Le conduit rempli de solutions enzymatiques. ( B1 ) L'aiguille insérée dans la lumière du conduit biliaire et le conduit rempli d'un colorant bleu. ( B2 ) En raison d'une canulation inappropriée, l'aiguille se trouve sous la voie biliaire, et seule une capsule gonflée est observée après la distribution du colorant bleu. ( C1 ) Une canulation réussie est mise en évidence par la distension du pancréas. ( C2 ) En raison du serrage inapproprié, le colorant bleu entre dans le duodénum et provoque une distension. Cliquez ici pour voir une version plus grande de ce chiffre.
- Digestion et purification des îlots.
- Incuber les tubes coniques contenant le pancréas perfusé à 37 ° C pendant 17 min.
NOTE: Le temps d'incubation peut varier selon l'âge et l'espèce de l'animal. - Terminez la digestion en ajoutant 7 ml de solution de neutralisation et en mettant les tubes sur de la glace.
- Dissocier le tissu en agitant vigoureusement les tubes ( par exemple, 20 fois sur 10 s) jusqu'à obtention de fines particules de tissu.
NOTE: Le rendement de l'îlot sera faible si le pancréas ne se dissocie pas complètement. - Filtrer les échantillons de tissus digérés par un treillis métallique de 0,5 mm pour éliminer tous les morceaux de tissu non digérés. Recueillir les suspensions d'îlots dans un nouveau tube conique de 50 ml.
- Centrifuger les tubes pendant 3 min à 230 xg et 4 ° C et verser le surnageant soigneusement, sans perturber les pastilles de tissu.
- Remettre en suspension les pastilles de 3 souris dans 4 mL de gradient de densité de polysucrose en vortexant doucement ou pDéclencher la suspension vers le haut et vers le bas quelques fois. Pipeter lentement 4 mL de HBSS sur le côté du tube vers le haut des solutions de polysucrose.
REMARQUE: les deux solutions devraient être des couches bien séparées avec une interface nette.
REMARQUE: L'ajout de HBSS doit être effectué avec précaution, sans perturber le gradient de densité de polysucrose en bas. - Centrifuger la suspension pendant 20 min à 900 xg et 4 ° C en sélectionnant un taux d'accélération très lent. Mettre fin à la centrifugation sans frein.
NOTE: Il s'agit d'une étape pour purifier les îlots des cellules exocrines, la plupart des îlots migrant vers l'interface entre les couches de polysucrose et HBSS et la plupart des cellules exocrines s'installant en bas. - Enlever la totalité des solutions surnageantes de 8 ml en utilisant une pipette à 15 orifices à gros orifices. Passez les solutions à travers une passoire inversée de 70 μm.
NOTE: Les îlots seront encore purifiés et retenus par la crépine, tandis que les cellules exocrinesPassera par le filtre.
Attention: le gradient de densité de polysucorse est toxique pour les cellules; La filtration aidera les îlots à se débarrasser du polysucrose. - Pipettez 2 mL de solution de neutralisation à froid dans une boîte de Petri de 35 mm. Inverser la crépine de la cellule vers le haut, tremper la surface en retenant les îlots dans la solution et secouer doucement pour libérer les îlots.
- Choisissez à la main les îlots sous un microscope à l'aide d'une pipette de 20 μL avec une pointe blanche.
NOTE: Les îlots sont des agrégats de cellules jaunes et compactes ( Figure 3A ), tandis que le tissu ou les cellules exocrines contaminants ont une structure noirâtre et lâche sous le microscope à dissection. - Placez environ 200 îlots dans un plat de 35 mm avec 2 mL de milieu de culture et incubez à 37 ° C dans un incubateur fourni avec 5% de CO 2 pendant 12 h.
REMARQUE: Habituellement, 150 à 300 îlots peuvent être récoltés à partir d'une souris C57BL / 6J de 12 semaines. Les îlots sont enclins à former des agrégats pendant la culture,Et les grands îlots (> 300 μm) sont sensibles à la nécrose centrale ( figure 1B , encadré). Bien agiter bien la suspension pour répartir uniformément les îlots dans le plat et réduire l'agglutination.
- Incuber les tubes coniques contenant le pancréas perfusé à 37 ° C pendant 17 min.
2. Culture d'îlots sur l'échafaudage
NOTE: DCS a une porosité d'environ 79%, une épaisseur d'environ 0,6 mm et une taille de pore allant de 12 à 300 μm.
- Couper les échafaudages en disques de 7 mm, les tremper dans de l'éthanol à 70% et les laver avec HBSS. Placez les échafaudages dans les inserts de culture de tissu de 24 po.
REMARQUE: Lorsque les îlots frais sont récupérés après une culture de nuit, les îlots sont brillants et serrés, avec des bordures lisses ( Figure 3B ). - Faire tourbillonner le plat et collecter les îlots du centre du plat en utilisant une pipette de 20 μL avec une pointe blanche. Transférer les îlots sur les échafaudages (250 îlots / échafaudages) à l'aide d'une pipette et ajouter 2 mL de milieu de culture àle puits. Culturez les îlots pendant 12 heures avant la transplantation.
3. Transplantation d'îlots sur le site EFP
- Induction du diabète chez les souris destinataires.
- Placez des souris C57BL / 6J (plus de 10 semaines) dans une cage fraîche avec un approvisionnement en eau mais pas de nourriture. Accélérer les souris pendant 10 h avant l'apparition du diabète.
- Préparer des solutions tampons avec des valeurs de pH de 4,2 à 4,5 en mélangeant de l'acide citrique 0,1 M avec du citrate de sodium 0,1 M. Dissoudre STZ (10 mg / mL) dans le tampon fraîchement préparé et stériliser la solution en la passant par un filtre de 0,22 μm.
REMARQUE: STZ est sensible à la lumière et perd de l'activité dans les 10 minutes; Préparez toujours la solution STZ fraîche avant l'injection. - Injecter chaque souris par voie intrapéritonéale avec STZ à une dose de 140-150 mg / kg pour chaque souris C57BL / 6J.
NOTE: La dose varie en fonction de l'âge et de l'espèce de l'animal. Il est recommandé d'effectuer une optimisation de la dose à petite échelleSt pour les espèces données avant de commencer l'expérience formelle. - Recueillir le sang de la veine de la queue et surveiller la glycémie avec un compteur de glucose aux jours 2, 3 et 4 post-STZ injection.
NOTE: Lorsque les animaux sont hyperglycémiques (glycémie non-jeûne> 16,7 mM) pendant deux jours consécutifs, ils sont prêts pour la transplantation d'îlots.
- Transplantation d'îlots sur le site EFP.
- Anesthésier les souris avec du pentobarbital administré par voie intrapéritonéale (50 mg / kg). Placez la souris en position couchée sur une serviette en papier, la queue pointant vers l'opérateur. Raser l'abdomen largement pour enlever la fourrure autour du site de l'incision. Tapez les quatre membres et essorez complètement la peau avec de l'alcool alternatif et des lingettes d'iodophor déplacées de manière circulaire pour stériliser le site d'incision. Décordez la souris avec un drap stérile, ce qui ne permet que l'accès à la zone d'incision. Faire une incision de 7 mm à travers la paroi péritonéale dans leLigne médiane, proche de la zone génitale.
REMARQUE: Tous les instruments utilisés pendant la chirurgie, y compris les gants, doivent être stériles. - Accrochez doucement et retirez l'EFP de la cavité abdominale à l'aide d'une pince. Faites passer l'EFP sur de la gaze stérile mouillée. Placez l'échafaud contenant des îlots sur l'EFP et pliez l'EFP pour envelopper la transplantation. Assurer le contact direct entre les îlots et l'EFP en suturant l'EFP avec des sutures absorbables de 6-0. Mouiller la surface de l'EFP avec une solution saline stérile à l'aide d'un coton-tige trempé pour empêcher l'EFP de se dessécher.
- Placez délicatement l'EFP dans la cavité abdominale. Fermez l'incision en suturant la paroi péritonéale et en serrant la couche dermique avec des clips enroulés.
- Injecter de la buprénorphine (0,1 mg / kg) par voie sous-cutanée comme analgésique.
- Injecter 1 ml de solution saline par voie sous-cutanée pour éviter la déshydratation.
- Placez la souris dans une cage sur un coussin chauffant jusqu'à ce que la souris récupère de l'anesthésie.
- Vérifiez le taux de glycémie non-jeûneVents deux jours plus tard en recueillant du sang de la veine de la queue. Si vous récupérez le greffon, répétez les procédures de transplantation ci-dessus, retirez doucement l'EFP, utilisez une suture 3-0 pour ligater la fin de la graisse adjacente à l'épididyme, obstruez les vaisseaux sanguins, explitez le greffon EFP et conservez-le pour l'histologie .
REMARQUE: l'explication des îlots devrait rendre les souris réceptrices hyperglycémiques à nouveau dans les 3 jours, confirmant la fonction du greffon.
- Anesthésier les souris avec du pentobarbital administré par voie intrapéritonéale (50 mg / kg). Placez la souris en position couchée sur une serviette en papier, la queue pointant vers l'opérateur. Raser l'abdomen largement pour enlever la fourrure autour du site de l'incision. Tapez les quatre membres et essorez complètement la peau avec de l'alcool alternatif et des lingettes d'iodophor déplacées de manière circulaire pour stériliser le site d'incision. Décordez la souris avec un drap stérile, ce qui ne permet que l'accès à la zone d'incision. Faire une incision de 7 mm à travers la paroi péritonéale dans leLigne médiane, proche de la zone génitale.
Résultats
Notre méthode de serrage, réalisée à l'aide d'une pince microscopique hémostatique, est simple et économique en comparaison de la technique de ligature de suture. Il a fallu environ 4 h pour isoler et purifier environ 1 200 îlots de 6 souris. Les îlots fraîchement isolés avaient généralement une périphérie rugueuse sous un microscope optique ( figure 3A ). Une fois que les îlots ont récupéré du processus d'isolement, ils ont l&#...
Discussion
La perfusion de pancréas et le temps de digestion sont deux paramètres clés qui affectent le rendement et la qualité des îlots. Moskalewski a d'abord signalé l'utilisation d'un mélange brut de collagénase pour digérer le pancréas haché du cobaye 11 . Lacy et al. A signalé l'injection d'enzymes dans le système de conduits pour perfuser le pancréas, ce qui a considérablement augmenté le rendement en îlot 12 . La perfusion ductal ...
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
Les auteurs souhaitent remercier Wei Zhang de Guanhao Biotech pour la fourniture des échafaudages décellularisés. Nous remercions Xiao-hong Peng pour les discussions utiles. Cette recherche a été soutenue financièrement par la National Natural Science Foundation of China (Projet n ° 331322021).
matériels
| Name | Company | Catalog Number | Comments |
| Dissecting scissor | Ningbo Medical | ||
| Forceps | Ningbo Medical | ||
| 0.5 mm diameter wire mesh | Ningbo Medical | ||
| 70 μm cell strainer | Falcon | 352350 | |
| Artery hemostatic clamp | Ningbo Medical | ||
| Microscopic hemostatic clamp | Ningbo Medical | ||
| Hemostatic forceps | Ningbo Medical | ||
| Absorbable 6-0 PGLA sutures | JINHUAN | With needle | |
| Wound clip | Ningbo Medical | ||
| Cotton swab | Ningbo Medical | ||
| Gauze | Ningbo Medical | ||
| Sterile drapes | Ningbo Medical | ||
| 10mL syringe | JINGHUAN | ||
| 1 mL syringe | JINGHUAN | ||
| 27G intravenous needle | JINGHUAN | 0.45x15 RWSB | |
| 1.5 mL Eppendorf tube | Axygen | ||
| 15mL conical tube | Corning | 430791 | |
| 50mL conical tube | Corning | 430829 | |
| 35mm Non-treated Peri-dishes | Corning | 430588 | |
| Transwell | Corning | 3422 | |
| 0.22 μm filter | Pall | PN4612 | |
| 10 mL serological pipet | Corning | 4488 | |
| Pipet filler S1 | Thermo Scientific | 9501 | |
| Pipette (2-20μL) | Axygen | AP-20 | AXYPETTM |
| Dissecting microscope | Olympus | SZ61 | |
| Centrifuge | Eppendorf | 5810R | |
| Hank’s balanced salt solution | Gibco | C14175500CP | |
| Collagenase P | Roche | COLLP-RO | |
| Histopaque 1077 | Sigma | 10771 | |
| RPMI 1640 | Gibco | 11879-20 | |
| FBS | Gibco | 16000-044 | |
| D-glucose | Gibco | A24940-01 | |
| Glucose meter | Roche | ACCU-CHEK | |
| Penicillin-streptomycin | Gibco | 15140-122 | |
| Streptozotocin | Sigma | V900890 | VetecTM |
| Chloral hydrate | J&K | C0073 | |
| Sodium citrate | Sigma | 71497 | |
| Citric acid | Sigma | C2404 | |
| Iodophors | Ningbo Medical | ||
| C57BL/6J, 10-12 weeks old | VitalRiver | Beijing, China | |
| Decellularized scaffold | Guanhao Biotec | 131102 | Guangzhou, China |
Références
- Shapiro, A. M., et al. Islet transplantation in seven patients with type 1 diabetes mellitus using a glucocorticoid-free immunosuppressive regimen. N Engl J Med. 343, 230-238 (2000).
- Shapiro, A. M. J., et al. International Trial of the Edmonton Protocol for Islet Transplantation. N Engl J Med. 355, 1318-1330 (2006).
- Ryan, E. A., et al. Five-year follow-up after clinical islet transplantation. Diabetes. 54, 2060-2069 (2005).
- Merani, S., Toso, C., Emamaullee, J., Shapiro, A. M. Optimal implantation site for pancreatic islet transplantation. Br J Surg. 95, 1449-1461 (2008).
- Schmidt, C. Pancreatic islets find a new transplant home in the omentum. Nat Biotechnol. 35 (1), (2017).
- Dufour, J. M., et al. Development of an ectopic site for islet transplantation, using biodegradable scaffolds. Tissue Eng. 11, 1323-1331 (2005).
- Weaver, J. D., et al. Controlled Release of Dexamethasone from Organosilicone Constructs for Local Modulation of Inflammation in Islet Transplantation. Tissue Eng Part A. 21, 2250-2261 (2015).
- Wang, K., et al. From Micro to Macro: The Hierarchical Design in a Micropatterned Scaffold for Cell Assembling and Transplantation. Adv Mater. 29, (2017).
- Blomeier, H., et al. Polymer Scaffolds as Synthetic Microenvironments for Extrahepatic Islet Transplantation. Transplantation. 82, 452-459 (2006).
- Gibly, R. F., et al. Extrahepatic islet transplantation with microporous polymer scaffolds in syngeneic mouse and allogeneic porcine models. Biomaterials. 32, 9677-9684 (2011).
- Moskalewski, S. Isolation and Culture of the Islets of Langerhans of the Guinea Pig. Gen Comp Endocrinol. 5, 342-353 (1965).
- Lacy, P. E., Kostianovsky, M. Method for the isolation of intact islets of Langerhans from the rat pancreas. Diabetes. 16, 35-39 (1967).
- Zmuda, E. J., Powell, C. A., Hai, T. A Method for Murine Islet Isolation and Subcapsular Kidney Transplantation. J Vis Exp. (50), (2011).
- Li, D. S., Yuan, Y. H., Tu, H. J., Liang, Q. L., Dai, L. J. A protocol for islet isolation from mouse pancreas. Nat Protoc. 4, 1649-1652 (2009).
- Stull, N. D., Breite, A., McCarthy, R., Tersey, S. A., Mirmira, R. G. Mouse Islet of Langerhans Isolation using a Combination of Purified Collagenase and Neutral Protease. J Vis Exp. (67), (2012).
- Sakata, N., Yoshimatsu, G., Tsuchiya, H., Egawa, S., Unno, M. Animal models of diabetes mellitus for islet transplantation. Exp Diabetes Res. , 256707 (2012).
- Schmidt, C. Pancreatic islets find a new transplant home in the omentum. Nat Biotech. 35, 8-8 (2017).
- Londono, R., Badylak, S. F. Biologic scaffolds for regenerative medicine: mechanisms of in vivo remodeling. Ann Biomed Eng. 43, 577-592 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon