このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
均質な時間分解蛍光共鳴エネルギー転送を用いた測定インスリン分泌の検出
要約
ここでは、提案する均質な時分割フレット (HTRF) 細胞から分泌されるインスリンの急速な検出のための効率的な方法として。
要約
インスリン分泌の検出だけでなく代謝の研究のように規制の分泌機構の解明にとって重要です。多数のインスリン アッセイは、何十年も存在している、けれども均一時間分解蛍光共鳴エネルギー伝達 (HTRF) 技術の最近の出現が大幅これらの測定に簡略化します。これは、急速なコスト効果の高い、再現、および堅牢な光学測定時間分解蛍光共鳴エネルギー移動を容易にする長期的な排出量と明るい蛍光物質を抗体に依存です。また、HTRF インスリン検出は高スループット スクリーニングの試金の開発の影響を受けやすいです。ここ HTRF を使用して INS 1E 細胞、ラット インスリノーマ細胞ラインでインスリン分泌を検出します。これはインスリンとグルコース刺激による変化の基底のレベルを推定することができます。さらに、このインスリン検出システムを [グルコース刺激によるインスリン分泌 (GSIS) の負の調節因子としてのドーパミンの役割を確認します。同様に、他のドーパミン D2-受容体アゴニスト、クインピ、ブロモクリプチン、濃度依存的に GSIS を減らすような。我々 の結果は、GSIS、その薬理学的プロファイルで多数の薬の役割を決定する際に HTRF インスリン測定形式の有用性を強調表示します。
概要
主要な蛋白同化ホルモン、インスリンによるエネルギー代謝の調節を微調整します。インスリンが合成・増加細胞外グルコース レベルに応じて膵 β 細胞が発表しました。リリースされたインシュリンはインシュリン敏感なティッシュ1,2によりブドウ糖の取り込みをトリガーします。生理学的に、これはグルコースの取り込みを調節するインスリンの分泌が続く、食後後のグルコース濃度の上昇にリンクされます。グルコース恒常性の障害がインスリン抵抗性で最高潮に達する代謝障害につながる、最終的に、2 型糖尿病2,3、4を発症。
インスリン分泌が広く研究されていますがその分子機構、ままかり。調査の重要な分野は、インスリン分泌 β 細胞5,6,7,8で新規変調器の識別されています。これらの研究では、グルコース刺激とインスリン分泌の結合関係の理解を深める必要があります。したがって、正確に監視し、グルコース刺激によるインスリン分泌 (GSIS) のレベルを定量化することが不可欠でした。までに、ただし、メソッド数が限られていたインスリン分泌細胞や膵島を用いた GSIS の定量化できます。インスリンのタグ付きの放射性同位元素と抗体を利用したラジオイムノアッセイ (RIA) であります。このアプローチの主な制限には、取り扱いや放射性物質の処分のための安全性の問題が含まれます。また、このメソッドは労働集約的な複数の長い洗濯とインキュベーションの手順を含みます。酵素結合抗体法 (ELISA) は、インスリン検出のための抗体を利用して別のコストがかかり、労働集約的なアプローチです。抗体の親和性のインスリンの認識効率の変化はこのメソッドの要因を制限しているし、結果の再現性に影響を与えることができます。ELISA も RIA は、高スループット実験のために設計されました。AlphaScreen、均質なアッセイ検出とインスリン分泌のレベルを測定するために使用します。AlphaScreen 技術は、周囲の酸素の化学発光の生成に終って化学発光の種と反応することができます酸素の励起一重項状態への変換に基づいています。試金は同種、RIA、ELISA に関連付けられている洗濯の手順の多くは除去されます。しかし、反応の性質により信号が不安定は、アッセイの読み出しに影響を与える可能性があります制限要因です。(TR 挟撃、Heyduk および同僚の9によって開発された、インスリン分子上の異なるエピトープを 2 つの独立した抗体の結合に基づくインスリン測定に同種別のアプローチ。抗体が短い相補単鎖 DNA オーバーと各二重に化学的にリンクの鎖 DNA です。インスリン抗体の結合は、一緒にそれらをもたらす、二重鎖 DNA 二重につながります。各抗体はそれぞれのドナーやアクセプタ fluorophore に関連付けられても、DNA 密生相のアソシエーションをもたらします一緒にこれらの同時蛍光共鳴エネルギー移動 (FRET) を生成します。TR-挟撃の潜在的な制限の 1 つは、ただし、フレット自体にかかっています。フレット反応中にバック グラウンド蛍光を急速に消費することができないことは、背景の蛍光性の比較的高いレベルと信号対雑音比アッセイ内につながる可能性があります。したがって、高スループット方法で GSIS を定量化するため、堅牢で信頼性の高い、費用対効果分析のため、まだ必要があります。
生物物理学の最近の進歩は、均質な時間分解蛍光エネルギー共鳴の転送 (HTRF) を用いたアッセイの開発に結実しています。具体的には、内のエネルギー移動のアッセイがありますフレット ベースとして記述されていたより正確に、HTRF に依存は、ドナーとアクセプター間エネルギーの非放射伝達発光エネルギー共鳴転送 (LRET)10種11,12,13。蛍光のタイミング重要であるこの区別またはフレットと LRET ゲートの同じ種類を利用できますより多くの LRET、それは異なるフレット インタラクションを焼入れです。また、ユウロピウムなど化合物の希土類元素ランタノイド cryptate の使用または HTRF でテルビウム cryptate が長い蛍光半減12,14を生成します。これはドナー励起と受容体 (すなわち、時間分解法) からの放出の測定間の遅延時間 (μ 秒) の導入のユニークな利点を提供しています。この遅延は、アクセプター発光蛍光の測定前に放散する背景の蛍光性のための十分な時間をことができます。その結果、読み出しが非特異蛍光を解放し、したがって、高い信号対雑音比を達成 (図 1)。さらに、HTRF の同種の性質は、elisa 法や RIA ベースの方法より迅速アッセイを重視、非連結の種を洗浄する洗浄手順の必要性を排除します。
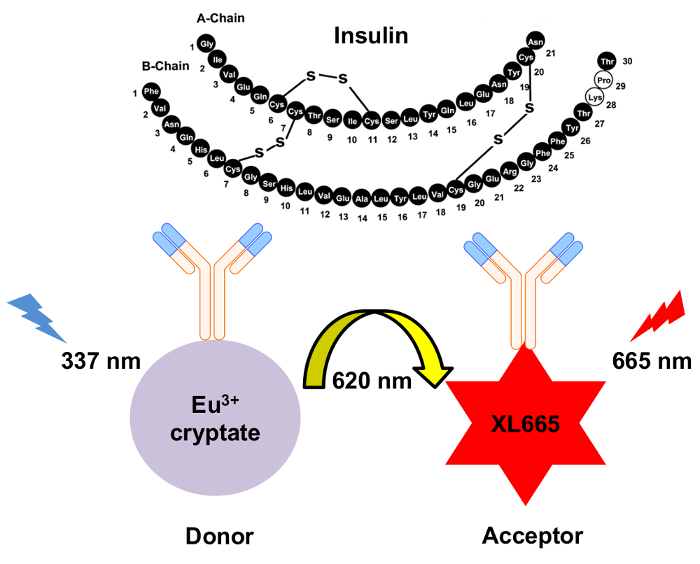
図 1: HTRF インスリン検出のメカニズムの概略図。2 つ独立して生成されたモノクローナル抗体は具体的に認識し、別々 のサイトでインスリン バインドします。これらの抗体はユウロピウム cryptate ドナーまたは XL665 アクセプター共役系します。620 で排出で 337 nm 結果をドナー励起 nm。結果として得られるエネルギー移動の原因で波長が長く、665 を出力する XL665 nm。この図の拡大版を表示するのにはここをクリックしてください。
ここで、詳細なプロトコルを提供 HTRF ベースのアプローチを使用して、INS 1E 細胞から情報科学研究科のレベルを判断する、インスリノーマ細胞ライン15をラット、確立されたインスリン分泌 β 細胞由来します。さらに、この試金はインスリン分泌の分子の調節物質の薬理学的プロファイルを識別するため使用する場合があります。ドーパミン D2を調べるこの HTRF ベース インスリン アッセイを適用-国際学研究科受容体規制のような。増加研究は、神経伝達物質ドーパミンが GSIS8,16,17,18,19,20,の重要な制御因子であることを明らかにしました。21,22ドーパミンがドーパミン D2アクションを介して負オートクリン/パラクリン的 GSIS を影響-膵細胞のベータ8の表面に表現の受容体 (D2、3D、D4受容体) のように。,16,19. この試金を使用して、我々 は情報科学研究科の負の調節因子としてドーパミンの役割を確認し、ことを示すドーパミン D2-受容体作動薬のブロモクリプチンとクインピまた、GSIS を減らすような。
プロトコル
1. INS 1E 細胞: メンテナンスとめっき
- 5% (v/v) 熱不活化牛胎児血清 L-グルタミン, 2 mM 10 mM HEPES、1 mM ピルビン酸ナトリウム、100 U/mL ペニシリン/ストレプトマイシンを添加した INS 1E 細胞加湿 37 ˚C/5% CO2インキュベーターと RPMI 1640 培地で培養を維持します。50 μ M β-メルカプトエタノールのソリューションです。80-90% の合流点に到達するまで、トリプシンし継代またはインスリン分泌の試金のために使用することができます (プレート) あたり 10 mL 完全 RPMI 1640 培地での細胞を培養します。
- 1 日目:メディアを吸引し、予め温めておいた PBS の 5 mL と一度セルを洗ってください。トリプシン (0.025%) の 0.5 mL 希釈 0.5 mL の PBS のセルを trypsinize し、37 ° C で 3-4 分間インキュベートに 1:1 を追加します。15 mL 遠心管にピペットによって 9 mL 完全なメディアおよび転送細胞を加えることによってトリプシンを非アクティブ化します。
- 遠心分離によって細胞をペレットし、約 5 mL の新鮮なメディアで再細胞ペレットを中断します。
- 再浮遊細胞の 10 μ L を取るし、10 μ L でトリパン ブルー セル実行可能性を確認するための重要な染料を混ぜます。診断この混合物の 10 μ L のライブとデッドのセルをカウントします。生存率レベルは 90% 以上にする必要があります。1 mL あたり 100 万の細胞に新鮮なメディアの再浮遊細胞を希釈します。
- 多 L リジンの井戸あたり種子 0.5 mL INS 1E 細胞事前 500,000 細胞/ウェルの密度で、24 ウェル プレートをコーティングしました。
- 2 日目:18-24 h のメディアを削除後めっきと新鮮な RPMI 1640 メディアの 500 μ L/ウェルを追加。セル前の passaging ステップから完全に回復するように別の 24 時間のセルを孵化させなさい。この余分な時間は、細胞の培養皿に広がりを許可します。
2. インスリン分泌の試金 (3 日目)
- KRB バッファーを準備: 132.2 mM NaCl、3.6 mM KCl、5 mM NaHCO3、0.5 mM NaH2PO40.5 mM MgCl2、1.5 mM CaCl2、0.001 g/mL ウシ血清アルブミン (BSA)、pH 7.4。
- 細胞からメディアを吸引し、予め温めておいた PBS で 2 回洗ってください。
- グルコース飢餓ステップ 37 ˚C/5% CO2で 1 時間血糖なし 450 μ L/ウェル KRB (含まれている BSA) を追加します。
- グルコース飢餓の段階、準備 200 ミリメートルを含む KRB で薬のシリアル希薄グルコース (10 倍濃度)。
- 200 mM グルコース (また最終的なアッセイのグルコース濃度 x 10) を添加した KRB の最終濃度 x 10 で薬物を準備します。場合薬株式 (プラス追加の 10 グルコース x) は、DMSO に DMSO 割合の試金 (DMSO 0.1% 未満の理想的に最終的な割合) を通して一貫性が保たを確認します。
- 100 に 100 μ M の最終的なアッセイ薬物濃度範囲を使用してドーパミンやクインピの治療のため薬物を含まない用量反応の最後のポイントで (高いもの低い濃度から)、午後。ブロモクリプチン、薬物のない制御をされている用量反応の最後の点と、22 に 10 μ M の最終的な分析濃度範囲を使用します。
- グルコース飢餓後線量応答を生成するアッセイに薬物のシリアル希薄を追加します。
- シリアル希薄を各 50 μ L/ウェルを対応する井戸 (合計アッセイ ボリューム 500 μ L) に追加します。
- グルコース刺激ステップ (20 mM グルコース) の存在下でそれぞれ薬シリアル希釈でセルを 37 ˚C/5% CO で 90 分間インキュベートします2. 。コントロール井戸のセットが含まれます: (1) 任意の新たな薬物と (2) どちらも薬物も (分泌の基礎率を提供する) グルコース刺激される細胞の不在で一人で 20 mM グルコース刺激。
- 刺激のステップの後 (直接使用またはストア 4 ° C で) 培養上清を慎重に取り外します。
注: (600 × g、1 分) のさらに 5 分穏やかなの遠心分離ステップをこの時点で導入してアッセイ培養上清中に残っているセルを削除することがあります。
3. HTRF 測定インスリン分泌に
- できればクリア 96 ウェル プレートでアッセイ培養上清 1:10 KRB (BSA) なしでを希釈します。
- HTRF インスリン測定 (表 1) インスリン標準曲線を準備します。
| 標準原液 500 ng/ml | シリアルの希薄 | [インスリン] ng/ml の作業 |
| STD 7 | 30 μ l 在庫 + 140 μ l KRB | 150 |
| スタンダード 6 | 30 μ l STD 7 + 45 μ l KRB | 60 |
| STD 5 | 30 μ l STD 6 + 45 μ l KRB | 24 |
| STD 4 | 30 μ l STD 5 + 45 μ l KRB | 9.6 |
| STD 3 | 30 μ l STD 4 + 45 μ l KRB | 3.84 |
| STD 2 | 30 μ l STD 3 + 45 μ l KRB | 1.54 |
| STD 1 | 30 μ l STD 2 + 45 μ l KRB | 0.61 |
| STD 0 | 45 μ l KRB | 0 |
| 注: STD 入荷 500 ng/ml | ||
表 1。インスリン標準曲線にシリアルの希薄。
- 標準曲線のサンプルや希釈アッセイ培養上清を HTRF プレートに追加します。96 ウェルまたは試金ボリュームに再調整することは念頭に置きつつ、384 ウェル プレート形式の HTRF によって分泌されたインスリンの測定が行えます。使用 10 μ L/ウェルの 384 ウェル白い低ボリューム、丸底プレートに 5 μ L/ウェルまたは 96 ウェル ハーフ エリア プレート サンプル (材料の表を参照してください)。
- 抗体検出バッファーにミックスを準備 (材料の表を参照) で 1:2 ドナー (cryptate)/アクセプター (XL-665) 比。
注: さらに HTRF 測定についての詳細は、製造元から入手できます。 - (96 ウェル プレート アッセイ フォーマット) の 30 μ L/ウェルまたは 15 μ L/ウェル (384 ウェル プレート アッセイ フォーマット) のために試金する抗体のミックスを追加します。
- プレートを密封し、室温で孵化させなさい。
- 2 h、4 h、または一晩インキュベート後プレートをプレート リーダーと適切な HTRF 光モジュールを使用する抗体と読む (337 665 620 nm) (材料表と製造元の指示を参照してください)。60 μ s で統合開始を設定し、ウェルあたり 400 μ s で積分時間使用 200 点滅します。
注: これらのパラメーターは、特定のリーダーの使用に基づいていた。620 で読み出し nm と 665 nm がさまざまな楽器と異なる場合があります。これは 665/620 比を使用をお勧めする理由の一つです。この比の計算、リーダーにリーダーから任意の潜在的な違いは正規化され、HTRF 測定に使われる道具に関係なく、一貫した値を提供します。
4. データの解析と標準化
- レシオ メトリックの外挿によって試金井戸のインスリン濃度を計算する第 2 順序 2 次多項式曲線 (図 2) の蛍光測定 (665 nm/620 nm)。

図 2: インスリン標準曲線。既知濃度のヒトインスリン株式は、インスリン標準曲線の生成に使用されました。結果として得られる HTRF 比 (665 nm/620 nm) インスリン濃度に対してプロットしました。データが第 2 順序の 2 次多項式曲線にベスト フィット (R2 = 0.99996)。これは、代表的な標準曲線です。誤差 = SEM.この図の拡大版を表示するのにはここをクリックしてください。
- Ng/ml 分泌されるインスリンの推定データ、(リガンド濃度の増加への応答で分泌されるインスリン) を % 最大のインスリン分泌の試金井 (20 mM グルコースだけで条件) の平均値に正規化します。
- 内陸変動を計算するのに単一の実験からカーブ フィット (R2) を使用します。実験中、個々 の R2値を近似曲線の平均の標準誤差の計算をできるように実験内の重複に由来します。
- プレート境界のバリエーションを確認するには、集合的な曲線の R2値の平均値の標準誤差を計算するのに少なくとも 3 つの個々 の実験からのデータを使用します。
結果
定義済みの濃度 (図 2) の浄化されたヒトインスリン標準を使用してインスリン標準曲線を生成することによって、インスリン HTRF 測定を検証しました。レシオ メトリック蛍光測定値を推定することができること標準的な曲線の世代薬物治療 (図 2) への応答で分泌されたインスリン レベルを決定します。カーブ フィットの?...
ディスカッション
ここで説明した HTRF インスリン アッセイ培養細胞系からのインスリン分泌を測定するための迅速で効率的なシステムを提供しています。その最も重要な利点は、この試金は高い信号対雑音比のための低バック グラウンド信号を提供しています。また、HTRF 信号は、長期間安定したことを確認した (> 24 h)7。それにもかかわらず、のでインスリン結合モノクローナル抗体迅速?...
開示事項
INS 1E 細胞を気前よく提供、ニコラ ・ ピエール (生物検定 Cisbio) 有益な助言と博士ピエール Maechler (ジュネーブの大学) に感謝します。この作品は、国防総省 (Z.F. にグラント PR141292) とジョン ・ f ・財団 (Z.F.) にピッツバーグのナンシー A. Emmerling 基金からの資金によって支えられました。
謝辞
著者が明らかに何もありません。
資料
| Name | Company | Catalog Number | Comments |
| 96-well white half area plate | Greiner Bio-One | 82050-042 | |
| 384-well white low-volume, round-bottom plate | Corning | 15100157 | |
| Insulin High Range Kit | Cisbio Bioassays | 62IN1PEH | 10,000 test HTRF-based insulin assay kit |
| PHERAstar FSX plate reader | BMG Labtech | FSX | Plate reader adapted for HTRF-based assay readings |
| Plate sealers | Fisher Scientific | DY992 | To seal plate while antibodies incubate |
| Hemocytometer | Hausser Scientific | 3100 | |
| RPMI Medium 1640 (1x) | Gibco | 11875-093 | [+] L-glutamine |
| Trypsin 0.05% | Corning | 25-052-CI | 0.53 mM EDTA, (-) sodium bicarbonate |
| DPBS (Dulbecco's phosphate buffered saline) | Corning | 21-031-CV | Without calcium and magnesium |
| Fetal Bovine Serum | Corning | 35-010-CV | |
| HEPES | Gibco | 156-30-080 | |
| Sodium pyruvate | Gibco | 11360070 | |
| Penicillin/Streptomycin solution 100x | Corning | 30-002 CT | |
| 2-mercaptoethanol | Sigma | M1348 | |
| Trypan Blue Stain (0.4%) | Gibco | 15250-061 | |
| Dopamine hydrochloride | Sigma | 8502 | |
| Bromocriptine mesylate | Tocris | 427 | |
| (-)-Quinpirole hydrochloride | Tocris | 1061 | |
| Bovine Serum Albumin | Calbiochem | 12659 | |
| Poly-L-Lysine | Sigma | P4832 | |
| Glucose | Sigma | G7021 | |
| DMSO (Dimethyl sulfoxide) | Sigma | 276855 |
参考文献
- Taniguchi, C. M., Emanuelli, B., Kahn, C. R. Critical nodes in signalling pathways: Insights into insulin action. Nat Rev Mol Cell Biol. 7 (2), 85-96 (2006).
- Vetere, A., Choudhary, A., Burns, S. M., Wagner, B. K. Targeting the pancreatic beta-cell to treat diabetes. Nat Rev Drug Discov. 13 (4), 278-289 (2014).
- Despres, J. P., Lemieux, I. Abdominal obesity and metabolic syndrome. Nature. 444 (7121), 881-887 (2006).
- Kahn, S. E., Hull, R. L., Utzschneider, K. M. Mechanisms linking obesity to insulin resistance and type 2 diabetes. Nature. 444 (7121), 840-846 (2006).
- Barg, S. Mechanisms of exocytosis in insulin-secreting B-cells and glucagon-secreting A-cells. Pharmacol Toxicol. 92 (1), 3-13 (2003).
- Braun, M., Ramracheya, R., Rorsman, P. Autocrine regulation of insulin secretion. Diabetes Obes Metab. 14 Suppl 3, 143-151 (2012).
- Farino, Z. J., et al. Development of a rapid insulin assay by homogenous time-resolved fluorescence. PLoS One. 11 (2), e0148684 (2016).
- Simpson, N., et al. Dopamine-mediated autocrine inhibitory circuit regulating human insulin secretion in vitro. Mol Endocrinol. 26 (10), 1757-1772 (2012).
- Heyduk, E., Moxley, M. M., Salvatori, A., Corbett, J. A., Heyduk, T. Homogeneous insulin and C-Peptide sensors for rapid assessment of insulin and C-peptide secretion by the islets. Diabetes. 59 (10), 2360-2365 (2010).
- Heyduk, T. Measuring protein conformational changes by FRET/LRET. Curr Opin Biotechnol. 13 (4), 292-296 (2002).
- Degorce, F. HTRF((R)): Pioneering technology for high-throughput screening. Expert Opin Drug Discov. 1 (7), 753-764 (2006).
- Degorce, F., et al. HTRF: A technology tailored for drug discovery - a review of theoretical aspects and recent applications. Curr Chem Genomics. 3, 22-32 (2009).
- Mathis, G. HTRF(R) Technology. J Biomol Screen. 4 (6), 309-314 (1999).
- Daijo, J. E., Sportsman, J. R. A time-resolved fluorescence immunoassay for insulin in rodent plasma. J Pharm Biomed Anal. 19 (3-4), 335-342 (1999).
- Merglen, A., et al. Glucose sensitivity and metabolism-secretion coupling studied during two-year continuous culture in INS-1E insulinoma cells. Endocrinology. 145 (2), 667-678 (2004).
- Ustione, A., Piston, D. W. Dopamine synthesis and D3 receptor activation in pancreatic beta-cells regulates insulin secretion and intracellular [Ca(2+)] oscillations. Mol Endocrinol. 26 (11), 1928-1940 (2012).
- Ustione, A., Piston, D. W. A simple introduction to multiphoton microscopy. J Microsc. 243 (3), 221-226 (2011).
- Ustione, A., Piston, D. W., Harris, P. E. Minireview: Dopaminergic regulation of insulin secretion from the pancreatic islet. Mol Endocrinol. 27 (8), 1198-1207 (2013).
- Rubi, B., et al. Dopamine D2-like receptors are expressed in pancreatic beta cells and mediate inhibition of insulin secretion. J Biol Chem. 280 (44), 36824-36832 (2005).
- Garcia-Tornadu, I., et al. Disruption of the dopamine d2 receptor impairs insulin secretion and causes glucose intolerance. Endocrinology. 151 (4), 1441-1450 (2010).
- Garcia-Tornadu, I., et al. New insights into the endocrine and metabolic roles of dopamine D2 receptors gained from the Drd2 mouse. Neuroendocrinology. 92 (4), 207-214 (2010).
- Lopez Vicchi, F., et al. Dopaminergic drugs in type 2 diabetes and glucose homeostasis. Pharmacol Res. 109, 74-80 (2016).
- Kalra, S., Kalra, B., Agrawal, N., Kumar, S. Dopamine: The forgotten felon in type 2 diabetes. Recent Pat Endocr Metab Immune Drug Discov. 5 (1), 61-65 (2011).
- Mahajan, R. Bromocriptine mesylate: FDA-approved novel treatment for type-2 diabetes. Indian J Pharmacol. 41 (4), 197-198 (2009).
- Caicedo, A. Paracrine and autocrine interactions in the human islet: more than meets the eye. Semin Cell Dev Biol. 24 (1), 11-21 (2013).
- Ballon, J. S., Pajvani, U., Freyberg, Z., Leibel, R. L., Lieberman, J. A. Molecular pathophysiology of metabolic effects of antipsychotic medications. Trends Endocrinol Metab. , (2014).
- Freyberg, Z., Aslanoglou, D., Shah, R., Ballon, J. S. Intrinsic and antipsychotic drug-induced metabolic dysfunction in schizophrenia. Front Neurosci. 11, 432 (2017).
- de Leeuw van Weenen, E. J., et al. The dopamine receptor D2 agonist bromocriptine inhibits glucose-stimulated insulin secretion by direct activation of the alpha2-adrenergic receptors in beta cells. Biochem Pharmacol. 79 (12), 1827-1836 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved