JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
균질 시간 해결 포스터 공명 에너지 전송 기반 분석 결과 인슐린 분 비의 검출에 대 한
요약
여기, 우리가 현재의 균질 시간 세포에서 분 비 하는 인슐린의 신속한 검출을 위한 효율적인 방법으로 무서 워 (HTRF) 해결.
초록
인슐린 분 비의 검출은 규제의 분 비 또한 연구에서 물질 대사의 elucidating 메커니즘에 대 한 중요 합니다. 비록 수많은 인슐린 분석 실험은 수십 년 동안 존재 했다, 균질 시간 해결 포스터 공명 에너지 전송 (HTRF) 기술의 최근 출현 방식이 크게이 측정을 간소화 하 게 됩니다. 이것은, 비용, 재현성, 신속 하 고 강력한 광학 분석 결과 오래 지속 방출 포스터 공명 에너지 전송 시간 해결 용이와 밝은 fluorophores에 활용 된 항 체에 의존. 또한, HTRF 인슐린 탐지 높은 처리량 검열 분석 실험의 개발에 대 한 순종입니다. 여기 우리는 기능-1E 셀, 쥐 insulinoma 파생 셀 라인에서에서 인슐린 분 비를 검색 하기 위해 HTRF를 사용 합니다. 인슐린과 포도 당 자극에 그들의 변화 기초 수준 추정 수 있습니다. 또한,이 인슐린 탐지 시스템 사용 하 여 포도 당 자극 인슐린 분 비 (GSIS)의 부정적인 레 귤 레이 터로 서 도파민의 역할을 확인 하. 비슷한 방식으로, 다른 도파민 D2-수용 체 주 작동 근, quinpirole, bromocriptine, 줄일 GSIS 농도 의존 방식에서 처럼. 우리의 결과 GSIS와 그들의 약리 프로필에 수많은 약물의 역할을 결정 HTRF 인슐린 분석 결과 형식 유틸리티를 강조 표시 합니다.
서문
에너지 대사의 규정 주요 단백 동화 호르몬, 인슐린에 의해 미세 하 게. 인슐린 합성 이며 췌 장 베타 세포 증가 세포 외 포도 당 수준에 대 한 응답에서에 의해 발표. 출시 된 인슐린 인슐린에 민감한 조직1,2포도 당 통풍 관을 트리거합니다. 생리학적으로,이 식사 후, 포도 당 통풍 관을 통제 하는 인슐린의 분 비에 의해 다음 포도 당 농도의 상승에 연결 됩니다. 포도 당 항상성 교란 인슐린 저항에 culminating 대사 장애가 발생할 고 궁극적으로 2 형 당뇨병2,,34의 발병에.
인슐린 분 비를 광범위 하 게 공부 했다, 하지만 그 규제 메커니즘 제대로 이해 남아 있습니다. 수 사의 중요 한 지역 베타 세포5,6,,78인슐린 분 비의 소설 변조기의 식별 되었습니다. 이러한 연구는 포도 당 자극 인슐린 분 비 사이의 결합 관계의 더 나은 이해 해야 합니다. 따라서, 정확 하 게 모니터링 하 고 포도 당 자극 인슐린 분 비 (GSIS)의 수준을 계량 능력 필수 되었습니다. 그러나 날짜 하려면,, 방법의 제한 된 수만 셀 라인 인슐린 분 비 췌 장 독도 이용 GSIS의 정량화를 허용 하도록 사용할 수 없었습니다. 하나는 방사성 태그 인슐린과 항 체를 이용 하는 방사 면역 검정 법 (RIA)입니다. 이 방법의 주요 제한 사항 처리 및 방사성 물질의 안전 문제가 포함 됩니다. 또한,이 방법은 노동 집약, 여러 긴 세척 및 인큐베이션 단계를 포함 합니다. 효소 연결 된 immunosorbent 분석 결과 (ELISA) 인슐린 검출을 위한 항 체를 이용 하는 또 다른 비용과 노동 집약적인 접근 이다. 항 체 친 화력 및 인슐린 인식의 효율 변화 요인이이 방법의 제한 그리고 결과의 재현성에 영향을 미칠 수 있습니다. 애 란도 리아 높은 처리량 실험을 위해 설계 되었습니다. AlphaScreen 균질 분석 결과 감지 하 고 인슐린 분 비의 수준 측정에 사용 되는. AlphaScreen 기술 화학의 세대의 결과로 chemiluminescent 종으로 대응할 수 있는 흥분된 산소 내의 상태로 주변 산소의 변환 기반으로 합니다. 분석 결과 균질 성 때문에, 많은 RIA와 ELISA 세척 단계는 제거 됩니다. 그러나, 반응의 특성상 신호의 불안정은 제한 요인 분석 결과의 판독에 영향을 미칠 수 있습니다. (TR-협공,9Heyduk와 동료 의해 개발 된 인슐린 분자에 다른 epitopes 두 개의 별도 항 체의 바인딩을에 따라 인슐린 측정에 다른 동종 접근 이다. 항 체는 짧은 상호 보완적인 단일 좌초 DNA 돌출부와 화학적으로 이중 연결 된 각 좌초 DNA. 인슐린 항 체의 바인딩 함께 그들을 제공 그리고 두 배 좌초 된 DNA 이중으로 이어집니다. 각 항 체는 또한 각 기증자 또는 수락자 fluorophore와 연결 하 고 DNA 이중의 협회 포스터 공명 에너지 전달 (무서 워)를 생성 하기 위해 이러한 fluorophores 함께 제공. 그러나 TR-협공의 한 가지 잠재적인 한계 자체 무서 워, 달려있다. 빠르게 무서 워 반응 동안 배경 형광을 발산 하지 못하는 배경 형광의 상대적으로 높은 수준 및 낮은 신호 대 잡음 비 분석 결과 내에서 발생할 수 있습니다. 따라서, 필요 높은 처리량 방식에서 GSIS를 측정에 대 한, 강력한, 안정적이 고 비용 효율적인 분석 결과 대 한 여전히 존재 합니다.
물리학에서 최근의 진보는 균질 시간 해결 형광 에너지 공명 전송 (HTRF) 기반으로 분석 결과의 개발에서 남 중 했다. 특히, 에너지 내에서 전송 하는 동안 분석 결과 수 있습니다 무서 워 기반으로 설명 더 정확 하 게, 발광 에너지 공명 전송 (LRET)10 은 기증자와 수락자 사이 에너지의 비 복사 전달에 의존 하는 HTRF 종11,,1213. 이 차이 이후는 형광의 타이밍 중요, 또는 냉각 하는 기반으로 무서 워 상호 작용 LRET, 보다 훨씬 다른 무서 워 및 LRET 게이팅의 동일한 종류를 사용할 수 있습니다. 또한, 유로 퓸 등 희토류 란타넘족 cryptate 사용 하 여 화합물 또는 HTRF에 븀 cryptate 생산 긴 형광 반감기12,14. 이 여기 기증자와 수락자 (즉, 시간 확인 시험)에서 방출의 측정 사이 타임 딜레이 (무색하)의 도입의 독특한 장점을 제공합니다. 이 시간 지연의 수락자 방출 형광 측정 전에 사라지고 배경 형광에 대 한 충분 한 시간을 허용 합니다. 따라서, 판독은 일반적인 형광의 자유롭고 높은 신호 대 잡음 비율 달성 하므로, (그림 1). 또한, HTRF의 동질적인 특성 분석 결과 많이 만드는 언바운드 종 ELISA 또는 RIA 기반 방법 보다 더 빠른 씻어 세척 단계에 대 한 필요가 없습니다.
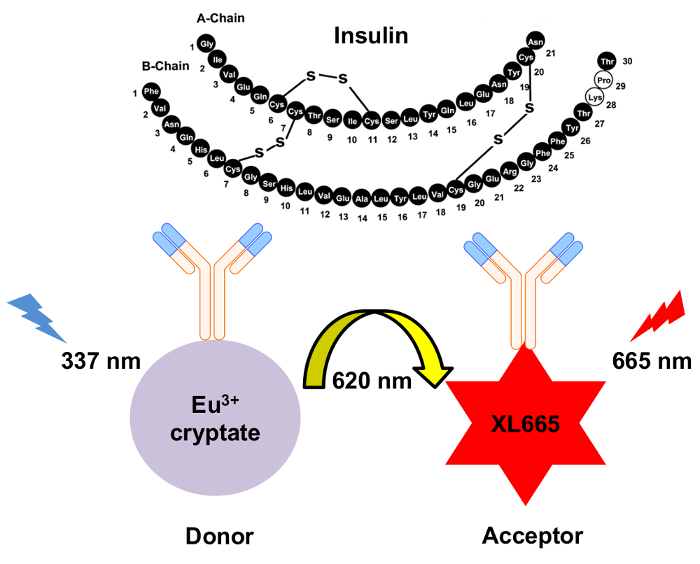
그림 1: HTRF 인슐린 감지 메커니즘의 도식. 두 개의 독립적으로 생성 된 단일 클론 항 체는 특히 인식 하 고 별도 사이트에서 인슐린에 바인딩합니다. 이 항 체는 유로 퓸 cryptate 기증자 또는 수락자 XL665 활용 된. 여기 620에서 방출에 337 nm 결과에 기증자의 nm. 결과 에너지 전송 하면 더 긴 파장, 665에서 방출 하는 XL665 nm. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
여기, 우리는 자세한 프로토콜 제공 기능-1E 셀에서 GSIS의 수준을 결정 하는 HTRF 기반 방식을 사용 하 여를 위한 insulinoma 셀 선15쥐는 확고 인슐린 은닉 베타 세포 파생. 또한,이 분석 결과 인슐린 분 비의 분자 레 귤 레이 터의 약리 프로필을 식별 하는 데 사용할 수 있습니다. 우리이 인슐린 HTRF 기반 분석 결과 도파민 D2를 검사 하는 적용-GSIS의 수용 체 규칙 처럼. 증가 연구는 신경 전달 물질 도파민 GSIS8,,1617,18,19,20, 의 중요 한 레 귤 레이 터 밝혀졌다 21 , 22. 도파민은 도파민 D2에 대 한 작업을 통해 부정적인 autocrine/paracrine 방식에서 GSIS를에 영향을 미치는-같은 수용 체 (D2, D3D4 수용 체) 베타 췌 장 세포8 의 표면에 표현 , 16 , 19. 우리 GSIS의 부정적인 레 귤 레이 터로 서 도파민의 역할을 확인 하 고 입증 하는이 분석 결과 사용 하 여, 도파민 D2-수용 체 주 작동 근 bromocriptine와 quinpirole 또한 GSIS 감소 같은.
프로토콜
1. 기능-1E 셀: 유지 보수 및 도금
- 기능-1E 셀 습도 37 ˚C/5% CO2 인큐베이터 고 RPMI 1640 매체와 교양 5% (v/v) 열 비활성화 태아 둔감 한 혈 청, 2 m m L-글루타민, 10 mM HEPES, 1mm 나트륨 pyruvate, 100 U/mL 페니실린/스와 보완 유지 솔루션, 50 µ M β-mercaptoethanol입니다. 80-90%의 합류를 도달할 때까지, 그들은 수 있는 trypsinized 및 passaged 또는 인슐린 분 비 분석 결과 대 한 사용 하는 경우 셀 (접시), 당 10 mL 전체 RPMI 1640 매체에 문화.
- 주 1: 미디어를 발음 하 고 셀 미리 따뜻하게 PBS의 5 mL로 한 번 씻어. 트립 신 (0.025%)의 0.5 mL 희석 1:1 0.5 ml PBS 셀 trypsinize 37 ˚C에서 3-4 분 동안 품 어를 추가 합니다. 추가 하 여 9 mL 전체 미디어 전송 셀 15 mL 원심 분리기 튜브를 pipetting으로 트립 신을 비활성화 합니다.
- 원심 분리에 의해 세포를 작은 고 다시 약 5 mL 신선한 매체에서 셀 펠 릿을 일시 중단.
- 다시 일시 중단 된 세포의 10 µ L 고 10 µ L 세포 생존 능력에 대 한 확인을 Trypan 블루 중요 한 염료 혼합. 10 µ L hemocytometer를 사용 하 여이 혼합의에 라이브 하 고 죽은 세포를 계산 합니다. 생존 수준 90% 이상 이어야 한다입니다. ML 당 1 백만 세포에 신선한 미디어에 다시 정지 셀을 희석.
- 폴 리-L-리 신에 잘 당 종자 0.5 mL 기능-1E 셀 전 24-잘 접시, 500, 000 셀/잘의 조밀도에 코팅.
- 주 2: 미디어 18-24 h를 제거 후 도금 및 신선한 RPMI 1640 미디어의 500 µ L/잘 추가. 이전 passaging 단계에서 완벽 하 게 복구 하 셀 수 있도록 또 다른 24 h에 대 한 셀을 품 어. 이 추가 시간 조직 문화 접시에 확산 하기 위해 셀 수 있습니다.
2. 인슐린 분 비 분석 결과 (3 일)
- 기계 버퍼 준비: 132.2 m m NaCl, 3.6 m m KCl, 5mm NaHCO3, 0.5 m m NaH2포4, 0.5 m m MgCl2, 1.5 m m CaCl2및 0.001 g/mL 소 혈 청 알 부 민 (BSA), pH 7.4.
- 셀에서 미디어를 발음 하 고 미리 데워 공영으로 두 번 씻어.
- 포도 당 기아 단계 37 ˚C/5% CO2450 µ L/잘 기계 (포함 BSA) 없이 1 시간에 대 한 포도 당을 추가 합니다.
- 포도 당 기아 단계 동안 준비 200 m m를 포함 하는 기계에 나타나는데의 직렬 희석 포도 당 (10 배 농도).
- 200 mM 포도 당 (또한 10 최종 분석 결과 포도 당 농도 배)으로 보충 하는 기계에 최종 농도 x 10에서 마약을 준비 합니다. 경우 약 재고 (추가 10 플러스 포도 당 x)는 DMSO, DMSO 비율 분석 결과 (이상적으로 최종 비율 0.1 %DMSO 미만)에 걸쳐 일관성이 유지 됩니다 있는지 확인.
- 치료를 위해 도파민, quinpirole, 100 100 µ M의 최종 분석 결과 약물 농도 범위를 사용 하 여 포함 하는 약 복용량 응답의 마지막 포인트 (가장 높은 것에서 낮은 농도), 오후. Bromocriptine, 마약류 통제 되는 복용량 응답의 마지막 지점으로 오후 10 시, 10 µ M의 최종 분석 결과 농도 범위를 사용 합니다.
- 포도 당 기아 후 마약 직렬 희석 생산 복용량 응답 분석 결과를 추가 합니다.
- 해당 우물 (총 분석 결과 볼륨 500 µ L)를 각 직렬 희석의 50 µ L/우물을 추가 합니다.
- 포도 당 자극 단계에 대 한 37 ˚C/5% CO에서 90 분 동안 각각 약 직렬 희석 (20 mM 포도 당)의 존재와 셀을 품 어2. 제어 우물의 세트를 포함: (1) 어떤 추가 약물 및 약물도 (이 분의 기저 속도 제공 합니다) 포도 당 자극도 (2) 세포의 부재에 혼자 20 mM 포도 당으로 자극.
- 자극 단계 후 조심 스럽게 제거 supernatants (직접 사용 또는 저장소 4 ˚C에서).
참고: 추가 5 분 부드러운 원심 분리 단계 (600 x g, 1 분) 분석 결과 supernatants에 나머지 셀을 제거 하려면이 시점에서 소개 될 수 있습니다.
3입니다. HTRF 측정 인슐린 분 비를
- 명확한 96 잘 접시에 선호 분석 결과 supernatants 1:10 (BSA) 없이 기계를 희석.
- HTRF 인슐린 분석 결과 (표 1)에 대 한 인슐린 표준 곡선을 준비 합니다.
| 표준 재고 솔루션 500 ng/ml | 직렬 희석 | [인슐린] ng/ml 일 |
| STD 7 | 30 µ l 주식 + 140 µ l 기계 | 150 |
| 표준 6 | 30 µ l 성병 7 + 45 µ l 기계 | 60 |
| 표준 5 | 30 µ l 성병 6 + 45 µ l 기계 | 24 |
| 표준 4 | 30 µ l 성병 5 + 45 µ l 기계 | 9.6 |
| 표준 3 | 30 µ l 성병 4 + 45 µ l 기계 | 3.84 |
| 표준 2 | 30 µ l 성병 3 + 45 µ l 기계 | 1.54 |
| 표준 1 | 30 µ l 성병 2 + 45 µ l 기계 | 0.61 |
| STD 0 | 45 µ l 기계 | 0 |
| 참고: 표준 재고는 500 ng/ml | ||
표 1입니다. 인슐린 표준 곡선을 만들기 위해 직렬 희석입니다.
- HTRF 플레이트를 표준 곡선 샘플 및 희석된 분석 결과 supernatants를 추가 합니다. HTRF에 의해 인슐린 분 비의 측정 96 잘 또는 분석 결과 볼륨을 다시 조정 해야 하는 것을 명심 384-잘 플레이트 형식 수행할 수 있습니다. 사용 10 µ L/잘 96 잘 화이트 반-지역 접시 또는 384-잘 화이트 낮은 볼륨, 라운드-하단 플레이트에서 5 µ L/잘 샘플 ( 재료의 표참조).
- 항 체 탐지 버퍼에 혼합 준비 ( 재료의 표참조) 1:2 기증자 (cryptate)에서 / 수락자 (XL-665) 비율.
참고: 추가 HTRF 분석 결과 대 한 특정 정보는 제조 업체에서 사용할 수 있습니다. - 30 µ L/잘 (96 잘 접시 분석 결과 형식) 또는 15 µ L/잘 (384-잘 접시 분석 결과 형식)에 대 한 분석 결과를 항 체 믹스를 추가 합니다.
- 접시를 봉인 하 고 실 온에서 품 어.
- 2h, 4h, 및 야간 보육 후 플레이트 리더와 적절 한 HTRF 광섬유 모듈을 사용 하 여 항 체 판 읽기 (337 665 620 nm) ( 테이블의 재료 및 제조 업체의 지침 참조). 60 µ s에 통합 시작을 설정 하 고 통합 시간 400 μ s. 사용 200 잘 당 깜박입니다.
참고: 이러한 매개 변수는 우리의 특정 리더의 사용에 근거 했다. 620에서 판독 및 665 nm 서로 다른 악기 사이 다를 수 있습니다. 이 665/620 비율을 사용 하는 것이 좋습니다 이유 중 하나입니다. 이 비율을 계산, 리더를 리더에서 어떤 잠재적인 차이 정규화 될 것 이다 하 고 HTRF를 측정 하는 데 사용 하는 악기에 관계 없이 일관 된 값을 제공 합니다.
4. 데이터 분석 및 정규화
- 비율의 추정을 통해 분석 결과 우물의 인슐린 농도 계산 형광 판독 (665 nm/620 nm)는 두 번째 순서 이차 다항식 곡선 (그림 2).

그림 2 : 인슐린 표준 곡선. 인간 인슐린 재고 알려진된 농도의 인슐린 표준 곡선을 생성 하기 위해 사용 되었다. 결과 HTRF 비율 (665 nm / 620 nm) 인슐린 농도 대 한 표시 했다. 데이터는 두 번째 순서 이차 다항식 곡선 적합 (R2 = 0.99996). 이것은 대표적인 표준 곡선 이다. 오차 막대 SEM. = 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
- 인슐린 분 비의 ng/mL로 추정 데이터 % 최대 인슐린 분 비 분석 결과 우물 (20 mM 포도 당 혼자 조건)의 평균 값 (ligand 농도 증가에 대 한 응답에서 분 비 되는 인슐린)를 정상화.
- Intraplate 변화를 계산 하는 단일 실험에서 곡선 적합 (R2)를 사용 합니다. 실험에서 맞는 곡선에 대 한 의미의 표준 오차 계산을 수 있도록 내 실험 중복에서 개별 R2 값을 파생.
- Interplate 변형 결정 집단 곡선의 R2 값에 대 한 의미의 표준 오차를 계산 하기 위해 적어도 3 개의 개별 실험에서 데이터를 사용 합니다.
결과
우리는 미리 정의 된 농도 (그림 2)의 순화 된 인간의 인슐린 표준을 사용 하 여 인슐린 표준 곡선을 생성 하 여 우리의 인슐린 HTRF 분석 결과 검증. 따라서 우리 비율 형광 수치를 추정 하는 것을 허용 하는 표준 곡선의 세대 하 고 다음으로 하는 약물 치료 (그림 2)에 대 한 응답 인슐린 분 비 수준을 결정. 커브 피팅 Intraplate 변형 ...
토론
여기에 설명 된 HTRF 인슐린 분석 결과 교양된 셀 기반 시스템에서 인슐린 분 비를 측정 하는 신속 하 고 효율적인 시스템을 제공 합니다. 그것의 가장 중요 한 장점 중이 분석 결과 높은 신호 대 잡음 비율 때문에 낮은 배경 신호를 제공합니다. 또한, 우리는 시간의 연장된 기간에 대 한 HTRF 신호는 안정 확인 했습니다 (> 24 h)7. 그럼에도 불구 하 고, 인슐린 바인딩 단일 클론 항 체 ?...
공개
우리가 아낌없이 제공 하는 기능-1E 셀에 대 한 유용한 조언을 니콜라 피에르 (Cisbio 생물 검정) 및 박사 피에르 Maechler (제네바 대학) 감사 합니다. 이 작품은 국방부 (그랜트는 Z.F. PR141292), 그리고 존 F. 낸시 A. Emmerling 기금 (Z.F.)에 피츠버그 재단에서 자금에 의해 지원 되었다.
감사의 말
저자는 공개 없다.
자료
| Name | Company | Catalog Number | Comments |
| 96-well white half area plate | Greiner Bio-One | 82050-042 | |
| 384-well white low-volume, round-bottom plate | Corning | 15100157 | |
| Insulin High Range Kit | Cisbio Bioassays | 62IN1PEH | 10,000 test HTRF-based insulin assay kit |
| PHERAstar FSX plate reader | BMG Labtech | FSX | Plate reader adapted for HTRF-based assay readings |
| Plate sealers | Fisher Scientific | DY992 | To seal plate while antibodies incubate |
| Hemocytometer | Hausser Scientific | 3100 | |
| RPMI Medium 1640 (1x) | Gibco | 11875-093 | [+] L-glutamine |
| Trypsin 0.05% | Corning | 25-052-CI | 0.53 mM EDTA, (-) sodium bicarbonate |
| DPBS (Dulbecco's phosphate buffered saline) | Corning | 21-031-CV | Without calcium and magnesium |
| Fetal Bovine Serum | Corning | 35-010-CV | |
| HEPES | Gibco | 156-30-080 | |
| Sodium pyruvate | Gibco | 11360070 | |
| Penicillin/Streptomycin solution 100x | Corning | 30-002 CT | |
| 2-mercaptoethanol | Sigma | M1348 | |
| Trypan Blue Stain (0.4%) | Gibco | 15250-061 | |
| Dopamine hydrochloride | Sigma | 8502 | |
| Bromocriptine mesylate | Tocris | 427 | |
| (-)-Quinpirole hydrochloride | Tocris | 1061 | |
| Bovine Serum Albumin | Calbiochem | 12659 | |
| Poly-L-Lysine | Sigma | P4832 | |
| Glucose | Sigma | G7021 | |
| DMSO (Dimethyl sulfoxide) | Sigma | 276855 |
참고문헌
- Taniguchi, C. M., Emanuelli, B., Kahn, C. R. Critical nodes in signalling pathways: Insights into insulin action. Nat Rev Mol Cell Biol. 7 (2), 85-96 (2006).
- Vetere, A., Choudhary, A., Burns, S. M., Wagner, B. K. Targeting the pancreatic beta-cell to treat diabetes. Nat Rev Drug Discov. 13 (4), 278-289 (2014).
- Despres, J. P., Lemieux, I. Abdominal obesity and metabolic syndrome. Nature. 444 (7121), 881-887 (2006).
- Kahn, S. E., Hull, R. L., Utzschneider, K. M. Mechanisms linking obesity to insulin resistance and type 2 diabetes. Nature. 444 (7121), 840-846 (2006).
- Barg, S. Mechanisms of exocytosis in insulin-secreting B-cells and glucagon-secreting A-cells. Pharmacol Toxicol. 92 (1), 3-13 (2003).
- Braun, M., Ramracheya, R., Rorsman, P. Autocrine regulation of insulin secretion. Diabetes Obes Metab. 14 Suppl 3, 143-151 (2012).
- Farino, Z. J., et al. Development of a rapid insulin assay by homogenous time-resolved fluorescence. PLoS One. 11 (2), e0148684 (2016).
- Simpson, N., et al. Dopamine-mediated autocrine inhibitory circuit regulating human insulin secretion in vitro. Mol Endocrinol. 26 (10), 1757-1772 (2012).
- Heyduk, E., Moxley, M. M., Salvatori, A., Corbett, J. A., Heyduk, T. Homogeneous insulin and C-Peptide sensors for rapid assessment of insulin and C-peptide secretion by the islets. Diabetes. 59 (10), 2360-2365 (2010).
- Heyduk, T. Measuring protein conformational changes by FRET/LRET. Curr Opin Biotechnol. 13 (4), 292-296 (2002).
- Degorce, F. HTRF((R)): Pioneering technology for high-throughput screening. Expert Opin Drug Discov. 1 (7), 753-764 (2006).
- Degorce, F., et al. HTRF: A technology tailored for drug discovery - a review of theoretical aspects and recent applications. Curr Chem Genomics. 3, 22-32 (2009).
- Mathis, G. HTRF(R) Technology. J Biomol Screen. 4 (6), 309-314 (1999).
- Daijo, J. E., Sportsman, J. R. A time-resolved fluorescence immunoassay for insulin in rodent plasma. J Pharm Biomed Anal. 19 (3-4), 335-342 (1999).
- Merglen, A., et al. Glucose sensitivity and metabolism-secretion coupling studied during two-year continuous culture in INS-1E insulinoma cells. Endocrinology. 145 (2), 667-678 (2004).
- Ustione, A., Piston, D. W. Dopamine synthesis and D3 receptor activation in pancreatic beta-cells regulates insulin secretion and intracellular [Ca(2+)] oscillations. Mol Endocrinol. 26 (11), 1928-1940 (2012).
- Ustione, A., Piston, D. W. A simple introduction to multiphoton microscopy. J Microsc. 243 (3), 221-226 (2011).
- Ustione, A., Piston, D. W., Harris, P. E. Minireview: Dopaminergic regulation of insulin secretion from the pancreatic islet. Mol Endocrinol. 27 (8), 1198-1207 (2013).
- Rubi, B., et al. Dopamine D2-like receptors are expressed in pancreatic beta cells and mediate inhibition of insulin secretion. J Biol Chem. 280 (44), 36824-36832 (2005).
- Garcia-Tornadu, I., et al. Disruption of the dopamine d2 receptor impairs insulin secretion and causes glucose intolerance. Endocrinology. 151 (4), 1441-1450 (2010).
- Garcia-Tornadu, I., et al. New insights into the endocrine and metabolic roles of dopamine D2 receptors gained from the Drd2 mouse. Neuroendocrinology. 92 (4), 207-214 (2010).
- Lopez Vicchi, F., et al. Dopaminergic drugs in type 2 diabetes and glucose homeostasis. Pharmacol Res. 109, 74-80 (2016).
- Kalra, S., Kalra, B., Agrawal, N., Kumar, S. Dopamine: The forgotten felon in type 2 diabetes. Recent Pat Endocr Metab Immune Drug Discov. 5 (1), 61-65 (2011).
- Mahajan, R. Bromocriptine mesylate: FDA-approved novel treatment for type-2 diabetes. Indian J Pharmacol. 41 (4), 197-198 (2009).
- Caicedo, A. Paracrine and autocrine interactions in the human islet: more than meets the eye. Semin Cell Dev Biol. 24 (1), 11-21 (2013).
- Ballon, J. S., Pajvani, U., Freyberg, Z., Leibel, R. L., Lieberman, J. A. Molecular pathophysiology of metabolic effects of antipsychotic medications. Trends Endocrinol Metab. , (2014).
- Freyberg, Z., Aslanoglou, D., Shah, R., Ballon, J. S. Intrinsic and antipsychotic drug-induced metabolic dysfunction in schizophrenia. Front Neurosci. 11, 432 (2017).
- de Leeuw van Weenen, E. J., et al. The dopamine receptor D2 agonist bromocriptine inhibits glucose-stimulated insulin secretion by direct activation of the alpha2-adrenergic receptors in beta cells. Biochem Pharmacol. 79 (12), 1827-1836 (2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유