Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Однородное время решены Фёрстер резонанс энергии на основе передачи Assay для обнаружения секреции инсулина
В этой статье
Резюме
Здесь мы представляем однородной время решена ладу (HTRF) как эффективный метод для быстрого обнаружения инсулина выделяется из клеток.
Аннотация
Обнаружение секреции инсулина имеет решающее значение для разъяснения механизмов регулируется секреции также как и исследования метаболизма. Хотя многочисленные анализы инсулина существовали на протяжении десятилетий, недавние появлением однородных время решена Фёрстер передачи энергии резонанса (HTRF) технологии значительно упростила эти измерения. Это быстрый, экономически эффективным, воспроизводимые и надежные оптических пробирного зависит от антител, конъюгированных яркие флуорофоров с длительной выбросов, которая облегчает время решена Фёрстер резонанс передачи энергии. Кроме того для разработки высокопроизводительного скрининга анализов поддается HTRF инсулина обнаружения. Здесь мы используем HTRF для обнаружения секреции инсулина в INS-1E клеток, крысы линии инсулинома производные ячейки. Это позволяет нам оценить базальный уровень инсулина и их изменения в ответ на стимуляцию глюкозы. Кроме того мы используем эту систему обнаружения инсулина для подтверждения роли допамина как негативный регулятор секреции инсулина глюкоза стимулирует (ССГС). Аналогичным образом, другие допамина D2-как агонистами рецепторов, quinpirole и Бромокриптин, уменьшить ССГС в зависимости от концентрации. Наши результаты подчеркивают полезность формата пробирного инсулин HTRF в определении роли многочисленных лекарств в ССГС и их фармакологические профили.
Введение
Регулирование энергии метаболизма скорректировать основных анаболический гормон инсулин. Инсулин синтезируется и выпущенное бета клеток поджелудочной железы в ответ на увеличение внеклеточного глюкозы. Выпустила инсулин вызывает усвоение глюкозы, инсулина чувствительных тканей1,2. Физиологически это связано с повышение концентрации глюкозы после еды, следуют секрецию инсулина, чтобы регулировать глюкозы. Нарушения гомеостаза глюкозы приводят к метаболические расстройства, кульминацией которых сопротивление инсулина и в конечном итоге в начале типа 2 диабет2,3,4.
Хотя широко изучены секреции инсулина, ее механизмы регулирования по-прежнему осознаются. Критической областью исследования было выявление романа Модуляторы секрецию инсулина бета-клеток5,6,,78. Эти исследования требуют лучшего понимания муфта отношения между глюкозы стимуляции и секреции инсулина. Таким образом способность точно контролировать и количественную оценку уровней инсулина глюкоза стимулирует секрецию (ССГС) весьма важное значение. На сегодняшний день, однако, лишь ограниченное количество методов были доступны дать количественную оценку данной ССГС с помощью секреции инсулина клеточных линий и/или панкреатических островков. Один является радиоиммуноанализ (RIA), которая использует радиоизотопные тегами инсулина и антител. Основные ограничения такого подхода включают вопросы безопасности за счет обработки и утилизации радиоактивных материалов. Кроме того этот метод является трудоемким, с участием нескольких долго стирки и инкубации шаги. Энзим соединенный assay иммуносорбента (ELISA) является другой дорогостоящие и трудоемкие подход, который использует антитела для обнаружения инсулина. Вариации в антитела сродства и эффективности признания инсулина сдерживающими факторами этого метода и может повлиять на воспроизводимость результатов. ELISA ни РИА был разработан для высокой пропускной способности экспериментов. AlphaScreen является однородной пробирного используется для обнаружения и измерения уровня секреции инсулина. Технология AlphaScreen основана на преобразование атмосферного кислорода в состояние синглетно возбужденных кислорода, которые могут реагировать с хемилюминесцентный видов, что приводит к генерации хемилюминесценции. Потому что assay однородной, многие из стиральной шаги, связанные с РИА и ELISA устраняются. Однако нестабильность сигнала благодаря характер реакции является ограничивающим фактором, который может повлиять на значение индикации assay. (TR-клещи, разработанный Heyduk и коллеги9, является другой однородной подход к инсулина измерения, основанные на связывание двух отдельных антител к различным эпитопам на молекуле инсулина. Антитела являются каждого химически связаны с двойной мель ДНК с короткие дополнительные одного мель ДНК свесы. Связывание антител к инсулину объединяет их и приводит к двойной дуплекс мель ДНК. Каждое антитело также связан с соответствующими донорами или акцепторной Флюорофор, и Ассоциация ДНК дуплекс объединяет эти флуорофоров для создания передачи энергии резонанса Фёрстер (лад). Одним из потенциальных ограничений TR-клещи, однако, лежит на ладу, сам. Невозможность быстро рассеивать флуоресценции фон во время реакции лад может привести к относительно высоким уровнем фона флуоресценции и низкое соотношение сигнал-шум в assay. Таким образом по-прежнему существует необходимость для надежные, надежной и рентабельной assay для количественной оценки ССГС в духе высокой пропускной способности.
Последние достижения в биофизике привели к разработке однородной флуоресценции время решена энергии резонанса передачи (HTRF) на основе анализа. В частности в то время как энергия передачи в пределах assay можно охарактеризовать как основанные на ладу, более точно, HTRF опирается на люминесценции энергии резонанса передачи (среде)10 , который является не радиационное передачи энергии между доноров и акцепторов видов11,12,13. Это различие имеет важное значение, поскольку сроки флуоресценции или тушения на основе взаимодействия ладу сильно отличается, чем для его, хотя для ладу и его могут использоваться те же типы стробирования. Кроме того использование редкоземельных лантаноиды cryptate соединений например европий или Тербий cryptate в HTRF производит длинные флуоресценции полураспада12,14. Это дает уникальные преимущества введения задержки (µsec) между донорами возбуждения и измерения выбросов от акцептор (то есть, время решена проба). Эта задержка позволяет достаточно времени для флуоресценции фон для рассеивания до измерения флуоресценции акцептора выбросов. Следовательно, индикация является бесплатным неспецифичные флуоресценции и таким образом, достигается высокое соотношение сигнал шум (рис. 1). Кроме того однородный характер HTRF устраняет необходимость для мытья шаги смыть несвязанных видов, что делает assay намного более быстрым чем ELISA или методы, основанные на РИА.
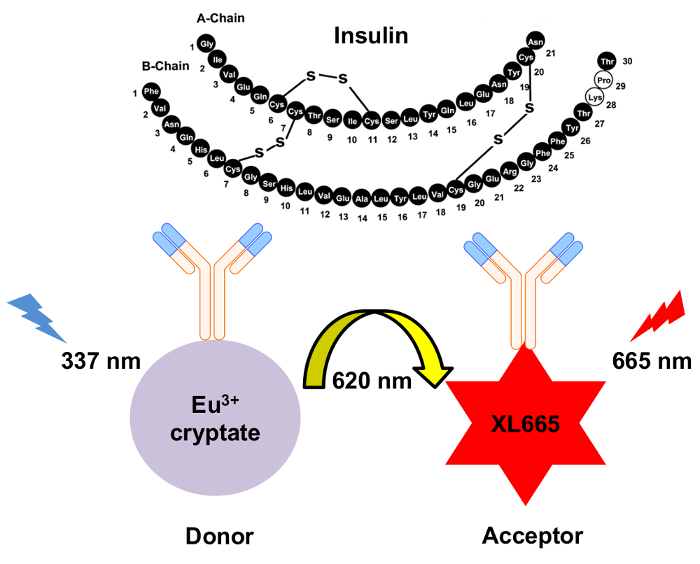
Рисунок 1: схема механизма обнаружения инсулин HTRF. Два самостоятельно сгенерированный моноклональные антитела конкретно признать и привязку к инсулина на отдельных участках. Эти антитела конъюгированных европий cryptate доноров или акцепторной XL665. Возбуждения донора в 337 нм приводит к эмиссии на 620 Нм. Результате переноса энергии вызывает XL665 выпустить на больше длины волны, 665 нм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Здесь, мы предоставляем подробный протокол для использования подхода на основе HTRF для определения уровней ССГС от клеток INS-1E, устоявшихся инсулин секреции бета клеток крыса инсулинома клеток линии15. Кроме того этот assay может использоваться для идентификации фармакологических профиль молекулярных регуляторов секреции инсулина. Мы применяем этот assay на основе HTRF инсулина для изучения допамина D2-как рецептор регулирование ССГС. Все исследования показали, что нейротрансмиттеров допамина является важным регулятором ССГС8,16,,1718,19,20, 21 , 22. допамина влияет ССГС отрицательным образом Аутокринный/паракринными через действия на допамин D2-как рецепторы (Д-2, D3, D4 рецепторов) выразил на поверхности бета-клеток поджелудочной железы8 , 16 , 19. используя этот assay, мы подтверждаем допамина в роли как негативный регулятор ССГС и продемонстрировать, что допамина D2-как Бромокриптин агонистами рецепторов и quinpirole также уменьшить ССГС.
Access restricted. Please log in or start a trial to view this content.
протокол
1. INS-1E клетки: техническое обслуживание и покрытие
- Сохранять INS-1E клетки в увлажненные 37 ˚C/5% CO2 инкубатора и культивировали среду RPMI 1640 дополнена 5% (v/v) тепло инактивированная плода бычьим сывороточным, 2 мм L-глютамином, 10 HEPES, пируват натрия 1 мм, 100 ед/мл пенициллина/стрептомицина решение, 50 мкм β-меркаптоэтанол. Культура клетки в 10 мл полного среднего RPMI 1640 (на пластину), до тех пор, пока они достигают 80-90% слияния, когда они могут быть trypsinized и пассированной или использоваться для assay секреции инсулина.
- День 1: Аспирационная СМИ и вымыть клетки один раз с 5 мл подогретым PBS. Добавьте 0,5 мл трипсина (0,025%) разводят 1:1 в 0,5 мл PBS trypsinize клетки и Инкубируйте 3-4 мин на 37 градусов. Деактивируйте трипсина, добавив 9 мл полные средства массовой информации и передачи клетки для пластиковых пробирок 15мл, закупорить.
- Пелле клетки центрифугированием и вновь приостановить Пелле клеток в приблизительно 5 мл свежего СМИ.
- Возьмите 10 мкл вновь приостановлено клеток и смешать с 10 мкл жизненно Трипановый синий краситель для проверки жизнеспособности клеток. Граф живые и мертвые клетки в 10 мкл этой смеси с помощью Горяева. Жизнеспособность уровень должен быть выше 90%. Разбавьте вновь приостановлено клетки в свежих СМИ 1 миллион клеток / мл.
- Семя 0,5 мл INS-1E ячеек на скважину в поли L-лизин предварительно покрытием 24-ну пластины, на плотности 500 000 клеток/хорошо.
- 2-й день: Удалите медиа 18-24 ч после покрытия и добавить 500 мкл/хорошо свежие RPMI 1640 средств массовой информации. Инкубируйте клетки для еще 24 часа позволить клетки, чтобы полностью оправиться от предварительного passaging шаг. Это дополнительное время позволяет клетки для распространения на пластину культуры ткани.
2. инсулин секрецию Assay (день 3)
- Подготовить KRB буфера: 132.2 мм NaCl, 3,6 мм KCl, 5 мм NaHCO3, 0.5 мм NaH2PO4, 0,5 мм MgCl2, CaCl 1,5 мм2и 0,001 г/мл, бычьим сывороточным альбумином (БСА), рН 7,4.
- Аспирационная СМИ от клеток и мыть дважды с подогретым PBS.
- Для шага голода глюкозы добавьте 450 мкл/хорошо KRB (содержащий BSA) без глюкозы в течение 1 ч 37 ˚C/5% CO2.
- Во время голодания шага глюкозы, подготовить серийных разведений препаратом в KRB, содержащие 200 мм глюкозы (10 x концентрации).
- Подготовьте наркотиков в 10 x конечная концентрация в KRB дополнена 200 мм глюкозы (также 10 x концентрации глюкозы окончательный анализ). Если запасы наркотиков (плюс добавлен 10 x глюкоза) находится в ДМСО, убедитесь, что ДМСО процент остается несогласованной пробирного (идеально окончательный процент меньше, чем 0.1% ДМСО).
- Для допамина и quinpirole лечения, использовать окончательный анализ наркотиков диапазон концентраций 100 мкм до 100 м (от высокой к низкой концентрации), с последней точки доза ответ, содержащий без наркотиков. Для Бромокриптин используйте окончательный анализ концентрации диапазон 10 мкм до 10 вечера, с последней точки ответа дозу, будучи свободной от наркотиков управления.
- После голодания глюкозы добавьте наркотиков серийных разведений в assay производить дозы ответ.
- Добавьте 50 мкл/хорошо каждый серийный разбавления соответствующий скважин (всего пробирного объем 500 мкл).
- Для стимуляции шаг глюкозы, клетки с серийных разведений соответствующих наркотиков (в присутствии 20 мм глюкозы) Инкубируйте 90 мин на 37 ˚C/5% CO2. Включает в себя набор контроля скважин: (1) стимуляции с 20 мм глюкозы только в отсутствие каких-либо дополнительных наркотиков и (2) клетки, которые стимулируются ни с наркотиками, ни глюкозы (которая обеспечивает базальный уровень секреции).
- После стимуляции шага осторожно удалите supernatants (использование непосредственно или хранить при 4 ° c).
Примечание: Дополнительные 5 мин мягкое центрифугирование шаг (600 x g, 1 мин) могут быть введены в этот момент чтобы удалить все оставшиеся ячейки в supernatants пробирного.
3. HTRF для измерения секреции инсулина
- Разбавьте пробирного supernatants 1:10 в KRB (без BSA), предпочтительно в ясно 96-луночных пластины.
- Подготовьте калибровочной кривой инсулина для assay инсулин HTRF (таблица 1).
| Стандартный раствор 500 нг/мл | Серийных разведений | Работа [инсулина] нг/мл |
| STD 7 | 30 мкл фондовой + 140 KRB мкл | 150 |
| STD 6 | 30 мкл STD 7 + 45 мкл KRB | 60 |
| STD 5 | 30 мкл STD 6 + 45 мкл KRB | 24 |
| STD 4 | 30 мкл STD 5 + 45 мкл KRB | 9.6 |
| STD 3 | 30 мкл STD 4 + 45 мкл KRB | 3.84 |
| STD 2 | 30 мкл STD 3 + 45 мкл KRB | 1.54 |
| STD 1 | 30 мкл STD 2 + 45 мкл KRB | 0,61 |
| STD 0 | KRB 45 мкл | 0 |
| Примечание: STD фондовая-500 нг/мл | ||
Таблица 1. Серийных разведений для сделать стандартной кривой инсулина.
- Добавьте образцы калибровочной кривой и разбавленных пробирного supernatants HTRF пластины. Измерение выделяется инсулина, HTRF может осуществляться в 96-луночных или формат 384-ну пластины, имея в виду, что пробирного объем должен корректироваться повторно. Использование 10 мкл/хорошо образец в 96-луночных белая половина площадь пластин или 5 мкл/колодец в 384-ну белый низким объемом, раунд нижней плиты (см. Таблицу материалы).
- Приготовить смесь антител в буфере обнаружения (см. Таблицу материалы) в донором 1:2 (cryptate) / акцептора (XL-665) отношение.
Примечание: Дальнейшие подробные сведения о HTRF assay доступны от производителя. - Добавьте смесь антител к assay 30 мкл/хорошо (для 96 хорошо плита пробирного формата) или 15 мкл/скважины (для формата пробирного 384-ну пластины).
- Печать пластину и инкубации при комнатной температуре.
- Читайте пластины после 2 h, 4 h или ночь инкубации с антителами, используя читателя пластины и соответствующий модуль оптического HTRF (337 665 620 Нм) (см. Таблицу материалы и инструкции производителя). Задать начало интеграции на 60 МКС и время интеграции на 400 МКС. Использование 200 вспышки за хорошо.
Примечание: Эти параметры были основаны на использовании нашего конкретного читателя. Индикация в 620 Нм и 665 нм могут варьироваться между различными инструментами. Это одна из причин, почему мы рекомендуем использовать соотношение 665/620. При расчете этого показателя, любые потенциальные различия от читателя к читателю будет нормализована и обеспечивают согласованные значения независимо от того, инструмент, используемый для измерения HTRF.
4. анализ данных и нормализации
- Рассчитать концентрации инсулина пробирного скважин через экстраполяция ratiometric чтений (665 нм/620 Нм) флуоресценции для второго порядка полиномиальной кривой (рис. 2).

Рисунок 2 : Калибровочной кривой инсулина. Инсулин человеческий запас известных концентрациях был использован для создания стандартной кривой инсулина. Результате соотношения HTRF (665 нм / 620 Нм) были заговоре против концентрации инсулина. Данные были лучше всего подходят для второго порядка полиномиальной кривой (R2 = 0.99996). Это представитель калибровочной кривой. Планки погрешностей = SEM. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
- С экстраполяции данных как нг/мл секретируемых инсулина нормализовать (инсулина в ответ на повышение концентрации лигандом) среднее значение % максимальный инсулина секрецию пробирного скважин (20 мм глюкозы только условие).
- Используйте кривая fit (R2) от одного эксперимента для вычисления межплитовых вариации. В рамках эксперимента производными внутри экспериментальной дубликаты, позволяя расчет Среднеквадратичная ошибка среднего для кривой отдельные значения R2 .
- Для определения interplate вариации, используйте данные из по меньшей мере три отдельных экспериментов для вычисления стандартной ошибки означают для R значение2 коллективного кривой.
Access restricted. Please log in or start a trial to view this content.
Результаты
Мы проверяются нашего анализа HTRF инсулина путем создания инсулина калибровочной кривой с использованием очищенного инсулина человека стандартов предопределенных концентрации (рис. 2). Поколение стандартной кривой, позволил нам экстраполировать чтен...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Пробирного инсулин HTRF, описанные здесь предлагает быстрые, эффективные системы для измерения секреции инсулина от культурной системы, основанной на ячейку. Среди его наиболее важных преимуществ этот assay предлагает низкий фонового сигнала из-за высокое соотношение сигнал шум. Кроме то?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Мы благодарим Nicolas Пьер (Cisbio Bioassays) за полезные советы и доктор Пьер Maechler (Женевский университет) за щедро предоставленные INS-1E клетки. Эта работа была поддержана финансирование от министерства обороны (Грант PR141292 в з.ф.) и Нэнси а. Emmerling фонда Фонда Питтсбург (чтобы з.ф.) и Джон ф.
Благодарности
Авторы не имеют ничего сообщать.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 96-well white half area plate | Greiner Bio-One | 82050-042 | |
| 384-well white low-volume, round-bottom plate | Corning | 15100157 | |
| Insulin High Range Kit | Cisbio Bioassays | 62IN1PEH | 10,000 test HTRF-based insulin assay kit |
| PHERAstar FSX plate reader | BMG Labtech | FSX | Plate reader adapted for HTRF-based assay readings |
| Plate sealers | Fisher Scientific | DY992 | To seal plate while antibodies incubate |
| Hemocytometer | Hausser Scientific | 3100 | |
| RPMI Medium 1640 (1x) | Gibco | 11875-093 | [+] L-glutamine |
| Trypsin 0.05% | Corning | 25-052-CI | 0.53 mM EDTA, (-) sodium bicarbonate |
| DPBS (Dulbecco's phosphate buffered saline) | Corning | 21-031-CV | Without calcium and magnesium |
| Fetal Bovine Serum | Corning | 35-010-CV | |
| HEPES | Gibco | 156-30-080 | |
| Sodium pyruvate | Gibco | 11360070 | |
| Penicillin/Streptomycin solution 100x | Corning | 30-002 CT | |
| 2-mercaptoethanol | Sigma | M1348 | |
| Trypan Blue Stain (0.4%) | Gibco | 15250-061 | |
| Dopamine hydrochloride | Sigma | 8502 | |
| Bromocriptine mesylate | Tocris | 427 | |
| (-)-Quinpirole hydrochloride | Tocris | 1061 | |
| Bovine Serum Albumin | Calbiochem | 12659 | |
| Poly-L-Lysine | Sigma | P4832 | |
| Glucose | Sigma | G7021 | |
| DMSO (Dimethyl sulfoxide) | Sigma | 276855 |
Ссылки
- Taniguchi, C. M., Emanuelli, B., Kahn, C. R. Critical nodes in signalling pathways: Insights into insulin action. Nat Rev Mol Cell Biol. 7 (2), 85-96 (2006).
- Vetere, A., Choudhary, A., Burns, S. M., Wagner, B. K. Targeting the pancreatic beta-cell to treat diabetes. Nat Rev Drug Discov. 13 (4), 278-289 (2014).
- Despres, J. P., Lemieux, I. Abdominal obesity and metabolic syndrome. Nature. 444 (7121), 881-887 (2006).
- Kahn, S. E., Hull, R. L., Utzschneider, K. M. Mechanisms linking obesity to insulin resistance and type 2 diabetes. Nature. 444 (7121), 840-846 (2006).
- Barg, S. Mechanisms of exocytosis in insulin-secreting B-cells and glucagon-secreting A-cells. Pharmacol Toxicol. 92 (1), 3-13 (2003).
- Braun, M., Ramracheya, R., Rorsman, P. Autocrine regulation of insulin secretion. Diabetes Obes Metab. 14 Suppl 3, 143-151 (2012).
- Farino, Z. J., et al. Development of a rapid insulin assay by homogenous time-resolved fluorescence. PLoS One. 11 (2), e0148684(2016).
- Simpson, N., et al. Dopamine-mediated autocrine inhibitory circuit regulating human insulin secretion in vitro. Mol Endocrinol. 26 (10), 1757-1772 (2012).
- Heyduk, E., Moxley, M. M., Salvatori, A., Corbett, J. A., Heyduk, T. Homogeneous insulin and C-Peptide sensors for rapid assessment of insulin and C-peptide secretion by the islets. Diabetes. 59 (10), 2360-2365 (2010).
- Heyduk, T. Measuring protein conformational changes by FRET/LRET. Curr Opin Biotechnol. 13 (4), 292-296 (2002).
- Degorce, F. HTRF((R)): Pioneering technology for high-throughput screening. Expert Opin Drug Discov. 1 (7), 753-764 (2006).
- Degorce, F., et al. HTRF: A technology tailored for drug discovery - a review of theoretical aspects and recent applications. Curr Chem Genomics. 3, 22-32 (2009).
- Mathis, G. HTRF(R) Technology. J Biomol Screen. 4 (6), 309-314 (1999).
- Daijo, J. E., Sportsman, J. R. A time-resolved fluorescence immunoassay for insulin in rodent plasma. J Pharm Biomed Anal. 19 (3-4), 335-342 (1999).
- Merglen, A., et al. Glucose sensitivity and metabolism-secretion coupling studied during two-year continuous culture in INS-1E insulinoma cells. Endocrinology. 145 (2), 667-678 (2004).
- Ustione, A., Piston, D. W. Dopamine synthesis and D3 receptor activation in pancreatic beta-cells regulates insulin secretion and intracellular [Ca(2+)] oscillations. Mol Endocrinol. 26 (11), 1928-1940 (2012).
- Ustione, A., Piston, D. W. A simple introduction to multiphoton microscopy. J Microsc. 243 (3), 221-226 (2011).
- Ustione, A., Piston, D. W., Harris, P. E. Minireview: Dopaminergic regulation of insulin secretion from the pancreatic islet. Mol Endocrinol. 27 (8), 1198-1207 (2013).
- Rubi, B., et al. Dopamine D2-like receptors are expressed in pancreatic beta cells and mediate inhibition of insulin secretion. J Biol Chem. 280 (44), 36824-36832 (2005).
- Garcia-Tornadu, I., et al. Disruption of the dopamine d2 receptor impairs insulin secretion and causes glucose intolerance. Endocrinology. 151 (4), 1441-1450 (2010).
- Garcia-Tornadu, I., et al. New insights into the endocrine and metabolic roles of dopamine D2 receptors gained from the Drd2 mouse. Neuroendocrinology. 92 (4), 207-214 (2010).
- Lopez Vicchi, F., et al. Dopaminergic drugs in type 2 diabetes and glucose homeostasis. Pharmacol Res. 109, 74-80 (2016).
- Kalra, S., Kalra, B., Agrawal, N., Kumar, S. Dopamine: The forgotten felon in type 2 diabetes. Recent Pat Endocr Metab Immune Drug Discov. 5 (1), 61-65 (2011).
- Mahajan, R. Bromocriptine mesylate: FDA-approved novel treatment for type-2 diabetes. Indian J Pharmacol. 41 (4), 197-198 (2009).
- Caicedo, A. Paracrine and autocrine interactions in the human islet: more than meets the eye. Semin Cell Dev Biol. 24 (1), 11-21 (2013).
- Ballon, J. S., Pajvani, U., Freyberg, Z., Leibel, R. L., Lieberman, J. A. Molecular pathophysiology of metabolic effects of antipsychotic medications. Trends Endocrinol Metab. , (2014).
- Freyberg, Z., Aslanoglou, D., Shah, R., Ballon, J. S. Intrinsic and antipsychotic drug-induced metabolic dysfunction in schizophrenia. Front Neurosci. 11, 432(2017).
- de Leeuw van Weenen, E. J., et al. The dopamine receptor D2 agonist bromocriptine inhibits glucose-stimulated insulin secretion by direct activation of the alpha2-adrenergic receptors in beta cells. Biochem Pharmacol. 79 (12), 1827-1836 (2010).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены