È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Förster Time-resolved omogeneo risonanza energia basati su trasferimento test per la determinazione della secrezione dell'insulina
In questo articolo
Riepilogo
Qui, presentiamo omogeneo tempo risolto FRET (HTRF) come un metodo efficace per la rilevazione rapida di insulina secernuta dalle cellule.
Abstract
La rilevazione della secrezione dell'insulina è fondamentale per illuminante meccanismi di secrezione regolata anche negli studi di metabolismo. Anche se numerosi saggi di insulina sono esistite per decenni, il recente avvento di tecnologia tempo-risolta omogenea del Förster Resonance Energy Transfer (HTRF) ha notevolmente semplificato queste misurazioni. Questo è un saggio di ottico rapido, conveniente, riproducibile e robusto affidamento anticorpi coniugati a fluorofori luminose con emissione di lunga durata che facilita risolta in tempo Förster Resonance Energy Transfer. Inoltre, rilevamento di insulina HTRF è favorevole per lo sviluppo di saggi di screening ad alta resa. Qui usiamo HTRF per rilevare la secrezione dell'insulina in cellule INS-1E, una linea cellulare derivata da insulinoma del ratto. Questo ci permette di stimare i livelli basali di loro cambiamenti in risposta a stimolazione del glucosio e dell'insulina. Inoltre, utilizziamo questo sistema di rilevazione di insulina per confermare il ruolo della dopamina come un regolatore negativo della secrezione insulinica glucosio-mediata (GSIS). In modo simile, altri di dopamina D2-come agonisti del recettore, quinpirole e Bromocriptina, ridurre GSIS in un modo dipendente dalla concentrazione. I nostri risultati evidenziano l'utilità del formato di dosaggio di insulina HTRF nel determinare il ruolo dei numerosi farmaci in GSIS e loro profili farmacologici.
Introduzione
La regolazione del metabolismo energetico è messo a punto da un importante ormone anabolizzante, insulina. L'insulina viene sintetizzata e rilasciato da cellule beta pancreatiche in risposta ai livelli aumentati del glucosio extracellulare. L'insulina rilasciata innesca l'assorbimento di glucosio da tessuti insulino sensibili1,2. Fisiologicamente, questo è legato all'elevazione della concentrazione di glucosio dopo un pasto, seguita dalla secrezione di insulina per regolare l'assorbimento del glucosio. Perturbazioni nell'omeostasi del glucosio conducono ai danni metabolici che culmina nell'insulino-resistenza e, infine, nell'insorgenza del diabete di tipo 22,3,4.
Anche se la secrezione dell'insulina è stata studiata estesamente, suoi meccanismi regolatori rimangono poco compresi. Un'area critica di indagine è stata l'identificazione di nuovi modulatori della secrezione di insulina dalle cellule beta5,6,7,8. Questi studi richiedono una migliore comprensione del rapporto accoppiamento tra stimolazione del glucosio e la secrezione di insulina. Di conseguenza, la possibilità di monitorare accuratamente e quantificare i livelli di secrezione insulinica glucosio-mediata (GSIS) è stato essenziale. Fin qui, tuttavia, solo un numero limitato di metodi era disponibile per consentire la quantificazione di GSIS utilizzando linee di cellule secernenti insulina e/o isole pancreatiche. Uno è la radioimmunoanalisi (RIA), che utilizza il radioisotopo-etichetta dell'insulina e gli anticorpi. Le principali limitazioni di questo approccio includono problemi di sicurezza dovuto la manipolazione e lo smaltimento di materiali radioattivi. Inoltre, questo metodo è laborioso, che coinvolgono più lunga lavaggio e le fasi di incubazione. Analisi enzima-collegata dell'immunosorbente (ELISA) è un altro approccio costoso e laborioso che utilizza anticorpi per il rilevamento di insulina. Variazione di affinità dell'anticorpo e dell'efficienza di riconoscere insulina stanno limitando i fattori di questo metodo e può influenzare la riproducibilità dei risultati. ELISA, né RIA è stato progettato per esperimenti di alto-rendimento. AlphaScreen è un dosaggio omogeneo utilizzato per il rilevamento e la misurazione dei livelli di secrezione dell'insulina. AlphaScreen tecnologia si basa sulla conversione dell'ossigeno ambientale in uno stato di singoletto eccitato ossigeno che possa reagire con specie a chemiluminescenza, conseguente generazione di chemiluminescenza. Perché il test sia omogeneo, molti i passaggi di lavaggio associato a RIA ed ELISA sono eliminati. Tuttavia, l'instabilità del segnale a causa della natura della reazione è un fattore limitante che può influenzare la lettura del test. (TR-tenaglia, sviluppato da Heyduk e colleghi9, è un altro approccio omogeneo alla misura dell'insulina basata sul legame degli anticorpi separati due epitopi diversi della molecola di insulina. Gli anticorpi sono ogni chimicamente legata al doppio DNA incagliato con strapiombi di DNA incagliati singoli complementari breve. Associazione degli anticorpi all'insulina li riunisce e porta ad un duplex di DNA incagliato doppio. Ogni anticorpo inoltre è associato con un fluoroforo donatore o accettore rispettivo, e l'associazione del duplex DNA riunisce questi fluorofori per generare il trasferimento di energia per risonanza (FRET). Uno dei potenziale limiti di TR-tenaglia, spetta tuttavia con il tasto stesso. L'incapacità di dissipare rapidamente fluorescenza di fondo durante la reazione di FRET può portare a livelli relativamente alti di fluorescenza di fondo e un basso rapporto segnale-rumore all'interno del dosaggio. Pertanto, sia ancora necessario per un'analisi affidabile, robusta e conveniente per quantificare GSIS in un modo ad alta velocità.
Gli avanzamenti recenti nella biofisica sono culminati nello sviluppo di un test di trasferimento (HTRF) basata risonanza energia omogenea fluorescenza risolta in tempo. In particolare, mentre l'energia di trasferimento all'interno l'analisi può essere descritto come basato su FRET, più precisamente, che HTRF si basa sulla luminescenza energia risonanza trasferimento (LRET)10 che è il non-radiative trasferimento di energia tra il donatore e accettore specie11,12,13. Questa distinzione è importante, poiché i tempi di una fluorescenza o tempra base FRET interazione è molto diversa da quella per LRET, anche se gli stessi tipi di gating possono essere utilizzati per FRET e LRET. Inoltre, l'uso di terre rare lantanidi cryptate composti quali europio o terbio cryptate in HTRF produce fluorescenza lunga emivita12,14. Questo offre un vantaggio unico dell'introduzione di un tempo di ritardo (µ sec) tra eccitazione del donatore e la misurazione del livello di emissione l'accettore (cioè, risolta in tempo saggio). Questo ritardo consente per un tempo sufficiente per la fluorescenza di fondo dissipare prima misurazione della fluorescenza emissione accettore. Di conseguenza, la lettura è libera di fluorescenza aspecifica e così, si ottiene un elevato rapporto segnale-rumore (Figura 1). Inoltre, la natura omogenea di HTRF Elimina la necessità per i passaggi di lavaggio per lavare via le specie non associate, che rende l'analisi molto più rapido rispetto ELISA o metodi basati su RIA.
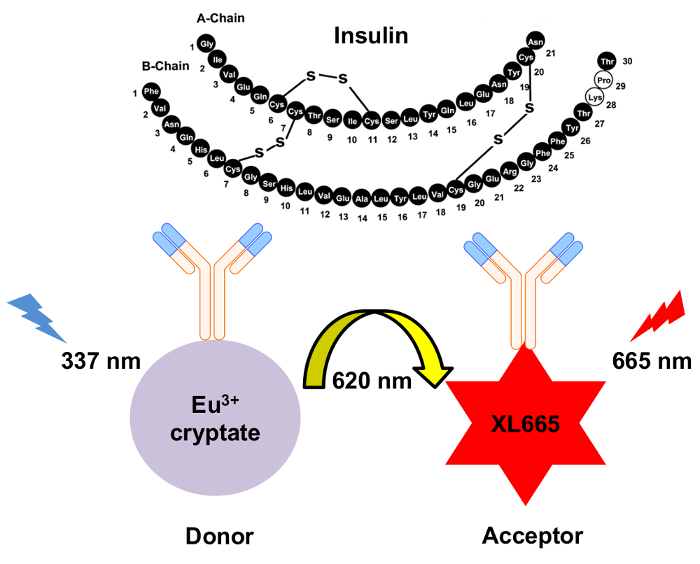
Figura 1: schematica del meccanismo per il rilevamento di insulina HTRF. Due anticorpi monoclonali indipendentemente generati specificamente riconoscono e si legano all'insulina presso siti separati. Questi anticorpi sono coniugati per il donatore cryptate europio o l'accettore XL665. Eccitazione del donatore a 337 risultati nm in emissione a 620 nm. Il trasferimento di energia provoca XL665 a emettere ad una lunghezza d'onda, 665 nm. Clicca qui per visualizzare una versione più grande di questa figura.
Qui, forniamo un protocollo dettagliato per l'utilizzo di un approccio basato su HTRF per determinare i livelli di GSIS dalle cellule INS-1E, una consolidata insulina-secrezione beta cellula-derivato ratto insulinoma cella linea15. Inoltre, questo dosaggio può essere usato per identificare il profilo farmacologico di molecolari regolatori della secrezione dell'insulina. Applichiamo questo dosaggio di insulina basata su HTRF per esaminare la dopamina D2-come regolazione del recettore di GSIS. Sempre più studi hanno rivelato che la dopamina del neurotrasmettitore è un regolatore importante di GSIS8,16,17,18,19,20, 21 , 22. dopamina colpisce GSIS in modo autocrino/paracrino negativo tramite azioni sulla dopamina D2-come i ricevitori (D2, D3, ricevitori4 D) espressi sulla superficie delle cellule pancreatiche beta8 , 16 , 19. usando questa analisi, abbiamo conferma del ruolo di dopamina come un regolatore negativo di GSIS e dimostrare che la dopamina D2-come bromocriptina agonisti del recettore e quinpirole ridurre anche GSIS.
Protocollo
1. INS-1E cellule: manutenzione e placcatura
- Mantenere cellule INS-1E in un incubatore 37 ˚C/5% CO2 e coltivate con medium RPMI 1640 completati con 5% (v/v) inattivati siero bovino fetale, 2 mM L-Glutammina, 10 mM HEPES, piruvato di sodio di 1 mM, 100 U/mL di penicillina/streptomicina soluzione, 50 µM β-mercaptoetanolo. Della coltura di cellule in 10 mL di terreno completo RPMI 1640 (per piastra), finché non raggiungono la confluenza di 80-90%, quando possono essere tripsinizzate e attraversate o utilizzati per il dosaggio di secrezione di insulina.
- 1 ° giorno: Media di aspirare e lavare le cellule una volta con 5 mL di PBS preriscaldata. Aggiungere 0,5 mL di tripsina (0.025%) diluito 1:1 in 0,5 mL di PBS tripsinizzano le cellule e incubare per 3-4 min a 37 ° c. Disattivare tripsina aggiungendo 9 mL completo media e cellule di trasferimento di una provetta da centrifuga da 15 mL pipettando.
- Pellet di cellule mediante centrifugazione e risospendere il pellet cellulare nei mezzi di comunicazione fresco di circa 5 mL.
- Prendere 10 µ l di cellule ri-sospensione e mescolare con 10 µ l di colorante vitale tripan blu per verificare la vitalità cellulare. Contare le celle vivi e morte in 10 µ l di questa miscela utilizzando un emocitometro. Livello di redditività dovrebbe essere superiore al 90%. Diluire le cellule risospese in media fresco per 1 milione di cellule per mL.
- Le cellule di INS-1E 0,5 mL di seme per pozzetto in una poli-L-lisina prerivestiti piastra a 24 pozzetti, ad una densità di 500.000 cellule per pozzetto.
- 2 ° giorno: Rimuovere media 18-24 h dopo la placcatura e aggiungere 500 µ l/pozzetto di fresco RPMI 1640 media. Incubare le cellule per altre 24 ore consentire alle cellule di recuperare completamente dal passaggio precedente e passaging. Questo tempo aggiuntivo permette alle cellule di diffondere sulla piastra di coltura del tessuto.
2. insulina secrezione Assay (giorno 3)
- Preparare il tampone di KRB: 132,2 mM NaCl, 3,6 mM KCl, 5mm NaHCO3, 0,5 mM NaH2PO4, 0,5 mM MgCl2, 1,5 mM CaCl2e 0,001 g/mL di sieroalbumina bovina (BSA), pH 7,4.
- Media da cellule di aspirare e lavare due volte con PBS preriscaldata.
- Per il passaggio di fame di glucosio, aggiungere 450 µ l/pozzetto KRB (contenente BSA) senza glucosio per 1 h a 37 ˚C/5% CO2.
- Durante la fase di inedia di glucosio, preparare diluizioni seriali delle droghe in KRB contenente 200 mM glucosio (10x concentrazione).
- Preparare droga a 10x la concentrazione finale in KRB completati con 200 millimetri di glucosio (anche 10 volte la concentrazione di glucosio finale del dosaggio). Se lo stock di droga (plus aggiunto 10 x glucosio) è in DMSO, assicurarsi che la percentuale di DMSO è mantenuto costante durante tutto il test (percentuale idealmente finale inferiore a 0.1% DMSO).
- Per i trattamenti di dopamina e quinpirole, utilizzare una gamma di concentrazione di farmaco dosaggio finale di 100 µM a 100 pM (dalla più alta alla più bassa concentrazione), con l'ultimo punto della dose risposta non contenente nessuna droga. Per la bromocriptina, utilizzare una gamma di concentrazione finale del dosaggio di 10 µM a 22, con l'ultimo punto della dose risposta essendo il controllo droga-libero.
- Dopo aver fame di glucosio, aggiungere diluizioni seriali di droga per il dosaggio di produrre una reazione al dosaggio.
- Aggiungere 50 µ l/pozzetto di ciascuna diluizione seriale nei pozzetti corrispondenti (dosaggio totale volume 500 µ l).
- Per la fase di stimolazione del glucosio, incubare le cellule con le diluizioni seriali di rispettivi droga (in presenza di glucosio 20 mM) 90 min a 37 ˚C/5% CO2. Comprendono una serie di pozzetti di controllo: (1) stimolazione con 20 millimetri di glucosio da solo in assenza di qualsiasi farmaco aggiuntivo e (2) le cellule che vengono stimolate né droga né glucosio (che fornisce un tasso basale di secrezione).
- Dopo la fase di stimolazione, rimuovere con cautela i surnatanti (uso direttamente o conservare a 4 ° c).
Nota: Un passo di centrifugazione delicata di ulteriori 5 minuti (600 x g, 1 min) può essere introdotti a questo punto per rimuovere tutte le cellule rimanenti nei surnatanti dosaggio.
3. HTRF per misura la secrezione dell'insulina
- Diluire il dosaggio surnatanti 01:10 in KRB (senza BSA), preferibilmente in piastre da 96 pozzetti chiaro.
- Preparare la curva standard di insulina per il dosaggio di insulina HTRF (tabella 1).
| Soluzione standard stock 500 ng/ml | Diluizioni seriali | Lavoro [insulina] ng/ml |
| STD 7 | 30 µ l stock + 140 µ l KRB | 150 |
| STD 6 | 30 µ l STD 7 + 45 µ l KRB | 60 |
| STD 5 | 30 µ l STD 6 + 45 µ l KRB | 24 |
| STD 4 | 30 µ l STD 5 + 45 µ l KRB | 9.6 |
| STD 3 | 30 µ l STD 4 + 45 µ l KRB | 3.84 |
| STD 2 | 30 µ l STD 3 + 45 µ l KRB | 1.54 |
| STD 1 | 30 µ l STD 2 + 45 µ l KRB | 0.61 |
| STD 0 | KRB 45 µ l | 0 |
| Nota: STD Stock è 500 ng/ml | ||
Tabella 1. Diluizioni seriali per rendere la curva standard di insulina.
- Aggiungere i campioni di curva standard ed i surnatanti di dosaggio diluito alla piastra HTRF. La misurazione di insulina secreta da HTRF può avvenire in un formato di piastra 384 pozzetti, tenendo presente che il volume di dosaggio deve essere ri-regolato o un 96 pozzetti. Uso 10 µ l/pozzetto campione in bianchi 96 pozzetti metà-zona lastre o 5 µ l/pozzetto in un piatto bianco 384 pozzetti di basso volume, turno-fondo (Vedi Tabella materiali).
- Preparare la miscela di anticorpi nel buffer di rilevamento (Vedi Tabella materiali) in un donatore di 1:2 (criptato) / rapporto accettore (XL-665).
Nota: Ulteriori dettagli specifici circa l'analisi HTRF sono disponibili presso il produttore. - Aggiungi mix di anticorpo per test a 30 µ l/pozzetto (per un formato di 96 pozzetti saggio) o 15 µ l/pozzetto (per un formato di test piastra 384 pozzetti).
- La piastra ed incubare a temperatura ambiente.
- Leggere la piastra dopo 2h, 4h, e/o pernottamento incubazione con anticorpi usando il lettore di piastre e il modulo di ottica HTRF appropriato (337 665 620 nm) (Vedi Tabella dei materiali e le istruzioni del produttore). Impostare l'inizio di integrazione alle 60 µs e il tempo d'integrazione alle 400 µs. uso 200 lampeggia per pozzetto.
Nota: Questi parametri sono stati basati sull'uso del nostro lettore particolare. La lettura a 620 nm e 665 nm possono variare tra i diversi strumenti. Questo è uno dei motivi che si consiglia di utilizzare il rapporto di 665/620. Nel calcolo di questo rapporto, eventuali differenze di potenziale dal lettore al lettore saranno normalizzati e forniscono valori coerenti indipendentemente lo strumento utilizzato per misurare HTRF.
4. normalizzazione e analisi dei dati
- Calcolare le concentrazioni di insulina nei pozzetti di saggio tramite estrapolazione di raziometrici letture di fluorescenza (665 nm/620 nm) a una secondo ordine polinomiale curva quadratica (Figura 2).

Figura 2 : Curva standard insulina. Stock di insulina umana di concentrazioni note è stato utilizzato per generare la curva standard di insulina. I rapporti HTRF risultanti (665 nm / 620 nm) sono state tracciate contro le concentrazioni di insulina. I dati erano più adatta a una curva polinomiale quadratica di secondo ordine (R2 = 0.99996). Si tratta di una curva standard rappresentativa. Barre di errore = SEM. Clicca qui per visualizzare una versione più grande di questa figura.
- Con i dati estrapolati come ng/mL di insulina secernuta, normalizzare (insulina secernuta in risposta all'aumento delle concentrazioni di ligando) al valore medio dei pozzi % insulina massima secrezione assay (stato solo del glucosio di 20 mM).
- Utilizzare la curva adatta (R2) da un singolo esperimento per calcolare la variazione di intraplacca. All'interno dell'esperimento, derivato i singoli valori di R2 dai duplicati intra-sperimentali, che consentano di calcolare l'errore standard della media per la curva.
- Per la determinazione della variazione interplacca, utilizzare i dati da almeno tre singoli esperimenti per calcolare l'errore standard della media per il valore di2 R della curva del collettivo.
Risultati
Abbiamo validato la nostra analisi HTRF insulina generando una curva standard di insulina utilizzando standard di insulina umana purificata delle concentrazioni predefiniti (Figura 2). Generazione della curva standard ha permesso di estrapolare le letture di fluorescenza raziometrici e quindi a determinare i livelli di insulina secreta in risposta ai trattamenti farmaco (Figura 2). Variazione di intraplacca per adattamento della ...
Discussione
Il dosaggio di insulina HTRF descritto qui offre un sistema rapido, efficiente per misurare la secrezione di insulina da un sistema basato su cellule coltivata. Tra i suoi più importanti vantaggi, questo saggio offre un segnale basso fondo dovuto l'alto rapporto segnale-rumore. Inoltre, abbiamo confermato che il segnale HTRF è stabile per lunghi periodi di tempo (> 24 h)7. Tuttavia, poiché gli anticorpi monoclonali di insulina-associazione raggiungere velocemente la saturazione di associazione ...
Divulgazioni
Ringraziamo Nicolas Pierre (Cisbio analisi biologiche) per consigli utili e Dr. Pierre Maechler (Università di Ginevra) per fornire generosamente alle cellule INS-1E. Questo lavoro è stato sostenuto dal finanziamento dal dipartimento della difesa (grant PR141292 a Z.F.), John F. e Nancy A. Emmerling Fund della Fondazione Pittsburgh (a Z.F.).
Riconoscimenti
Gli autori non hanno nulla a rivelare.
Materiali
| Name | Company | Catalog Number | Comments |
| 96-well white half area plate | Greiner Bio-One | 82050-042 | |
| 384-well white low-volume, round-bottom plate | Corning | 15100157 | |
| Insulin High Range Kit | Cisbio Bioassays | 62IN1PEH | 10,000 test HTRF-based insulin assay kit |
| PHERAstar FSX plate reader | BMG Labtech | FSX | Plate reader adapted for HTRF-based assay readings |
| Plate sealers | Fisher Scientific | DY992 | To seal plate while antibodies incubate |
| Hemocytometer | Hausser Scientific | 3100 | |
| RPMI Medium 1640 (1x) | Gibco | 11875-093 | [+] L-glutamine |
| Trypsin 0.05% | Corning | 25-052-CI | 0.53 mM EDTA, (-) sodium bicarbonate |
| DPBS (Dulbecco's phosphate buffered saline) | Corning | 21-031-CV | Without calcium and magnesium |
| Fetal Bovine Serum | Corning | 35-010-CV | |
| HEPES | Gibco | 156-30-080 | |
| Sodium pyruvate | Gibco | 11360070 | |
| Penicillin/Streptomycin solution 100x | Corning | 30-002 CT | |
| 2-mercaptoethanol | Sigma | M1348 | |
| Trypan Blue Stain (0.4%) | Gibco | 15250-061 | |
| Dopamine hydrochloride | Sigma | 8502 | |
| Bromocriptine mesylate | Tocris | 427 | |
| (-)-Quinpirole hydrochloride | Tocris | 1061 | |
| Bovine Serum Albumin | Calbiochem | 12659 | |
| Poly-L-Lysine | Sigma | P4832 | |
| Glucose | Sigma | G7021 | |
| DMSO (Dimethyl sulfoxide) | Sigma | 276855 |
Riferimenti
- Taniguchi, C. M., Emanuelli, B., Kahn, C. R. Critical nodes in signalling pathways: Insights into insulin action. Nat Rev Mol Cell Biol. 7 (2), 85-96 (2006).
- Vetere, A., Choudhary, A., Burns, S. M., Wagner, B. K. Targeting the pancreatic beta-cell to treat diabetes. Nat Rev Drug Discov. 13 (4), 278-289 (2014).
- Despres, J. P., Lemieux, I. Abdominal obesity and metabolic syndrome. Nature. 444 (7121), 881-887 (2006).
- Kahn, S. E., Hull, R. L., Utzschneider, K. M. Mechanisms linking obesity to insulin resistance and type 2 diabetes. Nature. 444 (7121), 840-846 (2006).
- Barg, S. Mechanisms of exocytosis in insulin-secreting B-cells and glucagon-secreting A-cells. Pharmacol Toxicol. 92 (1), 3-13 (2003).
- Braun, M., Ramracheya, R., Rorsman, P. Autocrine regulation of insulin secretion. Diabetes Obes Metab. 14 Suppl 3, 143-151 (2012).
- Farino, Z. J., et al. Development of a rapid insulin assay by homogenous time-resolved fluorescence. PLoS One. 11 (2), e0148684 (2016).
- Simpson, N., et al. Dopamine-mediated autocrine inhibitory circuit regulating human insulin secretion in vitro. Mol Endocrinol. 26 (10), 1757-1772 (2012).
- Heyduk, E., Moxley, M. M., Salvatori, A., Corbett, J. A., Heyduk, T. Homogeneous insulin and C-Peptide sensors for rapid assessment of insulin and C-peptide secretion by the islets. Diabetes. 59 (10), 2360-2365 (2010).
- Heyduk, T. Measuring protein conformational changes by FRET/LRET. Curr Opin Biotechnol. 13 (4), 292-296 (2002).
- Degorce, F. HTRF((R)): Pioneering technology for high-throughput screening. Expert Opin Drug Discov. 1 (7), 753-764 (2006).
- Degorce, F., et al. HTRF: A technology tailored for drug discovery - a review of theoretical aspects and recent applications. Curr Chem Genomics. 3, 22-32 (2009).
- Mathis, G. HTRF(R) Technology. J Biomol Screen. 4 (6), 309-314 (1999).
- Daijo, J. E., Sportsman, J. R. A time-resolved fluorescence immunoassay for insulin in rodent plasma. J Pharm Biomed Anal. 19 (3-4), 335-342 (1999).
- Merglen, A., et al. Glucose sensitivity and metabolism-secretion coupling studied during two-year continuous culture in INS-1E insulinoma cells. Endocrinology. 145 (2), 667-678 (2004).
- Ustione, A., Piston, D. W. Dopamine synthesis and D3 receptor activation in pancreatic beta-cells regulates insulin secretion and intracellular [Ca(2+)] oscillations. Mol Endocrinol. 26 (11), 1928-1940 (2012).
- Ustione, A., Piston, D. W. A simple introduction to multiphoton microscopy. J Microsc. 243 (3), 221-226 (2011).
- Ustione, A., Piston, D. W., Harris, P. E. Minireview: Dopaminergic regulation of insulin secretion from the pancreatic islet. Mol Endocrinol. 27 (8), 1198-1207 (2013).
- Rubi, B., et al. Dopamine D2-like receptors are expressed in pancreatic beta cells and mediate inhibition of insulin secretion. J Biol Chem. 280 (44), 36824-36832 (2005).
- Garcia-Tornadu, I., et al. Disruption of the dopamine d2 receptor impairs insulin secretion and causes glucose intolerance. Endocrinology. 151 (4), 1441-1450 (2010).
- Garcia-Tornadu, I., et al. New insights into the endocrine and metabolic roles of dopamine D2 receptors gained from the Drd2 mouse. Neuroendocrinology. 92 (4), 207-214 (2010).
- Lopez Vicchi, F., et al. Dopaminergic drugs in type 2 diabetes and glucose homeostasis. Pharmacol Res. 109, 74-80 (2016).
- Kalra, S., Kalra, B., Agrawal, N., Kumar, S. Dopamine: The forgotten felon in type 2 diabetes. Recent Pat Endocr Metab Immune Drug Discov. 5 (1), 61-65 (2011).
- Mahajan, R. Bromocriptine mesylate: FDA-approved novel treatment for type-2 diabetes. Indian J Pharmacol. 41 (4), 197-198 (2009).
- Caicedo, A. Paracrine and autocrine interactions in the human islet: more than meets the eye. Semin Cell Dev Biol. 24 (1), 11-21 (2013).
- Ballon, J. S., Pajvani, U., Freyberg, Z., Leibel, R. L., Lieberman, J. A. Molecular pathophysiology of metabolic effects of antipsychotic medications. Trends Endocrinol Metab. , (2014).
- Freyberg, Z., Aslanoglou, D., Shah, R., Ballon, J. S. Intrinsic and antipsychotic drug-induced metabolic dysfunction in schizophrenia. Front Neurosci. 11, 432 (2017).
- de Leeuw van Weenen, E. J., et al. The dopamine receptor D2 agonist bromocriptine inhibits glucose-stimulated insulin secretion by direct activation of the alpha2-adrenergic receptors in beta cells. Biochem Pharmacol. 79 (12), 1827-1836 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon