Method Article
細胞培養および皮膚のアプリケーション フィルム複合シリコン エラストマーを薄い: 製造とキャラクタリゼーション
要約
異なるヤング係数または厚さを有する高分子薄膜複合構造体の製造のためのプロトコルが表示されます。フィルムは、高度な細胞培養研究または皮膚接着剤として生産されています。
要約
このプロトコルの皮膚接着剤の開発、高度な細胞培養用エラストマ複合膜を作製する方法を提案する.(PDMS、柔らかい皮膚接着剤 (SSA))、2 つの異なるポリ-(dimethyl siloxanes) は、生物学的効果と接着特性の深さの調査に使用されています。複合フィルムは、柔軟なバッキング層・接着剤の上塗りで構成されます。両方のレイヤーは、ドクター刃アプリケーション技法によって製造されています。現在の調査で層の厚さの関数またはトップ層のヤング率の変化として複合膜の接着挙動を調べた。PDMS のヤングは、架橋剤の混合比にベースを変化させることにより変更されています。さらに、SSA の膜の厚さは約 16 μ m から約 320 μ m. 走査型電子顕微鏡 (SEM) に多様されている、光学顕微鏡は、厚さ測定のために使用されています。エラストマー フィルムとの接着は、膜厚、ポリマーと表面特性のヤング率によって強く決まります。したがって、表面粗さを示すガラス基板上にこれらのフィルムの通常の接着が検討されています。引き剥がし応力との分離作業は、シリコーンエラストマーの混合比に依存。
さらに、支持の支持層の上に置かれた柔らかい肌接着剤の厚さは、皮膚用パッチを生成するために多様されています。(混合比 10:1) PDMS 薄膜や SSA 映画 (混合比 50: 50) L929 マウス線維芽細胞の細胞接着、増殖細胞毒性が行われています。我々 は示されているここでは、初めて、両ポリマーの製造複合薄膜の横に並べて比較とその生物と粘着特性の調査を提示します。
概要
このプロトコルでは、エラストマのフィルムの生産のための詳細な手順が掲載されています。広く利用可能なドクター刃技法は、複合薄膜の生産のために使用されています。製造技術は、大規模なこれらのフィルムの後続の生産を有効にする polyethylenterephtalate (ペット) 箔に行われています。このプロトコルの重点は、再現性、正確な複合膜の異なる層と最終的な複合材パッチの生物と接着特性の定量の製作の評価です。シリコーンのエラストマー ポリジメチルシロキサン (PDMS) は皮膚接着剤、マイクロ流体アプリケーション、その他の研究フィールド1,2,3 の生産を含む医療技術で広く使用されて ,4。最近、いわゆる柔らかい皮膚接着剤 (SSAs) PDMS の別のサブクラスは導入された、穏やかな皮膚の接着・非接着の特定されています。
シリコーン SSAs は、類似高分子シリカ5を補強の有無によって異なる官能基化ビニール エラストマーです。他の PDMS、SSA のようなヤング合わせることができる広い範囲で変調架橋剤濃度または硬化時間6,7,8。シリコーンエラストマーのヤング率の変化材料の接着特性に大きく影響し、表面9,10上で培養した原核生物と真核生物の細胞にも深遠な影響を持って,11. 細胞の生物学的レベルのそれを示した、真核細胞がマトリックスの弾力性の変調や表面9,10,12 の厚さに信号伝達レベルに対応 ,,1314。したがって、可変機械的性質を持つ高分子の細胞文化アプリケーションで広範な関心が存在します。重要なは、シリコーン系エラストマーの本質的に低表面エネルギーは、真核細胞の細胞培養に最適な条件を提供しません。酸素プラズマ処理は PDMS 低表面エネルギー、一時的に引き剥がし強度の向上につながるを高めるため広く使用されている手法は並列添付ファイル、拡散を推進中の分子の表面吸着を減少し、真核細胞15,16,17,18の増殖。
材料特性に加え表面の地形は細胞接着と接着剤 2 つ材料19,20,21,22相互に大きく影響します。表面粗さは、2 つのサーフェス間接触の形成に関するいくつかの効果: 高接触面積の削減にアスペリティをき裂伝ぱに及ぼす影響は、接着強度23を変えることができるだけでなく周囲の弾性エネルギーが格納されています。 24。人間の皮膚に粘着の接着は新興分野、例えば、創傷被覆材、心電図電極の固定または他ウェアラブル電子機器25,26,27、 28。表面地形に関連しての自己接着剤の接着性能を測定するには、通常接着測定8、21の粗さの度合いとガラス基板を使用できます。ここでは、2 枚のガラス基板は、高分子膜の接着特性を調査する選択されています。混合比の異なる PDMS 10 に 1 の重量部品の混合比の PDMS バッキング層と最初、複合フィルムは特徴付けられました。2 番目のステップでは、両方の成分の等しい重量量とサポート PDMS 膜上の膜厚を変化に接着 SSA 層が準備されました。
プロトコル
注意: 使用前に関連するすべての材料安全データ用紙 (MSDS) を参照してください。このプロトコルで使用される化学物質の一部は、急性毒性や発癌性の刺激です。これらの化学物質を処理する場合は、すべての適切な安全対策を使用してください。これは、工学 (化学キャビネット) および個人の使用が含まれています保護具 (保護メガネ、手袋、白衣、フルの長さのズボン、閉じてつま先の靴)。次の手順の一部は、動物の細胞ラインの文化を含みます。したがって、特定のバイオ セーフティ規則に従ってください。化学・生物兵器の廃棄物は、特定の国および教育機関の規則と推奨事項に従って破棄する必要があります。
1. シリコン弾性薄膜複合材構造の作製
-
ポリマーの合成
- 化合物 B の 0.1 g と化合物 A の 1.0 g を混合比 10:1 で PDMS の 1.1 g を準備するには
- ミックス、degase 下 2350 rpm で速ミキサー前のポリマーを 3 分の掃除します。
- 化合物 A と化合物 B の質量比を持ち 45: 1 と 70:1 に変更します。1.1.2 で説明する方法のようにそれらを準備します。
- 50: 50 の比率で柔らかい肌接着剤 (SSA) の 1 g を準備します。したがって前述の 1.1.2 の化合物 A と化合物 B の 0.5 g に 0.5 g をミックスします。
-
ペット箔被覆ポリ-(vinyl alcohol) (PVA) 作製
- PVA を脱イオン水に追加することによって 18% (w/w) PVA 水溶液の水を準備し、磁気スターラー混ぜて一晩。4 ° C でこのソリューションを格納します。
- 医師ブレード アプリケーション マシン、ブレードの 100 μ m ギャップと約 2.0 mm/秒の速度を使用して効果的な厚 15 μ m を示す薄膜を準備します。
- 95 ° C 15 分でオーブンに作品を配置します。
-
ドクター刃技法による PDMS 10:1 混合比のバッキング層の作製
- 薄膜の作製の準備のために自動的に制御された医師ブレード アプリケーション マシンを使用します。
- 100% イソプロパノールでペット箔をきれいにし医師ブレード アプリケーション領域の表面の上に置きます。
- 箔の上にドクターブレードを置き、ネジを位置決めマイクロで厚さを調整します。湿層の製造、60 μ m、100 μ m、200 μ m、500 μ m の厚さに適用されます。
- PDMS 10:1 高分子の単回使用の注射器、ドクターブレードの貯水池に 1.1 の手順で作製をご記入ください。約 2.0 mm/秒の速度で、ブレードの動きを開始します。
- マシンから応用の 10:1 のコーティングを施した PET フィルムを外し、95 ° C、湿度 40% と 65% の間を展示室で 1 時間オーブンにそれを置きます。
- イソプロパノール、ペーパー タオルとドクターブレードをクリーンアップします。
- すべての必要な厚さのためには、この手順を繰り返します。
-
医師ブレードによる混合比が異なるの PDMS の最上位のレイヤーの準備
- メスまたは配置できるようにかみそりの刃と基になるフィルムの長さの側面とでペット箔、ドクターブレードのスライディングの細いストライプを削除します。
- 1.3.3 に 1.3.6 プロトコル手順に従います。湿式厚フィルムの適用は 160 μ m です。
- PDMS コンポーネント (持ち 45: 1 および 70:1) の別の混合比を持つ 2 つの独立したフィルムの生産のためには、この手順を繰り返します。部屋の温度でフィルムを保存 (約 22 ° C、40 および 65% の湿度) 汚染やほこりからそれらを防ぐために正方形のペトリ皿に。
-
SSA の 50: 50 層の異なる厚さを示す複合薄膜の作製
- 手順 1.3 で前に説明したバッキング層として PDMS 10:1 映画を準備します。
- 1.4.1 とこれらの映画を生成する 1.4.2 プロトコル手順に従います。50: 50 の混合比率で SSA を使用し、湿式厚 40 μ m でフィルムを製造します。
- 追加のウェット膜厚に対して手順を繰り返します: 120 μ m、300 μ m、500 μ m。
2 表面粗さの異なる基板を用いた通常付着測定
-
表面粗さの異なるガラス基板の作製と評価
- '滑らかな基板」として直径 2 mm のガラス シリンダーを使用します。
- 曇らされたガラス スライドから約 4 × 4 mm の寸法で一枚ガラス カッターで '大まかな基板」消費税を製造。研磨ダイヤモンドのハンドパッドを使用すると、直径約 3 mm の円形の領域を取得できます。
- ガラスを UV 接着剤でアルミ コーンに添付し、3 分に UV 照射室の中それを照らします。
- 光学顕微鏡で基板の表面領域の半径を決定します。数式の A によると面積を計算する πr2を =。
- 決定する粗さパラメーター R、 Rz (によると: DIN EN ISO 4287、ASME B46.1) スタイラスの測定機を持つ。
- 基板を測定機の試料ステージに貼るし、先端をもたらす (ダイヤモンド、標準: 2 μ m/60 °) サンプルと接触します。
- 0.3 mm/s の速さと長さ 1 mm の粗さ形状を記録します。
- 表面の地形を分析し、スタイラス粗さ計は、関連するソフトウェアによって運営と丁度 1 mm2の面積を測定します。
注: 外部のコンピューター、測定機が運営しています。ホルダーは y 方向に 0.001 mm ずれるが x に達すると 1 mm の変位方向。記録されました。サーフコム マップ エキスパート ソフトウェア 3 D 画像を作成するに RS3 ファイルがインポートされます。
-
薄膜 PDMS や SSA で製造の通常の密着性評価
- UV 接着剤でスライド ガラス上に約 4.0 cm2と場所のエリアと小さな断片にペット箔にフィルムをカットするのにかみそりの刃を使用します。3 分間紫外線を照らします。
- 高分子サンプルを試料ホルダーにマウントします。
- エタノールで軽く表面乾燥窒素ガスで基板をクリーニングします。
- ロードセルに、アルミニウム コーンにマウントされているガラス基板を取り付けます。
- 傾斜可能なテーブル (ゴニオ メーター) を使用して、正確に近づいてポリマー フィルム基板の傾き角度を調整することによって表面を揃えます。これを行うには、手動でフィルムと接触して基板をもたらします。カメラ画像による可視化、お互いに両方の表面の完全に並列配置が得られるまでは、傾斜角度を変更します。
注: ロードセルは、可倒式のテーブルに接続されます。図 4、2 台のカメラとの接触面積の可視化ができ、ポリマー フィルム基板の配置を有効にするのに示すように、サンプル下ガラスのプリズムがあります。 - 13 ± 5 kPa の予圧圧力はまでの高分子膜表面に基板を実現 (図 4) を移動します。
- などで必要な測定パラメーターを保持時間とアプローチ/収縮速度コントロールに LabView で書き込まれるカスタム プログラムされたソフトウェア パッケージを開始します。保持するホールド時間 t は 1 秒でアプローチ、剥離速度はそれぞれ 30 μ m/s と 10 μ m/s。
- 3 つの独立した製造されたサンプル、各フィルム表面に六つの異なる場所で密着性測定を実行します。
-
データ分析と重要な機械要素の計算: 引き剥がし応力との分離作業。
- 応力を計算
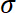 S基板エリアによって記録された力で割って。
S基板エリアによって記録された力で割って。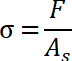
- 垂直応力の最大値として記述されている引き剥がし応力を決定します。
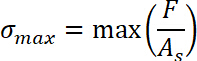
- ド結合が完了したサンプル位置 s の終わりから引張政権の0の開始位置の加減によって変位 Δs を取得します。S0として引張の政体の開始を定義する 0 を =。
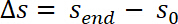
- 次の式に従ってシステム コンプライアンス C サンプル位置の測定値を修正します。
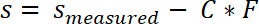
- 分離作業を計算するために s0と s端の応力変位曲線を統合します。

- 応力を計算
-
数学的な計算ソフトウェア原点を使用してキーの力学的因子の計算。
- 元のテーブルに 1 つの密着性評価から記録された .dat ファイルをインポートします。記録されたパラメーターは、時間、サンプル位置と力です。これらのパラメーターに列 A (時間)、B (サンプル位置) と C (力) を挿入します。
- 空白の値を決定するには、高分子膜を連絡する前に力の約 20 の測定値の平均値します。この平均値 Fオフセットに名前を付けるし、D 列に貼り付けます
- バック グラウンドの補正を計算する次の式に従ってを強制的に F *

E 列に、以下のようにこの方程式を挿入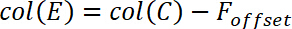
- ゼロ変位,すなわち, s0として引張の政体の開始を定義する 0 を =。したがって、s0を決定および列 B の移動距離からそれを減算し、列 F に保存
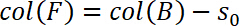
- さらに、コンピューターの準拠によってサンプル位置を修正します。この補正は列 G. 挿入 G 列に次の式で実行されます。
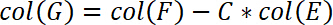
- 次の列 H の応力を計算します。そのため、基板面積で力を分割します。次の式を挿入します。
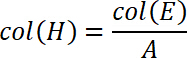
A は mm2 (2.1 で判断) でガラス基板の表面の面積。 - 応力と変位の値からの分離作業を計算します。したがって、x 軸方向変位と軸応力をプロットします。Sエンドのエンドが引張応力がゼロに戻る変位として定義されている、s0からこのグラフを統合、すなわち完全剥離が起こった。グラフを統合するには、統合機能を選択します。I と J 列に集計値を追加します。
3. 走査電子顕微鏡 (SEM) と光学顕微鏡による薄膜の解析
-
光学顕微鏡
- かみそりの刃で細かく (約 0.25 cm2) 高分子フィルムをカット、スライド ガラスの端に取り付けます。スライド ガラスの場所は垂直方向正立顕微鏡下で配向し、膜断面の厚さを測定します。
注: 使用 20 × 対物 (NA = 0.45、理論上解像度 800 nm 1.1 μ m の) 約 ≤ 20 μ m の膜厚値を測定します。フィルム厚み 50 μ m まで 20 μ m の範囲で使用して 10 × 対物 (NA = 0.30、理論分解能 800 で nm 1.6 μ m の) フィルム厚さ ≥ 50 μ m 使用 5 × 対物 (NA = 0.15、800 で理論上解像度 3.3 μ m の nm)。
- かみそりの刃で細かく (約 0.25 cm2) 高分子フィルムをカット、スライド ガラスの端に取り付けます。スライド ガラスの場所は垂直方向正立顕微鏡下で配向し、膜断面の厚さを測定します。
-
SEM 観察
- ペット箔をカットし、スライド ガラスに約 2 cm2のサンプルを添付サンプル ホルダー ≤ ホルダーの上面の下 2 mm 内側クランプ機構に垂直方向に配置します。
- 選択加速電圧 10 kV、反射電子検出器 (BSD)、低真空環境 (60 Pa)。
- フォーカス、倍率、明るさ、画像のコントラストを調整します。
- 28 の画像の取込時間を選択 s 1024 x 2048 ピクセルの解像度を持つ。
- SEM の試料ホルダーを削除します。
4. 生物学的検討
- ルーチン文化 L929 細胞
- 調査のためマウス線維芽細胞のセルライン L929 を使用します。ローズウェル公園記念研究所 (RPMI) 1640 基礎培地で細胞の培養 10% 牛胎児血清と 37 ° C でペニシリンとストレプトマイシン補われる、5% CO2コート t75 フラスコ細胞培養フラスコ。合流点の約 70% から 80% で細胞を通路します。
- セルを通過すると、吸引によって媒体を削除し、カルシウム ・ マグネシウム無料リン酸バッファー (DPBS-/-) 30 で洗って s の下に層流のキャビネット。その後 Accutase と蛋白分解酵素液 2 mL で細胞をインキュベートし、37 ° c、5% CO2を 5 分程度のコラゲナーゼ活性。
- 位相差顕微鏡で細胞培養フラスコ表面から細胞の剥離を確認します。
- 血清を含む 8 mL を加えるフラスコに 15 mL の反応チューブに細胞懸濁液転送中。
- 細胞懸濁液の 10 μ L のサンプルを取るし、トリパン ブルーの 10 μ L で混ぜます。
- ノイバウアー商工会議所と携帯電話の番号を確認して、セルの合計数を計算します。
注意: トリパン ブルーは毒性が強いため、MSDS に記載されている必須の手順、MSDS をコンサルティング、身に着けている適切な個人の安全保護と化学キャビネットの下処理が必要です。化学廃棄物の堆積のため廃棄物を収集します。
注: トリパン ブルー陽性細胞は青で、非そのまま細胞膜を示します。 - 次の通路では、文化 5 x 105 10 ml の新しい媒体の新しい無菌細胞培養用フラスコ細胞。実験条件は、3 × 10 6 ウェル プレート5細胞と高分子サンプル (プロトコル手順 4.2) を含む、24 ウェル プレートの各ウェルに 6 × 104セル。
- 細胞培養実験の複合膜の作製。
- 直径 12 mm. の展示ガラス カバー スリップの表面にピンセットとメスと場所でペットの支持層からプロトコル手順 1.4 と 1.5 で製造されて、指定した大きさのフィルムの単一の部分を消費税、2 の井戸の中のサンプルを配置します。4 ウェル プレートします。
- 細胞毒性測定および細胞数、ペット箔からフィルムを削除しないでください。約 9.4 cm2の円形の領域を切り取り、映画からの 6 ウェル プレートの単一の井戸にちゃんとフィッティングは 1.4 と 1.5 で生産し、細胞培養プレートのウェルに配置します。
- 脱イオン H2O の ≥ の高分子試料を浸漬 30 分。
注: 高分子のサンプルは、オートクレーブに入れることによって殺菌する可能性があります。したがって、細胞培養皿からすべてポリマー含んでいるサンプルを削除し、ガラス シャーレ内に配置。2.05 バー 121 ° C の温度で 20 分間のオートクレーブで滅菌され
- 高分子のプラズマ処理
- ペット箔または丸いガラス カバー スリップ (4.2.1 で製造) プラズマ装置の反応チャンバ内に添付されている映画を配置します。
- 蓋を閉めるし、1.6 x 10-2 mbar の圧力に達するまで避難。
- 3 分のプラズマ処理を実行します。
- 反応チャンバーし、よく 24 またはそれ以上細胞文化調査のため 6 よく料理サンプルを配置します。
- 拘水接触角の測定の 1 つのサンプルを使用します。したがって、ソフトウェア パッケージを使用して高分子の表面近くに注射器を移動し、表面の上に 3 μ L の水一滴を配置します。ゴニオメータ ソフトウェアと静的水接触角を計算します。
- 染色と顕微鏡観察
- 4.1.7 のステップと 37 ° C、5% CO2で 3 d のための文化の説明に従ってセルを準備します。
- 自然のままで 3 日間培養した細胞の位相コントラスト画像をキャプチャ-プラズマ処理による固定の直前に映画と。
- 0.2% 添加 PBS を準備トリトン X 100。ゆっくりと 100 mL の PBS (PBS-T) にストック溶液 200 μ L をピペットします。
- 4% パラホルムアルデヒド/PBS 溶液 (PFA/PBS-T) を準備します。
注意: パラホルムアルデヒドは毒性が強いため、MSDS に記載されている必須の手順、MSDS をコンサルティングと適切な個人の安全保護の身に着けていると化学キャビネットの下処理が必要です。 - 5 %bsa/PBS-T ソリューションを準備します。
- 薄層流れのキャビネット下の吸引細胞診でメディアを削除します。中の残基を削除する井戸に PBS を追加します。
- 化学のキャビネットにプレートを転送し、室温で 25 分の PFA/PBS 溶液 400 μ L で PBS を置き換えます。
- 4 回単一の井戸、慎重に PBS で洗浄から PFA/PBS ソリューションを削除します。各洗浄工程間 3 分待つし、化学廃棄物処理のソリューションを収集します。プレートを直接使用するか、4 ° C で保存
- 5% ウシ血清アルブミン (BSA) を追加/井戸に PBS T と非特異的結合部位をブロックする RT で 60 分間インキュベートします。
- ソリューションを吸引し、アレクサ 488 (希釈 1: 160) に共役ファロイジンを置き換えます/PBS T ソリューションを補完 0.2% トリトン X 100。
注意: 488 ファロイジンは毒性が強いため、MSDS に記載されている必須の手順、MSDS をコンサルティングと適切な個人の安全保護の身に着けていると化学キャビネットの下処理が必要です。 - アルミ箔と板のカバーや RT で 3 時間インキュベート 4 ° C で一晩
- ソリューションを吸引し、PBS にて 3 回洗浄します。各洗浄ステップの間の 3 分を待ちます。化学廃棄物処理のソリューションを収集します。
- ヘキスト 33342 色素の 1 μ L の溶液を調製 (貯蔵液 1 mg/mL)。ヘキストの 1: 1000 希釈ピペット 1 μ L の PBS T 3334 に 1 mL を染めるし、よく混ぜます。井戸にヘキスト 33342 水溶液 300 μ L を追加し、暗闇の中で室温で 10 分間インキュベートします。
注意: 染料ヘキスト 33342 は DNA デュアルインターカレーション試薬と必須の手順を MSDS の記載 MSDS および身に着けている適切な個人の安全保護と下処理したがって潜在的変異原性、したがってコンサルティング、化学のキャビネットが必要です。 - ソリューションを吸引し、PBS で 4 回サンプルを洗ってください。各洗浄ステップの間の 3 分を待ちます。化学廃棄物処理のためのソリューションを収集します。
- 埋め込み、慎重に文化面からフィルムを削除、顕微鏡スライド ガラスの上に置きます。フィルムに水可溶性埋め込む媒体の 20 に 40 μ L を追加し、上わずかな圧力を使用して新しい円形のガラス製カバー スリップを添付します。
- 蛍光顕微鏡を用いたイメージングを実行します。照明用フィルター: アレクサ 488 は、496 励起最大 nm、最大排出量は、519 nm。したがって、発光色は緑色です。ヘキスト 33342 染料 trihydrochlorid 三水和物 DNA との複合体は励起 355 nm で最大最大 DNA の複雑な放射は、465 nm。
- 細胞毒性の測定、細胞数の測定
- 6 4.3 準備したプレート、4.1.7 の手順で作製した電池で育った細胞で実験を実行します。37 ° C、5% CO2で 3 日間培養します。肯定的な制御、高分子膜を含む細胞治療文化ポリスチレン表面上に成長した細胞を使用します。背景の定量 (否定的な条件)、セルなしの井戸からメディアを取得します。
注: 媒体は、細胞治療文化のポリスチレン表面の培養も含む細胞からも撮影することができます。 - 実験サンプルの数に応じて 15 mL チューブ ラベルを付けます。
- 肯定的な制御に 0.9% トリトン X-100 含む PBS 溶液 40 μ L を加え、1000 μ L チップで精力的に混ぜます。約 3 分待ちます。
- 表面にセルを削除せず 4.5.3 で作製したサンプルを含む、すべてのサンプルから培地を吸引し、媒体を 15 mL チューブに転送します。単一の井戸に DPBS-/-の 3 mL を追加し、流 4.5.9 に従って細胞数定量のキャビネットの下の版を保存します。
- 200 x g で 3 分間遠心し、LDH 活性測定の上清 1 mL を削除します。15 mL の管細胞を含むとキャビネットの層流中の残りを保存します。
- 試金のため底が平坦な黒 96 ウェルのプレートが使用されます。50 μ L のサンプル中、30、ミックスに CytoTox 1 試薬 50 μ L を追加 s。
- アルミ箔と板をカバーし、10 分間室温保管
- 各ウェルに停止液を 25 μ L を追加し、蛍光プレート リーダーで蛍光強度を記録します。10 のプレートを振る s 520 の励起波長と蛍光信号を検出、nm、発光波長 560 nm。空気の泡を避けるため。
- セル番号吸引 DPBS-/-プロトコルから培養プレートの井戸からの定量ステップ 4.5.4 しプロトコル手順番号 4.5.5 で収集した培養上清を含む 15 mL の反応管にソリューションを追加します。
- 3 分間 200 x g で 15 mL の反応管を遠心し、上清を吸引します。トリプシン/EDTA の 0.5 mL を追加し、37 ° C で 10 分間インキュベート
- プレートの井戸にトリプシン/EDTA で 2 mL を追加し、高分子膜からの細胞をデタッチする 37 ° C で約 10 分間インキュベートします。
- 細胞懸濁液は、ステップ番号 4.6.10 から 15 mL の反応管に転送されます。さらに、媒体を含んでいる血清と精力的にプレートを洗います。
- 3 分の 200 x g でサンプルを遠心、上清を吸引し、管に媒体を含んでいる血清を追加します。
- 4.1.5、4.1.6 の手順に記載されている携帯電話番号を決定します。
- 6 4.3 準備したプレート、4.1.7 の手順で作製した電池で育った細胞で実験を実行します。37 ° C、5% CO2で 3 日間培養します。肯定的な制御、高分子膜を含む細胞治療文化ポリスチレン表面上に成長した細胞を使用します。背景の定量 (否定的な条件)、セルなしの井戸からメディアを取得します。
結果
最初の実験では、PET フィルム (図 1) にさまざまな厚さおよび一定した混合の比率は 10:1 と PDMS 薄膜を製造されています。バッキング層の厚さに大きく影響するので剛性や 13 ± 2 μ m と 296 ± 13 μ m の単一映画だった初期の実験では、全体の複合膜のプロパティの処理は、(図 1) を製造しました。それはよく知られている、高分子膜の硬化プロセス収縮中に発生です。薄フィルム用ウェットと硬化条件の 3.1% 78% ± の違いを見ました。厚いフィルムの収縮率 40.9% ± 2.6% がされているは (図 1) を検出しました。
このプロトコルで提供されるアプリケーション、映画ペット箔から手動で削除する必要があります。我々 は、特に薄膜を鉗子で扱いにくいこの処理中に破棄されます多くの場合、認識。したがって、影響の薄いポリ (ビニル アルコール) 支持層としてコーティングを行った。PVA は、高い剛性を持っているし、下流のアプリケーションで水溶解性の関係を簡単に取り外せます。応用 PVA コーティング約 17 μ m の厚さがあり、したがってこのレイヤーの上に PDMS 膜は PVA コーティング (データは示されていない) なしフィルムと比較して少し薄い。特に操作性に着目し、我々 を締結、極薄のフィルムだけがペット箔からの除去のための支持の PVA フィルムを必要とすること。
有効膜厚は約 40 μ m は、すべてのそれ以上の実験のために選ばれました。複合フィルムの生産のため PDMS の混合比は持ち 45: 1、70:1 10:1 から変化され医師刃技法 (図 2 a) で以前重合 PDMS 膜上に適用されます。10:1 の比率を除いて、適切な精度と光学顕微鏡による別の映画を明確に区別できます。顕微解析映画でメスでカット、スライド ガラスの端に接続されています。トップ層の高い混合比がバッキング層 (図 2 b) の 10:1 の比率と比較して顕微鏡画像の視覚的に明るい登場。さらに、走査電子顕微鏡観察 (図 2) 約 860 X の倍率で試料を画像に使用されました。10:1 の比率とは対照的、製造、混合率が高く、2 つの PDMS 映画の明るさがはっきり観察可能な違いが認められました。切断手順の SEM 写真 (図 2 b) で目に見えるマークを残します。これらの結果に基づいて、複合膜の平均全面的な厚さだった 112 μ m ± 5.0 μ m (図 2 D) です。
さらなる実験でこれらのフィルムの密着性は、2 つの異なるガラス基板 (図 3) を使用して正常な力付着測定と決定されています。'滑らかな基板」は、算術平均粗さ R、 0.013 ± 0.0002 μ m と 0.12 ± 0.004 μ m (図 3 a) の平均ピークの谷 Rz表面テクスチャを持っています。基板 2 (GS2、ラフとして指定) 0.338 ± 0.021 (Rを) μ m と 2.055 ± 0.017 μ m (Rz) の粗さ値を出展した (図 3 b)。平均 2.1.4 '滑らかな' 基材の表面積は 'ラフ基板 6.07 mm2の面積の 3.2 mm2で得られた半径を計算されています。
これらの 2 つの基板を別のフィルムの接着挙動が判明しました。膜の接着特性を記述する 2 つのパラメーターが選択されます: 引き剥がし応力 σmaxと分離 W9 月の作業。接着・非接合サンプル位置の全体のプロセスの中に s および正常な力 F が記録されます。結果は、応力・変形曲線 (図 4) で表されます。
実験結果の正しい解釈、高分子膜表面に基板を正確に合わせて重要です。また、測定装置のコンピューターの準拠は、変位を修正するために考慮する必要があります。測定の間に応用力は、サンプルだけではなく試験装置の他の部分にも機能します。したがって、2 つの基板の各は 13 ± 5 kPa の圧縮応力とスライド ガラスに押し付けています。コンプライアンスを測定するには、負荷曲線は考慮に入れ、すなわち力-変位曲線の部分 2 つのサーフェスが接触正確な予圧に達すると、サンプル位置まで来る。曲線の相互の傾きがコンピューターの準拠 c. と等しいC の計算値は、0.12 μ m/ミネソタです。
最初の実験で PDMS の混合比が異なる膜を行った (図 5)。複合フィルム用には、厚さと PDMS 10:1 の製造、裏付けの層の混合比が一定に保たれました。トップ層の厚さはまた 65 μ m の値で一定に保たれました。(図 5 a) PDMS 10:1 映画に滑らかなガラス基板を用いた 109 ± 27.6 kPa の最も高い引き剥がし応力を求めた。混合比の増加は、70:1 比 41.4 ± 17 kPa 持ち 45: 1 混合比率は 76.7 ± 17 kPa に引き剥がし応力の減少につながります。22 ± の粗いガラス プリング ・ オフ基板ストレス 2.2 kPa PDMS 10:1 映画に断固としただった。一般に、分離の仕事の両方のガラス基板、例えば間で比較した、1.4 ± 0.6 J/m2の極薄フィルムを用いて滑らかな基板、極薄のフィルムに 1.84 ± 0.7 J/m2は大まかな基板 (で得られた。5 b を図)。
次に、アプリケーションがされている細胞培養、皮膚用薄膜の生産は (図 6) を検討しました。SSA 50: 50 は、複合膜の最上位のレイヤーの生産のために使用されています。PDMS、1:10 混合比約 40 μ m の厚さでは、裏付けの層として使用されています。混合比が一定に保たれた、図 5に, 以前の実験とは異なりトップ層の厚さが変化させた (図 6 a)。SSA は高い表面粗さ、特に人間の皮膚表面に添付ファイルを含むアプリケーションで、接着性のため混合比 50: 505,8のメーカー推奨を使用して選択されています。人間の表皮には、高い表面粗さが所有しています。年齢に応じて、解剖 48 μ m と 71 μ m の平均表面粗さ深さ (RZ) がされている地域は29を報告しました。安全で穏やかな皮膚密着性は重要ですが、新生児のまたはほとんどの敏感肌用の特殊性は高齢者の皮膚を再生成します。異なるウェット厚さ 40 μ m、120 μ m、300 μ m から 500 μ m に至るまでが適用された (図 6 a)。ウェット膜厚依存複合膜の合計の厚さは、51 μ m および 344 μ m (図 6 b) によって異なります。硬化後コンポジットはボランティアの手 (図 6) の背部に添付されました。別のフィルムの厚さは (図 6) 皮膚の粗さに自分の順応特性の違いを明確に示します。薄膜 (50 μ m ・ 100 μ m 厚) は、(220 μ m と 340 μ m 厚) の厚いフィルムに比べて皮膚のしわに適応率が高いを表示します。応用医師刃技法と正確に複合膜の厚さの広い範囲を作り出すことができることが示唆されました。
これらの複合膜 (図 7) で実験を行った。SSA のトップ フィルムの厚さに応じて、我々 は、膜厚の増加と引き剥がし応力の減少を観察しました。最高の引き離し力 133 ± 36.6 kPa の滑らかな基板 (図 7 a) を測定しました。厚いフィルムの荒い基板 18 ± 4 kPa の低ストレスをオフのプルが得られました。興味深いことに両方の基板間の比較は、薄フィルム (図 7 a) の 2.7 倍の違いを明らかにします。増加の膜厚と厚い膜上特に顕著な違いはありませんでした観測 (図 7 a)。滑らかな基板を用いた 1.8 ± 0.8 J/m2は約 100 μ m の合計の厚さを示すフィルムを検出される分離の作業は続いてフィルム厚さ依存減少 (220 μ m 厚さ: 1.6 ± 0.6 J/m2と 330 μ m: 1.3 ± 0.4 J/m2(図 7 b))。大まかな基板上で測定した分離の作業は一般的に滑らかな基板にに比べて若干安 (100 μ m 厚さ: 1.63 ± 0.6 J/m2; 220 μ m 厚さ: 1.1 ± 0.6 J/m2と 330 μ m: 1.0 ± 0.2 J/m2 (図 7 b)).
さらに、剥離が生じるメカニズムは、測定 (図 7) 中に記録されました。小さなキャビテーションは、亀裂のような指の出現であった (図 7) の厚いフィルムで観察可能、極薄のフィルムで観察されました。
測定は、膜の製造後 1 ヶ月以内に行われています。ただし、安定性と弾性膜の機械的性質の保存は、温度、湿度などの環境要因によって影響を受ける可能性があります。プロトコル手順 1.4.3 で説明した、映画は、部屋の温度と湿度 40-65% で格納されています。防ぐために、汚染やほこり、映画からそれらは暗闇の中でプラスチックのシャーレに格納されています。長期的な安定性、付着測定および SSA の膜厚測定を調査するには、50: 50 映画は作製後約 4 ヶ月間行われています。貯蔵の後ない膜厚、引き剥がし応力分離の仕事の主要な影響が検出されました。たとえば、120 μ m SSA のウェット膜厚と湿式厚 100 μ m PDMS 製 SSA 複合膜の引き剥がし応力は作製後 46.6 ± 6 kPa そして分離 1627 ± 592 mJ/m2の仕事をだった。製造後、約 4 ヶ月間 48.8 ± 5.4 kPa の引き剥がし応力を行い、1666 ± 723 mJ/m2の分離が決定されました。さらに、製造業、これらのフィルムの合計の厚さでは μ m ± 13.9 103.3 直後とストレージ 98.1 ± 9.1 μ m 後。
さらに実験 PDMS 10:1 と SSA 50: 50 複合フィルム総厚約 105 μ m で細胞培養基板 (図 8) として使用されました。プロトコル番号をステップ 1 で製造された複合膜を簡単にペット箔から削除され必要な寸法と幾何学的形状にカットすることができます。剛体にフィルムを付着すると例ガラスの表面は、別のヤング係数を表示する複数のフィルムに並べて取り付けることがしかも細胞培養プレートの単一の井戸の中に置かれるかもしれない。映画は、追加 coverslip せず直接ポリスチレン表面に接続可能性があります。また、フィルムは異なった表面と幾何学的構造、チューブや指輪、さらに従来の細胞培養材料と達成可能でない研究を有効にするように適応かもしれません。図 8に行われた実験でペット箔複合膜は、細胞培養皿に直接配置されているまたはフィルムをペット箔から削除しガラス カバー スリップ上に配置します。実験条件のいくつかのポリマーは、自由表面エネルギーを増加する空気プラズマと扱われています。一般的には、PDMS プラズマ治療の前に約 115 ° の水接触角を所有しているし、超親水性になります (水接触角 < 30 °) 後処理8。プラズマ処理は、生体適合性表面をレンダリングし、真核細胞の付着を容易に。治療時間と強さに応じて高分子表面は変更、粗さの高度を表示する、また亀裂が表示ことがあります。治療後すぐに疎水性回復過程が観察されます。プロトコル手順 4.3.5 拘は静的水接触角を決定に使用されました。したがって、空気プラズマ治療後 ddH2O 1 h のために配置されているポリマーを行った後。プラズマ処理水の接触角を大幅に削減する (PDMS 原始的な: 117.0 ± 2.2 °;原始的な SSA: 127.9 ± 5.6 °;PDMS プラズマ: 18.0 ± 7.2 °;SSA プラズマ: 29.3 ± 11.5 °)。
水の土台を埋め込むサンプル媒体を適用されています。任意の時点でサンプルをもう一度削除する必要があります、標本が一晩シャーレを含む水で配置できます。最終的には、追加の分析のためカバー スリップを削除できます。
添付ファイルの動作と PDMS、SSA の 50: 50 複合膜 3 日間シード L929 細胞の形態が決定された位相差顕微鏡と蛍光標識ファロイジン 488 とヘキスト 33342 (図 8) 色素染色後。また、画像の入力位相差顕微鏡と強くお勧めします特にポリマーのプラズマと扱われないため。これら高分子表面に弱い細胞接着のため単一セルまたは集計簡単に切り離されます、その後の分析の方法の正しい解釈を複雑します。
原始的なポリマーに播種された細胞が貧しい人々 の添付ファイルを表示され、携帯コンフルエント単層中動作 (8A1 を図と C1) を拡散プラズマ処理表面 (図 8B1 と D1) の培養細胞の観察されました。.細胞凝集体の表面から剥離形成より原始的な表面に顕著であった。アクチン フィラメント 4% パラホルムアルデヒド固定明らかにいくつかの細胞の細胞凝集体の周縁と原始的な PDMS、SSA 50: 50 複合薄膜 (図 8A2ケラトサイト突起の発散に移行後の可視化・ C2、矢印)。両方の高分子材料を比較しながら大きな質的な違いはなかった。側の注意点としてそれが表示されます、細胞凝集体の少ない量に比べて PDMS SSA 50: 50 に存在していた。また、SSA 50: 50 上のサーフェスに接続されている集計よりフラット (図 8 1) 登場。予想通り、携帯電話の添付ファイルと両面に大きく広がり、驚くべきケラトサイト突起とコンフルエント単層 (図 8 b2 と 8 の 2) の形成につながる空気プラズマ処理が向上しました。
LDH の文化の 3 日後のリリースは、細胞毒性 (図 9 a) を決定するための指標として使用されました。一般に、LDH のレベルが 5% 未満で、両方の高分子材料上で培養した細胞に匹敵する細胞毒性 (原始的な PDMS: 2.8 ± 2.0%; 50: 50 SSA 原始的な: 4.5 ± 3.6%; プラズマ処理による PDMS: 3.4 ± 1.5%; 50: 50 プラズマ処理 SSA: 3.4 ± 1.6%)。これらの結果は、両方のエラストマーの調査に焦点を当てて私たちの以前に発行された研究で提示されたデータに匹敵します。8さらに LDH アッセイの結果を検証するため、トリパン ブルー排除テストが実行されました。また、セル全体人口は、増殖活性 (図 9 b) の相違点を表示する決定されました。一般的に 5% 未満トリパン ブルー陽性細胞が数えられた (原始的な PDMS: 2.4 ± 0.3%; 50: 50 SSA 原始的な: 3.8 ± 2.5%; プラズマ処理による PDMS: 0.74 ± 1.3% プラズマ処理 SSA 50: 50: 0.95 ± 1.6%)。
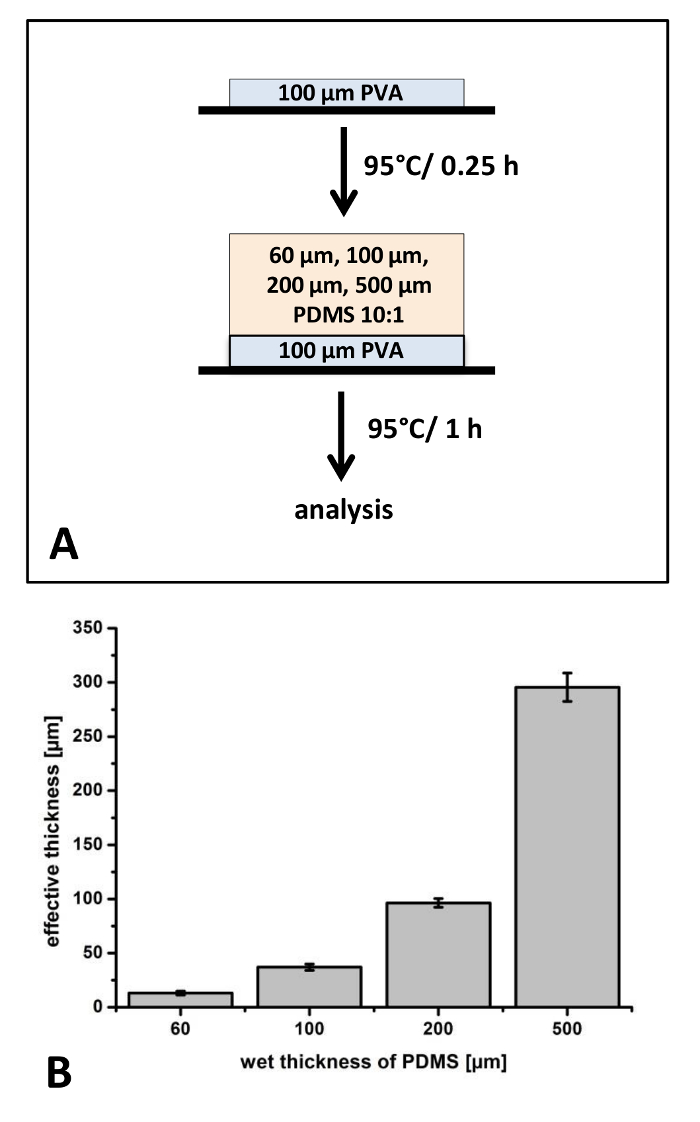
図 1: ペット箔被覆ポリ-(vinyl alcohol) (PVA) PDMS 薄膜作製:ペット箔の厚さを変化させると PDMS 薄膜の製造プロセスは、再現性とハンドリング性能 (A) 決定に適用されました。95 ° c (B) 硬化後の PDMS 膜厚の光学顕微鏡による行ったN = 3 独立していない製造された薄膜を行った。3 つの異なる場所が選ばれたそれぞれの映画から、カットと 3 位と各サンプルを分析した (k = 27)。エラーバーは標準偏差を表します。この図の拡大版を表示するのにはここをクリックしてください。

図 2: 異なる混合比率で作製した PDMS の複合膜の作製:PDMS の架橋 (コンポーネント B) に拠点 (コンポーネント A) の混合比が異なるを展示複合膜は、ドクター刃技法によって製造されました。最上位のレイヤーは、PDMS (コンポーネント A:B) の比率は 10:1 で構成される、持ち 45: 1 と 70:1 は以前硬化 PDMS 10:1 映画 (A) の上に適用されます。95 ° C でその後硬化後複合膜の厚さは、光学顕微鏡 (B) と (C) 走査型電子顕微鏡によって分析されました。N = 3 の独立した実験は実行され、光学顕微鏡 (D) と分析します。それぞれ独立した製造されたフィルムを形成、3 つの異なる場所が選ばれた、カットと 3 位と各サンプルを分析した (k = 27)。エラーバーは標準偏差を表します。この図の拡大版を表示するのにはここをクリックしてください。

図 3: 付着測定に使用される 2 つの基板の表面粗さ地形の定量:異なる表面粗さを有する 2 枚のガラス基板を特徴としました。'滑らかな' 基板 GS (A1) と 'ラフ基板 GR (B1) の表面の 3 つの次元の profilometric, 分析を行った.対応するシングル ライン曲線が描かれている A2 と B2)。この図の拡大版を表示するのにはここをクリックしてください。

図 4: 通常付着測定の原理:カスタム ビルドのセットアップは、ポリマー試料の接着特性を特徴付けるに使用されました。(A) 測定点の設定が描かれているし、(B) の詳細が表示されます。計測解析応力は応力時間曲線 (C) から判断されます。分離作業は、秒の終わりと s0 (D) の応力変位曲線の統合によって決定されました。この図の拡大版を表示するのにはここをクリックしてください。

図 5: と PDMS の混合比が異なる複合膜の接着特性の測定:引き剥がし応力 (A) PDMS の混合比 10:1、持ち 45: 1、70:1 で製造された複合膜の分離 (B) の作業は測定しました。分析のため '滑らかな' ガラス基板 (GS)、Rは= 0.013 μ m と Rと 'ラフ ガラス基板 (GR) = 0.338 μ m が使用されました。N = 3 独立していない製造された薄膜を行った。それぞれの映画から 2 つの作品が選ばれ、各サンプルの 3 つの異なるポジションを行った (k = 18)。エラーバーは標準偏差を表します。この図の拡大版を表示するのにはここをクリックしてください。
図 6: SSA の厚さを変化させるとの複合膜の作製:SSA 折半だった以前硬化 PDMS 10:1 映画 (A) の上に適用されます。40 から 500 μ m に至るまでこの層の異なるウェット厚さと硬化後膜厚を光学顕微鏡 (B) で検討した.手は、約 100 μ m (フィルム #2) 総厚膜 (C) 皮膚の粗さにも準拠している表示されるボランティアの背面にフィルムの添付ファイル。単一の層の厚さと複合フィルムの合計の厚さは、図 6 bに表示されます。分析 n = 3 独立して製造されたサンプルは光学顕微鏡を用いて測定しました。3 つの異なる場所が選ばれたそれぞれの映画から、カットと 3 位と各サンプルを分析した (k = 27)。エラーバーは標準偏差を表します。6 C のスケール バーを示しています約 1 cmこの図の拡大版を表示するにはここをクリックしてください。 。

図 7: 柔らかい肌接着剤の複合膜の接着特性の測定:最上位のレイヤーと PDMS 10:1 バッキング層として SSA の複合薄膜が製造されました。トップ層の厚さに変化させた 50 と 330 μ m. 引き剥がし応力 (A)、2 つの異なるガラス基板上で測定した複合膜の分離 (B) の仕事を行った (Rを出展 '滑らかな' ガラス基板 (GS)、= 0.013 μ m と Rと 'ラフ ガラス基板 (GR) 0.338 μ m を =)。剥離メカニズムの模範的な写真は、 Cで視覚化されます。データ分析 n = 3 独立製造実験を行った。それぞれの映画から 2 つの作品が選ばれ、各サンプルの 3 つの異なるポジションを行った (k = 18)。エラーバーは標準偏差を表します。7 C に縮尺記号を描く 0.5 mmこの図の拡大版を表示するにはここをクリックしてください。 。
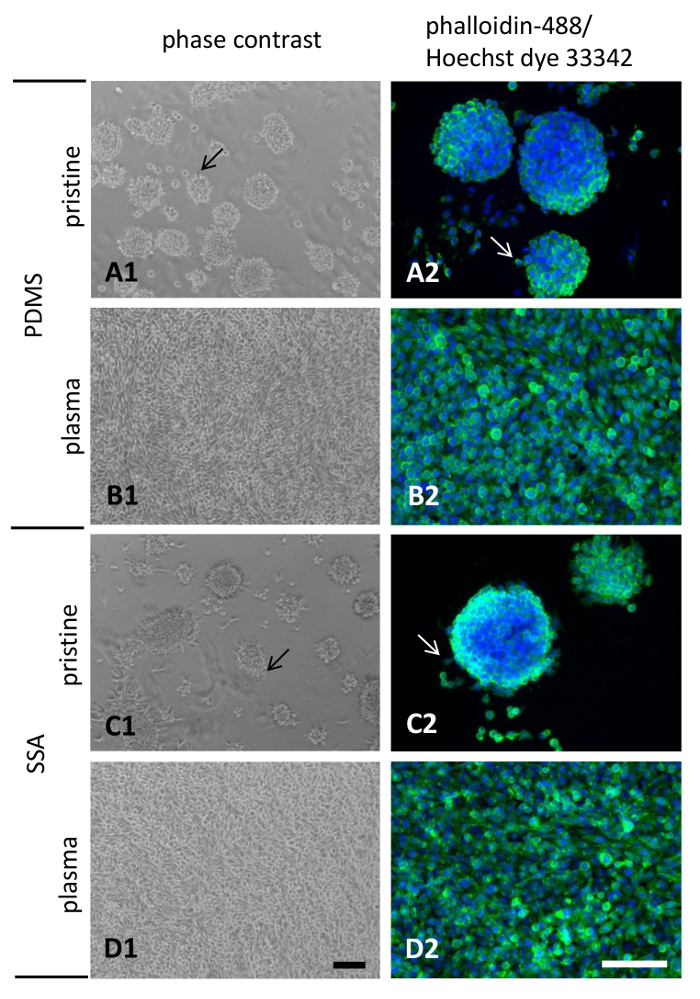
図 8: L929 線維芽細胞膜上で培養した細胞の形態:L929 マウス線維芽細胞は、PDMS (A1、A2、B1、B2) または SSA (C1、C2、D1、D2) から製造された薄膜 3 日間培養しました。空気プラズマ処理した表面の親水性を高めるため (B1, B2, D1, D2) を実行します。D1 と D2 でスケール バーを描く 100 μ m.この図の拡大版を表示するのにはここをクリックしてください。
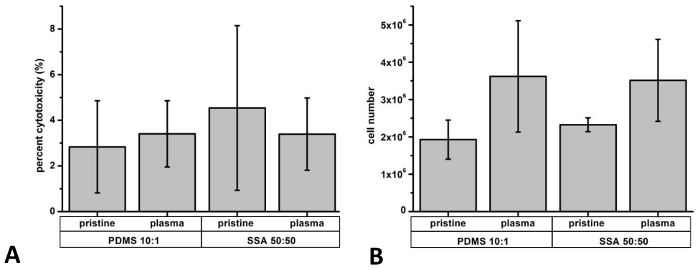
図 9: 細胞毒性や細胞増殖の定量:細胞毒性、細胞増殖の定量、PDMS 10:1 と SSA 50: 50 複合膜の三日間 L929 細胞を播種されました。乳酸脱水素酵素 (LDH) のリリース LDH 活性測定法によるし、5% 未満を明らかに細胞毒性 (A)。栽培期間後の細胞数は、ノイバウアー室 (B) 単一セルを数えるマニュアル後に評価されました。N = 3 が独立して、実験を行ったを行った。エラーバーは標準偏差を表します。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
複合構造物の設計には、ヤング率やサンプルの厚さなどの材料特性の簡単な調整ができます。PDMS のヤングは、2 つのコンポーネント間の混合比を変更することまたは別のシリコーンのエラストマー30,31を使用してブレンドの製造によって広い範囲で効果的に変更できます。説明の方法に限定されない PDMS の現在の調査で使用されるが、特に粘着性能は使用される特定のタイプによって強く決まります。このプロトコルの中で重要なステップは、複合膜 (図 1) の製造プロセスです。フィルムの厚さが大きく (図 5および図 6) 皮膚を含む、異なる基板上に薄膜の付着挙動で影響が示されました。膜厚だけでなく時間と硬化過程の温度32材料特性に影響します。したがって、ポリマー層の厚さとしてパラメーターは慎重に適応し、検証する必要があります。
薄膜の接着特性の解析を行った Ra 最大表面粗さの異なる 2 つのガラス基板を用いた垂直力付着測定 = 0.338 μ m (図 3)。一般に、粗さ影響大幅表面、特に弾性材料33,34の接着です。ガラスの粗さは異なるアスペリティ サイズ、高い粗さ値21を出展基板の作製を許可のサンドペーパーで研磨が簡単に変えることができます。たとえばまた、他の材料は基板15,35の生産のためエポキシ樹脂を使用できます。提案するプロトコルの変更の重要な戦略があります。たとえば、異なる表面自由エネルギーを示す基板が必要なのか地形は必要です。ここでは、引き剥がし応力と PDMS、SSA の製造された薄膜の分離の動作をカスタム セットアップ (巨視的密着性測定装置 (MAD、図 4)) を行った。36基板と圧子の光学配置は、測定結果の分析のための重要なステップです。したがって、チルト角度の調整は、ゴニオメータ、可能な限り正確に実行する必要があります。これは、水平方向の接触を達成するまで手動でフィルム表面と接触する基板を持って来ることによって十分な精度で実現できます。
現在のプロトコルのホールド時間が一定 1 秒後(図 5 と図 7)。特に、大まかな基板表面に弾性膜の接着性能の調査のためホールド時間の延長は、追加情報を示します。たとえば、保持時間の増加とともに引き剥がし応力の増加は、報告された8をされています。現在のプロトコルは、他の方法で実行される測定に加えてたとえば皮テスト実行でした、接着性能37のより包括的な調査を許可します。
複合膜柔らかい肌接着剤の厚さを調べた別のフィルムを展示しています (図 7) との接着。我々 の結果は公開されたデータ、監禁、すなわち、基板直径、膜厚の増加38,39 間の比率としてフィルム厚鉛引き剥がし応力の増加の減少を示すに沿っています。.これらの結果、図 7に示されているデータに基づいて、良好な密着性 p を約 100 μ m (約 60 μ m の厚約 40 μ m で PDMS 膜に適用の SSA 層の厚さ) の合計の厚さ複合膜に展示を終えてください。粗面のプロパティ。
次に、原始的な複合膜の生物学的特性に関連する実験を行ったし、プラズマ処理による複合膜 (図 8)。シリコン ・ エラストマーのプラズマ処理は表面および携帯電話の添付ファイルと携帯40,41を拡散促進の親水性の特性を高めるため多くの場合、汎用性の高い手法です。シリコーンは低毒性の高い biostability よく知られているが、残留モノマーまたは触媒細胞毒性42,43にもつながる生理的プロセスに影響を及ぼす可能性がありますがあります。で、我々 を観察した実験を行った未満 5% 細胞毒性指標とトリパン ブルー排除アッセイ LDH リリースを使用して。提案するプロトコル、全体の携帯電話人口の増殖解析 (図 9 b) 表面分析されているフォームをデタッチ細胞集合体を含みます。プロトコルの変更より差別化された結果を作り出すことができます。各サンプルでは、戸建の細胞凝集体を含む上清を別反応管を転送し、高分子表面から酵素によって削除されたセルと組み合わされていないでした。これは、表面に付着した細胞の正確な評価を許可し、最終的に細胞接着過程に及ぼすポリマーのより詳細な決定を明らかにします。に加えて免疫細胞化学的方法をここで提示、セルのイムノブロット法、蛋白質の表現の詳細な定量的評価を可能と調査のために収穫があります。
要約すると、高度な細胞培養研究用エラストマー複合薄膜の生産のための製造条件を設けています。また、これらの薄膜は、皮膚の粗さ、洗練されたデザインの皮膚接着剤を有効にするのに高い適応性を持っています。
開示事項
著者が明らかに何もありません。
謝辞
サンプルおよび細胞培養プロシージャの確立の準備の彼の援助のマーティン ・ ダナーを認めた著者は、ドイツビスターフェルドベルンハルト Spezialchemie GmbH (ハンブルク、ドイツ)、継続的なサポートおよび議論のため特にロバート ・ Radsziwill に感謝したいと思います。これらの結果につながる研究は、欧州連合の第 7 フレームワーク プログラム (FP/2007-2013) ERC 助成契約名 340929 の下で欧州研究評議会から資金を受けています。
資料
| Name | Company | Catalog Number | Comments |
| 2-Propanol, 97% | Stockmeier Chemie | 1000452610000 | Isopropanol |
| Abrasive diamnod hand pad | Bohle | MO 5007522 | Grit: 220 |
| Accutase | Capricorn Scientific | ACC-1B | |
| Albumin Fraktion V | Roth | 0163.2 | BSA |
| Alexa Fluor 488 Phalloidin | ThermoFischer Scientific | A12379 | highly toxic |
| Aquamount | Polysciences | 18606-20 | water soluble mounting medium |
| CytoTox-ONE Homogeneous Membrane Integrity Assay | Promega | G7890 | |
| DPBS, without Ca2+, Mg2+ | ThermoFischer Scientific | 14190094 | |
| Fetal bovine serum gold | GE Health Care Life Science | A15-151 | FBS |
| Goniometer OCA35 | Dataphysics | for the determination of the static water contact angle | |
| Hoechst Dye 33342 | Sigma-Aldrich | B1155-100MG | bisBenzimide H 33342 trihydrochloride, highly toxic |
| Microscope Axiovert 25 | Zeiss | Microscope used for cell culture documentation | |
| Microscope Eclipse LV100ND | Nikon | Microscope used for film thickness determination | |
| Paraformaldehyde, aqueous solution 16% | Electron Microscopy Sciences | RT 15710 | electron microscopy grade |
| penicillin und streptomycin solution | Sigma-Aldrich | P4333-100ML | |
| Phenom XL Scanning Electron Microscope (SEM) | Phenom | ||
| Poly-(vinyl alcohol) 4-88, MW 31000 | Sigma-Aldrich | 81381-1KG | Mowiol 4-88 |
| Poly-dimethyl siloxanes, Sylgard 184 | Dow Corning | (400)000108351397 | PDMS |
| RPMI 1640 basal medium | ThermoFischer Scientific | 21875034 | |
| soft skin adhesive (SSA) | Dow Corning | (400)000108251792 | MG 7-9800 Soft Skin Adhesive (SSA) |
| speed mixer DAC 600.2 VAC-P | Hauschild | ||
| stylus profilomter | Zeiss | Model: SURFCOM 1500SD3 | |
| Tecan Infinite M200 pro | Tecan | fluorescence plate reader | |
| Triton X 100 | Calbiochem | 648466 | |
| Trypan Blue solution | Sigma-Aldrich | T8154-100ML | highly toxic |
| Trypsin/EDTA solution | PAN-Biotech | P10-023500 | 0.05% Trypsin, 0.02% EDTA in PBS |
| UV glue | Bohle | BO MV76002 | medium viscosity |
参考文献
- Lloyd, A. W., Faragher, R. G. A., Denyer, S. P. Ocular biomaterials and implants. Biomaterials. 22, 769-785 (2001).
- Zhang, M., Wu, J., Wang, L., Xiao, K., Wen, W. A simple method for fabricating multi-layer PDMS structures for 3D microfluidic chips. Lab Chip. 10, 1199-1203 (2010).
- Kwak, M. K., Jeong, H. E., Suh, K. Y. Rational design and enhanced biocompatibility of a dry adhesive medical skin patch. Adv. Mater. 23, 3949-3953 (2011).
- Gun Park, D., Chul Shin, S., Won Kang, S., Tae Kim, Y. Development of flexible self adhesive patch for professional heat stress monitoring service. Conf. Proc. IEEE Eng. Med. Biol. Soc. 4, 3789-3792 (2005).
- Thomas, X. Silicone Adhesives in Healthcare Applications. Dow corning Lit. , (2013).
- Fuard, D., Tzvetkova-Chevolleau, T., Decossas, S., Tracqui, P., Schiavone, P. Optimization of poly-di-methyl-siloxane (PDMS) substrates for studying cellular adhesion and motility. Microelectron. Eng. 85, 1289-1293 (2008).
- Wang, Z., Volinsky, A. A., Gallant, N. D. Crosslinking effect on polydimethylsiloxane elastic modulus measured by custom-built compression instrument. J. Appl. Polym. Sci. 131, 41050 (2014).
- Fischer, S. C. L., Kruttwig, K., Bandmann, V., Hensel, R., Arzt, E. Adhesion and cellular compatibility of silicone-based skin adhesives. Macromol. Mater. Eng. , 1-11 (2017).
- Martina, D., Creton, C., Damman, P., Jeusette, M., Lindner, A. Adhesion of soft viscoelastic adhesives on periodic rough surfaces. Soft Matter. 8, 5350-5357 (2012).
- Brown, X. Q., Ookawa, K., Wong, J. Y. Evaluation of polydimethylsiloxane scaffolds with physiologically-relevant elastic moduli: Interplay of substrate mechanics and surface chemistry effects on vascular smooth muscle cell response. Biomaterials. 26, 3123-3129 (2005).
- Song, F., Ren, D. Stiffness of cross-linked poly(dimethylsiloxane) affects bacterial adhesion and antibiotic susceptibility of attached cells. Langmuir. 30, 10354-10362 (2014).
- Buxboim, A., Rajagopal, K., Brown, A. E. X., Discher, D. E. How deeply cells feel: methods for thin gels. J. Phys. Condens. Matter. 22, 194116 (2010).
- Discher, D. E., Janmey, P., Wang, Y. -. L. Tissue cells feel and respond to the stiffness of their substrate. Science. 310, 1139-1143 (2005).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix Elasticity Directs Stem Cell Lineage Specification. Cell. 126, 677-689 (2006).
- Roth, J., et al. Surface functionalization of silicone rubber for permanent adhesion improvement. Langmuir. 24, 12603-12611 (2008).
- Thiébaud, P., Lauer, L., Knoll, W., Offenhäusser, A. PDMS device for patterned application of microfluids to neuronal cells arranged by microcontact printing. Biosens. Bioelectron. 17, 87-93 (2002).
- Tourovskaia, A., Figueroa-Masot, X., Folch, A. Differentiation-on-a-chip: a microfluidic platform for long-term cell culture studies. Lab Chip. 5, 14-19 (2005).
- Peterson, S. L., McDonald, A., Gourley, P. L., Sasaki, D. Y. Poly(dimethylsiloxane) thin films as biocompatible coatings for microfluidic devices: Cell culture and flow studies with glial cells. J. Biomed. Mater. Res. - Part A. 72, 10-18 (2005).
- Wan, Y., et al. Nanotextured substrates with immobilized aptamers for cancer cell isolation and cytology. Cancer. 118, 1145-1154 (2012).
- Ross, A. M., Jiang, Z., Bastmeyer, M., Lahann, J. Physical aspects of cell culture substrates: Topography, roughness, and elasticity. Small. 8, 336-355 (2012).
- Barreau, V., et al. Fibrillar Elastomeric Micropatterns Create Tunable Adhesion Even to Rough Surfaces. Adv. Funct. Mater. 26, 4687-4694 (2016).
- Briggs, G. A. D., Briscoe, B. J. The effect of surface topography on the adhesion of elastic solids. J. Phys. D. Appl. Phys. 10, 2453-2466 (1977).
- Dapp, W. B., Lücke, A., Persson, B. N. J., Müser, M. H. Self-affine elastic contacts: Percolation and leakage. Phys. Rev. Lett. 108, 1-4 (2012).
- Putignano, C., Carbone, G., Dini, D. Mechanics of rough contacts in elastic and viscoelastic thin layers. Int. J. Solids Struct. 69, 507-517 (2015).
- Laulicht, B., Langer, R., Karp, J. M. Quick-release medical tape. Proc. Natl. Acad. Sci. 109, 18803-18808 (2012).
- Kim, T., Park, J., Sohn, J., Cho, D., Jeon, S. Bioinspired, Highly Stretchable, and Conductive Dry Adhesives Based on 1D-2D Hybrid Carbon Nanocomposites for All-in-One ECG Electrodes. ACS Nano. 10, 4770-4778 (2016).
- Adamietz, I. A., et al. Effect of self-adhesive, silicone-coated polyamide net dressing on irradiated human skin. Radiat. Oncol. Investig. 2, 277-282 (1994).
- White, R. Evidence for atraumatic soft silicone wound dressing use. Wounds UK. 1, 104-109 (2005).
- Quan, M. B., Edwards, C., Marks, R. Non-invasive in vivo techniques to differentiate photodamage and ageing in human skin. Acta Derm. Venereol. 77, 416-419 (1997).
- Brown, X. Q., Ookawa, K., Wong, J. Y. Evaluation of polydimethylsiloxane scaffolds with physiologically-relevant elastic moduli: Interplay of substrate mechanics and surface chemistry effects on vascular smooth muscle cell response. Biomaterials. 26, 3123-3129 (2005).
- Palchesko, R. N., Zhang, L., Sun, Y., Feinberg, A. W. Development of Polydimethylsiloxane Substrates with Tunable Elastic Modulus to Study Cell Mechanobiology in Muscle and Nerve. PLoS One. 7, e51499 (2012).
- Johnston, I. D., McCluskey, D. K., Tan, C. K. L., Tracey, M. C. Mechanical characterization of bulk Sylgard 184 for microfluidics and microengineering. J. Micromechanics Microengineering. 24, 35017 (2014).
- Persson, B. N. J., Gorb, S. The effect of surface roughness on the adhesion of elastic plates with application to biological systems. J. Chem. Phys. 119, 11437 (2003).
- Peressadko, A. G., Hosoda, N., Persson, B. N. J. Influence of surface roughness on adhesion between elastic bodies. Phys. Rev. Lett. 95, 1-4 (2005).
- Purtov, J., et al. Measuring of the hardly measurable: adhesion properties of anti-adhesive surfaces. Appl Phys A. 111, 183-189 (2013).
- Kroner, E., Blau, J., Arzt, E. Note: An adhesion measurement setup for bioinspired fibrillar surfaces using flat probes. Rev. Sci. Instrum. 83, 16101 (2012).
- Sun, S., Li, M., Liu, A. A review on mechanical properties of pressure sensitive adhesives. Int. J. Adhes. Adhes. 41, 98-106 (2013).
- Webber, R. E., Shull, K. R., Roos, A., Creton, C. Effects of geometric confinement on the adhesive debonding of soft elastic solids. Phys. Rev. E. 68, 21805 (2003).
- Creton, C., Lakrout, H. Micromechanics of flat-probe adhesion tests of soft viscoelastic polymer films. J. Polym. Sci. Part B Polym. Phys. 38, 965-979 (2000).
- Tan, S. H., Nguyen, N. -. T., Chua, Y. C., Kang, T. G. Oxygen plasma treatment for reducing hydrophobicity of a sealed polydimethylsiloxane microchannel. Biomicrofluidics. 4, 32204 (2010).
- Kim, B., Peterson, E. T. K., Papautsky, I. Long-term stability of plasma oxidized PDMS surfaces. Conf. Proc. IEEE Eng. Med. Biol. Soc. 7, 5013-5016 (2004).
- Briganti, E., et al. Silicone based polyurethane materials: A promising biocompatible elastomeric formulation for cardiovascular applications. J. Mater. Sci. Mater. Med. 17, 259-266 (2006).
- Regehr, K. J., et al. Biological implications of polydimethylsiloxane-based microfluidic cell culture. Lab Chip. 9, 2132 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved