Method Article
Mince Film silicium composites élastomères pour les Applications de la peau et de Culture cellulaire : fabrication et caractérisation
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Un protocole pour le procédé de fabrication de structures composites polymères minces possédant soit Young différent modules ou épaisseurs est présenté. Films sont produits, études sur la culture cellulaire avancé ou comme adhésifs de la peau.
Résumé
Dans ce protocole, nous présentons des méthodes pour fabriquer des films composites élastomère mince pour des applications de culture cellulaire avancé et pour le développement des adhésifs de la peau. Deux-(dimethyl siloxanes) différentes poly (PDMS et colle de peau douce (SSA)), ont été utilisés pour enquête approfondie des effets biologiques et les caractéristiques de l’adhésifs. Les films composites se composent d’une couche souple et un revêtement adhésif haut de la page. Les deux couches ont été fabriqués par la technique d’application lame docteur. Dans la présente enquête, on a étudié le comportement adhésif des films composites comme une fonction de l’épaisseur de la couche ou une variation de la module d’Young de la couche supérieure. Le module de Young de PDMS a été modifié en faisant varier la base au rapport de mélange de reticulation. En outre, l’épaisseur des films de la SSA a été varié d’environ 16 µm à environ 320 µm. Scanning electron microscope et microscopie optique ont été utilisés pour des mesures d’épaisseur. Les propriétés adhésives des films élastomère dépendent fortement de l’épaisseur du film, le module de Young des polymères et des caractéristiques de surface. Par conséquent, on a étudié adhérence normale de ces films sur des substrats de verre présentant des surfaces lisses et rugueuses. > Pull-off stress et travail de séparation sont dépendants sur le rapport de mélange d’élastomères de silicone.
En outre, l’épaisseur de la colle de peau douce placée au dessus d’une couche de soutien favorable a été modifiée afin de produire des correctifs pour les applications de la peau. La cytotoxicité, la prolifération et adhésion cellulaire des fibroblastes murins L929 sur films PDMS (mélange ratio 10:1) et SSA (mélange ratio 50/50) ont été menées. Nous ont montré ici, pour la première fois, la comparaison côte à côte des couches minces composites fabriqué de deux polymères et présenter l’étude de leurs propriétés biologiques - et adhésif.
Introduction
Dans le présent protocole, sont présentées des méthodes détaillées pour la fabrication de films minces d’élastomère. La technique de lame docteur largement disponibles a été utilisée pour la production de films minces de composites. La technique de fabrication a été réalisée sur des feuilles de polyethylenterephtalate (PET), permettant la production subséquente de ces films à grande échelle. L’accent du présent protocole est l’évaluation de la reproductibilité, précise de fabrication des différentes couches des films composites et détermination des propriétés biologiques et adhérence du patch composite finale. Le poly-(dimethylsiloxane) d’élastomère de silicone (PDMS) est largement utilisé dans la technologie biomédicale, y compris la production de colles de peau, microfluidique applications et recherches complémentaires champs1,2,3 ,4. Récemment, une autre sous-classe de PDMS, dite douce peau adhésifs (SSAs) ont été introduites, notamment pour la peau douce de liaison et de collage.
Silicone SSAs sont des élastomères de vinyle fonctionnalisé, différant de polymères analogues par l’absence de renforcement silice5. Semblables aux autres PDMS, SSA d’Young peut être adaptée dans une large gamme par modulation réticulant concentration ou polymérisation temps6,7,8. Ce changement de module de Young des élastomères de silicone affecte les propriétés adhésives du matériel considérablement et a également des conséquences profondes sur les cellules procaryotes et eucaryotes cultivés sur la surface9,10 , 11. au niveau biologique cellulaire, il a été démontré, que les cellules eucaryotes répondent au niveau de la transduction de signal à une modulation de l’élasticité de la matrice ou l’épaisseur de la surface9,10,12 ,13,14. Donc, il existe un large intérêt pour applications de culture de cellules de polymères ayant des propriétés mécaniques accordables. Ce qui est important, l’intrinsèquement faible énergie de surface des élastomères à base de silicone ne fournit pas des conditions optimales pour la culture cellulaire des cellules eucaryotes. Traitement au plasma oxygène est une technique largement utilisée pour augmenter le PDMS faible énergie de surface temporairement, conduisant à une amélioration de sa force de traction, a diminué l’adsorption de molécules, alors qu’en parallèle favorisant l’attachement, épandage en surface et prolifération de cellules eucaryotes15,16,17,18.
Outre les propriétés des matériaux, la topographie de surface affecte de manière significative adhésion cellulaire et l’interaction adhésive entre deux matériaux19,20,21,22. Rugosité de surface a plusieurs effets sur la formation de contact entre deux surfaces : réduction de la surface de contact, haute stocké énergie élastique entourant les aspérités ainsi que de l’influence sur la propagation de la fissure peut modifier la force d’adhérence23, 24. Adhérence de films autocollants à la peau humaine est un nouveau domaine d’application, p. ex., pansements, fixation des électrodes ECG ou autres appareils électroniques portables25,26,27, 28. Pour mesurer le rendement adhésif autocollants en ce qui concerne la topographie de la surface, des substrats de verre avec des degrés de rugosité permet l’adhérence normale mesures8,21. Ici, les deux substrats de verre ont été choisis pour étudier les propriétés adhésives des films polymères. Tout d’abord, composites films avec une couche de support du PDMS dans un rapport de 10 contre 1 poids pièces couvertes par PDMS avec rapport de mélange différente ont été caractérisés. Dans un second temps une couche adhésive de la SSA a été réalisée avec des quantités de poids égal des deux composants avec différentes épaisseurs de film sur un support film PDMS.
Protocole
ATTENTION : Veuillez consulter toutes les fiches signalétiques (FS) avant utilisation. Certains produits chimiques utilisés dans le présent protocole sont irritants, extrêmement toxiques et/ou cancérigènes. Copiez toutes les pratiques de sécurité qui s’imposent lors de la manipulation de ces produits chimiques. Cela comprend l’utilisation de génie (chimique le cabinet) et personnel des équipements de protection (lunettes, gants, blouse, pleine longueur pantalons et chaussures fermées). Certaines parties des procédures suivantes impliquent la culture d’une lignée de cellules animales. Par conséquent, veuillez suivre les règlements de sécurité biologique spécifique. Les déchets chimiques et biologiques doivent être disposé selon les règles nationales et institutionnelles spécifiques et des recommandations.
1. préparation du silicone élastomère minces Structures composites
-
Préparation de polymères
- Pour préparer le ratio 10:1 de 1,1 g de PDMS, se mêlent 1,0 g du composé A 0,1 g du composé B.
- Mix et degase les prépolymères dans un mélangeur à vitesse à 2350 tr/min sous vide pendant 3 min.
- Changer les rapports de masse entre le composé A et B composé de 45 : 1 et 70:1. Préparez-les semblable à la méthode décrite au paragraphe 1.1.2.
- Préparer 1 g de la colle de peau douce (SSA) dans une proportion de 50/50. Donc Mélangez 0,5 g du composé A et 0,5 g du composé B tel que décrit au paragraphe 1.1.2.
-
Préparation de poly-(vinyl alcohol) (PVA) enduit feuille PET
- Préparer une solution PVA de 18 % (p/p) dans l’eau en ajoutant le PVA à l’eau désionisée et mélanger durant la nuit avec un agitateur magnétique. Conserver cette solution à 4 ° C.
- Préparer des films minces, présentant une épaisseur effective de 15 µm avec la machine demande de doctor lame, à l’aide de 100 µm écart de la lame et une vitesse d’environ 2,0 mm/s.
- Placer les films dans un four à 95 ° C pendant 15 min.
-
Préparation de la couche-du rapport de mélange de 10:1 PDMS par technique de lame docteur
- Utiliser une machine demande à lame docteur automatiquement contrôlé pour la préparation des films minces.
- Nettoyez la grille avec de l’isopropanol 100 % de PET et le placer sur la surface de la zone d’application de lame docteur.
- Placer la racle plastique sur le dessus de la feuille et régler l’épaisseur avec le micro positionnement vis. Pour la fabrication des couches humides, appliquer une épaisseur de 60 µm, 100 µm, 200 µm et 500 µm.
- Remplir le polymère de 10:1 de PDMS préparé à l’étape 1.1 dans le réservoir de la racle avec une seringue à usage unique. Commencer le mouvement de la lame avec une vitesse d’environ 2,0 mm/s.
- Retirer le film PET avec le revêtement appliqué de 10:1 de la machine et le placer dans un four pendant 1 h à 95 ° C, située dans une salle présentant des taux d’humidité entre 40 % et 65 %.
- Nettoyer la racle avec isopropanol et papier essuie-tout.
- Répétez cette procédure pour toutes les épaisseurs requises.
-
Préparation de la couche supérieure du PDMS dans différents rapports de mélange de technique de lame docteur
- Enlever les fines rayures des côtés de la longueur du film avec un bistouri ou une lame de rasoir afin de permettre le placement sous-jacent et de glissement de la racle sur la feuille de PET.
- Suivez les étapes de protocole 1.3.3 à 1.3.6. Humide l’épaisseur appliquée pour le film est 160 µm.
- Répétez cette procédure pour la production de deux films indépendants avec un autre rapport de mélange des composants PDMS (45 : 1 et 70:1). Stocker les films à température ambiante (environ 22 ° C et un taux d’humidité entre 40 et 65 %) dans des plats de Pétri carrée pour les empêcher de saletés et la poussière.
-
Préparation des couches minces composites présentant différentes épaisseurs de la couche de 50/50 de SSA
- Préparer les films de 10:1 de PDMS comme une couche de support, comme dans l’étape 1.3.
- Suivez les étapes du protocole 1.4.1 et 1.4.2 pour produire ces films. Utilisation le SSA dans le rapport de mélange de 50/50 et fabriquer un film de 40 µm d’épaisseur humide.
- Répétez l’opération pour les épaisseurs humides supplémentaires de : 120 µm, 300 µm, 500 µm.
2. mesures d’adhérence normal en utilisant des substrats avec rugosité différente
-
Préparation et caractérisation des substrats de verre avec une rugosité différente
- Utiliser un cylindre en verre avec 2 mm de diamètre comme un « substrat lisse ».
- Pour fabriquer les accises « rude substrat » avec un coupe-verre un morceau avec la dimension d’environ 4 x 4 mm d’une lame de verre dépoli. Utilisez un tampon de main abrasifs diamant afin d’obtenir une zone circulaire d’environ 3 mm de diamètre.
- Fixer le verre sur un cône en aluminium avec de la colle UV et illuminer dans la chambre d’illumination UV pendant 3 min.
- Déterminer le rayon de la surface du substrat avec un microscope optique. Calculer la superficie selon la formule suivante : A = πr2.
- Déterminer la rugosité paramètre Run et Rz (selon : DIN EN ISO 4287, ASME B46.1) avec un profilomètre à stylet.
- Apposer le substrat sur la scène de l’échantillon de la profilomètre et amener la pointe (diamant, standard : 2 µm/60 °) en contact avec l’échantillon.
- Enregistrer le profil de rugosité avec une vitesse de 0,3 mm/s et d’une longueur de 1 mm.
- Pour analyser la topographie de la surface, mesurer une aire exactement 1 mm2 avec un profilomètre à stylet, géré par le logiciel associé.
Remarque : Le profilomètre est géré par un ordinateur externe. Le titulaire est décalé par 0,001 mm dans la direction y après un déplacement de 1 mm est atteinte en x direction. L’enregistré. RS3 fichier est importé dans Surfcom carte Expert logiciel pour créer des images 3D.
-
Mesure d’adhérence normale des couches minces fabriqués de PDMS ou SSA
- Utiliser une lame de rasoir pour couper les films sur la feuille de PET en petits morceaux avec une superficie d’environ 4,0 cm2 et place que sur un verre glisser avec de la colle UV. Éclairer avec ultraviolets pendant 3 min.
- Monter l’échantillon de polymère sur le porte-échantillon.
- Nettoyer le substrat surface doucement avec de l’éthanol et sec à l’azote.
- Fixer le substrat de verre, monté sur le cône en aluminium, à la cellule de pesage.
- Utilisez la table inclinable (goniomètre) pour aligner les surfaces précisément en ajustant l’angle d’inclinaison du substrat approchant le film polymère. Pour ce faire, mettre le substrat manuellement en contact avec le film. Changer l’angle d’inclinaison jusqu'à l’obtention d’un alignement parallèle complètement de mutuellement, visualisé par les images de caméras, les deux surfaces.
Remarque : La cellule de pesage est connectée à la table inclinable. Un prisme de verre situé sous l’échantillon tel qu’illustré à la Figure 4, permettant la visualisation de la zone de contact avec deux caméras et en permettant l’alignement du substrat sur le film de polymère. - Déplacez le substrat à la surface de film polymère jusqu'à ce que le stress un précharge de 13 ± 5 kPa est atteint (Figure 4).
- Démarrer le progiciel programmée personnalisé écrit dans LabView pour contrôler que les paramètres de mesure requis tels que tenir temps et approche/rétraction de la vitesse. Le temps attente ttenir est de 1 seconde, l’approche et vitesse du détachement est respectivement de 30 µm/s et 10 µm/s.
- Effectuer des mesures d’adhérence sur trois échantillons fabriqués indépendants et à six endroits différents sur chaque surface du film.
-
Analyse des données et calcul des principaux facteurs mécaniques : traction stress et travail de séparation.
- Calculer la contrainte
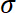 en divisant les forcer par la surface du substrat uneS.
en divisant les forcer par la surface du substrat uneS.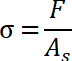
- Déterminer la contrainte de traction, qui est décrit comme la valeur maximale de la contrainte normale.
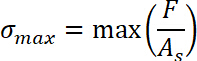
- Obtenir le Δs de déplacement par soustraction de la position de départ du régime de tractions0 de l’échantillon position sfin où la liaison est terminée. Définir le début du régime de traction s0 = 0.
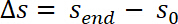
- Corriger les valeurs mesurées de la position de l’échantillon par la conformité au système C selon l’équation suivante :
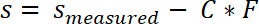
- Intégrer la courbe effort-déplacement de s0 sfin afin de calculer le travail de séparation.

- Calculer la contrainte
-
Calcul des facteurs-clés mécaniques à l’aide de logiciels de calcul mathématique origine.
- Importez le fichier .dat enregistré d’une mesure d’adhérence unique dans une table d’origine. Les paramètres qui sont enregistrés sont temps, position de l’échantillon et la force. Insérez ces paramètres dans les colonnes de A (heure), B (position de l’échantillon) et C (force).
- Pour déterminer la valeur vide, en moyenne environ 20 valeurs de mesure de la force avant de contacter le film polymère. Nommez cette valeur moyenne Foffset , puis collez-le dans la colonne D.
- Calculer l’arrière-plan corrigé la force F * selon l’équation suivante

et insérez cette équation, comme indiqué ci-dessous, en colonne E.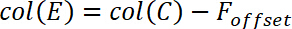
- Définir le début du régime de traction comme zéro déplacement, c'est-à-dire, s0 = 0. Par conséquent, déterminer s0 et soustraire du déplacement dans la colonne B, puis enregistrez-le dans colonne F:
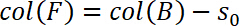
- En outre, de corriger la position de l’échantillon de la conformité de la machine. Cette correction est effectuée dans la colonne G. Insérez l’équation suivante dans la colonne G
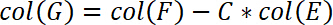
- Calculer la contrainte dans la colonne suivante H. Par conséquent, diviser la force par la surface du substrat. Insérez l’équation suivante
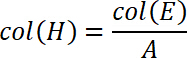
où A est la surface des substrats verre en mm2 (déterminé en 2.1). - Calculer le travail de séparation d'avec les valeurs de contrainte et de déplacement. Par conséquent, tracer le déplacement le long de l’axe des abscisses et la tension le long de l’axe des ordonnées. Intégrer ce graphique de s0 sfin où sfin est défini comme le déplacement au cours de laquelle la contrainte de traction est remis à zéro, c'est-à-dire le détachement complet a eu lieu. Pour intégrer le graphique, choisissez la fonction à intégrer. Ajouter les valeurs calculées dans les colonnes I et J.
3. caractérisation des Films par microscopie à balayage électronique (SEM) et microscopie optique
-
Microscopie optique
- Avec une lame de rasoir, coupez le film polymère en petits morceaux (environ 0,25 cm2) et les attacher au bord d’une lame de verre. Place la lame de verre verticalement orienté sous un microscope vertical et mesure l’épaisseur de la section transversale du film.
Remarque : Utiliser un objectif 20 X (NA = 0,45, résolution théorique à 800 nm de 1,1 µm) pour mesurer les valeurs d’épaisseur de film ≤ environ 20 µm. Pour un film de l’épaisseur de l’ordre de 20 µm jusqu'à 50 µm utiliser un objectif 10 X (NA = 0,30, résolution théorique à 800 nm de 1,6 µm) et pour un film épaisseur ≥ 50 µm utiliser un objectif X 5 (NA = 0,15, résolution théorique à 800 nm de 3,3 µm).
- Avec une lame de rasoir, coupez le film polymère en petits morceaux (environ 0,25 cm2) et les attacher au bord d’une lame de verre. Place la lame de verre verticalement orienté sous un microscope vertical et mesure l’épaisseur de la section transversale du film.
-
Enquête de SEM
- Couper la feuille de PET et fixer un échantillon d’environ 2 cm2 sur une lame de verre et placer verticalement sur le mécanisme de serrage à l’intérieur de l’échantillon titulaire ≤ 2 mm sous la surface supérieure du titulaire.
- Sélectionnez une tension d’accélération de 10 kV, un détecteur d’électrons rétrodiffusés (BSD) et l’aspiration est faible (60 Pa).
- Ajuster la mise au point, la grossissement, la luminosité et le contraste des images.
- Choisissez une durée d’acquisition d’image de 28 s avec une résolution de 1024 x 2048 pixels.
- Retirez le porte-échantillon et le SEM.
4. biologique enquête
- Cellules de Culture de L929 systématique
- Utilisez la ligne de cellules fibroblastes murins L929 pour enquête. La culture des cellules dans un milieu basal Rosewell Park Memorial Institute (RPMI) 1640, additionné de sérum de veau fœtal 10 % et de streptomycine und pénicilline à 37 ° C, 5 % de CO2 dans l’épreuve T75 flacons de culture de cellules. Le passage des cellules à une confluence d’environ 70 à 80 %.
- Pour passage de cellule, retirez le support par aspiration et laver avec du calcium et magnésium libre du tampon phosphate (SPD- / -) pour 30 s dans une enceinte à flux laminaire. Ensuite Incuber les cellules avec 2 mL de Accutase, une solution enzymatique protéolytique et l’activité collagénolytique jusqu'à 5 min à 37 ° C, 5 % de CO2.
- Vérifiez le détachement des cellules de la surface de flacon de culture cellulaire avec un microscope à contraste de phase.
- Ajoutez 8 mL de sérum contenant moyen dans la fiole et transférez la suspension de cellules dans un tube de réaction de 15 mL.
- Prélever un échantillon de 10 µL de la suspension cellulaire et mélanger avec 10 µL de bleu Trypan.
- Déterminer le numéro de cellulaire avec une chambre de Neubauer et calculer le nombre total de cellules.
ATTENTION : Le bleu Trypan est toxique, donc consulter la fiche signalétique, suivant les procédures obligatoires décrites dans la fiche signalétique, port de protection de sécurité personnelle qui s’imposent et manipulation sous une armoire chimique sont nécessaire. Collecte des déchets pour les dépôts de déchets chimiques.
Remarque : Les cellules positives bleu Trypan sont de couleur bleues, indiquant les membranes cellulaires non intacte. - Pour le prochain passage, culture 5 x 105 éléments dans un nouveau flacon de culture de cellule stérile 10 ml de milieu nouveau. Pour les conditions expérimentales, culture 3 x 105 éléments dans les puits 6 assiettes et 6 x 104 cellules dans chaque puits de la plaque 24 puits, contenant des échantillons polymériques (étape 4.2 du protocole).
- Préparation des films composites pour les expériences de culture cellulaire.
- Pièces uniques d’accise des films des diamètres désirés fabriqués à l’étape de protocole 1.4 et 1.5 de la couche de soutien PET avec un bistouri et un lieu avec des pincettes sur la surface des lamelles de verre présentant un diamètre de 12 mm. Placer les échantillons dans les puits d’un 2 4 plaque bien.
- Pour la détermination de la cytotoxicité et comptage de cellules, ne retirez pas les films de la feuille de PET. Couper les zones circulaires d’environ 9,4 cm2, raccord proprement dans l’unique puits d’une plaque 6 puits, des films produit en 1.4 et 1.5 et placez-les dans les puits d’une plaque de culture cellulaire.
- Immerger les échantillons de polymère dans désionisée H2O pour ≥ 30 min.
Remarque : Les échantillons polymériques peuvent être stérilisés à l’autoclave. Par conséquent, supprimer tous les échantillons de polymère contenant de la vaisselle de culture cellulaire et placez-les à l’intérieur d’un verre de Pétri. La stérilisation est effectuée dans un autoclave à 2.05 bar pendant 20 min à une température de 121 ° C.
- Traitement au plasma de polymères
- Placer les films qui y sont attachées sur feuille de PET ou verre rond lamelles (fabriqués en 4.2.1) à l’intérieur de la chambre de réaction de l’appareil de plasma.
- Fermer le couvercle et évacuer jusqu'à atteindre une pression de 1,6 x 10-2 mbar.
- Effectuer un traitement plasma pendant 3 min.
- Aérer la chambre de réaction et placer les échantillons dans 24 puits ou 6 cupules pour des études de culture cellulaire plus.
- Utilisez un échantillon pour déterminer les angles de contact l’eau avec un goniomètre. Ainsi donc, la seringue à proximité de la surface polymère au moyen du progiciel et déposez une goutte de 3 µL d’eau sur le dessus de la surface. Calculer l’angle de contact statique de l’eau avec le logiciel goniomètre.
- Microscopie et coloration
- Préparer les cellules tel que décrit à l’étape 4.1.7 et culture pendant 3 jours à 37 ° C et 5 % de CO2.
- Capturer des images de contraste de phase des cellules cultivées pendant trois jours sur la Vierge- et plasma traité films peu de temps avant la fixation.
- Préparer les PBS additionné de 0,2 %-Triton X-100. Lentement Pipeter 200 µL de la solution mère dans 100 mL de PBS (PBS-T).
- Préparer une solution de paraformaldéhyde/PBS 4 % (PFA/PBS-T).
ATTENTION : Paraformaldéhyde est toxique, donc consulter la fiche signalétique, suivant les procédures obligatoires décrites dans la fiche signalétique et port de protection de sécurité personnelle qui s’imposent et manipulation sous une armoire chimique sont nécessaire. - Préparer une solution de BSA/PBS-T 5 %.
- Retirez le support par aspiration sous le limbe à flux. Ajouter PBS dans les puits pour éliminer les résidus moyennes.
- La plaque de transfert à une armoire chimique et remplacer les PBS avec 400 µL de la solution PFA/PBS pendant 25 minutes à température ambiante.
- Enlever la solution PFA/PBS provenant des puits unique, laver soigneusement avec du PBS quatre fois. Attendre 3 minutes entre chaque étape de lavage et de recueillir les solutions pour l’élimination des déchets chimique. Utilisez la plaque directement, ou conserver à 4 ° C.
- Ajouter 5 % d’albumine sérique bovine (BSA) / PBS-T dans les puits et incuber pendant 60 min à RT à bloquer les sites de liaison non-spécifique.
- Aspirer la solution et remplacez-le par une phalloïdine conjuguée à Alexa-488 (dilution 1 : 160) / solution de PBS-T additionné de 0,2 %-Triton X-100.
ATTENTION : La phalloïdine-488 est toxique, donc consulter la fiche signalétique, suivant les procédures obligatoires décrites dans la fiche signalétique et port de protection de sécurité personnelle qui s’imposent et manipulation sous une armoire chimique sont nécessaire. - Couvrir la plaque avec du papier aluminium et il incuber pendant 3 h à RT ou durant la nuit à 4 ° C.
- Aspirer la solution et laver trois fois avec du PBS. Attendre 3 minutes entre chaque étape de lavage. Recueillir les solutions pour l’élimination des déchets chimique.
- Préparer une solution de 1 µL de colorant Hoechst 33342 (solution mère 1 mg/mL). Pour une dilution de 1/1000, prélever 1 µL de Hoechst 3334 à 1 mL de PBS-T de colorant et bien mélanger. Ajouter 300 µL de la solution de 33342 colorant Hoechst dans les puits et incuber pendant 10 min à la RT dans l’obscurité.
ATTENTION : Colorant Hoechst 33342 est un réactif intercalant de l’ADN et donc potentiellement mutagènes, donc Conseil la FS, suivant les procédures obligatoires décrites dans le FS et le port de protection appropriées de sécurité personnelle et la manipulation sous un chimique est nécessaire. - Aspirer la solution et laver les échantillons quatre fois avec du PBS. Attendre 3 min entre chaque étape de lavage. Recueillir la solution pour l’élimination des déchets chimique.
- Pour l’enrobage, soigneusement retirer les films de la surface de la culture et les placer sur une lame de microscope. Ajouter 20 à 40 µL de milieu d’enrobage soluble dans l’eau dans le film et fixer une nouvelle lamelle de verre circulaire sur le dessus à l’aide d’une légère pression.
- L’imagerie s’exécute avec un microscope à fluorescence. Les filtres nécessaires pour l’éclairage : Alexa-488 dispose d’un maximum d’excitation à 496 émission nm et maximum se produit à 519 nm. Par conséquent, la couleur d’émission est verte. Hoechst 33342 de colorant trihydrochlorid trihydrate complexé avec l’ADN a une excitation maximale à 355 nm et maximum des émissions complexe ADN se produit à 465 nm.
- Détermination de la cytotoxicité et la détermination du nombre de cellules
- Réaliser l’expérience avec des cellules cultivées en 6 assiettes bien préparées à l’étape 4.3 et cellules préparées à l’étape 4.1.7. La culture des cellules pendant 3 jours à 37 ° C et 5 % de CO2. Pour le contrôle positif, utiliser les cellules qui ont été cultivées sur une surface en polystyrène cell culture traitée, ne contenant aucun films polymères. Pour la détermination du fond (condition négative), obtenir le moyen provenant d’un puits sans cellules.
NOTE : Moyen vous pouvez prélever des cellules contenant bien cultivés sur la surface en polystyrène de cell culture traitée. - Selon le nombre de tubes de 15 mL pour le label échantillons expérimentaux.
- Ajouter 40 µL d’une solution de PBS contenant 0,9 % Triton X-100 au témoin positif et mélanger vigoureusement avec une pointe de 1000 µL. Attendez environ 3 min.
- Sans enlever les cellules attachées à la surface, aspirer le support de tous les échantillons, y compris les échantillons préparés au point 4.5.3 et transférer le support pour les tubes de 15 mL. Ajouter 3 mL de SPD- / - aux puits unique et stocker les plaquettes dans l’enceinte à flux laminaire pour déterminer le nombre de cellulaire comme décrit dans 4.5.9.
- Centrifuger à 200 x g pendant 3 minutes et prélever 1 mL du surnageant pour la détermination de l’activité LDH. Stocker les tubes de 15 mL contenant des cellules et en restant sous l’enceinte à flux laminaire.
- Pour le dosage, un noir plaques 96 de puits à fond plat sont utilisés. Ajouter 50 µL de réactif de CytoTox-ONE dans 50 µL de l’échantillon milieu et mélangez bien pour 30 s.
- Couvrir la plaque avec du papier aluminium et stocker pendant 10 min à température ambiante.
- Ajouter 25 µL de la solution d’arrêt dans chaque puits et enregistrer l’intensité de fluorescence avec un lecteur de fluorescence. Secouer la plaque pour 10 s et détecter le signal de fluorescence avec une longueur d’onde d’excitation de 520 nm et une longueur d’onde d’émission de 560 nm. Éviter les bulles d’air.
- Pour la détermination de l’aspirat numéro de cellule le SPD- / - provenant des puits de la plaque de culture de protocole étape 4.5.4 et ajouter les solutions pour les tubes de réaction 15 mL contenant les surnageants recueillis dans le numéro de protocole étape 4.5.5.
- Centrifuger le tube de réaction de 15 mL à 200 x g pendant 3 min et aspirer le surnageant. Ajouter 0,5 mL de trypsine/EDTA et incuber pendant 10 min à 37 ° C.
- Ajouter 2 mL de trypsine/EDTA à dans les puits de la plaque et incuber pendant environ 10 min à 37 ° C, pour détacher des cellules des films polymères.
- La suspension cellulaire est transférée dans le tube de réaction de 15 mL du numéro de l’étape 4.6.10. En outre, laver les plaques vigoureusement avec un sérum contenant le support.
- Centrifuger les échantillons à 200 x g pendant 3 min, aspirer le surnageant et ajouter de sérum contenant le support pour le tube.
- Déterminer le numéro de cellulaire comme décrit aux étapes 4.1.5 et 4.1.6.
- Réaliser l’expérience avec des cellules cultivées en 6 assiettes bien préparées à l’étape 4.3 et cellules préparées à l’étape 4.1.7. La culture des cellules pendant 3 jours à 37 ° C et 5 % de CO2. Pour le contrôle positif, utiliser les cellules qui ont été cultivées sur une surface en polystyrène cell culture traitée, ne contenant aucun films polymères. Pour la détermination du fond (condition négative), obtenir le moyen provenant d’un puits sans cellules.
Résultats
Dans les premières expériences, les films PDMS avec différentes épaisseur et constante de rapport de 10:1 de mélange ont été fabriqués sur films PET (Figure 1). Parce que l’épaisseur de la couche peut influencer considérablement la rigidité et la gestion des propriétés des films composites ensemble, dans les expériences initiales simples films entre 13 ± 2 µm et 296 ± 13 µm ont été fabriqués (Figure 1). Il est bien connu, que pendant le retrait de polymérisation processus des films polymère se produit. Pour les films plus minces, nous avons observé une différence de 78 % ± 3,1 % entre les conditions humides et durcies. Pour les films épais, rétrécissement de 40,9 % ± 2,6 % a été détectée (Figure 1).
Pour les demandes présentées dans le présent protocole, films doivent être supprimés manuellement de la feuille de PET. Nous avons reconnu que particulièrement minces sont difficiles à manipuler avec une pince et sont souvent détruits au cours de ce processus. Par conséquent, nous avons étudié l’influence d’un mince poly (alcool vinylique) revêtement comme une couche de soutien. PVA possède une grande rigidité et peut être facilement retiré en raison de sa solubilité dans l’eau dans les applications en aval. Le revêtement de PVA appliqué a une épaisseur d’environ 17 µm et donc films PDMS recouvert sur le dessus de cette couche sont légèrement plus mince par rapport aux films sans le revêtement de PVA (données non présentées). Surtout en se concentrant sur les propriétés de manipulation, nous concluons, que seulement le plus mince film nécessite un film PVA favorable pour l’élimination de l’emballage protecteur PET.
Une épaisseur de film efficace d’environ 40 µm a été sélectionnée pour toutes les autres expériences. Pour la production de films composites, le rapport de mélange de PDMS a été varié de 10:1 à 45 : 1 et à 70:1 et appliqué sur le film PDMS déjà polymérisé avec la technique de lame docteur (Figure 2 a). À l’exception de la ratio 10:1, les films différents peuvent être clairement distingués par microscopie optique avec la précision voulue. Pour l’analyse microscopique, les films ont été coupés avec un scalpel et attachées à l’arête d’une lame de verre. Les rapports de mélange plus élevées de la couche supérieure est apparu visuellement plus claires sur les images microscopiques comparées au ratio 10:1 de la couche (Figure 2 b). En outre, microscopie électronique à balayage a été utilisé à l’image des échantillons à un grossissement d’environ 860 X (Figure 2). Une différence clairement observable de luminosité entre les deux films PDMS, fabriqués dans les rapports de mélange plus élevées a été reconnue, par contraste avec le ratio 10:1. La procédure de coupe laisse des marques, visibles sur les photos de SEM (Figure 2 b). Selon ces résultats, l’épaisseur moyenne des films composites était 112 µm ± 5,0 µm (Figure 2D).
Dans d’autres expériences, les propriétés d’adhérence de ces films ont été déterminées avec des mesures d’adhérence force normale à l’aide de deux substrats de verre différents (Figure 3). Le « substrat lisse » possède une texture de surface avec une rugosité moyenne arithmétique Rune de 0,013 ± 0.0002 µm et une moyenne pic-vallée Rz de 0,12 ± 0,004 µm (Figure 3 a). Substrat 2 (GS2, désigné comme rugueuse) présentaient des valeurs de rugosité de 0,338 ± 0,021 (Ra) µm et 2.055 ± 0,017 µm (Rz) (Figure 3 b). Avec la moyenne rayon obtenu en 2.1.4 que la surface du substrat « lisse » a été de 3,2 mm2 alors que pour le substrat « brut » une surface de 6,07 mm2 a été calculée.
Avec ces deux substrats, le comportement adhésif des films différents a été déterminé. Deux paramètres sont choisis pour décrire les propriétés adhésives des films : la contrainte de traction σmax et le travail de séparation Wsep. Pendant le processus entier de collage et de liaison de la position de l’échantillon s et la force normale F sont enregistrées. Les résultats sont représentés dans une courbe de contrainte-déplacement (Figure 4).
Pour l’interprétation correcte des résultats expérimentaux, il est important d’aligner avec précision le substrat à la surface de film polymère. Aussi, la conformité de la machine de l’appareil de mesure doit être considéré afin de corriger le déplacement. Pendant la mesure, la force appliquée agit non seulement sur l’échantillon, mais aussi sur d’autres parties de l’appareil. Par conséquent, chacun des deux substrats est appuyée contre une lame de verre avec une contrainte de compression de 13 ± 5 kPa. Pour mesurer la conformité, la courbe de charge tient compte, c'est-à-dire la partie de la courbe force-déplacement où les deux surfaces entrent en contact jusqu'à la position de l’échantillon où la force de précontrainte exacte est atteint. La réciproque pente de la courbe est égale à la conformité de la machine C. La valeur calculée pour C est 0,12 µm/mN.
Dans la première expérience films avec différents rapports de mélange de PDMS ont été analysés (Figure 5). Pour les films composites, l’épaisseur et le rapport de mélange de la couche, fabriqué de PDMS 10:1 est maintenu constant. L’épaisseur de la couche supérieure est également maintenu constant d’une valeur de 65 µm. La contrainte de traction plus élevée de 109 ± 27,6 kPa a été déterminée avec le substrat de verre lisse sur le film de 10:1 de PDMS (Figure 5 a). Une augmentation du ratio mélange conduit à une diminution de la contrainte de traction à 76,7 ± 17 kPa pour 45 : 1 rapport de mélange et de 41,4 ± 17 kPa pour la ratio 70:1. Le film 10:1 de PDMS a été établie avec le stress de substrat un arrachement de verre brut de 22 ± 2,2 kPa. En général, le travail de séparation était comparable entre les deux substrats de verre, par exemple., 1,4 ± 0,6 J/m2 sur le film mince obtenu avec le substrat lisse et 1,84 ± 0,7 J/m2 sur le film mince obtenu avec le substrat rugueux ( Figure 5 b).
Ensuite, la production de couches minces pour des applications de la peau et pour la culture cellulaire des demandes ont été explorées (Figure 6). 50/50 de SSA a été utilisé pour la production de la couche supérieure des films composites. PDMS dans un 01:10 rapport de mélange d’environ 40 µm d’épaisseur a été utilisé comme une couche de support. Par contraste avec les expériences précédentes présentés à la Figure 5, l’épaisseur de la couche supérieure a été modifié, alors que le rapport de mélange est maintenu constant (Figure 6 a). SSA a été choisi en raison de ses propriétés adhésives dans les applications impliquant l’attachement aux surfaces avec la rugosité de surface élevée, en particulier la peau humaine, en utilisant les recommandations du fabricant du mélange ratio 50/505,8. Épiderme humain possède une rugosité de surface élevée. Selon l’âge et anatomique région qu'une profondeur moyenne de rugosité (RZ) entre 48 µm et le µm 71 a été rapporté29. Adhérence de la peau douce et sécuritaire est important, particularité pour la peau sensible des nouveau-nés ou difficilement régénérant la peau des personnes âgées. Ont été appliquées les différentes épaisseurs humides allant de 120 µm, 40 µm, 300 µm à 500 µm (Figure 6 a). Selon l’épaisseur humide, l’épaisseur totale des films composites varie entre 51 µm et 344 µm (Figure 6 b). Après durcissement, le composite ont été attachées à l’arrière de la main d’un volontaire (Figure 6). Les épaisseurs de films différents montrent clairement des différences dans les propriétés de leur adaptation à la rugosité de la peau (Figure 6). Les films minces (50 µm et 100 µm d’épaisseur total) affichent un taux élevé d’adaptation pour les rides de la peau par rapport à des films plus épais (220 µm et 340 µm d’épaisseur total). Ces résultats indiquent que des films composites avec une large gamme d’épaisseurs peuvent être produites précisément avec la technique de lame docteur appliquée.
Expériences d’adhérence ont été effectuées avec ces films composites (Figure 7). Selon l’épaisseur de la pellicule SSA, nous avons observé une diminution de la contrainte de traction épaisseur croissante. La force d’arrachement plus élevée de 133 ± 36,6 kPa a été mesurée sur un support lisse (Figure 7 a). Le pull-off-stress plus bas 18 ± 4 kPa a été obtenu avec le substrat rugueux sur le film plus épais. Fait intéressant, une comparaison entre les deux substrats révèle une différence de 2,7 fois sur les films plus minces (Figure 7 a). Avec l’épaisseur de film croissante, en particulier sur les films plus épaisses aucune différence remarquable n’était observable (Figure 7 a). Avec le substrat lisse une œuvre de séparation de 1,8 ± 0,8 J/m2 a été détectée sur le film présentant une épaisseur totale d’environ 100 µm, suivie d’une diminution de charge épaisseur film (220 µm d’épaisseur : 1,6 ± 0,6 J/m2 et 330 µm : 1,3 ± 0,4 J/m2 (Figure 7 b)). Le travail de séparation mesurée avec les substrats bruts était en général légèrement inférieur par rapport au substrat lisse (100 µm d’épaisseur : 1,63 ± 0,6 J/m2; 220 µm d’épaisseur : 1,1 ± 0,6 J/m2 et 330 µm : 1,0 ± 0,2 J/m2 (Figure 7 b )).
En outre, le mécanisme de détachement a été enregistré lors de la mesure (Figure 7). Cavitation Little a été observée sur le film plus mince, tandis que l’apparence du doigt comme les fissures n’était observable sur les films plus épais (Figure 7).
Des mesures ont été effectuées dans le mois suivant la fabrication des films. Cependant, stabilité et conservation des propriétés mécaniques des films élastiques pourraient être affectées par des facteurs environnementaux, y compris la température et l’humidité. Comme indiqué au protocole point 1.4.3, les films ont été stockés à température ambiante et une humidité de 40 à 65 %. Afin d’éviter leur de la contamination et la poussière, les films ont été stockés en plastique Pétri dans l’obscurité. Pour étudier la stabilité à long terme, les mesures d’adhérence et les détermination d’épaisseur du CLRSS de 50 : 50 films ont été effectués environ quatre mois après leur fabrication. Aucune influence majeure sur l’épaisseur du film, le pull-off stress et le travail de séparation n’a été détectée après stockage. Par exemple, arrachement stress des films composites SSA fabriqué avec une épaisseur humide de 120 µm SSA et une épaisseur humide de 100 µm PDMS était 46,6 kPa ± 6 et le travail de séparation 1627 ± 592 mJ/m2 après leur fabrication. Environ quatre mois après leur production, une contrainte de traction de 48,8 ± 5,4 kPa et une œuvre de séparation de 1666 ± 723 mJ/m2 a été déterminées. En outre, peu de temps après la fabrication, l’épaisseur totale de ces films a été 103,3 µm ± 13,9 et après stockage 98.1 ± 9,1 µm.
En plus des expériences PDMS 10:1 et films composites de SSA 50/50 d’une épaisseur totale d’environ 105 µm ont été utilisées comme cellules de substrats de culture (Figure 8). Des films composites fabriqués au protocole étape numéro 1 peuvent être facilement retirés de la feuille de PET et couper dans les dimensions souhaitées et des formes géométriques. En outre, pour coller les films à un rigide surface, pour le verre de l’exemple, plusieurs films affichant des modules de Young différents peuvent être attachés côte à côte et pourraient être placés à l’intérieur d’un seul puits d’une plaque de culture cellulaire. Films susceptibles d’être joints à la surface en polystyrène directement sans une lamelle couvre-objet supplémentaire. En outre, films pourraient être adaptés à différentes surfaces et de la structure géométrique, comme les tubes ou bagues, permettant aux autres études non réalisables avec des matériaux de culture cellulaire conventionnel. Dans les expériences effectuées, représentés à la Figure 8 films composites sur une feuille de PET ont été placés directement dans les plaques de culture cellulaire ou films ont été retirés de l’emballage protecteur PET et placés sur des lamelles de verre. Pour les conditions expérimentales, certains polymères ont été traités avec le plasma d’air pour augmenter leur énergie libre de surface. En général, PDMS possède un angle de contact de l’eau d’environ 115° avant traitement au plasma et devient fortement hydrophile de post-traitement (eau angle de contact < 30°)8. Traitement au plasma rend la surface biocompatible et facilite la fixation des cellules eucaryotes. Selon l’intensité et la durée du traitement, la surface du polymère est altérée, affichant un degré plus élevé de la rugosité et aussi fissures peuvent apparaître. Immédiatement après le traitement, on observe un processus de rétablissement hydrophobe. Comme décrit aux étapes de protocole 4.3.5 un goniomètre servait à déterminer l’angle de contact statique de l’eau. Par conséquent, polymères qui ont été placés dans des ddH2O pendant 1 h après le traitement de plasma d’air ont été par la suite analysées. Traitement au plasma a considérablement réduit l’angle de contact de l’eau (PDMS vierges : 117,0 ± 2,2 ° ; SSA vierge : 127.9 ± 5,6 ° ; Plasma PDMS : 18,0 ± 7,2 ° ; Plasma de SSA : 29.3 ± 11,5 °).
Pour exemple, incorporant un montage aqueux moyen a été appliquée. Si à tout moment les échantillons doivent être supprimés à nouveau, les spécimens peuvent être placés dans une eau contenant Pétri du jour au lendemain. Finalement, les lamelles peut être enlevés pour analyse complémentaire.
Les pièces jointes et la morphologie des cellules L929 graines pendant 3 jours sur PDMS et SSA 50/50 films composites a été déterminée par microscopie à contraste de phase et après coloration avec fluorescence conjugué phalloïdine-488 et colorant Hoechst 33342 (Figure 8). Acquisition d’images avec la microscopie en contraste de phase est fortement recommandée, surtout pour les polymères non traités par plasma. En raison de la faible adhésion cellulaire à ces surfaces polymères cellules individuelles ou des agrégats sont facilement détachés, ce qui complique l’interprétation correcte des méthodes d’analyse ultérieure.
Les cellules ensemencées sur les polymères vierges affichent mauvaise fixation et cellulaires propagation comportement (Figure 8 a 1 et C1) alors que d’une monocouche confluente a été observée chez les cellules cultivées sur des surfaces de plasma traité (Figure 8 b 1 et D1) . La formation d’agrégats cellulaires et le détachement de la surface était plus prononcée sur les surfaces vierges. Visualisation des filaments d’actine après que fixation avec 4 % de paraformaldéhyde a révélé quelques cellules migrant vers la périphérie des agrégats cellulaires et émanation de protubérances lamellipodia sur vierge PDMS et SSA 50/50 films composites (Figure 8 a 2 et C2, flèches). Aucune différence qualitative importante ne pourrait observer en comparant les deux matériaux polymères. Comme note latérale, il apparaît qu’un montant moins d’agrégats cellulaires étaient présents sur SSA 50/50 par rapport au PDMS. Aussi, les agrégats attachés aux surfaces sur SSA 50/50 est apparu que plus aplaties (Figure 8 1). Comme prévu, le traitement par plasma air amélioré attachement cellulaire et s’étend sur les deux surfaces significativement, conduisant à la formation de saillies lamellipodia remarquable et une monocouche confluente (Figure 8 b2 et 2 de 8).
Libération de LDH après 3 jours de culture a été utilisée comme indicateur pour déterminer les effets cytotoxiques (Figure 9 a). En général, les niveaux de LDH étaient comparables pour les cellules cultivées sur ces deux matériaux polymériques, avec moins de 5 % cytotoxicité (PDMS vierges : 2,8 ± 2,0 % ; 50/50 de vierges SSA : 4,5 ± 3,6 % ; plasma traité PDMS : 3,4 ± 1,5 % ; 50/50 de plasma traité SSA : 3,4 ± 1,6 %). Ces résultats sont comparables aux données présentées dans notre étude précédemment publiée mettant l’accent sur l’enquête des deux élastomères. 8 afin de valider davantage les résultats de l’essai de la LDH, un test d’exclusion bleu trypan a été réalisé. En outre, la population entière de cellules a été déterminée pour afficher les différences dans l’activité de prolifération (Figure 9 b). En général moins de 5 % des cellules positives bleu Trypan étaient comptés (PDMS vierges : 2,4 ± 0,3 % ; 50/50 de vierges SSA : 3,8 ± 2,5 % ; plasma traité PDMS : 0,74 ± 1,3 % plasma traité SSA 50/50 : 0,95 ± 1,6 %).
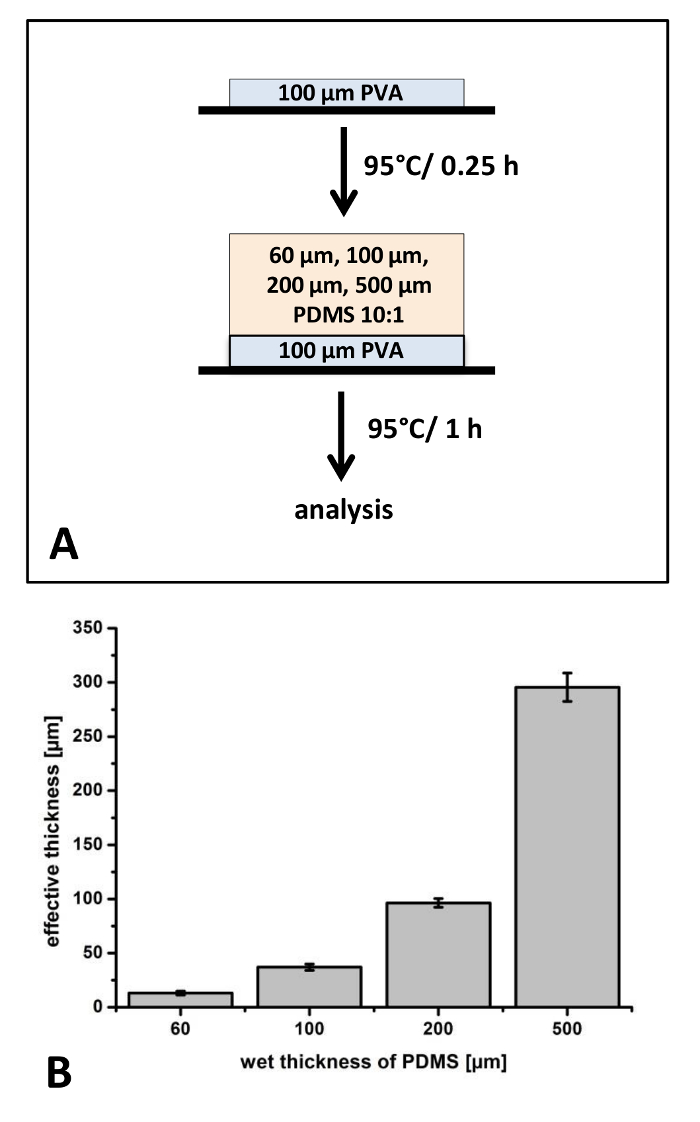
Figure 1 : préparation de films PDMS sur poly-(vinyl alcohol) (PVA) recouvert de feuille de PET : Le processus de fabrication de films PDMS avec épaisseur variable sur une feuille de PET a été appliqué pour déterminer la reproductibilité et la gestion des performances (A). Les épaisseurs des films PDMS ont été analysés au microscope optique après cuisson à 95 ° C (B). N = 3 fabriqué indépendamment films ont été analysés. Chaque film, trois différents endroits ont été choisis, de coupe et 3 positions sur chaque échantillon ont été analysées (k = 27). Barres d’erreur représentent déviation standard. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : préparation des films composites du PDMS préparé dans différents rapports de mélange : Des films composites présentant différents rapports de mélange de la base (composant A) à RETICULATION (composant B) du PDMS ont été fabriqués par technique de lame de médecin. La couche supérieure composée de PDMS du ratio 10:1 (composant b), 45 : 1 et 70:1 ont été appliqués sur le dessus un film de 10:1 PDMS préalablement durci (A). Après durcissement ultérieur à 95 ° C, épaisseur des films composites a été analysée par microscopie optique (B) et la microscopie électronique à balayage (C). N = 3 expériences indépendantes ont été effectués et analysés par microscopie optique (D). Former chaque film indépendant manufacturé, trois différents endroits ont été choisis, coupe et 3 positions différentes sur chacun des échantillons ont été analysés (k = 27). Barres d’erreur représentent déviation standard. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : détermination de la rugosité de la surface topographique des deux substrats utilisés pour les mesures d’adhérence : Deux substrats de verre possédant une rugosité différente ont été caractérisés. Trois analyse profilométrique tridimensionnelle de la surface a été réalisée sur le substrat « lisse » GS (A1) et le substrat « brut » GR (B1). Les courbes de seule ligne correspondante sont dépeints dans A2 et B2). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 : principe de la mesure de l’adhérence normale : Une configuration de génération personnalisée a été utilisée pour caractériser les propriétés d’adhérence des échantillons polymères. L’installation de mesure est représentée en (A) et (B) les détails sont affichés. Pour l’analyse de la mesure, stress dépendait d’une courbe de temps de stress (C). Travaux de séparation a été déterminée par l’intégration de la courbe effort-déplacement entre sfin et s0 (D). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 5 : détermination de l’adhérence des films composites avec différentes proportions de mélange de PDMS : Effort d’arrachement (A) et travail de séparation (B) des films composites fabriqués du PDMS dans le mélange ratio 10:1, 45 : 1 et 70:1 ont été mesurés. Pour l’analyse, un « bon » verre de substrat (GS) présentant un Ra = 0,013 µm et un substrat de verre « bruts » (GR) avec Run = 0,338 µm ont été utilisés. N = 3 fabriqué indépendamment films ont été analysés. Chaque film, deux pièces ont été choisies et trois positions différentes sur chaque échantillon ont été analysées (k = 18). Barres d’erreur représentent déviation standard. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
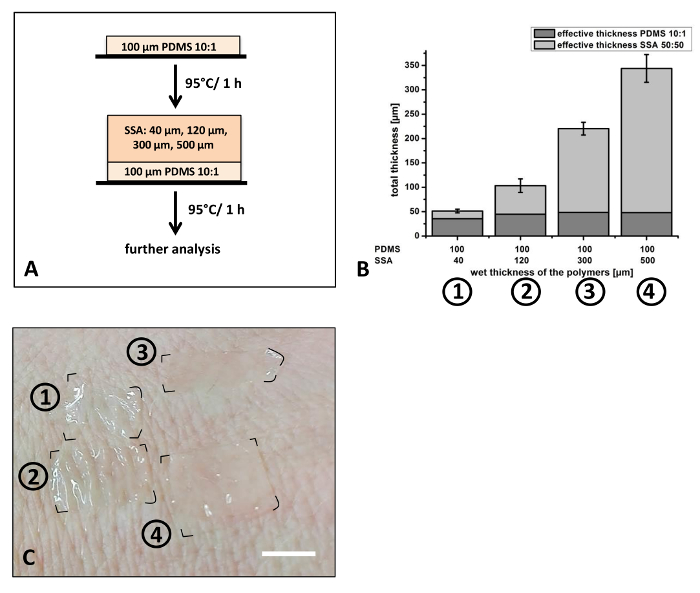
Figure 6 : préparation de films composites de SSA avec épaisseur variable : 50/50 de SSA a été appliqué sur le dessus un film de 10:1 PDMS préalablement durci (A). Différentes épaisseurs humides de cette couche allant de 40 à 500 µm ont été appliquées et l’épaisseur après durcissement étudié par microscopie optique (B). Fixation des films à l’arrière d’une main affichés que les films avec une épaisseur totale d’environ 100 µm (film #2) conforme bien à la rugosité de la peau (C) les bénévoles. Épaisseur des couches simples et l’épaisseur totale des films composites sont indiquées dans la Figure 6 b. Pour l’analyse n = 3 échantillons indépendants manufacturés ont été mesurées au microscope optique. Chaque film, trois différents endroits ont été choisis, de coupe et 3 positions sur chaque échantillon ont été analysées (k = 27). Barres d’erreur représentent déviation standard. Barre d’échelle en 6C représente environ 1 cm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 7 : détermination de l’adhérence des films composites de la colle de peau douce : Composites minces de SSA comme une couche supérieure et PDMS 10:1 comme couche ont été fabriqués. L’épaisseur de la couche supérieure variait entre 50 et 330 µm. Pull-off stress (A) et travail de séparation (B) des films composites mesurée à l’aide de deux substrats de verre différentes ont été analysées (un substrat de verre « lisse » (GS) présentant un Run = 0,013 µm et un substrat de verre « bruts » (GR) avec Run = 0,338 µm). Photos exemplaires des mécanismes de détachement sont visualisées à la C. Pour l’analyse de données n = 3 expériences indépendamment manufacturés ont été analysés. Chaque film, deux pièces ont été choisies et trois positions différentes sur chaque échantillon ont été analysées (k = 18). Barres d’erreur représentent déviation standard. Barres d’échelle en 7C représentent 0,5 mm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
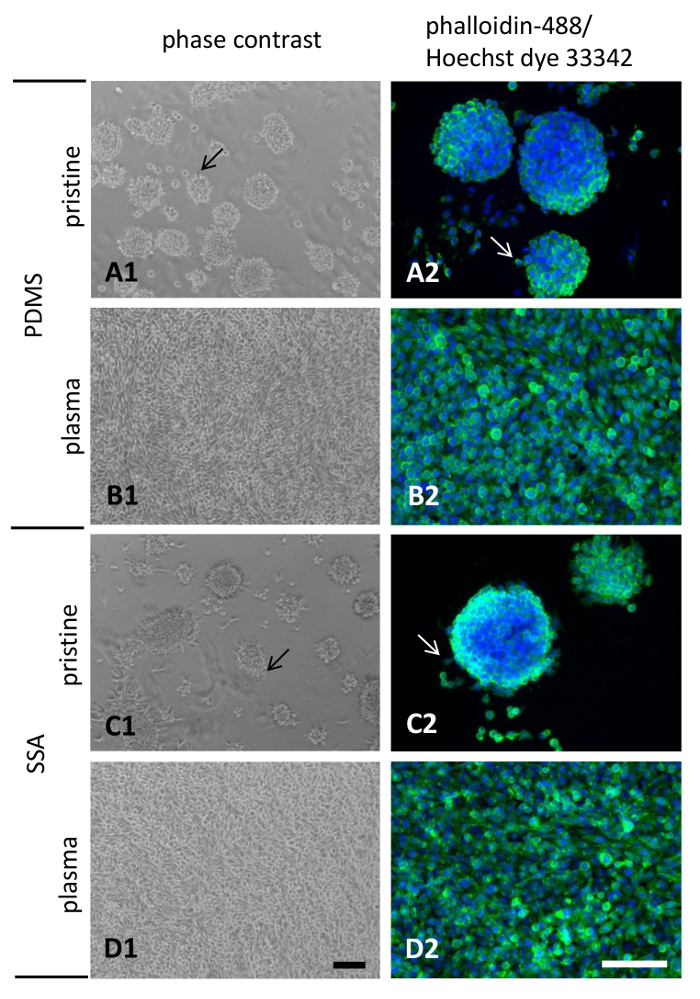
Figure 8 : morphologie cellulaire des fibroblastes L929 cultivés sur des films minces : L929 fibroblastes murins ont été cultivés pendant 3 jours sur les couches minces, fabriqués à partir de PDMS (A1, A2, B1, B2) ou SSA (C1, C2, D1, D2). Pour augmenter la hydrophilicité des surfaces air plasma traitement a été effectué (B1, B2, D1, D2). Barres d’échelle en D1 et D2 illustrent 100 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
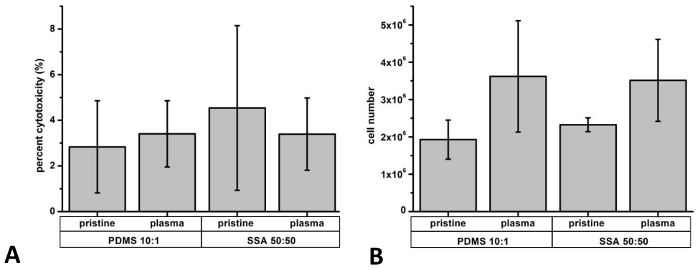
Figure 9 : détermination de la prolifération cellulaire et de cytotoxicité : Pour la détermination des effets cytotoxiques et prolifération cellulaire, les cellules L929 ont été ensemencées pendant trois jours sur PDMS 10:1 et films composites de la SSA 50/50. Libération de la lactate déshydrogénase (LDH) a été déterminée par un dosage de l’activité LDH et révélait que moins de 5 % (A) la cytotoxicité. Nombre total de cellules après la période de culture a été évalué après manuel comptage des cellules individuelles avec une chambre de Neubauer (B). N = 3 effectué indépendamment des expériences ont été analysés. Barres d’erreur représentent déviation standard. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
La conception de structures composites permet l’ajustement simple des propriétés des matériaux, tels que le module de Young ou l’épaisseur des échantillons. Le module de Young du PDMS est effectivement modifiable dans un large éventail en modifiant le rapport de mélange entre les deux composantes ou fabrication de mélanges en utilisant un autre silicone élastomère30,31. Les méthodes décrites ne sont pas limités à de la PDMS utilisé dans l’enquête en cours, mais surtout la performance adhésive dépend fortement du type spécifique utilisé. Une étape cruciale dans le présent protocole est le procédé de fabrication des films composites (Figure 1). Il a été démontré que l’épaisseur des films affecte sensiblement le comportement de l’adhérence des films sur différents substrats, y compris la peau (Figure 5 et Figure 6). Outre l’épaisseur du film, temps et température pendant le processus de durcissement affecte les propriétés matérielles32. Paramètres que l’épaisseur des couches polymères doivent être adaptées et vérifié avec soin.
Analyse des propriétés adhésives des films minces a été réalisée avec les mesures d’adhérence de force normale à l’aide de deux substrats de verre avec une rugosité différente jusqu'à Ra = 0,338 µm (Figure 3). En général, rugosité effets sensiblement l’adhérence des surfaces, en particulier des matériaux élastiques33,,34. La rugosité du verre peut être facilement modifiée par ponçage au papier de verre de tailles différentes aspérités, ce qui permet la fabrication de substrats présentant plus de valeurs de rugosité21. En outre, les autres matériaux, par exemple la résine époxyde utilisable pour la production de substrats15,35. Cela pourrait être une stratégie importante modification du protocole présenté. Par exemple, si les substrats présentant différentes énergies libres de surface sont nécessaires ou spécifiques topographies sont nécessaires. Ici, l’arrachement stress et travail de séparation des films minces fabriqués de PDMS et SSA ont été analysés avec une configuration sur mesure (dispositif de mesure adhérence macroscopique (MAD, Figure 4)). 36 l’alignement optique du substrat et avec pénétrateur est une étape essentielle pour l’analyse des résultats de la mesure. Par conséquent, réglage de l’angle d’inclinaison doit être effectuée avec le goniomètre, aussi précis que possible. C’est possible avec une précision suffisante en mettant manuellement le substrat en contact avec la surface du film jusqu'à l’obtention d’un contact horizontal.
Dans le protocole actuel, le temps d’attente était maintenu constant à une seconde (Figure 5 et Figure 7). Spécialement pour l’enquête sur la performance adhésive d’un film élastique à une surface de substrat rugueux, une prorogation du délai attente fournit des informations supplémentaires. Par exemple, une augmentation de contrainte de traction avec le temps d’attente a été rapporté8. Outre les mesures effectuées dans le protocole actuel, d’autres méthodes, par exemple essais de pelage pourraient exécuter, permettant une enquête plus approfondie d’adhérence performance37.
Les propriétés adhésives des films composites présentant le film différente épaisseurs de la colle de peau molle ont été déterminées (Figure 7). Nos résultats concordent avec les données publiées, montrant qu’une baisse de film épaisseur conduisent à une augmentation de la contrainte de traction comme le confinement, c.-à-d., le rapport entre l’épaisseur de film et le diamètre du substrat, augmentations38,39 . Basé sur ces résultats et les données représentées dans la Figure 7, nous concluons que les films composites avec une épaisseur totale d’environ 100 µm (l’épaisseur de la couche de SSA env. 60 µm, appliqué à un film PDMS avec une épaisseur d’environ 40 µm) pièce adhérence favorable p ropriétés sur des surfaces rugueuses.
Ensuite, les expériences liées à la caractérisation biologique ont été réalisées sur des films composites immaculées et plasma traité films composites (Figure 8). Traitement plasma des élastomères de silicone est une technique souvent appliquée, polyvalente pour augmenter les propriétés hydrophiles des surfaces et la promotion d’attachement cellulaire et cellulaires diffusion40,41. Silicones sont bien connus pour leur faible toxicité et biostabilité haute mais peuvent contenir des monomères résiduels ou catalyseurs susceptibles d’influencer les processus physiologiques, conduisant aussi à la cytotoxicité42,43. Dans les expériences, nous avons observé moins de cytotoxicité de 5 % à l’aide de libération de LDH comme un indicateur et un test d’exclusion bleu Trypan. Dans le protocole présenté, l’ensemble de la population cellulaire, y compris les agrégats cellulaires individuelles forme que la surface a été analysée pour l’analyse de prolifération (Figure 9 b). Une modification du protocole pourrait produire des résultats plus différenciées. Pour chaque échantillon, le surnageant contenant des agrégats cellulaires individuelles pourrait être transféré dans un tube à essais distincts et pas combiné avec les cellules enzymatiquement retirés de la surface du polymère. Cela permet l’évaluation exacte des cellules attachées à la surface et finit par révéler une détermination plus détaillée de l’influence des polymères sur le processus d’adhésion cellulaire. Outre les méthodes immunocytochimiques présentées ici, cellules pourraient être récoltées pour enquête avec des méthodes d’immunoblot, ce qui permet une évaluation quantitative détaillée d’expression de la protéine.
En résumé, nous avons établi des conditions de fabrication pour la production de composites élastomères minces pour des applications dans la recherche de culture cellulaire avancé. En outre, ces films minces possèdent haute capacité d’adaptation à la peau de rugosité, permettant la conception sophistiquée de colles de peau.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Martin Danner est reconnu pour son aide dans la préparation des échantillons et la mise en place des procédures de culture cellulaire. Les auteurs tiennent à remercier Biesterfeld Spezialchemie GmbH (Hambourg, Allemagne), en particulier Robert Radsziwill pour un soutien continu et des discussions. La recherche ayant abouti à ces résultats a été financé par le Conseil européen de la recherche au titre septième Programme-cadre (FP/2007-2013) Convention de subvention ERC n. de l’Union européenne 340929.
matériels
| Name | Company | Catalog Number | Comments |
| 2-Propanol, 97% | Stockmeier Chemie | 1000452610000 | Isopropanol |
| Abrasive diamnod hand pad | Bohle | MO 5007522 | Grit: 220 |
| Accutase | Capricorn Scientific | ACC-1B | |
| Albumin Fraktion V | Roth | 0163.2 | BSA |
| Alexa Fluor 488 Phalloidin | ThermoFischer Scientific | A12379 | highly toxic |
| Aquamount | Polysciences | 18606-20 | water soluble mounting medium |
| CytoTox-ONE Homogeneous Membrane Integrity Assay | Promega | G7890 | |
| DPBS, without Ca2+, Mg2+ | ThermoFischer Scientific | 14190094 | |
| Fetal bovine serum gold | GE Health Care Life Science | A15-151 | FBS |
| Goniometer OCA35 | Dataphysics | for the determination of the static water contact angle | |
| Hoechst Dye 33342 | Sigma-Aldrich | B1155-100MG | bisBenzimide H 33342 trihydrochloride, highly toxic |
| Microscope Axiovert 25 | Zeiss | Microscope used for cell culture documentation | |
| Microscope Eclipse LV100ND | Nikon | Microscope used for film thickness determination | |
| Paraformaldehyde, aqueous solution 16% | Electron Microscopy Sciences | RT 15710 | electron microscopy grade |
| penicillin und streptomycin solution | Sigma-Aldrich | P4333-100ML | |
| Phenom XL Scanning Electron Microscope (SEM) | Phenom | ||
| Poly-(vinyl alcohol) 4-88, MW 31000 | Sigma-Aldrich | 81381-1KG | Mowiol 4-88 |
| Poly-dimethyl siloxanes, Sylgard 184 | Dow Corning | (400)000108351397 | PDMS |
| RPMI 1640 basal medium | ThermoFischer Scientific | 21875034 | |
| soft skin adhesive (SSA) | Dow Corning | (400)000108251792 | MG 7-9800 Soft Skin Adhesive (SSA) |
| speed mixer DAC 600.2 VAC-P | Hauschild | ||
| stylus profilomter | Zeiss | Model: SURFCOM 1500SD3 | |
| Tecan Infinite M200 pro | Tecan | fluorescence plate reader | |
| Triton X 100 | Calbiochem | 648466 | |
| Trypan Blue solution | Sigma-Aldrich | T8154-100ML | highly toxic |
| Trypsin/EDTA solution | PAN-Biotech | P10-023500 | 0.05% Trypsin, 0.02% EDTA in PBS |
| UV glue | Bohle | BO MV76002 | medium viscosity |
Références
- Lloyd, A. W., Faragher, R. G. A., Denyer, S. P. Ocular biomaterials and implants. Biomaterials. 22, 769-785 (2001).
- Zhang, M., Wu, J., Wang, L., Xiao, K., Wen, W. A simple method for fabricating multi-layer PDMS structures for 3D microfluidic chips. Lab Chip. 10, 1199-1203 (2010).
- Kwak, M. K., Jeong, H. E., Suh, K. Y. Rational design and enhanced biocompatibility of a dry adhesive medical skin patch. Adv. Mater. 23, 3949-3953 (2011).
- Gun Park, D., Chul Shin, S., Won Kang, S., Tae Kim, Y. Development of flexible self adhesive patch for professional heat stress monitoring service. Conf. Proc. IEEE Eng. Med. Biol. Soc. 4, 3789-3792 (2005).
- Thomas, X. Silicone Adhesives in Healthcare Applications. Dow corning Lit. , (2013).
- Fuard, D., Tzvetkova-Chevolleau, T., Decossas, S., Tracqui, P., Schiavone, P. Optimization of poly-di-methyl-siloxane (PDMS) substrates for studying cellular adhesion and motility. Microelectron. Eng. 85, 1289-1293 (2008).
- Wang, Z., Volinsky, A. A., Gallant, N. D. Crosslinking effect on polydimethylsiloxane elastic modulus measured by custom-built compression instrument. J. Appl. Polym. Sci. 131, 41050 (2014).
- Fischer, S. C. L., Kruttwig, K., Bandmann, V., Hensel, R., Arzt, E. Adhesion and cellular compatibility of silicone-based skin adhesives. Macromol. Mater. Eng. , 1-11 (2017).
- Martina, D., Creton, C., Damman, P., Jeusette, M., Lindner, A. Adhesion of soft viscoelastic adhesives on periodic rough surfaces. Soft Matter. 8, 5350-5357 (2012).
- Brown, X. Q., Ookawa, K., Wong, J. Y. Evaluation of polydimethylsiloxane scaffolds with physiologically-relevant elastic moduli: Interplay of substrate mechanics and surface chemistry effects on vascular smooth muscle cell response. Biomaterials. 26, 3123-3129 (2005).
- Song, F., Ren, D. Stiffness of cross-linked poly(dimethylsiloxane) affects bacterial adhesion and antibiotic susceptibility of attached cells. Langmuir. 30, 10354-10362 (2014).
- Buxboim, A., Rajagopal, K., Brown, A. E. X., Discher, D. E. How deeply cells feel: methods for thin gels. J. Phys. Condens. Matter. 22, 194116 (2010).
- Discher, D. E., Janmey, P., Wang, Y. -. L. Tissue cells feel and respond to the stiffness of their substrate. Science. 310, 1139-1143 (2005).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix Elasticity Directs Stem Cell Lineage Specification. Cell. 126, 677-689 (2006).
- Roth, J., et al. Surface functionalization of silicone rubber for permanent adhesion improvement. Langmuir. 24, 12603-12611 (2008).
- Thiébaud, P., Lauer, L., Knoll, W., Offenhäusser, A. PDMS device for patterned application of microfluids to neuronal cells arranged by microcontact printing. Biosens. Bioelectron. 17, 87-93 (2002).
- Tourovskaia, A., Figueroa-Masot, X., Folch, A. Differentiation-on-a-chip: a microfluidic platform for long-term cell culture studies. Lab Chip. 5, 14-19 (2005).
- Peterson, S. L., McDonald, A., Gourley, P. L., Sasaki, D. Y. Poly(dimethylsiloxane) thin films as biocompatible coatings for microfluidic devices: Cell culture and flow studies with glial cells. J. Biomed. Mater. Res. - Part A. 72, 10-18 (2005).
- Wan, Y., et al. Nanotextured substrates with immobilized aptamers for cancer cell isolation and cytology. Cancer. 118, 1145-1154 (2012).
- Ross, A. M., Jiang, Z., Bastmeyer, M., Lahann, J. Physical aspects of cell culture substrates: Topography, roughness, and elasticity. Small. 8, 336-355 (2012).
- Barreau, V., et al. Fibrillar Elastomeric Micropatterns Create Tunable Adhesion Even to Rough Surfaces. Adv. Funct. Mater. 26, 4687-4694 (2016).
- Briggs, G. A. D., Briscoe, B. J. The effect of surface topography on the adhesion of elastic solids. J. Phys. D. Appl. Phys. 10, 2453-2466 (1977).
- Dapp, W. B., Lücke, A., Persson, B. N. J., Müser, M. H. Self-affine elastic contacts: Percolation and leakage. Phys. Rev. Lett. 108, 1-4 (2012).
- Putignano, C., Carbone, G., Dini, D. Mechanics of rough contacts in elastic and viscoelastic thin layers. Int. J. Solids Struct. 69, 507-517 (2015).
- Laulicht, B., Langer, R., Karp, J. M. Quick-release medical tape. Proc. Natl. Acad. Sci. 109, 18803-18808 (2012).
- Kim, T., Park, J., Sohn, J., Cho, D., Jeon, S. Bioinspired, Highly Stretchable, and Conductive Dry Adhesives Based on 1D-2D Hybrid Carbon Nanocomposites for All-in-One ECG Electrodes. ACS Nano. 10, 4770-4778 (2016).
- Adamietz, I. A., et al. Effect of self-adhesive, silicone-coated polyamide net dressing on irradiated human skin. Radiat. Oncol. Investig. 2, 277-282 (1994).
- White, R. Evidence for atraumatic soft silicone wound dressing use. Wounds UK. 1, 104-109 (2005).
- Quan, M. B., Edwards, C., Marks, R. Non-invasive in vivo techniques to differentiate photodamage and ageing in human skin. Acta Derm. Venereol. 77, 416-419 (1997).
- Brown, X. Q., Ookawa, K., Wong, J. Y. Evaluation of polydimethylsiloxane scaffolds with physiologically-relevant elastic moduli: Interplay of substrate mechanics and surface chemistry effects on vascular smooth muscle cell response. Biomaterials. 26, 3123-3129 (2005).
- Palchesko, R. N., Zhang, L., Sun, Y., Feinberg, A. W. Development of Polydimethylsiloxane Substrates with Tunable Elastic Modulus to Study Cell Mechanobiology in Muscle and Nerve. PLoS One. 7, e51499 (2012).
- Johnston, I. D., McCluskey, D. K., Tan, C. K. L., Tracey, M. C. Mechanical characterization of bulk Sylgard 184 for microfluidics and microengineering. J. Micromechanics Microengineering. 24, 35017 (2014).
- Persson, B. N. J., Gorb, S. The effect of surface roughness on the adhesion of elastic plates with application to biological systems. J. Chem. Phys. 119, 11437 (2003).
- Peressadko, A. G., Hosoda, N., Persson, B. N. J. Influence of surface roughness on adhesion between elastic bodies. Phys. Rev. Lett. 95, 1-4 (2005).
- Purtov, J., et al. Measuring of the hardly measurable: adhesion properties of anti-adhesive surfaces. Appl Phys A. 111, 183-189 (2013).
- Kroner, E., Blau, J., Arzt, E. Note: An adhesion measurement setup for bioinspired fibrillar surfaces using flat probes. Rev. Sci. Instrum. 83, 16101 (2012).
- Sun, S., Li, M., Liu, A. A review on mechanical properties of pressure sensitive adhesives. Int. J. Adhes. Adhes. 41, 98-106 (2013).
- Webber, R. E., Shull, K. R., Roos, A., Creton, C. Effects of geometric confinement on the adhesive debonding of soft elastic solids. Phys. Rev. E. 68, 21805 (2003).
- Creton, C., Lakrout, H. Micromechanics of flat-probe adhesion tests of soft viscoelastic polymer films. J. Polym. Sci. Part B Polym. Phys. 38, 965-979 (2000).
- Tan, S. H., Nguyen, N. -. T., Chua, Y. C., Kang, T. G. Oxygen plasma treatment for reducing hydrophobicity of a sealed polydimethylsiloxane microchannel. Biomicrofluidics. 4, 32204 (2010).
- Kim, B., Peterson, E. T. K., Papautsky, I. Long-term stability of plasma oxidized PDMS surfaces. Conf. Proc. IEEE Eng. Med. Biol. Soc. 7, 5013-5016 (2004).
- Briganti, E., et al. Silicone based polyurethane materials: A promising biocompatible elastomeric formulation for cardiovascular applications. J. Mater. Sci. Mater. Med. 17, 259-266 (2006).
- Regehr, K. J., et al. Biological implications of polydimethylsiloxane-based microfluidic cell culture. Lab Chip. 9, 2132 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon