Method Article
Тонкий фильм композитный кремния эластомеров для культуры клеток и приложений кожи: производство и характеристика
* Эти авторы внесли равный вклад
В этой статье
Резюме
Протокол для производства композиционных полимерных тонкопленочных структур, обладающих различными молодые модули или толщины представлен. Пленки производятся для изучения передовых клетки культуры или как клей кожи.
Аннотация
В этом протоколе мы представляем методы для изготовления тонких эластомер композитных фильмов для приложений передовых клеток культуры и развития кожи клей. Два различных поли-(dimethyl siloxanes) (PDMS и мягкой кожи клей (SSA)), были использованы для глубины исследования биологических эффектов и адгезионные характеристики. Композитные пленки состоят из слоя гибкой поддержкой и клей верхнего покрытия. Оба слоя были изготовлены методом доктор лезвие приложения. В ходе настоящего расследования была исследована клей поведение композиционных пленок как функция толщины слоя или вариации Юнга верхнего слоя. Юнга PDMS был изменен путем изменения базы для сшивателя смешивая коэффициент. Кроме того толщина пленки SSA менялась от 16 мкм до приблизительно 320 мкм. сканирование электронная микроскопия (SEM) и оптической микроскопии были использованы для измерения толщины. Адгезивные свойства эластомера фильмов сильно зависит от толщины пленки, Юнга полимеров и характеристик поверхности. Таким образом была исследована нормальной адгезии этих фильмов на подложках стекла экспонирования гладкие и шероховатые поверхности. Отрыва стресс и работа разделения зависит от смешивания соотношения Эластомеры силиконовые.
Кроме того Толщина мягкой кожи клей, укладывают поверх слоя вспомогательную поддержку изменялось для того чтобы произвести патчи для приложений кожи. Были проведены цитотоксичность, распространением и клеточной адгезии мышиных фибробластов L929 на PDMS (смешивания соотношении 10:1) и кино SSA (смешивания соотношение 50: 50). Мы показали здесь, в первый раз, бок о бок сравнение композитных пленок, изготовленных из обоих полимеров и представить исследование их свойств биологического - и клей.
Введение
В этом протоколе представлены подробные методы для производства тонких эластомер фильмов. Широко доступны доктор лезвие методика использовалась для производства композитных пленок. Технология изготовления была выполнена на polyethylenterephtalate (ПЭТ) пленки, что позволяет последующее производство этих фильмов в больших масштабах. Внимание этот протокол является оценки воспроизводимости, точное изготовление различные слои композиционных пленок и определения биологического и адгезии свойств Заключительный композитный патч. Poly-(dimethylsiloxane) силиконовые эластомеры (PDMS) широко используется в биомедицинской технологии, включая производство кожи клей, микрофлюидика приложений и дополнительных исследований поля1,2,3 ,4. Недавно еще один подкласс PDMS, так называемые мягкие кожи клеи (SSAs) были введены, особенно для нежной кожи, склеивание и де склеивание.
Силиконовые SSAs, винил функционализированных эластомеры, отличаются от аналогичных полимеров отсутствие усиления кремнезема5. Похож на других PDMS, SSA Юнга может быть адаптирована в широком диапазоне регулирования концентрации крест-компоновщик или отверждения время6,,7-8. Это изменение в Юнга силиконовые эластомеры значительно влияет на адгезивные свойства материала и имеет также серьезные последствия на клетки прокариот и эукариот, культивируемых на поверхности9,10 , 11. на клеточном уровне биологической, было показано, что эукариотических клеток реагировать на уровне трансдукции сигнала модуляции матрица упругости или толщина поверхности9,10,12 ,,1314. Таким образом существует широкий интерес в приложениях культуры клеток с перестраиваемой механических свойств полимеров. Важно отметить, что неразрывно низкой поверхностной энергией силиконовой основе эластомеров не обеспечивать оптимальные условия для клеточной культуры эукариотических клеток. Плазменной очистки кислорода является широко используемый метод для увеличения PDMS низкой поверхностной энергией временно, привело к увеличению численности ее отрыва, уменьшилось поверхности адсорбции молекул, в то время как параллельно поощрение вложения, распространение и распространение эукариотических клеток15,16,17,18.
Помимо свойств материалов топографии поверхности значительно влияет на клеточной адгезии и клей взаимодействие между двумя материалы19,20,21,22. Шероховатость поверхности имеет несколько эффектов на формирование контакта между двумя поверхностями: сокращение площади контакта, высокая хранится упругая энергия, окружающих городами, а также влияние на распространение трещин может изменить слипчивая прочность23, 24. Адгезия Пленки самоклеющиеся для кожи человека является полем новых приложений, например, перевязочные, фиксации электродов ЭКГ или других носимых электронных устройств25,26,27, 28. Для измерения производительности клей self-клеи применительно к топографии поверхности, стеклянные подложки с различной степенью шероховатости может использоваться в обычных сцепления измерения8,21. Здесь были выбраны две стеклянные подложки расследовать адгезивные свойства полимерных пленок. Во-первых, Композитные пленки слоем PDMS бэк в смешивая соотношении 10: 1 вес частей, охватываемых PDMS с различным соотношением смешивания были охарактеризованы. В качестве второго шага клеевой слой SSA был подготовлен с одинаковое количество обоих компонентов и с различной толщины пленки поверх поддержки PDMS фильм.
протокол
Предупреждение: Обратитесь все соответствующие листы данных безопасности материалов (MSDS) перед использованием. Некоторые из химических веществ, используемых в настоящем Протоколе являются раздражителями, остро токсичными или канцерогенными. Пожалуйста, используйте все практики безопасности при обработке этих химических веществ. Это включает использование техники (химическая кабинет) и личного защитного снаряжения (защитные очки, перчатки, лаборатории пальто, брюки полной длины и закрыты носок обуви). Части следующие процедуры включают культуру животных клеток линии. Поэтому пожалуйста, следуйте положениям конкретных биобезопасности. Химические и биологические отходы необходимо утилизировать согласно конкретные национальные и институциональные правила и рекомендации.
1. Подготовка кремния эластомерных тонкопленочных композитных конструкций
-
Подготовка полимеров
- Подготовить 1.1 g PDMS в соотношении 10:1, смешайте 1.0 g соединение A с 0,1 г соединения б.
- Смеси и degase предварительно полимеров в смесителе скорость на 2350 об/мин под вакуум на 3 мин.
- Измените массового соотношения между соединения A и B комплекса 45: 1 и 70:1. Приготовляют их аналогично описанному в 1.1.2.
- Подготовка 1 g мягкой кожи клей (SSA) в соотношении 50: 50. Поэтому Смешайте 0,5 г соединения A и 0,5 g комплекса B, как описано в 1.1.2.
-
Подготовка поли-(vinyl alcohol) (ПВА) покрытием PET фольгой
- Приготовляют раствор ПВА 18% (w/w) в воде, добавив ПВА деионизированной воды и перемешать на ночь с магнитной мешалкой. Хранить это решение при 4 ° C.
- Подготовка тонких пленок, экспонируется эффективной толщиной 15 мкм с машиной доктор лезвие приложения, используя 100 мкм разрыв лезвия и скорости около 2,0 мм/сек.
- Место фильмов в духовке при температуре 95 ° C в течение 15 мин.
-
Подготовка бэк-слоя смешивания соотношения PDMS 10:1 методом доктор лезвие
- Используете машину приложения автоматически контролируемые доктор лезвие для приготовления тонких пленок.
- Очистить ПЭТ фольги с 100% изопропиловый спирт и поместите его на поверхность области применения доктор лезвие.
- Поместите нож доктор поверх фольги и отрегулировать толщину с микро позиционирования винтов. Для изготовления мокрые слои, применяют толщиной 60 мкм, 100 мкм, 200 мкм и 500 мкм.
- Заполните PDMS полимер 10:1, подготовленный на этапе 1.1 в водохранилище ракельный нож с одного шприца. Начало движения лезвия со скоростью около 2,0 мм/сек.
- Снимите с машины ПЭТ-пленка с покрытием прикладной 10:1 и поместите его в духовку на 1 час при температуре 95 ° C, в комнате, экспонирование влажность между 40% и 65%.
- Очищайте лезвие доктор с изопропанол и бумажные полотенца.
- Повторите эту процедуру для всех требуемых толщины.
-
Подготовка верхнего слоя PDMS в различных соотношениях смешивания методом доктор лезвие
- Удаление тонкие полосы длина стороны основной фильм с скальпелем или лезвием бритвы, чтобы позволить размещение и скольжения лезвия, доктор Пэт фольги.
- Выполните действия протокола 1.3.3 для 1.3.6. Мокрый толщина применяется для фильма составляет 160 мкм.
- Повторите эту процедуру для производства двух независимых фильмов с другой смешивая коэффициент PDMS компонентов (45: 1 и 70:1). Храните фильмы при комнатной температуре (около 22 ° C и влажности от 40 до 65%) в квадратных Петри, чтобы предотвратить их от загрязнения и пыли.
-
Подготовка композитных пленок, экспонирования различной толщины слоя SSA 50: 50
- Подготовьте PDMS 10:1 фильмов в качестве бэк слоя, как описано в шаге 1.3 раньше.
- Выполните шаги протокол 1.4.1 и 1.4.2 производить эти фильмы. Использование SSA в смешивая соотношении 50: 50 и производство фильма с мокрой толщиной 40 мкм.
- Повторите эту процедуру для дополнительных мокрой толщины: 120 мкм, 300 мкм, 500 мкм.
2. нормальное сцепление измерения с использованием подложек с различными шероховатость поверхности
-
Подготовка и характеристика стеклянных субстратов с различными шероховатости поверхности
- Используйте стеклянный цилиндр диаметром 2 мм как «гладкая субстрат».
- Для изготовления акцизных «грубой субстрата» с стеклорез кусок с измерением около 4 x 4 мм из матового стекла слайда. Используйте абразивные алмазные подручник для получения круговой области приблизительно диаметром 3 мм.
- Придают стекла и алюминия конуса с УФ клеем и осветить ее в камере УФ освещения на 3 мин.
- Определите радиус площади поверхности субстрата с помощью оптического микроскопа. Вычислить площадь согласно формуле A = πr2.
- Определение шероховатости параметр R и Rz (согласно: DIN EN ISO 4287, ASME B46.1) с профилометра пера.
- Аффикс субстрата на сцене образца профилометра и привести кончик (алмаз, Стандартный: 2 мкм/60 °) контакт с образца.
- Запишите профиль шероховатости с длиной 1 мм и скорости 0,3 мм/с.
- Для анализа рельефа поверхности, измерьте площадь точно 1 мм2 с пера профилометр, выполняемых соответствующее программное обеспечение.
Примечание: Профилометра управляется внешним компьютером. Держатель сдвигается на 0,001 мм в направлении y после перемещения 1 мм в x направление. Записанные. RS3-файл импортируется в Surfcom карта эксперт программное обеспечение для создания 3D-изображений.
-
Измерение нормальный адгезии тонких пленок, изготовленных из PDMS или SSA
- Используйте лезвие бритвы отрезать фильмов на PET фольгой на мелкие кусочки с площадью около 4,0 см2 и место их на стекло слайд с УФ клеем. Освещения с УФ-излучения на 3 мин.
- Смонтируйте полимерных образца на держателя образца.
- Очистите субстрат поверхности нежно с этанолом и сухим азотом.
- Прикрепите стеклянной подложке, монтируется к алюминиевой конуса, нагрузки ячейки.
- Используйте таблицу наклоняемая (гониометра) для выравнивания поверхности точно регулируя угол наклона подложки, приближается к полимерной пленки. Чтобы сделать это, принести субстрат вручную при контакте с фильма. Измените угол наклона до тех пор, пока полностью параллельной выравнивание обеих поверхностей друг к другу, визуализированное камеры изображения, получается.
Примечание: Динамометр подключен к таблице наклона. Призму стекла расположен ниже образец, как показано на рисунке 4, позволяя визуализация области контакта с двумя камерами и включение выравнивания субстрата на полимерную пленку. - Перемещение подложки к поверхности полимерной пленки до тех пор, пока преднагрузки стресс 13 ± 5 кПа достигнута (рис. 4).
- Стартовый пакет пользовательские запрограммирован программное обеспечение, написанное в LabView для управления требуется измерение параметров таких как провести время и подход/Ретракция скорости. T время держать,держать составляет 1 секунду, подход и скорость отряда — 30 мкм/с и 10 мкм/s соответственно.
- Выполните измерения адгезии на три независимых промышленных образцов и в шести различных местах на каждой поверхности пленки.
-
Анализ данных и расчет ключевых механических факторов: отрыва стресс и работа разделения.
- Рассчитать стресс
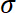 путем деления записанные силы в зоне субстратаS.
путем деления записанные силы в зоне субстратаS.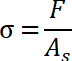
- Определите стресс отрыва, который описывается как максимальное значение нормального напряжения.
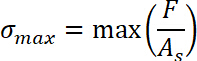
- Получите Δs перемещения путем вычитания начальное положение растяжение режимs0 из образца позицию sконце где было завершено де склеивание. Определить начало режима при растяжении s0 = 0.
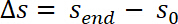
- Исправьте измеренных значений образец позицию соответствия системы C по следующему уравнению:
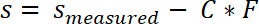
- Интегрируйте стресс смещение кривой между0 s и sконец для того чтобы вычислить работу разделения.

- Рассчитать стресс
-
Расчет основных механических факторов с использованием математических вычислений программного обеспечения происхождения.
- Импортируйте файл записанного .dat из одного сцепления измерения в таблице происхождения. Параметры, которые записываются являются время, образец позицию и силу. Вставьте эти параметры в столбцах A (время), B (образец позиция) и C (силы).
- Чтобы определить пустое значение, в среднем около 20 измерений силы прежде чем связаться с полимерной пленки. Назовите это среднее значение Fсмещение и вставьте его в колонке D.
- Рассчитать фон исправлены силы F * по следующему уравнению

и вставить это уравнение, как показано ниже, в столбец E.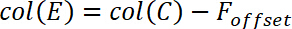
- Определить начало режима растяжение нулевого смещения, т.е., s0 = 0. Таким образом определить s0 и вычесть его от перемещения в столбец B и сохранить его в столбец F:
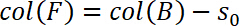
- Кроме того исправьте положение образца, машина соответствия. Эта коррекция выполняется в столбце G. вставить следующее уравнение в столбец G
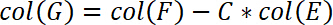
- Рассчитать стресс в следующем столбце H. Таким образом разделите силы в зоне субстрата. Вставьте следующее уравнение
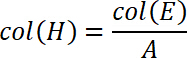
где A — площадь поверхности стеклянных субстратов в мм2 (определяется в 2.1). - Вычислите работу отделения от стресса и перемещения ценностей. Таким образом участок перемещения вдоль оси x и стресса вдоль оси y. Интегрировать этот граф от s0 sконце где sконец определяется как перемещение, при котором растяжении возвращается к нулю, т.е. полный отряд занял место. Чтобы интегрировать на графике, выберите функцию интеграции. Добавьте вычисленные значения в столбцы, я и Дж.
3. Характеристика пленок путем сканирования электронная микроскопия (SEM) и оптической микроскопии
-
Оптическая микроскопия
- С лезвием бритвы полимерная пленка нарезать небольшими кусочками (около 0,25 см2) и прикрепите их к краю на стеклянное скольжение. Место слайд стекло вертикально ориентированные под прямо микроскопом и измерения толщины поперечного сечения фильм.
Примечание: Используйте 20 X цель (NA = 0,45, теоретические разрешение 800 Нм 1,1 мкм) для измерения толщины пленки около ≤ 20 мкм. Для фильма толщины в диапазоне от 20 мкм до 50 мкм использовать объектив 10 X (NA = 0.30, теоретические разрешение 800 Нм 1,6 мкм) и для фильма толщиной ≥ 50 мкм использовать объектив 5 X (NA = 0,15, теоретические разрешение 800 Нм 3,3 мкм).
- С лезвием бритвы полимерная пленка нарезать небольшими кусочками (около 0,25 см2) и прикрепите их к краю на стеклянное скольжение. Место слайд стекло вертикально ориентированные под прямо микроскопом и измерения толщины поперечного сечения фильм.
-
SEM расследование
- Вырезать PET фольгой и придают образец приблизительно 2 см2 на стеклянное скольжение и поместите его вертикально зажимного механизма внутри образца держатель ≤ 2 мм ниже верхней поверхности держателя.
- Выберите ускорение напряжением 10 кв, детектор рассеяния электронов (BSD) и низким вакуума (60 Па).
- Отрегулируйте фокус, увеличение, яркость и контрастность изображения.
- Выбрать изображение приобретение время 28 s с разрешением 1024 x 2048 пикселей.
- Выньте держатель образца из SEM.
4. биологические исследования
- Обычные клетки культуры L929 клетки
- Используйте линии мышиных фибробластов клетки L929 для расследования. Культура клетки в базальной средний Розуэллом парк Мемориальный институт (RPMI) 1640, дополненная плода бычьим сывороточным 10% и пенициллина и стрептомицина при 37 ° C, 5% CO2 в T75 клетки культуры колбы. Проход клетки при впадении от 70% до 80%.
- Для клеток пассированый, удалите среды путем аспирации и мыть с кальция и магния бесплатно фосфатного буфера (DPBS- / -) для 30 s под ламинарным потоком кабинета. После инкубации клеток с 2 мл Accutase, фермент решение с протеолитической и collagenolytic активности до 5 минут при 37 ° C, 5% CO2.
- Проверка отряд клеток от поверхности колбы культуры клеток с микроскопом контраст фазы.
- Добавить 8 мл сыворотки содержащих средних в колбу и передачи суспензию клеток 15 мл реакции.
- Возьмите 10 мкл пример из суспензии клеток и смешать с 10 мкл Трипановый синий.
- Определить номер сотового с камерой Нойбауэр и рассчитать общее количество клеток.
Предупреждение: Трипановый синий токсичными, поэтому консалтинг ИКБМ, после обязательных процедур, описанных в ИКБМ, ношение защиты личной безопасности и обработки под Химический шкаф не требуется. Сбор отходов для осаждения химических отходов.
Примечание: Позитивные клетки Трипановый синий окрашены в синий, указанием номера нетронутыми клеточных мембран. - Для следующего прохода культуры 5 x 105 клеток в новую стерильную клеточные культуры флакон с 10 мл новой среды. Для экспериментальных условий, культуры 3 x 105 клетки в 6 хорошо пластин и 6 x 104 клетки в каждой скважине 24 хорошо пластины, содержащие полимерные образцы (шаг 4.2 протокол).
- Подготовка составного фильмов для экспериментов культуры клеток.
- Акцизный один штук фильмов желаемых размеров, изготовленных в протокол шаг 1.4 и 1.5 от PET благоприятной слоя с скальпель и место с помощью пинцета на поверхность скользит крышка стекла экспонирования диаметром 12 мм. место образцы в скважинах 2 4 пластины хорошо.
- Для определения цитотоксичности и подсчета клеток не удаляйте фильмов из фольги ПЭТ. Разрезать круговой области около 9,4 см2, установки аккуратно в одиночных скважин 6 хорошо плиты, из фильмов производится в 1.4 и 1.5 и поместите их в скважинах плиты культуры клеток.
- Погружать полимерные образцы в дейонизированной H2O ≥ 30 мин.
Примечание: Полимерные образцы могут быть стерилизован автоклавированием. Таким образом удалите все содержащие полимерные образцы из блюд культуры клеток и поместить их внутрь стекла Петри. Стерилизация проводится в автоклаве баре 2.05 для 20 минут при температуре 121 ° C.
- Плазменная обработка полимеров
- Место фильмов, которые крепятся на PET фольгой или круглой стеклянной крышки скользит (производство 4.2.1) внутри камеры реакции устройства, плазменным.
- Закройте крышку и эвакуировать до тех пор, пока будет достигнуто давление 1,6 x 10-2 мбар.
- Проводить лечение плазмы на 3 мин.
- Проветрите реакционной камере и образцы в 24 хорошо или 6 также блюда для дальнейшего расследования культуры клеток.
- Используйте характерную для определения угла контакта воды с гониометр. Таким образом переместить шприц близко к поверхности полимерных, используя пакет программного обеспечения и поместите каплю 3 мкл воды на верхней поверхности. Вычислите угол контакта статические воды с помощью гониометра программного обеспечения.
- Окрашивание и микроскопия
- Подготовка клетки, как описано в шаге 4.1.7 и культуре для 3 d при 37 ° C и 5% CO2.
- Захватить фазы контрастность фотографии клетки культивировали в течение трех дней на нетронутые- и плазмы лечить фильмов незадолго до фиксации.
- Подготовить PBS с 0,2% Тритон X-100. Медленно Пипетка 200 мкл Стоковый раствор 100 мл PBS (PBS-T).
- Приготовляют раствор 4% параформальдегида/PBS (PFA/PBS-T).
Предупреждение: Параформальдегида токсичными, поэтому консалтинг ИКБМ, после обязательных процедур, описанных в ИКБМ и ношение защиты личной безопасности и обработки под Химический шкаф не требуется. - Приготовляют раствор 5% BSA/PBS-Т.
- Удалите носитель, аспирации под пластинки поток кабинета. Добавьте PBS скважин для удаления средних остатков.
- Передавать химические кабинет пластину и замените 400 мкл раствора PFA/PBS PBS для 25 минут при комнатной температуре.
- Удаление решения PFA/PBS из одиночных скважин, тщательно вымыть с PBS в четыре раза. Подождите 3 минуты между каждым шагом стиральные и собирать решения для удаления химических отходов. Используйте пластину непосредственно, или хранить при 4 ° C.
- Добавить 5% бычьим сывороточным альбумином (БСА) / PBS-T к скважинам и проинкубируйте 60 мин на RT для блокирования сайтов неспецифических связывания.
- Аспирационная решения и заменить его с Фаллоидин, конъюгированных с Alexa-488 (разбавления 1: 160) / PBS-T решение дополнено с 0,2% Тритон X-100.
Предупреждение: Фаллоидин-488 токсичными, поэтому консалтинг ИКБМ, после обязательных процедур, описанных в ИКБМ и ношение защиты личной безопасности и обработки под Химический шкаф не требуется. - Крышка с алюминиевой фольгой и Инкубируйте 3 h на RT или на ночь при 4 ° C.
- Аспирационная решение и стирать три раза с PBS. Подождите 3 минуты между каждым шагом стирки. Собирайте решения для удаления химических отходов.
- Приготовляют раствор 1 мкл краситель Hoechst 33342 (stock раствор 1 мг/мл). Для разбавления 1: 1000 дозатор 1 мкл Hoechst красителя 3334 до 1 мл PBS-t и хорошо перемешать. Добавить 300 мкл краситель Hoechst 33342 решения скважин и проинкубируйте втечение 10 мин на RT в темноте.
Предупреждение: Краситель Hoechst 33342 является ДНК интеркалирующего реагента и поэтому потенциально мутагенным, поэтому консалтинговых ИКБМ, после обязательных процедур, описанных в MSDS и ношение защиты личной безопасности и обработки под химические кабинет не требуется. - Аспирационная решение и стирать образцы четыре раза с PBS. Подождите 3 минуты между каждым шагом стирки. Соберите раствор для удаления химических отходов.
- Для встраивания, тщательно удалить фильмы с поверхности культуры и разместить их на стекло микроскопа. 20-40 мкл воды растворимые внедрения среды к фильму и прикрепить новый циркуляр стекла Крышка скольжения на вершине, используя небольшое давление.
- Выполнение визуализации с флуоресцентным микроскопом. Фильтры, необходимые для освещения: Alexa-488 имеет максимум возбуждения в 496 Нм и максимум выбросов происходит в 519 Нм. Таким образом выбросов цвет зеленый. Hoechst 33342 краситель trihydrochlorid тригидрат complexed с ДНК имеет возбуждения максимум 355 Нм и максимальный комплекс выбросов ДНК происходит 465 Нм.
- Цитотоксичность определение и определение числа клеток
- Выполнение эксперимента с клеток, выращиваемых в 6 хорошо пластины, подготовленный на шаге 4.3 и клетки, подготовленную на этапе 4.1.7. Культура клетки для 3 дней при 37 ° C и 5% CO2. Для позитивных элемента управления используйте клетки, которые были выращены на культуре клеток лечение полистирол поверхности, содержащие не полимерных пленок. Для определения фона (негативное состояние) получите средний из скважины без клетки.
Примечание: Средний также могут быть взяты из хорошо содержащие клетки культивировали на поверхности полистирола лечение культуры клеток. - Зависимости от количества экспериментальных образцов ярлык 15 мл пробирок.
- Добавить 40 мкл раствора 0.9% Тритон X-100 содержащий PBS положительный контроль и энергично перемешать с наконечником 1000 мкл. Подождите около 3 мин.
- Без удаления клеток, придает поверхности, аспирационная средство от всех образцов, включая подготовленный в 4.5.3 и передачи среды для 15 мл пробирок. Добавить 3 мл DPBS- / - для одиночных скважин и хранить пластины под Ламинарный шкаф для определения номер сотового, как описано в 4.5.9.
- Центрифуга на 200 x g 3 минут и удалить супернатант для определения активности ЛДГ 1 мл. Сохраните 15 мл пробирок содержащие клетки и оставшиеся среднего под Шкаф ламинарный поток.
- Для анализа используются черный 96 также пластины с плоским дном. Добавьте 50 мкл Реагента CytoTox-один 50 мкл пример среднего и перемешать хорошо для 30 s.
- Крышка с алюминиевой фольгой и хранить в течение 10 мин на RT.
- 25 мкл стоп решения для каждой скважины и записывать интенсивности флуоресценции с читателем пластины флуоресценции. Встряхнуть пластину для 10 s и обнаруживать флуоресценции сигнал с волны возбуждения 520 Нм и длина волны излучения 560 Нм. Избегайте воздушных пузырей.
- Для определения количество аспирата клеток DPBS- / - из скважин культуры пластина из протокола шаг 4.5.4 и добавьте решения 15 мл реакции пробирки, содержащие supernatants, собранные в шаге номер протокола 4.5.5.
- Центрифуга для 15 мл реакции на 200 x g 3 мин и удалить супернатант. Добавить 0,5 мл трипсина/ЭДТА и инкубировать в течение 10 минут при 37 ° C.
- Добавить 2 мл трипсина/ЭДТА в к добрам плиты и проинкубируйте около 10 минут при 37 ° C для отсоединения клетки из полимерных пленок.
- Суспензию клеток переносится 15 мл реакции от шаг номер 4.6.10. Кроме того промойте пластины энергично сыворотка, содержащая среднего.
- Центрифугуйте образцы на 200 g x 3 мин, аспирационная супернатант и добавить сыворотки, содержащие среднего к трубе.
- Определите номер сотового, как описано в шагах 4.1.5 и 4.1.6.
- Выполнение эксперимента с клеток, выращиваемых в 6 хорошо пластины, подготовленный на шаге 4.3 и клетки, подготовленную на этапе 4.1.7. Культура клетки для 3 дней при 37 ° C и 5% CO2. Для позитивных элемента управления используйте клетки, которые были выращены на культуре клеток лечение полистирол поверхности, содержащие не полимерных пленок. Для определения фона (негативное состояние) получите средний из скважины без клетки.
Результаты
В первых экспериментах были изготовлены PDMS фильмов с различной толщины и постоянная смешивания в соотношении 10:1 на PET фильмов (Рисунок 1). Потому что толщина слоя бэк могут существенно влиять жесткость и обработки свойств всего композиционных пленок, в первоначальных экспериментов, которую один фильмы между 13 ± 2 мкм и 296 ± 13 мкм были изготовлены (рис. 1). Хорошо известно, что во время отверждения процесс усадки Пленки полимерные происходит. Для тонких пленок мы наблюдали разница 78% ± 3,1% между влажных и вылечить. Для толстых пленок усадка 40,9% ± 2,6% был обнаружен (рис. 1).
Для приложений, представленных в настоящем Протоколе фильмы должны быть вручную удалены из ПЭТ фольги. Мы признали, что особенно тонких пленок трудно справиться с щипцами и часто уничтожались во время этого процесса. Таким образом мы исследовали влияние тонкой поли-(виниловый спирт) покрытие как благоприятной слой. PVA имеет высокую жесткость и может быть легко удалена из-за его растворимости в воде в нисходящие приложения. Применяемых ПВА покрытие имеет толщину около 17 мкм и поэтому PDMS пленочной оболочкой поверх этого слоя слегка тоньше по сравнению с фильмов без покрытия ПВА (данные не показаны). Особенно упором на свойств обработки, мы заключаем, что только тонкий фильм требует благоприятной пленки ПВА для удаления из фольги ПЭТ.
Для всех дальнейших экспериментов был выбран эффективной пленки толщиной около 40 мкм. Для производства композитных пленок смешивая коэффициент PDMS варьировала от 10:1.45: 1 и 70:1 и применяется поверх ранее полимеризованной PDMS фильм с техникой доктор лезвия (рис. 2A). За исключением 10:1 соотношение различные фильмы можно четко отличает оптической микроскопии с точностью, соответствующей. Для микроскопического анализа фильмы были вырезать с помощью скальпеля и прилагается к краю на стеклянное скольжение. Более высокие коэффициенты смешивания верхнего слоя появился на микроскопических изображений, по сравнению с 10:1 соотношение Резервное слой (рис. 2B) визуально ярче. Кроме того сканирующая электронная микроскопия был использован для изображения образцов с увеличением около 860 X (рис. 2 c). Было признано, четко наблюдаемых разница в яркости между двумя PDMS фильмов, изготовленных в более высокие коэффициенты смешивания, в отличие от соотношении 10:1. Процедура резки оставляет знаки, видны на фотографии SEM (рис. 2B). На основе этих результатов, средняя общая толщина составного фильмов было 112 микрон ± 5,0 мкм (Рисунок 2D).
В дальнейших экспериментов адгезионные свойства этих фильмов были определены с нормальной силы сцепления измерения с использованием двух различных стеклянных субстратов (рис. 3). «Гладкая субстрата» обладает текстуры поверхности с арифметическое среднее шероховатостью R 0,013 ± 0.0002 мкм и среднее пик Долина Rz 0,12 мкм ± 0,004 (рис. 3A). Субстрат 2 (GS2, как грубая) выставлены значения шероховатости 0.338 ± 0,021 (R) мкм и 2.055 ± 0,017 мкм (R,z) (рис. 3B). С виду был рассчитан радиус, полученные в 2.1.4, площадь поверхности субстрата «гладкая» был 3,2 мм2 во время «грубой» субстрата, площадь поверхности 6.07 мм2 .
С этих двух субстратов было определено клей поведение различных фильмов. Два параметра выбраны для описания адгезивные свойства пленок: отрыва напряжение σМакс и работа разделения ВтСен. В течение всего процесса склеивания и де склеивание положение образца s и нормальная сила F записываются. Результаты представлены в стресс смещение кривой (рис. 4).
Для правильной интерпретации экспериментальных результатов она имеет важное значение для точного выравнивания субстрата к поверхности полимерных пленок. Кроме того машина соответствия устройство измерения должны рассматриваться для того, чтобы исправить смещения. Во время измерения усилие действует не только на образце, но и на других частях испытательного устройства. Таким образом каждый из двух субстратов прижимается стекла слайд с напряжений 13 ± 5 кПа. Для оценки соответствия, кривой нагрузки принимается во внимание, т.е., частью сил смещение кривой где две поверхности вступают в контакт до позиции образца, где достигается точное Предварительная сила. Взаимные наклон кривой равна машина соответствия C. Вычисленное значение для C-0,12 мкм/мин.
В первом эксперименте были проанализированы пленки с различными смешивания соотношения PDMS (рис. 5). Для композитных пленок был неизменным толщины и соотношением смешивания слоя бэк, изготовленных из PDMS 10:1. Толщина верхнего слоя был также неизменным со значением 65 мкм. Высокий отрыва стресс 109 ± 27,6 кПа был определен с гладкой стеклянной подложкой на фильм 10:1 PDMS (Рисунок 5A). Увеличение соотношения смешивания приводит к снижению стресса отрыва 76.7 ± 17 кПа для смешивая коэффициент 45: 1 и 41,4 ± 17 кПа для коэффициента 70:1. С грубой стекла субстрата отрыва стрессом 22 ± 2,2 кПа был определен на фильм PDMS 10:1. В общем, работа разделения была сопоставимой между обеими стеклянные подложки, например., 1.4 ± 0,6, J/м2 на тонкой пленки, полученные с гладкой субстрата и 1,84 ± 0,7 J/m2 на тонкий фильм получил с грубой субстрата ( Рисунок 5B).
Далее производство тонких пленок для приложений кожи и культуры клеток, которые приложений были изучены (рис. 6). SSA 50: 50 был использован для производства верхнего слоя композитных пленок. PDMS в 1:10 соотношение смешивания с толщиной 40 мкм был использован в качестве резервного слоя. В отличие от предыдущих экспериментов, изображенные на рисунке 5, была различной толщины верхнего слоя, в то время как смешивая коэффициент был неизменным (рис. 6A). SSA был выбран из-за его адгезивные свойства в приложениях, связанных с привязанность к поверхности с высоким шероховатости поверхности, особенно кожи человека, используя рекомендации производителей смешивания соотношение 50: 505,8. Эпидермис человека обладает высокой шероховатостью. В зависимости от возраста и анатомического региона средняя шероховатость поверхности глубины (ZR) между 48 мкм и 71 мкм был сообщили29. Безопасный и нежной кожей сцепления имеет важное значение, особенность для чувствительной кожи новорожденных или вряд ли регенерации кожи пожилых людей. Применялись различные мокрой толщины от 40 мкм, 120 мкм, 300 мкм до 500 мкм (рис. 6A). В зависимости от толщины мокрых Общая толщина композитных пленок варьируется от 51 мкм и 344 мкм (Рисунок 6B). После отверждения, композитный были прикреплены к задней части добровольцев руки (рис. 6 c). Толщины различных фильмов ясно показывают различия в свойствах их адаптации к шероховатости кожи (рис. 6 c). Тонких пленок (50 мкм и общей толщиной 100 мкм) отображают высокий уровень адаптации к морщин, по сравнению с толще фильмов (220 мкм и общая толщина 340 мкм). Эти результаты показывают, что композитные пленки с широким диапазоном толщины могут быть произведены именно с прикладной доктор лезвие техникой.
Были проведены эксперименты адгезии с этих составных фильмов (Рисунок 7). В зависимости от толщины Топ фильм SSA мы наблюдаем снижение стресса, pull-off с увеличения толщины пленки. Высшую силу отрыва 133 ± 36,6 кПа была измерена на гладкой поверхности (рис. 7A). Низкие тянуть покинуть стресс 18 ± 4 кПа был получен с грубой субстрата на толстую пленку. Интересно сравнение между обоих субстратов показывает 2,7 раза разница на тонких пленках (рис. 7A). С увеличение толщины пленки особенно на толстой пленки не замечательный разница была наблюдаемых (рис. 7A). С гладкой субстрата работу разделения 1.8 ± 0,8, J/m2 был обнаружен на выставке общей толщиной 100 мкм, фильм следуют зависимых уменьшение толщины фильм (220 мкм толщина: 1.6 ± 0,6 J/m2 и 330 мкм: 1,3 ± 0,4 J/м2 (Рис. 7B)). Работа разделения измеряется с грубой субстратов был в целом чуть ниже по сравнению с гладкой субстрата (100 мкм толщина: 1.63 ± 0,6 J/m2; 220 мкм толщина: 1.1 ± 0,6 J/m2 и 330 мкм: 1,0 ± 0,2 J/м2 (Рисунок 7B )).
Кроме того механизм отряд был записан во время измерений (рис. 7 c). Маленький кавитации был замечен на тонкий фильм, в то время как появление палец как трещины было наблюдать на более толстые фильмов (рис. 7 c).
Измерения были выполнены в течение одного месяца после производства фильмов. Однако стабильность и сохранение механических свойств упругих фильмы могут быть затронуты экологическими факторами, включая температуру и влажность. Как описано в шаге протокол 1.4.3, фильмы были сохранены при комнатной температуре и влажности воздуха 40-65%. Чтобы предотвратить их от загрязнения и пыли, фильмы были сохранены в пластиковых чашек Петри в темноте. Расследовать долгосрочной стабильности, измерения адгезии и определение толщины SSA 50: 50 фильмов были проведены примерно через четыре месяца после изготовления. Не большое влияние на толщины пленки, pull-off стресс и работа разделения была обнаружена после хранения. К примеру pull-off стресс SSA композитных фильмов, изготовленных с мокрой толщиной 120 мкм SSA и мокрой толщиной 100 мкм PDMS был 46,6 ± 6 кПа и работе разделения 1627 ± 592 МДж/м2 после изготовления. Приблизительно через четыре месяца после производства, было определено отрыва стресс 48.8 ± 5,4 кПа и работа разделения 1666 ± 723 МДж/м2 . Кроме того, вскоре после того, как производство, Общая толщина этих фильмов был 103,3 ± 13,9 мкм и после хранения 98,1 ± 9.1 мкм.
В дальнейших экспериментов PDMS 10:1 и SSA 50: 50 композитных пленок с общей толщиной приблизительно 105 мкм были использованы как клетки культуры субстратов (рис. 8). Композитные пленки, изготовлены в протокол шаг номер 1 можно легко удаляются из фольги ПЭТ и режут в необходимые размеры и геометрических форм. Кроме того, когда соблюдение пленки на жесткой поверхности, например стекла, несколько фильмов, отображение различных молодые модули могут прилагаться бок о бок и могут быть размещены внутри одного хорошо плиты культуры клеток. Фильмы могут прилагаться к поверхности полистирола напрямую без дополнительных coverslip. Кроме того фильмы могут быть адаптированы к различным поверхностям и геометрические структуры, таких как трубы или кольца, позволяя дальнейшие исследования не достижимы с обычными клетки культуры материалов. В проведенных экспериментах, изображен на рисунке 8 композитных пленок на ПЭТ фольги были помещены прямо в ячейку культуры пластин или фильмы были удалены из PET фольгой и помещены на скользит крышка стекла. Для экспериментальных условиях некоторые полимеры обращались с воздуха плазмой для увеличения их свободной поверхностной энергии. В общем, PDMS обладает углом контакта воды около 115° перед плазменной обработки и становится высоко гидрофильных доочистки (вода угол контакта < 30°)8. Плазменная обработка оказывает поверхности биосовместимых и облегчает прикрепление эукариотических клеток. В зависимости от лечения время и интенсивность изменяется поверхности полимера, отображение более высокой степени шероховатости и также могут появиться трещины. Сразу же после лечения наблюдается процесс гидрофобные восстановления. Как описано в разделе протокол шаг 4.3.5 гониометр была использована для определения статического воды контактных углов. Таким образом впоследствии были проанализированы полимеров, которые были помещены в ddH2O за 1 ч после плазменной очистки воздуха. Плазменная обработка значительно сократить угол контакта воды (PDMS нетронутой: 117,0 ± 2,2 °; SSA нетронутой: 127.9 ± 5,6 °; PDMS плазмы: 18,0 ± 7,2 °; SSA плазмы: 29.3 ± 11,5 °).
Для образца, встраивание водный монтажа применялся средний. Если в любой момент времени образцы должны быть удалены снова, образцы могут быть размещены в воде, содержащей Петри на ночь. В конце концов скользит крышка может быть удалены для дополнительного анализа.
Фазово-контрастная микроскопия и после окрашивания с флуоресцентным конъюгированных Фаллоидин-488 и краситель Hoechst 33342 (рис. 8) определено поведение привязанности и морфологию клеток L929, отобранный для 3 дней на композитных пленок PDMS и SSA 50: 50. Получение изображения с Фазово-контрастная микроскопия настоятельно рекомендуется, особенно для полимеров, не получавших плазмы. Из-за слабых клеточных адгезию к эти полимерные поверхности легко отсоединяются отдельные ячейки или агрегатов, осложняет правильное толкование последующего анализа методов.
Посеян на нетронутой полимеров ячеек плохое вложение и сотовых, распространение поведение (Рисунок 8A1 и C1) во время вырожденная монослоя было отмечено для клетки культивировали на поверхности плазмы лечение (Рисунок 8В1 и D1) . Формирования клеточных агрегатов и отрешенности от поверхности было более выраженным на нетронутых поверхностях. Визуализация нитей актина после фиксации с параформальдегида 4% выявлено несколько клетки мигрируют в периферии клеточных агрегатов и эманация lamellipodia выступы на нетронутой PDMS и SSA композитных пленок 50: 50 (Рисунок 8A2 и C2, стрелки). Никаких крупных качественных различий можно наблюдать при сравнении двух полимерных материалов. В качестве побочного сведению, представляется, что меньше количество клеточных агрегатов присутствовали на SSA 50: 50 по сравнению с PDMS. Кроме того агрегаты, придает поверхности на SSA 50: 50 появилась более плоский (Рисунок 8 c 1). Как и ожидалось, лечение с воздуха плазмой улучшение сотовой вложений и распространяется на обе поверхности значительно, ведущей к формированию замечательных lamellipodia выступы и вырожденная монослоя (Рисунок 8B2 и 8 d 2).
Релиз ЛДГ после 3 дней культуры был использован как индикатор для определения цитотоксических эффектов (рис. 9а). В целом, уровень ЛДГ были сопоставимыми для клетки культивировали на обоих полимерных материалах, с менее чем 5% цитотоксичности (нетронутой PDMS: 2.8 ± 2,0%; нетронутой SSA 50: 50: 4,5 ± 3,6%; плазмы лечение PDMS: 3,4 ± 1,5%; плазмы лечение SSA 50: 50: 3,4 ± 1,6%). Эти результаты сопоставимы с данных, представленных в нашей ранее опубликованные исследования, упором на расследование обоих эластомеров. 8 для дальнейшей проверки результатов assay ЛДГ, Трипановый синий исключение было испытание. Кроме того всю ячейку населения был определен для отображения различий в деятельности по распространению (рис. 9B). В целом меньше, чем 5% были подсчитаны Трипановый синий позитивные клетки (нетронутой PDMS: 2.4 ± 0,3%; нетронутой SSA 50: 50: 3,8 ± 2,5%; плазмы лечение PDMS: 0.74 ± 1,3% плазмы лечение SSA 50: 50: 0,95 ± 1,6%).
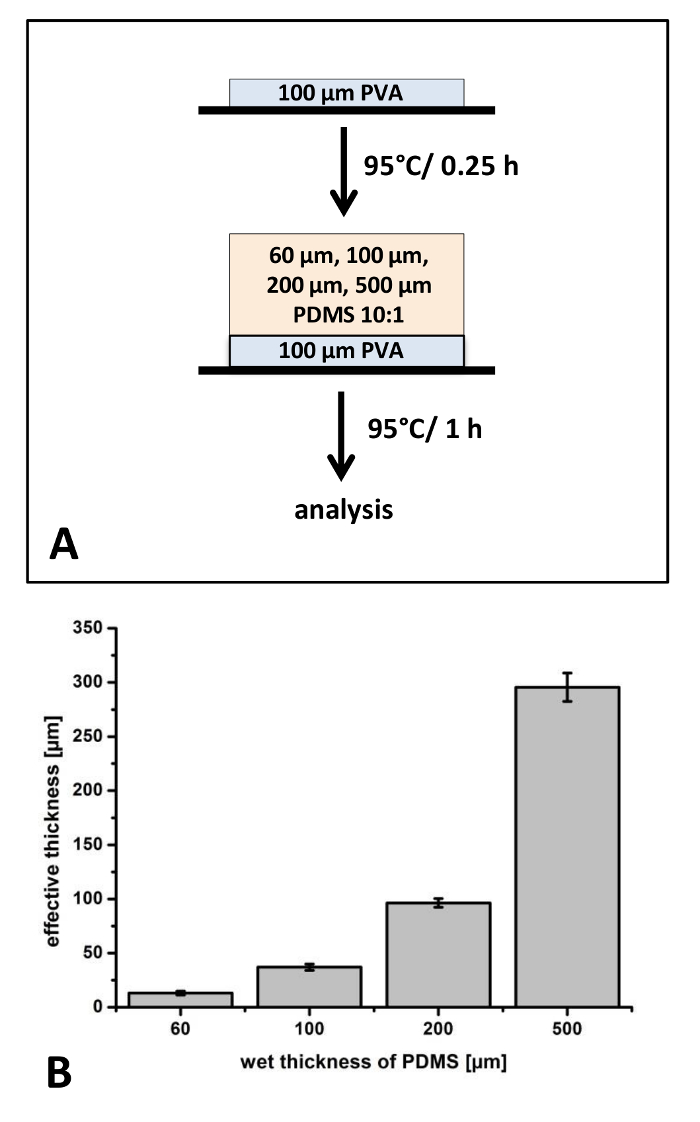
Рисунок 1: подготовка PDMS фильмов на Поли-(vinyl alcohol) (ПВА) покрытием PET фольгой: Процесс изготовления PDMS фильмов с различной толщины фольги ПЭТ был применен для определения воспроизводимость и обработка производительности (A). Толщины PDMS фильмов были проанализированы с оптической микроскопии после отверждения при 95 ° C (B). N = 3 самостоятельно изготовленных пленок были проанализированы. От каждого фильма, были выбраны три разных местах, были проанализированы вырезать и 3 позиции на каждом образце (k = 27). Планки погрешностей представляют собой стандартное отклонение. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2: подготовка композитных пленок PDMS, подготовленные в разных соотношениях смешивания: Композитные пленки, экспонируется различные соотношения смешивания базы (компонент A) для сшивателя (компонент Б) PDMS были изготовлены методом доктор лезвие. Верхний слой, состоящий из PDMS в соотношении 10:1 (компонент: b), 45: 1 и 70:1 были применены поверх ранее вылечить PDMS фильм 10:1 (A). После последующих отверждается при 95 ° C толщина составного фильмов был проанализирован оптической микроскопии (B) и растровая электронная микроскопия (C). N = 3 независимых экспериментов были выполнены и проанализированы с оптической микроскопии (D). Форма каждого независимого производства фильма, были выбраны три разных местах, были проанализированы вырезать и 3 позиции на каждой пробы (k = 27). Планки погрешностей представляют собой стандартное отклонение. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 3: определение шероховатости топографической поверхности двух субстратов, используемых для измерения адгезии: Две стеклянные подложки, обладающие различными шероховатость поверхности были охарактеризованы. Три размерные профилометрическийанализ анализ поверхности была выполнена на «гладкая» субстрат GS (A1) и «грубой» субстрат GR (B1). Соответствующие однолинейной кривых изображены в А2 и В2). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4: принцип измерения нормального сцепления: Установка настраиваемого построения был использован для характеризовать свойства адгезии полимерных образцов. Установки измерения изображен в (A), и подробная информация приводится в пункте (B). Для анализа измерений стресс был определен от стресса кривой времени (C). Работа отделения определялся интеграция стресс смещение кривой междуконец s и s0 (D). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 5: определение свойств адгезии композитных пленок с различными смешивания соотношения PDMS: Усилие отрыва (A) и работа разделения (B) композитный фильмов, изготовленные из PDMS смешивания соотношения 10:1, 45: 1 и 70:1 были измерены. Для анализа, ровную» стеклянные подложки (GS) выставке Ra = 0,013 мкм и «грубой» стеклянной подложке (GR) с R = 0,338 мкм были использованы. N = 3 самостоятельно изготовленных пленок были проанализированы. От каждого фильма, были выбраны две штуки и были проанализированы три различные позиции на каждом образце (k = 18). Планки погрешностей представляют собой стандартное отклонение. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
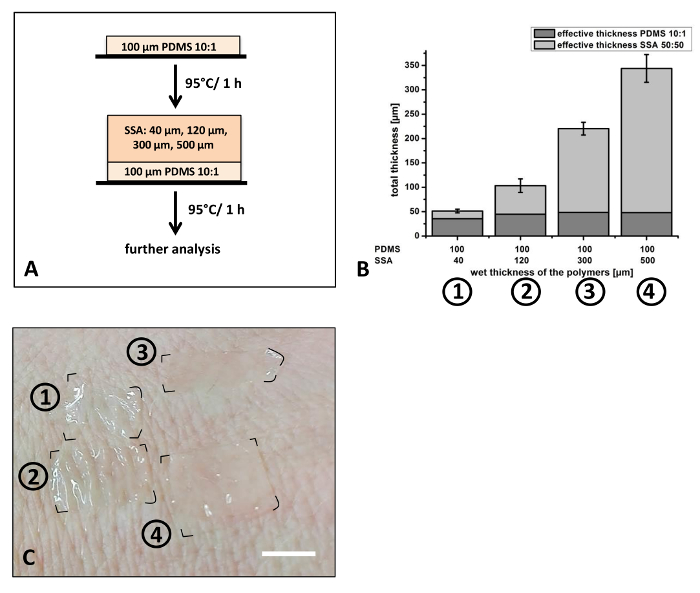
Рисунок 6: подготовка композитных пленок SSA с различной толщиной: SSA 50: 50 был применен поверх ранее вылечить PDMS фильм 10:1 (A). Применялись различные мокрой толщина этого слоя, начиная от 40 до 500 мкм и толщину после отверждения расследование с оптической микроскопии (B). Крепление фильмов к задней части добровольцев, которые рука отображается, что фильмы с общей толщиной 100 мкм (фильм #2) хорошо соответствует шероховатость кожи (C). Толщина одного слоя и общая толщина Композитные пленки показаны на рисунке 6B. Для анализа n = 3 самостоятельно изготовленные образцы были измерены с оптической микроскопии. От каждого фильма, были выбраны три разных местах, были проанализированы вырезать и 3 позиции на каждом образце (k = 27). Планки погрешностей представляют собой стандартное отклонение. Линейки в 6C изображает около 1 см. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 7: определение свойств адгезии композитных пленок из мягкой кожи клей: Композитных пленок СНО как верхний слой и PDMS 10:1 как бэк слоя были изготовленн. Толщина верхнего слоя был варьируется между 50 и 330 мкм., Pull-off стресс (A) и работа отделения (B) композитный фильмов, измеренная с двумя различными стеклянные подложки были проанализированы («гладкая» стеклянной подложке (GS) выставке R = 0,013 мкм и «грубой» стеклянной подложке (GR) с R = 0.338 мкм). Образцовое фотографии механизмов отряда визуализируются в C. Для анализа данных n = 3 независимо промышленные эксперименты были проанализированы. От каждого фильма, были выбраны две штуки и были проанализированы три различные позиции на каждом образце (k = 18). Планки погрешностей представляют собой стандартное отклонение. Масштаб баров в 7C изображают 0.5 мм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
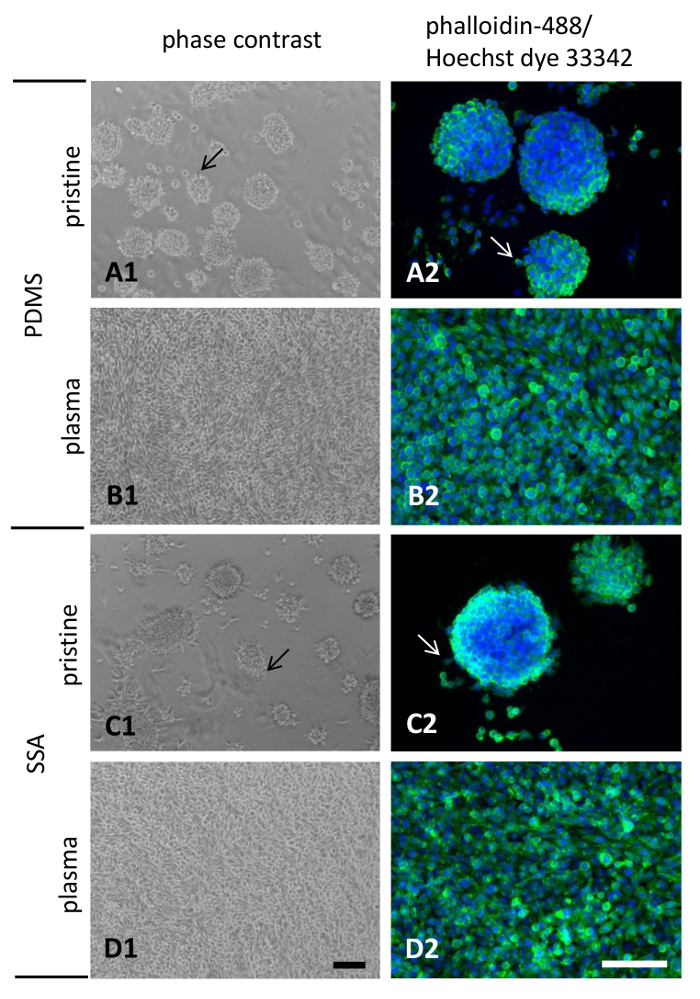
Рисунок 8: клеточной морфологии L929 фибробластов, культивируемых на тонких пленок: L929 мышиных фибробластов были культивировали в течение 3 дней на тонких пленок, изготовленных из PDMS (A1, A2, B1, B2) или ССС (C1, C2, D1, D2). Для увеличения гидрофильность поверхности, плазменной очистки воздуха было выполнено (B1, B2, D1, D2). Масштаб баров в D1 и D2 изображают 100 мкм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
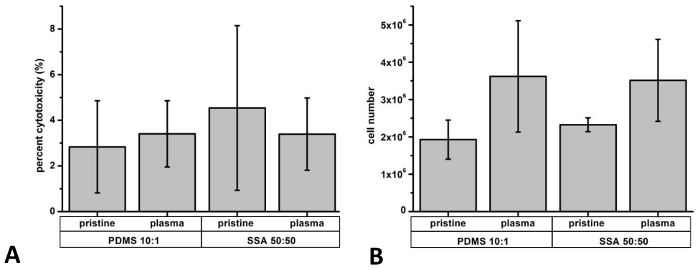
Рисунок 9: определение цитотоксичности и сотовых распространения: Для определения цитотоксических эффектов и пролиферации L929 клеток были посеяны на три дня по PDMS 10:1 и композитных пленок SSA 50: 50. Релиз Лактатдегидрогеназа (LDH) определяется assay активность ЛДГ и показали менее 5% цитотоксичности (A). Номер всего клетки после периода выращивания оценивали после руководства, считая одной клетки с камерой Нойбауэр (B). N = 3 самостоятельно выполненных экспериментов были проанализированы. Планки погрешностей представляют собой стандартное отклонение. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Дизайн композитных конструкций позволяет простой регулировки свойств материала, например Юнга или толщины образцов. Юнга PDMS может быть эффективно изменено в широком диапазоне изменяя соотношение смешивания между двумя компонентами или производство смесей с использованием различных силиконовые эластомера30,31. Описаны методы не ограничиваются PDMS используется в текущем расследовании, но особенно клей производительность сильно зависит от конкретного типа используется. Важнейшим шагом в рамках этого протокола является процесс производства композитных фильмов (Рисунок 1). Было показано, что толщина пленки значительно влияет на поведение адгезии фильмов на разных субстратах, включая кожи (Рисунок 5 и Рисунок 6). В дополнение к толщины пленки время и температуру во время процесса сушки влияет на свойства материала32. Таким образом параметры, как толщина полимерных слоев должны быть тщательно адаптированы и проверены.
Был проведен анализ адгезивные свойства тонких пленок с нормальной силы сцепления измерения с использованием две стеклянные подложки с различными шероховатость поверхности до Ra = 0.338 мкм (рис. 3). В общем шероховатость влияет существенно сцепления поверхности, особенно эластичные материалы33,34. Неровности стекла может быть легко изменено методом шлифования наждачной бумагой неустроенность различных размеров, таким образом позволяя изготовления подложек, экспонируется более высокие значения шероховатости21. Кроме того, другие материалы, например эпоксидной смолы может использоваться для производства субстратов15,35. Это может быть важным модификации стратегией представленных протокола. Например если субстратов, экспонирование различные поверхности свободной энергии необходимы или конкретных топографии не требуется. Здесь pull-off стресс и работа разделения тонких пленок, изготовленные из PDMS и ССС были проанализированы с заказ установки (макроскопическая адгезии устройство измерения (MAD, рис. 4)). 36 оптических выравнивание субстрата и индентора является важным шагом для анализа результатов измерений. Таким образом регулировка угла наклона необходимо выполнить с гониометр, как можно точнее. Это достигается с достаточной точностью вручную чего субстрата контакт с поверхности пленки, вплоть до горизонтального контакта.
В протоколе текущее время был неизменным в одну секунду (Рисунок 5 и Рисунок 7). Особенно для расследования клей производительности эластичную пленку на поверхности грубые субстрата расширение время предоставляет дополнительные сведения. Например увеличение отрыва стресс с увеличением времени удержания был сообщил8. Помимо измерений, выполненных в текущем протоколе, другие методы, например пил тесты могут выполняться, позволяя более всестороннего расследования адгезии производительности37.
Адгезивные свойства композитных пленок экспонируется различные пленки, которую толщины мягкой кожи клей были определены (рис. 7). Наши результаты согласуются с опубликованных данных, показывают, что снижение пленки толщиной приводят к увеличению стресса отрыва родов, то есть, соотношение между субстрата диаметр и кино толщина, увеличение38,39 . На основе этих результатов и данных, изображенный на рисунке 7, мы заключаем, что композитные пленки с общей толщиной 100 мкм (толщина слоя SSA 60 мкм применяется для PDMS фильм с толщиной 40 мкм) exhibit благоприятные адгезии p ссылок на шероховатых поверхностях.
Далее были проведены эксперименты, связанные с биологической характеристике на нетронутой композитных пленок и плазмы рассматриваются составные фильмов (Рисунок 8). Плазменная обработка кремния эластомеров является часто прикладной, универсальная техника для увеличения гидрофильные свойства поверхности и поощрения сотовой привязанности и сотовых, распространяя40,41. Силиконы хорошо известны за их низкой токсичностью и высокой биостойкостью, но может содержать остаточных мономеров или катализаторов, которые могут повлиять на физиологические процессы, приводит также к цитотоксичность42,43. В проведенных экспериментов, которые мы наблюдали меньше, чем 5% цитотоксичность, с помощью выпуска ЛДГ как индикатор и пробирного исключения Трипановый синий. В представленных протокол, всей клеточной популяции, включая клеточных агрегатов отдельные формы, когда поверхность была проанализирована для анализа распространения (рис. 9B). Более дифференцированной результаты могут быть изменения протокола. Для каждого образца супернатанта, содержащий отдельный клеточных агрегатов может перенесены в отдельный реакции трубку и не сочетается с клетками ферментативно удалены с поверхности полимера. Это позволит точные оценки клеток на поверхности и в конечном итоге выявить более подробное определение влияния на процесс клеточной адгезии полимеров. Помимо иммуноцитохимическое методы, представленные здесь клетки может быть собрано для расследования с immunoblot методы, позволяющие подробные количественные оценки выражения протеина.
Таким образом мы создали условий производства для производства эластичных композитных пленок для применений в исследованиях культуры передовых клеток. Кроме того эти тонкие пленки обладают высокой приспособляемости кожи шероховатости, позволяя утонченный дизайн кожи клеев.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Мартин Danner признается за его помощь в подготовке проб и установление процедур культуры клеток. Авторы хотели бы поблагодарить Биестерфелд Spezialchemie GmbH (Гамбург, Германия), особенно Роберт Radsziwill для непрерывной поддержки и дискуссий. Исследований, приведших к эти результаты получил финансирование от Европейского Совета исследований под Европейского союза соглашение о Субсидировании КЧП седьмой рамочной программы (FP/2007-2013) н. 340929.
Материалы
| Name | Company | Catalog Number | Comments |
| 2-Propanol, 97% | Stockmeier Chemie | 1000452610000 | Isopropanol |
| Abrasive diamnod hand pad | Bohle | MO 5007522 | Grit: 220 |
| Accutase | Capricorn Scientific | ACC-1B | |
| Albumin Fraktion V | Roth | 0163.2 | BSA |
| Alexa Fluor 488 Phalloidin | ThermoFischer Scientific | A12379 | highly toxic |
| Aquamount | Polysciences | 18606-20 | water soluble mounting medium |
| CytoTox-ONE Homogeneous Membrane Integrity Assay | Promega | G7890 | |
| DPBS, without Ca2+, Mg2+ | ThermoFischer Scientific | 14190094 | |
| Fetal bovine serum gold | GE Health Care Life Science | A15-151 | FBS |
| Goniometer OCA35 | Dataphysics | for the determination of the static water contact angle | |
| Hoechst Dye 33342 | Sigma-Aldrich | B1155-100MG | bisBenzimide H 33342 trihydrochloride, highly toxic |
| Microscope Axiovert 25 | Zeiss | Microscope used for cell culture documentation | |
| Microscope Eclipse LV100ND | Nikon | Microscope used for film thickness determination | |
| Paraformaldehyde, aqueous solution 16% | Electron Microscopy Sciences | RT 15710 | electron microscopy grade |
| penicillin und streptomycin solution | Sigma-Aldrich | P4333-100ML | |
| Phenom XL Scanning Electron Microscope (SEM) | Phenom | ||
| Poly-(vinyl alcohol) 4-88, MW 31000 | Sigma-Aldrich | 81381-1KG | Mowiol 4-88 |
| Poly-dimethyl siloxanes, Sylgard 184 | Dow Corning | (400)000108351397 | PDMS |
| RPMI 1640 basal medium | ThermoFischer Scientific | 21875034 | |
| soft skin adhesive (SSA) | Dow Corning | (400)000108251792 | MG 7-9800 Soft Skin Adhesive (SSA) |
| speed mixer DAC 600.2 VAC-P | Hauschild | ||
| stylus profilomter | Zeiss | Model: SURFCOM 1500SD3 | |
| Tecan Infinite M200 pro | Tecan | fluorescence plate reader | |
| Triton X 100 | Calbiochem | 648466 | |
| Trypan Blue solution | Sigma-Aldrich | T8154-100ML | highly toxic |
| Trypsin/EDTA solution | PAN-Biotech | P10-023500 | 0.05% Trypsin, 0.02% EDTA in PBS |
| UV glue | Bohle | BO MV76002 | medium viscosity |
Ссылки
- Lloyd, A. W., Faragher, R. G. A., Denyer, S. P. Ocular biomaterials and implants. Biomaterials. 22, 769-785 (2001).
- Zhang, M., Wu, J., Wang, L., Xiao, K., Wen, W. A simple method for fabricating multi-layer PDMS structures for 3D microfluidic chips. Lab Chip. 10, 1199-1203 (2010).
- Kwak, M. K., Jeong, H. E., Suh, K. Y. Rational design and enhanced biocompatibility of a dry adhesive medical skin patch. Adv. Mater. 23, 3949-3953 (2011).
- Gun Park, D., Chul Shin, S., Won Kang, S., Tae Kim, Y. Development of flexible self adhesive patch for professional heat stress monitoring service. Conf. Proc. IEEE Eng. Med. Biol. Soc. 4, 3789-3792 (2005).
- Thomas, X. Silicone Adhesives in Healthcare Applications. Dow corning Lit. , (2013).
- Fuard, D., Tzvetkova-Chevolleau, T., Decossas, S., Tracqui, P., Schiavone, P. Optimization of poly-di-methyl-siloxane (PDMS) substrates for studying cellular adhesion and motility. Microelectron. Eng. 85, 1289-1293 (2008).
- Wang, Z., Volinsky, A. A., Gallant, N. D. Crosslinking effect on polydimethylsiloxane elastic modulus measured by custom-built compression instrument. J. Appl. Polym. Sci. 131, 41050 (2014).
- Fischer, S. C. L., Kruttwig, K., Bandmann, V., Hensel, R., Arzt, E. Adhesion and cellular compatibility of silicone-based skin adhesives. Macromol. Mater. Eng. , 1-11 (2017).
- Martina, D., Creton, C., Damman, P., Jeusette, M., Lindner, A. Adhesion of soft viscoelastic adhesives on periodic rough surfaces. Soft Matter. 8, 5350-5357 (2012).
- Brown, X. Q., Ookawa, K., Wong, J. Y. Evaluation of polydimethylsiloxane scaffolds with physiologically-relevant elastic moduli: Interplay of substrate mechanics and surface chemistry effects on vascular smooth muscle cell response. Biomaterials. 26, 3123-3129 (2005).
- Song, F., Ren, D. Stiffness of cross-linked poly(dimethylsiloxane) affects bacterial adhesion and antibiotic susceptibility of attached cells. Langmuir. 30, 10354-10362 (2014).
- Buxboim, A., Rajagopal, K., Brown, A. E. X., Discher, D. E. How deeply cells feel: methods for thin gels. J. Phys. Condens. Matter. 22, 194116 (2010).
- Discher, D. E., Janmey, P., Wang, Y. -. L. Tissue cells feel and respond to the stiffness of their substrate. Science. 310, 1139-1143 (2005).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix Elasticity Directs Stem Cell Lineage Specification. Cell. 126, 677-689 (2006).
- Roth, J., et al. Surface functionalization of silicone rubber for permanent adhesion improvement. Langmuir. 24, 12603-12611 (2008).
- Thiébaud, P., Lauer, L., Knoll, W., Offenhäusser, A. PDMS device for patterned application of microfluids to neuronal cells arranged by microcontact printing. Biosens. Bioelectron. 17, 87-93 (2002).
- Tourovskaia, A., Figueroa-Masot, X., Folch, A. Differentiation-on-a-chip: a microfluidic platform for long-term cell culture studies. Lab Chip. 5, 14-19 (2005).
- Peterson, S. L., McDonald, A., Gourley, P. L., Sasaki, D. Y. Poly(dimethylsiloxane) thin films as biocompatible coatings for microfluidic devices: Cell culture and flow studies with glial cells. J. Biomed. Mater. Res. - Part A. 72, 10-18 (2005).
- Wan, Y., et al. Nanotextured substrates with immobilized aptamers for cancer cell isolation and cytology. Cancer. 118, 1145-1154 (2012).
- Ross, A. M., Jiang, Z., Bastmeyer, M., Lahann, J. Physical aspects of cell culture substrates: Topography, roughness, and elasticity. Small. 8, 336-355 (2012).
- Barreau, V., et al. Fibrillar Elastomeric Micropatterns Create Tunable Adhesion Even to Rough Surfaces. Adv. Funct. Mater. 26, 4687-4694 (2016).
- Briggs, G. A. D., Briscoe, B. J. The effect of surface topography on the adhesion of elastic solids. J. Phys. D. Appl. Phys. 10, 2453-2466 (1977).
- Dapp, W. B., Lücke, A., Persson, B. N. J., Müser, M. H. Self-affine elastic contacts: Percolation and leakage. Phys. Rev. Lett. 108, 1-4 (2012).
- Putignano, C., Carbone, G., Dini, D. Mechanics of rough contacts in elastic and viscoelastic thin layers. Int. J. Solids Struct. 69, 507-517 (2015).
- Laulicht, B., Langer, R., Karp, J. M. Quick-release medical tape. Proc. Natl. Acad. Sci. 109, 18803-18808 (2012).
- Kim, T., Park, J., Sohn, J., Cho, D., Jeon, S. Bioinspired, Highly Stretchable, and Conductive Dry Adhesives Based on 1D-2D Hybrid Carbon Nanocomposites for All-in-One ECG Electrodes. ACS Nano. 10, 4770-4778 (2016).
- Adamietz, I. A., et al. Effect of self-adhesive, silicone-coated polyamide net dressing on irradiated human skin. Radiat. Oncol. Investig. 2, 277-282 (1994).
- White, R. Evidence for atraumatic soft silicone wound dressing use. Wounds UK. 1, 104-109 (2005).
- Quan, M. B., Edwards, C., Marks, R. Non-invasive in vivo techniques to differentiate photodamage and ageing in human skin. Acta Derm. Venereol. 77, 416-419 (1997).
- Brown, X. Q., Ookawa, K., Wong, J. Y. Evaluation of polydimethylsiloxane scaffolds with physiologically-relevant elastic moduli: Interplay of substrate mechanics and surface chemistry effects on vascular smooth muscle cell response. Biomaterials. 26, 3123-3129 (2005).
- Palchesko, R. N., Zhang, L., Sun, Y., Feinberg, A. W. Development of Polydimethylsiloxane Substrates with Tunable Elastic Modulus to Study Cell Mechanobiology in Muscle and Nerve. PLoS One. 7, e51499 (2012).
- Johnston, I. D., McCluskey, D. K., Tan, C. K. L., Tracey, M. C. Mechanical characterization of bulk Sylgard 184 for microfluidics and microengineering. J. Micromechanics Microengineering. 24, 35017 (2014).
- Persson, B. N. J., Gorb, S. The effect of surface roughness on the adhesion of elastic plates with application to biological systems. J. Chem. Phys. 119, 11437 (2003).
- Peressadko, A. G., Hosoda, N., Persson, B. N. J. Influence of surface roughness on adhesion between elastic bodies. Phys. Rev. Lett. 95, 1-4 (2005).
- Purtov, J., et al. Measuring of the hardly measurable: adhesion properties of anti-adhesive surfaces. Appl Phys A. 111, 183-189 (2013).
- Kroner, E., Blau, J., Arzt, E. Note: An adhesion measurement setup for bioinspired fibrillar surfaces using flat probes. Rev. Sci. Instrum. 83, 16101 (2012).
- Sun, S., Li, M., Liu, A. A review on mechanical properties of pressure sensitive adhesives. Int. J. Adhes. Adhes. 41, 98-106 (2013).
- Webber, R. E., Shull, K. R., Roos, A., Creton, C. Effects of geometric confinement on the adhesive debonding of soft elastic solids. Phys. Rev. E. 68, 21805 (2003).
- Creton, C., Lakrout, H. Micromechanics of flat-probe adhesion tests of soft viscoelastic polymer films. J. Polym. Sci. Part B Polym. Phys. 38, 965-979 (2000).
- Tan, S. H., Nguyen, N. -. T., Chua, Y. C., Kang, T. G. Oxygen plasma treatment for reducing hydrophobicity of a sealed polydimethylsiloxane microchannel. Biomicrofluidics. 4, 32204 (2010).
- Kim, B., Peterson, E. T. K., Papautsky, I. Long-term stability of plasma oxidized PDMS surfaces. Conf. Proc. IEEE Eng. Med. Biol. Soc. 7, 5013-5016 (2004).
- Briganti, E., et al. Silicone based polyurethane materials: A promising biocompatible elastomeric formulation for cardiovascular applications. J. Mater. Sci. Mater. Med. 17, 259-266 (2006).
- Regehr, K. J., et al. Biological implications of polydimethylsiloxane-based microfluidic cell culture. Lab Chip. 9, 2132 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены