Method Article
腸幹細胞の隔離とブタモデル分節小さな腸管虚血の文化
要約
このプロトコルには、正常に腸内阻の豚のモデルを確立、その後分離し、損傷上皮修復の研究のための腸幹細胞の培養に読者が有効になります。
要約
腸管虚血の罹患率と人間および獣医の患者の死亡率の主要な原因のまま。腸への血液供給、そのため酸素が減少、多くの病気プロセスは腸管虚血の結果します。これは腸の壁損失および根本的なティッシュへの損傷につながる。小腸幹細胞 Lieberkühn の陰窩の基部に存在する、恒常性と次の傷害の間に腸内のリニューアルを担当。細胞培養の技術前のヴィヴォは三次元上皮器官のようなシステムの成長を支える培養条件を確立することによって上皮幹細胞の相互作用の研究のため許可されている ("enteroids"と呼ばれる"colonoids「小規模および大規模な腸からそれぞれ).これらの enteroids はクリプトと絨毛のようなドメインの構成とすべての上皮内で見つかった細胞の種類を格納する成熟しました。歴史的に、マウスモデルは腸管を研究に利用されています。しかし、ブタのモデルは、サイズと同様に消化管の解剖学と人間の生理学の類似性を含むいくつかの利点を提供しています。ブタのモデルを活用し、我々 は、分節ループ腸管虚血の単一動物の内で作成することができます、異なる研究時間虚血性損傷のポイントおよびin vivoを修復プロトコルを確立します。また、述べるを分離し、腸管の虚血性のループから腸幹細胞の培養上皮修復、幹細胞によって変調に関する継続的な研究を可能にする前のヴィヴォ。
概要
腸管の虚血性損傷、削減や腸への血流の完全閉塞による酸素濃度の低下の可用性の結果人間と動物の患者1,2死亡率と罹患率の重要な原因のまま。虚血性損傷、その後炎症と細胞浸潤は粘膜バリア妥協に します。粘膜のバリアは、全身循環3,4にバクテリアル トランス ロケーションと関連付けられた毒素の予防に重要です。虚血性の組織の後の再灌流は、損傷損傷5を悪化させ、活性酸素種の形成で起因できます。腸管虚血はほとんど予防できるため、ほとんどの現在の研究は早期虚血と再灌流傷害またはターゲットの粘膜修復を低減する新規治療法の開発のための技術の進展にきました。
動物モデルは、虚血再灌流障害の基本的な科学知識を展開し、トランスレーショナルリサーチの命令のままに広く使用されています。齧歯動物モデルは能力を遺伝子操作6をすることのための最も広く使用されています。ただし、最近では人間7、8に豚の解剖学的および生理学的類似点を含む利点の数が多いため将来の橋渡し研究の大動物モデル、特に豚の使用が提唱されています。さまざまな傷害モデルは虚血再灌流障害を研究し、完全な血管閉塞、低流量虚血腸間膜血管閉塞などが開発されています。これらのモデルの完全なレビューは、著者らが最近レビュー3に読者を誘導するただしこの記事の領域外です。
体内モデルに加えて細胞培養システム前のヴィヴォの使用は、腸管の恒常性と損傷修復を検討する有望なツールを提供しています。小腸幹細胞は、細胞の増殖と腸の上皮粘膜の売り上げ高。通常または傷つけられた腸から分離された腸幹細胞は文化で維持できるし、ツールまたは幹細胞と上皮細胞生物学を研究するためのモデルとして役立ちます。メソッドを特定し、これらの三次元培養システム (enteroids と colonoids それぞれ大・小腸から派生する場合と呼ばれる) さまざまな種および器官システム9,10 の記載されています。 ,11,12,13。具体的には、消化管の内でこれら文化システムはモデル消化器疾患がん、病原体感染症や炎症性腸疾患14などに使用されています。この時、分離および任意の種 ischemically 負傷した小腸から腸幹細胞の維持を記述するレポートはございません。したがって、ここで述べる小説、大動物モデルの再現可能な傷害との追加研究のため通常と ischemically 負傷者の腸から腸幹細胞を分離する能力に起因する腸管虚血のプロセス回復前のヴィヴォ。
プロトコル
これらの実験すべての動物の研究は、制度的動物ケアおよび使用委員会 (IACUC) ノースカロライナ州立大学のによって承認されました。
1. 文化のための準備
注: すべての試薬は、材料表に表示されます。特定の成長因子の濃度は表 1に示します。
- 脱イオン蒸留水 (ddH2O) で 0.5 M エチレンジアミン四 edta 溶液を準備します。十分に混合し、水酸化ナトリウムや塩酸のソリューションを使用して 7.4 に pH を調整します。
注: は各実験の前に新鮮な EDTA 原液を作る。 - 次のように解離試薬 #1 (DR #1) を準備し、氷の場所: 結合リン酸緩衝生理食塩水 Ca2 +と Mg2 + (PBS) 0.5 M EDTA, 1 M 1, 4 ジチオトレイトール (DTT)、10 μ M なし Y27632 と 1 X 抗生物質抗真菌ソリューション (対策)ペニシリン、ストレプトマイシンおよびアムホテリシン b を含む
注: は、直前の組織コレクション Y27632 を追加します。 - 解離試薬 #2 (DR #2) を次のように準備し、37 ° C の水浴中に配置: なし Ca2 +と Mg2 +、0.5 M の EDTA、10 μ M を組み合わせて PBS Y27632 と 1 X 対策。注: は、直前の組織コレクション Y27632 を追加します。
- 次のように腸管上皮幹細胞 (IESC) メディアの準備: ミックス 25 mL 詳細 1 X N2 サプリメント DMEM/F12 媒体、1 X B-27 補足、10 mM HEPES、2 mM Glutamax と 1 X 対策。使用するまで 4 ° C で保存します。
- 次のように削減成長因子基底膜マトリックス (行列) および補足の成長因子のマスター ミックスを調製: 氷の行列を解凍。微量遠心チューブに 100 ng/mL を追加組換えの人間の頭、500 ng/mL 組換えひと R Spondin 1、50 ng/mL 組換えひと上皮成長因子 (EGF)、100 ng/mL 組換え人間 Wnt3a、10 mM ニコチンアミド、10 nM ガストリン 500 nM A-83-01、10 μ M Y-27632、10 mM SB202190、500 nM LY2157299、2.5 μ M グリコーゲンのシンターゼのキナーゼ 3 の阻害剤 (GSK3i、CHIR99021)。マトリックスを解凍すると、(マスター ミックスを作る) 成長因子の組み合わせで補完、氷の上を格納します。
注: これはめっき中に行列パティ内のアイテムを作成する空気の泡を防止するように気をつけてください。 - 中古セル分離手順を開始する前に 37 ° C のインキュベーターで 24 ウェル培養皿を温めます。
2. 手術モデルの虚血およびティッシュのコレクション
- 使用 8 10 週齢ヨークシャーを交配 (推奨) いずれかのセックスの豚。手術前にすべてのフィードの 16-18 h を削除します。豚のすべての回で水へのアクセスを許可します。
- スケジュール到着する豚実験環境順化を許可する前に、少なくとも 48 時間。
注: 認可された獣医監修獣医および/または実験室の訓練を受けた技術者は、ルーチンの動物のケアと麻酔と援助を提供します。 - キシラジンと豚の premedicate (1.5 mg/kg 筋肉内 (IM)) とケタミン (11-20 mg/kg (IM))15。一度落ち着いた、豚 orotracheally を挿管します。
- イソフルラン (2-5%) 安楽死の時間まで 100% O2の気化と全身麻酔下のブタを維持します。
- 静脈内 (IV) カテーテル (耳静脈推奨) を置き、置換液 15 mL/kg の整備率で一日リンガーズ ソリューションなどを管理/h。
- パルス酸素濃度計、心電図検査と血圧測定15を含む監視麻酔ルーチンを実行します。豚の呼吸数と労力を監視し、手動でまたは機械的に終わり潮 CO2が 55 〜 60 mmHg を超える場合、必要に応じて換気します。
注: 適切な麻酔心拍数 (範囲 80-130 拍/分)、非観血的血圧 (平均動脈圧 75-100 mmHg) と呼吸 (10-25 呼吸/分)16、および定期点検の傾向の継続的なモニタリングにより確認しています。顎とアナルの調子の不在。麻酔深度は次の手術刺激筋脱力と筋弛緩の程度によっても判断できます。眼反射がない値16通常です。監督機関 IACUC ポリシーとして、鎮痛を提供ことができます。この場合、手術中に、オピオイド、ブプレノルフィンなどを管理できます。 - 加熱パッドの豚を置き、外科処置で背の臥床で抑制します。
- 手術時手洗い法 (クロルヘキシジン溶液) とイソプロピル アルコールを使用しての準備し、腹側腹部を剃る。
- 臍を中心としたメスの刃を使用して腹部にアクセス 8-10 cm の腹側正中切開を行います。
- 回盲部に小腸 (空腸) 約 40 cm 口腔を識別します。円周 2 回腸を縛ることによって腸の 10 cm 長いループを描く、その後作成する前に、それぞれの合字の間 1 cm ループ 10 cm 口頭である (図 1)。
- 虚血の時間ポイントごと 2 つのループに隣接しお互い、虚と虚血再灌流の追加 1 h 必要に応じて作成します。完全虚血 (動脈や静脈の流れはありません) を作成するためクランプまたは 1、2、3、および 4 h のブルドッグ血管クランプ、曲線のハルステッド モスキート鉗子または 2-0 非吸収性絹糸を使用して腸間膜血管を結紮し、クランプの 1 時間を削除再灌流、希望する場合。
注: 著者は 4 h 虚血性ループ順に虚血のすべてのループを作成し、近位 (総手術時間の短縮) に移動が進みます。隣接する虚血性腸管が隣接するループを損傷することの可能性に対処するため虚血性ループの順序を変えることができます。これは手術時間の合計を変更可能性があります。
注: 再灌流の時間枠は、興味や灌流中にテストする場合の治療法の研究の質問に基づいて様々 なことがされます。ただし、組織の損傷はより深刻な虚血だけの期間を増やすことからになると、再灌流障害の可能性はさらに上皮損傷に寄与しません。再灌流は次の虚血性損傷の穏やかな期間役割を果たす可能性が高い。 - 虚血時間ポイントの間にカバーを閉じたり、滅菌タオルやタオルのクランプを使用して腹部を維持します。
注: この実験のための単一動物、内 8 虚血性セグメントを作成できます。追加腸、少なくとも 5 ~ 10 cm 内部の通常のコントロールとして機能する最後の虚血性ループの近位を識別します。 - ブルドッグ血管クランプまたは曲線ハルステッド モスキート止血あたり約 3 つの腸間膜血管を妨げます。血管は、簡単に傷を負ったために、止血の適用時に注意する必要があります。クランプの顎の中の血管をスタックしてみてください。
- 実験では, ペントバルビ タール 85 100 mg/kg iv 次安楽死の終わりに聴診ハートビート角膜反射の消失と死を確認後 metzenbaum はさみを使用して組織のすべてのループを収集します。最後の虚血性ループの近位空腸通常少なくとも 5-10 cm の制御部分を集めることによって開始します。
- 分離し、地下室の分離のための準備ができるまで氷冷 PBS の小さな容器で傷害の時間の各ポイントからループを保存します。
注: 必要な場合する虚血性ループ長く組織や腸管幹細胞文化の別のサンプルに分割するにはしかし、著者は、ループ長さ約 10 cm より大きいの最も多い出血性になることを発見しました。
3. クリプト (幹細胞) 虚血性から分離、制御ループ
- 20 ゲージのワイヤと組織鉗子を使用して粘膜面を公開する小腸の各ループを反転します。縫合 (2-0 非吸収性の絹または同等) を使用してワイヤーにしっかりとループの上下を結ぶ。
- 次の反転、内腔のがれき撤去を氷冷 PBS の各ループをすすいでください。
- すぐに DR #1 30 分間氷の上を含む 50 mL の円錐管にサンプルを配置します。
- ループ制御で始まるを収集し、次の段階的虚血の期間に増加のループを持つ。以下の損傷した組織 (すなわち制御と 1 h 虚血組織) からのループは最良の結果のための手首のスナップ強制的、動揺することができます。深刻な損傷した組織 (虚血の 3 と 4 h) から組織が優しく揺れるまたはクリプト混乱と追加の組織破壊原因となりますあまりにも多くの振動だけを反転します。チューブは、動揺や氷中に 5 分ごとを反転する必要があります。
- 37 ° C の水浴中に 10 分間 DR #2 にサンプルを転送します。振るか 5 分ごとのチューブを反転します。
- 組織を転送した後、上清中の EDTA を削除する破損している 2-4 h ループから DR #1 を含む円錐管 (5 分 200 g x) を遠心します。これらの組織が非常に破損している、陰窩が解離になってすでに不可能です。上清を除去し、PBS (5 mL) の体積が小さく、ペレットを再懸濁します 3.9 の手順に進みます。
- DR #2 からサンプルを取り出し、25 mL の氷 (洗浄 #1 としてラベル) の冷 PBS に直接組織サンプルを置きます。60 rpm で氷の上の軌道のシェーカーにサンプルを配置します。振ったり、30 の各チューブを反転し続ける s すべての 2 〜 5 分。
- 2-4 h から DR #2 を含む円錐管組織、スピンを転送した後は、EDTA の上澄み (5 分 200 g x) を削除するためにループを破損しています。これらの組織が非常に破損している陰窩が解離になることが可能です。上清を除去し、PBS (5 mL) の体積が小さく、ペレットを再懸濁します 3.9 の手順に進みます。
- 洗浄 #1 (または DR から) 50 μ 因数を削除のクリプト解離度と残骸の量を確認します。新しい 50 mL の円錐管に組織を配置 (洗浄 #2、#3 など) そのまま陰窩が最小限の破片と絨毛分離まで寒さの PBS と手ふれの 25 mL でいっぱい。
注: 目標は、そのまま陰窩と最小限の破片のごく一部をきれいに分離することができることです。各追加の洗浄、セルの二次組織/細胞の損傷が発生する開始、しかしあまりにも多くの震動をクリーンアップします。さらに、陰窩はメッキパーツと解離試薬ステップではなく洗浄ステップから場合、少なくとも汚染で最良の結果が達成されます。 - 残りの組織を除去し、上清を除去する 5 分間 200 x g で 50 mL の円錐管を遠心、PBS (5 mL) の小さいボリュームに残っているクリプト ペレットを再懸濁します。
- 倒立顕微鏡を使用して陰窩/分数の数を決定する各サンプルの 50 μ 因数を調べます。目標は、される最終的な行列パティのサイズですが、50-100 陰窩/50 μ L です。
注: サンプルがあまりにも集中して場合、は、必要な濃度に達するまで冷 PBS を追加していきます。サンプルがあまりにも希薄になる場合、必要なクリプト収量に達するし、調整に必要な因数の数を決定します。 - 陰窩 (分注の観察によって決まります) 微量遠心チューブに分注の適切なボリューム。たとえば、サンプルには、50 の地下室/50 μ L、パティ X 3 複製あたり 50 μ L 分注が含まれている場合 = 150 μ L/遠心チューブします。サンプルにはのみ 25 陰窩/50 μ L、必要に応じて 2 の因数が含まれます/パティ X 3 複製 300 μ L/チューブを = します。
- 4 ° C で 5 分間 200 x g でペレット陰窩
- 優しく適切な量 (50 μ L/ウェル) のマスターの組合せで小球形にされた地下聖堂を再懸濁します。急速に空気の泡を作成しなくても 15 回をピペッティングにより徹底的にミックスします。
注: は、あらかじめマスター ミックスを吸引する前に冷滅菌 PBS のピペット チップを冷たい。これは広がるからマスター ミックスを保つを助けます。ヒントは、冷蔵庫に保管しを使用する前にすぐにボンネット内に配置できます。 - 予め温めておいた 24 well プレートの各ウェルの中心に 50 μ L マスター ミックス プラス クリプト液滴を調剤します。
- 37 ° C で 30 分間培養プレートを孵化させなさい
- 500 μ L/IESC メディア (追加の成長要因のマスターの組合せの内で含まれている、0 日目に必要) の各マトリックス パテをオーバーレイします。
- 任意の未使用井戸左側に湿度を維持するためにプレートに 500 μ L 滅菌 PBS を追加します。
- 0 日目にメッキの陰窩の数をカウントします。
注: それぞれの細胞培養プレートのより正確なカウントを確保するために分割前のグリッドに便利です。 - Enterospheres すべての 24 h の数をカウントし、enteroid 開発毎日監視します。
- 各すべての 48 h に成長因子 IESC メディアすべて 96 h の削除し、500 μ L 新鮮なメディア (成長因子はメディアに追加する必要があります) に置き換えて追加します。
結果
完全な腸管虚血は、縫合またはクランプ図 1に示すように、血管の閉塞を利用して小さい腸のループで作成されました。クランプをリリースすることによって、必要な場合その後再灌流障害の追加研究のため許可、再灌流の制御された期間を実行できます。すべての動物は、安楽死まで最小限の合併症の中に生き残った。最も一般的な手術の合併症は、低血圧、ドブタミンなどの肯定的な心不全の補充で解決でした。
正しく実行すると、虚血性損傷は腸絨毛の先端で開始し、虚血の増加 (図 2) の期間として地下室内を移行します。手術の手技で 1 つよくある間違いは、血管の結紮または均等に固定されていない場合に発生します。結果は出血性虚血 (図 3)、薄肉静脈は動脈の組織に潜入する追加の血液を可能にする前に崩壊です。これは暗い紫漿膜面として (図 3、左) 完全虚血 (図 3右) の中に淡い表面と比較して著しく見られます。
次の虚血性腸ループの除去は、腸陰窩を次の解離プロトコル (図 4) 分離しました。予想通り、もっとひどく傷つけられた縦長から陰窩が壊れていた頻繁 (f; フラグメント) クリプト分数含まれる背景のより多くの細胞残骸なしを受けたそれらと比較されたとき、または軽度の損傷。プロトコルの中に重傷を負った腸を基になる組織に追加のダメージを避けるために軽く動揺する必要があります。さらにクリプト損傷と追加の途切れない EDTA を含む災害復旧ソリューションで終わる陰窩の大半で起因できる余りに大体揺れ。
メッキ、一度虚血のすべての時間の点から陰窩は存続し、(図 5) の文化で定着することができます。文化の通常、軽度破損腸陰窩をメッキするとき、24-48 時間以内の enterospheres フォーム。重度の虚血性損傷 (3 〜 4 h)、腸陰窩生き残るが、最初小さく球の形成に終って、破損しています。72 120 h enteroids は明白な中央ルーメンと新進構造より複雑になります。全体的にみて、陰窩の減らされた成長効率だけでなく、重度の損傷した腸管組織 (ゴンザレス、L.M.、未発表データ、2017) から派生した enteroids の大きさを減少があります。
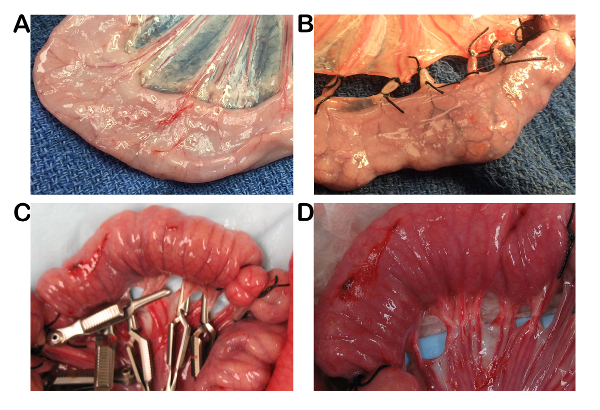
図 1: ブタモデルにおける完全腸管虚血の外科モデル。A) 通常豚腸が体外します。B) 腸間膜血管は、腸管虚血を作成する縫合糸で結紮されています。C) 必要な場合は組織再灌流、ブルドッグ血管クランプを使って作成した虚血。D) 腸血管血管クランプの除去の直後します。この図の拡大版を表示するのにはここをクリックしてください。
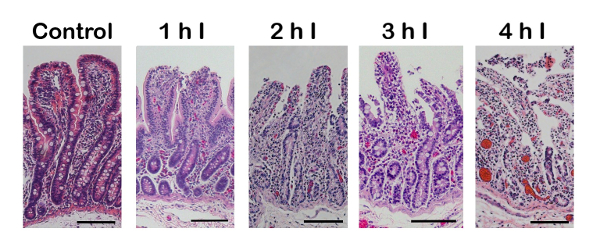
図 2: 上皮損傷完全腸管虚血の期間が長く、次の増加の組織学的証拠 (ヘマトキシリンとエオシン (H & E) 染色).被害は、単一の細胞上皮層、絨毛の鈍化、細胞損傷の重傷 (最大 4 時間) を基本のクリプトにまで拡張の漸進的な損失で絨毛の先端から始まります。100 μ m スケール バー。私 = 虚血。この図の拡大版を表示するのにはここをクリックしてください。
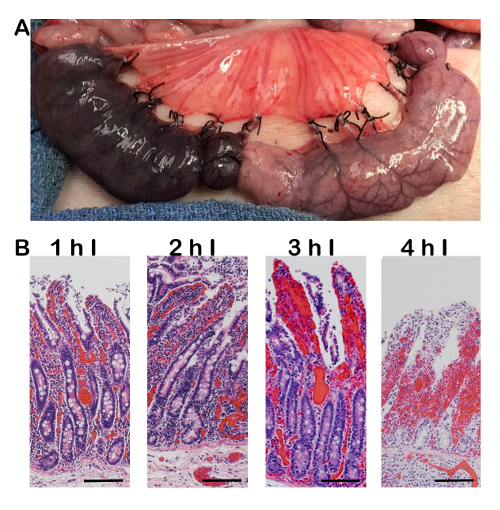
図 3: 出血性虚血の総, 組織学的証拠。A) 総写真出血性虚血 (左ループ) と完全な虚血 (右のループ) を比較します。血管が結紮、均等にクランプ、血は追加の炎症や損傷の結果、組織に潜入する続行できます。1-4 h からの期間の延長の出血性虚血の B) H & E の画像。完全虚血で見られる細胞損傷、に加えて周囲の粘膜内で赤血球細胞浸潤の証拠があります。100 μ m スケール バー。私 = 虚血。この図の拡大版を表示するのにはここをクリックしてください。
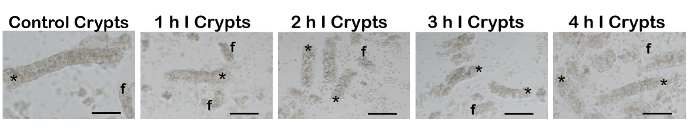
図 4: 虚血性と通常の腸管から分離された腸陰窩の因数。完了すると、そのまま腸陰窩 (アスタリスク) を腸のループから分離しました。予想通り、もっとひどく傷つけられた時点から陰窩が壊れていた頻繁 (f; フラグメント) クリプト分数含まれる背景のより多くの細胞残骸なしを受けたそれらと比較されたとき、または軽度の損傷。100 μ m スケール バー。私 = 虚血。この図の拡大版を表示するのにはここをクリックしてください。

図 5: 小腸虚血性ループからの分離に続く腸管幹細胞成長の時間コース。通常腸陰窩は、文化でメッキされた、24-48 時間以内 enterospheres が形成されます。重度の虚血性損傷 (3 〜 4 h)、陰窩生き残るが、はるかに小さい球を最初に形成します。72 120 h enteroids は明白な中央ルーメンと新進構造より複雑になります。20 μ m スケール バーの断りのない限り。この図の拡大版を表示するのにはここをクリックしてください。
| 成長因子 | 希釈剤 | ストック濃度 | 株式の希薄化 | 希釈作業 |
| R Spondin | PBS | 100 X | 100 μ g/ml | 1 μ g/ml |
| 酒を飲むこと | SW/0.1%BSA | 1000 X | 100 μ g/ml | 100 ng/ml |
| EGF | 10 mM 酢酸 | 10,000 X | 500 μ g/ml | 50 ng/ml |
| A-83-01 | DMSO | 1000 X | 500 Μ M | 500 nM |
| SB202190 | DMSO | 3000 X | 30 mM | 10 Μ M |
| ニコチン酸アミド | SW | 1000 X | 1 M | 1 mM |
| ガストリン | PBS | 10,000 X | 100 Μ M | 10 nM |
| Y-27632 | PBS | 1000 X | 10 mM | 10 Μ M |
| LY2157299 | DMSO | 10,000 X | 5 mM | 0.5 Μ M |
| CHIR99021 | PBS | 1000 X | 2.5 mM | 2.5 Μ M |
| Wnt3a | PBS | 2000 X | 200 μ g/ml | 100 ng/ml |
表 1: 成長因子試薬テーブル。成長因子原液とこのプロトコルで使われる作業ソリューションの概要です。
ディスカッション
分節の腸管虚血の豚のモデルの開発は同じ動物の内で組織の損傷の複数の時点の研究により以前のマウス モデルを拡張します。このプロトコルの適切な血管結紮術、組織再灌流成功したクリプト細胞培養などのいくつかの重要な論点があります。
適切な血管結紮術は、完全虚血のモデルの作成に不可欠です。縫合糸を均等に縛らまたはクランプない完全からの血を強化した場合肉厚動脈組織を入力し続けるかもしれないし、薄肉静脈の崩壊のため終了できません。その他の組織の損傷を引き起こしている粘膜に血液の血管外漏出でこの結果します。しかし、検討している虚血性損傷の種類に応じて完全なまたは出血性虚血を必要があります。たとえば、小腸移植の過程で、腸は完全に完全な腸管虚血につながるプロシージャの段階で切除血管 (動脈、静脈) から区切られます。また、ただし、腸軸捻転などのイベント中に腸間膜をねじったり、静脈還流はしばしば妨げられる最初、妨げられる、従って作成する動脈供給される前に組織内で追加の血液につながる出血性虚血。
虚血傷害の結果は絨毛の先端から始まる地下3の基盤にまで拡張し、組織の損傷。虚では、アデノシン三リン酸の形でエネルギーが使用され続けているし、代謝産物ヒポキサンチンを生成します。組織は骨格の酸素と、ヒポキサンチン キサンチン酸化酵素によって代謝されるとなるし、粘膜傷害と好中球17,18の損傷組織の魅力につながる活性酸素フリーラジカルを生成します。キサンチン酸化酵素の様々 な表現と同様、粘膜の血管構築の種の違いにより再灌流傷害3の度合い。虚血再灌流の猫、齧歯動物モデルが活性酸素代謝物19,20から再灌流障害が発生しやすい。対照的に、豚が少ないキサンチンオキシダーゼしたがって少ない再灌流障害より人間の腸管虚血21に匹敵するこのモデルを作るが見つかりました。この時、ノックアウトまたは腸管損傷を研究するトランスジェニック モデルの使用記載されていない、これはこのモデルの主要な制限を作るします。適切な動物モデルの選択は病気プロセスに依存または特定条件研究者は研究に望みます。たとえば、6 h まで虚血性損傷のモデルは、マウスモデルで最も虚血性のプロシージャは 45-60 分の23に対し説明22をされています。
ノーマルと ischemically ダメージの腸から腸陰窩の分離を成功させる文化の上皮の回復に関することができます。このシステムにより、上皮だけでない血管供給または考慮する免疫細胞のコンポーネントがある、一意に焦点を当てる研究員です。これは上皮細胞の相互作用と異なる成長因子、または培養液を継ぎ足すことによって手術または次のクリプト分離中に投与治療への応答の他の損傷の回復を検討する機会を提供しています。この手順の最も困難なまま、ひどく傷つけられたループからの隔離を必要と穏やかな揺れと EDTA を含むソリューションの迅速な除去陰窩が持っている場合になる途中で解離。腸のこれらのループが徹底的に洗浄されていない、陰窩でが文化に汚染されてしまう可能性があります。その結果、抗生物質抗真菌薬ソリューションは、IESC メディアに加えて両方の DR ソリューションに追加されました。別の論点は通常のコントロールとして収集腸に焦点を当てください。動物は可能な二次虚血、炎症性メディエーターを循環の可能性と一緒に、全身組織灌流をもつ麻酔を受けるも「普通の」コントロール組織は真のコントロールを表さない場合があります。これらの実験の制御組織登場肉眼的および病理組織学的に匹敵する組織虚血 (ゴンザレス、L.M.、未発表データ、2017) 他の実験を受けていない動物から注意です。
要約すると、このメソッドは、密接に人間の虚血性損傷での動作をモデル化するブタ腸管虚血の再現モデルをについて説明します。さらに、虚血性ループから腸幹細胞の隔離を記述、上皮修復と文化での治療可能な応答を研究するのに役立ちます。
開示事項
著者が明らかに何もありません。
謝辞
このプロジェクトは、NIH の K01OD0199、NIH T32 OD011130、NIH の P30DK034987、臨床科学部普及資金に支えられ
資料
| Name | Company | Catalog Number | Comments |
| Phosphate Buffered Saline, Ca2+, Mg 2+ free | Fisher Scientific | BP-399 | Dilute 1:10 |
| Distilled, deionized water (ddH2O) | Used to prepare EDTA and PBS | ||
| Dimethyl Sulfoxide (DMSO) | Thermo Scientific | 20688 | |
| Ethylenediamene tetraacetic acid (EDTA) | Sigma Aldrich | ED45 | Make fresh before each experiment; pH 7.4 |
| 1,4-Dithiothreitol (DTT) | Sigma Aldrich | 646563 | |
| Y-27632 | Sigma Aldrich | Y0503 | |
| Advanced DMEM/F12 | Life Technologies | 12634-010 | |
| N2 Supplement | Life Technologies | 17502-048 | |
| B-27 Supplement | Life Technologies | 12587-010 | |
| HEPES | Life Technologies | 15630-106 | |
| Glutamax | Life Technologies | 35050-061 | |
| Penicillin/Streptomycin/Amphotericin B | Gibco | 15240-096 | Anti-Anti solution |
| Recombinant human Wnt-3a | R & D Systems | 5036 WN/CF | |
| Recombinant human Rspondin1 | R & D Systems | 4645- RS | |
| Recombinant human Noggin | R & D Systems | 6057-NG | |
| Recombinant human EGF | R & D Systems | 236-EG | |
| LY2157299 | SelleckChem | 52230 | |
| CHIR99021 | Cayman Chemical | 13122 | |
| Human [leu]15-Gastrin 1 | Sigma Aldrich | G9145 | |
| SB202190 | Sigma Aldrich | 57067 | |
| A83-01 | Tocris | 2939 | |
| Nicotinamide | Sigma Aldrich | N0636 | |
| Acetic Acid | Sigma Aldrich | 695092 | |
| Water, WFI Quality | Corning, Inc. | 25-055-CM | Referred to as sterile water (SW); for growth factor stocks |
| Bovine Serum Albumin (BSA) | Sigma Aldrich | A2153 | |
| Matrigel Matrix, GFR | Corning, Inc. | 356231 | Phenol red free |
| 24 Well Culture Dish | Corning, Inc. | 3524 | |
| Conical Tube, 50 ml | Corning, Inc. | 430828 | |
| Scalpel Handle | World Precision Instruments | 500236 | |
| Carbon Steel Surgical Blade, No. 10 | World Precision Instruments | 504169 | |
| Tissue Forceps | World Precision Instruments | 15918 | |
| Debakey Tissue Forceps | World Precision Instruments | 501239 | |
| Mayo Scissors | World Precision Instruments | 501752 | Curved or straight |
| Metzenbaum Scissors | World Precision Instruments | 501739 | |
| Mosquito Forceps, Curved | World Precision Instruments | 503724-12 | Curved or straight (503728-12) |
| Hopkins Bulldog Clamp | Stoelting Co. | 52120-40P | Straight |
| Silk, 2-0 | Henry Schein | 685S-BUT | Any similar brand is acceptable |
| Towel Clamps | World Precision Instruments | 501700 | |
| Needle Holder | World Precision Instruments | V503382 | |
| Wire suture, 20 gauge | Henry Schein | 19075 | Cut and straighten before use. |
| Surgical Towels | Henry Schein | ST1833 | Any similar product is acceptable. |
| Lactated Ringers Solution | Henry Schein | 9851 | |
| Chlorhex antiseptic scrub (4%) | Henry Schein | VINV-CHMX-SCRB | Any similar brand is acceptable |
| Isopropyl Alcohol 70% | Henry Schein | MS071HS | Any similar brand is acceptable |
| IV catheter, 22 gauge | Henry Schein | 2225PUR | May need 20g or 24 g depending on size of the vein |
| Xylazine (100 mg/ml) | Henry Schein | 33198 | |
| Ketamine (100 mg/ml) | Henry Schein | 11695-6835-1 | Controlled medication |
| Isoflurane solution | Henry Schein | 10015516 | |
| Pentobarbital (Fatal Plus Euthanasia Solution (390 mg/ml)) | Vortech Pharm. | Multiple brands of Pentobarbital Sodium available. | |
| Heating pad | Gaymar | Tpump Core Warming System; others are available. | |
| Mindray Datascope Monitor | Mindray North America | Any equivalent piece of monitoring equipment acceptable | |
| Vaporizer | Vetland Medical | Recommended to use a Circle System w/ Y piece; multiple suppliers available. | |
| Fluid Pump | Abbott Hospira | Plum A+; Any similar manufacturer is recommended. |
参考文献
- Eltzschig, H. K., Eckle, T. Ischemia and reperfusion--from mechanism to translation. Nat Med. 17 (11), 1391-1401 (2011).
- Blikslager, A. T. Treatment of gastrointestinal ischemic injury. Vet Clin North Am Equine Pract. 19 (3), 715-727 (2003).
- Gonzalez, L. M., Moeser, A. J., Blikslager, A. T. Animal models of ischemia-reperfusion-induced intestinal injury: progress and promise for translational research. Am J Physiol Gastrointest Liver Physiol. 308 (2), 63-75 (2015).
- Podolsky, D. K. Mucosal immunity and inflammation. V. Innate mechanisms of mucosal defense and repair: the best offense is a good defense. Am J Physiol. 277 (3), 495-499 (1999).
- Collard, C. D., Gelman, S. Pathophysiology, clinical manifestations, and prevention of ischemia-reperfusion injury. Anesthesiology. 94 (6), 1133-1138 (2001).
- Mallick, I. H., Yang, W., Winslet, M. C., Seifalian, A. M. Ischemia-reperfusion injury of the intestine and protective strategies against injury. Dig Dis Sci. 49 (9), 1359-1377 (2004).
- Gonzalez, L. M., Moeser, A. J., Blikslager, A. T. Porcine models of digestive disease: the future of large animal translational research. Transl Res. 166 (1), 12-27 (2015).
- Ziegler, A., Gonzalez, L. M., Blikslager, A. T. Large animal models: The key to translational discovery in digestive disease research. Cell Mol Gastroenterol Hepatol. 2 (6), 716-724 (2016).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Meneses, A. M. C., et al. Intestinal organoids-Current and future applications. Veterinary Sciences. 3 (4), 31 (2016).
- Clevers, H. Modeling development and disease with organoids. Cell. 165 (7), 1586-1597 (2016).
- Mahe, M. M., Sundaram, N., Watson, C. L., Shroyer, N. F., Helmrath, M. A. Establishment of human epithelial enteroids and colonoids from whole tissue and biopsy. J Vis Exp. (97), (2015).
- Dedhia, P. H., Bertaux-Skeirik, N., Zavros, Y., Spence, J. R. Organoid models of human gastrointestinal development and disease. Gastroenterology. 150 (5), 1098-1112 (2016).
- Swindle, M. M., Smith, A. C. . Swine in the Laboratory: Surgery, Anesthesia, Imaging & Experimental Techniques, 3rd Ed. , (2015).
- Riebold, T. W., Geiser, D. R., Goble, D. O. . Large Animal Anesthesia: Principles and Techniques, 2nd Ed. , (1995).
- Parks, D. A., Granger, D. N. Contributions of ischemia and reperfusion to mucosal lesion formation. Am J Physiol. 250 (6), 749-753 (1986).
- Schoenberg, M. H., et al. Involvement of neutrophils in postischaemic damage to the small intestine. Gut. 32 (8), 905-912 (1991).
- Nilsson, U. A., et al. Free radicals and pathogenesis during ischemia and reperfusion of the cat small intestine. Gastroenterology. 106 (3), 629-636 (1994).
- Osborne, D. L., Aw, T. Y., Cepinskas, G., Kvietys, P. R. Development of ischemia/reperfusion tolerance in the rat small intestine. An epithelium-independent event. J Clin Invest. 94 (5), 1910-1918 (1994).
- Blikslager, A. T., Roberts, M. C., Rhoads, J. M., Argenzio, R. A. Is reperfusion injury an important cause of mucosal damage after porcine intestinal ischemia. Surgery. 121 (5), 526-534 (1997).
- Shegarfi, H., et al. Regulation of CCN1 (Cyr61) in a porcine model of intestinal ischemia/reperfusion. Innate Immun. 21 (5), 453-462 (2015).
- Gubernatorova, E. O., Perez-Chanona, E., Koroleva, E. P., Jobin, C., Tumanov, A. V. Murine model of intestinal ischemia-reperfusion injury. J Vis Exp. (111), (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved