Method Article
Intestinale Stammzellen isoliert und Kultur in einem porcinen Modell der segmentalen kleinen intestinalen Ischämie
In diesem Artikel
Zusammenfassung
Dieses Protokoll ermöglicht Lesern erfolgreich etablieren ein porcinen Modell der segmentale intestinale Ischämie und anschließend isolieren und Kultur intestinale Stammzellen für das Studium der epithelialen Reparatur nach Verletzung.
Zusammenfassung
Intestinale Ischämie bleibt eine der Hauptursachen für Morbidität und Mortalität bei Patienten der Human- und Veterinärmedizin. Viele Krankheitsprozessen führen intestinale Ischämie, wenn die Versorgung mit Blut und damit Sauerstoff in den Darm verringert wird. Dies führt zu Verlust der Darmbarriere und das darunter liegende Gewebe. Intestinale Stammzellen befinden sich auf der Basis der Krypten Lieberkühn und sind verantwortlich für intestinale Erneuerung während der Homöostase und folgende Verletzungen. Ex-Vivo Zelle Kulturtechniken konnten für das erfolgreiche Studium der epithelialen Stammzellen Interaktionen durch die Schaffung Kulturbedingungen, die das Wachstum der dreidimensionalen epithelialen Orgel-artigen Systemen unterstützen (genannt "Enteroids" und" Colonoids"aus dem dünn- und Dickdarm, beziehungsweise). Diese Enteroids sind aus Krypta und Villus-ähnlichen Domänen und Reifen für alle Zelltypen, die innerhalb der Epithel gefunden. In der Vergangenheit wurden murine Modelle genutzt, um intestinale Verletzungen zu untersuchen. Ein porcinen Modell bietet jedoch einige Vorteile einschließlich der Ähnlichkeit der Größe als auch Magen-Darm-Anatomie und Physiologie des Menschen. Durch die Verwendung einer porcinen Modell, schaffen wir ein Protokoll in der segmentale Schleifen der intestinalen Ischämie in ein einziges Tier erstellt werden können, ermöglicht die Untersuchung von unterschiedlichen Zeitpunkten der ischämische Schädigung und Reparatur in Vivo. Darüber hinaus wir beschreiben eine Methode zu isolieren und Kultur die intestinale Stammzellen aus den ischämischen Loops des Darmes, so dass für das weitere Studium der epithelialen Reparatur, moduliert durch Stammzellen, ex Vivo.
Einleitung
Intestinale ischämischen Verletzungen, das Ergebnis der verringerten sauerstoffverfügbarkeit aufgrund einer Verminderung oder vollständige Okklusion des Blutflusses in den Darm bleibt eine wesentliche Ursache für Morbidität und Mortalität im menschlichen und tierischen Patienten1,2. Ischämische Schädigung, zusammen mit nachfolgenden Entzündungen und zelluläre Infiltration, führt zu Schleimhaut Barriere Kompromiss. Die Schleimhaut-Barriere ist entscheidend für die Verhinderung von bakteriellen Translokation und damit verbundenen Toxinen in den systemischen Kreislauf3,4. Die anschließende Reperfusion des ischämischen Gewebe kann dazu führen, dass Bildung von reaktiven Sauerstoffspezies, die Verletzungen5verschlimmern können zu beschädigen. Da intestinale Ischämie selten vermeidbar ist, konzentriert sich die aktuelle Forschung an der Weiterentwicklung von Methoden zur Früherkennung von Ischämie und die Entwicklung neuartiger therapeutischer Ansätze, die Reperfusion Verletzungen oder Ziel Schleimhaut Reparatur reduzieren.
Tiermodelle wurden ausgiebig zur erweitern unser Wissen der Grundlagenforschung der Ischämie-Reperfusion Verletzungen und bleiben für die translationale Forschung unerlässlich. Nager-Modelle wurden die am weitesten verbreitete aufgrund ihrer Fähigkeit, genetisch manipulierten6sein. Vor kurzem hat jedoch die Verwendung von großen Tiermodellen, speziell das Schwein für zukünftige translationale Studien durch eine Reihe von Vorteilen, einschließlich der Schweine anatomische und physiologische Ähnlichkeiten mit Menschen7,8befürwortet worden. Eine Vielzahl von Verletzungen Modelle wurden entwickelt, um Ischämie-Reperfusion Verletzungen zu studieren und beinhalten komplette Gefäßverschlüssen, Low-Flow-Ischämie und segmentale mesenterialen Gefäßverschlüssen. Eine vollständige Überprüfung dieser Modelle ist außerhalb des Bereichs dieses Artikels jedoch die Autoren Leser auf den letzten Beitrag3leiten.
Neben in Vivo Modellen bietet der Einsatz von ex-Vivo zellulare Systeme ein viel versprechendes Instrument zur Untersuchung von intestinalen Homöostase und Reparatur nach Verletzung. Intestinale Stammzellen sind verantwortlich für die Zellproliferation und Umsatz von epithelialen Darmschleimhaut. Aus normalen oder verletzten Darm isoliert, intestinale Stammzellen in Kultur gehalten werden können, und dienen als Werkzeug oder Modell, Stammzellen und Epithelzelle Biologie zu studieren. Methoden, zu isolieren und diese dreidimensionale Kultur Systeme (benannt Enteroids und Colonoids bei den dünn- und Dickdarm, bzw. abgeleitet) sind beschrieben worden, für eine Vielzahl von Arten und Organ Systeme9,10 ,11,12,13. Insbesondere wurden innerhalb des Magen-Darm-Trakts, diese Kultur-Systeme für Modell Magen-Darm-Krankheiten einschließlich Krebs, Erreger Infektion und entzündliche Darm-Krankheit-14verwendet. Zu diesem Zeitpunkt gibt es keine Berichte über die Isolation und die Wartung von intestinale Stammzellen aus ischämisch Geschädigten Dünndarm in irgendeiner Sorte. Deshalb beschreiben hier wir den Prozess der intestinalen Ischämie in einem Roman, große Tier porcinen Modell führt zu reproduzierbaren Verletzungen und die Fähigkeit, intestinale Stammzellen aus normalen und ischämisch Geschädigten Darm für das weitere Studium der isolieren Erholung, ex Vivo.
Protokoll
Für diese Experimente stimmten alle Tierversuche mit den institutionellen Animal Care und Nutzung Committee (IACUC) der North Carolina State University.
1. Vorbereitung für Kultur
Hinweis: Alle Reagenzien werden in die Tabelle der Materialienaufgeführt. Bestimmten Wachstumsfaktor-Konzentrationen sind in Tabelle 1aufgeführt.
- Bereiten Sie eine 0,5 M Ethylenediaminetetraacetic Säure (EDTA) Lösung in destilliertem, entionisiertem Wasser (DdH2O). Angemessen zu mischen und Anpassen des pH-Werts 7,4 mit NaOH oder HCl-Lösungen.
Hinweis: Make-up EDTA-Stammlösung frisch vor jedem Experiment. - Dissoziation Reagenz #1 (DR #1) wie folgt vorbereiten und auf Eis: Mähdrescher Phosphat gepufferte Kochsalzlösung ohne Ca2 + und Mg2 + (PBS), 0,5 M EDTA, 1 M 1,4-Dithiothreitol (DTT), 10 µM Y27632 und 1 X Antibiotikum-antimykotische Lösung (Anti-Anti) mit Penicillin, Streptomycin und Amphotericin b.
Hinweis: Fügen Sie Y27632 unmittelbar vor der Entnahme von Gewebe. - Dissoziation Reagenz #2 (DR #2) wie folgt zubereiten und in einem 37 ° C Wasserbad legen: kombinieren Sie PBS ohne Ca2 + und Mg2 +0,5 M EDTA, 10 µM Y27632 und 1 X Anti-Anti. Hinweis: Fügen Sie Y27632 unmittelbar vor der Entnahme von Gewebe.
- Intestinalen epithelialen Stammzellen (IESC) Medien wie folgt vorbereiten: Mix 25 mL erweiterte DMEM/F12 Medium mit 1 X N2-Ergänzung, 1 X B-27 10 mM HEPES, 2 mM Glutamax und 1 X Anti-Anti ergänzen. Bei 4 ° C bis zur Verwendung aufbewahren.
- Einen master-Mix von reduzierten Wachstumsfaktor Basalmembran Matrix (Matrix) und zusätzliche Wachstumsfaktoren wie folgt vorbereiten: die Matrix auf Eis Auftauen. In einem Microcentrifuge Schlauch hinzufügen 100 ng/mL rekombinanten menschlichen Birne, 500 ng/mL rekombinante menschliche R-Spondin-1, 50 ng/mL rekombinanten menschlichen epidermalen Wachstumsfaktor (EGF), 100 ng/mL rekombinanten menschlichen Wnt3a, 10 mM Nicotinamid, 10 nM Gastrin 500 nM A-83-01, 10 µM Y-27632 , 10 mM SB202190, 500 nM LY2157299 und 2,5 µM Glykogen-Synthase Kinase 3 Inhibitor (GSK3i, CHIR99021). Wenn die Matrix aufgetaut ist, mit dem Wachstumsfaktor-Mix (wodurch master-Mix) ergänzen und speichern auf dem Eis.
Hinweis: Achten Sie darauf, keine Luftblasen einzuführen, da dies Artefakt innerhalb der Matrix-Patty während der Beschichtung zu schaffen. - Wärmen Sie ein 24-Well-Zellkultur-Gericht in einem 37 ° C Inkubator vor Beginn der Zelle Isolierungsmaßnahmen vor.
2. chirurgische Modell der Ischämie und Gewebe-Sammlung
- Verwendung acht bis zehn Wochen alten Yorkshire gekreuzt Schweine beiderlei Geschlechts (empfohlen). Alle Futtermittel 16-18 h vor der Operation zu entfernen. Können Sie Schweine Zugang zu Wasser zu allen Zeiten.
- Planen Sie die Schweine kommen mindestens 48 h vor den versuchen, um ökologische Akklimatisierung zu ermöglichen.
Hinweis: Ausgebildete Veterinär und/oder Labor Techniker überwacht von einem zugelassenen Tierarzt bieten routinemäßige Pflege und Unterstützung bei der Narkose Verfahren. - Premedicate das Schwein mit Xylazin (1,5 mg/kg intramuskulär (IM)) und Ketamin (11-20 mg/kg (IM))15. Einmal gesetzte, Intubation Schwein Orotracheally.
- Pflegen Sie Schweine unter allgemeiner Anästhesie mit Isofluran (2-5 %) in 100 % O2 bis zum Zeitpunkt der Euthanasie verdampft.
- Legen Sie einen intravenöse (IV) Katheter (Ohr Vene empfohlen) und administrieren eine Ersatz-Flüssigkeit wie gesäugt Klingeltöne Lösung mit einer Wartung Rate von 15 mL/kg/h.
- Führen Sie Routine Narkose Überwachung einschließlich Pulsoximetrie, Elektrokardiographie und indirekte Blutdruck-Messungen-15. Überwachen Sie des Schweins Atemfrequenz und Aufwand und lüften Sie manuell oder mechanisch nach Bedarf steigt Ende Gezeiten-CO2 über 55-60 MmHg.
Hinweis: Geeignete Anästhesie wird durch ständige Kontrollen der Trends in der Herzfrequenz (Bereich 80-130 Schläge/min), nicht-invasive Blutdruck (mittlere arterielle Druck 75-100 MmHg), und Atemfrequenz (10-25 Atemzüge/min)16und periodische Überprüfung bestätigt für das Fehlen von Kiefer und anal Ton. Tiefe der Narkose kann auch durch Muskelentspannung und Muskel Faszikulation nach chirurgischen Reiz beurteilt werden. Okuläre Reflexe sind in der Regel der Wert16. Analgesie kann bereitgestellt werden, wie durch die Institutionen IACUC Politik verwiesen. In diesem Fall kann ein Opioid wie Buprenorphin, während der Operation verabreicht werden. - Legen Sie das Schwein auf ein Heizkissen und zurückhalten in dorsal liegen für den chirurgischen Eingriff.
- Die ventralen Bauch rasieren und prep mit chirurgischen Peeling (Chlorhexidin-Lösung) und Isopropyl-Alkohol.
- Machen Sie einen ventralen Mittellinie 8-10-cm-Schnitt mit einem Skalpellklinge zentriert auf den Nabel auf dem Bauch.
- Dünndarm (Jejunum) ca. 40 cm Oral bis zur Kreuzung Ileocecal zu identifizieren. 10 cm lange Schleifen von Jejunum durch umlaufend Ligation Darm zweimal abzugrenzen, 1 cm zwischen jede Ligatur, vor dem Erstellen nachfolgende Schlaufen 10 cm befindet sich mündlich (Abbildung 1).
- Erstellen Sie zwei Schlaufen pro Zeitpunkt der Ischämie neben einander, eins für Ischämie und eins für Ischämie mit einem zusätzlichen 1h der Reperfusion bei Bedarf. Erstellen Sie komplette Ischämie (kein Durchfluss von Arterien oder Venen), Klemmen Sie oder verbinden Sie die mesenterialen Gefäßsystem mit Bulldog vaskulären Klemmen, gebogene Halstead Mosquito futterzange oder nicht resorbierbar Seide 2-0 für 1, 2, 3 und 4h und entfernen Sie dann die Klemmen für 1h Reperfusion, falls gewünscht.
Hinweis: Die Autoren alle Schleifen der Ischämie in der Reihenfolge beginnend mit der 4h ischämischen Schleife erstellt und fortgeschritten, Umzug nach proximal (nach insgesamt Operationszeit zu minimieren). Um die Möglichkeit zu begegnen, dass benachbarte ischämische Darm Segmente benachbarte Schleifen beschädigen kann, kann die Reihenfolge der ischämischen Schleifen variiert werden. Dies kann total OP-Dauer ändern.
Hinweis: Der zeitliche Rahmen der Reperfusion kann variiert werden je nach Fragestellung von Interesse oder auf Wunsch Therapien in der Reperfusion Zeit getestet werden. Aber wie Gewebeschäden immer schwerer wird von der Erhöhung der Dauer der Ischämie allein, beitragen Reperfusion Verletzungen wahrscheinlich nicht zu weiteren epithelialen Verletzungen. Reperfusion spielt wahrscheinlich eine Rolle nach milden Perioden der ischämischen Verletzungen. - Zwischen den Zeitpunkten der Ischämie halten Sie den Bauch bedeckt oder mit einem sterilen Tuch und/oder ein Handtuch Klemme geschlossen.
Hinweis: In ein einziges Tier für dieses Experiment können acht ischämischen Segmente erstellt werden. Identifizieren Sie eine zusätzliche Jejunal-Segment, mindestens 5-10 cm proximal zu der letzten ischämischen Schleife, die als normale interne Kontrolle dienen wird. - Behindern Sie etwa drei mesenterialen Gefäße pro Bulldog vaskulären Klemme oder gebogene Halstead Mosquito Gefäßklemme. Während der Gefäßklemme Anwendung muss darauf geachtet werden, weil die Schiffe leicht traumatisiert sind. Versuchen Sie, die Schiffe in die Backen der Klemmen zu stapeln.
- Am Ende des Experiments, folgende Euthanasie mit Pentobarbital 85-100 mg/kg IV, sammeln Sie alle Schleifen des Gewebes mit metzenbaumschere, nachdem Tod ohne Herzschlag horchte und Verlust der Hornhaut Reflex bestätigt wurde. Starten Sie durch das Sammeln ein Stück Kontrolle von normalen Jejunum mindestens 5 - 10 cm proximal der letzten ischämischen Schleife.
- Trennen Sie und verwahren Sie die Schleifen von jeder Verletzung Zeitpunkt in kleinen Behältern von eiskaltem PBS bis bereit zur Krypta Isolierung.
Hinweis: Auf Wunsch Schleifen machen ischämischen lange genug Aufteilung in getrennte Proben für Histologie und Darm Stammzelle-Kultur; Allerdings haben die Autoren festgestellt, dass größer als ca. 10 cm lange Schleifen am ehesten hämorrhagische geworden sind.
(3) Gruft (Stammzellen) isoliert von ischämischen und Regelkreisen
- Each-Schleife des Dünndarms mit einem 20-Drahtstärke und Gewebe Zange um die Schleimhautoberfläche aussetzen zu invertieren. Binden Sie die oberen und unteren Rand der Schleife fest an den Draht mit Naht (2: 0 nicht resorbierbar Seide oder gleichwertig).
- Spülen Sie nach Inversion jede Schleife in Eis kaltem PBS, luminalen Ablagerungen zu entfernen.
- Legen Sie die Proben sofort in 50 mL konische Röhrchen mit DR #1 für 30 min auf Eis.
- Sammeln Schleifen beginnend mit Kontrolle und folgen mit Schleifen von schrittweise Erhöhung der Dauer der Ischämie. Schleifen von weniger beschädigte Gewebe (d.h. Kontrolle und 1 h ischämischen Gewebe) können gewaltsam, schnappte das Handgelenk für beste Ergebnisse geschüttelt werden. Gewebe aus stark beschädigten Gewebe (3 und 4 h der Ischämie) sollte sanft geschaukelt oder invertiert nur da zu viel schütteln Krypta Störungen und weitere Gewebezerstörung führt. Rohre sollten geschüttelt oder invertiert alle 5 min auf Eis.
- Übertragen Sie Proben in DR #2 für 10 min bei 37° C Wasserbad. Schütteln oder Rohre alle 5 min zu invertieren.
- Nach der Übertragung der Gewebe, Zentrifugieren der konischen Röhrchen mit DR #1 von 2-4 h beschädigt Schleifen, überstand EDTA zu entfernen (200 X g für 5 min). Da diese Gewebe stark beschädigt sind, ist es möglich die Krypten bereits getrennt werden müssen. Entfernen Sie überstand und Aufschwemmen Sie Pellet mit einem kleinen Volumen der PBS (5 mL) und fahren Sie mit Schritt 3,9.
- Proben aus DR #2 und Gewebeproben direkt in 25 mL kaltem PBS auf Eis (Label als Wash #1). Legen Sie die Proben auf einem Orbitalschüttler auf Eis bei 60 u/min. Weiter zu schütteln oder invertieren jedes Rohr für 30 s alle 2 bis 5 Minuten.
- Nach der Übertragung der Gewebe, Spin die konischen Röhrchen mit DR #2 von 2-4 h beschädigt Schleifen, EDTA überstand (200 X g für 5 min) zu entfernen. Da diese Gewebe stark beschädigt sind ist es möglich, dass die Krypten getrennt werden. Entfernen Sie überstand und Aufschwemmen Sie Pellet mit einem kleinen Volumen der PBS (5 mL) und fahren Sie mit Schritt 3,9.
- Eine Aliquote 50 µL aus Wash #1 (oder aus der DR) entfernen, um den Grad der Krypta Dissoziation und Menge der Ablagerungen prüfen. Setzen Sie eine neue 50 mL konische Rohr Gewebe (Wash #2, #3, etc.) gefüllt mit 25 mL kaltem PBS und schütteln bis intakte Krypten mit minimalem Rückstand und Zotten isoliert sind.
Hinweis: Das Ziel ist, einen sauberen Bruch mit intakten Krypten und minimale Ablagerungen isolieren zu können. Jede zusätzliche Wäsche reinigt die Zellen jedoch zuviel schütteln beginnt zu sekundären Gewebe/Zellschäden zur Folge haben. Darüber hinaus werden die besten Ergebnisse mit geringsten Verunreinigungen erreicht werden, wenn Krypten von einem Waschschritt und nicht von einer Dissoziation Reagenz Schritt überzogen sind. - Entfernen Sie das restliche Gewebe zu und Zentrifugieren Sie die 50 mL konische Röhrchen bei 200 X g für 5 Minuten, Überstand entfernen, dann Aufschwemmen Sie verbleibenden Krypta Pellet in kleineren Volumen von PBS (5 mL).
- Überprüfen Sie mit einem inversen Mikroskop, 50 µL-Aliquots jeder Probe, Anzahl der Krypten/Bruchteil bestimmen. Das Ziel ist 50-100 Krypten/50 µL, da dies die Größe des endgültigen Matrix Patty sein wird.
Hinweis: Wenn die Stichprobe zu konzentriert ist, weiterhin kaltem PBS hinzugefügt, bis die gewünschte Konzentration erreicht ist. Wenn Probe zu verdünnen ist, bestimmen Sie die Anzahl der Aliquote benötigt, um gewünschte Krypta Ertrag zu erreichen und einzustellen. - Aliquoten entsprechenden Volumes der Krypten (bestimmt durch aliquoten Beobachtungen) zu einem Microcentrifuge Schlauch. Beispielsweise wenn Probe enthält 50 Krypten/50 µL dann aliquoten 50 µL pro Patty repliziert X 3 = 150 µL / Microcentrifuge Schlauch. Wenn die Probe nur enthält 25 Krypten/50 µL dann 2 Aliquote benötigt / Patty X 3 repliziert = 300 µL/Rohr.
- Pellet-Krypten 200 X g für 5 min bei 4° C.
- Aufschwemmen Sie sanft gebeizte Krypten mit entsprechenden Volumen des master-Mix (50 µL pro Well). Mischen Sie gründlich, indem schnell pipettieren 15mal ohne Luftblasen zu erstellen.
Hinweis: Vorkühlen der Pipettenspitze mit kalten sterilen PBS vor dem Absaugen der master-Mix. Dies wird helfen, den master-Mix davon abhalten, ausbreiten. Tipps können auch im Kühlschrank aufbewahrt und unmittelbar vor dem Gebrauch in die Haube gelegt. - Eine 50 µL-master-Mix plus Krypta Tröpfchen in Zentrum von jedem Bohrloch eine vorgewärmte 24-well-Platte zu verzichten.
- Inkubieren Sie die Kultur-Platte für 30 min bei 37 ° c
- Jede Matrix-Pastetchen mit 500 µL / gut von IESC Medien (keine zusätzliche Wachstumsfaktoren benötigt am Tag 0, da sie in der master-Mix enthalten sind) zu überlagern.
- Ungenutzten Brunnen auf dem Teller weiterhin Feuchtigkeit übrig fügen Sie 500 µL steriler PBS hinzu.
- Anzahl der vergoldeten Krypten am Tag 0.
Hinweis: Es ist hilfreich, Pre-Raster, die jede Zelle Kultur Platte in Quadranten um genauere Zählung sicherzustellen. - Anzahl der Enterospheres pro 24 h und für Enteroid Entwicklung täglich zu überwachen.
- Fügen Sie Wachstumsfaktoren zu jeder jede 48 h. IESC Medien alle 96 h entfernen und ersetzen mit 500 µL frische Medien (Wachstumsfaktoren muss dann Medien hinzugefügt werden).
Ergebnisse
Komplette intestinale Ischämie entstand im kleinen Darm Schleifen durch die Verwendung von Gefäßverschlüssen mit Naht oder Klammern wie in Abbildung 1dargestellt. Durch Lösen der Klemmen, kann ein kontrollierte Zeitraum der Reperfusion durchgeführt werden, ermöglichen zusätzliche Untersuchung der anschließende Reperfusion Verletzungen wenn gewünscht. Alle Tiere haben während des Verfahrens mit minimalen Komplikationen bis Euthanasie überlebt. Die häufigste chirurgische Komplikation war Hypotonie, die mit einem positiv Inotrope wie Dobutamin-Supplementierung gelöst.
Wenn richtig ausgeführt, ischämische Schädigung beginnt an der Spitze der intestinalen Villus und Wandern nach unten in die Krypta als die Dauer der Ischämie erhöht (Abbildung 2). Ein häufiger Fehler mit der Operationstechnik kann auftreten, wenn die Blutgefäße nicht ligiert oder gleichmäßig geklemmt. Das Ergebnis ist eine hämorrhagische Ischämie (Abbildung 3), in denen die dünnwandigen Vene vor der Arterie, zusätzliche Blut in das Gewebe einzudringen, zulassend zusammenbricht. Dies ist grob gesehen als dunkel lila serosal Oberfläche (Abbildung 3, Links) im Vergleich zu einer helleren Fläche während komplette Ischämie (Abbildung 3, rechts).
Nach Entfernen der ischämischen Darm Schleifen wurden Darm Krypten erfolgreich isoliert nach der Dissoziation-Protokolls (Abbildung 4). Wie erwartet, Krypten von mehr schwer beschädigten Zeitpunkte waren oft gebrochen (f; Fragment) und Krypta Brüche enthalten mehr Hintergrund zelltrümmer im Vergleich zu denen, die keine unterzogen oder leichte Schäden. Während des Protokolls muss der Schwerverletzten Darm sanft geschüttelt werden, um zusätzlichen Schaden auf das darunter liegende Gewebe zu vermeiden. Schütteln kann auch etwa weiteren Krypta Schäden und der Großteil der Krypten landet in der DR-Lösungen mit EDTA, wodurch zusätzliche Störung führen.
Sobald vernickelt, Krypten von allen Zeitpunkten der Ischämie überleben und sind in der Lage, sich in der Kultur (Abbildung 5) zu etablieren. Wann sind normale und leicht beschädigte Darm Krypten in Kultur, Enterospheres Form innerhalb von 24-48 h beschichtet. Mit schweren ischämischen Schäden (3 und 4 h) die Darm Krypten überleben aber beschädigt sind, was zur Bildung von viel kleineren Kugeln zunächst. Von 72-120 h komplexer Enteroids mit offensichtlich zentrale Lumen und angehende Strukturen. Insgesamt gibt es einen verminderten Wachstum Wirkungsgrad von Krypten sowie eine verminderte Größe des Enteroids, abgeleitet von der schwer beschädigten Darmgewebe (Gonzalez, L.M, unveröffentlichte Daten, 2017).
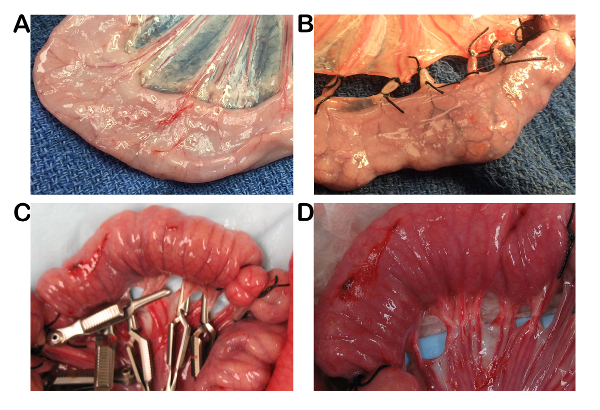
Abbildung 1 : Chirurgische Modell der komplette intestinale Ischämie in einem porcinen Modell. (A) normaler porcinen Jejunum verwirklicht. (B) mesenterialen Gefäße haben mit Naht erstellen intestinale Ischämie ligiert. (C) Ischämie mit Bulldog vaskulären Klemmen, um Gewebe Reperfusion zu ermöglichen, bei Bedarf erstellt. (D) Darm Gefäßsystem sofort nach dem Entfernen der vaskulären Klemmen. Bitte klicken Sie hier für eine größere Version dieser Figur.
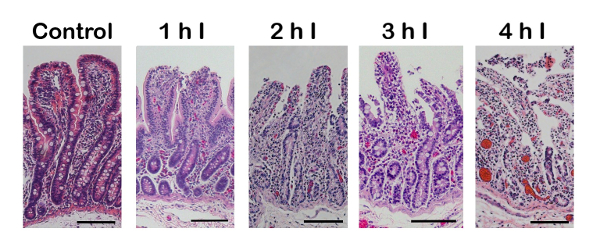
Abbildung 2 : Histologische Nachweis (Hämatoxylin und Eosin (H & E) Fleck) epithelialen Schäden nach längere Laufzeiten der komplette intestinale Ischämie zu erhöhen. Schaden beginnt an der Spitze der Villus mit allmählichen Verlust der Einzelzelle Epithelschicht, Villus Abstumpfung und Zellschädigung bis auf die Krypta mit schweren Verletzungen (bis zu 4 h Dauer). 100 µm Maßstabsleiste. Ich = Ischämie. Bitte klicken Sie hier für eine größere Version dieser Figur.
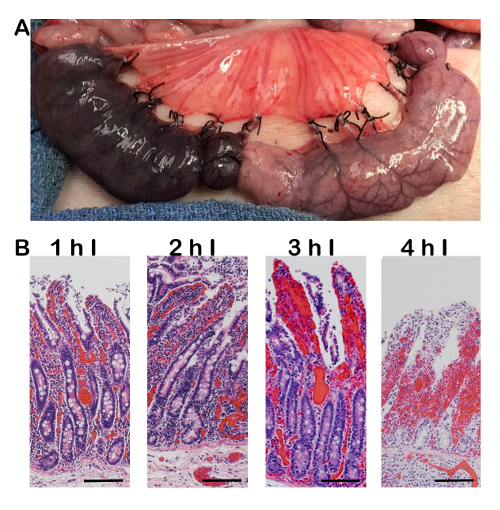
Abbildung 3 : Brutto- und histologischen Nachweis der hämorrhagischen Ischämie. (A) Brutto Foto hämorrhagische Ischämie (linke Schleife) und komplette Ischämie (richtige Schleife) zu vergleichen. Wenn das Gefäßsystem nicht ligiert oder gleichmäßig geklemmt, kann Blut weiterhin das Gewebe, was zu zusätzlichen Entzündungen und Schäden zu infiltrieren. (B) H & E Bilder von hämorrhagischen Ischämie von zunehmender Dauer von 1-4 h. Neben der Zellschädigung mit komplette Ischämie gesehen gibt es Hinweise auf roten Blutkörperchen Eindringen in die umgebende Lamina Propria. 100 µm Maßstabsleiste. Ich = Ischämie. Bitte klicken Sie hier für eine größere Version dieser Figur.
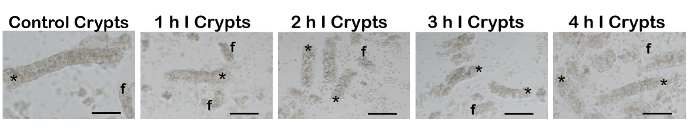
Abbildung 4 : Aliquote der intestinalen Krypten isoliert von den Schlingen des ischämischen und normaler Darm. Komplette, intakte Darm Krypten (Sternchen) wurden erfolgreich isoliert von each-Schleife des Darms. Wie erwartet, Krypten von mehr schwer beschädigten Zeitpunkte waren oft gebrochen (f; Fragment) und Krypta Brüche enthalten mehr Hintergrund zelltrümmer im Vergleich zu denen, die keine unterzogen oder leichte Schäden. 100 µm Maßstabsleiste. Ich = Ischämie. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 5 : Zeitlicher Verlauf des Wachstums der intestinale Stammzellen isoliert von den ischämischen Schlingen des Dünndarms nach. Als normale intestinale Krypten in Kultur überzogen waren, bildeten Enterospheres innerhalb von 24-48 h. Mit schweren ischämischen Schäden (3 und 4 h) Krypten überleben, aber viel kleinere Kugeln anfangs zu bilden. Von 72-120 h komplexer Enteroids mit offensichtlich zentrale Lumen und angehende Strukturen. 20 µm Maßstab bar sofern nicht angegeben. Bitte klicken Sie hier für eine größere Version dieser Figur.
| Wachstumsfaktor | Verdünnungsmittel | Lager Konzentration | Lager Verdünnung | Arbeiten Verdünnung |
| R-Spondin | PBS | 100 X | 100 µg/ml | 1 µg/ml |
| Birne | SW/0.1%BSA | 1000 X | 100 µg/ml | 100 ng/ml |
| EGF | 10mM Essigsäure | 10.000 X | 500 µg/ml | 50 ng/ml |
| A-83-01 | DMSO | 1000 X | 500 ΜM | 500 nM |
| SB202190 | DMSO | 3000 X | 30 mM | 10 ΜM |
| Nicotinamid | SW | 1000 X | 1 M | 1 mM |
| Gastrin | PBS | 10.000 X | 100 ΜM | 10 nM |
| Y-27632 | PBS | 1000 X | 10 mM | 10 ΜM |
| LY2157299 | DMSO | 10.000 X | 5 mM | 0,5 ΜM |
| CHIR99021 | PBS | 1000 X | 2,5 mM | 2,5 ΜM |
| Wnt3a | PBS | 2000 X | 200 µg/ml | 100 ng/ml |
Tabelle 1: Wachstumsfaktor Reagenz Tabelle. Zusammenfassung der Wachstumsfaktor Stammlösungen und funktionierende Lösungen in diesem Protokoll verwendeten.
Diskussion
Die Entwicklung einer porcinen Modell der segmentale intestinale Ischämie baut auf murinen Vorgängermodellen dadurch, dass für die Untersuchung von mehreren Zeitpunkten von Gewebeverletzungen innerhalb der selben Tier. Es gibt mehrere kritische Diskussionspunkte dieses Protokolls einschließlich geeignetes Gefäß Ligation, Gewebe Reperfusion und erfolgreiche Krypta Zellkultur.
Geeignetes Gefäß Ligatur ist unerlässlich für die Schaffung eines Modells der komplette Ischämie. Wenn die Naht ungleichmäßig gebunden ist oder die Klemme nicht angezogen, Blut aus die dickwandigen Arterie kann weiterhin das Gewebe eingeben und kann nicht beendet werden aufgrund des Zusammenbruchs der dünnwandigen Ader. Dies führt zu Extravasation des Blutes in die Lamina Propria zusätzliche Gewebeschäden verursachen. Allerdings kann je nach Art der ischämischen Verletzungen untersucht, vollständig oder hämorrhagische Ischämie erwünscht sein. Beispielsweise ist in den Prozess der Darm-Transplantation, der Darm vollständig die Gefäßversorgung (Arterie und Vene) während der Resektion Phase des Verfahrens, getrennt die komplette intestinale Ischämie führt. Alternativ, jedoch wenn das Mesenterium während eines Ereignisses wie ein Darm Volvulus verdreht ist, den venösen Rückfluss ist oft zunächst behindert führt zusätzliche Blut in das Gewebe vor der arteriellen Versorgung wird behindert, wodurch hämorrhagische Ischämie.
Ischämische Schädigung führt zu Gewebeschäden Villus Tipp ab und bis auf die Basis der Krypta3. Während Ischämie Energie in Form von Adenosintriphosphat weiterhin verwendet werden und erzeugt die Metaboliten Hypoxanthin. Wenn das Gewebe mit Sauerstoff reperfused, Hypoxanthin Xanthin-Oxidase metabolisiert wird und produziert Superoxid-radikale führt zu Verletzungen der Schleimhaut und Attraktion der Gewebe beschädigen Neutrophilen17,18. Artenunterschiede in Schleimhaut gefäßarchitektur sowie unterschiedlichen Ausdruck von Xanthin-Oxidase, führen in unterschiedlichem Ausmaß der Reperfusion Verletzungen3. Katzen und Nager Modelle der Ischämie-Reperfusion sind anfälliger für Reperfusion Verletzungen von reaktivem Sauerstoff Metaboliten19,20. Im Gegensatz dazu wurden Schweine haben weniger Xanthin-Oxidase und daher weniger Reperfusion Verletzungen, so dass dieses Modell mehr vergleichbar mit der menschlichen intestinalen Ischämie21gefunden. Zu diesem Zeitpunkt wurde die Verwendung von Knockout oder transgenen Schweinen Modelle, intestinale Verletzungen zu studieren nicht beschrieben so dass dies eine große Einschränkung dieses Modells. Auswahl der richtigen Tiermodell richtet sich nach den Krankheitsprozess oder bestimmte Bedingung der Forscher studieren möchte. Zum Beispiel wurden porcinen Modelle der ischämischen Verletzungen bis zu 6 h beschrieben22, während die meisten ischämische Verfahren in murinen Modellen 45-60 min23 sind.
Erfolgreiche Isolierung der intestinalen Krypten von normalen und ischämisch Geschädigten Darm ermöglicht für das Studium der epithelialen Erholung in Kultur. Dieses System ermöglicht die Forscher eindeutig auf das Epithel allein konzentrieren, da gibt es keine Gefäßversorgung oder Immunzelle Komponente zu berücksichtigen. Dies bietet die Möglichkeit, epithelialen Zell-Interaktionen und Wiederherstellung nach Verletzungen neben der Reaktion auf verschiedene Wachstumsfaktoren oder Behandlungen, die während der Operation oder folgenden Krypta Isolation durch die Ergänzung der Nährmedien zu studieren. Dieser Schritt ist der schwierigste, wie losgelöst von der schwer beschädigten Schleifen erfordert sanft schütteln und schnelle Entfernung der EDTA-haltigen Lösungen für den Fall, dass die Krypten haben werden vorzeitig getrennt. Wenn diese Schleifen des Darmes nicht gründlich gewaschen werden, haben die Krypten das Potenzial, in der Kultur kontaminiert werden. Infolgedessen wurde Antibiotikum antimykotische Lösung beide DR-Lösungen neben den IESC Medien hinzugefügt. Ein weiterer Diskussionspunkt konzentriert sich auf den Darm als eine normale Kontrolle gesammelt. Wie die Tiere Anästhesie mit möglichen Änderungen in systemischen Gewebedurchblutung, zusammen mit der Möglichkeit der zirkulierenden Entzündungsmediatoren, Ischämie, sekundäre unterziehen kann auch "normale" kontrollgewebe keine wirkliche Kontrolle darstellen. In diesen Experimenten ist es bemerkenswert, dass das kontrollgewebe grob und histologisch vergleichbar mit Gewebe von Tieren erschienen, die nicht Ischämie in anderen Experimenten (Gonzalez, L.M, unveröffentlichte Daten, 2017) durchlaufen.
Zusammenfassend lässt sich sagen beschreibt diese Methode ein reproduzierbares Modell von porcinen intestinale Ischämie, die eng modelliert, was im menschlichen ischämische Schädigung auftritt. Darüber hinaus wird die Isolation der intestinale Stammzellen von ischämischen Schleifen beschrieben, die dazu dient, die epithelialen Reparatur und mögliche Reaktion auf die Behandlung in der Kultur zu studieren.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Dieses Projekt wurde von NIH K01OD0199, NIH T32 OD011130, NIH P30DK034987 und Abt. klinische Wissenschaften Verbreitung Fonds unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Phosphate Buffered Saline, Ca2+, Mg 2+ free | Fisher Scientific | BP-399 | Dilute 1:10 |
| Distilled, deionized water (ddH2O) | Used to prepare EDTA and PBS | ||
| Dimethyl Sulfoxide (DMSO) | Thermo Scientific | 20688 | |
| Ethylenediamene tetraacetic acid (EDTA) | Sigma Aldrich | ED45 | Make fresh before each experiment; pH 7.4 |
| 1,4-Dithiothreitol (DTT) | Sigma Aldrich | 646563 | |
| Y-27632 | Sigma Aldrich | Y0503 | |
| Advanced DMEM/F12 | Life Technologies | 12634-010 | |
| N2 Supplement | Life Technologies | 17502-048 | |
| B-27 Supplement | Life Technologies | 12587-010 | |
| HEPES | Life Technologies | 15630-106 | |
| Glutamax | Life Technologies | 35050-061 | |
| Penicillin/Streptomycin/Amphotericin B | Gibco | 15240-096 | Anti-Anti solution |
| Recombinant human Wnt-3a | R & D Systems | 5036 WN/CF | |
| Recombinant human Rspondin1 | R & D Systems | 4645- RS | |
| Recombinant human Noggin | R & D Systems | 6057-NG | |
| Recombinant human EGF | R & D Systems | 236-EG | |
| LY2157299 | SelleckChem | 52230 | |
| CHIR99021 | Cayman Chemical | 13122 | |
| Human [leu]15-Gastrin 1 | Sigma Aldrich | G9145 | |
| SB202190 | Sigma Aldrich | 57067 | |
| A83-01 | Tocris | 2939 | |
| Nicotinamide | Sigma Aldrich | N0636 | |
| Acetic Acid | Sigma Aldrich | 695092 | |
| Water, WFI Quality | Corning, Inc. | 25-055-CM | Referred to as sterile water (SW); for growth factor stocks |
| Bovine Serum Albumin (BSA) | Sigma Aldrich | A2153 | |
| Matrigel Matrix, GFR | Corning, Inc. | 356231 | Phenol red free |
| 24 Well Culture Dish | Corning, Inc. | 3524 | |
| Conical Tube, 50 ml | Corning, Inc. | 430828 | |
| Scalpel Handle | World Precision Instruments | 500236 | |
| Carbon Steel Surgical Blade, No. 10 | World Precision Instruments | 504169 | |
| Tissue Forceps | World Precision Instruments | 15918 | |
| Debakey Tissue Forceps | World Precision Instruments | 501239 | |
| Mayo Scissors | World Precision Instruments | 501752 | Curved or straight |
| Metzenbaum Scissors | World Precision Instruments | 501739 | |
| Mosquito Forceps, Curved | World Precision Instruments | 503724-12 | Curved or straight (503728-12) |
| Hopkins Bulldog Clamp | Stoelting Co. | 52120-40P | Straight |
| Silk, 2-0 | Henry Schein | 685S-BUT | Any similar brand is acceptable |
| Towel Clamps | World Precision Instruments | 501700 | |
| Needle Holder | World Precision Instruments | V503382 | |
| Wire suture, 20 gauge | Henry Schein | 19075 | Cut and straighten before use. |
| Surgical Towels | Henry Schein | ST1833 | Any similar product is acceptable. |
| Lactated Ringers Solution | Henry Schein | 9851 | |
| Chlorhex antiseptic scrub (4%) | Henry Schein | VINV-CHMX-SCRB | Any similar brand is acceptable |
| Isopropyl Alcohol 70% | Henry Schein | MS071HS | Any similar brand is acceptable |
| IV catheter, 22 gauge | Henry Schein | 2225PUR | May need 20g or 24 g depending on size of the vein |
| Xylazine (100 mg/ml) | Henry Schein | 33198 | |
| Ketamine (100 mg/ml) | Henry Schein | 11695-6835-1 | Controlled medication |
| Isoflurane solution | Henry Schein | 10015516 | |
| Pentobarbital (Fatal Plus Euthanasia Solution (390 mg/ml)) | Vortech Pharm. | Multiple brands of Pentobarbital Sodium available. | |
| Heating pad | Gaymar | Tpump Core Warming System; others are available. | |
| Mindray Datascope Monitor | Mindray North America | Any equivalent piece of monitoring equipment acceptable | |
| Vaporizer | Vetland Medical | Recommended to use a Circle System w/ Y piece; multiple suppliers available. | |
| Fluid Pump | Abbott Hospira | Plum A+; Any similar manufacturer is recommended. |
Referenzen
- Eltzschig, H. K., Eckle, T. Ischemia and reperfusion--from mechanism to translation. Nat Med. 17 (11), 1391-1401 (2011).
- Blikslager, A. T. Treatment of gastrointestinal ischemic injury. Vet Clin North Am Equine Pract. 19 (3), 715-727 (2003).
- Gonzalez, L. M., Moeser, A. J., Blikslager, A. T. Animal models of ischemia-reperfusion-induced intestinal injury: progress and promise for translational research. Am J Physiol Gastrointest Liver Physiol. 308 (2), 63-75 (2015).
- Podolsky, D. K. Mucosal immunity and inflammation. V. Innate mechanisms of mucosal defense and repair: the best offense is a good defense. Am J Physiol. 277 (3), 495-499 (1999).
- Collard, C. D., Gelman, S. Pathophysiology, clinical manifestations, and prevention of ischemia-reperfusion injury. Anesthesiology. 94 (6), 1133-1138 (2001).
- Mallick, I. H., Yang, W., Winslet, M. C., Seifalian, A. M. Ischemia-reperfusion injury of the intestine and protective strategies against injury. Dig Dis Sci. 49 (9), 1359-1377 (2004).
- Gonzalez, L. M., Moeser, A. J., Blikslager, A. T. Porcine models of digestive disease: the future of large animal translational research. Transl Res. 166 (1), 12-27 (2015).
- Ziegler, A., Gonzalez, L. M., Blikslager, A. T. Large animal models: The key to translational discovery in digestive disease research. Cell Mol Gastroenterol Hepatol. 2 (6), 716-724 (2016).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Meneses, A. M. C., et al. Intestinal organoids-Current and future applications. Veterinary Sciences. 3 (4), 31 (2016).
- Clevers, H. Modeling development and disease with organoids. Cell. 165 (7), 1586-1597 (2016).
- Mahe, M. M., Sundaram, N., Watson, C. L., Shroyer, N. F., Helmrath, M. A. Establishment of human epithelial enteroids and colonoids from whole tissue and biopsy. J Vis Exp. (97), (2015).
- Dedhia, P. H., Bertaux-Skeirik, N., Zavros, Y., Spence, J. R. Organoid models of human gastrointestinal development and disease. Gastroenterology. 150 (5), 1098-1112 (2016).
- Swindle, M. M., Smith, A. C. . Swine in the Laboratory: Surgery, Anesthesia, Imaging & Experimental Techniques, 3rd Ed. , (2015).
- Riebold, T. W., Geiser, D. R., Goble, D. O. . Large Animal Anesthesia: Principles and Techniques, 2nd Ed. , (1995).
- Parks, D. A., Granger, D. N. Contributions of ischemia and reperfusion to mucosal lesion formation. Am J Physiol. 250 (6), 749-753 (1986).
- Schoenberg, M. H., et al. Involvement of neutrophils in postischaemic damage to the small intestine. Gut. 32 (8), 905-912 (1991).
- Nilsson, U. A., et al. Free radicals and pathogenesis during ischemia and reperfusion of the cat small intestine. Gastroenterology. 106 (3), 629-636 (1994).
- Osborne, D. L., Aw, T. Y., Cepinskas, G., Kvietys, P. R. Development of ischemia/reperfusion tolerance in the rat small intestine. An epithelium-independent event. J Clin Invest. 94 (5), 1910-1918 (1994).
- Blikslager, A. T., Roberts, M. C., Rhoads, J. M., Argenzio, R. A. Is reperfusion injury an important cause of mucosal damage after porcine intestinal ischemia. Surgery. 121 (5), 526-534 (1997).
- Shegarfi, H., et al. Regulation of CCN1 (Cyr61) in a porcine model of intestinal ischemia/reperfusion. Innate Immun. 21 (5), 453-462 (2015).
- Gubernatorova, E. O., Perez-Chanona, E., Koroleva, E. P., Jobin, C., Tumanov, A. V. Murine model of intestinal ischemia-reperfusion injury. J Vis Exp. (111), (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten