Method Article
Стволовых клеток кишечника изоляции и культуры в свинину модели сегментарный малого кишечника ишемии
В этой статье
Резюме
Этот протокол позволит читателям успешно создать свинину модель сегментарный кишечная ишемия и впоследствии изолировать и культуры кишечных стволовых клеток для изучения эпителиальных ремонта после травмы.
Аннотация
Кишечная ишемия остается одной из основных причин заболеваемости и смертности в медицине и ветеринарии пациентов. Многие болезни процессы приводят в кишечной ишемией, когда кровоснабжение и, следовательно, кислорода уменьшается в кишечник. Это приводит к кишечный барьер потери и повреждения основной ткани. Кишечные стволовые клетки находятся в основании склепы Lieberkühn и отвечают за кишечных обновления во время гомеостаза и следующие травмы. Ex vivo методы культуры клетки позволили для успешного изучения стволовых клеток эпителия взаимодействия путем создания условий культуры, которые поддерживают рост трехмерной эпителиальных орган подобных систем (называется «enteroids» и» colonoids «от малого и большого intestine, соответственно). Эти enteroids состоит из склепа и ворсинок, как домены и зрелой, чтобы содержать все типы клеток, в эпителии. Исторически мышиных модели были использованы для изучения кишечных повреждений. Однако свинину модель предлагает несколько преимуществ, включая сходство размер, а также желудочно-кишечного тракта анатомии и физиологии, людей. Используя модель свинину, мы создать протокол, в котором сегментарный петель кишечника ишемии могут создаваться в рамках одного животного, включение изучения различных очагов ишемического повреждения и ремонт в естественных условиях. Кроме того, мы описываем метод для изоляции и культуры кишечная стволовые клетки от ишемического петель кишечника, позволяя для дальнейшего изучения эпителиальных ремонта, модулированные стволовых клеток, ex vivo.
Введение
Кишечные ишемических повреждений, в результате сокращения кислородная доступности вследствие сокращения или полной окклюзии потока крови в кишечник, остается значительной причиной заболеваемости и смертности у человека и животных пациентов1,2. Ишемические повреждения, наряду с последующим воспалением и клеточного инфильтрата, приводит к слизистой барьер компромисса. Слизистых оболочек барьер имеет решающее значение для предотвращения бактериальной транслокации и связанные токсинов в кровообращения3,4. Последующей реперфузии ишемии тканей могут привести к образованию повреждения реактивнооксигенных видов, которые могут обострить травмы5. Так как кишечная ишемия редко предотвратима, самые современные исследования была сосредоточена на продвижение методов для раннего выявления ишемии и развития Роман терапевтические подходы, позволяющие сократить реперфузии травмы или целевой слизистой ремонта.
Животные модели широко используются для расширения наших знаний фундаментальной науки ишемии реперфузии травмы и остаются необходимым для трансляционного исследования. Грызун модели были наиболее широко используется из-за их способность быть генетически модифицированных6. Совсем недавно однако, использование больших животных моделей, специально свиньи, выступает для будущих трансляционного исследования из-за ряда преимуществ, включая свиней анатомо-физиологического сходства людей7,8. Целый ряд травм модели были разработаны для изучения ишемии реперфузии травмы и полной окклюзии сосудов, низкого потока ишемии и сегментарные окклюзии брыжеечных сосудов. Полный обзор этих моделей находится вне сферы этой статьи однако авторы направлять читателей на недавней отзыв3.
В дополнение к в естественных условиях модели использование систем ex vivo клеточной культуры предлагает перспективным инструментом для изучения кишечных гомеостаза и ремонт после травмы. Кишечные стволовые клетки отвечают за пролиферации и оборот эпителиальной выстилки кишечника. При изоляции от нормальной или раненых кишечника, кишечные стволовые клетки могут сохраняться в культуре и служить в качестве инструмента или модель для изучения стволовых клеток и эпителиальных клеток биологии. Методы для изоляции и установить эти трехмерные культура систем (называется enteroids и colonoids когда производный от малого и большого intestine, соответственно) были описаны для различных видов и органа системы9,10 ,11,12,13. В частности в пределах желудочно-кишечного тракта, эти культуры системы были использованы для модели желудочно-кишечных заболеваний, включая рак, возбудителя инфекции и воспалительных кишечника болезни14. На данный момент Есть никаких сообщений, описывая изоляции и поддержание кишечных стволовых клеток из ишемически потерпевшего тонкой кишки в любых видов. Таким образом здесь мы описываем процесс кишечная ишемия в роман, крупных животных свинину модель, которая приводит к воспроизводимые травмы и способность изолировать кишечных стволовые клетки от обычных и ишемически раненых intestine для дополнительного изучения восстановления ex vivo.
протокол
Для этих экспериментов все исследования на животных были утверждены институциональный уход животных и использование Комитет (IACUC) из университета штата Северная Каролина.
1. Подготовка к культуре
Примечание: Все реагенты, перечислены в Таблице материалов. В таблице 1перечислены конкретные фактор роста концентрации.
- Приготовляют раствор 0,5 М Этилендиаминтетрауксусная кислота (ЭДТА) в дистиллированной деионизированной воды (ddH2O). Mix адекватно и скорректировать рН 7,4, с использованием NaOH или HCl решений.
Примечание: Составляют ЭДТА Стоковый раствор свежий перед каждой эксперимент. - Приготовляют следующим образом диссоциации реагент #1 (DR #1) и место на льду: комбинат фосфат буфер солевой раствор без Ca2 + и Mg2 + (PBS), 0,5 М ЭДТА, 1 M 1,4-Дитиотреитол (DTT), 10 мкм Y27632 и 1 X антибиотик-противогрибковое раствора (анти анти) содержащие пенициллин, стрептомицин и амфотерицином B.
Примечание: Добавьте непосредственно перед ткани коллекции Y27632. - Приготовляют следующим образом диссоциации Реагент #2 (д-р #2) и место в ванну воды 37 ° C: объединить PBS без Ca2 + и Mg2 +, ЭДТА 0,5 М, 10 мкм Y27632 и 1 X анти анти. Примечание: Добавьте непосредственно перед ткани коллекции Y27632.
- Приготовляют следующим образом кишечного эпителия стволовых клеток (ИННЦ) СМИ: микс 25 мл расширенный среде DMEM/F12 с 1 X N2 дополнение, 1 X B-27, 10 мм HEPES, 2 Glutamax и 1 X анти анти. Хранить при 4 ° C до использования.
- Подготовка мастер смесь снижения фактора роста базальной мембраны матрицы (матрица) и дополнительных факторов роста следующим: оттепель матрицы на льду. В пробки microcentrifuge, добавить 100 нг/мл рекомбинантного человеческого льют, 500 нг/мл рекомбинантного человеческого R-Spondin-1, 50 нг/мл рекомбинантного человеческого эпидермального фактора роста (EGF), 100 нг/мл рекомбинантного человеческого Wnt3a, 10 мм никотинамид, 10 Нм гастрина, 500 Нм A-83-01, 10 мкм Y-27632 , 10 мм SB202190, 500 Нм LY2157299 и ингибитора киназы 3 синтазы гликогена 2,5 мкм (GSK3i, CHIR99021). Когда матрица является размороженным, дополнение смесью фактор роста (что делает Мастер микс) и хранить на льду.
Примечание: Будьте осторожны избежать введения пузырьки воздуха, как это будет создавать артефакт в пределах матрицы Пэтти во время покрытия. - Предварительно теплой 24-ну тканевые культуры блюдо в инкубаторе 37 ° C до начала процедуры изоляции клеток.
2. Хирургическое модель ишемии и коллекции тканей
- Использование восемь 10 недельных Йоркшир гибридных свиней обоего пола (рекомендуется). Удалите все корма 16-18 ч до операции. Разрешить доступ к воде во все времена свиней.
- Расписание свиней прибыть по крайней мере за 48 часов до экспериментов для окружающей среды адаптационного.
Примечание: Обученных специалистов ветеринарной и/или лаборатория под руководством лицензированного ветеринар предоставляют обычные животных уход и помощь с обезболивающий процедур. - Premedicate Свинья с Ксилазина (1,5 мг/кг внутримышечно (IM)) и кетамин (11-20 мг/кг (IM))15. После седативное, интубации orotracheally свиньи.
- Поддерживать свиней под общим наркозом с изофлюрановая (2-5%), испаряется в 100% O2 до времени эвтаназии.
- Поместите внутривенного (IV) катетера (уха вен рекомендовала) и администрировать замена жидкости как раствор лактат звонарей 15 мл/кг со скоростью обслуживания/ч.
- Выполните процедуру анестезиологического мониторинга включая пульсоксиметрии, электрокардиография и косвенные артериального давления измерения15. Контролировать частоту дыхания и усилий свиньи и проветрить вручную или механически, при необходимости, если конца Приливные CO2 поднимается выше 55-60 мм рт.ст..
Примечание: Соответствующие анестезии подтверждается постоянный мониторинг тенденций в ЧСС (диапазон 80-130 уд/мин), неинвазивная кровяное давление (среднее артериальное давление 75-100 мм рт.ст.) и частота дыхания (10-25 вдохов/мин)16и периодическая проверка из-за отсутствия челюсти и анальный тон. Глубины анестезии можно также судить по степени расслабления мышц и подрагивание мышц после хирургической стимул. Глазной рефлексы, как правило, не значение16. Обезболивание может быть предоставлена по указанию IACUC политики учреждения. В этом случае опиоид, таких как бупренорфин, может назначаться во время операции. - Место свиньи на грелку и удержать в спинной recumbency для хирургической процедуры.
- Брить живот брюшной и подготовка с помощью хирургического скраб (хлоргексидин раствор) и изопропиловый спирт.
- Надрезают 8-10 см брюшные срединной линии с помощью центрирована на пупочное лезвие скальпеля для доступа к области живота.
- Идентифицировать тонкой кишки (тощая кишка) примерно 40 см устные в илеоцекальной junction. Определить 10 см длиной петли тощей кишки по окружности безлигатурные кишечника дважды, один см между каждой лигатуры, до создания последующих петель 10 см расположен устно (рис. 1).
- Создайте две петли на момент времени ишемии рядом друг с другом, один для ишемии и один для ишемии с дополнительного 1h реперфузии, при желании. Для создания полной ишемии (нет потока артерий или вен), зажим или перевязать брыжеечных сосудистую, используя бульдог сосудистых зажимов, изогнутые Halstead комаров hemostats или 2-0 не рассасывающиеся шелка для 1, 2, 3 и 4h и снимите зажимы для 1h реперфузии, при желании.
Примечание: Авторы создали все петли ишемии в порядке, начиная с 4h ишемического цикла и прогрессировала, перемещение проксимально (свести к минимуму время общей хирургии). Чтобы устранить возможность, что соседние ишемии кишечника сегментов может повредить соседние петли, порядок ишемическая петель могут быть разнообразны. Это может изменить длительность хирургического.
Примечание: Сроки реперфузии может изменяться на основании исследования вопроса о интерес или если терапии хочу быть испытаны во время периода реперфузии. Однако как повреждение ткани становится более серьезным, от увеличения длительности ишемия самостоятельно, реперфузионных повреждений вероятно не способствуют дальнейшей эпителиальных травмы. Реперфузии вероятно играть роль после мягкой периодов ишемических повреждений. - Между моментами времени ишемии Держите живот охвачены или закрыть с помощью стерильных полотенце или струбциной полотенце.
Примечание: В пределах одиночного животного для этого эксперимента, восемь ишемического сегменты могут быть созданы. Определите дополнительные тощей кишки сегмент, по крайней мере 5-10 см проксимальнее последний ишемического цикл, который будет служить в качестве нормального внутреннего контроля. - Препятствовать примерно три брыжеечных сосудов бульдог сосудистый зажим или изогнутые кровоостанавливающий комаров Halstead. Будьте внимательны во время применения кровоостанавливающий потому что сосуды легко травму. Попробуйте стека судов в пределах кулачков зажима.
- В конце эксперимента, следующие эвтаназии с IV Пентобарбитал 85-100 мг/кг, соберите все петли ткани с помощью ножниц metzenbaum, после смерти был подтвержден с не auscultated сердцебиения и потери роговицы рефлекс. Начните сбор управления часть нормальной тощей кишки по крайней мере 5 - 10 см проксимальнее последний цикл ишемического.
- Отдельные и хранить петли из каждой точки время травмы в маленьких контейнерах ледяной PBS до готовности для изоляции склеп.
Примечание: При желании, сделать ишемического петли достаточно долго чтобы разделить на отдельные образцы для гистологии и стволовых клеток кишечника культуры; Однако авторы нашли что петли больше чем приблизительно 10 см длиной, скорее всего, стать геморрагические.
3. склеп (стволовых клеток) изоляции от ишемического и контуров управления
- Инвертируйте каждый цикл с помощью 20-проволока и ткани щипцы подвергать поверхность слизистой оболочки тонкой кишки. Галстук верхней и нижней части цикла надежно проволока, используя шовный материал (2-0 не рассасывающиеся шелка или эквивалент).
- После инверсии промойте каждый цикл в лед холодной PBS для удаления Люминал мусора.
- Поместите образцы сразу в 50 мл конические пробирки, содержащие DR #1 на льду за 30 мин.
- Собирать петли, начиная с управления и следовать с петлями постепенного увеличения длительности ишемии. Петли из менее поврежденной ткани (т.е. управления и 1 h ишемии ткани) может быть поколеблено насильственно, щелкая на запястье для достижения наилучших результатов. Ткани из сильно поврежденных тканей (3 и 4 h ишемии) следует аккуратно потрясли или перевернутый только как слишком много тряски вызовет склеп разрушение и уничтожение дополнительные ткани. Трубы должны быть потрясен или инвертированный каждые 5 минут на льду.
- Передача образцов в DR #2 10 мин на водяной бане 37° C. Встряхнуть или инвертировать трубы каждые 5 мин.
- После передачи в тканях, центрифуга конические пробирки, содержащие DR #1 из 2-4 h поврежден петли, чтобы удалить супернатант ЭДТА (200 g x 5 мин). Поскольку эти ткани сильно повреждены возможна, склепы уже стали отделять. Удалить супернатант и Ресуспензируйте лепешка с небольшой объем PBS (5 мл) и перейдите к шагу 3.9.
- Удалить образцы из DR #2 и место образцов ткани непосредственно в 25 мл холодного PBS на льду (метка как мыть #1). Поместите образцы на орбитальный шейкер на льду на 60 об/мин. Продолжать поколебать или инвертировать каждая трубка для 30 s каждые 2-5 мин.
- После передачи тканей, спина конические пробирки, содержащие DR #2 от 2-4 h поврежден петли, чтобы удалить супернатант ЭДТА (200 g x 5 мин). Поскольку эти ткани сильно повреждены вполне возможно, что склепов стали отделять. Удалить супернатант и Ресуспензируйте лепешка с небольшой объем PBS (5 мл) и перейдите к шагу 3.9.
- Удаление 50 мкл Алиготе от мыть #1 (или от DR) для проверки степени диссоциации склеп и количество мусора. Место ткани в новой 50 мл Конические трубки (мыть #2, #3, и т.д.) заполнены с 25 мл холодного PBS и трясти, пока нетронутыми склепы изолированы с минимальными мусором и ворсинки.
Примечание: Цель заключается в том, чтобы иметь возможность изолировать чистой дроби с нетронутыми склепы и минимальным мусора. Каждая дополнительная стирка будет очистить клетки, однако слишком много тряски начнут привести к повреждению вторичных ткани/клеток. Кроме того лучшие результаты с наименее загрязнение будет достигаться, если склепы являются покрытием от шага мыть и не от шага реагент диссоциации. - Удалите оставшиеся ткани и центрифуги 50 мл конические трубы на 200 x g 5 минут чтобы удалить супернатант, затем Ресуспензируйте оставшиеся Пелле склеп в меньший объем PBS (5 мл).
- С помощью инвертированного микроскопа, изучите 50 мкл аликвоты каждого образца, чтобы определить количество склепы/дроби. Цель – 50-100 мкл склепы/50, как это будет размер окончательного матрица пирожок.
Примечание: Если образец слишком сконцентрированы, продолжайте добавлять холодной PBS до нужной концентрации. Если образец слишком разреженных, определите количество аликвоты, необходимо достичь желаемого склеп урожайности и отрегулировать. - Аликвота соответствующие тома крипт (определяется аликвота наблюдений) в трубку microcentrifuge. Например, если образец содержит 50 склепы/50 мкл аликвота 50 мкл на Пэтти реплицирует X 3 = 150 мкл / пробки microcentrifuge. Если образец содержит только 25 мкл склепы/50, а затем 2 аликвоты необходимы / Пэтти X 3 реплицирует = 300 мкл/трубки.
- Пелле склепы в 200 g x 5 мин при 4° C.
- Нежно ресуспензируйте гранулированных склепы с соответствующим объемом главный микс (50 мкл на хорошо). Тщательно перемешать, быстро закупорить 15 раз без создания пузырьков воздуха.
Примечание: Предварительно Прохладный наконечник пипетки с холодного стерильного PBS до аспирационных Мастер микс. Это поможет сохранить главный микс от распространения. Советы можно также хранить в холодильнике и помещены в капюшоне непосредственно перед использованием. - Отказаться от 50 мкл мастер смесь плюс капли склеп в центр каждой скважины подогретым 24 хорошо плиты.
- Инкубировать культуры пластина для 30 минут при 37 ° C.
- Наложение каждой матрицы пирожки с 500 мкл / хорошо ИННЦ СМИ (без дополнительных факторов роста требуется в день 0, как они содержатся в наборе мастер).
- Добавьте 500 мкл стерильные PBS в любой неиспользуемых скважин на пластину для поддержания влажности.
- Количество количество покрытием склепы в день 0.
Примечание: Это полезно предварительно сетку, каждая ячейка культуры пластины в квадрантах, чтобы обеспечить более точный подсчет. - Подсчитайте количество enterospheres каждые 24 ч и мониторинг развития enteroid ежедневно.
- Добавление факторов роста для каждого хорошо каждые 48 ч. ИННЦ СМИ каждые 96 h удалить и заменить 500 мкл свежие СМИ (факторы роста должен затем быть добавлен к средствам массовой информации).
Результаты
Полная кишечная ишемия был создан в небольших кишечной петли, используя окклюзии сосудов с швом или зажимы, как показано на рисунке 1. Выпуская зажимы, может выполняться управляемый периода реперфузии, позволяя для дополнительного изучения последующих реперфузионных повреждений при желании. Все животные выжили во время процедуры с минимальными осложнение до эвтаназии. Наиболее распространенным осложнением хирургических был гипотония, который разрешен с добавками положительных инотропным например добутамина.
Если выполнено правильно, ишемического повреждения начнется на кончике кишечных ворсинок и мигрируют вниз в склепе увеличением длительности ишемии (рис. 2). Одна общая ошибка с хирургической техники может произойти когда кровеносные сосуды не лигируют или зажимается равномерно. Результатом является геморрагический ишемии (рис. 3), в котором тонкостенных вен падает до артерии, позволяя для дополнительной крови проникнуть в ткани. Это грубо рассматривается как темный фиолетовый серозных поверхности (рис. 3, слева) по сравнению с светлее поверхности во время полной ишемии (рис. 3, право).
После удаления ишемического кишечной петли кишечные крипты были успешно изолированы после диссоциации протокол (рис. 4). Как и ожидалось, склепы из более сильно поврежденных timepoints часто были сломаны (f; фрагмент) и склеп фракций содержится больше фона сотовой мусора по сравнению с теми, которые прошли без или мягкий повреждение. Во время протокол серьезно раненых кишечника быть поколеблен осторожно, чтобы избежать дополнительного ущерба основной ткани. Пожимая слишком грубо может привести к дальнейшего повреждения склеп и большинство склепы, оседают в DR растворы, содержащие ЭДТА, что приводит к дополнительным нарушения.
После того, как покрытие, склепы со всех точек время ишемии выжить и способны стать создан в культуре (рис. 5). Когда нормальный и слегка поврежденных кишечных склепы покрыты в культуре, enterospheres форму в течение 24-48 ч. С тяжелой ишемического повреждения (ч. 3 и 4) кишечные крипты выжить, но повреждены, что приводит к формированию гораздо меньших сфер изначально. По 72-120 h enteroids становятся все более сложными, с очевидным Центральной люменов и многообещающий структур. В целом является сокращение роста эффективности склепы, а также уменьшение размера enteroids, полученные из сильно поврежденных кишечника ткани (Гонсалес, л.м., неопубликованные данные, 2017).
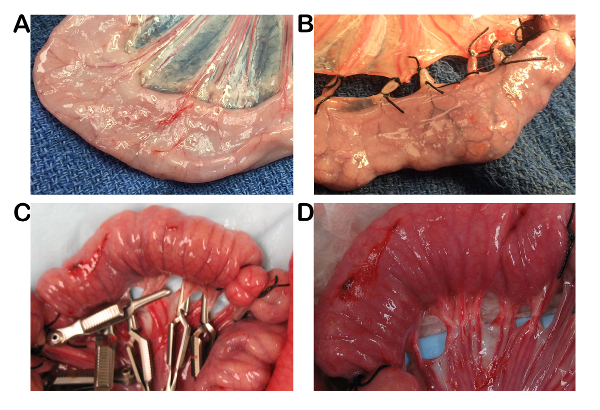
Рисунок 1 : Хирургические модель полного кишечных ишемии в модели свинину. A) нормальный свинину тощей кишки печенке. B) брыжеечных сосудов были лигируют с швом, создавая кишечной ишемией. C) ишемии, созданные с помощью бульдог сосудистых зажимов позволяют для ткани реперфузии, при желании. D) кишечника сосудистую, сразу же после удаления сосудистых зажимов. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
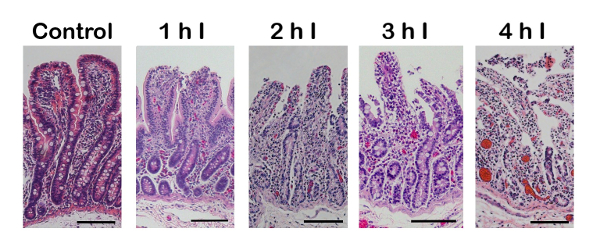
Рисунок 2 : Гистологических доказательств (гематоксилином и эозином (H & E) пятно) увеличения эпителиальных повреждения после более длинней продолжительности полная кишечная ишемия. Повреждение начинает на кончике ворсинок с постепенной потери одноклеточного эпителиального пласта, ворсинок притупления и клеточных повреждений, расширение до склепа базы с тяжелой травмой (до 4 ч. Продолжительность). линейки шкалы 100 мкм. Я = ишемии. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
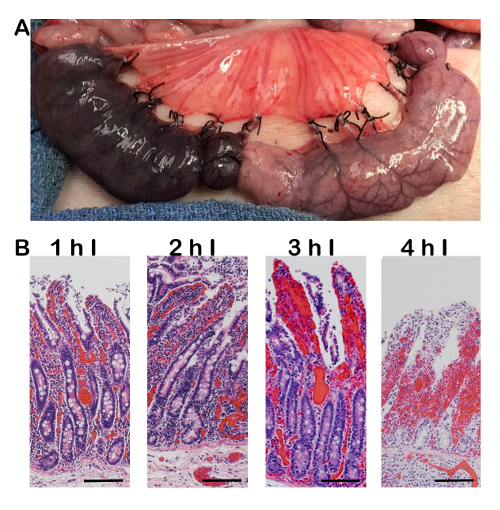
Рисунок 3 : Брутто и гистологических свидетельства о геморрагическом ишемии. A) валового фотография сравнивая геморрагические ишемии (левая петля) и полный ишемии (правый петля). Когда сосудистую не лигируют и не зажат равномерно, кровь может продолжать проникать в ткани, что приводит к дополнительным воспаление и повреждение. B) H & E изображения геморрагические ишемии увеличения продолжительности от 1-4 ч. В дополнение к клеточных повреждений, видели с полным ишемии есть свидетельства инфильтрации красных кровяных клеток в пределах окружающим propria lamina. линейки шкалы 100 мкм. Я = ишемии. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
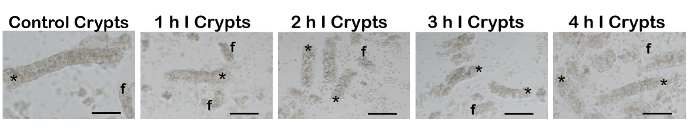
Рисунок 4 : Аликвоты кишечных склепы, изолированных от петли ишемического и нормальных кишечника. Полная, нетронутыми кишечные крипты (звездочки) были успешно изолированы от каждой петли кишечника. Как и ожидалось, склепы из сильно поврежденных время больше очков часто были сломаны (f; фрагмент) и склеп фракций содержится больше фона сотовой мусора по сравнению с теми, которые прошли без или мягкий повреждение. линейки шкалы 100 мкм. Я = ишемии. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 5 : Время курс роста стволовых клеток кишечника после изоляции от ишемического петли тонкой кишки. Когда нормальные кишечные крипты были покрытием в культуре, enterospheres образуется в течение 24-48 ч. С тяжелой ишемического повреждения (ч. 3 и 4) склепы выжить, но первоначально форме гораздо меньших сфер. По 72-120 h enteroids становятся все более сложными, с очевидным Центральной люменов и многообещающий структур. 20 мкм шкала бар, если не указано. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Фактор роста | Разбавитель | Складе концентрация | Складе разрежения | Рабочие разрежения |
| R-Spondin | PBS | 100 X | 100 мкг/мл | 1 мкг/мл |
| Башка | SW/0.1%BSA | 1000 X | 100 мкг/мл | 100 нг/мл |
| EGF | 10 мм уксусной кислоты | 10000 X | 500 мкг/мл | 50 нг/мл |
| A-83-01 | ДМСО | 1000 X | 500 МКМ | 500 Нм |
| SB202190 | ДМСО | 3000 X | 30 мм | 10 МКМ |
| Никотинамид | SW | 1000 X | 1 M | 1 мм |
| Гастрин | PBS | 10000 X | 100 МКМ | 10 Нм |
| Y-27632 | PBS | 1000 X | 10 мм | 10 МКМ |
| LY2157299 | ДМСО | 10000 X | 5 мм | 0,5 МКМ |
| CHIR99021 | PBS | 1000 X | 2.5 мм | 2.5 МКМ |
| Wnt3a | PBS | 2000 X | 200 мкг/мл | 100 нг/мл |
Таблица 1: фактор роста реагент таблицы. Краткое описание фактора роста запасов решений и рабочие решения, используемые в настоящем Протоколе.
Обсуждение
Разработка свинину модели сегментарный кишечной ишемией расширяет предыдущий мышиных моделях, позволяя для изучения нескольких точек времени повреждения тканей в то же самое животное. Есть несколько точек критического обсуждения настоящего Протокола, включая перевязки подходящим сосудом, реперфузия ткани и успешных склеп клеточной культуры.
Перешнуровка подходящим сосудом имеет важное значение для создания модели полной ишемии. Если шов связана неравномерно или зажим не затягивать полностью, кровь из толстостенных артерии могут продолжать вводить в ткани и не может выйти из-за распада тонкостенных вен. Это приводит к кровоподтек крови в lamina propria, вызывая повреждение дополнительные ткани. Однако в зависимости от типа ишемического повреждения изучается, может потребоваться полное или геморрагический ишемии. Например в процессе трансплантации кишечника, кишечника полностью отделена от кровоснабжения (артерии и Вены) на этапе резекции процедуре, которая приводит к полной кишечной ишемией. Кроме того однако, когда брыжейка витой во время события как кишечные заворот, венозный возврат часто затруднен во-первых, приводит к дополнительной крови в ткани перед артериальной поставки препятствовали, таким образом создавая геморрагические ишемии.
Ишемические повреждения приводит повреждения тканей начиная на кончике ворсинок и вниз к основанию склеп3. Во время ишемии энергии в форме аденозинтрифосфата продолжает использоваться и генерирует метаболит гипоксантина. Когда ткань является reperfused с кислородом, гипоксантин становится метаболизируется путем ксантиноксидаза и производит супероксид свободных радикалов приводит к слизистой травмы и привлечение ткани, повредив нейтрофилов17,18. Межвидовые различия в слизистой сосудистой архитектуры, а также различные выражения ксантиноксидаза, привести к той или иной степени реперфузионных повреждений3. Кошек и грызунов модели ишемии-реперфузии более чувствительны к реперфузионных повреждений от реактивнооксигенных метаболитов19,20. В отличие от свиньи были обнаружены меньше ксантиноксидаза и поэтому менее реперфузии травмы, что делает эту модель более сопоставимы с человека кишечной ишемией21. В настоящее время использование нокаут или трансгенных свиного модели для изучения кишечных повреждений не был описан, делая это одним из основных ограничений этой модели. Выбор правильной модели на животных зависит от патологического процесса или конкретных условий исследователь хочет учиться. К примеру свинину модели ишемических повреждений до 6 часов были описаны22, тогда как наиболее ишемического процедуры в мышиных моделях 45-60 мин23.
Успешной изоляции кишечные крипты от нормальных и ишемически поврежденного кишечника позволяет исследование эпителия восстановления в культуре. Эта система позволяет исследователю однозначно сосредоточиться на эпителии только, как есть не кровоснабжения или иммунных клеток компонент для рассмотрения. Это дает возможность изучить взаимодействия эпителиальных клеток и восстановления после травмы помимо ответа на различные факторы роста или лечения, во время операции или следующих склеп изоляции в ведении дополняющего культуры средств массовой информации. Этот шаг остается наиболее сложным, как требует изоляции из сильно поврежденных петель мягкий встряхивания и быстрого удаления растворов ЭДТА содержащих в случае склепов стали преждевременно отделить. Если эти петли кишечника не тщательно промывают, склепы имеют потенциал, чтобы стать загрязненных в культуре. В результате антибиотик противогрибковое решение был добавлен в обоих DR решений помимо СМИ ИННЦ. Еще один момент обсуждения фокусируется на кишечнике, собранные как обычный элемент управления. Как животные проходят анестезии с возможных изменений в системных ткани перфузии, а также возможность распространения воспалительных медиаторов вторичного к ишемии, даже «нормального» управления ткани могут не отражать истинный элемент управления. В этих экспериментах это следует отметить, что ткани управления появился грубо и гистологически сопоставимых ткани от животных, которые не проходят ишемии в других экспериментах (Гонсалес, л.м., неопубликованные данные, 2017).
В целом этот метод описывает воспроизводимые модели свиного кишечного ишемии, моделирующее тесно, что происходит в человека ишемического повреждения. Кроме того, описан изоляции кишечных стволовых клеток от ишемическая петель, который служит для изучения эпителиальных ремонт и возможной реакции на лечение в культуре.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Этот проект был поддержан низ K01OD0199, низ T32 OD011130, низ P30DK034987 и отдел клинических наук распространение фондов
Материалы
| Name | Company | Catalog Number | Comments |
| Phosphate Buffered Saline, Ca2+, Mg 2+ free | Fisher Scientific | BP-399 | Dilute 1:10 |
| Distilled, deionized water (ddH2O) | Used to prepare EDTA and PBS | ||
| Dimethyl Sulfoxide (DMSO) | Thermo Scientific | 20688 | |
| Ethylenediamene tetraacetic acid (EDTA) | Sigma Aldrich | ED45 | Make fresh before each experiment; pH 7.4 |
| 1,4-Dithiothreitol (DTT) | Sigma Aldrich | 646563 | |
| Y-27632 | Sigma Aldrich | Y0503 | |
| Advanced DMEM/F12 | Life Technologies | 12634-010 | |
| N2 Supplement | Life Technologies | 17502-048 | |
| B-27 Supplement | Life Technologies | 12587-010 | |
| HEPES | Life Technologies | 15630-106 | |
| Glutamax | Life Technologies | 35050-061 | |
| Penicillin/Streptomycin/Amphotericin B | Gibco | 15240-096 | Anti-Anti solution |
| Recombinant human Wnt-3a | R & D Systems | 5036 WN/CF | |
| Recombinant human Rspondin1 | R & D Systems | 4645- RS | |
| Recombinant human Noggin | R & D Systems | 6057-NG | |
| Recombinant human EGF | R & D Systems | 236-EG | |
| LY2157299 | SelleckChem | 52230 | |
| CHIR99021 | Cayman Chemical | 13122 | |
| Human [leu]15-Gastrin 1 | Sigma Aldrich | G9145 | |
| SB202190 | Sigma Aldrich | 57067 | |
| A83-01 | Tocris | 2939 | |
| Nicotinamide | Sigma Aldrich | N0636 | |
| Acetic Acid | Sigma Aldrich | 695092 | |
| Water, WFI Quality | Corning, Inc. | 25-055-CM | Referred to as sterile water (SW); for growth factor stocks |
| Bovine Serum Albumin (BSA) | Sigma Aldrich | A2153 | |
| Matrigel Matrix, GFR | Corning, Inc. | 356231 | Phenol red free |
| 24 Well Culture Dish | Corning, Inc. | 3524 | |
| Conical Tube, 50 ml | Corning, Inc. | 430828 | |
| Scalpel Handle | World Precision Instruments | 500236 | |
| Carbon Steel Surgical Blade, No. 10 | World Precision Instruments | 504169 | |
| Tissue Forceps | World Precision Instruments | 15918 | |
| Debakey Tissue Forceps | World Precision Instruments | 501239 | |
| Mayo Scissors | World Precision Instruments | 501752 | Curved or straight |
| Metzenbaum Scissors | World Precision Instruments | 501739 | |
| Mosquito Forceps, Curved | World Precision Instruments | 503724-12 | Curved or straight (503728-12) |
| Hopkins Bulldog Clamp | Stoelting Co. | 52120-40P | Straight |
| Silk, 2-0 | Henry Schein | 685S-BUT | Any similar brand is acceptable |
| Towel Clamps | World Precision Instruments | 501700 | |
| Needle Holder | World Precision Instruments | V503382 | |
| Wire suture, 20 gauge | Henry Schein | 19075 | Cut and straighten before use. |
| Surgical Towels | Henry Schein | ST1833 | Any similar product is acceptable. |
| Lactated Ringers Solution | Henry Schein | 9851 | |
| Chlorhex antiseptic scrub (4%) | Henry Schein | VINV-CHMX-SCRB | Any similar brand is acceptable |
| Isopropyl Alcohol 70% | Henry Schein | MS071HS | Any similar brand is acceptable |
| IV catheter, 22 gauge | Henry Schein | 2225PUR | May need 20g or 24 g depending on size of the vein |
| Xylazine (100 mg/ml) | Henry Schein | 33198 | |
| Ketamine (100 mg/ml) | Henry Schein | 11695-6835-1 | Controlled medication |
| Isoflurane solution | Henry Schein | 10015516 | |
| Pentobarbital (Fatal Plus Euthanasia Solution (390 mg/ml)) | Vortech Pharm. | Multiple brands of Pentobarbital Sodium available. | |
| Heating pad | Gaymar | Tpump Core Warming System; others are available. | |
| Mindray Datascope Monitor | Mindray North America | Any equivalent piece of monitoring equipment acceptable | |
| Vaporizer | Vetland Medical | Recommended to use a Circle System w/ Y piece; multiple suppliers available. | |
| Fluid Pump | Abbott Hospira | Plum A+; Any similar manufacturer is recommended. |
Ссылки
- Eltzschig, H. K., Eckle, T. Ischemia and reperfusion--from mechanism to translation. Nat Med. 17 (11), 1391-1401 (2011).
- Blikslager, A. T. Treatment of gastrointestinal ischemic injury. Vet Clin North Am Equine Pract. 19 (3), 715-727 (2003).
- Gonzalez, L. M., Moeser, A. J., Blikslager, A. T. Animal models of ischemia-reperfusion-induced intestinal injury: progress and promise for translational research. Am J Physiol Gastrointest Liver Physiol. 308 (2), 63-75 (2015).
- Podolsky, D. K. Mucosal immunity and inflammation. V. Innate mechanisms of mucosal defense and repair: the best offense is a good defense. Am J Physiol. 277 (3), 495-499 (1999).
- Collard, C. D., Gelman, S. Pathophysiology, clinical manifestations, and prevention of ischemia-reperfusion injury. Anesthesiology. 94 (6), 1133-1138 (2001).
- Mallick, I. H., Yang, W., Winslet, M. C., Seifalian, A. M. Ischemia-reperfusion injury of the intestine and protective strategies against injury. Dig Dis Sci. 49 (9), 1359-1377 (2004).
- Gonzalez, L. M., Moeser, A. J., Blikslager, A. T. Porcine models of digestive disease: the future of large animal translational research. Transl Res. 166 (1), 12-27 (2015).
- Ziegler, A., Gonzalez, L. M., Blikslager, A. T. Large animal models: The key to translational discovery in digestive disease research. Cell Mol Gastroenterol Hepatol. 2 (6), 716-724 (2016).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Meneses, A. M. C., et al. Intestinal organoids-Current and future applications. Veterinary Sciences. 3 (4), 31 (2016).
- Clevers, H. Modeling development and disease with organoids. Cell. 165 (7), 1586-1597 (2016).
- Mahe, M. M., Sundaram, N., Watson, C. L., Shroyer, N. F., Helmrath, M. A. Establishment of human epithelial enteroids and colonoids from whole tissue and biopsy. J Vis Exp. (97), (2015).
- Dedhia, P. H., Bertaux-Skeirik, N., Zavros, Y., Spence, J. R. Organoid models of human gastrointestinal development and disease. Gastroenterology. 150 (5), 1098-1112 (2016).
- Swindle, M. M., Smith, A. C. . Swine in the Laboratory: Surgery, Anesthesia, Imaging & Experimental Techniques, 3rd Ed. , (2015).
- Riebold, T. W., Geiser, D. R., Goble, D. O. . Large Animal Anesthesia: Principles and Techniques, 2nd Ed. , (1995).
- Parks, D. A., Granger, D. N. Contributions of ischemia and reperfusion to mucosal lesion formation. Am J Physiol. 250 (6), 749-753 (1986).
- Schoenberg, M. H., et al. Involvement of neutrophils in postischaemic damage to the small intestine. Gut. 32 (8), 905-912 (1991).
- Nilsson, U. A., et al. Free radicals and pathogenesis during ischemia and reperfusion of the cat small intestine. Gastroenterology. 106 (3), 629-636 (1994).
- Osborne, D. L., Aw, T. Y., Cepinskas, G., Kvietys, P. R. Development of ischemia/reperfusion tolerance in the rat small intestine. An epithelium-independent event. J Clin Invest. 94 (5), 1910-1918 (1994).
- Blikslager, A. T., Roberts, M. C., Rhoads, J. M., Argenzio, R. A. Is reperfusion injury an important cause of mucosal damage after porcine intestinal ischemia. Surgery. 121 (5), 526-534 (1997).
- Shegarfi, H., et al. Regulation of CCN1 (Cyr61) in a porcine model of intestinal ischemia/reperfusion. Innate Immun. 21 (5), 453-462 (2015).
- Gubernatorova, E. O., Perez-Chanona, E., Koroleva, E. P., Jobin, C., Tumanov, A. V. Murine model of intestinal ischemia-reperfusion injury. J Vis Exp. (111), (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены