Method Article
ショウジョウバエ蛹内炎症性細胞動態の長期的な体内の追跡
要約
ここで体内の高時空間的解像度でライブ イメージングの傷の修復に関連する炎症性応答プロトコルを提案する.このメソッドは、長期的な画像と時間の経過と共に特定の細胞集団の追跡を有効にするショウジョウバエ開発の蛹を利用し、効率的な RNAi による遺伝子の不活性化と互換性が。
要約
組織の損傷を急速な炎症性応答、時に生得の免疫組織の細胞は傷害のサイトにすぐに募集しています。一度、傷を自然免疫系細胞は、感染症と闘う、壊死の破片をクリア、マトリックスの成膜を刺激することなどの基本的な機能の数を実行します。この免疫反応を調節する多彩なシグナル伝達イベントが理解するために複雑の振る舞い (との間に発生する相互作用) を観察することが重要です複数セル血統、体内の高と、リアルタイム時空間的解像度。光の透光性とショウジョウバエの胚の遺伝的トレーサビリティ ライブ イメージに非常に貴重なモデルとしてのショウジョウバエを確立しているし、のメカニズムを含む炎症性細胞の動作の基本的な側面を解剖発達分散、アポトーシスの死体および/または微生物病原体と傷に募集のクリアランス。しかし、最近の作品は-ショウジョウバエ蛹-ショウジョウバエのライフ サイクルの後期に採用数 RNAi の効率を改善する、長い期間、イメージングなどの明確な利点を提供することを示している今、大きい免疫細胞数が大幅に。ここで画像の傷の修復のためのプロトコルとライブのショウジョウバエ蛹の高時空間的解像度に関連付けられている炎症反応について述べる。再上皮化と炎症の両方のダイナミクスに従う、上皮と自然免疫系細胞の生体内特定の蛍光マーカーの数を使用します。また、損傷部位から写真コンバーチブル fluorophores が付いて、楓など、移行の動作を追跡する、特定の免疫細胞サブセットを次のと解決の有効性を示します。
概要
効率的かつ効果的な炎症反応は、感染症と闘うし、がれき、負傷者の組織1の修理調整を行うすべての生物のため極めて重要です。この応答では、ほとんどの組織の損傷の必然的な結果ですが、炎症は厳格な規制を必要とする異なる疾病 (慢性の非治癒の傷を含むさまざまな不適切な炎症性応答をリンクしてありますので過度の瘢痕化とがん素因)1,2,3。この臨床的意義を考えると、それは新しい予後指標と慢性炎症の範囲を扱うための戦略を開発するために炎症性応答を運転の分子・細胞メカニズムの詳細な理解を得ることが重要条件は、修復組織の長引くと不必要な炎症を防ぐ可能性があります。
近年、ショウジョウバエは人間4,5に昆虫から保存された炎症性応答の基本的な特徴を解剖する老舗で、貴重なモデル システムになっています。現時点では、ショウジョウバエを提供 (マウス、ゼブラフィッシュなど)、その他の実験モデルで現在可能であるよりもはるかに大きい遺伝の少ない生体内で正確な時空間的遺伝的操作を許可する (不活化するまたは定義された発達の時点で特定のセル型内で興味の任意の遺伝子表現) とゲノム性スクリーン6,7。伝統的に、創傷治癒やショウジョウバエの炎症のほとんどのライブ イメージング研究において実施されてきた萌芽期の段階、胚、不動 (ショウジョウバエ幼虫または大人) とは異なり、光学的透明ができます。比類のない高分解能生体内でイメージ投射8。これは胚上皮9,を機械的またはレーザ誘起損傷に応答傷口にショウジョウバエ自然免疫系細胞 (血球) の急速な採用を可視化する研究者を許可しています。10,11,12,13,14. 遺伝子操作とこれらのライブ イメージング研究を組み合わせて、ショウジョウバエの胚の研究が多くの重要な免疫細胞のタンパク質を制御する炎症細胞挙動の生体内を発見しました。たとえば、CED 1 相同物ドレイパー (、ITAM ドメインを含むタンパク質) が発見されました重要な '損傷受容体」として、仲介募集ショウジョウバエ免疫細胞 H2O2-のサイトに依存する方法15をに損傷を与えます。免疫細胞内の生地屋のレベルは、カルシウム誘起 JNK シグナル伝達とアポトーシス死体吸収12の下流高架によって規制されて順番。血球運動さらに傷口に向かって指示の移行を調整する複雑な骨格の変更を必要とし、これは蛋白質のアクチン束ファシン16など Rho ファミリーの小さな骨格調節物質の活性に依存して分子量 gtp 結合タンパク質 Rac と Rho9。
ショウジョウバエは、成人17に到達する前の胚に続く追加の幼虫と蛹の段階を通過大人形昆虫です。ショウジョウバエの蛹は様々 な動的細胞イベントが、卵細胞の移行18、細胞分裂19、セル成長20、筋肉などの非侵襲的ライブ イメージングのために追加のモデルとして開発されました。収縮21。最近では、それは傷の修理や炎症体内22,23のダイナミクスを研究するための新たなモデルとして確立されています。
ショウジョウバエ蛹は、胚の段階と同じように、その不透明な蛹の場合18から慎重な郭清後の不動と光学的透明。この光の透過性を活かした、蛹翅22などのショウジョウバエ蛹組織内組織の損傷に対して自然免疫系細胞 (血球) の生体内挙動を従うことができます 1 つ。蛹の翼は翼周辺に接続されている 2 つの大型フラット上皮シートで構成されるシンプルな二重構造として存在します。これらの 2 つの上皮の層間細胞外領域は、体液 (昆虫の血) と運動性血球24の多数でいっぱいです。胚と同様翼上皮に機械的またはレーザ誘起損傷は損傷サイト23に血球の急速な採用をトリガーします。しかし、この蛹は以前の胚の段階でイメージングのためのいくつかの明確な利点を提供しています。負傷した蛹のイメージを作成 (少なくとも 5 h) をはるかに長い期間より多くの組織領域は (複数の傷の生成) など実験的摂動と血球でこのステージ (現在のかなり大きい数があります。改良された統計的検出力の数学の分析中にさらに距離からより多くのセルの軌跡を提供する)。さらに、RNAi による遺伝子不活化の効率が可能にする 'をノックダウン' 組織や胚のより伝統的な変異全体アプローチに比べて時間に固有の方法で多くの遺伝子、蛹の段階でかなり改善します。
傷再上皮化およびこの新しい蛹モデル内でそれに伴う炎症反応のダイナミクスに従う、ために 2 つの異なる細胞集団をラベルする必要があります: 蛹の上皮と (ショウジョウバエ自然免疫系細胞血球)。(材料表) の別のマーカーの数はこれらの 2 つの異なる細胞集団をラベルに使用可能な - マーカーの選択調査される特定のプロセスに依存します。セルの余白、または代わりにを GFP タグ付きの位置を指示する利用定期的に、普遍的に表現された GFP 付けられた E-カドヘリン (アドヘレンスジャンクションのラベル) となる蛹上皮、いずれかを含むショウジョウバエ行をマークするにはアクチン結合ドメイン (つまりアクチン細胞骨格のラベル) モエシン傷エッジ収縮アクチン リングとリーディング エッジの突起部分を可視化します。ショウジョウバエの血液細胞を核 RFP (核の追跡) のため、細胞質の GFP または GFP タグ モエシン (細胞質またはアクチン細胞骨格をそれぞれラベル) へのドライブ式血球固有srp Gal425にラベルを付けるか、蛍光蛍光 (楓) などが使用されます。実際には、核の運動と細胞の形態 (代表的な結果を参照してください) の同時分析を有効にする複数の免疫細胞のマーカーを組み合わせて使用に有利は頻繁。ただし、このプロトコルには、ショウジョウバエ蛹の使用が含まれているので遺伝マーカーの組み合わせだけを実行可能なまでです半ば蛹を利用することができます。また、胚性致死株は適切なできません。これはコントロールをイメージングするとき問題になる可能性は低い (または野生型) 蛹が遺伝子をノックダウンする場合を考慮することが重要ですまたは過剰に発現して、傷口の閉鎖や炎症への影響を評価します。Gal80ts遺伝子ノックダウン (または過剰発現)、によって引き起こされる初期の致死の場合構造は開発の後で Gal4 駆動ノックダウンを誘導するために使用され (の議論を参照してください)。
私たちの最近の研究で蛹の段階に移動させてきた順番傷の新しい詳細を推測する私たちを許可している高度な数理モデルを用いた炎症性の動作を分析するのに十分な免疫細胞移動軌跡データを収集炎症性誘引信号23をです。たとえば、このアプローチが明らかに傷の走化性因子は 200 μ m2最低、以前小さな候補分子 ATP などを推奨するよりもずっと遅いレートで炎症を起こしている組織を徐々 に広がり、H2O2と報告されています。26,27,28,29; を拡散します。これらの小さな「被害」分子が代わりに寛容な信号として機能する可能性があります。また、初期傷から解決し、2 番目 (最初の後様々 な縦長で作られた) にさらされている自然免疫系細胞の長期的な動作に従うことによって明らかにして、どの免疫細胞の間に一時的な '脱' 期間それに続く傷害23に盲目です。蛹のモデルでは、ショウジョウバエの遺伝的少ないとの長期的なイメージングの可能性を悪用によって 1 つはの (だけそれらの免疫の細胞傷のサイトに募集) など特定の免疫細胞群の挙動を従うことができます。蛍光蛍光30免疫細胞系列23内で表現することができますを使用して、後続の侮辱への応答。
ここで傷の修復と生活を使用して高の時空間的解像度で関連する炎症性応答のダイナミクスを可視化するプロトコルについて述べるショウジョウバエ蛹。初期の蛹の準備 (郭清および取付)、その後レーザーによる負傷とタイムラプス イメージングに必要な手順をカバーするための詳細な方法論を提供します。特定の免疫細胞サブセット体内のラベリングを許可する写真コンバーチブル fluorophores の使用についても述べる。長期的に、我々 はこの新しいショウジョウバエ蛹モデルが組織の損傷への炎症性応答の基礎となる複雑なシグナル伝達ダイナミクスを解剖するためのエキサイティングな可能性を開くことを思い描いています。高度な統計解析を適用することで RNAi を効率良くできる内のゲノム広いスクリーニングのアプリケーションにそれ自身を貸すしながらそれ以外の場合実験的アクセスできないまま応答値の特徴の覆いを取るかもしれない 1 つ免疫細胞体内の免疫細胞の挙動を制御する新規プレーヤーを識別します。
プロトコル
このプロトコルは 4 つの主要な一連のステップで構成されています:ショウジョウバエ株とショウジョウバエ蛹のステージング、(2) 蛹郭清と取り付けの準備 (1)、(3) 蛹が負傷した、(4)体内タイムラプス顕微鏡を用いたイメージング。
1.ショウジョウバエ株や蛹のステージングの準備
- 適切なショウジョウバエ株 (導入および材料の表を参照) を取得します。
- 適切な遺伝子型の若い健康な成虫を収集します。
- [大人飛ぶハエを簡単に麻酔する二酸化炭素ガスのパッドを使用して、コレクション バイアルに適切な遺伝子型や性別の転送に罰金絵筆を飛ぶ。
- 標準的なはえの食糧媒体を含む各バイアルに 20 の処女の女性と 20 男性を追加 (コーンミール糖蜜寒天混合材料の表を参照してください) 酵母を添加しました。
- 最適な蛹世代チップ大人のハエ毎日新鮮なバイアルは、25 ° C ですべてのバイアルを維持する新しい食品に
注: 系統特異的遺伝子発現を駆動する Gal4 UAS システム31を使用している場合の手順をすべて行わなければならない 25 ° c 以上、Gal4 UAS システムは温度に敏感。 - スケジュールされたイメージング セッションの前に 18 h バイアル瓶 (すなわち蛹殻形成過程、APF 後 0 h) から少なくとも 10 新しく形成された白い前蛹 (図 1 a) を選択してインテリア バイアル表面から蛹を取り除くため鉗子または罰金エフェクトペイント ブラシ ツールを使用して、きれいな空のプラスチック瓶の側面に蛹を慎重に転送します。
注: 放浪 3rd幼虫クロール上向き蛹; を受ける食品媒体から新しく形成された白い前蛹は、すぼまり前気門を所有している (3rd幼虫) とは異なり、静止するいると簡単に識別されます。キューティクルは、'蛹殻' (蛹の場合) 最初ソフトと白の17であるに変換します。不要な損傷による炎症反応だけでなく重要な発達の遅れにもつながるよう、蛹の損傷を避けるために注意する必要があります。 - 25 ° C でバイアル (APF は最適な結果を与える 18 h) 適切な発達段階に選択した蛹を時代します。
注: 蛹を開発、蛹のケースになります徐々 に暗くより脆性。 - その他の試薬を早めに次のステップに備えます。接着剤、重ね両面テープの全長 20 cm を組み合わせて 50 mL 遠心管中 20 mL ヘプタン ヘプタンをするためには、パラフィン フィルムとベンチに一晩室温でロックとシールします。
2. 準備中とショウジョウバエ蛹の解剖
- 段階的なショウジョウバエ蛹をスライド ガラスにマウントされている両面粘着テープの切れ端に転送します。蛹の位置腹側はテープにしっかりと付着し、背側に上向きに直面している (図 1 b)。
注: 前蛹の識別される蛹ケースの前方の端から突き出た 2 つの気門から。 - その保護囲蛹ケーシングの鉗子、マイクロ剪刀 (図 1 b・ D) を用いた明視野解剖顕微鏡の下でから蛹を慎重に取り外します。
- 当初は、鉗子 (図 1 b) を用いた蛹殻の前方の領域に切開を行います。蛹、蛹の発育初期ケース内で縮小しているためにはこの分野で蛹の場合、中空と蛹の組織を欠いていることを確認します。
- この初期の切開後慎重に涙や蛹の場合は蛹が褐色不透明の脆性筐体 (図 1) から完全に解放されるまで、鉗子または刀 (図 1) を使用して後方に、前方で開いているカットします。
注: この段階で蛹は非常に壊れやすい、蛹の表面を刺さないように注意する必要があります。穿刺は明白な体液はすぐに穿刺部位から漏れ出すです。パンク、しかし小さいと蛹を破棄しなければなりません。
- ヘプタンの接着剤を使用してガラス底皿に蛹をマウントします。
- 20 mL のピペット チップを使用すると、ガラス底皿の上の行に事前に用意されたヘプタン接着剤 (セクション 1.6 上記参照) の 10 mL のドロップを配置します。
- 5 乾燥して接着剤を許可する鉗子 (図 1E) を用いたヘプタン接着剤の上に慎重に解剖の蛹を転送する前に s。
- 負傷とイメージングの容易にするため、蛹に並んで行;約 5 蛹が提案されているが、詳細は経験を持つ管理されます。
メモ: ヘプタン接着剤の使用は直立したイメージング システムを使用してお勧めしますが逆システムを使用している場合は不要。光学接着剤を作成する場合、coverglass に直接イメージング、蛹の時に収差を代わりに配置できます-蛹の組織とガラスの自然な接着が安定した画像は、ほとんどの場合十分なイメージングを移動するときは注意がいる限り顕微鏡を皿します。
- 最高の結果を得るには、翼は翼表面の大半とこしたフラット coverglass (図 1 階) との直接接触で蛹をマウントします。翼が正しくマウントされていることを確認する自分の位置を変更する鉗子を使用して蛹をロールバックします。
- サンプル画像の期間中に脱水を防ぐためには、(図 1E) 蛹の邪魔にならないように注意しながら取り付けの終わりにガラス底皿の側に蒸留水に浸した脱脂綿のフィルター紙の部分を追加します。ふたが付いている皿をカバーします。
注: 蛹は負傷とイメージングする準備が整いました。
3 ショウジョウバエ蛹翼の負傷レーザー誘起
- 波長可変レーザー アブレーション システムを搭載した広視野顕微鏡にマウントされた蛹を含むガラス底皿に転送します。
- 使用パルス UV 空冷窒素励起アブレーション レーザー調整 435 nm の – 詳細11;材料の表を参照してください照明用光源の発振波長の精密は、適切な色素細胞を介してユーザーによって選択されます。
- 検索する最初の蛹の蛹の翼に顕微鏡ステージ コントロールを調整明視野光学系を用いた (図 1 f) が負傷。
- 最適な結果を得るには、両方のイメージングのためオイル 40 X または 63 X は水浸対物レンズを使用し、レーザーアブレーション;使用する浸漬液 (油またはグリセロール) はアブレーションやイメージング システム間での一貫性を確認します。ガラス基板 (すなわち負傷する上皮の領域にフォーカス) に最も近い蛹翅上皮の平面に焦点を当てるために、顕微鏡の調整細かいフォーカス コントロールつまみを使用して。
- 顕微鏡ステージの調整を使用すると、負傷する領域が直接アブレーション レーザーの既知のターゲット領域と揃うように蛹翅を位置します。
- アブレーション光の電力レベルを手動で調整するのにには、顕微鏡に装着エネルギー密度減衰器スライドを使用します。
注: 減衰スライダーはクリック ストップと相対的なレベルの減衰量を特定し、再現性の設定の使用を許可する判決。 - 外部手動トリガーコントロールを使用すると、トリガーの 1 回の簡単なクリックを使用して傷をするアブレーション レーザーをアクティブにします。それをチェック アブレーション サイトで一時的な気泡の外観の負傷は通常添付されますので。レーザー誘起負傷されているかどうか蛹の上皮を視覚化する適切な蛍光フィルターを使用して成功を確認します。
注: ビーム反射や皮膚障害が厳しい目を生じることができるレーザ光線への偶発的な暴露を避けるために注意してください。 - 負傷したが成功した場合 (現在の焦点のレベルの上下にかかわらず若干顕微鏡フォーカスを移動) 焦点面を変更し、アブレーション トリガーの 1 回のクリックを繰り返します。また、望ましい創傷サイズが達成されるまで減衰器スライドを使用してレーザー パワーが徐々 に増加します。
- リアのコントロール パネルの繰り返しノブを使ってアブレーション レーザー パルスの繰り返し周波数を変化させる (より小さい 1 パルス/秒から速度を変更する 60 Hz)。最適な負傷のパルス繰り返し周波数を 40 Hz に設定します。
- 別のサイズの傷を生成するのにには、手動でアブレーション光パワーレベルを調整するのにエネルギー密度減衰器スライドを使用します。
- すべてのマウントの蛹が負傷した控えるし、無傷のコントロールとしてこれらの非アブレーションの蛹を使用します。
- 一貫性のある結果 (関連する取扱説明書を使用して) レーザーアブレーション システムを定期的に再編成します。また、クリーニングし、レーザー出力波長を制御する色素共振器電池を補充します。
4.体内タイムラプス顕微鏡を用いたイメージング
- タイムラプス イメージングのための適切な顕微鏡にガラス底皿をすばやく転送します。
注: 最適な結果を得るのためには、高仕様共焦点または GFP と mCherry の両方の蛍光物質を検出できる検出器を搭載した回転ディスク顕微鏡を使用します。 - 全体の蛹の翼をイメージ、低倍率 (例: 20 X) 対物レンズ (図 2 a) を使用します。傷のイメージの修復や高空間解像度とそれに伴う炎症反応のために使用油浸漬 40 X (NA 1.3) または (図 2B-Dの代表的な画像を参照) (NA 1.4) 対物レンズ × 63。
- 顕微鏡に関連付けられている適切なイメージ キャプチャ ソフトウェアを開きます。
- イメージ キャプチャ ソフトウェアを使用して、適切なレーザーなど488 nm とそれぞれ (関連するボックスをクリック) によって GFP と mCherry の同時を視覚化とレーザー パワーを調整ゲイン/オフセットを与えるため設定して 561 nm のレーザーをオンに十分な蛍光信号ピクセルの彩度を避けながら退色と光毒性を最小限にする (5-20% の範囲) の最低の可能なレーザー パワーを使用します。
- 両方修理をキャプチャする上皮と炎症性細胞の動員、設定コントロール パネルの微小焦点調整ノブを使用して z を記録する顕微鏡最適な結果を得るには、ソフトウェアを設定 (手動ボタン クリックを使用して) (すべて 3 mm 最小)、蛹を経てレコード z スライスする (移行血球を含んでいる) の下に細胞外スペースにによって負傷した上皮の上から大規模な達成するために(50 〜 100 ミリメートルの範囲) で z スタック。
- タイムラプス イメージングの定期的な間隔で z スタックを記録 (最小あらゆる 30 s) 少なくとも 1 h の後負傷のため。
注: z スタック選択間の正確な時間間隔は、急速に変化する細胞動態をキャプチャとサンプルの写真漂白を避けることのトレードオフを表します。 - 同時に複数の蛹 (非アブレーションかん水コントロールを含む) のイメージは、(顕微鏡に接続) 電動ステージとイメージング ソフトウェアの内で利用できるマルチ ポジション獲得機能を使用します。ステージ位置制御ノブを使用してソフトウェアのそれぞれの個々 の蛹の位置を手動で設定し、それぞれの個々 の蛹の適切な z スタック制限 (上部と下部) を手動で設定。
- Z スタック投射または 3-D レンダリングを使用してコマ撮り画像画像キャプチャの実行中または後専門画像解析ソフト (ImageJ32) などで可視化します。たとえば、各血球の動きに従うこと (図 2'のように、 D')、オープン アクセス ImageJ プラグイン"TrackMate"または「手動トラッキング」( 33,の公開されたメソッドを使用してトラック血球核34)。
- 選択的に photoconvert (楓30) などの蛍光プローブを使用し、イメージ投射の間上皮や免疫細胞のサブセットをラベルします。
- 光変換を実行するイメージング ソフトウェア内で適切なモジュールを開く (FRAP、光退色後蛍光回復などモジュール) 405 nm レーザー (関連するソフトウェア ボックスで] をクリック) で35をアクティブにします。
- 正方形、円形またはフリーハンド選択ツールを使用して FRAP ソフトウェア内で photoconverted をするセルを選択します。FRAP ソフトウェア内で 1 つのイテレーション/フレーム光電 (漂白) の時間経過を設定し、20% レーザー パワーで 405 nm レーザーします。手動で光変換を実行する実験を開始をクリックします。
- FRAP モジュール (閉じるをクリック) を終了し、ソフトウェア内で元画像の画面に戻ります使用、488 nm と z と上記のコマ撮り録画を設定して photoconverted と非 photoconverted のセルの動作をイメージする 561 nm のレーザーです。
注: Photoconverted プローブは、(少なくとも 5 時間) の期間の後に photoconverted セルの動作を有効にする最初の光電後何時間も安定しています。たとえば、傷に炎症性細胞が選択的に photoconverted (図 2 f) することができます、彼らの行動は後から損傷部位 (図 2 と H) を解決するとき。
結果
このプロトコルでは、傷の修理や炎症の生体内でライブのタイムラプス イメージングのショウジョウバエ蛹の準備について説明します。このメソッドを使用して、それは簡単に蛹の傷口の閉鎖および炎症性細胞の動員の複数の高解像度ムービーを生成し、重要な退色せず負傷後長い時間の期間 (少なくとも 5 h) の蛹をイメージできるはずです。
ショウジョウバエの蛹の準備のための一般的な方式
図 1は、生体内イメージングのためのショウジョウバエ蛹を準備するための最適な方法を示しています。ショウジョウバエ白 '前蛹' '0 h' で終了後に回収蛹殻形成過程 (APF) クロール幼虫運動を中止し、ステレオタイプの蛹の形状を採用、落葉呼吸肢 (気門) に前方の一番端 (表示図 1 a)。白 0 h APF 前蛹、蛹の殻になったその時点で茶色 (図 1 b) とは、解剖微細鉗子や刀 (図 1、蛹の保護ケースを削除する) を使用して、25 ° C で 18 h を開発する許可を明らかにする、(図 1) 内光半透明の蛹。次の郭清、蛹の翼は (青、図 1-Dのアウトライン) 蛹胸郭の横側に表示されます。この段階で他の蛹の体の部分が簡単に見分けられる、目、足、腹部 (図 1のラベル付き) なども。足も傷炎症研究に適しており上記同じレーザー法による負傷することができます。複数の 18 h APF 蛹搭載できます同時に (図 1E、脱水を抑えるヘプタン接着剤や水に浸したろ紙を使用して) イメージング皿内 coverslip (と接触して翼 (輪郭を描かれた青) のフラットな部分図 1 階);これは 1 つの単一画像の期間中に記録されるいくつかの蛹を許可するように電動ステージを装備、イメージングを用いた場合に特に便利です。郭清または取り付け中に破損されている蛹は破棄しなければなりません (、 1E を図の矢印の順番は 3 番目に位置する例えばサナギ)。その他、ボディパーツ (例えば目と脚、輪郭を描かれたピンク)、coverslip また連絡と負傷のため利用可能なとその後 (図 1F) をイメージングします。実験単一の傷を勉強して、レーザー誘起損害が生じた一般的に最高中央翼 (アスタリスク、図 1 階)、複数の傷を検討する場合、他の場所を使用できます。
ショウジョウバエ蛹翅の堅牢な炎症反応をアクティブに滅菌が負傷しました。
傷の修復や、それに伴う炎症性応答生体内で18 h APFショウジョウバエ蛹の傷ついた翼に従うために、共焦点微速度顕微鏡観察 (図 2 a-H) を使用してをイメージしました。この蛹の段階で翼上皮が (ここでラベル翼縁を図 2 aに記載されている個々 のセルの境界をマークする E-カドヘリンの GFP タグを使用) セルの簡単なフラット シートです。でも無傷の翼 (低倍率、 2 a と 2 a の数字 ')、体液 (内 (血球、 srp Gal4緑、細胞質の GFP を駆動を使用してラベル付けと核 RFP、マゼンタ) 渡り鳥の生得の免疫細胞の数が多いにあります。昆虫の血) 介在細胞外スペースを占める (図 2 aと2 a ')。蛹翅上皮 (傷余白に白抜き、図 2 bD) レーザー誘起損傷傷のサイト (図 2 b-Dおよび図 2 bに免疫細胞核に血球の急速な移行を刺激します。'-D')。両方で血球をラベリング核マーカー (例えば「赤針」の核の RFP) の組み合わせで細胞質や細胞骨格のマーカー (例えば細胞質 GFP または GFP タグ モエシン) です特に有利であることができます、(血球挙動など移行速度と方向の自動解析) の核を血球と血球形態の可視化同時追跡。後者は重要な血液細胞が壊死を phagocytosing いるかどうかを決定することができます (図 2、インセット) 傷のエッジ (または微生物感染の場合)12,23と私たちに従うことができますその前方の動作として細かい糸状またはその前縁ケラトサイトに向かってまたは離れて傷と移行します。
単純な適切な画像解析ソフトウェア32を用いた血球核軌跡の追跡 (材料表) を示します炎症反応, は既報と同様の複雑な時空間的ダイナミクス胚9,36を負傷 (マルチカラー トラック、図 2' とD')。血液細胞傷害のサイトに最も近い位置が傷口に向かって向移行を開始負傷のちょうど 30 分以内 (図 2')。ただし、受傷後時間とともに、徐々 に位置する血球さらに損傷部位からも監督の移行を開始傷口に向かって (図 2 D')。この方法では傷の端から外側に広がる免疫細胞応答の '波' がみられ、損傷部位から傷の走化性因子の拡散を反映するように私たちを想像します。これらの免疫細胞の時空間的ダイナミクス傷誘引信号 (詳細なメソッドの新規プロパティを推論する高度な数学的モデリング (ベイズ推論) 分析を採用当社の最近の研究のための有用な出発点を提供します。23年出版)。私たちの軌跡、血球から傷誘引物質の詳細な特徴を抽出 1 つでした,生体内で免疫軌道に合わせて (血球バイアスに傷誘引グラデーションをリンク) いる私たちの計算モデルを調整しています。(信号の拡散率、ソース信号の生産の期間など) データ23。
また、 srp Gal4 (緑、図 2 e) 我々 はまた選択的に (など、これら渡り鳥翼血液細胞の亜集団にラベルを付けることができた免疫細胞系譜内光変換蛍光楓の式を駆動することによって傷のサイトに採用された者UV 誘起光電および F の前に、の E ポスト光電)。我々 と傷のサイト (矢印、図 2とH) からを解決するどのように彼らの行動はそれらの非 photoconverted から別の比較 (マゼンタ、図 2-H) 時間をかけてこれらの血液細胞の挙動を従うことができます。細胞傷害のサイトに到達しません。傷初期に募集血球が生成された 2 番目の傷口に鈍感一時的にことを示すこの体内標識法を使いましたが、この差分のラベリング手法も、90 分後の23、(ディスカッションを参照してください)、将来的に他の多くの洞察力に富んだアプリケーションがあります。
このアプローチを使用して、我々 は、同時に傷の修復やしている epithelialisation の時空間的ダイナミクスを従うことができます ' (図 2 bD)。ここ普遍的表現 GFP タグ E-カドヘリンは細胞アドヘレンスジャンクション翼上皮全体をラベルし、により、時間の経過の後に個々 の上皮細胞の形状。傷の端はそのまま GFP 標識の上皮細胞とラベルのない破片 (白破線、図 2 b-D) 間の接合として簡単に識別されます。傷の大半、傷は傷害と傷の端の進歩内側 (図 2 D); の 1 h 以内再上皮を開始します。このサイズの傷は損傷23の 2-3 時間以内通常治るでしょう。胚および蛹での創傷閉鎖が一緒にリーディング エッジのアクチンの豊富な糸状の23,37; アクトミオシン収縮ケーブルによって駆動されます。これらの細胞骨格のダイナミクスは、生体内で適切な記者では、GFP タグ キンシウリ (ミオシン調節軽鎖) または GFP 付けられたアクチン結合モエシン23などを使用して傷の修復中に直接視覚化できます。いくつかの特に大きい傷のためしかし、アクトミオシン ケーブルと先端の突起を保持しない - これらの傷 '慢性' となって、はるかに長い期間 (以上 24 h)生体内での後でさえも決して完全に再上皮23イメージング。興味深いことに、これらの創傷に関連付けられている炎症反応が著しく異なる関連付けられて通常急性傷23異常免疫細胞の挙動はクリニックの有用な予後マーカーでされる可能性を示唆しています。.さらに将来的には蛹のモデルにおける長期的な画像 (24 時間以上) を用いた慢性創傷の生体内解析可能性がありますこの衰弱状態の重要な機械論的洞察を提供します。
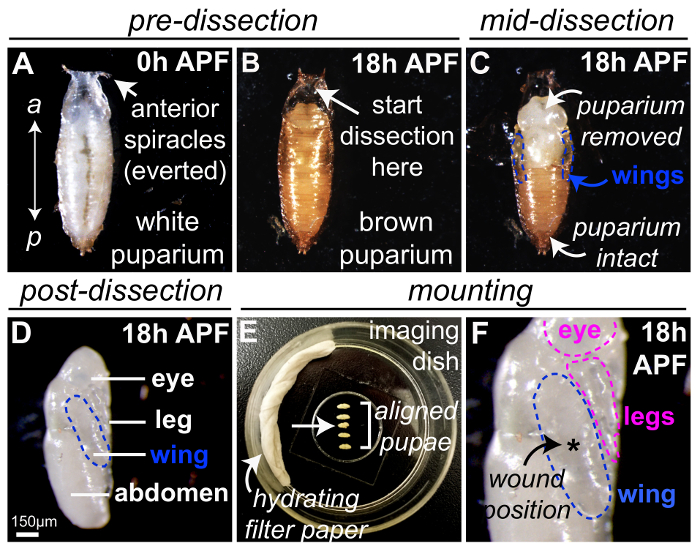
図 1:ショウジョウバエ蛹準備が負傷したとライブ イメージング。(気門) の付属肢を呼吸を落葉によって示される (A)ショウジョウバエ0 h APF、前方で白い前蛹が収集しました。(B) 25 ° C で 18 h の白 0 h APF 前蛹を調達後、蛹の殻が茶色表示されます。蛹の場合の郭清は適切な蛹は欠席、すぼまりの気門によって示されるほとんど前方地域 (矢印) から開始されますからこの地域、及び微細鉗子刀蛹の保護ケース (C) を削除するために使用します。蛹の翼は (青枠) の蛹の胸郭の横側に表示されます。(D) 蛹した完全に APF 蛹 18 h から削除される、ここで蛹ロールバックされている翼のイメージを作成する側を 90 ° 青のアウトラインします。(E ・ F)5 18 h APF 蛹は脱水 (E) を最小限に抑えるために水に浸したろ紙をヘプタンの接着剤を使用して料理を画像内にあるガラス基板にマウントされています。蛹の準備中に損傷が発生したシーケンス (矢印) である三番目を破棄しなければなりません。蛹が搭載される coverslip (F) と接触して翼 (輪郭を描かれた青) の平坦部分と複数の傷がある場合、他の場所を使用できますが、翼 (アスタリスク、 F) で集中的にレーザー誘起傷が生成されます。検討します。ウィーバーズet al., 201623から権限を持つ適応 (D) の画像。この図の拡大版を表示するのにはここをクリックしてください。
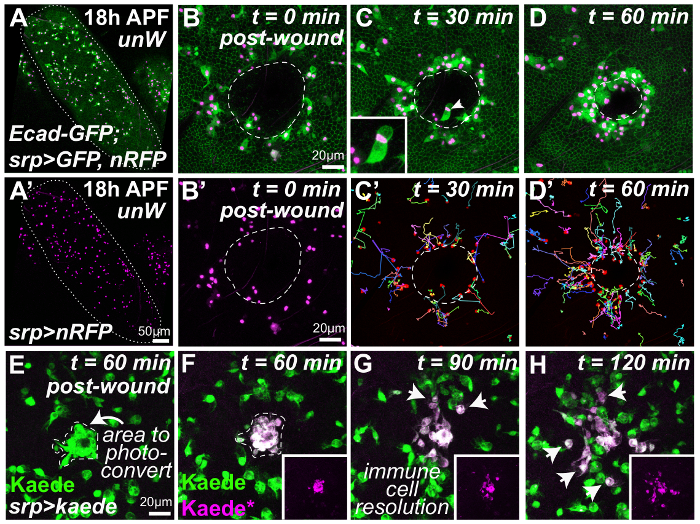
図 2: 動的体内分析組織の損傷への炎症性応答の。蛹蛹の保護ケースから解剖し、ガラス基板 (A) にマウントされている負傷しているし、その後共微速度顕微鏡観察 (B H) を使用してイメージを作成します。無傷の蛹翅の倍率表示を低 (A白で縁取られた翼マージン) 渡り鳥血球の数が多いを含む (A')。レーザ誘起損傷蛹翅上皮 (B ・ Dセルの境界標識 GFP 付けられたショウジョウバエの E-カドヘリンを使用して; 白で縁取られた余白の傷) 複数の血球 (の移行と急激な炎症反応をアクティブにsrp Gal4グリーン、マゼンタ、および細胞質の GFP 核 RFP 発現を駆動) (B D; 各フレームが 25 スライス 3 μ m の射影であるコマ撮りムービーから代表的なフレーム) 傷のサイトへ。血球の軌跡の追跡 (マルチカラー トラックC' 、 D') 負傷した胚の報告炎症性応答と同様の複雑な時空間的ダイナミクスを示します。血球も貪食細胞壊死傷のサイトで (矢印、 Cもはめ込みと)。免疫細胞の血統 (緑、 E、 srp Gal4を使用) で光変換蛍光楓の式により傷募集 (矢印、 E) 血球特異的 (マゼンタ、 F) をラベルし、続いて時間をかけて彼らは傷害のサイト (矢印、 GおよびH) から解決します。次の遺伝子型の蛹が活かされて: (A ~ D) w1118;ユービーアイ ・ デ ・ cad GFP srp Gal4 > UAS-GFP(II);UAS-nRFP(III)と(E H) w1118; srp-Gal4(II);UAS-Kaede(III)。ウィーバーズet al., 201623から許可を適応した画像。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
組織損傷に対する急性の炎症反応は、壊死と感染症との闘いのクリアランスを含む負傷した組織の修復を調整するために必要な複雑な非常にダイナミックなプロセスです。完全に理解し、この応答の基本的な側面を解明、それは実行される生体内で正確な動作のためには 3次元生体試料の研究は、様々 な相互作用細胞系統の続くことに関与する重要正確に時間をかけて。これらの細胞動態のリアルタイム解析では、古典的な免疫組織化学的手法を用いた固定サンプルから静的単一の時間ポイントより突然変異体の表現型のより詳細な特性をことができます。伝統的に、扱いやすい遺伝子ショウジョウバエモデルを用いたライブ イメージング研究のほとんどは光学透明化後発達段階4と比較して不動 fruitfly 開発の初期段階を使用しています。,5ただし、最近では私達のグループと他の人を開発したショウジョウバエ蛹高分解能と同時に傷の修復や炎症の長期的なイメージングを実行する新しいモデルとして生体内で8,22。 ,23。この新たなアプローチは炎症細胞挙動の解明の基礎のためのエキサイティングな長期的な可能性を提供しています、(ショウジョウバエ脂肪細胞など他の細胞系譜の動的挙動を調査にさらに適応することができます。38) 組織の損傷に続きます。
準備およびイメージ投射上記撮像結果の品質を決定する負傷のショウジョウバエ蛹の中にいくつかの重要な要因があります。間違いなく記載されているプロトコルの最も困難なステップは慎重な郭清や負傷とイメージング前蛹の精密位置決め。この発達段階では蛹が非常に壊れやすいと準備段階で蛹にもマイナーな損傷は実験; を大きく低下する可能性このダメージで他の場所での炎症性細胞行動のより広まった (またはも全身) 効果につながる可能性があります独自の炎症性応答を有効にできるので、実験から意図しないダメージをこうむっている可能性があります任意の蛹を破棄しなければなりません。蛹。(これは大人のために組織を準備する重要な組織再編成を受けている) これらの実験で利用した蛹の継続的な発展のため時折蛹に画像の中に移動されます。蛹の圧延は、しかし、蛹マウントされていない正しく翼 (またはイメージを作成する他の組織) のフラットな表面と coverglass; が付いている直接接触の場合に発生する可能性が高いカバーガラスに蛹を安定させるためにヘプタン接着剤の使用は、この望ましくない動きを最小にするべき。細心の注意は、このため、顕微鏡; 間サンプルを移動する場合、慎重に整列位置から蛹を外れを避けるためにも撮影する必要があります。理想的には、負傷のレーザーは、後続のタイムラプス イメージングと光電変換に使用する同じ顕微鏡にアタッチされます。
蛹の郭清と取り付け手順の能力に加えて使用されるショウジョウバエ蛹の正確な遺伝子型は生成された画像データの品質に大きな影響いるだろうたとえば、 Gal4ドライバーと UAS の構造 (例えばUA GFP または UA 楓) 個々 の蛹遺伝子内のコピーの数はその後イメージング中に信号対雑音比を決定します。一般的なルールとしてGal4やUAのより多くのコピーは組織内の蛍光蛋白質 (例えばGFP または楓) の合計レベル現在より大きいを構築します。蛍光タンパク質の最適なレベル、ただし、なります高品質イメージング (低いレーザー力、退色の減少の使用の有効化と拡張時間をかけて画像を許可するのに十分な昇降組織蛍光の注意深いバランス期間) が蛍光体による細胞毒性を引き起こすことがなく各実験で Gal4 と UAS の構造の最適な数は、特定のドライバーと使用されている蛍光物質によって異なります。Gal4 UAS システムは温度に敏感な低温度31で有効になりますので、25 ° C で (または上、29 ° C) 蛹を高めるために注意する必要があります。組織制御の追加レベルまたはGal4 -駆動式の特異性の時間を達成するために Gal4 UAS システム リプレッサー Gal80 で蛹遺伝子型39に含まれてことができます。Gal80 は Gal4 活動 (組織特異 Gal80 を使用して) 特定の組織内または特定の時点を抑制するどちらか使用できます (温度を使用して機密性の高い Gal80)。Gal4 UAS システムは、複数の構成 (例えばfluorophores が付いて、RNAi ラインは、ショウジョウバエを生成する (LexA-lexAopと QF-擬システム) などの他の独立したバイナリ システムとさらに組み合わせることができます。または、その他の遺伝的構成要素) 同時に異なったティッシュ39の範囲で表されます。
この新しいショウジョウバエ蛹モデルの使用より伝統的な胚アプローチ上の利点が提供しています。(3 h) まで短期の画像と比較して段階 15 の胚 (最も研究が負傷した萌芽期の段階、実行されます) で使用可能な蛹 (成人期蛹の発育の 96 時間後までの時間のかなり長い期間にわたってイメージを作成することができます).また、血球 (ショウジョウバエ自然免疫系細胞) のはるかに大きい数字は、蛹の組織内に存在 (とイメージングの利用) はより限られた胚の中に存在する比較してこれは集めることができましたはるか同じ総標本数を用いた血球性状に関するデータをイメージングします。重大に、順番ができました血球挙動を分析・傷誘引物質とされていたであろう実験的炎症反応の新しい特徴を抽出するより高度な数学的モデリングを適用するにはアクセスできない23。蛹のモデルの別の利点は、RNAi による遺伝子ノックダウンは、組織またはバイナリ システム Gal4 UAS システムなどを使用して時間特異的遺伝子不活化の改良分析前胚の段階よりもはるかに効率的39します。 この段階で RNAi の効率は従って大規模な (またはも公平なゲノム) を実行する可能性を開きます RNAi スクリーン創傷または炎症性細胞の挙動に関連する新規のプレイヤーを検索します。
ただし、ショウジョウバエ蛹明確に使用できません研究の表現型の胚は、遺伝子の突然変異に起因する致命的であります。時刻またはティッシュ特定の方法での RNAi による遺伝子ノックダウンが開発して蛹の段階に発生することを許可しない限り、胚で、萌芽期の開発に不可欠な遺伝子の機能とライブ イメージングの研究を実行したがって、まだ必要があります。胎児も勉強する選択肢とライブ画像のモデルのまま免疫細胞行動、その起源から免疫細胞の発達の散布、歩行の接触阻害とアポトーシス死体の貪食能などの特定の機能蛹のモデルでみられていない5,8を彫刻発達の組織の中に生成されます。ショウジョウバエの幼虫と大人の研究は傷の修理や炎症40,41,42,43,機構の重要な洞察を提供しているがこれらの段階で44ライブ イメージング研究サンプルの性質上本質的にモバイル難しいと判明しました。幼虫は、ライブ イメージングの短い期間を許可するように麻酔することができます、間麻酔の一時的な性質のため短いスナップショットのみライブの傷の修復または炎症反応の可視化45をすることができます。最近の研究は今準備およびまだイメージ投射の胚または蛹よりもはるかに困難なまま幼虫の創傷治癒の46, 長期的なイメージングを可能にする改善されたプロトコルを開発しました。長期的に各具体的な質問、これら異なるショウジョウバエのステージ - (それぞれ大人に幼虫と蛹の期間を通じて胚からのすべての 4 つの研究に対処するための最も適切な発達段階を用いたことを思い描いてください。独自のユニークな利点と制限) を - 傷の修復と炎症の分子・細胞メカニズムに相補的な洞察力を提供します。
将来的にこのプロトコルおよびショウジョウバエ蛹の長期的なイメージングの炎症関連現象の範囲を研究するために容易に適応することができ、炎症性傷害応答の暴く小説機能の広範囲に及ぶ可能性があります。生得の免疫細胞現象のダイナミクスを理解するための大きな価値の一緒に蛍光発光する蛍光剤 (楓) などのアプリケーションの長期的なイメージングの組み合わせがあり、特に、ずっとより少なく理解される解決フェーズ傷の炎症性応答。具体的には個人または (それら傷を採用) などの免疫細胞の集団の分類によって (死体、傷害など) 1 つの環境のキューへの暴露が免疫細胞の後にその後の対応をどのように影響するかを分析することが可能であろうキュー。以前の経験によるショウジョウバエの血液細胞の炎症性の動作を変更できます - たとえば、彼らが開発12中にアポトーシス死体の事前貪食によって組織の損傷に対応する先読みが気になります。かどうか他の環境手がかりは、同様のプライミング イベントを誘発します。蛹傷、これまでの研究は、自然免疫炎症反応に焦点を当てている、蛹翅モデルでは、また両方のライブ イメージする理想的な機会を提供します、上皮の傷の修復のメカニズムを解剖します。また、この蛹のイメージング法は、組織損傷38、蛹の翼自体または (目、足胸郭など) その他の簡単にアクセスできる蛹組織への応答の他の細胞系譜の動的挙動を調査に適応することができます。最後に、ショウジョウバエの遺伝の少ない長期蛹画像の使いやすさと組み合わせることで、新規上皮修復または炎症性規制されない可能性があります公平なゲノムワイド ノックダウンのアプリケーションをカバー近づきます。
開示事項
著者は、彼らは競合する利害の衝突があるを宣言します。
謝辞
マーティン、Nobes、リチャードソン、役に立つ議論のため木製のラボのメンバーに感謝したいと思います。我々 もウォルフソン バイオ イメージング施設 (ブリストル大学、英国)、ブルーミントン在庫センター (インディアナ大学、米国) とウィーンショウジョウバエリソース センター (ショウジョウバエ株式) と (最新ショウジョウバエの Flybase に感謝します。遺伝子アノテーション)。この作業は午後に MRC プロジェクト助成金によって支えられたと大戦 (氏/J002577/1) 大戦に、ウェルカム信頼のシニア親睦と午後に、ウェルカム信頼の奨励賞。
資料
| Name | Company | Catalog Number | Comments |
| Drosophila stocks | |||
| ubiquitous GFP-tagged E-cadherin ;Ubi-p63E-shg.GFP; (chrII) | Kyoto Stock Center, DGRC | #109007 | Ubi-p63E promoter sequences drive expression of Drosophila E-cadherin (shotgun) tagged at the C-terminal end with GFP. |
| ubiquitous GFP-tagged E-cadherin ;;Ubi-p63E-shg.GFP (III) | Bloomington Drosophila Stock Centre (Indiana University) | #58742 | Ubi-p63E promoter sequences drive expression of Drosophila E-cadherin (shotgun) tagged at the C-terminal end with GFP. |
| ubiquitous GFP-tagged Moesin P{sGMCA}3.1 | Bloomington Drosophila Stock Centre (Indiana University) | #59023 | The ubiquitously expressed sqh promoter/enhancer drives expression of a fragment of Moesin (that includes the actin binding sequences) tagged with GFPS65T. |
| hemocyte specific serpent-Gal4 driver ;srp-Gal4; | Generated by Katja Bruckner | Generated by Katja Bruckner | Expression of Scer\GAL4 fused to a polyA tail is under the control of 2 genomic sequences from upstream of Drosophila serpent. Ref: Brückner, K., Kockel, L., Duchek, P., Luque, C.M., Rørth, P., Perrimon, N. The PDGF/VEGF receptor controls blood cell survival in Drosophila. Dev Cell. 7 (1), 73–84, doi: 10.1016/j.devcel.2004.06.007 (2004). |
| UAS-nuclearRFP w1118;;P{UAS-RedStinger}6 | Bloomington Drosophila Stock Centre (Indiana University) | #8545 or #8547 | UAS regulatory sequences drive expression of the DsRed.T4 form of RFP which is tagged at the C-terminal end with a nuclear localisation signal |
| UAS-cytoplasmicGFP ;;P{UAS-GFP.S65T} | Bloomington Drosophila Stock Centre (Indiana University) | Multiple stocks available (e.g. #1522) | Expression of the S65T version of GFP by UAS regulatory sequences; the S65T variant exhibits increased brightness. |
| UAS-photoconvertibleKaede w1118;; P{UAS-Kaede.A}3 | Bloomington Drosophila Stock Centre (Indiana University) | #26161 | Kaede protein emits bright green fluorescence after synthesis, but changes efficiently to a bright stable red fluorescence on irradiation with UV. |
| GFP-tagged spaghetti squash w1118;;P{sqh-GFP.RLC} | Bloomington Drosophila Stock Centre (Indiana University) | #57145 | The sqh coding region, which is tagged at the C-terminal end with a T:Avic\GFPS65T tag, is expressed under the control of the natural sqh promoter. |
| Name | Company | Catalog Number | Comments |
| Ingredients for fly food media | Fly food media is made according to standard procedures (see Greenspan, R. 1997. Fly Pushing: The Theory and Practice of Drosophila Genetics. Cold Spring Harbor Press. 1-191 pp.) | ||
| maize | Wild Oats, Bristol, UK (or equivalent supplier) | Contact supplier direct | organic |
| soya flour | Wild Oats, Bristol, UK (or equivalent supplier) | Contact supplier direct | organic |
| malt extract | Wild Oats, Bristol, UK (or equivalent supplier) | Contact supplier direct | organic |
| molasses | Wild Oats, Bristol, UK (or equivalent supplier) | Contact supplier direct | organic |
| Difco agar | BD Biosciences, Fisher Scientific | DF0142-15-2 | For preparation of fly food |
| Propionic acid | Sigma | 402907 | For preparation of fly food |
| Nipagen | Sigma | 79721 | For preparation of fly food |
| Dried baker's yeast | Redstar, Dutscher Scientific, UK LTD | Redstar, Dutscher Scientific, UK LTD | For preparation of fly food |
| Name | Company | Catalog Number | Comments |
| Sample preparation and mounting | |||
| Parafilm | Sigma | P7793-1EA | For preparation of heptane glue |
| Fine sable paintbrush | Daler-Rowney (or equivalent) | #0 or 1 | |
| Forceps | Fisher Scientific (or Fine Science Tools) | NC9404145 | Dumont #5 |
| Glass bottomed dishes for imaging | MatTek | P35G-0-10-C | We suggest using 35mm petri dishes, with at least a 10mm Microwell, 0.085-0.13mm cover glass, uncoated. Dishes with larger microwells will enable increasing numbers of pupae to be mounted and imaged in a single experiment. |
| Heptane | Sigma | 51730-5ML | For preparation of heptane glue |
| Double sided sticky tape (e.g. Scotch) | Agar Scientific | AGG263 | For preparation of heptane glue |
| 50ml tube (for heptane glue) | Falcon tubes from Fisher Scientific | 14-432-22 | For preparation of heptane glue |
| Glass microscope slides | Agar Scientific | AGL4244 | For dissection of Drosophila pupae |
| Dissecting stereo microscope with brightfield | Leica (or equivalent) | M50 | For dissection of Drosophila pupae |
| Microscissors | John Weiss International | 103123 | Miniature Research Scissors (straight) |
| Name | Company | Catalog Number | Comments |
| Laser ablation and imaging | |||
| Nitogen ablation laser | Spectra-Physics (or Andor equivalent) | Model VSL-337ND-S | For wounding, this should be attached to a widefield imaging system |
| Multilaser confocal laser-scanning microscope (CLSM) | Leica (or equivalent) | TCS AOBS SP8 or SP5-II attached to a Leica DMi8 inverted epifluorescence microscope (or equivalent) | Ideally including a motorised stage for multi-site and 'mosaic' scanning, plus ‘hybrid’ GaAsP detectors (that offer much greater sensitivity and boosting of low signal) |
| Environmental chamber | Life Imaging Services (or equivalent) | "Microscope Temperature Control System" | Attached to Confocal microscope for temperature control during imaging |
| Name | Company | Catalog Number | Comments |
| Image Analysis Software | |||
| FRAP software module | Leica (or equivalent) | CLSM FRAP software module | For performing photoconversion of photoconvertible fluorophores such as Kaede |
| ImageJ (image analysis software) | National Institutes of Health (NIH) | https://imagej.nih.gov/ij/ | Schneider, C.A., Rasband, W.S., Eliceiri, K.W. "NIH Image to ImageJ: 25 years of image analysis". Nature Methods 9, 671-675, 2012. |
| ImageJ plugin "Manual Tracking" | National Institutes of Health (NIH) | https://imagej.net/Manual_Tracking | |
| ImageJ plugin "TrackMate" | ImageJ, NIH | https://imagej.net/TrackMate | Tinevez, JY.; Perry, N. & Schindelin, J. et al. (2016), "TrackMate: An open and extensible platform for single-particle tracking.", Methods 115: 80-90, PMID 27713081 |
| Volocity (high performance 3D imaging software) | Perkin Elmer | Volocity 6.3 | For image analysis |
| IMARIS (image analysis software) | Bitplane | IMARIS for Cell Biologists | For image analysis |
参考文献
- Eming, S. A., Wynn, T. A., Martin, P. Inflammation and metabolism in tissue repair and regeneration. Science. 356 (6342), 1026-1030 (2017).
- Crusz, S. M., Balkwill, F. R. Inflammation and cancer: advances and new agents. Nature Reviews Clinical Oncology. 12 (10), 584-596 (2015).
- Martin, P., Nunan, R. Cellular and molecular mechanisms of repair in acute and chronic wound healing. British Journal of Dermatology. 173 (2), 370-378 (2015).
- Razzell, W., Wood, W., Martin, P. Swatting flies: modelling wound healing and inflammation in Drosophila. Disease Model and Mechanism. 4 (5), 569-574 (2011).
- Wood, W., Martin, P. Macrophage Functions in Tissue Patterning and Disease: New Insights from the Fly. Development Cell. 40 (3), 221-233 (2017).
- Mohr, S. E., Smith, J. A., Shamu, C. E., Neumüller, R. A., Perrimon, N. RNAi screening comes of age: improved techniques and complementary approaches. Nature Reviews Molecular Cell Biology. 15 (9), 591-600 (2014).
- Muñoz-Soriano, V., López-Domenech, S., Paricio, N. Why mammalian wound-healing researchers may wish to turn to Drosophila as a model. Experimental Dermatology. 23 (8), 538-542 (2014).
- Weavers, H., Wood, W. Creating a Buzz about Macrophages: The Fly as an In Vivo Model for Studying Immune Cell Behavior. Developmental Cell. 38 (2), 129-132 (2016).
- Stramer, B., et al. Live imaging of wound inflammation in Drosophila embryos reveals key roles for small GTPases during in vivo cell migration. Journal of Cell Biology. 168 (4), 567-573 (2005).
- Wood, W., Faria, C., Jacinto, A. Distinct mechanisms regulate hemocyte chemotaxis during development and wound healing in Drosophila melanogaster. Journal of Cell Biolog. 173 (3), 405-416 (2006).
- Razzell, W., Evans, I. R., Martin, P., Wood, W. Calcium flashes orchestrate the wound inflammatory response through DUOX activation and hydrogen peroxide release. Current Biology. 23 (5), 424-429 (2013).
- Weavers, H., Evans, I. R., Martin, P., Wood, W. Corpse Engulfment Generates a Molecular Memory that Primes the Macrophage Inflammatory Response. Cell. , (2016).
- Stramer, B., Winfield, M., Shaw, T., Millard, T. H., Woolner, S., Martin, P. Gene induction following wounding of wild-type versus macrophage-deficient Drosophila embryos. EMBO Reports. 9 (5), 465-471 (2008).
- Matsubayashi, Y., Coulson-Gilmer, C., Millard, T. H. Endocytosis-dependent coordination of multiple actin regulators is required for wound healing. Journal of Cell Bioliogy. 210 (3), 419-433 (2015).
- Evans, I. R., Rodrigues, F. S. L. M., Armitage, E. L., Wood, W. Draper/CED-1 Mediates an Ancient Damage Response to Control Inflammatory Blood Cell Migration In Vivo. Current Biology. 25 (12), 1606-1612 (2015).
- Zanet, J., Stramer, B., Millard, T., Martin, P., Payre, F., Plaza, S. Fascin is required for blood cell migration during Drosophila embryogenesis. Development. 136 (15), 2557-2565 (2009).
- Bainbridge, S. P., Bownes, M. Staging the metamorphosis of Drosophila melanogaster. Journal of Embryology and Experimental Morphology. 66, 57-80 (1981).
- Ninov, N., Martín-Blanco, E. Live imaging of epidermal morphogenesis during the development of the adult abdominal epidermis of Drosophila. Nature Protocols. 2 (12), 3074-3080 (2007).
- Gho, M., Bellaïche, Y., Schweisguth, F. Revisiting the Drosophila microchaete lineage: a novel intrinsically asymmetric cell division generates a glial cell. Development. 126 (16), 3573-3584 (1999).
- Puah, W. C., Wasser, M. Live imaging of muscles in Drosophila metamorphosis: Towards high-throughput gene identification and function analysis. Methods. 96, 103-117 (2016).
- Berh, D., Scherzinger, A., Otto, N., Jiang, X., Klämbt, C., Risse, B. Automatic non-invasive heartbeat quantification of Drosophila pupae. Computers in Biology and Medicine. 93, 189-199 (2018).
- Sander, M., Squarr, A. J., Risse, B., Jiang, X., Bogdan, S. Drosophila pupal macrophages--a versatile tool for combined ex vivo and in vivo imaging of actin dynamics at high resolution. European Journal of Cell Biology. 92 (10-11), 349-354 (2013).
- Weavers, H., Liepe, J., Sim, A., Wood, W., Martin, P., Stumpf, M. P. H. Systems Analysis of the Dynamic Inflammatory Response to Tissue Damage Reveals Spatiotemporal Properties of the Wound Attractant Gradient. Current Biology. 26 (15), 1975-1989 (2016).
- Fristrom, D., Wilcox, M., Fristrom, J. The distribution of PS integrins, laminin A and F-actin during key stages in Drosophila wing development. Development. 117 (2), (1993).
- Brückner, K., Kockel, L., Duchek, P., Luque, C. M., Rørth, P., Perrimon, N. The PDGF/VEGF receptor controls blood cell survival in Drosophila. Development Cell. 7 (1), 73-84 (2004).
- Diehl, H., Ihlefield, H., Schwegler, H. . Physik fur Biologen. , (1991).
- Stewart, P. S., McFeters, G. A., Huang, C. T. Biofilm control by antimicrobial agents. Biofilms II Process Analysis and Application. , 373-405 (2000).
- . Cell Biology by the Numbers Available from: https://books.google.com/books?id=9NPRCgAAQBAJ&pgis=1 (2015)
- Ando, R., Hama, H., Yamamoto-Hino, M., Mizuno, H., Miyawaki, A. An optical marker based on the UV-induced green-to-red photoconversion of a fluorescent protein. Proceeding of National Academy of Science U S A. 99 (20), 12651-12656 (2002).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Tinevez, J. -. Y., et al. TrackMate: An open and extensible platform for single-particle tracking. Methods. 115, 80-90 (2017).
- Grueber, W., et al. Projections of Drosophila multidendritic neurons in the central nervous system: links with peripheral dendrite morphology. Development. 134 (1), 55-64 (2007).
- Wood, W., Faria, C., Jacinto, A. Distinct mechanisms regulate hemocyte chemotaxis during development and wound healing in Drosophila melanogaster. Journal of Cell Biology. 173 (3), 405-416 (2006).
- Wood, W., et al. Wound healing recapitulates morphogenesis in Drosophila embryos. Nature Cell Biology. 4 (11), 907-912 (2002).
- Franz, A., Wood, W., Martin, P. Fat Body Cells Are Motile and Actively Migrate to Wounds to Drive Repair and Prevent Infection. Developmetal Cell. 44 (4), 460-470 (2018).
- del Valle Rodríguez, A., Didiano, D., Desplan, C. Power tools for gene expression and clonal analysis in Drosophila. Nature Methods. 9 (1), 47-55 (2012).
- Losick, V. P., Fox, D. T., Spradling, A. C. Polyploidization and Cell Fusion Contribute to Wound Healing in the Adult Drosophila Epithelium. Current Biology. 23 (22), 2224-2232 (2013).
- Babcock, D. T., et al. Circulating blood cells function as a surveillance system for damaged tissue in Drosophila larvae. Proceedings of National Academy of Science U S A. 105 (29), 10017-10022 (2008).
- Galko, M. J., et al. Cellular and Genetic Analysis of Wound Healing in Drosophila Larvae. PLoS Biology. 2 (8), e239 (2004).
- Brock, A. R., et al. Transcriptional regulation of Profilin during wound closure in Drosophila larvae. Journal of Cell Science. 125 (23), (2013).
- Wu, Y., Brock, A. R., Wang, Y., Fujitani, K., Ueda, R., Galko, M. J. A blood-borne PDGF/VEGF-like ligand initiates wound-induced epidermal cell migration in Drosophila larvae. Current Biology. 19 (17), 1473-1477 (2009).
- Burra, S., Wang, Y., Brock, A. R., Galko, M. J. Using Drosophila Larvae to Study Epidermal Wound Closure and Inflammation. Methods in Molecular Biology. 1037, 449-461 (2013).
- Kakanj, P., et al. Insulin and TOR signal in parallel through FOXO and S6K to promote epithelial wound healing. Nature Communications. 7, 12972 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved