Method Article
초파리 번데기 내에서 염증 성 세포 역학의 장기 Vivo에서 추적
요약
여기 우리는 vivo에서높은 spatio 시간적 해상도에서 라이브 이미징 상처 복구와 관련 된 염증 반응에 대 한 프로토콜을 제시. 이 메서드는 초파리 개발 장기 이미징 및 시간이 지남에 따라 특정 세포 인구의 추적을 가능 하 게 하의 번데기 단계를 활용 하 고 효율적인 RNAi 중재 유전자 비활성화와 호환 됩니다.
초록
조직 손상에 급속 한 염증 반응, 동안 타고 난 면역 계통의 세포는 부상 사이트에 신속 하 게 보충 된다. 일단 상처에 타고 난 면역 세포 감염을 싸우는, 회 저 성 파편, 지우기 및 매트릭스 증 착을 자극 같은 필수적인 기능을 수행 합니다. 완전히이 면역 반응을 조절 하는 다양 한 신호 이벤트 이해, 그것은의 복잡 한 행동 (와 사이 발생 하는 상호 작용)을 관찰 하는 중요 한 여러 세포 계보는 vivo에서, 그리고 실시간으로 높은 spatio 시간적 해상도입니다. 광학 투명와 초파리 배아의 유전자 추적성 라이브 이미지에 귀중 한 모델 초파리 를 설립의 메커니즘을 포함 한 염증 성 세포의 근본적인 측면을 해 부 발달 분산, apoptotic 시체 및 미생물 병원 체, 그리고 상처에 채용의 그러나, 최근 작업 이제 보여주었다는 다양 한 향상 된 RNAi 효율성, 더 긴 기간, 이미징 등 뚜렷한 장점 제공- 초파리 번데기- 초파리 수명 주기에서 훨씬 나중의 단계를 사용 하 고 상당히 큰 면역 세포 숫자입니다. 여기 우리가 영상 상처 복구에 대 한 프로토콜 및 라이브 초파리 번데기에서 높은 spatio 시간적 해상도 관련된 염증 반응을 설명합니다. 다시 epithelialization와 염증의 역학 관계에 따라, 우리는 상피와 타고 난 면역 세포에 대 한 특정 vivo에서 형광 마커 수를 사용 합니다. 우리는 또한 부상 사이트에서 사진 컨버터블 fluorophores, 단풍나무, 등 그들은 이주 하는으로 그들의 행동을 추적 하는 특정 면역 세포 하위 집합을 다음에 대 한 해결의 효과 보여줍니다.
서문
효율적이 고 효과적인 선 동적인 응답은 감염을 싸울, 파편, 분명 부상된 조직1의 복구를 조정 하는 어떤 유기 체에 대 한. 비록이 응답은 대부분 조직 손상의 피할 수 없는 결과, 염증 필요 합니다 엄격한 규제를 때문에 부적절 한 염증 반응 (만성 비 치유, 상처를 포함 한 다른 인간의 질병의 다양 한에 연결 되었습니다. 과도 한 흉터와 암에 타고 났다)1,2,3. 이 임상 관련성을 감안할 때, 그것은 새로운 예 후 지표 및 다양 한 만성 염증 치료 하는 전략을 개발 하기 위해 염증 반응을 운전 분자 및 세포 메커니즘의 더 상세한 이해를 얻기 위해 중요 한 조건 연장 하 고 불필요 한 염증에서 조직 복구를 보호할 수 있습니다.
최근 몇 년 동안, 초파리 해 부 인간4,5곤충에서 보존 하는 염증 반응의 기본 기능을 잘 설립 하 고 귀중 한 모델 시스템 되고있다. 현재, 초파리 (예: 마우스 또는 zebrafish), 다른 실험 모델에서 현재 가능한 것 보다 훨씬 더 큰 유전 추적성 제공 vivo에서 정확한 spatio 시간적 유전자 조작 허용 (비활성화 하려면 또는 -정의 된 개발 시간 지점에서 특정 세포 유형 내의 관심사의 어떤 유전자 표현)와 게놈 넓은의 용이성 화면6,7. 전통적으로, 상처 치유와 초파리 에 염증의 대부분의 라이브 이미징 연구 수행 되었습니다 배아 단계에서 배아는 ( 초파리 애벌레 또는 성인)과 달리 움직이지과 광학 반투명 수 있습니다. 비교할 수 없는 높은 해상도 vivo에서 이미징8. 이 응답 배아 상피9, 기계 또는 레이저 유도 부상으로 상처 사이트에 초파리 타고 난 면역 세포 (hemocytes)의 신속 하 고 강력한 모집을 시각화 하는 연구자를 수 있다 10 , 11 , 12 , 13 , 14. 유전자 조작으로 이러한 라이브 이미징 연구를 결합 하 여 연구에 초파리 태아 염증 성 세포 행동 비보를 제어 하는 많은 중요 한 면역 세포 단백질 발견. 예를 들어 CED 1 체 드레이퍼 (는 ITAM 도메인에 포함 된 단백질) 발견 되었습니다는 중요 한 '손상 수용 체'로 H2O2의 모집 초파리 면역 세포 중재-의 사이트에 의존 방식으로 15를 손상. 면역 세포 내에서 레벨을 드레이퍼 칼슘 유도 설립 신호 및 다운스트림 apoptotic 시체 통풍 관12의 상승에 의해 차례 차례로 통제 된다. Hemocyte 운동 더 복잡 한 cytoskeletal 변경 상처 향해 감독된 마이그레이션 조정 요구 하 고이 걸 묶는 단백질 Fascin16 등 작은 Rho 가족 cytoskeletal 레 귤 레이 터의 활동에 따라 달라 집니다. GTPases Rac와로9.
초파리 는 embryogenesis, 성인17를 도달 하기 전에 다음과 같은 추가 애벌레 및 번데기 단계를 통해가 holometabolous 곤충. 비-침략 적 라이브 이미징 발달 셀 마이그레이션18,19세포 분열, 세포 성장20및 근육을 포함 한 동적 셀룰러 이벤트의 다양 한에 대 한 추가 모델 초파리 번데기 개발 되었습니다. 수축21. 최근에, 그것은 상처 수리 및 염증 vivo에서22,23의 역학을 공부 하는 새로운 모델로 설립 되었습니다.
그냥 배아 단계, 초파리 번데기가 움직이지 하 고 광학 반투명 그들의 불투명 번데기 경우18주의 절 개 후 합니다. 이 광학 투명도 이용 하 여 하나 번데기 날개22같은 초파리 번데기 조직 내에서 조직 손상에 대 한 응답에 타고 난 면역 세포 (hemocytes)의 생체 내에서 동작을 따를 수 있다. 번데기 날개 날개 주위; 연결 된 두 개의 대형 평면 상피 시트의 구성 된 간단한 bilayered 구조 존재 이 두 상피 층 사이의 세포 외 공간 운동 hemocytes24의 hemolymph (곤충 혈액) 및 많은 가득 합니다. 배아, 마찬가지로 날개 상피에 기계적 또는 레이저 유도 부상 부상 사이트23hemocytes의 급속 한 채용을 트리거합니다. 그러나,이 번데기 단계 배아 단계 이전에 영상에 대 한 몇 가지 뚜렷한 장점을 제공합니다. 부상된 pupae (적어도 5 h)에 대 한 훨씬 더 긴 기간 동안 군데 수, 더 많은 조직 영역 (예: 여러 상처의 발생) 실험 섭 동에 사용할 수 있으며 hemocytes이 단계 (에 존재의 상당히 큰 숫자 제공 하 고 더 이상 거리에서 더 많은 셀 궤도 향상 된 통계적 인 힘에 대 한 수학적 분석 중). 또한, RNAi 중재 유전자 비활성화의 효율 될 ' 노크-아래 '에 조직 또는 배아의 전체 돌연변이 더 전통적인 접근에 비해 시간 특정 방식으로 많은 유전자를 허용 하는 번데기 단계에서 상당히 향상 됩니다.
상처 다시 epithelialization와이 새로운 번데기 모델 내에서 동반 염증 반응의 역학을 수행 하기 위해 두 개의 서로 다른 세포 인구를 표시 해야 합니다: 번데기 상피와 타고 난 면역 세포 (초파리 hemocytes)입니다. 이 두 개의 서로 다른 세포 인구를 사용할 다른 마커 (자료 테이블)의 수 있습니다-공부 하는 특정 프로세스에 따라 마커 선택. 번데기 상피, 초파리 줄 중 하나를 표시 하는 편 표현된 GFP 태그 전자-cadherin (그 레이블 외화 접합)은 셀 여백, 또는 양자 택일로,는 GFP-태그의 위치를 나타내기 위해 정기적으로 활용 Moesin (그 걸 골격 레이블)의 걸 바인딩 도메인 상처 가장자리 수축 말라 반지 및 앞 가장자리 돌출을 시각화. 레이블을 초파리 hemocytes, hemocyte 전용 srp Gal425 (핵 추적)에 대 한 RFP를 핵, 세포질 GFP 또는 GFP 태그 Moesin (각각 세포질 또는 말라 골격 라벨)의 드라이브 식 또는 (가) 같은 photoconvertible fluorophore 사용 됩니다. 사실, 그것은 종종 조합, 여러 면역 세포 마커를 사용 하 여 핵 운동과 셀 형태학 (대표 결과 참조)의 동시 분석에 유리. 그러나, 때문에이 프로토콜 초파리 번데기의 사용을 포함, 유전자 표시의 조합만은 가능한 중반 번데기 단계를 활용할 수 있는 때까지. 또한, 배아 치명적인 주식 적합 되지 않습니다. 이것은 영상 제어 문제가 될 가능성 (또는 야생-타입) pupae 하지만 유전자 뜨 있을 때 고려 하는 것이 중요 하다 또는 overexpressed 상처 폐쇄 나 염증에 미치는 영향을 평가 하기 위해. Gal80ts 유전자 최저 (또는 overexpression)에 의해 발생 하는 초기 치의 경우 구문을 사용할 수 있습니다 Gal4 기반 최저 나중에 개발을 유도 하는 것 (내용 참조).
우리의 최근 연구에서 번데기 단계로 이동 활성화 우리가 차례로 우리는 상처의 소설 내용을 추론할 수 있다 정교한 수학적 모델링을 사용 하 여 염증 성 동작 분석에 충분 한 면역 세포 궤적 데이터를 수집 하 염증 성 유인23신호. 예를 들어이 접근 방식을 밝혀 상처 chemoattractant 200 μ m2/min, ATP와 같은 작은 후보 분자 이전 제안 보다 훨씬 느린 속도에서 염증된 조직을 통해 천천히 확산 또는 H2O2 를 보고는 26,27,,2829; 확산 이 작은 "손상" 분자 대신 허용 신호 역할 가능성이 있다. 또한, 그들은 초기 상처에서 해결 하 고 두 번째 (첫 번째 이후 다양 한 timepoints에서 만든)에 노출 되는 타고 난 면역 세포의 장기 행동에 따라, 우리를 발견는 면역 세포 중 임시 '둔감' 기간 이후 부상23장 님입니다. 초파리의 유전 추적성, 함께 번데기 모델의 장기 이미징 잠재력을 이용 하 여 하나에서 특정 면역 세포 인구 (만 그 면역 세포 상처 사이트에 모집) 등의 행동을 따를 수 있다 면역 세포 계보23내 독점적으로 표현 될 수 있는 photoconvertible fluorophore30 을 사용 하 여 후속 모욕에 응답.
우리가 상처 수리 및 높은 spatio 시간적 해상도 생활을 사용 하 여 관련 된 염증 반응의 역학을 시각화 하는 프로토콜을 설명 하는 여기 초파리 번데기. 자세한 방법론 (해 부 및 장착) 초기 pupae 준비와 후속 레이저 중재 부상 및 시간 경과 영상에 필요한 단계를 제공 합니다. 우리는 또한 특정 면역 세포 하위 집합에서 vivo에서의 라벨을 허용 하도록 사진 컨버터블 fluorophores의 사용을 설명 합니다. 장기, 우리는이 새로운 초파리 번데기 모델 기본 조직 손상으로 염증 반응을 복잡 한 신호 역학을 해 부에 대 한 흥미 진 진한 가능성을 열 것 이다 구상. 더 정교한 통계 분석을 적용 하 여 하나 그렇지 않으면 남아 있다 실험적으로 접근 하기 어려운, 효율 향상된 RNAi 게놈 넓은 검사 내에서 응용 프로그램에 자체를 빌려 수 하는 동안 응답의 기능을 밝히기 수 있습니다. 면역 세포에서 vivo에서 면역 세포 행동을 통제 하는 새로운 플레이어를 식별 하기 위해.
프로토콜
이 프로토콜의 4 개의 주요 순차적 단계 구성: 초파리 와 초파리 번데기의 준비, (2) 번데기 해 부 주식과 장착의 준비 (1), (3) 번데기 부상, 시간 경과 confocal 영상에 vivo에서 (4).
1. 초파리 주식 및 Pupae의 준비의 준비
- (소개 및 재료의 표참조) 적절 한 초파리 주식 취득
- 적절 한 유전자 형의 건강 한 젊은 성인 파리를 수집 합니다.
- 짧게 파리 anesthetize에 이산화탄소 가스 패드를 사용 하 여 선택 성인 파리를 전송 하는 좋은 붓 적절 한 유전자 형 또는 성별 컬렉션 유리병에 있습니다.
- 표준 비행 식품 미디어에 포함 된 각 유리병에 20 처녀 암컷과 수 컷 20 추가 (cornmeal-당 밀-한 천 혼합물 테이블의 자료를 참조) 효 모와 보충.
- 최적의 번데기 세대에 대 한 모든 튜브 25 ° c.에 유지 신선한 튜브에 새로운 음식에 매일 성인 파리 팁
참고: Gal4 UAS 시스템31 계보-특정 유전자 발현을 드라이브를 사용 중인 경우 모든 단계가 수행 되어야 합니다 25 ° c 이상 Gal4 UAS 시스템은 온도 민감한. - 튜브 (즉, puparium 형성, APF 후 0 h)에서 적어도 10 새로 형성된 된 화이트 사전 pupae (그림 1A)를 선택 하는 예약 된 이미징 세션 전에 18 h 인테리어 유리병 표면에서 번데기를 꺼내 려 집게 또는 벌금 페인트 브러시를 사용 하 여 고 깨끗 한 빈 플라스틱 병의 측면을 신중 하 게 번데기를 전송 합니다.
참고: 방황 3rd 탈피 애벌레 크롤 링 위로 받아야 pupation; 음식 매체 새로 형성된 된 화이트 prepupae 그들이 나왔으며 앞쪽 spiracles를 소유 하 고 (와 달리 3rd 탈피 애벌레) 고정에 쉽게 식별 됩니다. 표 피는 'puparium' (번데기 경우)는 처음 부드럽고 흰색17로 변환 합니다. 해야 합니다 주의 번데기, 손상을 방지 하려면 원치 않는 부상을 유발 염증 반응 뿐만 아니라 중요 한 발달 지연에이 끌 수 있습니다. - 25 ° c.에 유리병에 적절 한 발달 단계 (18 h APF 최적의 결과 줄 것 이다)에 선택한 번데기 나이
참고: 개발로 서 번데기, 번데기 케이스 될 것 이다 점차적으로 어둡게 하 고 더 취 성. - 미리 다음 단계에 대 한 다른 시 약을 준비 합니다. 헵 접착제, 50ml 원심 분리기 튜브에서 20 mL 헵 올리고 양면 테이프의 20 cm 길이 결합 하려면, 파라핀 영화와 벤치에 하룻밤 실 온에서 바위 봉인.
2. 준비와 초파리 번데기의 해 부
- 유리 슬라이드에 이중 면 끈끈한 테이프의 조각에 준비 된 초파리 번데기를 전송 합니다. 복 부 쪽은 테이프에 붙어 단단히 하 고 등 쪽 (그림 1B)를 위쪽으로 향하게는 번데기를 놓습니다.
참고: 번데기의 앞쪽 것에서 번데기 케이스의 앞쪽 끝에서 튀어나온 두 spiracles 식별. - 신중 하 게 그들의 보호 puparium 케이스 겸 마이크로-가 위 (그림 1B-D)를 사용 하 여 명시 해 부 현미경 아래에서 번데기를 제거 합니다.
- 처음에, 집게 (그림 1B)를 사용 하 여 puparium의 앞쪽 대부분 지역에서 절 개를 확인 합니다. 이 지역에서 번데기 케이스는 투명 하 고 번데기 조직 없는 번데기 초기 번데기 개발 중 케이스 내에서 축소는 것 때문에 확인 하십시오.
- 이 초기 절 개 후 신중 하 게 눈물 또는 번데기는 갈색 불투명 취 성 케이스 (그림 1D)에서 완전히 무료 때까지 집게 또는 microscissors (그림 1C)를 사용 하 여 후부 방향 앞쪽에서 번데기 케이스 자르면.
참고:이 단계에서 번데기는 매우 유약 하 고 주의 번데기 표면; puncturing을 피하기 위해 해야 합니다. puncturing hemolymph 펑크 사이트에서 신속 하 게 누수으로 분명 하다. 그러나 구멍, 작은과 번데기를 폐기 해야한다.
- 헵 접착제를 사용 하 여 유리 바닥 접시에 번데기를 탑재 합니다.
- 20 mL 피 펫 팁을 사용 하 여 미리 준비 된 헵 접착제 (참조 섹션 위의 1.6)의 10 mL 드롭 유리 바닥 접시에 라인 배치.
- 5 건조 접착제를 허용 해 부 pupae 집게 (그림 1E)를 사용 하 여 헵 접착제에 신중 하 게 전송 하기 전에 s.
- 부상 및 이미징의 용이성, 일렬로 번데기 연속; 약 5 pupae는 하지만 더 많은 경험으로 관리 될 것입니다.
참고: 헵 접착제의 사용 똑바로 이미징 시스템을 사용 하는 경우 것이 좋습니다 있지만 거꾸로 시스템을 사용 하는 경우에 필요 하지 않습니다. 경우 접착제 광학 이미징, pupae 동안 착오는 coverglass에 직접 배치 수 있습니다 대신-으로 이미지를 이동할 때 주의 번데기 조직과 유리 사이 자연 접착 안정적인 영상에 대 한 대부분의 경우에서 충분 한 것 현미경 사이 요리.
- 최상의 결과 얻으려면는 날개 날개 표면의 대다수와 가진 coverglass에 평평 coverglass (그림 1 층)와 직접 접촉에 번데기를 탑재 합니다. Pupae 날개 제대로 장착 되도록 그들의 위치를 변경 하려면 집게를 사용 하 여 롤.
- 이미징 기간 동안 샘플 탈수를 방지, 흡수 성 필터 종이 (그림 1E) 번데기를 방해 하지 않도록 주의 되 고, 설치의 끝에 유리 바닥 접시의 측면을 증류수에 젖 었을 추가 합니다. 커버 뚜껑 접시.
참고: Pupae은 부상 및 이미징에 대 한 준비.
3. 레이저 유도 초파리 번데기 날개의 부상
- 넓은 필드 현미경 가변 레이저 제거 시스템을 탑재 pupae를 포함 하는 유리 바닥 접시를 전송 합니다.
- 펄스 UV 공기 냉각된 질소 펌핑 절제 레이저 435에 조정 사용 nm-내용은11;에 대 한 재료의 표를 참조 조명에 사용 되는 빛의 정확한 파장 적절 한 염료 셀 통해 사용자에 의해 선택 됩니다.
- 대물 광학을 사용 하 여 조정 될 첫 번째 번데기의 번데기 날개를 찾으려고 현미경 단계 컨트롤 (그림 1 층) 상처를 입었다.
- 최적의 결과 얻으려면 기름 침수 40 X 또는 63 X 객관적 렌즈를 사용 하 여 두는 이미징 및 레이저 제거; 절제와 이미징 시스템 사이 일관 된 침수 액체 사용 (기름 또는 글리세롤) 인지 확인 합니다. 조정 유리 coverslip (즉 수 부상에 상피의 지역에 초점)에 가장 가까운 번데기 날개 상피의 평면에 초점 현미경 미세 초점 조절기를 사용 하 여.
- 현미경 단계 조정에 사용 하 여, 되도록 부 상자 수를 지역 직접 절제 레이저의 알려진된 대상 면적 번데기 날개 위치.
- 현미경에 장착 하는 에너지 밀도 감쇠기 슬라이드를 사용 하 여 수동으로 제거 빛의 전력 레벨을 조정.
참고: 감쇠기 슬라이더는 클릭 중지와 감쇠의 상대적 수준을 파악 하 고 재현 가능한 설정의 사용을 허용 하는 판결. - 외부 수동 트리거 제어를 사용 하 여 제거 레이저는 상처를 방 아 쇠의 한 번의 간단한 클릭을 사용 하 여 활성화 합니다. 체크 제거 사이트에 일시적인 공기 거품의 모양에 대 한 이후 부상 일반적으로 동반 될 것 이다. 레이저 유도 부상 번데기 상피를 시각화 하기 위해 적절 한 형광 필터를 사용 하 여 성공 되었는지 확인 하십시오.
참고: 빔 반사 수 있습니다 발생할 심각한 눈 또는 피부 손상으로 레이저 광선에 실수로 노출 하지 않도록 주의 하십시오. - 부상 하는 것은 성공, 초점 비행기 (현재 초점 수준 보다 약간 크거나 현미경 포커스 이동)를 변화 하 고 절제 트리거의 단 하나의 클릭을 반복. 또는 레이저 전력 감쇄 기 슬라이드를 사용 하 여 원하는 상처 크기 달성 될 때까지 점차적으로 증가.
- 제거 레이저 펄스 반복 속도 다양 하 게 사용 하 여 반복 속도 손잡이 후면 컨트롤 패널에서 (1 펄스/s에서 속도 변경 내용을 최대 60 Hz). 최적의 부상, 반복 주파수 40 Hz로 설정 합니다.
- 다른 크기의 상처를 생성 하려면 에너지 밀도 감쇠기 슬라이드 사용 하 여 수동으로 제거 빛의 전력 레벨을 조정.
- 모든 탑재 된 번데기의 부상에서 참 고 unwounded 컨트롤로이 아닌 연기나 pupae를 사용 합니다.
- 일관 된 결과 정기적으로 (는 관련 설명서를 사용 하 여) 제거 시스템 재개. 또한, 깨끗 하 고 레이저 출력 파장을 제어 하는 염색 공 셀 리필.
4. 시간 경과 Confocal 영상 Vivo에서
- 시간 경과 영상에 대 한 적절 한 현미경을 유리 바닥 접시를 신속 하 게 전송.
참고: 최적의 결과 얻으려면 높은 사양 confocal 또는 회전 디스크 현미경 GFP와 mCherry fluorophores 감지할 수 있는 민감한 검출기를 장착 사용 합니다. - 전체 번데기 날개 이미지 (예: 20 X) 저 배율 대물 렌즈 (그림 2A)를 사용 합니다. 이미지 상처 수리 및 높은 공간 해상도와 함께 염증 반응, 사용 기름 침수 40 X (NA 1.3) 또는 63 자 (나 1.4) 렌즈 ( 그림 2B-D에서 대표 이미지 참조) X.
- 현미경과 관련 된 적절 한 이미지 캡처 소프트웨어를 엽니다.
- 적절 한 레이저 예 는 488 nm 및 시각화 하 GFP와 mCherry fluorophores, 각각 (클릭 하 여 해당 상자에)와 레이저 전원 조정 고 이득/오프셋 설정 주고 561 nm 레이저 설정 이미지 캡처 소프트웨어를 사용 하 여 충분 한 형광 신호 픽셀 채도;를 피하는 동안 (범위 5-20%)에서 가장 낮은 가능한 레이저 파워를 사용 하 여 photobleaching 및 phototoxicity을 최소화 하기 위해.
- 모두는 수리를 잡으려고 상피 세포 및 염증 세포 모집 설정 z 스택 미세 초점 조정 손잡이 사용 하 여 제어판;에 기록 현미경 최적의 결과 얻으려면 소프트웨어 설정 (를 사용 하 여 수동 버튼 클릭) 번데기 날개 (최소 매 3 m m)를 통해 기록의 z 슬라이스로 (마이그레이션 hemocytes 포함) 아래 세포 외 공간을 통해 부상된 상피의 상단에서 큰 달성 하기 z-스택 (50-100 m m의 범위)에서.
- 시간 경과 영상에 대 한 정기적인 시간 간격으로 z-스택 기록 (최소 매 30 s) 1 h 후 부상에 대 한.
참고: z-스택 선택 사이의 정확한 시간 간격 빠르게 변화 세포 역학을 캡처하고 샘플 사진 표백 피하 절충을 나타냅니다. - 동시에 여러 pupae (를 포함 하 여 비 녹지 unwounded 컨트롤) 이미지, (현미경에 부착) 전동된 스테이지와 이미징 소프트웨어 내에서 사용할 수 있는 다 위치 수집 기능을 사용 합니다. 각 개별 번데기 단계 위치 제어 단자를 사용 하 여 소프트웨어 내에서 위치를 수동으로 설정 하 고 수동으로 각 개별 번데기에 대 한 적절 한 z-스택 한계 (위쪽 및 아래쪽)를 설정 합니다.
- Z-스택 예측 또는 3 차원 렌더링을 사용 하 여 시간 경과 이미지 이미지 캡처 또는 전문 이미지 분석 소프트웨어 (예: ImageJ32)와 나중을 시각화. 예를 들어, 개별 hemocytes의 움직임에 따라 ( 그림 2C' 에서 D'), 트랙 hemocyte 핵은 오픈 액세스 ImageJ 플러그-인 "TrackMate" 또는 "수동 추적" ( 33, 에 게시 메서드를 사용 하 여 34)입니다.
- 선택적으로 photoconvert (예:가30) photoconvertible 프로브를 사용 하 여 및 이미징 동안 상피 또는 면역 세포의 부분 집합 레이블.
- 이미징 소프트웨어는 photoconversion를 수행 하기 위해 적절 한 모듈을 열고 (FRAP, 사진 표백 후 형광 복구 같은 모듈) 활성화 405nm 레이저 (클릭 하 여 관련 소프트웨어 상자에서)35.
- 정사각형, 원형 또는 자유형 선택 도구를 사용 하 여 FRAP 소프트웨어 내에서 photoconverted 수 셀을 선택 합니다. FRAP 소프트웨어 내에서 단일 반복/프레임 photoconversion (표백)에 대 한 시간 코스를 설정 하 고 20% 레이저 전력에서 405 nm 레이저를 설정 합니다. 수동으로 photoconversion를 수행 하 는 실험을 시작 을 클릭 합니다.
- FRAP 모듈 ( 닫기를클릭)을 종료 하 고 소프트웨어;에서 원래 영상 화면으로 돌아갑니다 사용은 488 nm 그리고 z-스택 및 위와 시간 경과 녹화를 설정 하 여 photoconverted 및 photoconverted가 아닌 셀의 동작 이미지를 561 nm 레이저.
참고: Photoconverted 프로브는 초기 photoconversion, (적어도 5 h)에 대 한 시간이 지남에 따라 photoconverted 셀의 동작을 활성화 한 후 많은 시간 동안 안정적인 유지. 예를 들어 상처에 염증 세포는 선택적으로 photoconverted (그림 2F) 될 수 있으며 그들의 행동 뒤에 그들은 (그림 2G 및 H) 부상 사이트에서 확인할.
결과
이 프로토콜 상처 수리 및 염증에서 vivo에서의 라이브 시간 경과 영상에 대 한 초파리 번데기의 준비를 설명합니다. 이 방법을 사용 하 여, 그것은 쉽게 번데기 상처 폐쇄와 염증 세포 모집의 여러 고해상도 영화를 생성 하 고 뜻깊은 photobleaching 없이 부상 후 긴 시간 동안 (적어도 5 h) pupae 이미지 가능 해야 합니다.
초파리 번데기 준비에 대 한 일반적인 계획
그림 1 에 vivo에서 이미징 초파리 번데기를 준비 하기 위한 최적의 방법을 보여 줍니다. Drosophila 흰색 'prepupae' 수집 '0 h'에서 puparium 형성 (APF), 후 크롤링 애벌레 운동 중단 하 고는 틀에 박힌 번데기 모양 채택 나왔으며 호흡 부속 (spiracles) 그들의 가장 앞쪽 끝 ( 에서 볼 수 그림 1A). 화이트 0 h APF prepupae 수 있습니다 어떤 시간에 puparium 되고있다 (그림 1B) 브라운과는 다음 해 부 고급 집게 / microscissors (그림 1C, 보호 번데기 케이스 제거)를 사용 하 여 25 ° C에 18 h에 대 한 개발 공개 하는 (그림 1D) 내 광학 반투명 번데기. 해 부, 다음 번데기 날개 (파란색, 그림 1 c-D명시) 번데기 흉부의 측면 측면에 표시 됩니다. 이 단계에서 다른 번데기 신체 부위도 쉽게 뚜렷한, 눈, 다리, 그리고 복 부 ( 그림 1D에 표시)를 포함 하 여 있습니다. 다리는 또한 상처 염증 연구에 적합 하 고 위에서 설명한 동일한 레이저 메서드를 사용 하 여 부상 될 수 있습니다. 여러 18 h APF pupae 거치 될 수 있다 동시에 (그림 1E, 헵 접착제와 물에 젖은 필터 종이 사용 하 여 탈수를 최소화 하기 위해) 이미징 접시 내 날개 (개요 블루) ( coverslip 접촉의 평탄한 부분 그림 1 층); 이것은 특히 유리한 경우 이미징 현미경 전동된 스테이지 1 단일 이미징 기간 동안 기록 여러 pupae 있도록. 해 부 또는 설치 하는 동안 손상 된 어떤 pupae를 폐기 해야 합니다 (예: 번데기 순서, 화살표 그림 1E에에서 제 3 위치). 다른 신체 부위 (예: 눈과 다리, 개요 핑크)는 coverslip로 문의하실 수도 하 고 부상에 대 한 사용할 수 있으며 (그림 1F) 이미징 후속. 단일 상처를 공부 하는 실험에 대 한 레이저 유도 손해는 일반적으로 최고의 쏜 중앙 날개 (별표, 그림 1 층)에서 여러 상처는 공부를 해야 하는 경우 다른 위치를 사용할 수 있습니다.
초파리 번데기 날개에서 강력한 염증 반응을 활성화 살 균 부상
따라 상처 수리는 동반 염증 반응을 vivo에서 18 h APF 초파리 번데기의 부상된 날개 주문 되었다 confocal 시간 경과 현미경 검사 법 (그림 2A-H)를 사용 하 여 몇 군데. 이 번데기 단계에서 날개 epithelia (표시 여기 날개 여백 그림 2A에 명시 된 개별 셀 경계를 표시 하려면 E-cadherin GFP 태그를 사용 하 여) 셀의 간단한 플랫 시트는. Unwounded 날개에도 (확대, 낮은 2A 및 2A 인물 '), 많은 수의 철새 타고 난 면역 세포 (hemocytes, srp Gal4 세포질 GFP, 녹색, 구동을 사용 하 여 표시 및 핵 RFP, 자홍) hemolymph (내에서 발견 되 곤충 혈액) 중간 세포 외 공간을 점령 (그림 2A 와 2A'). 번데기 날개 상피 (상처 여백 화이트, 그림 2B-D에서 설명) 부상 레이저 유도 자극 (그림 2B-D 와 그림 2B 에서 면역 세포 핵 상처 사이트에 hemocytes의 빠른 마이그레이션 '-D'). 둘 다 hemocytes 라벨 핵 표시자 (예: ' 레드-스 팅 어 ' 핵 RFP) 조합에 세포질 또는 cytoskeletal 표시 (예: 세포질 GFP 또는 GFP 태그 Moesin)와 함께 특히 유리한 수는 (hemocyte 동작 예: 이동 속도와 방향이 자동된 분석)에 대 한 hemocyte 핵 및 hemocyte 형태학의 시각화의 동시 추적. 후자는 우리가 hemocytes 회 저 성 파편을 phagocytosing는 여부 결정 하 수 중요 한 (그림 2C, 삽입) 상처 가장자리 (또는 미생물 감염의 경우)12,23 그리고 또한 따를 수 있습니다 그들의 밀어내 행동으로 또는 상처에서 마이그레이션할 때 그들은 잘 filopodia 또는 lamellipodia 그들의 첨단에서 확장.
적절 한 이미지 분석 소프트웨어32 를 사용 하 여 hemocyte 핵 궤도의 추적 간단한 (자료 테이블) 설명 이전에 대 한 보고와 유사한 염증 반응의 복잡 한 spatio 시간적 역학 배아9,36 부상 (멀티 컬러 트랙, 그림 2C'와 D'). 부상의 단지 30 분 이내 부상 사이트에 가장 가까운 위치 하는 hemocytes 상처 향해 감독된 마이그레이션 시작 (그림 2C'). 그러나, 시간 후 부상, 증가 함께 점진적으로 위치한 hemocytes 추가 부상 사이트에서 또한 감독된 마이그레이션을 시작할 상처 쪽으로 (그림 2D'). 이 방법에서는, 상처 가장자리에서 바깥쪽으로 확산 하는 면역 세포 응답의 '웨이브'는 관찰, 우리는 부상 사이트에서 상처 chemoattractant의 보급을 반영 하기 위해 구상 하. 정교한 수학적 모델링 ('베이지안 추론') 분석 상처 유인 신호 (자세한 방법의 새로운 속성을 유추할 수 있는 우리의 최근의 연구에 대 한 유용한 출발점을 제공 하는 이러한 spatio 시간적 면역 세포 역학 23에 게시). 관찰 vivo에서 면역 궤적에 맞게 (hemocyte 바이어스에 상처 유인 그라디언트를 연결)는 우리의 계산 모델을 보정 하 여 우리의 hemocyte 궤적에서 상처 유인의 자세한 특징을 추출 수 하나 데이터 (예: 신호 확산 속도, 소스, 그리고 신호 생산 기간)23.
또한, srp Gal4 (녹색, 그림 2E) 우리를 선택적으로 이러한 철새 날개 hemocytes의 부분 모집단 (와 같은 수 있다 또한 사용 하 여 면역 세포 계보 내의 photoconvertible fluorophore가 식 운전으로 그는 상처 사이트에 채용 E, UV 유도 된 photoconversion 및 F, 전에 게시물-photoconversion). 우리가 따를 수 있습니다 다음 이러한 hemocytes의 동작 (마젠타, 그림 2G-H) 시간이 지남에 따라 그들은 상처 사이트 (화살표, 그림 2G H)에서 해결 하 고 그들의 행동은 어떻게 그 비-photoconverted에서 다른 비교 셀 부상 사이트에 도달 하지 않습니다. 우리이 사용 vivo에서 기술 라벨 hemocytes 상처 초기에 채용 생성 두 번째 상처에 desensitized 일시적으로 설명 하기 위해 90이 차동 라벨 기술 또한 수 있지만 나중에23, 분 있다 다른 많은 통찰력 응용 프로그램 앞에 (내용 참조).
이 방법을 사용 하 여, 우리 또한 동시에 상처 수리 나 있어 epithelialisation의 spatio 시간적 역학을 따를 수 있다 ' (그림 2B-D). 여기 편 표현 GFP 태그 전자 cadherin 레이블을 통해 날개 상피 세포 외화 접합 하 고 시간이 지남에 따라 개별 상피 세포의 모양 수 있습니다. 상처 가장자리 그대로 GFP 표시 된 상피 세포와 레이블이 없는 파편 (흰색 파선, 그림 2B-D) 사이의 연결으로 쉽게 식별 됩니다. 상처의 대부분에 대 한 상처의 부상과 상처 가장자리 발전 안쪽 (그림 2D); 1 시간 이내 epithelialize 다시 시작 이 크기의 상처는 부상23의 2-3 h 이내에 치료 일반적으로. 배아에 pupae 상처 폐쇄 첨단 말라 풍부한 filopodia23,37; 함께 actomyosin 수축 케이블에 의해 구동 됩니다. 이러한 cytoskeletal 역학 적절 한 비보에 기자, GFP 태그 스파게티 스쿼시 (Myosin 규제 빛 사슬) 또는 말라 바인딩 Moesin GFP 태그23등을 사용 하 여 상처 복구 중 직접 구상 될 수 있다. 그러나 일부 특히 큰 상처에 대 한, actomyosin 케이블 및 첨단 filopodia 지속 하지 않습니다-이러한 상처 ' 만성 '와 결코 완전 하 게 다시 vivo에서 의 훨씬 긴 기간 (이상 24 h) 후에23 epithelialize 이미지입니다. 흥미롭게도,이 치유 되지 않은 상처와 관련 된 염증 반응은 비정상적인 면역 세포 행동 클리닉에서 유용한 전조 마커 수 제안 일반적인 급성 상처23 와 관련 된 현저 하 게 다른 . 미래에, 더 번데기 모델에 장기 영상 (이상 24 h)을 사용 하 여 만성 상처의 비보에 분석은이 쇠 약 상태로 중요 한 기계적 통찰력을 제공할 수 있습니다.
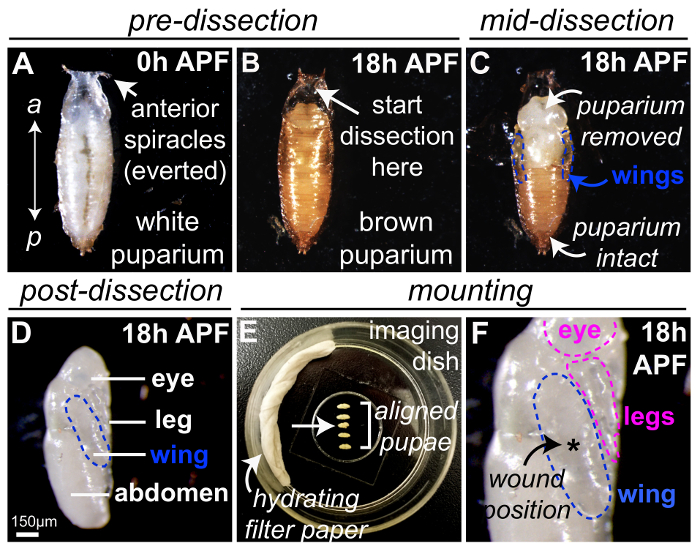
그림 1: 초파리 번데기 준비 부상 및 라이브 영상. (A) 초파리 0 h APF, 앞쪽 끝에 백색 prepupae 수집 나왔으며 호흡 부속 (spiracles)으로 표시. (B)는 puparium 높이 25 ° C에 18 h에 대 한 백색 0 h APF prepupae, 후 갈색 나타납니다. 번데기 케이스의 해 부 적절 한 번데기는 결 석으로 나왔으며 spiracles 표시 앞쪽 대부분 지역 (화살표)에서 시작 한다이 지역, 그리고 좋은 집게 또는 보호 번데기 케이스 (C)를 제거 하는 데 사용 하는 microscissors. 번데기 날개 (파란색 윤곽선) 번데기 흉부의 측면 측면에 표시 됩니다. (D) 번데기 케이스에서에서 완전히 제거해 18 h APF 번데기, 여기 번데기 롤백 되었습니다 표시 될 이미지를 날개와 측면 사이드 90 ° 파란색으로 설명. (E-F) 5 18 h APF pupae 유리 coverslip 이미징 헵 접착제를 사용 하 여 탈수 (E)을 최소화 하기 위해 물에 젖은 필터 종이 접시 내에 장착. 번데기 준비 하는 동안 발생 한 손상 (화살표) 순서에 있는 제 3 폐기 한다. Pupae coverslip (F) 접촉 (개요 블루) 날개의 평평한 부분으로 오르고 있지만 여러 상처는 경우 다른 위치를 사용할 수 있습니다 레이저 유도 상처 (별표, F), 날개에서 중앙 생성 됩니다. 공부. (D) 이미지 201623만 드 외., 허가 적응. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
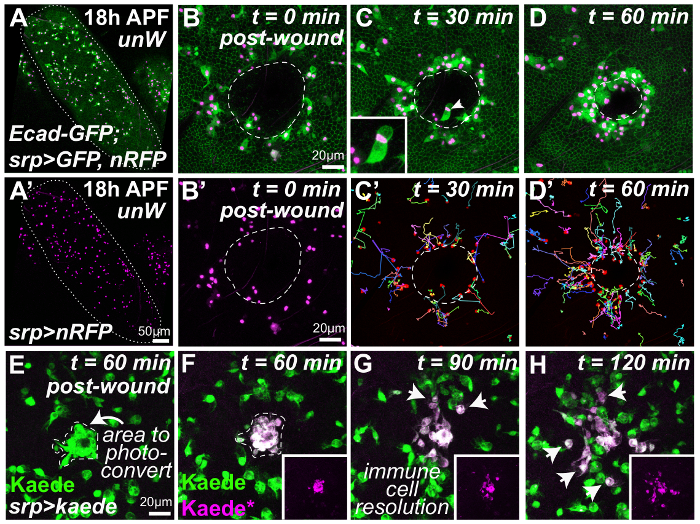
그림 2: 동적 vivo에서 분석 조직 손상에 염증 반응의. Pupae 보호 번데기 케이스에서 해 부하 고 유리 coverslip (A)에 상처를 입었다 고 이후 경과 confocal 현미경 (B-H)를 사용 하 여 몇 군데. 낮은 unwounded 번데기 날개의 확대 보기 (A, 화이트에 명시 된 날개 여백) 철새 hemocytes의 많은 수를 포함 하 (A'). 레이저 유도 상해 번데기 날개 상피 (B-D, 셀 경계 표시 초파리 E cadherin GFP 태그를 사용 하 여, 흰색에서 설명 하는 여백 상처)를 활성화 하는 여러 hemocytes ( 의 마이그레이션 빠른 염증 반응 srp Gal4 구동 핵 RFP, 마젠타 및 세포질 GFP, 녹색의 표현) 상처 사이트 (B D;는 각 프레임 25 조각 3 μ m의 투영은 시간 경과 영화에서 대표적인 프레임)으로. Hemocyte 궤도의 수동 추적 (멀티 컬러 트랙, C' 및 D')는 염증 반응, 비슷한 부상된 배아에 대 한 보고의 복잡 한 spatio 시간적 역학을 나타냅니다. Hemocytes는 또한 부상 사이트에서 괴 사 성 세포 파편 phagocytose (화살촉, C 도 삽입 하 고). Photoconvertible fluorophore가 면역 세포 계보 (녹색, E, srp Gal4를 사용 하 여)에서 표현 수 있습니다 상처 모집 (화살표, E) hemocytes를 차동 (마젠타, F)을 표시 하 고 다음을 시간이 지남에 따라 그들은 부상 사이트 (화살표, G 및 H)에서 확인할. 다음 번데기 genotypes 활용 했다: (A D) w1118; 유비-드-cad-GFP, srp-Gal4 > UAS-GFP(II); UAS-nRFP(III) 및 (전자-H) w1118; srp-Gal4(II); UAS-Kaede(III)입니다. 이미지만 드 외., 201623허가 적응. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
조직 손상으로 급성 염증 반응이 부상된 조직, 회 저 성 파편과 감염에 대 한 싸움의 클리어런스를 포함 하 여의 복구를 조정 필수적입니다 복잡 하 고 매우 역동적인 과정 이다. 완벽 하 게 이해 하 고이 응답의 근본적인 측면을 풀 다, 그것은 연구 수행 비보에 정확한 동작을 위해서 3 차원 생활 샘플에는 및 상호 작용의 다양 한 세포 계보에 따라 관련 된 중요 한 시간 동안 정확 하 게. 이러한 세포 역학의 실시간 분석 정적 한 시간-포인트 클래식 immunohistochemistry 기술을 사용 하 여 고정된 샘플에서 돌연변이 고기의 자세한 특성을 수 있습니다. 전통적으로, 대부분의 라이브 이미징 연구 유전자 온순한 초파리 모델을 사용 하 여 광학 반투명 및 부동 나중 발달 단계4 에 비해 fruitfly 개발의 배아 단계 사용 , 그러나 5., 최근 우리의 그룹 및 다른 개발 초파리 번데기 높은 해상도 동시에 상처 수리 및 염증의 장기 이미징 수행을 새로운 모델로 vivo에서8,22 ,23. 이 새로운 접근 염증 세포 행동의 분열 근본적인 측면에 대 한 흥미로운 장기 잠재력을 제공 하 고 추가 조사 (예: 초파리 adipocytes 다른 세포 계보의 동적 동작을 적용할 수 있습니다. 38) 조직 상해를 따르는.
준비 및 위에서 설명한 이미징 결과의 품질을 결정 하는 부상된 초파리 번데기의 이미징 동안 중요 한 요인이 있다. 틀림 없이 설명된 프로토콜의 가장 어려운 단계는 주의 해 부와 부상 및 이미징 전에 번데기의 정확한 위치입니다. 이 발달 단계에서 번데기는 충격에 약 하 고 준비 단계 동안 번데기에 사소한 실수로 손상을 크게 실험; 저하 됩니다. 이 손상에 다른 선 동적인 세포 행동에 더 넓은 확산 (또는 심지어 조직) 효과로 이어질 수 그것의 자신의 염증 반응을 활성화할 수 있기 때문에 의도 하지 않은 피해를 입은 수 있습니다 어떤 pupae 실험에서 폐기 해야 번데기입니다. (어떤 중요 한 조직 재배열 성인 조직 준비 중인)이이 실험에 활용 하는 번데기의 지속적인 개발으로 인해 때때로 pupae 이미징 과정 이동 합니다. 그러나 번데기 롤링은,, 번데기가 되어 올바르게 마운트하지 않으면 날개 (또는 이미지 수를 다른 조직)의 평평한 표면 coverglass;와 직접 접촉에서 하는 경우 발생할 가능성이 더 커버 유리에 pupae 안정 헵 접착제의 사용이 바람직하지 않은 움직임을 최소화 해야 합니다. 이러한 이유로, 큰 주의 해야 합니다 또한 현미경; 사이 샘플을 이동할 때 그들의 신중 하 게 정렬 된 위치에서 번데기를 dislodging 피하려고 이상적으로, 부상 레이저 후속 시간 경과 영상 및 사진 변환에 사용할 동일한 현미경에 연결 됩니다.
번데기 해 부 및 장착 단계의 능력 뿐만 아니라 사용 초파리 번데기의 정확한 유전자 생성 된 영상 데이터의 품질에 큰 영향을 해야한다. 예를 들어 Gal4 드라이버 및 개별 번데기 유전자 내에서 UAS 구문 (예: UAS-GFP 또는 UAS가)의 사본의 수 후속 이미징 동안 신호 대 잡음 비율을 결정 합니다. 일반적으로 Gal4 또는 UAS 의 더 많은 복사본에는 현재, 더 큰 조직 내의 형광 성 단백질 (예: GFP 또는 장난)의 총 수준을 구성합니다. 그러나 형광 단백질의 최적 수준을,, 될 충분히 고품질 이미징 (낮은 레이저 힘, photobleaching에 감소의 사용과 오랜된 시간 동안 이미징 수 있도록 높이기 조직 형광 사이 주의 균형 기간) 하지만 fluorophore 유도 세포 독성; 발생 하지 않고 각 실험에 Gal4 및 UAS 구문 최적의 수 fluorophores 사용 되 고 특정 드라이버에 따라 달라 집니다. Gal4 UAS 시스템 민감한 온도 낮은 온도31에 효과가 있을 것입니다 때문에 25 ° C에서 (또는 최대 29 ° C 이상) 번데기를 주의 한다. 달성 하기 위하여 조직 제어 레벨 또는 Gal4-식 구동 시간-특이성, Gal4 UAS 시스템 진압 Gal80 번데기 유전자 형39에 포함 될 수 있습니다. Gal80 특정 조직 (를 사용 하 여 조직 관련 Gal80) 내에서 또는 특정 시간에 Gal4 활동을 억 누르기 위해 사용 되거나 수 (온도 사용 하 여 민감한 Gal80). Gal4 UAS 시스템 추가와 결합 될 수 다른 독립적인 바이너리 시스템 (LexA-lexAop 및 QF-QUAS 시스템) 초파리 는 여러 구문 (예: fluorophores, RNAi 라인을 생성 하 또는 다른 유전 구조) 다른 조직39의 범위에 동시에 표현.
사용이 새로운 초파리 번데기 모델의 장점이 더 전통적인 태아 접근을 제공합니다. (최대 3 h) 단기 영상에 비해 무대 15 배아 (무대는 대부분 배아 연구 부상에서 수행 됩니다)에서 사용할 수 있는 pupae 시간 (주 후 번데기 개발의 96 h 성인 기까지 상당히 긴 기간 동안 군데 수 ). 또한, hemocytes (초파리 타고 난 면역 세포)의 훨씬 더 큰 숫자는 번데기 조직 내의 존재 (이미징에 사용할 수 있는)에 비해 태아 내의 더 제한 된 수 및이 수집 하기 위해 우리 수 있다 훨씬 더 많은 이미지의 표본 같은 총 수를 사용 하 여 hemocyte 동작에 대 한 데이터입니다. 결정적으로,이, 차례로 있게 hemocytes 동작을 분석 하 고 상처 attractants와 달리 실험적으로 남아 있을 것 이다 염증 반응의 비 발한 특징을 추출 하는 보다 정교한 수학적 모델링을 적용 액세스할 수23. 다른 번데기 모델의 장점은 그 RNAi 중재 유전자 최저 보다 훨씬 효율적 이전 배아 단계에서 조직 또는 시간 특정 유전자 비활성화 Gal4 UAS 시스템 바이너리 시스템을 사용 하 여 향상 된 분석을 수 39.이 단계에서 RNAi의 효율성 따라서 대규모 (또는 심지어 편견된 게놈 넓은) 수행 가능성이 열립니다 RNAi 상처 복구 또는 염증 성 셀 동작에 관련 된 새로운 선수에 대 한 검색 화면.
그러나, 초파리 번데기 명확 하 게 사용할 수 있는 배아는 유전 돌연변이에서 발생 하는 고기를 공부 하 치명적인; 배아 발달에 필수적인 유전자의 기능과 라이브 이미징 연구에 시간 또는 조직의 특정 방식으로 RNAi 중재 유전자 최저 허용 번데기 단계를 통해 발생 하는 개발 하지 않는 한 배아에 따라서 여전히 수행 합니다. 태아는 공부를 선택 하 고 라이브 이미지의 모델에 또한 남아 있다 그들의 근원에서 면역 세포의 발달 분산, 연락처-운동의 억제, apoptotic 시체의 식 균 작용을 포함 하 여 면역 세포의 특정 기능 개발 조직 번데기 모델에서 관찰 하지 아직5,8 조각 중에 생성. 비록 상처 수리 및 염증40,41,,4243, 를 기본 메커니즘에 대 한 중요 한 통찰력을 제공 하는 초파리 애벌레 및 성인 연구 이 단계에서 44 라이브 이미징 연구 샘플의 본질적으로 모바일 특성상 어려운 입증 했다. 애벌레는 라이브 이미징의 짧은 기간 동안 수 있도록 취 수 있습니다., 하는 동안 마 취의 임시 특성상 라이브 상처의 짧은 스냅만 수리 또는 염증 반응이 시각된45수 있습니다. 최근 연구는 지금 준비 및 아직도 이미징 배아 또는 번데기 보다 상당히 더 많은 도전 남아 있지만 애벌레 부상46, 치료의 장기적인 이미지를 허용 하는 향상 된 프로토콜을 개발 했다. 장기, 우리 구상 하는 각 특정 질문,이 단계의 다른 초파리 -성인 기 (각각에 애벌레 및 번데기 기간을 통해 배아에서 모든 4에서 연구에 가장 적절 한 발달 단계를 이용 하 여 그들의 자신의 독특한 장점과 한계)-상처 복구와 염증 분자 및 세포 메커니즘으로 상호 보완적인 통찰력을 제공할 것입니다.
미래에 부상 및 초파리 번데기의 장기 이미징이이 프로토콜 염증 관련 현상의 범위를 공부 쉽게 적용할 수 있으며 염증 성 상처 응답의 잠복 새로운 기능에 대 한 광범위 한 가능성. Photoconvertible fluorophores (단풍나무), 등의 응용 프로그램과 함께 장기 영상의 조합 타고 난 면역 세포 행동의 역학을 이해 하기 위한 훌륭한 가치 이며 특히, 멀리 더 적은 이해의 확인 단계 상처 염증 반응입니다. 구체적으로 개인 또는 (같은 상처를 그 모집) 면역 세포의 부분 모집단의 라벨 가능할 것 이다 (와 같은 시체 또는 부상) 한 환경 큐에 노출 나중에 면역 세포의 후속 반응에 미치는 영향을 분석 하 큐입니다. 초파리 hemocytes의 선 동적인 행동은 이전 경험에 의해 변경 될 수 있습니다-예를 들어 그들은 개발12 동안 apoptotic 시체의 이전 먹어서 여 조직 부상에 대응 하 액은 그러나 그것 볼 수 있다 여부를 다른 환경 신호 유도 비슷한 못쓰게 이벤트. 번데기 상처 지금까지 연구는 타고 난 염증 반응에 초점을 맞추고 있다, 있지만 번데기 날개 모델 모두 라이브 이미지 하는 이상적인 기회를 제공 하 고 상피 상처 복구 기본 메커니즘을 해 부. 또한,이 번데기 이미징 방법 또한 다른 세포 계보 조직 손상38, 번데기 날개 자체 또는 다른 쉽게 접근할 수 있는 번데기 조직 (예: 눈, 다리 또는 흉부)에 대 한 응답의 동적 동작을 조사 하기 위해 적응 수 있습니다. 마지막으로, 장기 번데기 이미징의 용이성과 함께 초파리 의 유전 추적성을 결합 하 여 새로운 상피 수리 또는 염증 성 레 귤 레이 터 수 편견된 게놈 넓은 눕의 응용 프로그램을 통해 대상 접근 한다.
공개
저자 들은 관심의 충돌이 없는 경쟁을 선언 합니다.
감사의 말
우리는 마틴, Nobes, 리처드슨과 도움이 토론을 위한 나무 연구소의 구성원에 게 감사 하 고 싶습니다. 우리는 또한 울프 Bioimaging 시설 (브리스톨 대학, 영국), 블루밍턴 증권 센터 (인디애나 대학, 미국)와 비엔나 초파리 리소스 센터 ( 초파리 주식) 및 Flybase (최신 초파리에 대 한 감사 유전자 주석). 이 작업 시 MRC 프로젝트 교부 금에 의해 지원 되었다와 트 면 (MR/J002577/1), 트 면에 Wellcome 트러스트 수석 장학금 및 오후 Wellcome 신뢰 조사 상.
자료
| Name | Company | Catalog Number | Comments |
| Drosophila stocks | |||
| ubiquitous GFP-tagged E-cadherin ;Ubi-p63E-shg.GFP; (chrII) | Kyoto Stock Center, DGRC | #109007 | Ubi-p63E promoter sequences drive expression of Drosophila E-cadherin (shotgun) tagged at the C-terminal end with GFP. |
| ubiquitous GFP-tagged E-cadherin ;;Ubi-p63E-shg.GFP (III) | Bloomington Drosophila Stock Centre (Indiana University) | #58742 | Ubi-p63E promoter sequences drive expression of Drosophila E-cadherin (shotgun) tagged at the C-terminal end with GFP. |
| ubiquitous GFP-tagged Moesin P{sGMCA}3.1 | Bloomington Drosophila Stock Centre (Indiana University) | #59023 | The ubiquitously expressed sqh promoter/enhancer drives expression of a fragment of Moesin (that includes the actin binding sequences) tagged with GFPS65T. |
| hemocyte specific serpent-Gal4 driver ;srp-Gal4; | Generated by Katja Bruckner | Generated by Katja Bruckner | Expression of Scer\GAL4 fused to a polyA tail is under the control of 2 genomic sequences from upstream of Drosophila serpent. Ref: Brückner, K., Kockel, L., Duchek, P., Luque, C.M., Rørth, P., Perrimon, N. The PDGF/VEGF receptor controls blood cell survival in Drosophila. Dev Cell. 7 (1), 73–84, doi: 10.1016/j.devcel.2004.06.007 (2004). |
| UAS-nuclearRFP w1118;;P{UAS-RedStinger}6 | Bloomington Drosophila Stock Centre (Indiana University) | #8545 or #8547 | UAS regulatory sequences drive expression of the DsRed.T4 form of RFP which is tagged at the C-terminal end with a nuclear localisation signal |
| UAS-cytoplasmicGFP ;;P{UAS-GFP.S65T} | Bloomington Drosophila Stock Centre (Indiana University) | Multiple stocks available (e.g. #1522) | Expression of the S65T version of GFP by UAS regulatory sequences; the S65T variant exhibits increased brightness. |
| UAS-photoconvertibleKaede w1118;; P{UAS-Kaede.A}3 | Bloomington Drosophila Stock Centre (Indiana University) | #26161 | Kaede protein emits bright green fluorescence after synthesis, but changes efficiently to a bright stable red fluorescence on irradiation with UV. |
| GFP-tagged spaghetti squash w1118;;P{sqh-GFP.RLC} | Bloomington Drosophila Stock Centre (Indiana University) | #57145 | The sqh coding region, which is tagged at the C-terminal end with a T:Avic\GFPS65T tag, is expressed under the control of the natural sqh promoter. |
| Name | Company | Catalog Number | Comments |
| Ingredients for fly food media | Fly food media is made according to standard procedures (see Greenspan, R. 1997. Fly Pushing: The Theory and Practice of Drosophila Genetics. Cold Spring Harbor Press. 1-191 pp.) | ||
| maize | Wild Oats, Bristol, UK (or equivalent supplier) | Contact supplier direct | organic |
| soya flour | Wild Oats, Bristol, UK (or equivalent supplier) | Contact supplier direct | organic |
| malt extract | Wild Oats, Bristol, UK (or equivalent supplier) | Contact supplier direct | organic |
| molasses | Wild Oats, Bristol, UK (or equivalent supplier) | Contact supplier direct | organic |
| Difco agar | BD Biosciences, Fisher Scientific | DF0142-15-2 | For preparation of fly food |
| Propionic acid | Sigma | 402907 | For preparation of fly food |
| Nipagen | Sigma | 79721 | For preparation of fly food |
| Dried baker's yeast | Redstar, Dutscher Scientific, UK LTD | Redstar, Dutscher Scientific, UK LTD | For preparation of fly food |
| Name | Company | Catalog Number | Comments |
| Sample preparation and mounting | |||
| Parafilm | Sigma | P7793-1EA | For preparation of heptane glue |
| Fine sable paintbrush | Daler-Rowney (or equivalent) | #0 or 1 | |
| Forceps | Fisher Scientific (or Fine Science Tools) | NC9404145 | Dumont #5 |
| Glass bottomed dishes for imaging | MatTek | P35G-0-10-C | We suggest using 35mm petri dishes, with at least a 10mm Microwell, 0.085-0.13mm cover glass, uncoated. Dishes with larger microwells will enable increasing numbers of pupae to be mounted and imaged in a single experiment. |
| Heptane | Sigma | 51730-5ML | For preparation of heptane glue |
| Double sided sticky tape (e.g. Scotch) | Agar Scientific | AGG263 | For preparation of heptane glue |
| 50ml tube (for heptane glue) | Falcon tubes from Fisher Scientific | 14-432-22 | For preparation of heptane glue |
| Glass microscope slides | Agar Scientific | AGL4244 | For dissection of Drosophila pupae |
| Dissecting stereo microscope with brightfield | Leica (or equivalent) | M50 | For dissection of Drosophila pupae |
| Microscissors | John Weiss International | 103123 | Miniature Research Scissors (straight) |
| Name | Company | Catalog Number | Comments |
| Laser ablation and imaging | |||
| Nitogen ablation laser | Spectra-Physics (or Andor equivalent) | Model VSL-337ND-S | For wounding, this should be attached to a widefield imaging system |
| Multilaser confocal laser-scanning microscope (CLSM) | Leica (or equivalent) | TCS AOBS SP8 or SP5-II attached to a Leica DMi8 inverted epifluorescence microscope (or equivalent) | Ideally including a motorised stage for multi-site and 'mosaic' scanning, plus ‘hybrid’ GaAsP detectors (that offer much greater sensitivity and boosting of low signal) |
| Environmental chamber | Life Imaging Services (or equivalent) | "Microscope Temperature Control System" | Attached to Confocal microscope for temperature control during imaging |
| Name | Company | Catalog Number | Comments |
| Image Analysis Software | |||
| FRAP software module | Leica (or equivalent) | CLSM FRAP software module | For performing photoconversion of photoconvertible fluorophores such as Kaede |
| ImageJ (image analysis software) | National Institutes of Health (NIH) | https://imagej.nih.gov/ij/ | Schneider, C.A., Rasband, W.S., Eliceiri, K.W. "NIH Image to ImageJ: 25 years of image analysis". Nature Methods 9, 671-675, 2012. |
| ImageJ plugin "Manual Tracking" | National Institutes of Health (NIH) | https://imagej.net/Manual_Tracking | |
| ImageJ plugin "TrackMate" | ImageJ, NIH | https://imagej.net/TrackMate | Tinevez, JY.; Perry, N. & Schindelin, J. et al. (2016), "TrackMate: An open and extensible platform for single-particle tracking.", Methods 115: 80-90, PMID 27713081 |
| Volocity (high performance 3D imaging software) | Perkin Elmer | Volocity 6.3 | For image analysis |
| IMARIS (image analysis software) | Bitplane | IMARIS for Cell Biologists | For image analysis |
참고문헌
- Eming, S. A., Wynn, T. A., Martin, P. Inflammation and metabolism in tissue repair and regeneration. Science. 356 (6342), 1026-1030 (2017).
- Crusz, S. M., Balkwill, F. R. Inflammation and cancer: advances and new agents. Nature Reviews Clinical Oncology. 12 (10), 584-596 (2015).
- Martin, P., Nunan, R. Cellular and molecular mechanisms of repair in acute and chronic wound healing. British Journal of Dermatology. 173 (2), 370-378 (2015).
- Razzell, W., Wood, W., Martin, P. Swatting flies: modelling wound healing and inflammation in Drosophila. Disease Model and Mechanism. 4 (5), 569-574 (2011).
- Wood, W., Martin, P. Macrophage Functions in Tissue Patterning and Disease: New Insights from the Fly. Development Cell. 40 (3), 221-233 (2017).
- Mohr, S. E., Smith, J. A., Shamu, C. E., Neumüller, R. A., Perrimon, N. RNAi screening comes of age: improved techniques and complementary approaches. Nature Reviews Molecular Cell Biology. 15 (9), 591-600 (2014).
- Muñoz-Soriano, V., López-Domenech, S., Paricio, N. Why mammalian wound-healing researchers may wish to turn to Drosophila as a model. Experimental Dermatology. 23 (8), 538-542 (2014).
- Weavers, H., Wood, W. Creating a Buzz about Macrophages: The Fly as an In Vivo Model for Studying Immune Cell Behavior. Developmental Cell. 38 (2), 129-132 (2016).
- Stramer, B., et al. Live imaging of wound inflammation in Drosophila embryos reveals key roles for small GTPases during in vivo cell migration. Journal of Cell Biology. 168 (4), 567-573 (2005).
- Wood, W., Faria, C., Jacinto, A. Distinct mechanisms regulate hemocyte chemotaxis during development and wound healing in Drosophila melanogaster. Journal of Cell Biolog. 173 (3), 405-416 (2006).
- Razzell, W., Evans, I. R., Martin, P., Wood, W. Calcium flashes orchestrate the wound inflammatory response through DUOX activation and hydrogen peroxide release. Current Biology. 23 (5), 424-429 (2013).
- Weavers, H., Evans, I. R., Martin, P., Wood, W. Corpse Engulfment Generates a Molecular Memory that Primes the Macrophage Inflammatory Response. Cell. , (2016).
- Stramer, B., Winfield, M., Shaw, T., Millard, T. H., Woolner, S., Martin, P. Gene induction following wounding of wild-type versus macrophage-deficient Drosophila embryos. EMBO Reports. 9 (5), 465-471 (2008).
- Matsubayashi, Y., Coulson-Gilmer, C., Millard, T. H. Endocytosis-dependent coordination of multiple actin regulators is required for wound healing. Journal of Cell Bioliogy. 210 (3), 419-433 (2015).
- Evans, I. R., Rodrigues, F. S. L. M., Armitage, E. L., Wood, W. Draper/CED-1 Mediates an Ancient Damage Response to Control Inflammatory Blood Cell Migration In Vivo. Current Biology. 25 (12), 1606-1612 (2015).
- Zanet, J., Stramer, B., Millard, T., Martin, P., Payre, F., Plaza, S. Fascin is required for blood cell migration during Drosophila embryogenesis. Development. 136 (15), 2557-2565 (2009).
- Bainbridge, S. P., Bownes, M. Staging the metamorphosis of Drosophila melanogaster. Journal of Embryology and Experimental Morphology. 66, 57-80 (1981).
- Ninov, N., Martín-Blanco, E. Live imaging of epidermal morphogenesis during the development of the adult abdominal epidermis of Drosophila. Nature Protocols. 2 (12), 3074-3080 (2007).
- Gho, M., Bellaïche, Y., Schweisguth, F. Revisiting the Drosophila microchaete lineage: a novel intrinsically asymmetric cell division generates a glial cell. Development. 126 (16), 3573-3584 (1999).
- Puah, W. C., Wasser, M. Live imaging of muscles in Drosophila metamorphosis: Towards high-throughput gene identification and function analysis. Methods. 96, 103-117 (2016).
- Berh, D., Scherzinger, A., Otto, N., Jiang, X., Klämbt, C., Risse, B. Automatic non-invasive heartbeat quantification of Drosophila pupae. Computers in Biology and Medicine. 93, 189-199 (2018).
- Sander, M., Squarr, A. J., Risse, B., Jiang, X., Bogdan, S. Drosophila pupal macrophages--a versatile tool for combined ex vivo and in vivo imaging of actin dynamics at high resolution. European Journal of Cell Biology. 92 (10-11), 349-354 (2013).
- Weavers, H., Liepe, J., Sim, A., Wood, W., Martin, P., Stumpf, M. P. H. Systems Analysis of the Dynamic Inflammatory Response to Tissue Damage Reveals Spatiotemporal Properties of the Wound Attractant Gradient. Current Biology. 26 (15), 1975-1989 (2016).
- Fristrom, D., Wilcox, M., Fristrom, J. The distribution of PS integrins, laminin A and F-actin during key stages in Drosophila wing development. Development. 117 (2), (1993).
- Brückner, K., Kockel, L., Duchek, P., Luque, C. M., Rørth, P., Perrimon, N. The PDGF/VEGF receptor controls blood cell survival in Drosophila. Development Cell. 7 (1), 73-84 (2004).
- Diehl, H., Ihlefield, H., Schwegler, H. . Physik fur Biologen. , (1991).
- Stewart, P. S., McFeters, G. A., Huang, C. T. Biofilm control by antimicrobial agents. Biofilms II Process Analysis and Application. , 373-405 (2000).
- . Cell Biology by the Numbers Available from: https://books.google.com/books?id=9NPRCgAAQBAJ&pgis=1 (2015)
- Ando, R., Hama, H., Yamamoto-Hino, M., Mizuno, H., Miyawaki, A. An optical marker based on the UV-induced green-to-red photoconversion of a fluorescent protein. Proceeding of National Academy of Science U S A. 99 (20), 12651-12656 (2002).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Tinevez, J. -. Y., et al. TrackMate: An open and extensible platform for single-particle tracking. Methods. 115, 80-90 (2017).
- Grueber, W., et al. Projections of Drosophila multidendritic neurons in the central nervous system: links with peripheral dendrite morphology. Development. 134 (1), 55-64 (2007).
- Wood, W., Faria, C., Jacinto, A. Distinct mechanisms regulate hemocyte chemotaxis during development and wound healing in Drosophila melanogaster. Journal of Cell Biology. 173 (3), 405-416 (2006).
- Wood, W., et al. Wound healing recapitulates morphogenesis in Drosophila embryos. Nature Cell Biology. 4 (11), 907-912 (2002).
- Franz, A., Wood, W., Martin, P. Fat Body Cells Are Motile and Actively Migrate to Wounds to Drive Repair and Prevent Infection. Developmetal Cell. 44 (4), 460-470 (2018).
- del Valle Rodríguez, A., Didiano, D., Desplan, C. Power tools for gene expression and clonal analysis in Drosophila. Nature Methods. 9 (1), 47-55 (2012).
- Losick, V. P., Fox, D. T., Spradling, A. C. Polyploidization and Cell Fusion Contribute to Wound Healing in the Adult Drosophila Epithelium. Current Biology. 23 (22), 2224-2232 (2013).
- Babcock, D. T., et al. Circulating blood cells function as a surveillance system for damaged tissue in Drosophila larvae. Proceedings of National Academy of Science U S A. 105 (29), 10017-10022 (2008).
- Galko, M. J., et al. Cellular and Genetic Analysis of Wound Healing in Drosophila Larvae. PLoS Biology. 2 (8), e239 (2004).
- Brock, A. R., et al. Transcriptional regulation of Profilin during wound closure in Drosophila larvae. Journal of Cell Science. 125 (23), (2013).
- Wu, Y., Brock, A. R., Wang, Y., Fujitani, K., Ueda, R., Galko, M. J. A blood-borne PDGF/VEGF-like ligand initiates wound-induced epidermal cell migration in Drosophila larvae. Current Biology. 19 (17), 1473-1477 (2009).
- Burra, S., Wang, Y., Brock, A. R., Galko, M. J. Using Drosophila Larvae to Study Epidermal Wound Closure and Inflammation. Methods in Molecular Biology. 1037, 449-461 (2013).
- Kakanj, P., et al. Insulin and TOR signal in parallel through FOXO and S6K to promote epithelial wound healing. Nature Communications. 7, 12972 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유