このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
分離してチラコイド脂質リポソームの珪藻峰 Meneghinianaから光捕集アンテナを組み込む
要約
フコキサンチン クロロフィル a/c 結合タンパク質 (FCP) 珪藻を分離し、天然の脂質組成のイオン組成変化の励起エネルギー移動を研究するリポソームにそれらを組み込むのためのプロトコルを紹介します。
要約
強く、植物、藻類、珪藻類の光合成能力は、葉緑体のチラコイド膜での転送プロセスを光収穫とエネルギーの高速かつ効率的な規制に依存します。集光珪藻のアンテナと呼ばれるフコキサンチン クロロフィル a/c 結合タンパク質 (FCP) が光の吸収に必要なと光合成反応に効率的に転送センター写真-過剰な光からの保護も同様。これら 2 つの関数の間のスイッチは、研究の長年問題です。これらの研究の多くは FCP で洗剤のミセルで行われています。相互作用の研究、FCP 錯体の非特異的凝集につながった、洗剤を削除されています。このアプローチで成果物と関連する生理学的データを区別するは難しいです。したがって、FCP や他の膜に埋もれた集光複合体についての有益な情報は、ネイティブ脂質環境に埋め込まれている場合、タンパク質間相互作用、エネルギー移動、他の分光学的特徴を研究することによって取得できます。主な利点は、リポソームが定義されているサイズと FCP のクラスタ リングの範囲を制御する定義された脂質・ タンパク質比ことです。さらに、集光性体内を調節する pH とイオン組成の変化は、簡単にシミュレートできます。チラコイド膜と比較してリポソームより均一なより少なく複雑な取得、分光学的データを理解して簡単に。プロトコルでは、FCP 分離精製、リポソーム調製と FCP の天然脂質リポソームへの取り込みの手順について説明します。一般的なアプリケーションからの結果が与えられ、議論。
概要
珪藻など光合成生物必要があります刻 々 変化する光条件に対処し、光合成効率を維持し、過剰な光によって写真酸化ダメージから保護する高度順化のメカニズムと対応します。光合成真核生物の主要な光保護プロセスは高エネルギー焼入れ (qE) の光ストレス条件1,2 の下で非光化学の焼入 (NPQ) への主要な貢献として発生する吸収光 ,3。光の収穫アンテナ複合体 (LHC) は、励起エネルギー移動経路の調節に関与しています。高い光に応答低pH葉緑体ルーメン、集光状態を急冷状態からアンテナ システム スイッチを誘発しました。このエネルギー散逸状態は、光酸化からのダメージを与える (PS) とチラコイド膜の他の複合体を保護します。光合成真核生物で qEは通常、2 つの要因1,2,3によって誘導します。要因の一つは、特殊な集光性タンパク質低pHに応答します。PsbS 蛋白質はより高い植物4qEを誘導します。LhcSRs5、PsbS 活動によって変調は、緑藻6で qEを誘発します。珪藻では、構造的に LHCSRs7,8,9,10に関連している Lhcx のような蛋白質を所有しています。
QEの 2 番目の要素は、アンテナのカロテノイドが de エポキシ化によって写真保護形式に変換、エポキシ化によって元に戻さキサントフィル サイクルです。植物や緑藻、ビオラキサンチンはゼアキサンチンに変換されます。珪藻の diadinoxanthin は NPQ11の程度と相関し、diatoxanthin に変換されます。珪藻集光アンテナはそれは進化植物と藻類の LHCs に関連するいくつかの特性を所有しています。光の写真の保護するために収穫からスイッチが非常に高速と NPQ 容量は植物12に比べて高い。これは珪藻が13海洋純一次生産量の 45% までに責任がある方法でさまざまな生態学的ニッチの非常に成功した 1 つの理由があります。したがって、光収穫系珪藻は光合成研究の興味深いオブジェクトです。
珪藻、峰 meneghinianaの中心の種は、チラコイド本質的な集光性色素にちなんで彼らのシステムを所有しているようなバインド - フコキサンチン、クロロフィル a と c、それゆえ FCP. 集光性タンパク質、FCPs などいくつかの膜層を構成するチラコイド膜システムに埋め込まれます。珪藻は、3 つのチラコイドのバンドを形作る。この複合体チラコイド膜で分子レベルで研究するが困難な状況です。さらに、多くのコンポーネントは、集光性 (上記参照) の規制に貢献します。したがって、さまざまな方法で複合体は、n-ドデシル-β-D-maltopyranoside (β-DDM)、膜可溶化が FCP 複合体をそのまま維持など、穏やかな洗剤を使用して膜から分離しました。可溶化された FCP を使用して分子内エネルギー転送14,15,16,17を調査する多くの分光学的研究を行った。しかし、この前者のアプローチは、エネルギー転送の規制が他のアンテナ複合体やダメージを与えると励起子相互作用を必要とするので、限られていた。したがって、これらの種類の研究が複合体間の相互作用が失われるためにを可溶化された錯体を実施できません。
アンテナ規制の重要な機能は、アンテナとチラコイド膜18のダメージを与える「分子クラウディング」です。以前は、単純なアプローチは、この効果をシミュレートするために実施された体外。アンテナ複合体のランダムな集約につながる洗剤が削除されました。いくつかの合理的なデータは、このアプローチの17,19によって得られた、洗剤除去体内の状況を反映していない、複合体は通常第三に対話していないのでいくつかの制限があります。構造体です。
リポソームを用いる元の制限のいくつかを克服します。第三構造は完全にそのままです。リポソーム膜はアンテナ複合体の準ネイティブ環境を提供します。膜は、リポソームの内部を外部環境から分離します。これらの手段では、リポソームは、輸送過程については同様のイオン ・ pH 勾配の研究の 2 つの反応区画を提供します。さらに、チラコイド膜の研究のため実験システムのパラメーターをより簡単に制御できます。リポソームは、既に光合成錯体を研究する優れたツールであること示されていた。過去の主要な焦点だった植物 LHC LHC II20に変更後の脂質組成の影響を調べた。他のアプローチで異なる LHC II 間の蛋白質蛋白質の相互作用は調査21だったまた、緑の藻でいくつかの研究を行った LHC22の間自発的なクラスタ リングについて説明します。、水生生物の生態系の珪藻の重要性を考慮した珪藻のアンテナ複合体に比較的少数の研究を行った。2 つの研究は、FCP アンテナ23と FCP の応答性の電気化学的勾配24にクラスタ リングが示した中心峰 meneghinianaのアンテナ複合体を検討しました。したがって、リポソーム、珪藻アンテナ相互作用とほぼネイティブ条件で規制を勉強する優れたツールです。リポソーム、脂質、リポソーム サイズ、密度などの多くの条件からの汎用性と周囲の水相を制御できます。さらに、メソッドのサンプルの少量が必要です。実験システムは、堅牢かつ再現性が高い。リポソームの区分により pH を勉強して、アンテナ複合体の調節に重要なイオン勾配要因。
ここでは、 c. meneghinianaから FCP アンテナ複合体の単離とその自然なチラコイド脂質リポソームについて述べる。また、可溶化された FCP の分光特性評価の模範的なデータを提供し、リポソームの FCP との比較します。メソッドは、知識と Gundermann と Büchel 2012 年23ナタリら2016年22アフマドと Dietzel 2017 年の24の改善から得られる標準化されたプロトコルをまとめたものです。

図 1: ワークフローの模式図。( 1) 細胞の成長、混乱およびショ糖密度勾配; 次の FCP 分離チラコイド分離を説明する段落 1 を参照C. m.-峰 meneghiniana細胞。(2) 2 と octylglycoside (OG) 脂質界面活性剤ミセルの創造、自然チラコイド脂質混合物 (MGDG、DGDG SQDG) の調製は項で説明します。定義された脂質ミセルの大きさは、定義された孔径の膜を用いた押出によって実現されます。FCP と脂質ミセルが定義済みの脂質で統一: タンパク質比や OG と β DDM の洗剤は削除を介して制御される透析 FCP プロテオリポソームを形成します。この図の拡大版を表示するのにはここをクリックしてください。
プロトコル
注:FCPs など光合成複合体が光と熱に対して非常に脆弱です。氷の上、非常に薄暗い光の下では常に動作します。
1. 細胞から FCP の分離
-
C. meneghiniana細胞からチラコイド分離
- C. meneghiniana 5 500 mL フラスコ 300 mL ASP 中23,25と 5000 万セルの満ちているそれぞれに成長します。綿栓付けフラスコを接続でき、16 h 光 120 rpm でシェーカーで約 1 週間の指数関数的成長相および 40 µmol photons/(m²s) 白い光で 8 時間暗期と温度 15-18 ° C の間に成長する細胞150 万セル/mL セル カウンター区域で間にあるセル数を確認します。
- 高速遠心分離機で 15 分間 500 mL 遠心分離機バイアル (4 ° C) で冷却ロータで 4,000 x gで細胞を遠心します。再ピペッティングによる均質化バッファー (HB,表 1) の 12 の mL の細胞ペレットを中断します。
- シングル 50 mL プラスチック チューブに懸濁液を転送します。-80 ° c のサンプルを格納または 1.1.3 のステップへ進みます。
- 前クールなビーズミルと機器。ガラス ビーズの混合物では 75% のビーズミル 50 mL ビーカーを記入し、細胞懸濁液を追加します。セル中断の全速 30 7 x 45 のパルスを使用して、各パルスの間冷却の s。1.1.6 の手順で品質チェックの乱れた細胞の 20 μ L を取る。
- 彼らがはっきり表示されるまでガラス製のビーズに HB を注ぐことによってガラス漏斗フィルターと洗浄の上中断セルをフィルターします。濾液と洗浄率をプールします。最終巻を 150 mL よりも低くしてください。
- 140 x g細胞の残骸をペレットに 3 つ 50 mL プラスチック チューブを使用して 15 分のサンプルを遠心します。慎重に上清を 20 mL ポリカーボネート遠心バイアルに転送し、ペレットを破棄します。
- HB でバイアルを埋める、重量を平衡させ、300,000 x gとペレット チラコイド膜への 4 ° C で 1 時間の適したローターの遠心分離機します。
- 遠心分離の時間を使用して、1.1.3 で 20 μ L のサンプルで 400 倍の倍率での顕微鏡による混乱した細胞の割合をチェックします。無料の葉緑体と葉緑体の遺骸 (シリカの殻) を含む間の比率を計算します。
注: 珪藻の細胞壁は、高い回折顕微鏡で物質として表示されているシリカの作られています。セル中断が働いていた場合、として緑のドットを発生する葉緑体は細胞からでリリースされている必要があります。 - できるだけ小さな洗浄バッファーとしての膜ペレットを再中断 (0.5-1 mL) 小さな画家のブラシを使用して。ポリカーボネート遠心バイアルの洗浄液 (表 1) を詰めて、重量および 200,000 x gと 4 ° C で 20 分間遠心を平衡
- 画家のブラシで洗浄の膜を再中断します。チラコイド濃度をできるだけ高く保つために必要な場合のみ、洗浄バッファーを追加します。1 つのサンプル瓶 (15 mL) ですべてチラコイドをプールします。
- 100% アセトンの 90 μ L で 10 μ L のサンプルを使用してサンプルを希釈済み。沈殿したタンパク質を餌に 5 分間、12,000 × gで遠心分離機に。Predilution の 10 μ L を取るし、90% アセトンの 990 μ L で混ぜます。
- クロロフィル a 及び c 664 の吸光度 (ABS) を測定 nm と 630 nm の 90% アセトン。両方の値から ABS750 nmを減算します。次の数式を使用して総クロロフィル内容の決定:24
1)
2)
- クロロフィル a 及び c 664 の吸光度 (ABS) を測定 nm と 630 nm の 90% アセトン。両方の値から ABS750 nmを減算します。次の数式を使用して総クロロフィル内容の決定:24
- 分注 0.5 mg 1.5 mL の反応管でクロロフィルの部分でそれらを液体窒素で凍結し、さらに使用まで-80 ° C で保存します。
-
FCP 錯体の分離・濃縮
- ショ糖勾配液を準備し、積載量 (300-500 μ L) マイナス トップまで遠心管を満たします。彼らが完全に冷凍されるまでは、-20 ° C でチューブを固定します。17 mL チューブの 3-4 時間がかかる +4 ° C で融解するチューブを許可します。
- 良い解像度のグラデーションを調整する 2 回凍結融解のサイクルを繰り返します。
- クロロフィルの 0.5 mg に対応する 1.1.9 で得られたサンプルを使用してバッファー B1 で調整する (表 1) に 2 mL の最終巻。可溶化、20 mM の最終的な集中に n-ドデシル-β-D-maltopyranoside (b DDM) を追加します。
- 3 回チューブを反転し、泡を避けるために穏やかな揺れで 20 分間氷の上に置きます。+4 ° C で予冷テーブル トップ遠心分離機で 12,000 × gで 5 分間遠心
- グラデーションの上清をロードします。17 mL バイアルを使用する場合は、グラデーションごと総クロロフィルよりも 125 μ g は読み込まれません。100,000 × gと +4 ° c. で 22 h、遠心分離
- 注射器 (図 2 a) を使用してグラデーションから目的の茶色の FCP 分数を回復します。5 μ L 分注と B1a の 995 μ L で希釈します。
- 370-750 nm 紫外可視分光の間の吸光度 (ABS) スペクトルを測定します。セミ ・ ミクロの光学ガラスのキュベットを使用します。
- スペクトル マネージャー ソフトウェアを開き、スペクトラム モードに行く、750 に 370 からベースラインを記録 nm サンプル測定が続きます。次の設定を使用: スキャン速度、200 nm/分。データ ピッチ、0.5 nm;対応、中。
- マイクロ ピペットで回収されたサンプルの量を測定します。B1 バッファー (表 1) と 2 回の回収量を追加して FCP 複合体を洗います。1,000 x gと少なくとも 20 の ABS672nm +4 ° C においてカットオフ 30 kDa の膜コンセントレーターに集中します。
注:B DDM 濃度は、試料室でミセル濃縮による上昇可能性があります。これは FCP の複合体のそれ以上の可溶化につながる可能性があります!洗剤無料バッファー B1 ステップをさらに洗う場合は残留ショ糖を削除する必要を追加して過可溶化を避けます。 - コントロールの分注 20 μ L を取る。ショック液体窒素でサンプルを凍結し、-80 ° C で保存
- ショ糖勾配液を準備し、積載量 (300-500 μ L) マイナス トップまで遠心管を満たします。彼らが完全に冷凍されるまでは、-20 ° C でチューブを固定します。17 mL チューブの 3-4 時間がかかる +4 ° C で融解するチューブを許可します。

図 2: 浄化の FCP、分光学的コントロールと純度チェック。(A)一晩遠心分離後ショ糖密度勾配の標準的な外観。茶色のバンドをすべて含む FCPa と FCPb pigm から成る FCP プール - 非連結顔料、PS の-(青線) 前に FCP のダメージを与える(B)吸光度スペクトル (オレンジ破線) 濃度 30 kDa カットオフで遠心ろ過デバイスの使用後.特に、カロテノイドは 500-550 nm の間の領域で低い吸光度になる FCP から損失になりやすいです。グラフがクロロフィル Qy ~ 670 で最大に正規化された nm。クロロフィル c の励振(C)クロロフィル a 発光スペクトル (465 nm) 機能の励起エネルギー移動をテストするため。エネルギー転送クロロフィル クロロフィル c の場合は、妨げられている 〜 640 追加蛍光バンド nm (クロロフィル c) が発生します。グラフは、最大排出量に正規化されます。(D)励起スペクトル記録 675 nm (クロロフィル蛍光最大) クロロフィルへのエネルギー移動のテストのため、すべて顔料 370 間吸収から nm と 600 nm。クロロフィルへのエネルギー移動の場合、効率が悪くなります、特に 465 と 550 nm 間蛍光収率が減少します。グラフが最大約 440 に正規化された nm。(B) のスペクトル (C) と (D) 濃度がうまくいった場合はほぼ同じです。(E)は、トリス トリシン ゲル28を使用して分離の FCP の純度を確認します。FCPa および FCPb 18-19 kDa のサブユニットがあります。すべて目に見える銀染色蛋白質 20 kDa より大きいは、汚染物質。Thyl。-チラコイドこの図の拡大版を表示するのにはここをクリックしてください。
-
分光学的及びゲル ベース コントロール
- 995 μ L B1a の 1.2.5 のステップの後で FCP の 5 μ L の 370 750 nm の吸光度を記録します。1.2.4 のステップで得られるスペクトルと比較します。同じインスツルメンテーションと 1.2.4 の手順で説明するように設定を使用します。
- *.Csv としてデータをエクスポートして、スプレッドシートにデータをインポートします。クロロフィルの最大の両方のスペクトルを正常化、約 672 の Qyバンドで nm図 2 bに示すように。
- 1.2.4 と 1.3.1 ステップからサンプルの希釈倍率を計算する、0.03 の必要な ABS672nmによって測定された ABS672nmを割る。それに応じて、サンプルを希釈 B1a とし、特殊ガラス蛍光キュベットに転送。
- クロロフィル クロロフィル (図 2) にクロロフィル c からそのままの光エネルギー移動を明らかにするため蛍光の蛍光発光スペクトルを記録します。
- 分光装置ソフトウェアを使用し、次の設定でスペクトル測定モードに行く: モード、発光。スリット幅励起と放射、3 nm;感度、媒体;スキャン速度、100 nm/分。データ ピッチ、0.5 nm;励起波長 465 nm;排出量は、600-800 nm。オートゼロおよび測定を実行します。
- 同じサンプルとすべて顔料からクロロフィルへのままのエネルギー移動を明らかにするための装置を持つ励起スペクトル (図 2 D) を記録します。設定を変更する: モード、励起;発光波長 675 nm;励起、370-600 nm。スペクトルを記録します。
- ローダミン スペクトル ランプ- cfのスペクトル特性の同じ範囲を修正します。ユーザー マニュアルの指示。
- クロロフィルの 1 μ g に対応するミックス FCP サンプル、SDS の読み込みバッファーの 10 μ L で。25 ° C で 10 分間インキュベートします。テーブル トップ遠心分離機で 12000 × g で 5 分間遠心します。
- トリス トリシン ゲル28上清をロードします。150 V で 2 h の分離および分離40の後で銀-汚れ。
メモ: FCP サブユニットは、FCPa および FCPb29 (図 2 e) の成分である 18-19 kDa の間の 2 つの著名なタンパク質バンドに区切ります。
- トリス トリシン ゲル28上清をロードします。150 V で 2 h の分離および分離40の後で銀-汚れ。
- 995 μ L B1a の 1.2.5 のステップの後で FCP の 5 μ L の 370 750 nm の吸光度を記録します。1.2.4 のステップで得られるスペクトルと比較します。同じインスツルメンテーションと 1.2.4 の手順で説明するように設定を使用します。
2. リポソームと FCP の設立の準備
-
脂質混合物と脂質洗剤ミセルの調製
注:脂質が酸化の条件と組み合わせる温度を暖かく影響を受けやすい。チルドと N2雰囲気下で脂質を維持しようとします。- Vieler et al. 200730によると、 C. meneghinianaの目的チラコイド脂質比を計算します。カスタマーインフォメーション センターの障害表 1の例を参照してください。脂質溶液溶媒証拠コンテナーで製造元の推奨を準備します。
- ピペット 2 mL の反応管内の脂質の希望の金額と穏やかな窒素フローを用いたクロロホルムを蒸発させる脂質をチューブ ベースの全領域に広がるしようとします。すべての溶媒が蒸発するまでに N2を流します。
- 4 h 加温 30 ° c. で 10 分の脂質混合物のための 4 ° C で n-オクチル-β-d-グルコピラノシド ソリューション (OG) の 29 μ L の脂質混合物を可溶化します。25 ° c 30 によって中断される 3 x 3 分間超音波発生装置浴で脂質を孵化させなさい氷の上 s。
- トリシン バッファーの 221 μ L と 4 x 透析バッファーの 250 μ L を追加します。
- 50-70 nm の定義されたリポソーム径 0.1 μ m のポリカーボネート膜と押出機を使用します。膜やフィルターのサポートと押出機を組み立てます。空気の泡を回避し、アセンブリを徹底的に強化します。
- 4 x 透析バッファーと 1 つの注射器を埋めるし、まで 2 回目の注射器で泡を見ることが、押出機を中古ウェットします。
- 脂質洗剤ミセルを押出機に適用など他の 1 つの注射器から解決策を押すし、戻る。5 回均質なソリューションが表示されるまでこの手順を繰り返します。
注:このソリューションは、4 ° C で数日間保存できます。凍結しないでください!
-
FCP 錯体と洗剤と集計の除去
注:この例では我々 は脂質/クロロフィル 12:1 の比率を使用して、脂質・ タンパク質比約 100: 1 に対応します。- クロロフィルの 20 μ g に等しい FCP を追加、250 μL の押し出しの脂質ミセル B1a バッファーを 500 μ l 添加し透析バッファー x 4 の 250 μ L の総ボリュームで。氷の上の 30 秒一時停止によって中断された 1,500-3,000 rpm で thermomixer の 25 ° C で 3 x 3 分のサンプルをインキュベートします。
- まだ蓋に収まる指輪を与えるトップのすぐ下の 4 つの 1.5 mL の反応チューブの蓋をカットします。透析膜の 1.5 cm × 1.5 cm の部分を準備し、20 mL の 1 x 透析バッファーにそれらを洗う
- 各ふたにサンプルの 250 μ L をご記入ください。コンパートメントは完全に満ちているサンプルと空気の泡が発生しないように蓋の上、慎重に膜を置きます。閉じられたコンパートメントを持っているためにアセンブリの反応管リングを締めます。
- タンブリング シェーカーに氷の上で一晩透析バッファー x 1 (12-16 h) 50 mL サンプルを dialyze します。透析に使用されるバッファーを新鮮なものに置き換えるし、少なくとも 6 時間の残りの洗剤を削除する吸着剤ビーズの 7 mg を追加します。
- 透析のバッファーを交換して再度別 12, 200 μ L ピペット チップで透析膜をピアスでのリポソームの回復を dialyze し、反応チューブの蓋からすべてリポソームを吸引します。
- オプションのステップ: もし高純度 (> 95%) が必要です。透析バッファーで 6%、10%、15%、20% のショ糖エピクロルヒドリン コポリマーを含む手順 17 mL の不連続密度勾配遠心瓶を準備します。一番上に、スイング バケツ ローターで 4 時間 100,000 × g で遠心リポソームをロードします。
- 上部の茶色の帯を注射器で回復、DP とサンプル 1:5 を希釈し、次の手順に進みます。
- 遠心分離機の少なくとも 2 ml x 100,000 × g と 4 ° C で 1.5 時間透析バッファー 1 の FCP リポソーム45 ° の角度で遠心管を回してリポソームを回復します。1 分 (図 3 a) の下に移動するリポソームを許可します。
- 回復 25 50 μ L の最終巻で FCP リポソームは、沈殿物を妨害しません。
-
コントロール 1: 吸光度、蛍光分光法
- FCP リポソームの 3 μ 因数を透析バッファー、12,000 × g で 5 分間遠心分離機 x 1 の 1 mL の最終的なボリュームに追加します。
- 1.2.4 で説明されているように同じ装備 FCP リポソームの 370 と 750 nm の吸光度を記録します。最大クロロフィル (670-680 nm) の Qyの領域のスペクトルを正常化し、可溶化された FCP (図 3) の正規化されたスペクトルと比較します。
- 吸光度 (ABS) と DP の 1 mL の FCP リポソームを準備 = 670-680 nm 間最大に関して 0.03。同じ ABS B1a で希釈するステップ 1.2.6 から洗剤の可溶化された FCP を調整します。
- 1.2.4 で説明している両方のサンプルの吸光度スペクトルを記録できます。1.3.3 で説明したように、クロロフィル両方のサンプルの蛍光発光スペクトルを記録します。
注:蛍光収率は FCP リポソーム サンプル (3 D 図と参考:ディスカッション) で減少します。
- FCP リポソームの 3 μ 因数を透析バッファー、12,000 × g で 5 分間遠心分離機 x 1 の 1 mL の最終的なボリュームに追加します。
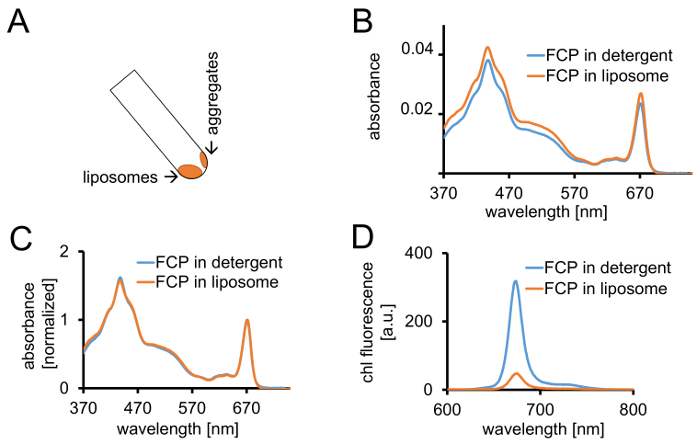
図 3: 分光学的コントロールと共焦点イメージング続いて FCP プロテオリポソームの分離。(A)遠心分離後 FCP リポソームの回復。遠心分離の管 45 ° を回し、約 1 分待って - FCP を集約する、管の壁に固執するリポソーム化されていないに対し、リポソームを下に移動します。(B)比較 (青) 洗剤の可溶化された FCP とリポソーム (オレンジ) での吸光度スペクトルの(C) (B) のように同じスペクトルは赤の領域で最大クロロフィルに正規化 (~ 670 nm - Qy ピーク);洗剤 (青) の可溶化された FCP とリポソーム (オレンジ) で。可能性があります可能性があります主にカロテノイドの色素の損失表示 500 550 nm 領域で。最大ピークの拡がりと、クロロフィルのわずかなシフトにつながる可能性がありますリポソームの FCP のクラスタ リング (~ 670 nm)、赤に。(D)洗剤の可溶化された FCP とリポソームの FCP の発光スペクトル。リポソームの FCP のクラスタ リング蛍光収率 (オレンジ曲線) を下げると赤に発光極大を若干シフト FCP 錯体のエネルギッシュな相互作用を高めます。この図の拡大版を表示するのにはここをクリックしてください。
結果
プロトコルでは、峰 meneghiniana合計 FCP 画分の分離とネイティブ脂質リポソームに定款をについて説明します。チラコイドの分離は、再現性が高いが、チラコイド収量が変更します。結果が全ての顔料の 50% 以上が 1.1.4 のステップでリカバリする場合できます。80% 以上が最適です。
チラコイドの可溶化は、重要なス?...
ディスカッション
FCP リポソーム天然脂質組成と分光学的性質を調査するための便利なシンプルで再現性のあるツールを提供するの in vitro 。FCP リポソームの脂質環境は、自然の状態に近い実験結果を生じ、チラコイド膜内状況に似ています。
FCP アンテナのモデル システムとしてc. meneghinianaを使用していくつかの利点があります。それは比較的速い成長、他の珪藻のモデル種...
開示事項
著者が明らかに何もありません。
謝辞
FCP の浄化支援ありがとうラナ Adeel アフマド。教授クラウディア Büchel は役に立つ議論のため認められている原稿を読む。この作品は LD (DI1956-1/1) にドイツ語研究財団および LD へフェオドル ・ リュネン フェローシップのフンボルト財団によって支えられました。
資料
| Name | Company | Catalog Number | Comments |
| 500 ml centrifuge vials | |||
| high speed centrifuge | Heraeus | ||
| Bead Mill VI 2 | Edmund-Bühler (edmund-buehler.de) | newer version: Vibrogen-Zellmühle Vl 6 | |
| Silibeads S 400 µm | Sigmund-Lindner.com | 5223-7 | |
| Silibeads S 1,-1,3 mm | Sigmund-Lindner.com | 4504 | |
| VitraPOR filter funnel - por1 | ROBU GmbH | 21121 | |
| polycarbonate ultracentrifuagtion vials (30 mL) for T-865 | Beranek Laborgeräte (Laborgeraete-beranek.de) | 314348 | |
| Ultracentrifuge Discovery 90SE | Sorvall | n.a. | |
| rotor T 865 | ThermoFisher Scientific (thermofisher.com) | 51411 | |
| Neubauer Cell Counter Chamber (improved) | Carl Roth Laborbedarf (Carlroth.com) | T729.1 | |
| Zeiss Mikroskop Primostar (7) | Optik-Pro (optik-pro.de) | 51428 | |
| optical glass cuvettes (6040-OG) | Hellma Analytics (hellma-analytics.com) | "6040-10-10" | |
| V-630 UV-VIS Spectrophotometer (incl. software) | Jasco (jasco.de) | V-630 | |
| n-Dodecyl-β-D-Maltopyranoside | ANATRACE (anatrace.com) | D310LA | |
| Ultra-Clear tubes 17 ml for AH629 | Beranek Laborgeräte (Laborgeraete-beranek.de) | 344061 | |
| rotor AH629-17-mL | ThermoFisher Scientific (thermofisher.com) | 54285 | |
| Membrane concentrator_Centriprep 30 kDa cutoff | Millipore (merckmillipore.com) | 4307 | |
| Biometra Minigel-Twin | Analytik Jena AG (analytik-jena.de) | 846-010-100 | |
| Silver Stain Plus Kit | Bio-Rad (bio-rad.com) | 1610449 | |
| libre office spread sheet | The document foundation | https://de.libreoffice.org/download/libreoffice-still/ | |
| special glass cuvettes for fluorescence (101-0S) | Hellma Analytics (hellma-analytics.com) | 101-10-20 | |
| Spectrofluorometer FP-6500 (incl. Software) | Jasco (jasco.de) | FP-6500 | |
| SDS-loading buffer Roti-Load | ROTH (carlroth.com) | K929.1 | |
| n-octyl β-D-glucopyranoside | ANATRACE (anatrace.com) | O311 | |
| Monogalactosyl Diaclyglycerol (MGDG) | Larodan AB (larodan.com) | 59-1300 | make stock solution in chloroform |
| Digalactosyl Diacylglycerol (DGDG) | Larodan AB (larodan.com) | 59-1310 | make stock solution in chloroform |
| Sulphoquinovosyl Diacylglycerol (SQDG) | Larodan AB (larodan.com) | 59-1230 | make stock solution in chloroform |
| L-alpha-Phosphatidylglycerol (PG) | Larodan AB (larodan.com) | 37-0150 | make stock solution in chloroform |
| L-α-Phosphatidylcholine | Sigma-Aldrich (sigmaaldrich.com) | P3782 SIGMA | make stock solution in chloroform |
| sonicator bath S-50TH | Sonicor (getmedonline.com | SONICOR-S-50TH | |
| mini-Extruder | Avanti Polar Lipids (Avanti.com) | 610000 | |
| Nuleopore polycarbonate membrane | Avanti Polar Lipids (Avanti.com) | 610005 | |
| dialysis membrane Visking 14 kDa cutoff | ROTH (carlroth.com) | 0653.1 | boil in destilled water before use |
| Biobeads SM2 Adsorbent | Biorad (Bio-rad.com) | 152-3920 | |
| sucrose epichlorhydrin copolymer - Ficoll 400 | Sigma-Aldrich (sigmaaldrich.com) | F4375 | |
| Polycarbonate ultracentrifuagtion vials (2.7 mL) for TFT 80.4 | Beranek Laborgeräte (Laborgeraete-beranek.de) | 252150 | |
| rotor TFT 80.4 | Millipore (merckmillipore.com) | 54356 | |
| material listed in order of appearance | For specific safety instructions please refer to material safety sheets and repective manuals. Standard lab material and substances are not listed. |
参考文献
- Eberhard, S., Finazzi, G., Wollman, F. A. The Dynamics of Photosynthesis. Annual Review of Genetics. 42, 463-515 (2008).
- Li, Z. R., Wakao, S., Fischer, B. B., Niyogi, K. K. Sensing and Responding to Excess Light. Annual Review of Plant Biology. 60, 239-260 (2009).
- Niyogi, K. K., Truong, T. B. Evolution of flexible non-photochemical quenching mechanisms that regulate light harvesting in oxygenic photosynthesis. Current Opinion in Plant Biology. 16 (3), 307-314 (2013).
- Li, X. -. P., et al. A pigment-binding protein essential for regulation of photosynthetic light harvesting. Nature. 403 (6768), 391-395 (2000).
- Peers, G., et al. An ancient light-harvesting protein is critical for the regulation of algal photosynthesis. Nature. 462 (7272), 518-521 (2009).
- Correa-Galvis, V., et al. Photosystem II Subunit PsbS Is Involved in the Induction of LHCSR Protein-dependent Energy Dissipation in Chlamydomonas reinhardtii. The Journal of biological chemistry. 291 (33), 17478-17487 (2016).
- Bailleul, B., et al. An atypical member of the light-harvesting complex stress-related protein family modulates diatom responses to light. Proceedings of the National Academy of Sciences of the United States of America. 107 (42), 18214-18219 (2010).
- Taddei, L., et al. Multisignal control of expression of the LHCX protein family in the marine diatom Phaeodactylum tricornutum. Journal of experimental botany. 67 (13), 3939-3951 (2016).
- Lepetit, B., et al. The diatom Phaeodactylum tricornutum adjusts nonphotochemical fluorescence quenching capacity in response to dynamic light via fine-tuned Lhcx and xanthophyll cycle pigment synthesis. New Phytologist. 214 (1), 205-218 (2017).
- Büchel, C. Evolution and function of light harvesting proteins. Journal of Plant Physiology. 172, 62-75 (2015).
- Lavaud, J., Rousseau, B., van Gorkom, H. J., Etienne, A. -. L. Influence of the Diadinoxanthin Pool Size on Photoprotection in the Marine Planktonic Diatom Phaeodactylum tricornutum. Plant Physiology. 129 (3), 1398-1406 (2002).
- Ruban, A., et al. The super-excess energy dissipation in diatom algae: comparative analysis with higher plants. Photosynthesis Research. 82 (2), 165-175 (2004).
- Mann, D. G. The species concept in diatoms. Phycologia. 38 (6), 437-495 (1999).
- Papagiannakis, E., van Stokkum, I. H. M., Fey, H., Büchel, C., van Grondelle, R. Spectroscopic Characterization of the Excitation Energy Transfer in the Fucoxanthin-Chlorophyll Protein of Diatoms. Photosynthesis Research. 86 (1-2), 241-250 (2005).
- Premvardhan, L., Robert, B., Beer, A., Büchel, C. Pigment organization in fucoxanthin chlorophyll a/c2 proteins (FCP) based on resonance Raman spectroscgopy and sequence analysis. Biochimica et Biophysica Acta-Bioenergetics. 1797 (9), 1647-1656 (2010).
- Gildenhoff, N., Herz, J., Gundermann, K., Büchel, C., Wachtveitl, J. The excitation energy transfer in the trimeric fucoxanthin-chlorophyll protein from Cyclotella meneghiniana analyzed by polarized transient absorption spectroscopy. Chemical Physics. 373 (1), 104-109 (2010).
- Ramanan, C., et al. Exploring the mechanism(s) of energy dissipation in the light harvesting complex of the photosynthetic algae Cyclotella meneghiniana. Biochimica et Biophysica Acta-Bioenergetics. 1837 (9), 1507-1513 (2014).
- Haferkamp, S., Kirchhoff, H. Significance of molecular crowding in grana membranes of higher plants for light harvesting by photosystem II. Photosynthesis Research. 95 (2-3), 129-134 (2008).
- Wahadoszamen, M., et al. Stark fluorescence spectroscopy reveals two emitting sites in the dissipative state of FCP antennas. Biochimica et Biophysica Acta-Bioenergetics. 1837 (1), 193-200 (2014).
- Zhou, F., et al. Effect of monogalactosyldiacylglycerol on the interaction between photosystem II core complex and its antenna complexes in liposomes of thylakoid lipids. Photosynthesis Research. 99 (3), 185-193 (2009).
- Moya, I., Silvestri, M., Vallon, O., Cinque, G., Bassi, R. Time-resolved fluorescence analysis of the photosystem II antenna proteins in detergent micelles and liposomes. Biochemistry. 40 (42), 12552-12561 (2001).
- Natali, A., et al. Light-harvesting Complexes (LHCs) Cluster Spontaneously in Membrane Environment Leading to Shortening of Their Excited State Lifetimes. Journal of Biological Chemistry. 291 (32), 16730-16739 (2016).
- Gundermann, K., Büchel, C. Factors determining the fluorescence yield of fucoxanthin-chlorophyll complexes (FCP) involved in non-photochemical quenching in diatoms. Biochimica et Biophysica Acta-Bioenergetics. 1817 (7), 1044-1052 (2012).
- Ahmad, R. A., Dietzel, L. Relaxation of cellular K+ gradients by valinomycin induces diatoxanthin accumulation in Cyclotella meneghiniana cells and alters FCPa fluorescence yield in vitro. Physiologia Plantarum. , 171-180 (2017).
- Provasoli, L., McLaughlin, J. J. A., Droop, M. R. The development of artificial media for marine algae. Archiv für Mikrobiologie. 25 (4), 392-428 (1957).
- Jeffrey, S., Humphrey, G. New spectrophotometry equations for determining chlorophyll a, chlorophyll b, chlorophyll c-1 and chlorophyll c-2 in higher plants, algae and natural phytoplankton. Biochemie und Physiologie der Pflanzen. 167, 191-194 (1975).
- Beer, A., Gundermann, K., Beckmann, J., Büchel, C. Subunit Composition and Pigmentation of Fucoxanthin−Chlorophyll Proteins in Diatoms: Evidence for a Subunit Involved in Diadinoxanthin and Diatoxanthin Binding. Biochemistry. 45 (43), 13046-13053 (2006).
- Schägger, H., von Jagow, G. Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa. Analytical Biochemistry. 166 (2), 368-379 (1987).
- Büchel, C. Fucoxanthin-Chlorophyll Proteins in Diatoms: 18 and 19 kDa Subunits Assemble into Different Oligomeric States. Biochemistry. 42 (44), 13027-13034 (2003).
- Vieler, A., Wilhelm, C., Goss, R., Süß, R., Schiller, J. The lipid composition of the unicellular green alga Chlamydomonas reinhardtii and the diatom Cyclotella meneghiniana investigated by MALDI-TOF MS and TLC. Chemistry and Physics of Lipids. 150 (2), 143-155 (2007).
- Gundermann, K., Büchel, C. The fluorescence yield of the trimeric fucoxanthin-chlorophyll-protein FCPa in the diatom Cyclotella meneghiniana is dependent on the amount of bound diatoxanthin. Photosynthesis Research. 95 (2-3), 229-235 (2008).
- Miloslavina, Y., et al. Ultrafast fluorescence study on the location and mechanism of non-photochemical quenching in diatoms. Biochimica et Biophysica Acta-Bioenergetics. 1787 (10), 1189-1197 (2009).
- Grouneva, I., Jakob, T., Wilhelm, C., Goss, R. The regulation of xanthophyll cycle activity and of non-photochemical fluorescence quenching by two alternative electron flows in the diatoms Phaeodactylum tricornutum and Cyclotella meneghiniana. Biochimica et Biophysica Acta-Bioenergetics. 1787 (7), 929-938 (2009).
- Chukhutsina, V. U., Büchel, C., van Amerongen, H. Disentangling two non-photochemical quenching processes in Cyclotella meneghiniana by spectrally-resolved picosecond fluorescence at 77 K. Biochimica et Biophysica Acta-Bioenergetics. 1837 (6), 899-907 (2014).
- Ghazaryan, A., Akhtar, P., Garab, G., Lambrev, P. H., Büchel, C. Involvement of the Lhcx protein Fcp6 of the diatom Cyclotella meneghiniana in the macro-organisation and structural flexibility of thylakoid membranes. Biochimica Et Biophysica Acta-Bioenergetics. 1857 (9), 1373-1379 (2016).
- Darley, W. M. Biochemical composition. The biology of diatoms. 13, 198-223 (1977).
- Milsman, M. H. W., Schwendner, R. A., Weder, H. G. Preparation of large single bilayer liposomes by a fast and controlled dialysis. Biochimica Et Biophysica Acta. 512 (1), 147-155 (1978).
- Zumbuehl, O., Weder, H. G. Liposomes of controllable size in the range of 40 to 180 nm by defined dialysis of lipid-detergent-mixed micelles. Biochimica Et Biophysica Acta. 640 (1), 252-262 (1981).
- Verchere, A., Broutin, I., Picard, M. Photo-induced proton gradients for the in vitro investigation of bacterial efflux pumps. Scientific Reports. 2 (306), (2012).
- Chevallet, M., Luche, S., Rabilloud, T. Silver staining of proteins in polyacrylamide gels. Nature Protocols. 1 (4), 1852-1858 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved