Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
İzole ve ışık-hasat antenler Diatom Cyclotella Meneghiniana lipozomlar Thylakoid lipidler ile gelen ekleme
Bu Makalede
Özet
Burada, bir protokol fucoxanthin klorofil a/c proteinler (FCP) Diyatomlarla dan ayırmak ve onları uyarma enerji transferi iyon kompozisyon değişiklikleri üzerine çalışmaya doğal lipit kompozisyonları ile lipozomlar içine dahil mevcut.
Özet
Bitkiler, algler ve Diyatomlarla fotosentetik performansı güçlü ışık hasat ve enerji hızlı ve verimli regülasyonu kloroplast thylakoid membran transfer işlemlerinde bağlıdır. Diyatomlarla anteni hasat ışık, sözde fucoxanthin klorofil a/c bağlayıcı proteinler (FCP), ışık emilimi için gerekli ve fotosentetik tepki verimli transferi de fotoğraf-koruma aşırı ışık gelince merkezleri. Bu iki işlev arasında geçiş araştırma uzun zamandır devam eden bir mesele. Bu çalışmaların çoğu FCP ile deterjan micelles gerçekleştirilen. Etkileşim çalışmaları için deterjanlar, hangi FCP kompleksleri belirsiz bir toplama için yol kaldırılmıştır. Bu yaklaşım, eserler ve fizyolojik olarak ilgili verileri arasında ayırt etmek zordur. Bu nedenle, FCP ve kompleksleri hasat diğer bağlı membran ışık hakkında daha değerli bilgiler yerel lipid ortamlarındaki katıştırılmış Eğer protein-protein etkileşimleri, enerji transferi ve diğer spektroskopik özellikleri inceleyerek elde edilebilir. En büyük avantajı lipozomlar tanımlı boyutunu ve hangi tarafından FCP kümeleme ölçüde kontrol edilir bir tanımlanmış lipid/protein oranı olması. Ayrıca, in vivo hasat ışık düzenleyen pH ve iyon kompozisyon değişiklikleri kolayca benzetimi yapılabilir. Thylakoid membran ile karşılaştırıldığında lipozomlar elde edilir ve spektroskopik veri anlamak daha kolay kılan daha homojen ve daha az karmaşık. Protokol FCP yalıtım ve arıtma, lipozom hazırlık ve FCP birleşme içine lipozomlar doğal lipid bileşimi ile ilgili yordamı açıklamaktadır. Sonuçlar tipik bir uygulamadan verilen ve tartışıldı.
Giriş
Fotosentetik canlılar Diyatomlarla gibi sürekli değişen ışık koşulları ile başa çıkmak ve yüksek fotosentetik verimliliği sürdürmek ve aşırı ışık tarafından fotoğraf-oksidatif hasarı korumak sofistike calıştıkları mekanizmaları ile yanıt. Bir büyük ışık-koruyucu fotosentetik ökaryotlarda yüksek enerji su verme (qE) olmayan fotokimyasal su verme (NPQ) hafif stres koşulları1,2 altında ana katkısı olarak oluşur emilen ışık işlemidir ,3. Işık hasat Anten kompleksleri (LHC) uyarma enerji transferi yolları Yönetmelikte katılmaktadırlar. Yanıt yüksek ışık olarak düşük pH kloroplast lümen, anten sistem anahtarları devlet su verme durumuna hasat ışık indüklenen. Bu enerji dissipative devlet photosystems (PS) ve diğer kompleksleri thylakoid zarda fotoğraf-oksidasyon korur. Fotosentetik ökaryotlarda qE genellikle iki faktör1,2,3tarafından indüklenen. Düşük pHiçin yanıt protein hasat özel ışık bir faktördür. PsbS protein yüksek bitkiler4qE neden olmaktadır. LhcSRs5PsbS faaliyete göre modüle, neden yeşil algler6'E q. Diyatomlarla yapısal olarak LHCSRs7,8,9,10' a ilgili Lhcx gibi proteinler sahip.
İkinci qE nerede karotenoidler anten fotoğraf-koruyucu forma de-epoxidation tarafından dönüştürülür ve epoxidation tarafından yeniden dönmek xanthophyll döngüsü faktördür. Bitki ve yeşil algler, violaxanthin zeaksantin için dönüştürülür. Diyatomlarla, diadinoxanthin diatoxanthin, sonra NPQ11ölçüde ile karşılıklı olarak ilişkilendirir dönüştürülür. Bitki ve yosun LHCs ilgili evrimsel olsa anten hasat diatom ışık bazı özelliklerine sahiptir. Fotoğraf-koruma için hasat ışık geçiş son derece hızlı ve NPQ kapasitesi daha bitkiler12' ye göre. Bu neden Diyatomlarla okyanus net birincil üretim13ilâ % 45 sorumlu oldukları bir şekilde farklı ekolojik niş içinde çok başarılı bir nedeni olabilir. Bu nedenle, diatom sistemleri hasat ışık fotosentez araştırma ilginç bir nesne vardır.
Merkezli türler Cyclotella meneghiniana, thylakoid içsel ışık sistemleri sonra pigmentler adlı hasat sahip gibi Diyatomlarla - fucoxanthin, klorofil (chl) a ve c, dolayısıyla FCP proteinler, hasat ışık bağlama FCPs gibi vardır birçok membran katmandan oluşan thylakoid membran sisteminde gömülü. Diyatomlarla üç thylakoids grupları oluşturur. Bu karmaşık durum thylakoid zarda moleküler düzeyde çalışmaya zor yapar. Buna ek olarak, birçok bileşenleri (yukarı bakın) hasat ışık düzenlenmesi için katkıda bulunur. Bu nedenle, pek çok yaklaşım içinde kompleksleri gibi n-Lauryl-β-D-membran solubilize ama FCP kompleksleri sağlam tutmak maltopyranoside (β-demir), hafif deterjan kullanarak zar izole edildi. İntramolecular enerji transferi14,15,16,17araştırmak için çözündürüldükten FCP kullanarak birçok spektroskopik çalışmalar gerçekleştirilmiştir. Enerji transferi Yönetmeliği ile diğer Anten kompleksleri veya photosystems excitonic etkileşim ihtiyacı ancak, bu eski yaklaşım sınırlı alınmaya başlanmıştır. Kompleksleri arasındaki etkileşimi kayıp olduğu için bu nedenle, bu tür çalışmalar çözündürüldükten kompleksleri ile uygulanmaz.
Önemli bir anten Yönetmelikte "moleküler kalabalık" anten ve thylakoid membran18photosystems özelliğidir. Eskiden, basit bir yaklaşım bu etkisi simüle etmek için yapılmıştır tüp bebek. Anten kompleksleri rasgele toplama için bu da neden deterjan kaldırıldı. Her ne kadar bazı makul veri bu yaklaşım17,19tarafından elde edildi, deterjan kaldırma durumu vivo içinde yansıtmaz ve kompleksleri onların düzenli Tersiyer etkileşim değil bu yana bazı sınırlamalar vardır yapısı.
Lipozomlar kullanımı birkaç eski sınırlamalar üstesinden gelir. Üçüncül yapı hala tam olarak sağlamdır. Lipozom membran Anten kompleksleri için yarı doğal bir ortam sağlar. Membran lipozom iç dış ortamdan ayıran. Bu şekilde, lipozomlar iyon ve pH degradeleri de taşıma işlemleri gelince, çalışmalar için iki reaksiyon bölmeler sağlar. Ayrıca, deneysel sistem parametrelerini daha kolay thylakoid membran araştırmaları kontrol edilebilir. Lipozomlar zaten fotosentetik kompleksleri eğitim için mükemmel bir araç olarak gösterildi. Geçmişte büyük bir odak bitki nerede değişmiş lipid kompozisyon etkisini LHC II20üzerinde test edildi LHC oldu. Diğer yaklaşımlar, farklı LHC II arasındaki protein-protein etkileşimi incelenen21idi. Ayrıca, yeşil algler bazı çalışmalarda spontan LHC22arasında kümeleme açıklayan gerçekleştirilmiştir. Diyatomlarla sucul ekosistemler için önemi göz önüne alındığında, görece az sayıda çalışmalar Diyatomlarla Anten kompleksleri ile gerçekleştirilmiştir. İki çalışma nerede FCP anten23 ve FCP yanıt elektrokimyasal gradyan24 için kümeleme gösterildi merkezli Cyclotella meneghiniana, Anten kompleksleri araştırıldı. Böylece, lipozomlar diatom antenler ve etkileşim ve neredeyse doğal koşullar Yönetmelikte eğitim için mükemmel bir araç vardır. Lipozomlar lipid bileşimi, lipozom boyutu, protein yoğunluğu gibi birçok koşulları beri çok yönlü ve çevresindeki sulu faz kontrol edilebilir. Ayrıca, yöntem örnekleri düşük miktarda gerektirir. Deneysel sistem sağlam ve son derece tekrarlanabilir. PH eğitimi için lipozomlar compartmentalization sağlar ve önemli iyon degradeler faktörler Anten kompleksleri Yönetmelikte.
Burada, FCP Anten kompleksleri C. meneghiniana üzerinden yalıtım ve onların birleşme lipozomlar doğal thylakoid lipid bileşimi ile açıklanmaktadır. Ayrıca, çözündürüldükten FCP spektroskopik karakterizasyonu için örnek veri sağlamak ve onları lipozomlar FCP ile karşılaştırın. Yöntem bilgi ve Gundermann ve Büchel 201223, Natali vd. 201622ve Ahmed ve Dietzel 201724ilerleme--dan elde edilen standart iletişim kuralları özetler.

Şekil 1: iş akışı şematik gösterimi. (1) başvuran hücre büyüme, bozulma ve FCP ayrılık sükroz yoğunluk gradyanlar üzerinde; aşağıdaki thylakoid yalıtım tanımlayan paragraf 1 C. m. -Cyclotella meneghiniana hücreleri. (2) doğal thylakoid lipid karışımı (MGDG, DGDG ve SQDG) hazırlanması 2 ve lipid-deterjan micelles octylglycoside (OG) ile oluşturulması paragrafta açıklanan. Tanımlanmış lipid-micelle boyutu ekstrüzyon tarafından tanımlanmış gözenek çapı membranlar kullanılarak elde edilir. FCP ve lipid-micelles önceden tanımlanmış bir lipid birleştirilmiş: protein oranı ve OG ve β-DDM deterjanlar vardır FCP proteoliposomes oluşturan kontrollü kaldırılan yolu ile diyaliz. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Protokol
Not: Fotosentetik kompleksleri FCPs gibi ışık ve ısı için son derece açıktır. Her zaman buz üzerinde ve bir çok loş ışık altında çalışır.
1. yalıtım FCP hücrelerden
-
Thylakoid yalıtım C. meneghiniana hücrelerden
- C. meneghiniana her ASP-orta23,25 ve 50 milyon hücre ile 300 mL dolu beş 500 mL şişe içinde büyümek. Şişeler ile pamuk Tıpa tak ve hücreleri bir shaker 16 h ışık ile 120 rpm'de yaklaşık bir hafta için üstel büyüme aşaması ve 8 h 40 µmol photons/(m²s) beyaz ışık karanlık aşamasında ve 15-18 ° c arasında bir sıcaklık için büyümeye izin Cep numarasını 1.5-2 milyon hücre/mL bir hücre sayaç odası arasında olup olmadığını kontrol edin.
- 4000 x g yüksek hızlı santrifüj 15dk için bir precooled Open End-500 mL santrifüj tüpleri (4 ° C) ile de hücreleri santrifüj kapasitesi. Hücre topakları homojenizasyon arabellek (HB, Tablo 1) 12 ml pipetting tarafından yeniden askıya alma.
- Süspansiyon tek 50 mL plastik tüp aktarın. -80 ° C'de örnekleri depolamak veya 1.1.3 adıma geçin.
- Boncuk fabrikası ve donanımları önceden serin. Boncuk Değirmen %75 50 mL kabı bir cam boncuk karışımı ile doldurun ve hücre süspansiyon ekleyin. Hücre bozulması için 30 ile tam hızda 7 x 45 s darbeleri kullanın her darbe arasında soğutma s. 20 µL kalite kontrolleri için kesintiye hücre içinde 1.1.6 adım.
- Kesintiye hücreleri bir cam filtre huni ve yıkama üzerinde net göründükleri kadar HB cam boncuklar dökerek filtre. Havuzu yıkama kesir ile filtrate. Son ses 150 mL daha düşük tutun.
- Örnek üç 50 mL Plastik tüpler hücre artıkları cips kullanarak 140 x g de 15 dakika santrifüj kapasitesi. Dikkatle süpernatant 20 mL Polikarbonat ultrasantrifüj şişeleri için transfer ve Pelet.
- Şişeleri HB ile doldurmak, ağırlık equilibrate ve 300.000 x g ve thylakoid membran cips 4 ° C, 1 h için uygun bir Open End santrifüj kapasitesi.
- Santrifüjü tam zamanı 1.1.3 içinde alınan 20 µL örnek ile 400 X büyütme, mikroskobu tarafından kesintiye hücre oranı kontrol etmek için kullanın. Kloroplast ücretsiz ve frustules (silis kabukları) içeren kloroplast arasındaki oran hesaplamak.
Not: Diatom hücre duvarları çok madde içinde mikroskop diffracting olarak görünür silis yapılır. Hücre bozulma işe yaradıysa kadar yeşil noktalar meydana gelen kloroplast hücrelerden serbest bırakılmış olması gereken. - İle membran Pelet mümkün olduğunca küçük çamaşır tampon olarak yeniden askıya alma (0.5-1 mL) küçük bir ressamın fırça kullanarak. Arabellek (Tablo 1) yıkama ile Polikarbonat ultrasantrifüj şişeleri doldurun, onların ağırlık ve 200.000 x g ve 4 ° c, 20 dk santrifüj equilibrate
- Bir ressamın fırça ile yıkanmış membranlar yeniden askıya alma. Çamaşır arabellek yalnızca mümkün olduğu kadar yüksek thylakoid konsantrasyonu tutmak için gerekirse ekleyin. Tüm thylakoids bir örnek flakon (15 mL) havuz.
- Örnek 10 µL % 100 aseton 90 µL ile kullanarak örnekleri önceden oranında seyreltin. 12.000 x g zarlarını protein cips 5 min için de santrifüj kapasitesi. Predilution 10 µL alıp % 90 aseton 990 µL ile karıştırın.
- Klorofil a ve c 664 absorbans (ABS) ölçmek nm ve 630 nm % 90 aseton içinde. Her iki değer üzerinden ABS750nm çıkarma. Aşağıdaki formülü kullanarak toplam klorofil içeriği belirlemek:24
1)
2)
- Klorofil a ve c 664 absorbans (ABS) ölçmek nm ve 630 nm % 90 aseton içinde. Her iki değer üzerinden ABS750nm çıkarma. Aşağıdaki formülü kullanarak toplam klorofil içeriği belirlemek:24
- Toplam klorofil 1,5 mL tepki tüpler 0.5 mg bazı bölümlerinde aliquot thylakoids onları sıvı azot içinde dondurma ve-80 ° C'de kadar daha fazla kullanılmasını depolayabilirsiniz.
-
Ayrılık ve FCP kompleksleri ile konsantrasyonu
- Sükroz degrade çözüm hazırlamak ve ultracentrifuge tüpler yükleme birimi (300-500 µL) eksi üst kadar doldurun. Onlar tamamen donmuş kadar tüpler-20 ° C'de dondurmak. 4 ° C'de 3-4 h 17 mL tüp için alır, çözülme tüpler izin.
- İki kez daha iyi çözünürlük için degrade iyileştirmek için donma-çözülme döngüsünü tekrarlayın.
- Klorofil 0.5 mg için karşılık gelen 1.1.9 elde örnekleri kullanır ve arabellek B1 ile ayarlamak (Tablo 1) son hacmiyle 2 mL. Solubilization için n-Lauryl-β-D-maltopyranoside (b-DDM) 20 mM son bir konsantrasyon için ekleyin.
- Tüp 3 kez ters çevir ve buz yumuşak köpük önlemek için sallayarak ile 20 dakika yerleştirin. Önceden soğutulmuş Masa Üstü Santrifüj 4 ° C'de 12.000 x g de 5 dk santrifüj
- Süpernatant degradeyi tarih yüklemek. 17 mL şişe kullanılan degrade başına toplam klorofil 125'ten fazla µg yük değil. Santrifüj için 100.000 x g ve 4 ° c, 22 h
- İstenen kahverengi FCP kesirler (Şekil 2A) kullanarak degrade yeniden elde etmek. 5 µL aliquot al ve B1a 995 µL ile sulandırmak.
- Bir UV-VIS-spektrofotometre 370-750 nm arasında absorbans (ABS) spektrum ölçmek. Yarı mikro optik cam cuvettes kullanın.
- Spectra Yöneticisi yazılımını açın, spektrum moduna gidin ve bir satır taban çizgisinden 370 750 için kayıt nm örnek ölçümleri tarafından takip. Kullanma ertesi gün koyma: tarama hızı, 200 nm/dak; veri aralığı, 0.5 nm; Yanıt, orta.
- Bir micropipette ile kurtarılan örnek hacmi ölçmek. FCP kompleksleri B1 arabelleği (Tablo 1) ile iki kez kurtarılan birim ekleyerek yıkayın. Membran yoğunlaştırıcı 30 kDa 1000 x g ve 4 ° C en az 20 ABS672nm için kesme ile konsantre.
Not: B-demir konsantrasyonu micelle zenginleştirme örnek yerde nedeniyle artış olabilir. Bu FCP kompleksleri daha fazla solubilization için neden olabilir! Aşırı solubilization deterjan boş arabellek adımları daha fazla yıkama Eğer B1 kalan sükroz kaldırmak için gerekli ekleyerek kaçının. - 20 µL denetimleri için aliquot al. Şok örnekleri sıvı azot donma ve onları-80 ° C'de depolayın
- Sükroz degrade çözüm hazırlamak ve ultracentrifuge tüpler yükleme birimi (300-500 µL) eksi üst kadar doldurun. Onlar tamamen donmuş kadar tüpler-20 ° C'de dondurmak. 4 ° C'de 3-4 h 17 mL tüp için alır, çözülme tüpler izin.

Şekil 2: arıtma FCP, spektroskopik denetimleri ve saflık onay. (A) tipik görünümünü sükroz yoğunluğu degrade sonra gece Santrifüjü. FCPa ve FCPb. pigm. oluşan FCP havuz bütün kahverengi grupları içeren - ilişkisiz pigmentler, PS - FCP photosystems (B) absorbans spectra (mavi çizgi) önce ve sonra santrifüj filtre aygıtından 30 kDa kesme (turuncu kesik çizgi) konsantrasyonu . Özellikle, karotenoidler kaybı için 500-550 nm arasındaki bölgede alt absorbans sonuçlanır FCP üzerinden yatkındır. Grafikler klorofil Qy ~ 670 maksimum için normalleştirilmiş nm. (C) klorofil a emisyon spectra chl c uyarma ile (465 nm) fonksiyonel uyarma enerji transferi test etmek için. Enerji için chl chl c aktarırsanız bir engel oluyor, ~ 640 bir ek floresans band nm (chl c) oluşur. Grafikler maksimum emisyon için normalleştirilmiş. (D) uyarma spectra kaydedilen 675 nm (chl bir floresan maksimum) enerji transferi chl için test etmek için bir bütün pigmentler 370 arasında emici üzerinden nm ve 600 nm. Enerji için chl aktarırsanız bir daha az verimlidir, floresans verim özellikle 465 ve 550 nm arasında azaltmak. Grafikleri en fazla yaklaşık 440 normalleştirilmiş nm. Spectra (b), (C) ve (D) konsantrasyonu iyi çalıştı Eğer neredeyse aynıdır. (E) Tris-tricine jel28kullanarak izole FCP saflık için kontrol edin. FCPa ve FCPb alt birimleri arasında 18-19 kDa var. Tüm görünür gümüş lekeli 20 kDa büyük kirletici maddeleri proteinlerdir. Thyl. -Thylakoids Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
-
Spektroskopik ve jel tabanlı denetimler
- Kayıt absorbans FCP 5 µL B1a 995 µL adım 1.2.5 sonra içinde 370-750 nm arasında. 1.2.4. adımda elde spektrum ile karşılaştırın. Aynı araçları ve 1.2.4. adımda açıklandığı gibi ayarlarını kullanır.
- Veri *.csv verebilir ve bir elektronik tabloya veri alabilirsiniz. Her iki spectra chl maksimum normalize bir civarında 672 Qy bandında Şekil 2Btasvir nm.
- 1.2.4 ve 1.3.1. adımdaki örnek seyreltme faktörü 0.03 istenen ABS672nm tarafından ölçülen ABS672nm bölerek hesaplayın. Buna göre örnekleri seyreltik B1a ile ve özel cam floresans cuvettes için aktarabilirsiniz.
- CHL sağlam ışık enerjisi transfer chl c chl bir (Şekil 2C) ortaya çıkarmak için bir spectrofluorometer ile floresan emisyon spektrum kaydedin.
- Spektrometre yazılımı kullanabilir ve spektrum ölçüm modu aşağıdaki ayarlarla gidin: modu, emisyon; yarık genişliği uyarma ve emisyon, 3 nm; duyarlılık, orta; tarama hızı, 100 nm/dak; veri aralığı, 0.5 nm; uyarma dalga boyu, 465 nm; emisyon, 600-800 nm. Autozero ve ölçü gerçekleştirmek.
- Uyarma spectra aynı örnek ve bozulmamış enerji transferi tüm pigmentler chl ortaya çıkarmak için donatım (Şekil 2B) kaydedin. Değiştirmek için ayarları: modu, uyarma; emisyon dalga boyu, 675 nm; uyarma, 370-600 nm. Spectra kaydedin.
- Lamba- cfspektral özellikleri için aynı aralıkta rodamine spektrum ile düzeltin. Kullanıcı el kitabındaki yönergeleri.
- Mix FCP örnekleri chl 1 µg için karşılık gelen bir 10 µL SDS-yükleme arabelleği ile. 25 ° C'de 10 dakika için kuluçkaya Santrifüj 12000 x g masa üstü santrifüj içinde de 5 min için.
- Tris-tricine jel28süpernatant yükleyin. Bu 150 V 2 h için ayrı ve gümüş-bu ayrılık40sonra leke.
Not: İki önemli protein grup arasında FCPa ve FCPb29 (2E rakam) bileşenlerinin çoğu 18-19 kDa FCP alt birimleri ayrı.
- Tris-tricine jel28süpernatant yükleyin. Bu 150 V 2 h için ayrı ve gümüş-bu ayrılık40sonra leke.
- Kayıt absorbans FCP 5 µL B1a 995 µL adım 1.2.5 sonra içinde 370-750 nm arasında. 1.2.4. adımda elde spektrum ile karşılaştırın. Aynı araçları ve 1.2.4. adımda açıklandığı gibi ayarlarını kullanır.
2. lipozomlar ve FCP ortaklığın hazırlanması
-
Lipid karışımı ve lipid deterjan micelles hazırlanması
Not: lipidler oksidatif koşulları ile kombine sıcaklık sıcak duyarlı. Lipidler soğutulmuş ve bir N2 atmosfer altında tutmaya çalışın.- İstenen thylakoid lipid oranları C. meneghiniana için Vieler ve ark. 200730göre hesaplar. Supplemental Tablo 1' de verilen örnek bakın. Lipid bir çözelti geçirmez Konteyner üreticisi tarafından önerilen hisse senedi çözümleri hazırlayın.
- Lipidler 2 mL tepki tüp içinde istenilen miktarda pipette ve nazik azot akışı kullanarak kloroform buharlaşır ve lipidler tüp tabanının bütün alana yayılmış çalışın. Tüm çözücü buharlaşan kadar N2 akışı sağlar.
- N-Oktil β-D-glucopyranoside çözüm (OG) 29 µL lipid karışımı 4 h Incubate lipid karışımı 30 ° C'de 10 dakika için 4 ° C'de solubilize 3 x 3 dk 30 tarafından kesintiye 25 ° C'de bir sonicator banyoda lipidler kuluçkaya s buz üzerinde.
- Tricine arabellek 221 µL ve 4 x diyaliz arabelleği 250 µL ekleyin.
- Bir ekstruder 0,1 µm Polikarbonat Membranlar ile 50-70 nm tanımlanmış lipozom çapı için kullanın. Ekstruder membran ve filtre desteği ile bir araya getirin. Hava kabarcıklarını önlemek ve derleme iyice sıkın.
- 4 x diyaliz arabellek ile bir şırıngaya doldur ve hava kabarcığı yok ikinci şırıngada görülebilir kadar ekstruder önceden ıslak.
- Lipid-deterjan-micelles için Ekstruder uygulamak ve diğer bir şırınga çözümden ileri tuşuna basın ve geri. Çözüm homojen görünene kadar bu 5 kez tekrarlayın.
Not: Bu çözüm 4 ° C'de birkaç gün boyunca saklanır. Dondurma değil!
-
FCP kompleksleri ve deterjanlar ve toplamları kaldırma
Not: Biz bir lipid/chl 12:1 oranında kullanın örneğin, hangi yaklaşık 100: 1 bir lipid/protein oranına karşılık gelir.- FCP chl 20 µg için eşit eklemek bir toplam hacmi 500 µL 250 μhaddelenmiş lipid micelles L B1a arabelleğe ve diyaliz arabellek x 4 250 µL içinde. Örnekleri 1500-3000 devirde buz üzerinde 30 s duraklamadan kesintiye thermomixer 25 ° C'de 3 x 3 dk için kuluçkaya.
- Dört 1,5 mL tepki tüp altında hala kapağını uygun bir yüzüğü vermek üst kapağını kesmek. Diyaliz membran 1.5 cm x 1,5 cm adet hazırlamak ve 20 mL 1 x diyaliz arabellek yıkayın
- Her kapak için örnek 250 µL doldurun. Dikkatle, membran kapak üzerinde yuvası ile örnek tamamen dolu ve hiçbir hava kabarcıkları oluşur düzenleyin. Derleme tepki tüp halka kapalı bir bölme için sıkın.
- Gecede 1 diyaliz arabellek x 50 mL (12-16 h) örneklerinde bir yuvarlanan shaker buz üzerinde diyaliz. Kullanılan diyaliz tampon yerine taze bir ve kalan deterjanlar için en az 6 h kaldırmak için adsorbent boncuk 7 mg ekleyin.
- Diyaliz arabellek tekrar eski yerine koymak ve diyaliz membran ile 200 µL micropipette bahşiş piercing tarafından lipozomlar başka bir 12 h. kurtarmak için diyaliz ve tepki tüp kapak üzerinden tüm lipozomlar Aspire edin.
- İsteğe bağlı adım: Eğer yüksek saflıkta (> % 95) gereklidir. Kesintili yoğunluğu Gradyanda 17 mL % 6, % 10, % 15 ve % 20 sükroz epichlorhydrin kopolimer diyaliz arabelleği içeren adımlarla ultrasantrifüj tüpleri hazırlayın. Lipozomlar üstte ve ultracentrifuge 100.000 x g sallanan bir kova Open End 4 h için de yük.
- Üst kahverengi bant şırıngayla kurtarmak, DP ile örnek 1:5 oranında seyreltin ve sonraki adıma geçin.
- En az 2 ml 1 x 100.000 x g ve 4 ° c, 1,5 saat için diyaliz arabellek FCP lipozomlar santrifüj kapasitesi Lipozomlar santrifüj tüpü bir 45 ° açıyla çevirerek kurtarmak. Lipozomlar 1 dk (Şekil 3A) aşağı taşımak izin verir.
- Çökelti rahatsız edici son hacmi 25-50 µL. FCP lipozomlar önlemek yeniden elde etmek.
-
Kontroller 1: absorbans, floresans spektroskopisi
- 3 µL aliquot FCP lipozomlar, 1 x diyaliz arabellek ve santrifüj 12.000 x g de 5 min için 1 mL son hacmi ekleyin.
- FCP-lipozomlar aynı ekipman ile 370 ve 750 nm arasında absorbans 1.2.4 içinde açıklandığı gibi kaydedin. Spektrum chl (670-680 nm) Sy bölgesinde maksimum normalleştirmek ve çözündürüldükten FCP (Şekil 3 c) normalleştirilmiş spektrum karşılaştırın.
- DP 1 ml bir absorbans (ABS) ile FCP lipozomlar hazırlamak 0,03 ile ilgili 670-680 nm arasında maksimum =. 1.2.6. adımdaki deterjan ile B1a sulandrarak aynı ABS için solubilized FCP ayarlayın.
- Her iki örnek absorbans spectra 1.2.4 içinde açıklandığı gibi kaydedin. CHL 1.3.3 içinde açıklandığı gibi her iki örnekleri bir floresan emisyon spektrum kaydedin.
Not: Floresans verim FCP lipozom örnek (şekil 3D ve bkz tartışma.) azalır
- 3 µL aliquot FCP lipozomlar, 1 x diyaliz arabellek ve santrifüj 12.000 x g de 5 min için 1 mL son hacmi ekleyin.
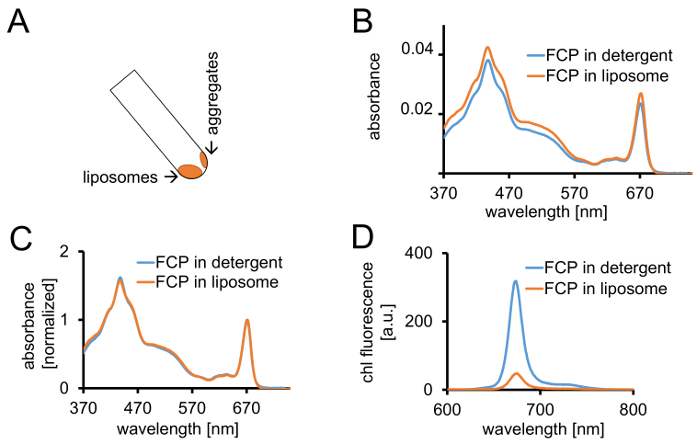
Şekil 3: FCP proteoliposomes yalıtım ardından spektroskopik denetimleri ve confocal görüntüleme ekleyin. (A) FCP lipozomlar Santrifüjü sonra kurtarılması. 45 ° aralıklarla tüp açın ve hangi tüp duvara lipozomlar sopa içine dahil değil FCP toplar ise yaklaşık 1 dak - lipozomlar hareket edecek bekleyin. Absorbans spectra çözündürüldükten FCP içinde deterjan (mavi) ve FCP lipozomlar (turuncu) içinde karşılaştırılması (B) (C) (B) olduğu gibi aynı spectra chl için kırmızı bölgede maksimum normalize (~ 670 nm - Qy tepe); çözündürüldükten FCP içinde deterjan (mavi) ve FCP lipozomlar (turuncu) içinde. Büyük olasılıkla, olabilir bir pigment kaybı özellikle karotenoidler görünür 500-550 nm bölgede. FCP lipozomlar içinde kümeleme bir tepe genişletmektedir ve chl hafif bir kayma için maksimum açabilir (~ 670 nm) kırmızı. (D) emisyon spectra çözündürüldükten FCP içinde deterjan ve FCP lipozom içinde. Lipozom FCP, kümeleme floresans verim (turuncu eğri) düşürür ve emisyon maxima biraz kırmızı vardiya FCP kompleksleri enerjik etkileşimlerin geliştirir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Sonuçlar
Protokol Cyclotella meneghiniana üzerinden toplam FCP kesir yalıtım ve birleşme lipozomlar yerli lipid bileşimi ile içine açıklar. Thylakoid yalıtım son derece tekrarlanabilir olmakla beraber thylakoid verim değişebilir. Tüm pigmentler % 50'den fazla adım 1.1.4 kazanılmaktadır kabul edilebilir bir sonucudur. % 80'den fazla en uygunudur.
Thylakoids solubilization kritik bir adımdır. Sonra adım 1.2.2 s?...
Tartışmalar
FCP lipozomlar doğal lipid bileşimi ile spektroskopik özellikleri araştırmak için kullanışlı, basit ve tekrarlanabilir bir araç sağlamak tüp bebek. FCP lipozomlar lipid ortamında doğal koşullarına yakın olan deneysel sonuçlar için sebebiyet veren thylakoid membran içinde durum benzer.
C. meneghiniana bir modeli sistem olarak FCP anten için kullanmanın bir çok avantajı vardır. Bu nispeten hızlı büyür ve diğer diatom modeli türler ile karşılaşt...
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Rana Adeel Ahmad FCP arıtma yardım için teşekkür. Prof. Claudia Büchel yararlı tartışmalar için kabul etti ve el yazması okuma. Bu eser Alman Araştırma Vakfı'na LD (DI1956-1/1) ve Feodor Lynen bursu için ld Humboldt Vakfı tarafından desteklenmiştir
Malzemeler
| Name | Company | Catalog Number | Comments |
| 500 ml centrifuge vials | |||
| high speed centrifuge | Heraeus | ||
| Bead Mill VI 2 | Edmund-Bühler (edmund-buehler.de) | newer version: Vibrogen-Zellmühle Vl 6 | |
| Silibeads S 400 µm | Sigmund-Lindner.com | 5223-7 | |
| Silibeads S 1,-1,3 mm | Sigmund-Lindner.com | 4504 | |
| VitraPOR filter funnel - por1 | ROBU GmbH | 21121 | |
| polycarbonate ultracentrifuagtion vials (30 mL) for T-865 | Beranek Laborgeräte (Laborgeraete-beranek.de) | 314348 | |
| Ultracentrifuge Discovery 90SE | Sorvall | n.a. | |
| rotor T 865 | ThermoFisher Scientific (thermofisher.com) | 51411 | |
| Neubauer Cell Counter Chamber (improved) | Carl Roth Laborbedarf (Carlroth.com) | T729.1 | |
| Zeiss Mikroskop Primostar (7) | Optik-Pro (optik-pro.de) | 51428 | |
| optical glass cuvettes (6040-OG) | Hellma Analytics (hellma-analytics.com) | "6040-10-10" | |
| V-630 UV-VIS Spectrophotometer (incl. software) | Jasco (jasco.de) | V-630 | |
| n-Dodecyl-β-D-Maltopyranoside | ANATRACE (anatrace.com) | D310LA | |
| Ultra-Clear tubes 17 ml for AH629 | Beranek Laborgeräte (Laborgeraete-beranek.de) | 344061 | |
| rotor AH629-17-mL | ThermoFisher Scientific (thermofisher.com) | 54285 | |
| Membrane concentrator_Centriprep 30 kDa cutoff | Millipore (merckmillipore.com) | 4307 | |
| Biometra Minigel-Twin | Analytik Jena AG (analytik-jena.de) | 846-010-100 | |
| Silver Stain Plus Kit | Bio-Rad (bio-rad.com) | 1610449 | |
| libre office spread sheet | The document foundation | https://de.libreoffice.org/download/libreoffice-still/ | |
| special glass cuvettes for fluorescence (101-0S) | Hellma Analytics (hellma-analytics.com) | 101-10-20 | |
| Spectrofluorometer FP-6500 (incl. Software) | Jasco (jasco.de) | FP-6500 | |
| SDS-loading buffer Roti-Load | ROTH (carlroth.com) | K929.1 | |
| n-octyl β-D-glucopyranoside | ANATRACE (anatrace.com) | O311 | |
| Monogalactosyl Diaclyglycerol (MGDG) | Larodan AB (larodan.com) | 59-1300 | make stock solution in chloroform |
| Digalactosyl Diacylglycerol (DGDG) | Larodan AB (larodan.com) | 59-1310 | make stock solution in chloroform |
| Sulphoquinovosyl Diacylglycerol (SQDG) | Larodan AB (larodan.com) | 59-1230 | make stock solution in chloroform |
| L-alpha-Phosphatidylglycerol (PG) | Larodan AB (larodan.com) | 37-0150 | make stock solution in chloroform |
| L-α-Phosphatidylcholine | Sigma-Aldrich (sigmaaldrich.com) | P3782 SIGMA | make stock solution in chloroform |
| sonicator bath S-50TH | Sonicor (getmedonline.com | SONICOR-S-50TH | |
| mini-Extruder | Avanti Polar Lipids (Avanti.com) | 610000 | |
| Nuleopore polycarbonate membrane | Avanti Polar Lipids (Avanti.com) | 610005 | |
| dialysis membrane Visking 14 kDa cutoff | ROTH (carlroth.com) | 0653.1 | boil in destilled water before use |
| Biobeads SM2 Adsorbent | Biorad (Bio-rad.com) | 152-3920 | |
| sucrose epichlorhydrin copolymer - Ficoll 400 | Sigma-Aldrich (sigmaaldrich.com) | F4375 | |
| Polycarbonate ultracentrifuagtion vials (2.7 mL) for TFT 80.4 | Beranek Laborgeräte (Laborgeraete-beranek.de) | 252150 | |
| rotor TFT 80.4 | Millipore (merckmillipore.com) | 54356 | |
| material listed in order of appearance | For specific safety instructions please refer to material safety sheets and repective manuals. Standard lab material and substances are not listed. |
Referanslar
- Eberhard, S., Finazzi, G., Wollman, F. A. The Dynamics of Photosynthesis. Annual Review of Genetics. 42, 463-515 (2008).
- Li, Z. R., Wakao, S., Fischer, B. B., Niyogi, K. K. Sensing and Responding to Excess Light. Annual Review of Plant Biology. 60, 239-260 (2009).
- Niyogi, K. K., Truong, T. B. Evolution of flexible non-photochemical quenching mechanisms that regulate light harvesting in oxygenic photosynthesis. Current Opinion in Plant Biology. 16 (3), 307-314 (2013).
- Li, X. -. P., et al. A pigment-binding protein essential for regulation of photosynthetic light harvesting. Nature. 403 (6768), 391-395 (2000).
- Peers, G., et al. An ancient light-harvesting protein is critical for the regulation of algal photosynthesis. Nature. 462 (7272), 518-521 (2009).
- Correa-Galvis, V., et al. Photosystem II Subunit PsbS Is Involved in the Induction of LHCSR Protein-dependent Energy Dissipation in Chlamydomonas reinhardtii. The Journal of biological chemistry. 291 (33), 17478-17487 (2016).
- Bailleul, B., et al. An atypical member of the light-harvesting complex stress-related protein family modulates diatom responses to light. Proceedings of the National Academy of Sciences of the United States of America. 107 (42), 18214-18219 (2010).
- Taddei, L., et al. Multisignal control of expression of the LHCX protein family in the marine diatom Phaeodactylum tricornutum. Journal of experimental botany. 67 (13), 3939-3951 (2016).
- Lepetit, B., et al. The diatom Phaeodactylum tricornutum adjusts nonphotochemical fluorescence quenching capacity in response to dynamic light via fine-tuned Lhcx and xanthophyll cycle pigment synthesis. New Phytologist. 214 (1), 205-218 (2017).
- Büchel, C. Evolution and function of light harvesting proteins. Journal of Plant Physiology. 172, 62-75 (2015).
- Lavaud, J., Rousseau, B., van Gorkom, H. J., Etienne, A. -. L. Influence of the Diadinoxanthin Pool Size on Photoprotection in the Marine Planktonic Diatom Phaeodactylum tricornutum. Plant Physiology. 129 (3), 1398-1406 (2002).
- Ruban, A., et al. The super-excess energy dissipation in diatom algae: comparative analysis with higher plants. Photosynthesis Research. 82 (2), 165-175 (2004).
- Mann, D. G. The species concept in diatoms. Phycologia. 38 (6), 437-495 (1999).
- Papagiannakis, E., van Stokkum, I. H. M., Fey, H., Büchel, C., van Grondelle, R. Spectroscopic Characterization of the Excitation Energy Transfer in the Fucoxanthin-Chlorophyll Protein of Diatoms. Photosynthesis Research. 86 (1-2), 241-250 (2005).
- Premvardhan, L., Robert, B., Beer, A., Büchel, C. Pigment organization in fucoxanthin chlorophyll a/c2 proteins (FCP) based on resonance Raman spectroscgopy and sequence analysis. Biochimica et Biophysica Acta-Bioenergetics. 1797 (9), 1647-1656 (2010).
- Gildenhoff, N., Herz, J., Gundermann, K., Büchel, C., Wachtveitl, J. The excitation energy transfer in the trimeric fucoxanthin-chlorophyll protein from Cyclotella meneghiniana analyzed by polarized transient absorption spectroscopy. Chemical Physics. 373 (1), 104-109 (2010).
- Ramanan, C., et al. Exploring the mechanism(s) of energy dissipation in the light harvesting complex of the photosynthetic algae Cyclotella meneghiniana. Biochimica et Biophysica Acta-Bioenergetics. 1837 (9), 1507-1513 (2014).
- Haferkamp, S., Kirchhoff, H. Significance of molecular crowding in grana membranes of higher plants for light harvesting by photosystem II. Photosynthesis Research. 95 (2-3), 129-134 (2008).
- Wahadoszamen, M., et al. Stark fluorescence spectroscopy reveals two emitting sites in the dissipative state of FCP antennas. Biochimica et Biophysica Acta-Bioenergetics. 1837 (1), 193-200 (2014).
- Zhou, F., et al. Effect of monogalactosyldiacylglycerol on the interaction between photosystem II core complex and its antenna complexes in liposomes of thylakoid lipids. Photosynthesis Research. 99 (3), 185-193 (2009).
- Moya, I., Silvestri, M., Vallon, O., Cinque, G., Bassi, R. Time-resolved fluorescence analysis of the photosystem II antenna proteins in detergent micelles and liposomes. Biochemistry. 40 (42), 12552-12561 (2001).
- Natali, A., et al. Light-harvesting Complexes (LHCs) Cluster Spontaneously in Membrane Environment Leading to Shortening of Their Excited State Lifetimes. Journal of Biological Chemistry. 291 (32), 16730-16739 (2016).
- Gundermann, K., Büchel, C. Factors determining the fluorescence yield of fucoxanthin-chlorophyll complexes (FCP) involved in non-photochemical quenching in diatoms. Biochimica et Biophysica Acta-Bioenergetics. 1817 (7), 1044-1052 (2012).
- Ahmad, R. A., Dietzel, L. Relaxation of cellular K+ gradients by valinomycin induces diatoxanthin accumulation in Cyclotella meneghiniana cells and alters FCPa fluorescence yield in vitro. Physiologia Plantarum. , 171-180 (2017).
- Provasoli, L., McLaughlin, J. J. A., Droop, M. R. The development of artificial media for marine algae. Archiv für Mikrobiologie. 25 (4), 392-428 (1957).
- Jeffrey, S., Humphrey, G. New spectrophotometry equations for determining chlorophyll a, chlorophyll b, chlorophyll c-1 and chlorophyll c-2 in higher plants, algae and natural phytoplankton. Biochemie und Physiologie der Pflanzen. 167, 191-194 (1975).
- Beer, A., Gundermann, K., Beckmann, J., Büchel, C. Subunit Composition and Pigmentation of Fucoxanthin−Chlorophyll Proteins in Diatoms: Evidence for a Subunit Involved in Diadinoxanthin and Diatoxanthin Binding. Biochemistry. 45 (43), 13046-13053 (2006).
- Schägger, H., von Jagow, G. Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa. Analytical Biochemistry. 166 (2), 368-379 (1987).
- Büchel, C. Fucoxanthin-Chlorophyll Proteins in Diatoms: 18 and 19 kDa Subunits Assemble into Different Oligomeric States. Biochemistry. 42 (44), 13027-13034 (2003).
- Vieler, A., Wilhelm, C., Goss, R., Süß, R., Schiller, J. The lipid composition of the unicellular green alga Chlamydomonas reinhardtii and the diatom Cyclotella meneghiniana investigated by MALDI-TOF MS and TLC. Chemistry and Physics of Lipids. 150 (2), 143-155 (2007).
- Gundermann, K., Büchel, C. The fluorescence yield of the trimeric fucoxanthin-chlorophyll-protein FCPa in the diatom Cyclotella meneghiniana is dependent on the amount of bound diatoxanthin. Photosynthesis Research. 95 (2-3), 229-235 (2008).
- Miloslavina, Y., et al. Ultrafast fluorescence study on the location and mechanism of non-photochemical quenching in diatoms. Biochimica et Biophysica Acta-Bioenergetics. 1787 (10), 1189-1197 (2009).
- Grouneva, I., Jakob, T., Wilhelm, C., Goss, R. The regulation of xanthophyll cycle activity and of non-photochemical fluorescence quenching by two alternative electron flows in the diatoms Phaeodactylum tricornutum and Cyclotella meneghiniana. Biochimica et Biophysica Acta-Bioenergetics. 1787 (7), 929-938 (2009).
- Chukhutsina, V. U., Büchel, C., van Amerongen, H. Disentangling two non-photochemical quenching processes in Cyclotella meneghiniana by spectrally-resolved picosecond fluorescence at 77 K. Biochimica et Biophysica Acta-Bioenergetics. 1837 (6), 899-907 (2014).
- Ghazaryan, A., Akhtar, P., Garab, G., Lambrev, P. H., Büchel, C. Involvement of the Lhcx protein Fcp6 of the diatom Cyclotella meneghiniana in the macro-organisation and structural flexibility of thylakoid membranes. Biochimica Et Biophysica Acta-Bioenergetics. 1857 (9), 1373-1379 (2016).
- Darley, W. M. Biochemical composition. The biology of diatoms. 13, 198-223 (1977).
- Milsman, M. H. W., Schwendner, R. A., Weder, H. G. Preparation of large single bilayer liposomes by a fast and controlled dialysis. Biochimica Et Biophysica Acta. 512 (1), 147-155 (1978).
- Zumbuehl, O., Weder, H. G. Liposomes of controllable size in the range of 40 to 180 nm by defined dialysis of lipid-detergent-mixed micelles. Biochimica Et Biophysica Acta. 640 (1), 252-262 (1981).
- Verchere, A., Broutin, I., Picard, M. Photo-induced proton gradients for the in vitro investigation of bacterial efflux pumps. Scientific Reports. 2 (306), (2012).
- Chevallet, M., Luche, S., Rabilloud, T. Silver staining of proteins in polyacrylamide gels. Nature Protocols. 1 (4), 1852-1858 (2006).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır