Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Изоляция и включения светособирающего антенны от диатомовые водоросли Cyclotella Meneghiniana в липосомах с липидами тилакоидов
В этой статье
Резюме
Здесь мы представляем протокол изолировать фукоксантин хлорофилл кондиционера связывания белков (FCP) диатомовых водорослей и включить их в липосомы с естественным липидной композиции для изучения передачи энергии возбуждения после изменения ионного состава.
Аннотация
Фотосинтетическая производительности растений, водорослей и диатомовые водоросли сильно зависит от быстрого и эффективного регулирования света уборки и энергии процессов переноса в тилакоидной мембране хлоропластов. Свет, уборки антенна диатомовых водорослей, так называемые фукоксантин хлорофилл кондиционера связывая протеинов (FCP), необходимые для поглощения света и эффективную передачу реакционном центров также для фото защита от чрезмерного света. Переключение между этими двумя функциями является давней проблемы исследования. Многие из этих исследований были проведены с FCP в мицеллах моющего средства. Для исследования взаимодействия были удалены моющих средств, что привело к неспецифическим агрегации FCP комплексов. В этом подходе трудно различать артефакты и физиологически соответствующих данных. Таким образом можно получить более ценную информацию о FCP и другие мембраны связаны света уборки комплексов путем изучения взаимодействий протеин протеина, передачи энергии и другие спектральные особенности, если они встроены в их среде родной липидов. Главным преимуществом является, что липосомы имеют определенный размер и соотношение определенных липидов/белков, в которой контролируется степень FCP кластеризации. Кроме того изменения в составе рН и Иона, которые регулируют света уборки в естественных условиях легко могут быть смоделированы. По сравнению с тилакоидной мембраны липосомы более однородной и менее сложным, что делает его легче получить и понять спектральные данные. Протокол описывает процедуру FCP изоляции и очистки, липосомы подготовки и включения FCP в липосомы с естественный липидный состав. Результаты от типичного приложения дают и обсуждены.
Введение
Фотосинтетических организмов, таких как диатомовые водоросли должны справиться с постоянно меняющейся освещенности и реагировать с адаптационного сложные механизмы, которые поддерживать высокую эффективность фотосинтеза и защищать от фото окислительных повреждений, вызванных чрезмерным свет. Основной свет защитные процесс в фотосинтетические eukaryotes является высокой энергии закалочные (qE) поглощается света, который возникает как главный вклад не фотохимического тушения (ЕНОЛ) под легкий стресс условия1,2 ,3. Света уборки антенные комплексы (LHC) участвуют в регуляции пути передачи энергии возбуждения. В ответ на высокий свет индуцированной низкий рН в просвете хлоропластов, Антенные переключатели системы от света уборки тушения состояние. Этой энергии диссипативных государство защищает фотосистемы (PS) и других комплексов в тилакоидной мембране от фото окисления. В фотосинтетической эукариот qE индуцируется обычно двух факторов1,2,3. Одним из факторов является специализированным свет уборки белок, который реагирует с низким рН. ОВО белка индуцирует дЕ в высших растений4. LhcSRs5, модулированные деятельности ОВО, побудить дЕ в зеленых водорослей6. Диатомовые водоросли обладают Lhcx подобных белков, структурно связанные с LHCSRs7,8,9,10.
Второй фактор qE является цикл Ксантофилл где преобразован в форму фото защитные деэпоксидации и вернулась эпоксидирования каротиноиды антенны. В растениях и зеленые водоросли виолаксантина преобразуется в зеаксантин. В диатомовых водорослей diadinoxanthin преобразуется в diatoxanthin, который затем коррелирует с степень ЕНОЛ11. Диатомовые водоросли света уборки антенна обладает некоторые особенности, хотя это эволюционный, относящиеся к заводе и водорослей LHCs. Переход от света, заготовки для фото защиты чрезвычайно быстрый и ЕНОЛ способности выше по сравнению с растений12. Это может быть одной из причин, почему диатомеи очень успешно в различных экологических ниш в пути, что они отвечают за до 45% океанических чистой первичной продукции13. Таким образом диатомовые водоросли света уборки систем являются интересным объектом исследований фотосинтеза.
Диатомовые водоросли, как ориентированных видов Cyclotella meneghiniana, обладают тилакоидов внутренние свет заготовки систем, названный пигменты они связывают - фукоксантин, хлорофилла (ХЛ) a и c, поэтому FCP. света уборки белков, например FCPs, являются Встроенный в системе мембрана тилакоида состоит из нескольких слоев мембраны. Диатомовые водоросли образуют полосы три тилакоидов. Этот комплекс положение делает его трудным для их изучения на молекулярном уровне в тилакоидной мембраны. Кроме того многие компоненты способствуют регуляции света уборки (см. выше). Таким образом во многих подходов, комплексы были изолированы от мембраны, используя мягкий моющих средств, таких как н додецил β-D-maltopyranoside (β-DDM), который солюбилизировать последнего мембраны, но сохраняют FCP комплексов. Многие спектроскопические исследования были проведены с использованием растворимых FCP расследовать внутримолекулярной энергии передачи14,,1516,17. Однако этот бывший подход был ограничен, поскольку регулирование передачи энергии экситонных взаимодействие с другими антенные комплексы или фотосистемы. Следовательно, эти виды исследований не могут осуществляться с растворимых комплексов потому, что взаимодействие между комплексами теряется.
Важной особенностью в положении антенна является «молекулярная вытеснения» антенны и фотосистем в тилакоидной мембраны18. Ранее, простой подход было проведено, чтобы имитировать этот эффект в пробирке. Был удален моющих средств, что приводит к случайным агрегации антенных комплексов. Хотя некоторые разумные данных было получено17,этот подход19, моющего средства удаления не отражает ситуацию в естественных условиях и имеет некоторые ограничения, поскольку комплексы не взаимодействующих в их регулярных третичный структура.
Использование липосомы преодолевает несколько бывших ограничений. Третичная структура по-прежнему полностью нетронутыми. Липосомы мембраны обеспечивает квази родной среде для антенных комплексов. Мембрана отделяет внутри липосом из внешней среды. Этими средствами липосомы предоставляют две реакции отсеков для исследований Ион и pH градиентов, а также транспортных процессов. Кроме того параметры экспериментальной системы могут контролироваться более легко исследований в тилакоидной мембраны. Уже показано, что липосомы были отличным инструментом для изучения фотосинтетической комплексов. Основное внимание в прошлом был на заводе LHC, где влияние изменения липидного состава был протестирован на LHC II20. В других подходов протеин протеина взаимодействия между различными LHC II были исследованы21. Кроме того, некоторые в зеленых водорослей были проведены исследования описывают, спонтанное кластеризации между LHC22. Учитывая важность диатомовых водорослей для водных экосистем относительно немногие исследования проводились с антенные комплексы диатомовых водорослей. Два исследования исследованы антенные комплексы ориентированных Cyclotella meneghiniana, где были показаны кластеризации FCP антенна23 и оперативности FCP электрохимических градиентов24 . Таким образом липосомы являются отличным инструментом для изучения взаимодействия диатомовых антенн и их регулирования в условиях почти родной. Липосомы универсальны, поскольку многие условия, такие как липидного состава, липосомы размер, плотность белка и окружающей водной фазе может контролироваться. Кроме того этот метод требует низкого количества образцов. Экспериментальная система является надежной и высокую воспроизводимость. Изолированность липосомы позволяет для изучения рН и Ион градиенты, которые являются важными факторами в регулировании антенных комплексов.
Здесь мы описываем изоляции FCP антенных комплексов с C. meneghiniana и их включения в липосомах с естественным тилакоидов липидный состав. Кроме того мы предоставляем образцовые данные для спектральные характеристики растворимых FCP и сравнить их с FCP в липосомах. Метод обобщает знания и стандартизованных протоколов, полученные от улучшения Гундерманн и бушель 201223, Натали et al. 201622и24Ахмад и Дицеля 2017.

Рисунок 1: Схематическое представление рабочего процесса. (1) относится к пункту 1, который описывает рост клеток, нарушения и изоляции тилакоид с following FCP разделения на градиенты плотности сахарозы; C. м. -Cyclotella meneghiniana клетки. (2) приготовления смеси натуральных тилакоидов липидов (MGDG, DGDG и SQDG) описано в пункте 2 и создание мицелл липидов-моющего средства с octylglycoside (ОГ). Размер определенный липид мицеллы достигается методом экструзии, с использованием определенной поры диаметром мембраны. FCP и липидов мицеллы унифицированы на предопределенные липидов: соотношение белка и моющих средств, ОГ и β-DDM будут удалены через контролируемые диализа, образуя FCP proteoliposomes. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
протокол
Примечание: Фотосинтетическая комплексы такие как FCPs весьма уязвимы для тепла и света. Всегда работайте на льду и очень тусклый свет.
1. изоляция FCP от клеток
-
Тилакоидов изоляции от клеток C. meneghiniana
- Растут C. meneghiniana в пяти 500 мл колб, которые каждый заполнены с 300 мл ASP-средний23,25 и 50 миллионов клеток. Подключите колбы с пробкой хлопка и позволяют клеткам расти фазы экспоненциального роста приблизительно в одну неделю на шейкер на 120 об/мин с 16 h света и темные фазы 8 h 40 мкмоль photons/(m²s) белый свет и температура между 15-18 ° C. Проверьте, что номер ячейки составляет 1,5-2 миллиона клеток/мл с камерой счетчик клеток.
- Центрифуга клетки на 4000 x g в помощи ротор центрифуги флакон 500 мл (4 ° C) для 15 мин в высокоскоростной центрифуги. Вновь приостановите клетки окатышей в 12 мл гомогенизации буфера (HB, Таблица 1), закупорить.
- Подвеска передать один 50 мл пластиковую трубку. Хранение образцов-80 ° C или перейдите к пункт 1.1.3.
- Предварительно охладить бисерная мельница и оборудование. Заполните 50 мл стакан мельницы до 75% с стеклянный шарик смесь и добавить суспензию клеток. Для разрушения клеток, используйте 7 x 45 s импульсов на полной скорости с 30 s охлаждения между каждого импульса. В шаге 1.1.6 примите 20 мкл нарушается клеток для проверки качества.
- Фильтр нарушается клетки над воронкой фильтра стекла и мыть, поливая HB через стеклянные бусы, до тех пор, пока они выглядят четкими. Бассейн мыть дроби с фильтрата. Держите окончательный объем меньше, чем 150 мл.
- Центрифуга для образца для 15 мин на 140 x g Пелле мусора ячейки с помощью трех 50 мл пластиковых труб. Тщательно супернатант передать ultracentrifugation флакон 20 мл поликарбоната и отбросить гранулы.
- Заполните флаконы с HB, сбалансировать вес и центрифуги в подходящей ротор за 1 ч в 300 000 x g и 4 ° C до Пелле тилакоидной мембраны.
- Используйте время центрифугирования для проверки доля нарушается клеток по микроскопии в 400 X увеличение с 20 мкл пример в 1.1.3. Рассчитайте соотношение между хлоропласта бесплатно и хлоропластов, содержащих frustules (кремний снарядов).
Примечание: Диатомовых клеточной стенки изготовлены из кремнезема, который виден как высоко Дифрагирующая вещество в микроскопе. Хлоропласты, происходящих как зеленые точки должны были освобождены от клеток если работал разрушения клеток. - Вновь приостановить мембраны лепешка с как мало Отмывающий буфер как можно скорее (0,5-1 мл) с помощью кисти маленький художник. Заполните ultracentrifugation флаконы из поликарбоната с отмывающего буфера (Таблица 1), сбалансировать их вес и центрифуги для 20 минут, 200000 x g и 4 ° C.
- Вновь приостановите промывают мембраны с кисти художника. Добавьте Отмывающий буфер, только если необходимо сохранить концентрацию тилакоидов как можно выше. Объединить все тилакоидов в одном образце флаконе (15 мл).
- Предварительно развести образцы с использованием 10 мкл пример с 90 µL 100% ацетона. Центрифуга на 12000 x g за 5 мин до Пелле осажденный белки. Возьмите 10 мкл predilution и смешать его с 990 мкл 90% ацетона.
- Измерение оптической плотности (ABS) хлорофилла a и c в 664 Нм и 630 Нм в 90% ацетона. Вычтите ABS750nm от обоих значений. Определить содержание всего хлорофилла, по следующей формуле:24
1)
2)
- Измерение оптической плотности (ABS) хлорофилла a и c в 664 Нм и 630 Нм в 90% ацетона. Вычтите ABS750nm от обоих значений. Определить содержание всего хлорофилла, по следующей формуле:24
- Аликвота тилакоидов порциями 0,5 мг всего хлорофилла в 1,5 мл пробирок реакции, заморозить их в жидком азоте и хранить их в-80 ° C до дальнейшего использования.
-
Разделение и концентрация FCP комплексов
- Подготовка градиентного раствора сахарозы и заполнить ультрацентрифуга трубы до верхней минус объем загрузки (300 – 500 мкл). Замораживание труб при-20 ° C до тех пор, пока они полностью заморожены. Разрешить трубы таять при + 4 ° C, который занимает 3-4 ч для 17 мл.
- Повторите цикл замораживания оттаивания дважды, чтобы уточнить градиента для лучшего разрешения.
- Использовать образцы, полученные в 1.1.9 соответствует 0,5 мг хлорофилла и отрегулировать с буфером B1 (Таблица 1) окончательный объемом 2 мл. Для солюбилизация добавьте n додецил β-D-maltopyranoside (b-DDM) в конечной концентрации 20 мм.
- Инвертировать трубку 3 раза и поместите его на льду на 20 мин с нежным пожимая избежать пены. Центрифуги для 5 мин, при 12000 x g в центрифугу предварительно охлажденным столешницы при + 4 ° C.
- Загрузите супернатант на градиенте. Загружайте не более чем 125 мкг всего хлорофилла в градиент если 17 мл флаконы используются. Центрифуги для 22 h на 100,000 x g и + 4 ° C.
- Восстановить желаемый коричневый FCP фракций из градиента с помощью шприца (рис. 2A). Возьмите 5 мкл аликвота и разбавить его с 995 мкл B1a.
- Измерение оптической плотности (ABS) спектра между 370-750 нм в UV-VIS-спектрофотометр. Используйте полу микро оптические стеклянные кюветы.
- Откройте менеджер программного обеспечения спектры, перейдите на режим спектра и запись исходных от 370 до 750 Нм следуют примеры измерений. Используйте следующие параметры: проверять скорость, 200 Нм/мин; поле данных, 0.5 Нм; ответ, средний.
- Измерьте объем изъятых образцов с микропипеткой. Мыть комплексы FCP, добавив два раза восстановленный том с буфером B1 (Таблица 1). Концентрируются в мембраны концентратор с 30 среза на 1000 x g и + 4 ° C до ABS672nm по крайней мере 20 кДа.
Примечание: B-DDM концентрации может возрасти благодаря мицеллы обогащения в отсеке образца. Это может привести к дальнейшему солюбилизация FCP комплексов! Избегайте чрезмерной солюбилизация, добавив стиральный порошок свободного буфера B1 Если стиральная дальнейшие шаги необходимы для удаления остаточного сахарозы. - Возьмите 20 мкл аликвота для элементов управления. Шок замораживание образцов в жидком азоте и хранить их в-80 ° C.
- Подготовка градиентного раствора сахарозы и заполнить ультрацентрифуга трубы до верхней минус объем загрузки (300 – 500 мкл). Замораживание труб при-20 ° C до тех пор, пока они полностью заморожены. Разрешить трубы таять при + 4 ° C, который занимает 3-4 ч для 17 мл.

Рисунок 2: Очистка FCP, спектроскопические контроль и проверка чистоты. (A) типичный вид градиента плотности сахарозы после ночи центрифугирования. Все коричневые полосы содержат FCP бассейн, состоящий из FCPa и FCPb. pigm. - несвязанных пигменты, PS - спектров поглощения (B) фотосистемы FCP до (синяя линия) и после (оранжевый пунктирная линия) концентрации с помощью центробежного фильтра устройств с 30 кДа отсечки . В частности каротиноиды склонны к потере от FCP, которое приведет к нижней поглощения в регионе между 500-550 Нм. Графы нормализуются с хлорофиллом Qy максимальная на ~ 670 нм. (C) хлорофилла a выбросов спектры с возбуждением chl c (465 Нм) для тестирования передачи энергии функциональные возбуждения. Если энергия передачи chl c chl затруднено, дополнительные флуоресценции band в ~ 640 Нм (chl c) будет происходить. Графы нормализуются к выбросам максимум. (D) спектров возбуждения записана в 675 Нм (chl флуоресценции максимум) для тестирования передачи энергии chl от всех пигментов поглощающих между 370 Нм и 600 Нм. Если энергия передачи chl является менее эффективным, выход флуоресценции уменьшит особенно между 465 и 550 Нм. Графики, нормализуется до максимума около 440 Нм. Спектры в (B), (C) и (D) почти идентичны, если концентрация работал хорошо. (E) Проверьте чистоту изолированных FCP, используя трис Трицин гель28. FCPa и FCPb имеют подразделения между 18-19 кДа. Все видимые серебро окрашенных белки больше чем 20 кДа являются загрязнителями. Тиль. -Тилакоиды пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
-
Спектральные и гель на основе элементов управления
- Запись поглощения между 370-750 Нм 5 мкл FCP в 995 мкл B1a после шага 1.2.5. Сравните его с спектра, полученного на шаге 1.2.4. Используйте те же инструментария и параметров, как описано в шаге 1.2.4.
- Экспорт данных в *.csv и импорта данных в таблицу. Нормализовать обоих спектров в максимуме КХЛ в полосеy Q около 672 Нм, как показано на рисунке 2B.
- Вычислить коэффициент разбавления пробы из шага 1.2.4 и 1.3.1 путем деления измеренного ABS672nm по желаемой ABS672nm 0,03. Развести образцы соответственно с B1a и перенести их в специальные стеклянные кюветы флуоресценции.
- Запись chl эмиссионный спектр флуоресценции с spectrofluorometer выявить передачи нетронутыми световой энергии от chl c chl (рис. 2 c).
- Использование программного обеспечения спектрометра и перейти в режим измерения спектра со следующими параметрами: режим, выбросов; щель шириной возбуждения и выбросов, 3 Нм; чувствительность, средний; скорость сканирования, 100 Нм/мин; поле данных, 0.5 Нм; Длина волны возбуждения, 465 Нм; Эмиссия, 600-800 Нм. Выполните autozero и меру.
- Запишите спектры возбуждения с тем же образца и оборудование, чтобы выявить передачи нетронутыми энергии от всех пигментов хлорофилла (Рисунок 2D). Чтобы изменить параметры: режим, возбуждения; Длина волны излучения, 675 Нм; возбуждение, 370-600 Нм. Запишите спектры.
- Исправьте родамин спектра в том же диапазоне для спектральных свойств лампы – cf. инструкции в руководстве пользователя.
- Mix FCP образцов, соответствующих 1 µg chl с 10 мкл буфера SDS-загрузки. Проинкубируйте втечение 10 мин при 25 ° C. Центрифуги для 5 мин при 12000 x g в центрифуге столешницы.
- Загрузите супернатант трис Трицин гель28. Отдельные его за 2 ч в 150 V и серебро пятно его после разделения40.
Примечание: FCP субблоков разделить на две группы видных белка между 18-19 кДа, которые являются составными FCPa и FCPb29 (Рисунок 2E).
- Загрузите супернатант трис Трицин гель28. Отдельные его за 2 ч в 150 V и серебро пятно его после разделения40.
- Запись поглощения между 370-750 Нм 5 мкл FCP в 995 мкл B1a после шага 1.2.5. Сравните его с спектра, полученного на шаге 1.2.4. Используйте те же инструментария и параметров, как описано в шаге 1.2.4.
2. Подготовка липосомы и включение FCP
-
Подготовка смеси липидов и стиральный порошок мицеллы липидов
Примечание: липиды являются чувствительными к теплой температуры в сочетании с окислительным условиям. Попробуйте держать липиды, охлажденной и под N2 атмосферы.- Рассчитайте коэффициенты желаемой тилакоидов липидов для C. meneghiniana согласно Vieler et al. 200730. Обратитесь к примеру в дополнительный Таблица 1. Подготовьте липидов акций решения, рекомендованного изготовителем в контейнере растворителя доказательство.
- Пипетка нужное количество липидов в 2-мл пробирку реакции и выпарить хлороформ, используя поток нежный азота и попытаться распространились по всей площади основания трубки липиды. Пусть N2 потока до тех пор, пока весь растворитель испаряется.
- Солюбилизировать последнего смесь липидов в 29 мкл раствора n октиловый β-D-glucopyranoside (ОГ) при 4 ° C для 4 h. инкубировать липидов смесь для 10 мин при 30 ° C. Инкубировать липидов в ванну sonicator 3 x 3 мин при 25 ° C, прервано 30 s на льду.
- Добавление 221 мкл буфера Трицин и 250 мкл 4 x диализа буфера.
- Используйте экструдера с 0,1 мкм поликарбоната мембраны для определенных липосом диаметром 50-70 нм. Соберите экструдера с поддержкой мембраны и фильтра. Избежать воздушных пузырей и затяните Ассамблея тщательно.
- Заполнить один шприц с 4 x диализа буфера и предварительно мокрой экструдера, до тех пор, пока не пузыри можно увидеть в втором шприце.
- Применить липидов-моющее средство мицеллы экструдера и нажмите вперед решение от одного шприца в другую и обратно. Повторите этот шаг 5 раз, до тех пор, пока решение появится однородная.
Примечание: Этот раствор может храниться при температуре 4 ° C на несколько дней. Не замораживать!
-
Включение FCP комплексов и удаления моющих средств и агрегатов
Примечание: В этом примере мы используем липидов/chl соотношении 12:1, что соответствует соотношение липидов/белка примерно плечом.- Добавить FCP равным 20 мкг ХЛ в общем объеме 500 мкл буфера B1a 250 μL экструдированные липидов-мицелл и 250 мкл 4 x диализа буфера. Проинкубируйте образцы для 3 x 3 мин при 25 ° C в thermomixer при 1500-3000 об/мин, прерван 30 s паузы на льду.
- Вырежьте крышку четыре трубки реакции 1,5 мл под верхней, давая кольцо, которая по-прежнему вписывается в крышке. Приготовить 1,5 x 1,5 см кусочки мембраны для диализа и мыть их в 20 мл 1 x диализа буфера
- Заполните 250 мкл образца для каждой крышкой. Осторожно заложить мембраны на крышке, так что отсек полностью заполнены с образцом и происходят без воздушных пузырей. Затяните кольцо трубки реакции на Ассамблее для того, чтобы иметь закрытый отсек.
- Dialyze образцы в 50 мл 1 x диализа буфера на ночь (12-16 ч) на льду на Тамблинг шейкер. Замените свежим буфера используется диализа и добавить 7 мг адсорбента бусы, чтобы удалить оставшиеся моющие средства для по крайней мере 6 часов.
- Заменить буфере диализа снова и dialyze для другого 12 h. восстановить липосомы, пирсинг диализа мембраны с наконечником микропипеткой 200 мкл и аспирационная все липосомы от крышку трубки реакции.
- Необязательный шаг: Если высокой чистоты (> 95%) необходима. Подготовьте разрывными плотность градиент в 17 мл флаконы ultracentrifugation с шагами, содержащие 6%, 10%, 15% и 20% сахарозы сополимеров эпихлоргидрина в буфере диализа. Загрузите липосомы сверху и ультрацентрифугирования на 100,000 x g для 4 ч в размахивая ведро ротора.
- Восстановить верхняя коричневая полоса с помощью шприца, разбавления 1:5 пример с DP и переходите к следующему шагу.
- Центрифуга для FCP липосомы в по крайней мере 2 мл 1 x диализа буфер для 1,5 h на 100,000 x g и 4 ° C. Восстановите липосомы, повернув пластиковых пробирок с углом 45°. Разрешить липосомы двигаться за 1 мин (рис. 3A).
- Восстановить FCP липосомы в окончательный объем 25-50 мкл. не мешать осадок.
-
Контроль 1: поглощения, флуоресцентной спектроскопии
- Добавьте 3 мкл Алиготе FCP-липосом конечный объем 1 x буфер диализа и центрифуги для 5 мин при 12000 g x 1 мл.
- Запись оптической плотности от 370 до 750 Нм FCP-липосомы с того же оборудования, как описано в 1.2.4. Нормализовать спектра до максимума в регионеy Q ХЛ (670-680 нм) и сравнить его с нормализованной спектр растворимых FCP (рис. 3 c).
- Подготовить FCP-липосомы в 1 мл DP с оптической плотности (ABS) = 0,03 отношении максимум между 670-680 нм. Отрегулируйте растворимых FCP моющего средства от шага 1.2.6 же АБС, разбавления с B1a.
- Записывать спектры поглощения обоих образцов, как описано в 1.2.4. Запись chl эмиссионный спектр флуоресценции обоих образцов, как описано в 1.3.3.
Примечание: Флуоресценции урожайность уменьшается в образце FCP-липосомы (рис. 3D и сравни обсуждения.)
- Добавьте 3 мкл Алиготе FCP-липосом конечный объем 1 x буфер диализа и центрифуги для 5 мин при 12000 g x 1 мл.
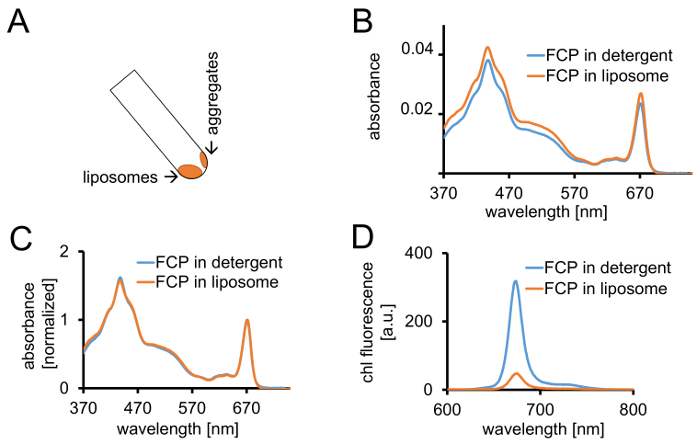
Рисунок 3: изоляция FCP proteoliposomes следуют спектроскопических контроля и конфокальная томография. (A) восстановления FCP липосом после центрифугирования. Поворачивайте трубку центрифугирования до 45° и подождите примерно 1 мин - липосомы будет двигаться вниз, тогда как FCP агрегатов, которые не включаются в липосомах прилипают к стенке трубки. (B) сравнения спектров поглощения растворимых FCP моющего средства (синий) и FCP в липосомах (оранжевый) (C) же спектры как и (B) нормированы chl максимум в регионе красный (~ 670 нм - Qy пик); растворимых FCP моющего средства (синий) и FCP в липосомах (оранжевый). Потенциально там может быть пигмент потери главным образом каротиноиды видимым в регионе Нм 500-550. Кластеризация FCP в липосомы может привести к расширению пик и смещение chl максимум (~ 670 нм) на красный. (D) выбросов спектры растворимых FCP моющего средства и FCP в липосомы. Кластеризация FCP в липосомы усиливает энергичные взаимодействия FCP комплексов, которые снижает выход флуоресценции (Оранжевая кривая) и слегка сдвигает Максима выбросов на красный. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Результаты
Протокол описывает изоляции всего FCP фракции от Cyclotella meneghiniana и включения в липосомы с родной липидный состав. Изоляция тилакоидов высокую воспроизводимость, но тилакоидов доходность может измениться. Результатом является приемлемым, если более 50% всех пигментов ...
Обсуждение
FCP липосомы с естественный липидный состав обеспечивают удобный, простой и воспроизводимые инструмент исследовать спектральные свойства в пробирке. Окружающей среды липидов в FCP липосомы напоминает ситуацию в тилакоидной мембраны, рождая экспериментальные результаты, которые н?...
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Мы благодарим рана Adeel Ахмад за помощь в FCP очистки. Профессор Claudia Büchel признается за полезные обсуждения и читать рукопись. Эта работа была поддержана Немецкий исследовательский фонд, чтобы LD (DI1956-1/1) и Фонд Гумбольдта Феодор Линен стипендий на LD.
Материалы
| Name | Company | Catalog Number | Comments |
| 500 ml centrifuge vials | |||
| high speed centrifuge | Heraeus | ||
| Bead Mill VI 2 | Edmund-Bühler (edmund-buehler.de) | newer version: Vibrogen-Zellmühle Vl 6 | |
| Silibeads S 400 µm | Sigmund-Lindner.com | 5223-7 | |
| Silibeads S 1,-1,3 mm | Sigmund-Lindner.com | 4504 | |
| VitraPOR filter funnel - por1 | ROBU GmbH | 21121 | |
| polycarbonate ultracentrifuagtion vials (30 mL) for T-865 | Beranek Laborgeräte (Laborgeraete-beranek.de) | 314348 | |
| Ultracentrifuge Discovery 90SE | Sorvall | n.a. | |
| rotor T 865 | ThermoFisher Scientific (thermofisher.com) | 51411 | |
| Neubauer Cell Counter Chamber (improved) | Carl Roth Laborbedarf (Carlroth.com) | T729.1 | |
| Zeiss Mikroskop Primostar (7) | Optik-Pro (optik-pro.de) | 51428 | |
| optical glass cuvettes (6040-OG) | Hellma Analytics (hellma-analytics.com) | "6040-10-10" | |
| V-630 UV-VIS Spectrophotometer (incl. software) | Jasco (jasco.de) | V-630 | |
| n-Dodecyl-β-D-Maltopyranoside | ANATRACE (anatrace.com) | D310LA | |
| Ultra-Clear tubes 17 ml for AH629 | Beranek Laborgeräte (Laborgeraete-beranek.de) | 344061 | |
| rotor AH629-17-mL | ThermoFisher Scientific (thermofisher.com) | 54285 | |
| Membrane concentrator_Centriprep 30 kDa cutoff | Millipore (merckmillipore.com) | 4307 | |
| Biometra Minigel-Twin | Analytik Jena AG (analytik-jena.de) | 846-010-100 | |
| Silver Stain Plus Kit | Bio-Rad (bio-rad.com) | 1610449 | |
| libre office spread sheet | The document foundation | https://de.libreoffice.org/download/libreoffice-still/ | |
| special glass cuvettes for fluorescence (101-0S) | Hellma Analytics (hellma-analytics.com) | 101-10-20 | |
| Spectrofluorometer FP-6500 (incl. Software) | Jasco (jasco.de) | FP-6500 | |
| SDS-loading buffer Roti-Load | ROTH (carlroth.com) | K929.1 | |
| n-octyl β-D-glucopyranoside | ANATRACE (anatrace.com) | O311 | |
| Monogalactosyl Diaclyglycerol (MGDG) | Larodan AB (larodan.com) | 59-1300 | make stock solution in chloroform |
| Digalactosyl Diacylglycerol (DGDG) | Larodan AB (larodan.com) | 59-1310 | make stock solution in chloroform |
| Sulphoquinovosyl Diacylglycerol (SQDG) | Larodan AB (larodan.com) | 59-1230 | make stock solution in chloroform |
| L-alpha-Phosphatidylglycerol (PG) | Larodan AB (larodan.com) | 37-0150 | make stock solution in chloroform |
| L-α-Phosphatidylcholine | Sigma-Aldrich (sigmaaldrich.com) | P3782 SIGMA | make stock solution in chloroform |
| sonicator bath S-50TH | Sonicor (getmedonline.com | SONICOR-S-50TH | |
| mini-Extruder | Avanti Polar Lipids (Avanti.com) | 610000 | |
| Nuleopore polycarbonate membrane | Avanti Polar Lipids (Avanti.com) | 610005 | |
| dialysis membrane Visking 14 kDa cutoff | ROTH (carlroth.com) | 0653.1 | boil in destilled water before use |
| Biobeads SM2 Adsorbent | Biorad (Bio-rad.com) | 152-3920 | |
| sucrose epichlorhydrin copolymer - Ficoll 400 | Sigma-Aldrich (sigmaaldrich.com) | F4375 | |
| Polycarbonate ultracentrifuagtion vials (2.7 mL) for TFT 80.4 | Beranek Laborgeräte (Laborgeraete-beranek.de) | 252150 | |
| rotor TFT 80.4 | Millipore (merckmillipore.com) | 54356 | |
| material listed in order of appearance | For specific safety instructions please refer to material safety sheets and repective manuals. Standard lab material and substances are not listed. |
Ссылки
- Eberhard, S., Finazzi, G., Wollman, F. A. The Dynamics of Photosynthesis. Annual Review of Genetics. 42, 463-515 (2008).
- Li, Z. R., Wakao, S., Fischer, B. B., Niyogi, K. K. Sensing and Responding to Excess Light. Annual Review of Plant Biology. 60, 239-260 (2009).
- Niyogi, K. K., Truong, T. B. Evolution of flexible non-photochemical quenching mechanisms that regulate light harvesting in oxygenic photosynthesis. Current Opinion in Plant Biology. 16 (3), 307-314 (2013).
- Li, X. -. P., et al. A pigment-binding protein essential for regulation of photosynthetic light harvesting. Nature. 403 (6768), 391-395 (2000).
- Peers, G., et al. An ancient light-harvesting protein is critical for the regulation of algal photosynthesis. Nature. 462 (7272), 518-521 (2009).
- Correa-Galvis, V., et al. Photosystem II Subunit PsbS Is Involved in the Induction of LHCSR Protein-dependent Energy Dissipation in Chlamydomonas reinhardtii. The Journal of biological chemistry. 291 (33), 17478-17487 (2016).
- Bailleul, B., et al. An atypical member of the light-harvesting complex stress-related protein family modulates diatom responses to light. Proceedings of the National Academy of Sciences of the United States of America. 107 (42), 18214-18219 (2010).
- Taddei, L., et al. Multisignal control of expression of the LHCX protein family in the marine diatom Phaeodactylum tricornutum. Journal of experimental botany. 67 (13), 3939-3951 (2016).
- Lepetit, B., et al. The diatom Phaeodactylum tricornutum adjusts nonphotochemical fluorescence quenching capacity in response to dynamic light via fine-tuned Lhcx and xanthophyll cycle pigment synthesis. New Phytologist. 214 (1), 205-218 (2017).
- Büchel, C. Evolution and function of light harvesting proteins. Journal of Plant Physiology. 172, 62-75 (2015).
- Lavaud, J., Rousseau, B., van Gorkom, H. J., Etienne, A. -. L. Influence of the Diadinoxanthin Pool Size on Photoprotection in the Marine Planktonic Diatom Phaeodactylum tricornutum. Plant Physiology. 129 (3), 1398-1406 (2002).
- Ruban, A., et al. The super-excess energy dissipation in diatom algae: comparative analysis with higher plants. Photosynthesis Research. 82 (2), 165-175 (2004).
- Mann, D. G. The species concept in diatoms. Phycologia. 38 (6), 437-495 (1999).
- Papagiannakis, E., van Stokkum, I. H. M., Fey, H., Büchel, C., van Grondelle, R. Spectroscopic Characterization of the Excitation Energy Transfer in the Fucoxanthin-Chlorophyll Protein of Diatoms. Photosynthesis Research. 86 (1-2), 241-250 (2005).
- Premvardhan, L., Robert, B., Beer, A., Büchel, C. Pigment organization in fucoxanthin chlorophyll a/c2 proteins (FCP) based on resonance Raman spectroscgopy and sequence analysis. Biochimica et Biophysica Acta-Bioenergetics. 1797 (9), 1647-1656 (2010).
- Gildenhoff, N., Herz, J., Gundermann, K., Büchel, C., Wachtveitl, J. The excitation energy transfer in the trimeric fucoxanthin-chlorophyll protein from Cyclotella meneghiniana analyzed by polarized transient absorption spectroscopy. Chemical Physics. 373 (1), 104-109 (2010).
- Ramanan, C., et al. Exploring the mechanism(s) of energy dissipation in the light harvesting complex of the photosynthetic algae Cyclotella meneghiniana. Biochimica et Biophysica Acta-Bioenergetics. 1837 (9), 1507-1513 (2014).
- Haferkamp, S., Kirchhoff, H. Significance of molecular crowding in grana membranes of higher plants for light harvesting by photosystem II. Photosynthesis Research. 95 (2-3), 129-134 (2008).
- Wahadoszamen, M., et al. Stark fluorescence spectroscopy reveals two emitting sites in the dissipative state of FCP antennas. Biochimica et Biophysica Acta-Bioenergetics. 1837 (1), 193-200 (2014).
- Zhou, F., et al. Effect of monogalactosyldiacylglycerol on the interaction between photosystem II core complex and its antenna complexes in liposomes of thylakoid lipids. Photosynthesis Research. 99 (3), 185-193 (2009).
- Moya, I., Silvestri, M., Vallon, O., Cinque, G., Bassi, R. Time-resolved fluorescence analysis of the photosystem II antenna proteins in detergent micelles and liposomes. Biochemistry. 40 (42), 12552-12561 (2001).
- Natali, A., et al. Light-harvesting Complexes (LHCs) Cluster Spontaneously in Membrane Environment Leading to Shortening of Their Excited State Lifetimes. Journal of Biological Chemistry. 291 (32), 16730-16739 (2016).
- Gundermann, K., Büchel, C. Factors determining the fluorescence yield of fucoxanthin-chlorophyll complexes (FCP) involved in non-photochemical quenching in diatoms. Biochimica et Biophysica Acta-Bioenergetics. 1817 (7), 1044-1052 (2012).
- Ahmad, R. A., Dietzel, L. Relaxation of cellular K+ gradients by valinomycin induces diatoxanthin accumulation in Cyclotella meneghiniana cells and alters FCPa fluorescence yield in vitro. Physiologia Plantarum. , 171-180 (2017).
- Provasoli, L., McLaughlin, J. J. A., Droop, M. R. The development of artificial media for marine algae. Archiv für Mikrobiologie. 25 (4), 392-428 (1957).
- Jeffrey, S., Humphrey, G. New spectrophotometry equations for determining chlorophyll a, chlorophyll b, chlorophyll c-1 and chlorophyll c-2 in higher plants, algae and natural phytoplankton. Biochemie und Physiologie der Pflanzen. 167, 191-194 (1975).
- Beer, A., Gundermann, K., Beckmann, J., Büchel, C. Subunit Composition and Pigmentation of Fucoxanthin−Chlorophyll Proteins in Diatoms: Evidence for a Subunit Involved in Diadinoxanthin and Diatoxanthin Binding. Biochemistry. 45 (43), 13046-13053 (2006).
- Schägger, H., von Jagow, G. Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa. Analytical Biochemistry. 166 (2), 368-379 (1987).
- Büchel, C. Fucoxanthin-Chlorophyll Proteins in Diatoms: 18 and 19 kDa Subunits Assemble into Different Oligomeric States. Biochemistry. 42 (44), 13027-13034 (2003).
- Vieler, A., Wilhelm, C., Goss, R., Süß, R., Schiller, J. The lipid composition of the unicellular green alga Chlamydomonas reinhardtii and the diatom Cyclotella meneghiniana investigated by MALDI-TOF MS and TLC. Chemistry and Physics of Lipids. 150 (2), 143-155 (2007).
- Gundermann, K., Büchel, C. The fluorescence yield of the trimeric fucoxanthin-chlorophyll-protein FCPa in the diatom Cyclotella meneghiniana is dependent on the amount of bound diatoxanthin. Photosynthesis Research. 95 (2-3), 229-235 (2008).
- Miloslavina, Y., et al. Ultrafast fluorescence study on the location and mechanism of non-photochemical quenching in diatoms. Biochimica et Biophysica Acta-Bioenergetics. 1787 (10), 1189-1197 (2009).
- Grouneva, I., Jakob, T., Wilhelm, C., Goss, R. The regulation of xanthophyll cycle activity and of non-photochemical fluorescence quenching by two alternative electron flows in the diatoms Phaeodactylum tricornutum and Cyclotella meneghiniana. Biochimica et Biophysica Acta-Bioenergetics. 1787 (7), 929-938 (2009).
- Chukhutsina, V. U., Büchel, C., van Amerongen, H. Disentangling two non-photochemical quenching processes in Cyclotella meneghiniana by spectrally-resolved picosecond fluorescence at 77 K. Biochimica et Biophysica Acta-Bioenergetics. 1837 (6), 899-907 (2014).
- Ghazaryan, A., Akhtar, P., Garab, G., Lambrev, P. H., Büchel, C. Involvement of the Lhcx protein Fcp6 of the diatom Cyclotella meneghiniana in the macro-organisation and structural flexibility of thylakoid membranes. Biochimica Et Biophysica Acta-Bioenergetics. 1857 (9), 1373-1379 (2016).
- Darley, W. M. Biochemical composition. The biology of diatoms. 13, 198-223 (1977).
- Milsman, M. H. W., Schwendner, R. A., Weder, H. G. Preparation of large single bilayer liposomes by a fast and controlled dialysis. Biochimica Et Biophysica Acta. 512 (1), 147-155 (1978).
- Zumbuehl, O., Weder, H. G. Liposomes of controllable size in the range of 40 to 180 nm by defined dialysis of lipid-detergent-mixed micelles. Biochimica Et Biophysica Acta. 640 (1), 252-262 (1981).
- Verchere, A., Broutin, I., Picard, M. Photo-induced proton gradients for the in vitro investigation of bacterial efflux pumps. Scientific Reports. 2 (306), (2012).
- Chevallet, M., Luche, S., Rabilloud, T. Silver staining of proteins in polyacrylamide gels. Nature Protocols. 1 (4), 1852-1858 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены