Method Article
Aggresome のような誘発構造で退色の黄色蛍光タンパク質タグ p62 後の蛍光回復
要約
退色実験細胞のライブ後の蛍光回復のための包括的かつ実用的なプロトコルについて述べる。プロトコル aggresome のような誘導構造の黄色蛍光タンパク質タグ p62 のモビリティの測定に使用しているが、各種顕微鏡システム、蛍光蛋白質に適用できます。
要約
(FRAP) 退色後蛍光回復 生細胞における蛋白質の移動性を定量化する使用ことができます顕微鏡手法です。典型的な FRAP 実験で繰り返される低強度レーザー光による定常状態の蛍光が観察されます。その後、蛍光分子が高強度レーザー光を簡単に暴露を介して迅速かつ不可逆的障害です。蛋白質の移動性に関する情報は、蛍光の回復を監視することによって取得されます。リポ多糖 (LPS) の刺激によた後マウスマクロファージ内 aggresome のような誘導構造 (ALIS) の p62 の流動性を決定する FRAP を使いました。不完全なまたは複雑な多くの既存 FRAP プロトコルであるために、私たちの目標は生きているセルと FRAP 実験の包括的な実用的な簡単なステップバイ ステップ プロトコルを提供するためにでした。ここでは、黄色蛍光タンパク質-p62 (YFP p62)、細胞を LPS、および prebleach、postbleach FRAP の画像とデータ解析を収集するためのステップバイ ステップのメソッドを公開することによってアリスの誘導の RAW264.7 マクロファージ トランスフェクションについて述べる。最後に、我々 は FRAP 実験を行う際の重要な要因をについて説明します。
概要
退色 (FRAP) はライブにおけるタンパク質ダイナミクスを定量化するため顕微法後の蛍光回復細胞1,2です。レーザ走査型共焦点顕微鏡高解像度、速度、感度と、広範な商業的利用のため FRAP の人気が増加しているし、の「虹」遺伝子にエンコードされた蛍光タンパク質、蛍光グリーンなどタンパク質 (GFP) と黄色い蛍光蛋白質 (YFP)3。興味の蛋白質の細胞レベル下のローカリゼーションのために興味の蛋白質を遺伝子にエンコードされた蛍光タンパク質を融合します。典型的な FRAP 実験低強度レーザー光と ROI の繰り返し画像を用いてセル内の利益 (率 ROI) の買収地域の定常状態の蛍光が観察されます。その後、蛍光分子は、以下に高強度レーザー光を簡単に暴露によって投資収益率、漂白剤と呼ばれる買収投資収益率の定義済みのサブセットで迅速かつ不可逆的に障害します。無漂白の新しい蛋白質は、時間をかけて漂白蛋白質を補充すると速度と漂白剤 ROI の蛍光回復の強度は蛋白質の移動性 (図 1)4についてを説明します。
リポ多糖 (LPS) の刺激がきっかけに、FRAP を確認後 RAW264.7 マウスマクロファージ内 aggresome のような誘導構造 (ALIS) のユビキチン結合タンパク質 p62 (として知られている sequestosome-1) の流動性を決定する上で我々 の関心文学。残念ながら、多くの既存 FRAP プロトコル、不完全なまたは極端に複雑で5,6,7,8,9です。いくつかは、レーザーの設定、ビーム パス構成では、画像集録パラメーター5,6,7,8,9の詳細を行いません。他の人はブリーチ ROI ドリフト6,9の問題に対処する方法やモバイル分数 (Mf)、不動小数を含む重要な回復パラメーターを計算する方法などのデータ分析に関する重要な詳細事項を省略しました。(私f)、および回復 (t½)5,7の半分の時間。逆に、他の人は Mf、計算に使用される複雑な数式にあまり重点を置く私f、および t1/25,6,8,9。したがって、我々 の目的は生きているセルと FRAP 実験の包括的な実用的な簡単なステップバイ ステップ プロトコルを提供します。
プロトコル
1. RAW264.7 マクロファージ トランスフェクション
- 完全培地 (ダルベッコ変更イーグル培地 (DMEM)) で 100,000 RAW264.7 細胞 (材料表) の培養 (材料表) 血糖値 4.5 g/L 含む 10% 牛胎児血清 (テーブルの材料を添加しました。) とペニシリン/ストレプトマイシン (材料表) の上に 35 mm ガラス底培養皿 (資材表) を放置し、37 °C/5% CO2インキュベーターで皿を配置。次の日に 1 mg/mL ポリエチレンイミン (PEI) (材料表) を使用してセルを transfect します。
- ミックス 1.5 μ g の YFP p62 を無血清 DMEM (ウシ胎児血清とペニシリン/ストレプトマイシンなし基本中) 166 μ に PEI の 8 μ l。
- 各皿に混合物を追加する前に 15 分間室温で放置トランスフェクションの複雑な混合物をしましょう。
- 優しくセルとロック プレートの既存媒体への複合体を追加します。
- 場所 37 ° C 5% CO2のインキュベーターで一晩プレート。
- 次の朝は、プレートから培地を吸引し、完全培地で一度すすいでください。プレートに 2 mL の完全培地を追加し、細胞が次の日まで修復します。
2 リポ多糖 (LPS) でアリスの誘導
- 次の日は、プレートから培地を吸引し、完全な媒体含む 10 ng/mL LPS (材料表) の 1 つの mL を追加します。37 °C/5% CO2インキュベーターで 5 時間インキュベートするプレートを許可します。
- LPS 処理後、培地を吸引し、145 mM の NaCl、KCl 5 mM、10 mM グルコース 1.5 mM CaCl2、1.0 mM MgCl2、10 mM HEPES (pH 7.4) プレートを洗浄するを含む冷たい、滅菌タイロード バッファーの 1 つの mL を追加します。
- バッファーを吸引し、1 mL の 10 μ g/mL ノコダゾール (資材表) を添加した寒さ、滅菌タイロード バッファーを追加します。FRAP イメージングおよび分析の前に 15 〜 20 分のための 4 ° C でインキュベートするプレートを許可します。
注:部屋の温度で実行するイメージング バッファリングの化合物として HEPES を含むタイロード バッファーの使用できます。ノコダゾールは、ALIS の動きを減少する微小管によって使用されました。培地には、バッファーに CO2を必要とする緩衝化合物として重炭酸塩が含まれています。それ以外の場合、重炭酸塩が CO2の不在で媒体変更 pH に含まれています。
3. セットアップの共焦点顕微鏡と関心の領域を選択します。
- レーザー選択とビームのパス構成
- 禅の目的やソフトウェア (材料表) または適切なイメージング ソフトウェア装備適当な共焦点顕微鏡 (材料表) を使用します。
- YFP 527 512 nm とピーク放出を励起ピークがあり、アルゴン/2 レーザーの 514 nm ラインを選択 nm。取得ボタンをクリック、レーザーボタンをクリックします。[レーザー制御] ウィンドウで、アルゴン/2 458, 477, 488, 514 nm、 、スタンバイボタンをクリックします。ウォーム アップにレーザ光を 〜 3 分を待っている後に、ボタン (図 2A) をクリックします。
- 100% (8.6 A) 514 nm アルゴン/2 レーザー ラインのレーザー出力を設定します。取得ボタンをクリック、レーザーボタンをクリックします。レーザー コントロール ウィンドウの出力 [%]フィールドに100を入力し、 Enterボタン (図 2A) を押します。
- 514 nm アルゴン/2 レーザー ラインの伝送を 5% に設定します。取得ボタン、[チャンネル] ボタンをクリックします。スキャン コントロールウィンドウでチャンネルボタンをクリックし、テキストの左側に正方形の白いボックスをクリックして514 nm 514 nm レーザー ラインを有効にするアクティブな行の列で。514 nm レーザ線 (図 2D) の伝送 [%]フィールドに5を入力します。
- これらのバンドは、励起用の標本に偏向がように、 HFT 458/514/561位置にプライマリ二色性ビームスプリッター (ハウプト ファーブ Teiler (HFT)) を設定します。取得] ボタン、[設定] ボタンをクリックします。構成コントロールウィンドウのチャネル モードボタン、し、 1 つのトラックのボタンをクリックします。HFTボタンをクリックし、ドロップ ダウン メニュー (図 2B) からHFT 458/514/561を選択します。
- 100% の 2 番目のダイクロイックばりスプリッター (Neben ファーブ Teiler 2 (NFT2)) に光を偏向ミラーの位置に最初のダイクロイックばりスプリッター (Neben ファーブ Teiler 1 (NFT1)) を設定します。取得] ボタン、[設定] ボタンをクリックします。構成コントロールウィンドウのチャネル モードボタン、し、 1 つのトラックのボタンをクリックします。NFT1ボタンをクリックし、ドロップ ダウン メニュー (図 2B) からミラーを選択します。
- ようにNFT 515位置に 2 番目のダイクロイックばりスプリッター (NFT2) を設定する波長 < 515 nm に反映されますと波長 > 515 nm が送信されます。取得] ボタン、[設定] ボタンをクリックします。構成コントロールウィンドウのチャネル モードボタン、し、 1 つのトラックのボタンをクリックします。NFT2ボタンをクリックし、ドロップ ダウン メニュー (図 2B) からNFT 515を選択します。
- LP 530ロングパス (LP) 排出フィルター (EF) に設定、波長 > 530 nm、光電子増倍管 (PMT 検出器) に送信されます。取得] ボタン、[設定] ボタンをクリックします。構成コントロールウィンドウのチャネル モードボタン、し、 1 つのトラックのボタンをクリックします。排出フィルターボタンをクリックし、ドロップ ダウン メニュー (図 2B) からLP 530を選択します。
- チャネル 3を選択します。取得] ボタン、[設定] ボタンをクリックします。構成コントロールウィンドウのチャネル モードボタン、し、 1 つのトラックのボタンをクリックします。Ch3ボタンの左側に正方形の白いボックスをクリックします。
- 画像取得設定
- 選択プラン アポクロマート 63 x/1.40 油 (材料表) の目的。顕微鏡の接眼レンズを介して試験片を表示し、ビューのフィールドの中央に ALIS を配置します。マイクロボタン [取得] ボタンをクリックします。顕微鏡制御ウィンドウの目的、次に選択プラン アポクロマート 63 x をクリックして/1.40 オイル ドロップ ダウン メニューから目的。
- 512 x 512 ピクセル、 8、スキャン速度と12ビット データの深さにフレーム サイズを設定します。取得ボタン、し、スキャンボタンをクリックします。スキャン コントロールウィンドウモードボタンとフレームボタンをクリックし、 512 ] ボタンをクリックします。入力8 スキャン速度フィールドでEnterキーを押す12 ビットボタン (図 2C) をクリックします。
- スキャンの平均を1と3に光学ズームを設定します。取得ボタンをクリックして、スキャンボタンをクリックします。スキャン コントロールウィンドウで、スキャンの平均数値フィールドの下向きの矢印ボタンをクリックし、ドロップ ダウン メニューから1を選択します。光学ズーム フィールドに3を入力し、入力してください(図 2C) を押します。
- 582 (飽和) のすぐ下に1.95 風通しの良いユニットや検出器の利得にピンホールを設定します。取得ボタン、し、スキャンボタンをクリックします。スキャン コントロールウィンドウでチャンネルボタンをクリックして、ピンホール フィールドに196を入力し、 enter。検出器を得るためフィールドに582を入力し、入力してください(図 2D) キーを押します。
- 514 nm アルゴン/2 レーザー ラインが 100% 電源 (8.6 A) に設定されているを確認します。レーザーボタン [取得] ボタンをクリックします。レーザー制御メニューで出力 [%] フィールドの値は100 (図 2A) をする必要があります。
- 514 nm アルゴン/2 レーザー ラインが 5% の透過に設定されているを確認します。取得ボタン、し、スキャンボタンをクリックします。スキャン コントロールウィンドウで 514 nm レーザー ラインの伝送 [%] フィールドの値は、 5 (図 2D) をする必要があります。
- 寸法 150 × 150 ピクセル (194.6 μ2) を持つ正方形 ROI (投資収益率の獲得) を作成します。取得ボタン、し、 ROI の編集ボタンをクリックします。ROI の編集] メニューの [四角形のアイコンをクリックし、クリックし、寸法 150 × 150 ピクセル (194.6 μ2) を持つ正方形を作成するイメージ ウィンドウでドラッグ (図 1A)。
注:投資収益率の獲得には興味、(b)、アリス (コントロール ROI) ではない、少なくとも 20 x 20 ピクセル (3.3 μ2)、蛍光の領域、(c) にも少なくとも 20 x 20 ピクセル (3.3 μ m no 蛍光 (背景 ROI) 少しの領域 (a)、アリスが含まれています2) (図 1A)。繰り返されるイメージングで発生する可能性の退色を制御できるので、獲得の投資収益率の投資収益率のコントロールを含めることが重要です。取得ここで定義されている ROI をスキャンする唯一の地域となります。繰り返しレーザー範囲スキャン投資収益率のみに制限する退色、投資収益率ではなく、たとえば、退色全体のセルまたは複数のセルと光電子増倍管 (検出器) で収集されたピクセルの数は数よりも大きくなります。ピクセルは、全体のセルまたは複数のセルをスキャンした後、PMT (検出器) で収集されます。 - セットアップ タイム シリーズあらゆる 30 s の取得ボタンをクリックし、時系列ボタン後に買収投資収益率が 35 倍にスキャンされること。時間シリーズのコントロールウィンドウでマニュアル シリーズがスタートボタンとマニュアル シリーズを停止] ボタンをクリックします。手動停止シリーズ] フィールドに35を入力、 Enterキーを押します、 30.0 秒サイクル遅延ボタン (図 2E) をクリックします。
- 投資収益率の獲得の 5 prebleach 画像を収集するスキャン数 5 後に、変質が発生するように、漂白剤コントロールを設定します。ブリーチ編集ボタン [取得] ボタンをクリックします。ブリーチ コントロールウィンドウで番号スキャン後ブリーチの横にある白い四角形をクリックします。スキャン番号] フィールドに5を入力し、enterキー (図 2F) 。
注:Prebleach と postbleach の画像は、同じ光学的深さで取得する必要があります。 - 円形状の漂白剤 10 ピクセルの直径を持つ ALIS 内で投資収益率を作成 (面積 0.8 μ m2=)。クリックしてを取得 |漂白剤を編集 |領域を定義する。ブリーチ領域ウィンドウでの円のアイコンをクリックします。10 ピクセルの直径の円を作成するイメージ ウィンドウでクリックしてドラッグ (面積 0.8 μ m2=) (図 2F)。
- イテレーションを300に設定します。ブリーチ編集ボタン [取得] ボタンをクリックします。ブリーチ コントロールウィンドウでイテレーション フィールドに300を入力し、enterキー (図 2F) 。
- 100% 電源 (8.6 A) アルゴン/2 514 nm レーザー ラインと漂白剤の中に 100% トランス ミッションを設定します。ブリーチ編集ボタン [取得] ボタンをクリックします。[ブリーチ コントロール] ウィンドウの左側に白い四角い箱514 nm。514 nm レーザー ラインの伝送 [%] フィールドに100を入力し、 Enterボタン (図 2F) を押します。
注:反復回数は、経験的に決定する必要があります。それは、蛍光体、漂白は、構造体のサイズとレーザーによって異なります。
- データ コレクション
- FRAP 実験を開始します。最初 5 prebleach 画像と最初の postbleach 画像を収集し、次の式に従って漂白剤深度を計算します。
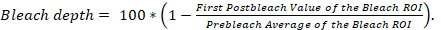
漂白剤の深さがある場合 < 90、実験を停止し、漂白剤の深さが十分でなかったとデータを破棄します。漂白剤の深さは、≥90 が、画像処理プログラム、スプレッドシート プログラム (材料表) の分析のためのデータを収集します。
注: ALIS のドリフトが 3 μ m と、実験を停止し、画像処理ソフトウェア (材料表) による解析によってこのイメージ ドリフト量を訂正できません、データを破棄します。ALIS のドリフトが < 3 μ m、画像処理プログラム、スプレッドシート プログラム (材料表) のデータ分析用のデータを収集します。 - ALIS のドリフトの未満 3 μ m 10 細胞から 10 ALIS から FRAP データを収集します。次に、データ解析のための個人のコンピューターに目的の .lsm ファイルを転送します。
- FRAP 実験を開始します。最初 5 prebleach 画像と最初の postbleach 画像を収集し、次の式に従って漂白剤深度を計算します。
- 画像処理プログラムでデータ分析
- 整列またはマッチングによる画像の (すなわち、登録) 取得の投資収益率の時系列画像のスタック。これを行うには、画像処理プログラム (材料表) の各目的の .lsm ファイルを開き、プラグインを選択 |登録 |StackReg |翻訳。次に、のプラグインを選択 |登録 |StackReg |剛体10。
- セットアップ ROI マネージャー ブリーチ ROI における信号強度を測定します。選択分析 |ツール |ROI マネージャー。楕円形ツールを選択し、10 ピクセルの直径を持つ漂白剤 ROI に円を描く追加] ボタンをクリックします。
- セットアップ ROI マネージャー コントロール ROI における信号強度を測定します。ROI マネージャーでは、四角形ツールを選択してコントロール ROI 領域で 20 x 20 ピクセルの四角形を描画し、追加ボタンをクリックします。
- セットアップ ROI マネージャー背景 ROI における信号強度を測定します。ROI マネージャーでは、四角形ツールを選択、背景 ROI 領域で 20 x 20 ピクセルの四角形を描画し、追加ボタンをクリックします。
- Roi の名前を変更します。ROI マネージャーで分析する・ ロワを追加すると、名前を変更ブリーチ ROI、コントロール ROI、および背景 ROIそれに応じて。
- Roi の測定信号強度。ブリーチの投資収益率、投資収益率制御、および背景 ROIを選択しよりを選択 |マルチ メジャー。すべての 35 のスライスを測定し、スライスごとに 1 行が選択されていることを確認します。測定の設定ウィンドウで、平均グレー値のみが選択されていることを確認します。
注:これらは、raw FRAP データ (図 1B)。 - 結果をスプレッドシート プログラム (材料表) に貼り付けます。ROI、漂白剤のコピー制御投資収益率、そして背景 ROI 信号強度結果ブリーチ投資収益率 ROI コントロール、および背景の投資収益率、それぞれ (材料表) のスプレッドシート プログラムでのラベル付きの列に貼り付けること。
- スプレッドシート プログラムでデータ分析
- 背景修正ブリーチ ROI における信号強度と制御 (図 1A、C) 投資収益率。(材料表) のスプレッドシート プログラムで関数の挿入ツールを使用して、ブリーチ ROIというラベルの付いた列の値からバック グラウンド ROIというラベルの付いた列の値を減算します。コントロール ROIというラベルの付いた列の値からバック グラウンド ROIというラベルの付いた列の値を減算します。これらの新しい列ブリーチ ROI の修正と修正制御 ROIのラベルを付けます。
- 漂白剤投資収益率 ROI (図 1A, D) コントロールでバック グラウンド補正された信号を信号を正規化します。修正制御 ROIというラベルの付いた列で値によってブリーチ ROI の修正というラベルの付いた列の数値を除算するのに関数 (材料表) のスプレッドシート プログラムでの挿入を使用します。この新しい列修正ブリーチ ROI の正規化にラベルを付けます。
- 投資収益率 (図 1A, E) 漂白剤の 5 prebleach 値の平均修正ブリーチ ROI の正規化された列の信号を正規化します。漂白剤の投資収益率の 5 prebleach 値の平均を計算します。次に、漂白剤 ROI の 5 prebleach 値の平均によって修正ブリーチ ROI の正規化というラベルの付いた列の値を分割します。この新しい列の正規化を修正 Prebleach 平均ブリーチ ROIのラベルを付けます。
- モバイル率と合うカーブのデータからのリカバリの半分の時間
- 画像処理プログラム (資材表) を使用して正規化され訂正された漂白剤 ROI データを曲線にフィット。画像処理プログラム (材料表) の選択分析 |ツール |カーブ フィット。コピー、postbleach 正規化し、漂白剤 ROI 値および対応する時刻の値を修正し、曲線フィッターのウィンドウに貼り付け。曲線フィッターのドロップ ダウン メニューから指数の回復に合わせて選択します。
- パラメーターの値を提供する回復機能から Mfを計算します: 'を ' ゆっくり回復端数'b' 回収率;'c' 急速に拡散率。方程式 Mfに ' c'、'の値を差し込むことで計算 Mf =、+ c. 計算 Ifの方程式を使って私f 1 - Mf=。式に 'b' の値を代入して t½を計算
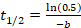 t1/2を解きます。11
t1/2を解きます。11
結果
3-5 h12RAW264.7 細胞の lps の ALIS の p62 の可動性を調べる FRAP を用いた典型的な実験の結果は、ここに示します。図 3Aは、漂白剤から得られる生データを制御して背景画像のスタックは、少量を補正するため配置されたいた後の投資収益率を示しています (< 〜 3 μ m)、アリスの画像ドリフトの。図 3Eと補足のビデオ 1に prebleach と postbleach でこのアリスに YFP p62 蛍光を示します。図 3Bは、バック グラウンド補正後、これらのデータを示しています。図 3Cは、投資収益率のコントロールで蛍光を補正した後これらのデータを示しています。図 3Dは、漂白剤の投資収益率の 5 prebleach 値の平均蛍光に正規化されたこれらのデータを示しています。漂白の度合いはこの実験で十分だった (深さをブリーチ 91.94 を =)。このアリス内 p62 YFP の蛍光回復ゆっくりと、t1/2 = 128.27 s (2.14 分)。YFP p62 ではなかったこの実験では、非常に携帯電話の蛋白質として Mf = 21.97 とf = 78.03。
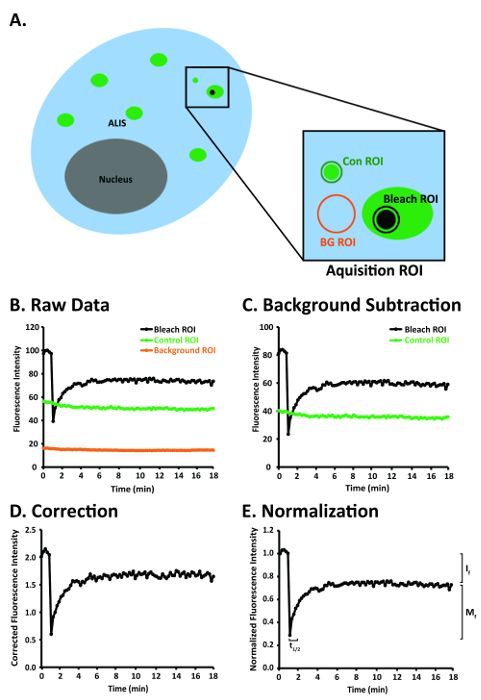
図 1: RAW264.7 細胞と FRAP 画像は、アリスの画像ドリフトを補正するため配置されている後の画像解析の手順の図。(A) いくつかのアリスと漂白剤、制御、および買収 ROI 内背景・ ロワを描いた RAW264.7 細胞の図。(B) 生 FRAP の理想的にされた描写データは、漂白剤、コントロール パネル (C) A の背景・ ロワ背景修正されている生の FRAP データの理想化されたグラフを取得しました。(D) 制御 ROI で蛍光正規化されているバック グラウンド補正の FRAP データの理想化されたグラフ。Prebleach 蛍光漂白剤 ROI に正規化されている正規化と背景修正の FRAP のデータのグラフを (E) 理想的。略語: Con = 制御;BG バック グラウンドを =。この図は、Rabut、Ellenberg4から変更されました。この図の拡大版を表示するのにはここをクリックしてください。
図 2:レーザー選択目的ソフトウェア (材料表) のユーザー インターフェイスの画像ビーム パスの構成と FRAP 実験の画像集録パラメーター 。(A) レーザー アルゴン/2 レーザー ライン、出力、および使用される管電流を示す画面を制御します。(B) 構成制御ビームを示す画面分割と発光フィルター使用の設定。(C) スキャンは、画像の取得に使用される設定を表示する画面を制御します。(D) スキャンは、ピンホール、検出器ゲイン、増幅器のオフセット、アンプのゲイン、およびアルゴン/2 514 nm レーザー回線の転送の設定を表示する画面を制御します。(E) 時系列制御使用時間シリーズの設定を表示する画面。(F) 漂白剤、prebleach を示す画面を制御し、使用するパラメーターを postbleach します。略語: HFT = ハウプト ファーブ Teiler (プライマリ ダイクロイック ビーム分割);NT1 = Neben ファーブ Teiler 1 (最初二次二色性ビームスプリッター);NT2 = Neben ファーブ Teiler 2 (ダイクロイックばり第 2 分割);EF = 排出フィルター。この図の拡大版を表示するのにはここをクリックしてください。
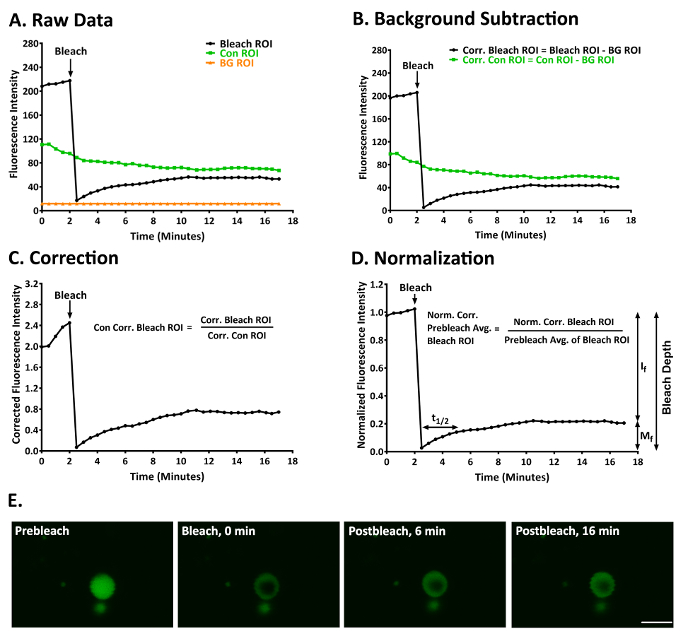
図 3: RAW264.7 細胞でアリスに YFP p62 の動態を勉強する代表的な FRAP 実験。漂白剤、制御、および投資収益率の背景の (A) 生蛍光強度データです。(B) 漂白剤とコントロール投資収益率 ROI の背景の蛍光性のため修正されていた後、パネル A で与えられたデータ。(C) 蛍光バック グラウンド補正コントロールの投資収益率のための口座に投資収益率漂白剤に蛍光強度の正規化後パネル A と B で与えられたデータ。(D) ブリーチ ROI の最初 5 prebleach 値の平均を正規化し、背景修正ブリーチ ROI の蛍光強度の正規化後パネル A ~ C で与えられたデータ。Mf = 21.97、私f 78.03、t1/2 = = 128.27 s (2.14 分) と漂白剤深さ = 91.94。(E) prebleach (1.5 分) と postbleach でアリスのイメージ (0、6、および 16 分)。スケール バー = 5 μ m とすべてのパネルです。略語: Con = 制御;BG = 背景;コアー = 訂正。規範。= 正規化されます。平均平均を =。この図はカベら12から変更されたこの図の拡大版を表示するのにはここをクリックしてください。

補助ビデオ 1: RAW264.7 マクロファージ前に、と退色後の典型的な ALIS 。P62 YFP の蛍光は photobleach; 後の回復に時間がかかるしたがって、p62 は非常に携帯電話のタンパク質ではありません。この実験は、Mf = 25.62、私f 74.38、t1/2 = = 442.79 s (7.38 分) と漂白剤の深さ = 90.19。スケール バー 5 μ m を =。このビデオから修正されたカベら12してくださいここをクリックしてこのビデオを表示します。(右クリックしてダウンロード)
ディスカッション
生きているセルと FRAP 実験の包括的な実用的なおよび簡単なステップバイ ステップのプロトコルを提供します。ここで、RAW264.7 マクロファージ ALIS で YFP p62 の移動度を測定するために使用された、プロトコルがレーザ共焦点顕微鏡システムの多くに適用されることができます、利用可能になりました蛍光タンパク質遺伝子をエンコードします。あらゆる顕微鏡システムのパイロット実験は退色と prebleach と postbleach の画像の獲得のための取得、漂白剤、および、コントロール ROI サイズのレーザー強度を含む最適な FRAP パラメーターを決定するため重要です。各遺伝子にエンコードされた蛍光タンパク質と細胞ラインのために異なる最適な FRAP パラメーターを期待するは無理です。
(A) 適切な達成を含める FRAP 実験を行なうとき考慮すべき重要な要因はブリーチ深さ、(b) 簡単な漂白のステップ、完全復旧機能、(d) 光効率を観察する (c) できるように十分な時間 postbleach の使用 (e)。細胞毒性と繰り返し FRAP、(f) 繰り返しイメージングによる蛍光の損失のためのコントロールを含めることです。セクション 3.3.1 で提供される同等化に従って計算することができます、漂白剤深さ ≥9013であることをお勧めします。漂白剤の深さが < 90、postbleach 蛍光回復の程度を過小評価することと値 i Mf、ft1/2不正確になります。FRAP 実験の期間と漂白剤誘導レーザー パルスの強度はさまざまフォトブリーチング ステップする簡潔な蛍光の回復機能よりもかなり速いことが重要です。それはない、漂白の段階の蛍光回復のかなりの量が起こります。時間が長い漂白剤の漂白の段階の蛍光回復ない測定されると私の不正確な測定につながるfMf、およびt1/2。さらに、fMf、私の正しい値を取得してt1/2、投資収益率の獲得を守らなければなりません postbleach ROI 漂白剤に蛍光レベルが高原に達するまで。たとえば、FRAP 実験ではなかった間違い Mf、ft1/2値 32.2 分ブリーチ投資収益率 ROI 漂白剤で YFP p62 を見ましたとき対 postbleach YFP p62 蛍光観測したときの15.1 分 postbleach;したがって、我々 は回復機能 15.1 分 postbleach12のプラトーに達したことを締結しました。フォトブリーチング効率に関してフォトブリーチング光学ズーム係数14の正方形と増加します。したがって、高光学ズーム レンズの使用は急速な退色のために好ましいが、望ましくないフォトブリーチング取得中に発生することができます。後者把握できるイメージ コントロール ROI によって。繰り返し退色は細胞毒性活性酸素種 (ROS) の生成することになるために避けられることです。しかし、高強度レーザー照射による活性酸素生成の度合いが低い化学発光する蛍光剤 (蛍光抗体など)15日より遺伝的コード化蛍光蛋白質と生成された ROS は反応する可能性が高い蛋白質の内で遺伝的コード化蛍光よりもセル4の他の分子と。細胞傷害性 ROS の生成の増加の確率に加えて繰り返し退色はコントロールすることは困難であるに避けられることです。最後に、低レーザー伝送はブリーチ以外のすべての画像を取得する使用されますが、いくつかの退色が必ず発生するを制御する必要があります。このため可能なコントロール監視など買収 ROI 内のコントロール ROI で蛍光、隣接無漂白セルにコントロールのイメージを取得で使用される同一の設定と制御実験を行うこと、退色実験なく退色イベント。
開示事項
著者はある利益相反を開示します。
謝辞
この原稿の彼の貴重なコメント、ロヨラ大学シカゴ校で博士セス Robia に感謝しますこの作品は、NIH グラント 1R01NS073967 01A1 ジョアンナ C. Bakowska にによって支えられました。
資料
| Name | Company | Catalog Number | Comments |
| Dulbecco's Modified Eagle Medium | Hyclone | SH30022.01 | High Glucose (4.5 g/L) |
| Fetal bovine serum | Gemini Bio-Products | 100-106 | |
| Glass bottom dishes | MatTek | P35G-1.5-14-C | 35 mm |
| ImageJ software | National Institutes of Health | N.A. | |
| Lipopolysaccharide (LPS) | Sigma | L4391 | |
| Nocodazole | Sigma | M1404 | |
| Penicillin-streptomycin solution | Corning | 30-002-Cl | 100× |
| Plan-Apochromat 63×/1.40 Oil objective | Carl Zeiss MicroImaging, Inc | 4407629904000000 | |
| Polyethylenimine (PEI) | Polysciences | 23966-1 | linear (MW 25,000) |
| RAW 264.7 murine macrophages | ATCC | TIB-71 | |
| Zeiss confocal microscope | Carl Zeiss MicroImaging, Inc | LSM 510 |
参考文献
- Axelrod, D., Koppel, D. E., Schlessinger, J., Elson, E., Webb, W. W. Mobility measurement by analysis of fluorescence photobleaching recovery kinetics. Biophysical Journal. 16 (9), 1055-1069 (1976).
- Peters, R., Peters, J., Tews, K. H., Bahr, W. A microfluorimetric study of translational diffusion in erythrocyte membranes. Biochimica et Biophysica Acta. 367 (3), 282-294 (1974).
- Patterson, G., Day, R. N., Piston, D. Fluorescent protein spectra. Journal of Cell Science. 114, 837-838 (2001).
- Rabut, G., Ellenberg, J. Photobleaching techniques to study mobility and molecular dynamics of proteins in live cells: FRAP, iFRAP, and FLIP. Live Cell Imaging: A Laboratory Manual (1st ed). , 101-126 (2004).
- Fritzsche, M., Charras, G. Dissecting protein reaction dynamics in living cells by fluorescence recovery after photobleaching. Nature Protocols. 10 (5), 660-680 (2015).
- Goodwin, J. S., Kentworthy, A. K. Photobleaching approaches to investigate diffusional mobility and trafficking of Ras in living cells. Methods. 37 (2), 154-164 (2005).
- Hildick, K. L., Gonzàlez-Gonzàlez, I. M., Jaskolski, F., Henley, J. M. Lateral diffusion and exocytosis of membrane proteins in cultured neurons assessed using fluorescence recovery and fluorescence-loss photobleaching. Journal of Visualized Experiments. (60), e3747 (2012).
- Nissim-Rafinia, M., Meshorer, E. Photobleaching assays (FRAP & FLIP) to measure chromatin protein dynamics in living embryonic stem cells. Journal of Visualized Experiments. (52), e2696 (2011).
- Zheng, C., Petralia, R. S., Wang, Y., Kachar, B. Fluorescence recovery after photobleaching (FRAP) of fluorescence tagged proteins in dendritic spines of cultured hippocampal neurons. Journal of Visualized Experiments. (50), e2568 (2011).
- Thevenaz, P., Ruttimann, U. E., Unser, M. A pyramid approach to subpixel registration based on intensity. IEEE Transactions on Image Processing. 7 (1), 27-41 (1998).
- Ishikawa-Ankerhold, H. C., Ankerhold, R., Drummen, G. P. Advanced fluorescence microscopy techniques--FRAP, FLIP, FLAP, FRET and FLIM. Molecules. 17 (4), 4047-4132 (2012).
- Cabe, M., Rademacher, D. J., Karlsson, A. B., Cherukuri, S., Bakowska, J. C. PB1 and UBA domains of p62 are essential for aggresome-like induced structure formation. Biochemical and Biophysical Research Communications. 503 (4), 2306-2311 (2018).
- Brown, E. B., Wu, E. S., Zipfel, W., Webb, W. W. Measurement of molecular diffusion in solution by multiphoton fluorescence photobleaching recovery. Biophysical Journal. 77 (5), 2837-2849 (1999).
- Centonze, V., Pawley, J. Tutorial on practical confocal microscopy and the use of the confocal test specimen. Handbook of biological confocal microscopy. , 549-570 (1995).
- Chudakov, D. M., Matz, M. V., Lukyanov, S., Lukyanov, K. A. Fluorescent proteins and their applications in imaging living cells and tissues. Physiological Reviews. 90 (3), 1103-1163 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved