Method Article
多発性硬化症の個人のための包括的な解剖プログラム
* これらの著者は同等に貢献しました
要約
多発性硬化症は、治療法のない炎症性脱筋膜疾患である。脳組織の分析は、疾患の病因を理解するための重要な手がかりを提供します。ここでは、クリーブランドクリニックで動作するユニークな迅速な解剖プログラムを通じて収集されたMS脳組織の方法論と下流分析について説明します。
要約
多発性硬化症(MS)を持つ個人のための迅速な組織寄付プログラムについて説明し、科学者や技術者が24/7、365日オンコールする必要があります。参加者は、脳と脊髄を寄付することに同意します。ほとんどの患者は、MS治療と研究のためのクリーブランドクリニックメレンセンターで神経科医が続きました.彼らの臨床コースと神経学的障害はよく特徴付けられています。死後まもなく、身体はMSイメージングセンターに搬送され、そこで脳は3T磁気共鳴イメージング(MRI)によってその場でスキャンされる。その後、遺体は解剖室に移され、そこで脳と脊髄が取り除かれる。脳は2つの半球に分かれています。1つの半球はすぐにスライスボックスに入れられ、代替1cm厚のスライスは2日間4%のパラホルムアルデヒドで固定されるか、またはドライアイスと2-メチルブタンで急速に凍結される。短い固定された脳のスライスは凍結保存液に貯え、敏感な抗原の組織学的分析および免疫細胞化学的検出のために使用される。冷凍スライスは-80°Cで保存され、分子、免疫細胞化学、およびその現場のハイブリダイゼーション/RNAスコープ研究に使用されます。他の半球は、数ヶ月間4%のパラホルムアルデヒドに入れられ、スライスボックスに入れ、3 T磁気共鳴(MR)スキャナで再スキャンし、センチメートル厚いスライスにスライスします。その現場での死後MR画像(MRI)は、MRI病理相関を促進するために1cm厚の脳スライスと共登録される。すべての脳スライスが撮影され、脳白物質病変が同定される。脊髄は2cmの区分に切断される。代替セグメントは、4%パラホルムアルデヒドまたは急速に凍結して固定される。死後MS組織の迅速な調達により、MS脳と脊髄の病理学的および分子的解析と脳MRI異常の病理学的相関が可能になります。これらの急速に処理された死後組織の品質(通常死亡の6時間以内)は、MS研究にとって大きな価値があり、多くのインパクトの強い発見をもたらしています。
概要
病気を研究する最良の方法の一つは、病気の組織自体を調べることです。これは、中枢神経系(CNS)の疾患を研究する人々に課題を提示します。病気の脳と脊髄の生検は非常にまれであり、通常は非定型症例を伴う。CNS疾患を有する個人の解剖率は近年劇的に減少しており、行われると、しばしば組織の迅速な調達を提供しない。これらの課題は、多発性硬化症(MS)を有する個人からの組織の採取に焦点を当てたいくつかの疾患中心の脳バンクの確立をもたらした。MSは、ミエリン、オリゴデンドロサイト(ミエリン形成細胞)、ニューロン、および軸母を破壊するCNSの炎症媒介性疾患である。MS患者の大半は、可変回復を伴う神経障害の発作から始まる双ファシス病コースを有し、最終的には自然界で神経変性である可能性が高い徐々に進行性の疾患に進化する。寄付されたMS脳の大半では、死後の間隔(PMI)が24時間を超える。これらの組織は、MS脳の病理学的変化に関する貴重な情報を提供しているが、それらは病気の病態生理学に強力な洞察を提供することができるより高度な分子研究には適していない。これは、無傷のRNAを必要とする遺伝子プロファイリング研究の場合に特に当てはまる。
上記の限界を克服するために、MRI/病理学的相関を可能にする迅速な組織寄付プログラムを開発しました。このプロトコルは、現代の分子研究に適したよく保存された組織を提供し、MS脳の脳病理とMRI異常の直接比較を可能にします。クリーブランドクリニック多発性硬化症組織寄付プログラムは、20年以上にわたり存在しています。この急速な組織の寄付プログラムはMSおよび他の関連する自己免疫神経学的条件を持つ個人から脳および脊髄を調達する。このプログラムは、死後6時間以内にMRIで取得し、その後、組織処理のための脳と脊髄の除去を目指す。
募集
寄付は、患者(事前同意)から直接得られる、または死後の親族の次から得られるアンテモーテムの同意のいずれかを通じて得られます。同意前の患者は、通常、オハイオ州クリーブランドの多発性硬化症治療研究センターの臨床集団から同定される。迅速な組織寄付プログラムにおける募集の好みは、縦方向の研究に従った患者に与えられるが、それは中心で見られるすべての患者に開かれている。死亡前に登録した参加者には、死亡時または死亡が差し迫っていると思われる場合に、家族または介護事業者に調査チームに連絡するよう指示されます。組織寄付プログラムに入る個人のための第二の方法は、近親者の同意を通じて死亡時です。オハイオ州は、オハイオ州北東部の20郡で活動するLifeBancという連邦政府の義務付けられた臓器調達組織に対して、死亡を義務付けています。LifeBancは、臓器提供の除外であるMSの診断のためにすべての死亡をスクリーンします。ライフバンクは、クリーブランド・クリニックから半径75マイル以内で発生したMSの関連診断を伴うすべての死亡に関して、MS組織寄付プログラムから調査官に通知する手配を行いました。次に、親族と病院のスタッフが組織寄付プログラムスタッフから連絡を受け、脳および脊髄組織の寄付に同意を得ます。LifeBancを通じて、これらの2つの募集のアンテモーテムと死後の方法は、年間約10-12の脳の寄付をもたらす。LifeBancから派生した紹介の数を管理するために、死亡の上限年齢制限に調整が行われます。
寄付金の調達
このプログラムでは、組織調達のための組織寄付プログラムのメンバーによる24時間のカバレッジ、365日が必要です。一元的な組織寄付通知電子メール/ポケットベル/モバイルデバイスのテキスト通知システムは、組織の寄付をカバーする臨床チームによって使用されます。LifeBancは、組織寄付プログラムのオンコール担当者に連絡するための番号を提供しています。メンバーは、病院の提供者/近親者(事前に同意)またはLifeBancおよびその他の紹介元によって死亡を通知されます。まず、死亡時刻と組織寄付の実現可能性の判定がなされる。その後、死亡は、長期死後低酸素症、大規模な破壊的な脳組織(例えば、大脳頭蓋内出血、広範な二半球脳卒中、広範な腫瘍)を含む、質の悪い組織をもたらす可能性のある条件についてスクリーニングされる。負担)、長時間の人工呼吸器サポート(>3日)、および血管活性剤の長期使用(>3日前)。医療検査官が死亡に関与する場合、研究神経科医は、医療検査官の責任を損なうことなく、タイムリーな組織を受け取る方法を模索するために、医師と話すことができます。生存可能な組織が存在すると感じられる場合は、書面による同意が得られ(死後前に得られなかった場合)、身体輸送のための準備がなされる。その後、以前に契約した受託輸送サービスに連絡して、クリーブランド・クリニックのMRI施設への輸送を行います。体温がMRI信号特性の変化に関連しているので、体が室温のままで、冷蔵庫に入れられていないように注意が必要です。
臨床履歴
臨床履歴には、MSの診断、症状の発症、使用される治療、臨床および準臨床検査の結果(誘発電位、脳脊髄液の結果、光学コヘレンス断層撮影)、多発性硬化症機能複合材料の詳細が含まれます。、医療記録(利用可能な場合)から収集される障害者ステータススケール(EDSS;実際または推定)、および近親者の次の直接面接を拡大した。死後MRIも採取されます。
プロトコル
このプロトコルは、クリーブランドクリニック機関レビュー委員会によって承認されており、クリーブランドクリニック人間研究倫理委員会のガイドラインに従っています。
1. インシトゥMRI
- ドナー本体をMRIスイートに持ち込み、MSイメージングファシリティーで2時間のMRIイメージングプロトコルを行います。3Tまたは7TイメージャーでMRIを行います。
注:レガシーデータの大部分は3Tで実行されているが、利用できない場合は7Tでイメージングが行われるため、優先度は3Tに与えられる。指定されたコア配列は、すべての症例(表1)に対して実行され、時間が許す限り(死後12時間未満の組織固定を達成することによって制約される)、現在の研究の利益に依存する追加の配列が実行される。表 1にコア シーケンスについて説明します。
2. 解剖
注:その場でMRIに続いて、体は、実験室のメンバーによるダイナーおよび組織処理によって脳および脊髄抽出のための死体安置所に運ばれる。
- 遺体が安置所に到着する前に、次の手順を実行します。2時間前に、4%パラホルムアルデヒド(PFA)の3Lを調作し、組織貯蔵用の容器および袋を標識する。8%PFAの3Lを調作し、8%PFAの1.5Lを4%PFAに希釈する。残りの8%のPFAを2日目の4°Cに置きます。
- 安置所に移動する前に、ドライアイス(大きなブロックがフィットし、小さなペレット)で50%の容量に2つの走行クーラーを埋めます。
- 遺体安置所では、ステンレス製の容器を2メチルブタンとドライアイスで半分に充填し、組織を凍結する準備のために蓋で覆います。
- 一度ダイナーによって取り除かれた脳の重量を量り、写真を撮る。
- PFAで満たされた容器に付属のデュラを置きます。
- 小脳と脳幹を大脳から分離し、大脳を撮影します。
- プローブとピンセットを使用して、視神経、キアズム、および管を識別し、分離します。メスで構造を切除します。
注:視神経の片側の遠位セグメントは、識別のためにヒギンズインクを使用してマークされます。 - 大脳半球を縦方向に分離し、各半球を個別に撮影します。
- 左半球の一次運動皮質(PMC)をインクで塗り、再撮影し、3.3Lコンテナに入って長い固定します。脳固定の開始時刻を文書化します。
- 右半球のPMCは、インクまたは取除物されてもよい。
- 摘出される場合は、まずカバー付けの髄膜を取り除く。
- インクまたは取り除かれた PMC を再撮影します。
- PMCを切除する場合は、同じサイズのセクションを6つに切ります。
- 各セクションのロストラル面をインクします。
- 短い固定のために PFA で満たされたコンテナーに奇数のセクションを配置します。
- 偶数のセクションをスナップフリーズし、密封された冷凍袋に入れてクーラー#1。
- 右半球の前部を1cmの厚さの冠状の切片に切る。
- 重大な異常(例えば、切削アーティファクト、出血、病変)を文書化する。
- 短い固定のために PFA で満たされたコンテナーに奇数のセクションを配置します。
- スナップフリーズ偶数のセクションと密封された冷凍袋に置きます。
- 脳固定時間の文書化終了.
- 脳幹を小脳から分離し、短い固定のためにPFAで満たされた容器に入れる。
- 小脳半球を縦方向に分離します。
- 各半球を4つの等しく厚い矢状のセクションに切ります。
- 写真の中間と横のビュー。
- 短い固定のためにPFAで満たされた容器に左小脳半球のスライスを置きます。
- 右小脳半球のスライスをスナップ凍結し、密封された冷凍袋に入れて、より涼しい#1に置きます。
- ジエナーから神経根を持つ脊髄を得る。
- 脊髄デュラ母母を取り除き、PFAを含む容器にデュラを保存します。
- 左右の前部と後部神経の根を分離します。脊髄から切り取られた左前部および後神経根を切り取り、短い固定のためにPFA充填容器に入れる。
- 脊髄から右前神経根を切り取り、スナップフリーズし、密閉された冷凍袋に入れ、より涼しい#2に入れます。
- 脊髄の最も20センチメートルの最も高い写真。腰部拡大の位置を文書化します。
- コードの2cm横のセクションを、角から骨に切り取ります。
- 各カットセクションのrostralの側面をインクします。
- 短い固定のために PFA で満たされたコンテナーに奇数のセクションを配置します。
- スナップフリーズ偶数部、密封された冷凍袋に入れ、クーラー#2に入れます。
- 脊髄固定の開始時刻と重大な異常を文書化します。
- 脊髄の残りのrostral部分を撮影します。
- 頸部拡大の位置を文書化します。残りの脊髄については、手順 2.13.5 ~ 2.13.8 に従ってください。
- 死体に続いて、-80°C冷凍庫の標識された箱に冷凍組織を置きます。固定組織を4°Cに保存します。
- 24時間の解剖後(2日目)で、残りの8%のPFAを4%に希釈する。
- 固定容器の4%PFAを新たに希釈した4%PFAに置き換えます。
- 60 h解剖後の溶液でグルタルアルデヒド、PFA、PFA、dH2Oおよびソレンソンのバッファーから4%PFAで2.5%グルタルアルデヒドの溶液を調製(順番に混合して調製:0.2 Mリン酸バッファーpH 7.4、ポリビニルピロリドン1%w/v、スクロース30%w/v、およびe30% v/v)。
- 使用した4%PFAを短い固定容器から取り外します。
- ソレンソンの緩衝液中の組織をすすいで、凍結保護溶液(グリセロール20%、0.4Mソレンソンの緩衝液20%、およびdH2 Oで0.02%のアジドナトリウム)に入れなさい。
- 写真短い固定脳スライス、小脳、脳幹および運動皮質(該当する場合)。
- メスブレードを使用すると、各2cmの短い固定脊髄セクションから2mmの厚い横のセクションを切断します。
- 2 mLシンチレーションバイアルにセクションを配置し、4%PFAで2.5%グルタルアルデヒドの溶液で充填します。
- 残りのセクションを元の 20 mL シンチレーション バイアルに戻します。ソレンソンのバッファでセクションをすすいで、凍結保護ソリューションに置き換えます。
3. 病理学
注:右半球の短い固定スライスと長い固定左半球(数ヶ月間4%のPFAに配置)は、30 μmセクション(フリーフローティングと呼ばれる)に切断されるか、パラフィンに埋め込まれ、12~14 μmセクション(と呼ばれる)として切断されます。パラフィン埋め込み)。これらのセクションは、通常、ジアミノベンジジン(DAB)法を用いた免疫活性のための脱筋脱筋化病変および主要組織適合性複合体II(MHC-II)を検出するためのプロテオリピッドタンパク質(PLP)で処理される。これらのプロトコルは標準化され、いくつかの出版物2、3、4、5、6、7、8、9で使用されています,10歳,11歳,12.
-
フリーフローティング(30 μm)DAB-アビジンビオチン複合体(ABC)組織染色
- 凍結貯蔵液から切片を取り出し、セクションを6ウェルプレートに移し、1xリン酸緩衝生理食生の2mLでそれぞれ3倍5分間洗浄する。6ウェルプレートで次の井戸に移す場合は、組織を引き裂かないように注意してください。各洗浄およびインキュベーションステップの間に、6ウェルプレートをシェーカーの上に置き、組織が穏やかに振れるようにします。
注:より小さな体積およびより大きなプレート(すなわち、12-および24ウェルプレート)でインキュベートされた組織切片は、表面およびエッジの引裂を示す傾向がある。 - 約30mLの10mMク硝酸バッファー(pH 6.0)を含むガラスビーカー内のマイクロウェーブ断面で抗原検索を行う。2~3分間、またはク硝子バッファーが沸騰し始めるまで、ペイントブラシとマイクロ波セクションで操作してティッシュが折りたたまれないようにしてください。断面を室温(約20分)まで冷却します。
- セクションを6ウェルプレートに戻し、PBS/0.3%トリトンX-100の2 mLでそれぞれ5分間セクションを3倍に洗浄します。内因性ペルオキシダーゼを2mLの2mLでインキュベートして3%H2 O2/0.3%トリトンX-100/PBSを室温(RT)で30分間ブロックする。
- PBS/0.3%トリトンX-100の2 mLでそれぞれ5分間セクション3xを洗浄します。3%正常ヤギ血清/0.3%トリトンX-100/1x PBSの2 mLのブロックセクションをRTで1時間。
- ミクログリアおよびミエリンエピトープに対して一次抗体で一晩5日間(抗体に応じて)セクションをインキュベートし、炎症(MHCII)および脱髄形成(PLP)を検出する(材料の表を参照)4°Cで検出する。
注:このステップまたは後続のステップでインキュベーションを行う際にセクションが折りたたまれないようにします。 - 1x PBSの2 mLでそれぞれ5分間セクション3xを洗浄します。次に、二次ビオチン化抗体の切片(材料表を参照)をRTで1時間インキュベートし、次の洗浄工程の約45分前にアビジンビオチン複合体(ABC)溶液を準備し、ABC複合体が形成できるようにします。
- 1x PBSの2 mLでそれぞれ5分間セクション3xを洗浄します。その後、RTで1時間ABCのセクションをインキュベートします。
- 1x PBSの2mLでセクションを5分間3回洗浄します。H2O 2(DABでは30%H2O2の1:500希釈)を含む濾過されたDAB(2mL/ウェル/セクション)の切片を、色が十分に発達するまで(〜3〜8分)インキュベートします。
- 1x PBSの2 mLでそれぞれ5分間セクション3xを洗浄します。信号を増強するために(任意)、0.04%OsO 4(〜30s)を使用してオスマイトする。
- セクションを1x PBSでそれぞれ5分間3回洗浄します。個別に、各セクションを6ウェルプレートから1x PBSの完全な小さな容器に移し、可能な限り平らにガラススライド上のティッシュセクションを配置します。
- ティッシュセクションが可能な限り平らであることを保ちながら、PBSからスライドをゆっくりと持ち上げます。2枚のペイントブラシを使用して、スライド上のティッシュを静かに平らにして伸ばし、余分な水をペーパータオルで取り除きます。グリセロール(または同等の取り付け媒体)で組織セクションをマウントし、明確なマニキュアでカバースリップをシールします。
- 凍結貯蔵液から切片を取り出し、セクションを6ウェルプレートに移し、1xリン酸緩衝生理食生の2mLでそれぞれ3倍5分間洗浄する。6ウェルプレートで次の井戸に移す場合は、組織を引き裂かないように注意してください。各洗浄およびインキュベーションステップの間に、6ウェルプレートをシェーカーの上に置き、組織が穏やかに振れるようにします。
4. パラフィン埋め込み半球部:DAB染色
- 60°Cのオーブンでスライドからパラフィンを5〜10分間溶かします。
- キシレン3xでそれぞれ5分間インキュベートすることにより、切片を脱パラフィン化する。
- 100%(それぞれ5分間2倍)、95%(5分間2倍)、70%(それぞれ5分間2倍)、および50%(それぞれ5分間に1x)で組織を再水和する。PBS のカバー スライド。
- 抗原は、10mMク硝酸バッファー(pH 6.0)のビーカー内のマイクロウェーブスライドによって取得する。
- 室温に一度冷却した1x PBS(各5分間3x)でスライドを洗います。組織を3%H2 O2/1%トリトン-X100/PBSで30分間インキュベートして内因性ペルオキシダーゼをブロックします。
- 1x PBSでティッシュを3回5分間洗浄する。PBSで6%正常なヤギ血清を1時間ブロックする。
- 一次抗体の切片を室温(RT)で一晩(最大20時間)のPBSでインキュベートします(材料の表を参照)。
- セクションを1x PBSでそれぞれ5分間3x洗浄します。次いで、RTで1時間PBSで対応する二次抗体の切片(材料の表を参照)をインキュベートします。
- インキュベーション中に次の洗浄工程の約45分前にABC溶液を準備する。
- セクションを1x PBSでそれぞれ5分間3x洗浄し、RTで1時間ABCでインキュベートします。
- セクション3xを1x PBSでそれぞれ5分間洗浄します。
- 色が十分に発達するまで、H2 O2を含むDAB(0.45 μmフィルター細孔サイズ)の断面をインキュベートします(約3-8分)。
- 1x PBSでセクション(3x 5分)を洗浄します。信号を増強するために、0.04%の一石体(OsO4;約30s)を使用してオスミケートする。
- 1x PBSでセクション(3x 5分)を洗浄します。
- エタノール50%(1x 5分)、70%(1x 5分)、95%(2x 5分)、100%(2x5分)、および100%キシレン(1x 5分)の等級シリーズで組織を脱水します。キシレンが蒸発するのを許可します。
- トルエンベースの急速な乾燥土台媒体が付いているセクションを取付ける。抗酸化物質を含む製剤は、汚れ漂白を防ぐために推奨されます。後続のストレージ用にカミソリを付けてスライドエッジから余分な取り付けメディアを取り外します。
5. MRI/病理学の相関関係
注:MRIと病理との相関関係については、まず、スライススロットを示すMRI可視マーカーを持つ調節可能なボックスで、長く固定された無傷の脳半球(上のステップ2.9)のex vivo MRIを実行します。次に、脳をスライスし、1cmのスライスを撮影し、個々の脳スライスに対するその中のMRIの共登録を可能にする。その後、MRI誘導解析を行い、MRI上で対象領域(ROI)を特定して組織分析を指示します。また、組織上でROIが同定される組織病理学誘導解析(例えば、白色物質病変、脱髄のない白色物質など)を行い、共局所的なMRI測定によって特徴付けることもできます(表1)。
-
MRIベースのROIの同定
注:以前の研究では、白色物質11、12、13、14、15および灰色物質16、17、およびROIを同定した。18.以下の例は白色物質分析用です。- セグメントT2の超強烈な病変をオンにした(ステップ1.1から)、最初は自動アルゴリズムによって処理され、その後、経験豊富なユーザーによって手動で修正された。
- T2病変中のセグメントT1低強度病変は、周囲の正常に現れる脳組織のシグナル強度の80%以下の信号強度を持つボクセルとして。
- 磁化伝達率(MTR)マップのセグメント低圧領域は、しきい値の 80% です。
- 上記のセグメンテーションを使用して 3 つの分類を作成します: (a) T2 重み付け/FLAIR スキャンでは異常であるが、T1 重み付けまたは MTR スキャンでは正常である T2T1MTR 病変、(b) T2T1MTR 病変は、すべての T2 重み付け/FLAIR、T1 重み付け、および MTR スキャンで異常です。(c) 正常に現れる白色物質 (NAWM) は、すべての T2 加重/フレア、T1 加重、および MTR スキャンで正常です。
注:スライスの選択は、同じスライス上の 3 つの関心領域タイプ(T2 のみ、T2T1MTR、および NAWM)の存在に基づいています。 - 異なる脳と異なる脳の位置から生じる変動を最小限に抑えるために、各ROIの正規化された強度を計算します。
-
脳スライスへのオンシチュMRIの共同登録
- カスタムスライスボックス内の固定脳半球をスキャンし、脳をスライスするためにナイフを挿入できるスロットをローカライズするMRIに敏感なマーカーの4行を持ちます。固定脳とすべてのマーカーをカバーする 1 mm 等方性解像度で T1 加重 3D MPRAGE 取得を実行します。
注:これは、ポスト固定MRIと呼ばれ、脳スライスにその中のMRIの共同登録のための中間ステップとしてのみ使用されます。 - スキャン直後に、1cm離れたスロットで脳半球をスライスし、約15枚のスライスを生み出します。
- 前側と後側の両方の脳のスライスを撮影します。
- 次の手順で、その現場のMRIと脳スライスの写真を共同登録します。
- ポストフィックスのセグメンテーションとオンシチュ MPRAGE では、ポストフィックスと強度不均一性19のオンシチュ MPRAGE MRI の両方を前処理します。
- 前処理後固定MPRAGEから脳とマーカーの4行をセグメント化します。
- 固定後MRI20,21に対応する半球を現場MPRAGEで前処理からセグメント化する。
- FSL FLIRT22を使用して、最大12度の自由度(アフィン登録)までの一連の線形登録プロセスを通じて、その中で脳抽出および固定後MRIを共登録する。スケーリングおよびせん断コンポーネントは、固定収縮の影響を説明します。
- セグメント化されたマーカーを使用して最大投影強度の合計を最小化して、スライス平面の法線方向を見つけます。これらの再方向角度は、前のステップから得られた変換行列に組み込まれます。
- MRI画像を、通常のベクトルの深さと向きを変えることを可能にする社内画像ビューアを使用して、固定後脳スライスの写真と視覚的に一致させます。脳のスライスが不完全であるため、小さな変更が必要です。
- 各スライスにAFFINE画像変換13を適用し、その場のMRIを脳スライスの写真と同じスライス位置に変換します。
- ポストフィックスのセグメンテーションとオンシチュ MPRAGE では、ポストフィックスと強度不均一性19のオンシチュ MPRAGE MRI の両方を前処理します。
- カスタムスライスボックス内の固定脳半球をスキャンし、脳をスライスするためにナイフを挿入できるスロットをローカライズするMRIに敏感なマーカーの4行を持ちます。固定脳とすべてのマーカーをカバーする 1 mm 等方性解像度で T1 加重 3D MPRAGE 取得を実行します。
結果
前述のように、大脳半球のほぼ半分が凍結され、DNA、RNA、またはタンパク質を使用した分子研究に利用できます。歴史的に、死後の脳組織を用いた研究は、死後の状態、年齢、性別、組織pH、mRNA完全性(RIN)、死後間隔(PMI)、診断確実性、併存物質の使用、および以前の薬物治療の影響を受けることが示されている。ステータス23.脳組織を用した研究に基づいて、DNAとタンパク質はRNAと比較してより少ない程度の影響を受けるようです。しかし、我々の経験に基づいて、RNAの単離と下流分析は、脳組織の死後の状態と死後間隔によって最も影響を受けることがわかった。そこで、死後MS組織を用いたRNAベースの分析を行うために従う条件のいくつかについて議論する。
すべての研究のために、脳が解剖で収集された後、それはスライス(1センチメートルの厚さ)、その後、形態学的研究のために4%のパラホルムアルデヒドで固定されるか、または生化学的分析のために急速に凍結されます。すべての組織ブロックは、上述したようにPLPを用いた免疫染色による脱髄のために特徴付けされる。代表的な分析スキームを図 1に示します。組織切片は、白色物質病変の存在について調べられる(図1A)。選択された領域は、免疫活性(図1B)および脱髄(図1C)のために染色される。凍結組織はクライオスタット(図1D)に取り付けられ、凍結された30μmのセクションが切断される。これに続いて、3〜4の後続のセクションの収集、隣接する組織からの分離、およびDNA、RNA、またはタンパク質単離のための貯蔵が続きます。このプロトコルを使用して、我々は正常にDNA24、25、 RNA5、6、7、 8、9 だけでなくタンパク質26を単離しました。MS脳からRNAを分析するいくつかの研究から主要な知見が議論されていますが、ここではRNA死後MS脳の分析に関連する問題のいくつかを示します。
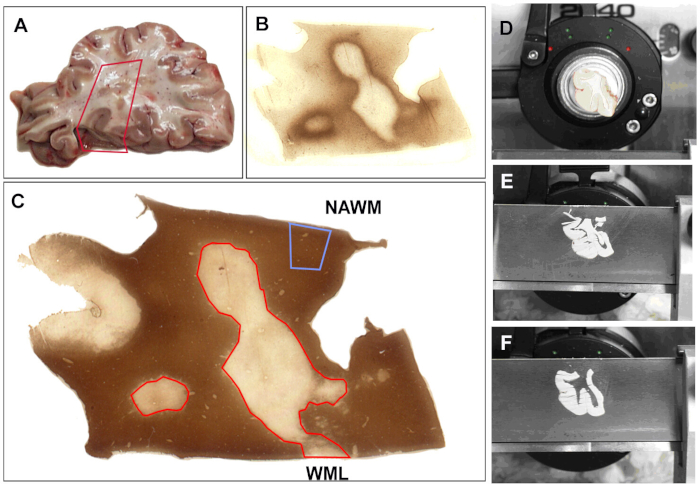
図1:mRNA分析のためのサンプル収集(A) 解剖組織は分析のために選択される。組織の領域が選択され、組織の一部が切除されます。すべての切片は、(B)MHC-II(主要組織適合性複合体(MHC)クラスII HLA-DR CR3/43)抗体で染色され、(C)プロテオリピッドタンパク質(PLP)を用いて、公開されたプロトコルを用いてミエリンの状態を決定する。ミエリンの状態に基づいて、ブロックはメス(D)によって得点される。セクション (60 μm)が切断され(E)、以前に採点された領域が除去され、チューブで区切られ、ラベル付け (F)PLPおよびMHC-IIの汚れはティッシュの適切なコレクションを保障するために5つのセクションの後に繰り返される。通常現れる白色物質(NAWM)が注目され、白色物質病変(WML)が赤で輪郭が描かれている。この図のより大きなバージョンを表示するには、ここをクリックしてください。
MS10の病変における軸上の切除.このプログラムの最初の科学的焦点は、脱筋化白物質病変の細胞成分の特性評価に関するものでした。局在する抗原の中には非リン酸化神経フィラメント(NF)があった。ほとんどのNFは、骨髄性軸母でリン酸化される。脱髄時に、軸が脱リン酸化される。脱筋化軸母における非リン酸化NFの期待発現を検出した。急性MS病変では、これらの脱筋化軸索の多くは、経常軸索の近位端を反映する軸索引数球根(図2A)として終了した。経常軸は、隣接する正常領域10と比較して急性病変において11,000mm3を超える。これらの観察は、MSを有する個人における永久的な神経障害の主な原因として神経変性の特徴付けに向けてフィールドを動かしたMS研究のパラダイムシフトを触媒するのに役立った。
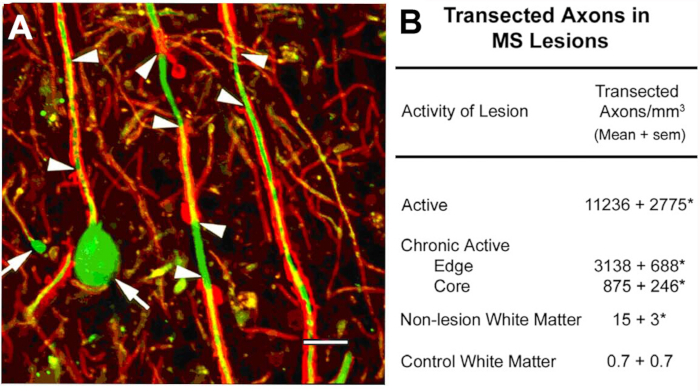
図2:炎症性脱髄中の軸視術軸線断視は炎症性脱髄(A、矢頭)の間に起こり、末端軸線オボイド(A、矢印)の形成を誘導する。定量化された(B)、トランスエクセド軸位はMS病変に豊富であり、病変の炎症活性と相関するように見える。パネルAは、許可を受けてTrappら10から再現。赤:プロテオリピドタンパク質、緑:抗非リン酸化神経フィラメント。この図のより大きなバージョンを表示するには、ここをクリックしてください。
慢性MS脳における再髄生3.再髄化は、MS の初期段階で堅牢にすることができます。しかし、多くの慢性MS病変は再び化化していない。オリゴデンドロサイト前駆細胞(OpC)の存在または新しいオリゴデンドロサイトの生成が慢性的に脱髄性白色物質病変の再髄生を制限するかどうかを調べた。OPC密度はしばしば減少したが、それらは全ての慢性脱筋脱筋化病変3に存在していた。新たに生成されたオリゴデンドロサイトは、多くの慢性MS病変にも存在していた。オリゴデンドロサイトプロセスに関連したが、脱髄軸母体を髄化しなかった(図3)。これらの研究は、OpCと新しいオリゴデンドロサイトを産生する能力が慢性白色物質病変の再髄生を制限していないことを示している。我々は、しばしばジストロフィーに現れる慢性脱髄軸索は、新たに産生されたオリゴデンドロサイトによる再髄生を受容しないと仮定した。
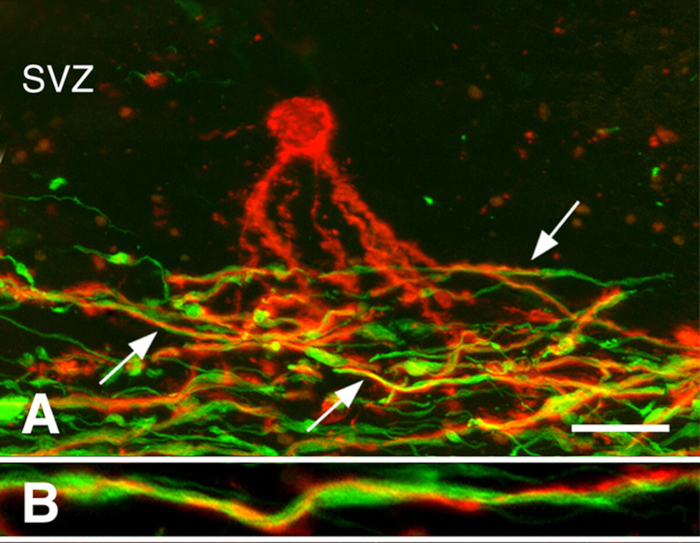
図3:軸線に関連する前骨髄性オリゴデンドロサイトのプロセス。PLP抗体で染色されたMS病変の共焦点顕微鏡写真(パネルA、Bの赤色)およびニューロフィラメント抗体(パネルA、Bの緑色)が示されている。心室下ゾーン(SVZ)における前骨髄化オリゴデンドロサイト(パネルAの赤色)は、慢性MS病変における脱筋化軸母(パネルAの緑色)の領域にプロセスを拡張した。これらのプロセスの多く(パネルAの矢印)は、より高い倍率(パネルB)に示すように、軸線の周りに渦巻いた。スケール バーは 20 μm (A) と 5 μm (B) を表します。許可を受けてChangら3から再現。この図のより大きなバージョンを表示するには、ここをクリックしてください。
MS6のミトコンドリア機能障害.慢性MS患者から得られた急速凍結運動皮質における神経遺伝子変化の公平な探索を行った(図4A)。このデータセットの公平な検索は、MS(図4B)の23の核コードされたミトコンドリアmRNAの大幅な減少を特定しました。免疫細胞化学と場ハイブリダイゼーションを用いた資格研究は、これらの遺伝子が皮質投影ニューロン(図4C)で非常に濃縮され、投影軸から分離されたミトコンドリアが減少した糖分解を示すことを示した(図4D)。本論文は、ミトコンドリア機能障害に焦点を当て、MSにおける軸線変性の主要な貢献者としてATP産生を減少させた。
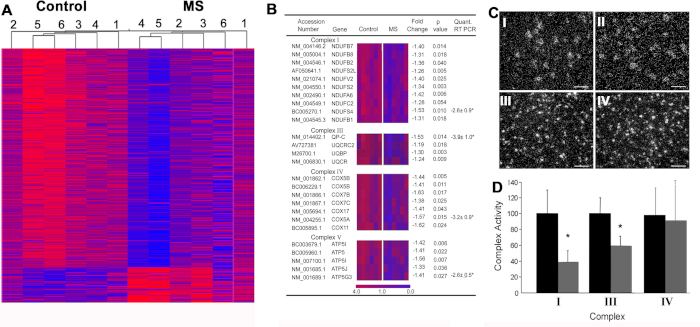
図4:MSモータ皮質で行われるマイクロアレイデータとダウンストリーム検証技術。(A) 対照(C1-C6)およびSPMS(MS1-MS6)運動皮質試料からの有意に変化した転写物の階層的なクラスタリングは、疾患関連遺伝子発現パターンを別々に支持する。MS運動皮質における転写の減少のうち、26個は電子輸送鎖(B)に属していた。ミトコンドリア複合体I(NDUFA6)mRNAは、MS運動皮質(CII)におけるニューロン(n=55-130)において対照(CI)と比較して減少したが、PLP mRNA密度は対照(CIII)とMS(CIV)大脳皮質の間で類似していた。MS患者の運動皮質からのミトコンドリア富化画分(n=3)(D)では、電子輸送複合体IおよびIIIの活性が低下した。許可を受けてDuttaら6から転載。誤差余数は SEM を表します。CI-IVのスケールバーは25 μm. * p < 0.05 学生のt-テストです。この図のより大きなバージョンを表示するには、ここをクリックしてください。
MS8における認知機能障害の病因MS患者の40~60%が認知機能低下と執行機能の低下を有する。我々は、記憶/学習の機能的な部位である海馬を、MSにおける脱髄の共通サイトとして同定した。次に、骨髄および脱骨髄性海馬におけるニューロン遺伝子発現を比較し、記憶/学習に関与するタンパク質をコードする神経mRNAの有意な減少を見出した。これらのマイクロRNAが脱筋膜海馬で増加し、グルタミン酸受容体の発現を減少させることができることを実証することによって、これらのデータを拡張した。これらの観測値をげっ歯類モデルで再現し、拡張しました。次に、骨髄性および脱筋化海馬におけるニューロン遺伝子発現を比較し、記憶/学習に関与するタンパク質をコードする神経mRNAの有意な減少を見出した。
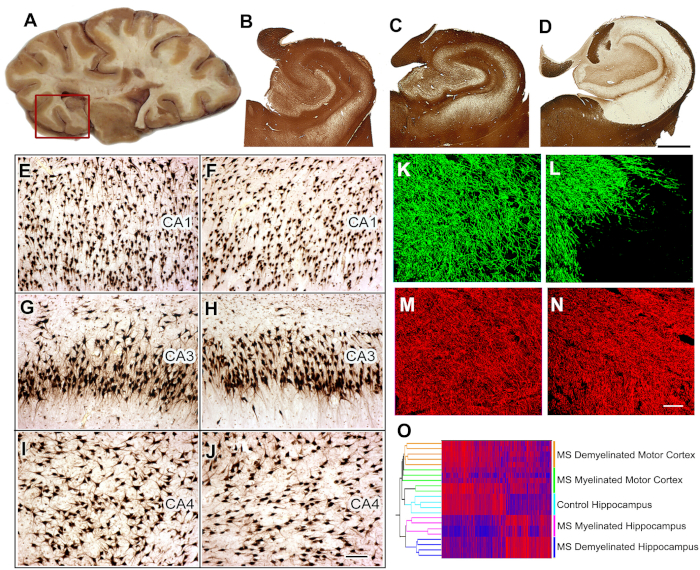
図5:MS海馬における組織採取、組織学的解析、遺伝子発現研究海馬を含む脳スライスは解剖(A)中に選択され、海馬と隣接する領域は、さらなる分析のために除去される(赤い箱)。PLPに対する免疫染色は、全対照(B)およびMS海馬(C)の40%においてミエリンの保存を示した。MS海馬(D)の約60%で広範な脱髄が検出された。コントロール海馬(E,G,I)と比較した場合、HuR免疫組織化学で示すように、脱筋化MS海馬(F、H、J)のCA1、CA3、またはCA4領域では有意な神経損失は検出されなかった。 ミエリン(ミエリン基性タンパク質(MBP)、緑)および軸(SMI32、赤色)の二重標識免疫蛍光は、コントロール海馬と比較してMS脱骨髄化海馬における軸(N)の相対的保存を伴うミエリン(L)の喪失を示した(MBP, K;SMI32、M)。 mRNA発現レベルの二重クラスタリングは、ミエリン状態(ミエリン化および脱筋線)および位置(海馬対運動皮質)(O)に基づいて離散クラスターにサンプルを配置した。高いmRNAレベルは赤と青で示され、低発現レベルを示す。パネルC-Oは許可を受けてDuttaら8から適応した。B-D: 2 mm, E-J: 100 μm, K-N: 50 μm.この図のより大きなバージョンを表示するには、ここをクリックしてください。
MRI変化の病理学的相関12.MRIはMSの診断と治療への応答の重要な指標であり、MS疾患進行の予測変数でもあるが、MRI変化の病理学的相関は十分に理解されていない。死後MRI研究は2つのMRI ROIに焦点を当てています。T1低強度、T2高強度、および減らされた磁化伝達比(MTR)(T2T1MTR)の組み合わせを有するT2超強度(T2のみ)とROAのみであった大脳白質ROA。脳白質T2のみのROIの約45%が骨髄を認め、非特異的な性質を確認した。対照的に、T2T1MTR ROIsの83%は慢性的に脱筋化され、ブラックホールとして現れた。T1 および MTR 値は半定量値であり、T2T1MTR ROIs ではその値が大きく変化します。ミエリンの損失がこれらのMRIの変化に唯一の寄与者である場合、値は一定でなければなりません。膨潤した脱筋化軸母軸は、T1値とMTR値の両方と相関した。
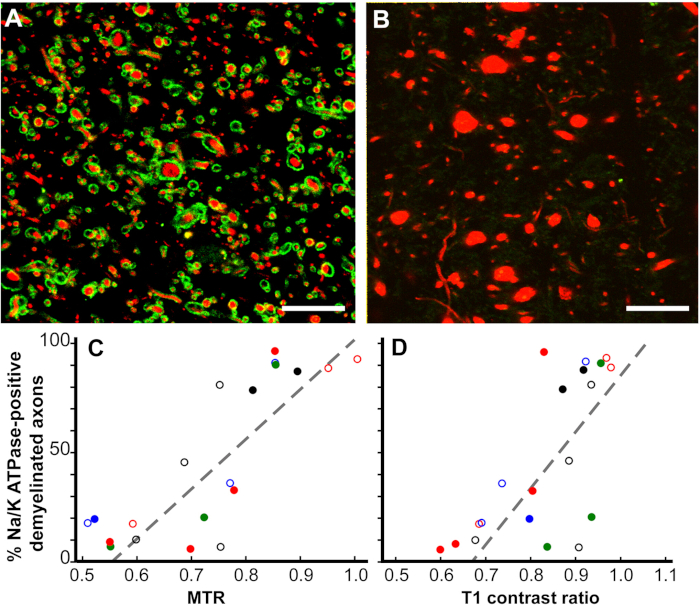
図6:磁化伝達比(MTR)およびT1コントラスト比は、慢性MS病変におけるNa+/K+ATPase陽性軸母の割合と直線的に相関する。Na+/K+ ATPase(緑)に染色された慢性脱筋化病変は、神経フィラメント(赤色)でほぼ100%(A)からゼロ(B)に変化した。Na+/K+ ATPaseを持たない多くの軸ゴンは、直径(B)を増加させた。慢性脱筋膜化MS病変におけるNa+/K+ATPase陽性軸官の割合の比較は、定量的事後MTR(p< 0.0001、C)およびT1コントラスト比(p< 0.0006,D)と相関した。 各データポイントは単一の病変からのもので、各ユニークなカラーシンボルの組み合わせは、研究された脳の1つを示します。スケールバー = 5 μm. 許可を受けてヤングら12から再現。この図のより大きなバージョンを表示するには、ここをクリックしてください。
脱髄に依存しない神経変性11.歴史的に、MSの神経変性は脱髄に起因すると考えられてきた。しかし、脳イメージング研究は、神経変性と脱髄が独立した事象である可能性を高めている。我々は最近、脊髄および大脳皮質の脱髄を有するMS患者の亜集団を同定したが、脳白質ではない。このMSサブタイプを骨髄皮質MS(MCMS)として造語した。MCMS症例は、脳白質脱髄と皮質神経喪失との関係を調査するためのプラットフォームを提供した。対照皮質と比較して、皮質神経損失は典型的なMS皮質よりもMCMS皮質において有意に大きかった。コントロール脳組織は、クリーブランドクリニックの病理学部から得られた。この研究は、脱髄の不在における神経変性の最初の病理学的証拠を提供する。
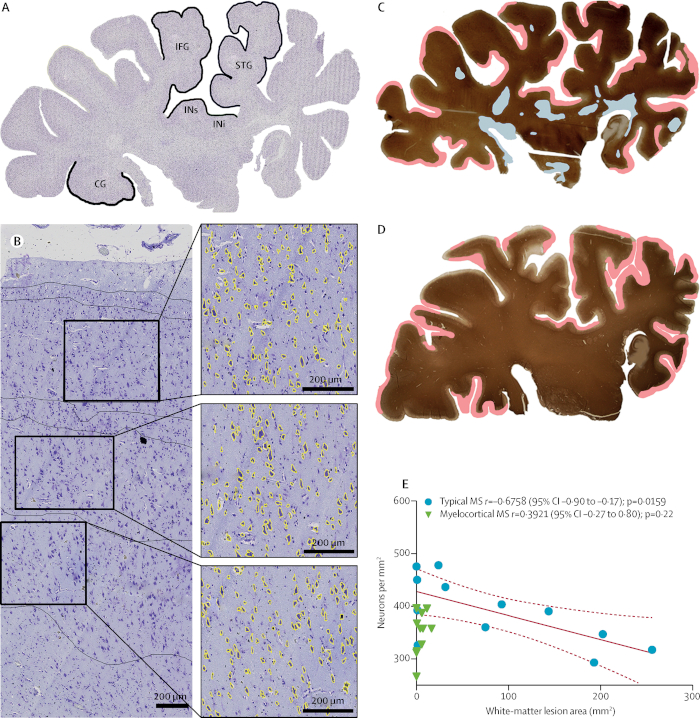
図7:脳白質脱髄の不在における神経喪失。クレシルバイオレット-染色された冠状の半球のセクションは、典型的なMS(A)を有するように分類された個人から。神経密度は、5つの標識領域のそれぞれにおいて皮質層III、V、およびVIで比較された。60 μm 2(黄色)を超える領域を有するニューロンは、優れた側頭皮質(B)からの代表的な画像に示されている。PLPのラベリングと脱髄病変の分布(白質脱髄は青色で強調表示され、下半髄はピンクで強調表示される)は、典型的なMS(C)および骨髄性MS(D)を有する個人からの半球セクションで強調表示される。)が表示されます。皮質神経密度の低下と増加した脳白質病変体との間の有意な相関関係は、典型的なMSで見出されたが、骨髄皮質MS(E);では見出されなかった。破線は95%信頼区間(CI)を示します。IFG = 劣った前頭部のジャイル。STG = 優れた時間的なジャイル。INi = 劣ったインシュラ。IN = 優れたインシュラ。CG = ジルをシンギュレートします。Trappら11から許可を受けて再現。この図のより大きなバージョンを表示するには、ここをクリックしてください。
| シーケンス期間 | シーケンスの説明 | シーケンスの使用 |
| 0:09 | ローカライザー | 後続のシーケンスのローカリゼーション |
| 9時14分 | 3D磁化は、急速な勾配エコー(MPRAGE)を準備 | 脳構造の構造イメージング体積推定 |
| 5時14分 | 3D流体減衰反転回復(FLAIR) | 病変同定病分セグメント体容積病変評価 |
| 2時35分 | 2D T2 重み付け | 病変同定病分セグメント体容積病変評価 |
| 5時12分 | 磁化伝達プリパルス付き3Dグラデーションリコールエコー(MT-ON) | 正常出現および病変組織におけるミエリン含有量の測定 |
| 5時12分 | 磁化伝達プリパルスなしの3Dグラデーションリコールエコー、(MT-OFF) | |
| 0:27 | 拡散テンソルイメージング(DTI)フィールドマッピング | 脳組織の完全性を反映すると考えられている脳組織における水拡散の尺度。 |
| 10時27分 | 拡散テンソルイメージング(DTI)マルチシェル | |
| 1時18分 | 拡散テンソルイメージング(DTI)マルチシェル | |
| 39:48:00 | 小計: コア |
表 1: 死後イメージング プロトコル。
ディスカッション
我々は、MSを持つ150人以上の個人から組織を迅速に調達し、処理するために使用されているプロトコルについて説明する。このプロトコルの重要な特徴は、組織を利用する科学者がプロトコルを確立し、組織集を行うことも担当していることです。これにより、個々の研究プロジェクトの科学的ニーズを柔軟に満たすことができます。このプロトコルのいくつかの側面は、そのユーティリティを強化します。患者の多くは、私たちのセンターで神経科医が続いているので、患者は通常、死ぬ前によく特徴付けられます。重要なステップは、死後すぐに組織の寄付の処理です, これは、他のいくつかの脳バンクと比較して凍結組織の品質を増加させます.これにより、組織学的および免疫細胞化学的観察の実証に不可欠な転写および翻訳遺伝子産物の変化を記述する上で大きな価値のある分子研究が可能になります。複数の症例にわたる形態学的/免疫細胞化学的および分子データの活用は、結論の信頼性を高めます。これは、大脳皮質におけるミトコンドリア遺伝子の変化と脱筋脱海馬における神経遺伝子の変化の記述によって最もよく示される。新しい遺伝子プロファイリングプロトコルは急速に開発されており、当バンクの凍結組織は、組織および単一細胞分析のための高品質のRNAを提供する必要があります。
私たちのプロトコルのもう一つの重要な側面は、短い固定脳スライスです。これらのティッシュは30 μmの厚さ、自由な浮遊セクションに切断される。これらのセクションは、共焦点顕微鏡を使用して3次元で2つ以上の抗原を分析するのに最適です。良い例は、慢性MS病変におけるジストロフィー軸索との前骨髄化オリゴデンドロサイトプロセスの相互作用、ならびに経絶軸索引力球根球への単一軸索接続の同定を含む。これは、3D 画像が実現不可能な 7 μm 厚のパラフィン セクションの日常的な使用とは対照的です。パラフィン埋め込み組織は、いくつかの質問、特に半球7 μm厚のセクションにおける神経密度の定量化に大きな価値を有する。従って私たちのティッシュ処理のプロトコルは多様であり、固定され、急速に凍結されたティッシュを保証する柔軟性を提供する。
私たちのプロトコルのもう一つのユニークな特徴は、その中の脳MRIの死後です。脳MRIsはMS疾患のかけがえのないバイオマーカーです。したがって、異常なMRI信号の病理学的相関を確立することが不可欠である。我々の研究は、T2のみおよびT2T1MTR ROIsの両方がしばしばミエリン化されることが明らかである。この知見は、骨髄異分化と脱筋化性脳白質を確実に区別する、より具体的なイメージングモダリティの必要性を支持する。MRIはミエリンの検出に敏感であるように見えるが、我々の研究は、T1/T2/MTRの組み合わせでさえ、髄質を同定するために特異的ではないことを示している。私たちの死後プロトコルは、新しいイメージングモダリティの能力をテストするための理想的なプラットフォームを提供し、骨髄切れと脱筋化された脳白質を区別します。MRIはまた、翻訳研究におけるMRIの使用と生きている患者における広範な臨床使用を考えると、基礎科学の結果を臨床実践に翻訳するための理想的な手段を提供します。
短く、長い固定だけでなく、冷凍スライスを切断すると、異なる研究のための複数のモードで組織を処理するための利点を提供していますが、この方法にはいくつかの制限があります。構造の全体の評価は、隣接するスライス上で異なる方法で処理される可能性があるため、構造の一部が制限される場合があります。しかし、組織バンクの大量は、サンプリングを改善するために、複数の被験者に関心のある構造を調査する能力を提供する。死後組織を利用する研究のもう一つの一般的な制限は、それらが断面的であることです。変更のタイミングと進行に関する結論は、この文脈の中で解釈する必要があります。組織を寄付する患者に選択バイアスがあり、MSを有するすべての患者にデータの一般化が制限される可能性があります。ほとんどのドナーは高度なMSの合併症で死亡するので、これらの患者からMSの初期段階の所見を外挿することは適切ではないかもしれません。それにもかかわらず、我々は非MS関連の状態(すなわち、急性心筋梗塞、薬物過剰摂取、自殺)で死亡した若い患者から組織を受け取った。我々のプロトコルの範囲は、MSに関与している他の器官(例えば、消化管および骨髄)のサンプリングを含まない。私たちは、プログラムの強みは、その限界を大きく上回ると信じています。
開示事項
著者は利益相反を宣言しない。
謝辞
著者はまた、編集支援のためにクリストファー・ネルソン博士に感謝したいと思います。解剖プログラムは、R35 認可 NS097303 から BDT に部分的にサポートされています。RDの実験室での仕事はNINDS(NS096148)および米国国立多発性硬化症協会(RG 5298)からの助成金によって支えられている。
資料
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| Biotinylated goat anti-mouse IgG | Vector Laboratories | BA-9200 | 1:500 dilution for hemispheric; 1:1,000 for 30µm free-floating. RRID: AB_2336171 |
| Biotinylated goat anti-rabbit IgG | Vector Laboratories | BA-1000 | 1:500 dilution. |
| Biotinylated goat anti-rat IgG | Vector Laboratories | BA-9400 | 1:500 dilution for hemispheric; 1:1,000 for 30µm free-floating. RRID: AB_2336208 |
| Glial fibrillary acid protein (GFAP) | Dako | Z0334 | 1:700 dilution for hemispheric. RRID: AB_10013382 |
| HuR, mouse IgG, 3A2 clone | Santa Cruz | SC-5261 | 1:500 for 30µm free floating. RRID: AB_627770 |
| Major histocompatibility complex (MHC) class II HLA-DR CR3/43 | Dako | Mo746 | 1:250 dilution for hemispheric; 1:500 for 30 µm free floating. RRID: AB_2313661 |
| Non-phosphorylated neurofilament (SMI32) | Biolegend | 801701 | 1:5,000 dilution for hemispheric; 1:2,500 for 30 µm free-floating. RRID: AB_2564642 |
| Phosphorylated neurofilament (SMI31) | Biolegend | 801601 | 1:5,000 dilution for hemispheric; 1:2,500 for 30 µm free-floating. RRID: AB_2564641 |
| Proteolipid protein (PLP) | Gift from Wendy Macklin | 1:250 dilution for IHC; alternative anti-PLP antibodies commercially available. | |
| Reagents | |||
| 125 mm filter paper | Whatman | 1452-125 | For filtering PFA. |
| 50% Glutaraldehyde | Electron Microscopy Sciences | 16320 | Electron microscopy grade. |
| Cytoseal | ThermoScientific | 8310-16 | |
| Ethylene glycol | Fisher Chemical | BP230-4 | |
| Glycerol | Sigma-Aldrich | G7893 | 400 mL/2 L Cryoprotection solution. |
| Millex-HV Syringe Filter Unit, 0.45 µm, PVDF, 33 mm, gamma sterilized | Millipore-Sigma | SLHV033RB | |
| Paraformaldehyde | Electron Microscopy Sciences | 19200 | Prills form. |
| Polyvinylpyrolidone (PVP-40) | Fisher Chemical | BP220-212 | |
| Sodium azide | Fisher Chemical | S227I | 2 g/2 L Sorenson's buffer. |
| Sodium phosphate dibasic | Sigma-Aldrich | S0876 | 98.8 g/2 L Sorenson's buffer. |
| Sodium phosphate mono basic monohydrate | Sigma-Aldrich | S9638 | 14.352 g/2 L Sorenson's buffer. |
| Sucrose | Sigma-Aldrich | PVP40-500G | |
| VectaStain ABC Kit | Vector Laboratories | PK-6100 | 1:1,000 dilution of A and B. RRID: AB_2336819 |
| Waterproof drawing black ink | Higgins | 44201 | |
| Xylene | Fisher Chemical | X3S | Histological grade. |
| Equipment | |||
| 3T MRI Magnetom Prisma | Siemens Healthineers | ||
| 7T MRI Agilent 830AS | Siemens Healthineers |
参考文献
- Trapp, B. D., Nave, K. A. Multiple sclerosis: an immune or neurodegenerative disorder?. Annual Review of Neuroscience. 31, 247-269 (2008).
- Chang, A., Nishiyama, A., Peterson, J., Prineas, J., Trapp, B. D. NG2-positive oligodendrocyte progenitor cells in adult human brain and multiple sclerosis lesions. Journal of Neuroscience. 20, 6404-6412 (2000).
- Chang, A., Tourtellotte, W. W., Rudick, R., Trapp, B. D. Premyelinating oligodendrocytes in chronic lesions of multiple sclerosis. New England Journal of Medicine. 346, 165-173 (2002).
- Chang, A., et al. Neurogenesis in the chronic lesions of multiple sclerosis. Brain. 131, 2366-2375 (2008).
- Chang, A., et al. Cortical remyelination: A new target for repair therapies in multiple sclerosis. Annals of Neurology. 72, 918-926 (2012).
- Dutta, R., et al. Mitochondrial dysfunction as a cause of axonal degeneration in multiple sclerosis patients. Annals of Neurology. 59, 478-489 (2006).
- Dutta, R., et al. Activation of the ciliary neurotrophic factor (CNTF) signalling pathway in cortical neurons of multiple sclerosis patients. Brain. 130, 2566-2576 (2007).
- Dutta, R., et al. Demyelination causes synaptic alterations in hippocampi from multiple sclerosis patients. Annals of Neurology. 69, 445-454 (2011).
- Dutta, R., et al. Hippocampal demyelination and memory dysfunction are associated with increased levels of the neuronal microRNA miR-124 and reduced AMPA receptors. Annals of Neurology. 73, 637-645 (2013).
- Trapp, B. D., et al. Axonal transection in the lesions of multiple sclerosis. New England Journal of Medicine. 338, 278-285 (1998).
- Trapp, B. D., et al. Cortical neuronal densities and cerebral white matter demyelination in multiple sclerosis: a retrospective study. Lancet Neurology. 17, 870-884 (2018).
- Young, E. A., et al. Imaging correlates of decreased axonal Na+/K+ ATPase in chronic multiple sclerosis lesions. Annals of Neurology. 63, 428-435 (2008).
- Fisher, E., et al. Imaging correlates of axonal swelling in chronic multiple sclerosis brains. Annals of Neurology. 62, 219-228 (2007).
- Moll, N. M., et al. Imaging correlates of leukocyte accumulation and CXCR4/CXCL12 in multiple sclerosis. Archieves of Neurology. 66, 44-53 (2009).
- Moll, N. M., et al. Multiple sclerosis normal-appearing white matter: pathology-imaging correlations. Annals of Neurology. 70, 764-773 (2011).
- Nakamura, K., Chen, J. T., Ontaneda, D., Fox, R. J., Trapp, B. D. T1-/T2-weighted ratio differs in demyelinated cortex in multiple sclerosis. Annals of Neurology. 82, 635-639 (2017).
- Chen, J. T., et al. Clinically feasible MTR is sensitive to cortical demyelination in MS. Neurology. 80, 246-252 (2013).
- Nakamura, K., Fox, R., Fisher, E. CLADA: cortical longitudinal atrophy detection algorithm. Neuroimage. 54, 278-289 (2011).
- Sled, J. G., Zijdenbos, A. P., Evans, A. C. A nonparametric method for automatic correction of intensity nonuniformity in MRI data. IEEE Transactions of Medical imaging. 17, 87-97 (1998).
- Fisher, E., Cothren, J. R. M., Tkach, J. A., Masaryk, T. J., Cornhill, J. F. Knowledge-based 3D segmentation of the brain in MR images for quantitative multiple sclerosis lesion tracking. Proc. SPIE 3034, Medical Imaging. , 19-25 (1997).
- Avants, B. B., Epstein, C. L., Grossman, M., Gee, J. C. Symmetric diffeomorphic image registration with cross-correlation: evaluating automated labeling of elderly and neurodegenerative brain. Medical Image Analysis. 12, 26-41 (2008).
- Jenkinson, M., Bannister, P., Brady, M., Smith, S. Improved optimization for the robust and accurate linear registration and motion correction of brain images. Neuroimage. 17, 825-841 (2002).
- Lewis, D. A. The human brain revisited: opportunities and challenges in postmortem studies of psychiatric disorders. Neuropsychopharmacology. 26, 143-154 (2002).
- Chomyk, A. M., et al. DNA methylation in demyelinated multiple sclerosis hippocampus. Scientific Reports. 7, 8696 (2017).
- Huynh, J. L., et al. Epigenome-wide differences in pathology-free regions of multiple sclerosis brains. Nature Neuroscience. , (2014).
- Ishii, A., et al. Human myelin proteome and comparative analysis with mouse myelin. Proceedings of the National Academy of Sciences. U. S. A. 106, 14605-14610 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved