Method Article
Programme complet d'autopsie pour les personnes atteintes de sclérose en plaques
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
La sclérose en plaques est une maladie démyélinisatrice inflammatoire sans traitement. L'analyse des tissus cérébraux fournit des indices importants pour comprendre la pathogénie de la maladie. Ici nous discutons la méthodologie et l'analyse en aval du tissu cérébral de SP rassemblée par un programme d'autopsie rapide unique en opération à la clinique de Cleveland.
Résumé
Nous décrivons un programme rapide de don de tissus pour les personnes atteintes de sclérose en plaques (SEP) qui exige que les scientifiques et les techniciens soient sur appel 24 heures sur 24, 7 jours sur 7, 365 jours par année. Les participants consentent à faire don de leur cerveau et de leur moelle épinière. La plupart des patients ont été suivis par des neurologues au Cleveland Clinic Mellen Center for MS Treatment and Research. Leurs cours cliniques et les incapacités neurologiques sont bien caractérisés. Peu de temps après la mort, le corps est transporté au Centre d'imagerie de la SP, où le cerveau est scanné in situ par imagerie par résonance magnétique 3 T (IRM). Le corps est ensuite transféré à la salle d'autopsie, où le cerveau et la moelle épinière sont enlevés. Le cerveau est divisé en deux hémisphères. Un hémisphère est immédiatement placé dans une boîte de découpe et d'autres tranches de 1 cm d'épaisseur sont soit fixées en paraformaldéhyde de 4 % pendant deux jours, soit rapidement congelées dans de la glace sèche et 2 méthylbutane. Les tranches de cerveau à courte durée déterminée sont stockées dans une solution de cryoconservation et utilisées pour les analyses histologiques et la détection immunocytochimique des antigènes sensibles. Les tranches congelées sont stockées à -80 oC et utilisées pour les études moléculaires, immunocytochimiques et in situ d'hybridation/ARN. L'autre hémisphère est placé dans un paraformaldéhyde de 4 % pendant plusieurs mois, placé dans la boîte de découpe, rescanné dans le scanner à résonance magnétique 3 T (MR) et découpé en tranches d'un centimètre d'épaisseur. Les images m.in situ post mortem (IRM) sont co-enregistrées avec des tranches de cerveau de 1 cm d'épaisseur pour faciliter les corrélations IRM-pathologie. Toutes les tranches de cerveau sont photographiées et les lésions de matière blanche de cerveau sont identifiées. La moelle épinière est coupée en segments de 2 cm. Les segments alternatifs sont fixés dans 4% de paraformaldéhyde ou rapidement congelés. L'acquisition rapide de tissus post mortem de la SP permet des analyses pathologiques et moléculaires des cerveaux et de la moelle épinière de la SP et des corrélations pathologiques des anomalies de l'IRM cérébrale. La qualité de ces tissus post-mortem rapidement traités (habituellement dans les 6 h de la mort) est d'une grande valeur pour la recherche sur la SP et a donné lieu à de nombreuses découvertes à fort impact.
Introduction
Une des meilleures façons d'étudier une maladie est d'examiner le tissu malade lui-même. Cela présente des défis pour ceux qui étudient les maladies du système nerveux central (SNC). Les biopsies du cerveau et de la moelle épinière malades sont extrêmement rares et impliquent habituellement des cas atypiques. Les taux d'autopsie chez les personnes atteintes de maladies du SNC ont considérablement diminué au cours des dernières années, et lorsqu'ils sont exécutés, ils n'assurent souvent pas l'approvisionnement rapide des tissus. Ces défis ont abouti à la création de banques cérébrales centrées sur la maladie, dont plusieurs ont porté sur la collecte de tissus auprès de personnes atteintes de sclérose en plaques (SEP). La SP est une maladie inflammatoire du SNC qui détruit la myéline, les oligodendrocytes (cellules formant la myéline), les neurones et les axones. La majorité des patients atteints de SP ont un cours de maladie bi-phasique qui commence par des épisodes d'incapacité neurologique avec un rétablissement variable qui évolue finalement en une maladie progressivement progressive qui est probablement neurodégénérative dans la nature1. Pour la majorité des cerveaux de SP donnés, les intervalles post mortem (PMI) entre la mort et le traitement des tissus dépassent 24 h. Bien que ces tissus aient fourni des informations précieuses sur les changements pathologiques dans les cerveaux de la SP, ils ne sont pas adaptés à des études moléculaires plus avancées qui peuvent fournir des informations puissantes sur la pathophysiologie de la maladie. C'est particulièrement le cas pour les études de profilage génétique, qui nécessitent un ARN intact.
Pour surmonter les limites mentionnées ci-dessus, nous avons développé un programme de don rapide de tissus qui permet l'IRM/corrélations pathologiques. Ce protocole fournit des tissus bien conservés adaptés aux études moléculaires modernes et permet une comparaison directe de la pathologie cérébrale et des anomalies de l'IRM dans le cerveau de la SP. Le Cleveland Clinic Multiple Sclerosis Tissue Donation Program existe depuis plus de 20 ans. Ce programme rapide de don de tissus procure des cerveaux et des moelles épinières à des personnes atteintes de SP et d'autres affections neurologiques auto-immunes associées. Le programme vise à obtenir des IRM in situ dans les 6 h suivant la mort, suivies de l'ablation du cerveau et de la moelle épinière pour le traitement des tissus.
recrutement
Les dons sont obtenus par consentement ante-mortem obtenu directement auprès de patients (pré-consentement) ou de parents proches après le décès. Les patients préconsents sont généralement identifiés à partir de la population clinique du Mellen Center for Multiple Sclerosis Treatment and Research à Cleveland, Ohio. Bien que la préférence dans le recrutement dans le programme rapide de don de tissus soit donnée aux patients qui ont été suivis dans des études de recherche longitudinales, il est ouvert à tous les patients vus au centre. Les participants qui s'inscrivent avant le décès reçoivent des instructions aux membres de la famille ou aux fournisseurs de soins de communiquer avec l'équipe de recherche, soit au moment du décès, soit lorsque le décès est considéré comme imminent. La deuxième méthode pour les personnes d'entrer dans le programme de don de tissus est au moment du décès par consentement de la plus proche parente. L'État de l'Ohio exige que les décès soient dirigés vers une organisation d'achat d'organes mandatée par le gouvernement fédéral, LifeBanc, qui opère dans 20 comtés du nord-est de l'Ohio. LifeBanc examine tous les décès pour un diagnostic de SP, ce qui est une exclusion pour le don d'organes. Des dispositions ont été prises pour que LifeBanc avise les enquêteurs du programme de don de tissus de SP pour tous les décès avec un diagnostic associé de SP se produisant dans un rayon de 75 milles de la clinique de Cleveland. Les proches et le personnel hospitalier sont ensuite contactés par le personnel du Programme de don de tissus et le consentement est obtenu pour le don de tissus cérébraux et de moelle épinière. Ces deux méthodes de recrutement ante-mortem et post-mortem par LifeBanc se traduisent par environ 10-12 dons de cerveau par an. Des ajustements sont apportés à la limite d'âge supérieure du décès pour gérer le nombre de renvois dérivés de LifeBanc.
Achat de dons
Le programme exige une couverture de 24 h, 365 jours par année par les membres du programme de don de tissus pour l'approvisionnement en tissus. L'équipe clinique utilise un système centralisé de notification de don de tissus par courriel/pager/appareil mobile pour les dons de tissus. LifeBanc reçoit des numéros pour communiquer avec le personnel de garde pour le programme de don de tissus. Les membres sont avisés du décès par les fournisseurs d'hôpitaux ou les proches (préconsents) ou par LifeBanc et d'autres sources d'aiguillage. Tout d'abord, une détermination de l'heure du décès et la faisabilité du don de tissus est faite. Les décès sont ensuite examinés pour des conditions qui peuvent entraîner des tissus de mauvaise qualité, y compris l'hypoxie pré-mortem prolongée, tissu cérébral destructeur massif (par exemple, une hémorragie intracrânienne importante, des accidents vasculaires cérébraux bihéssphériques étendus, une tumeur étendue charge de ventilateur prolongée ( 3 jours) et utilisation prolongée d'agents vasoactifs (3 jours) avant le décès. Lorsqu'un médecin légiste est impliqué dans un décès, le neurologue de l'étude peut parler avec le médecin légiste pour explorer un moyen de recevoir des tissus en temps opportun sans compromettre la responsabilité du médecin légiste. Si des tissus viables sont ressentis comme présents, le consentement écrit est obtenu (s'il n'est pas obtenu avant l'autopsie) et des préparatifs sont faits pour le transport du corps. Un service de transport décélérateur précédemment sous contrat est ensuite contacté pour le transport vers les installations d'IRM à la clinique de Cleveland. Il est fait attention de s'assurer que le corps reste à température ambiante et n'est pas placé en réfrigération, car des températures corporelles plus basses sont associées à des altérations des caractéristiques du signal d'IRM.
Antécédents cliniques
L'histoire clinique comprend des détails sur le diagnostic de la SP, l'enclence des symptômes, les traitements utilisés, les résultats des essais cliniques et paracliniques (potentiels évoqués, résultats du liquide céphalo-rachidien, tomographie de cohérence optique), la sclérose en plaques composite fonctionnelle , et l'élargissement de l'échelle de l'état d'invalidité (EDSS, réelle ou estimée), qui sont recueillies à partir du dossier médical (le cas échéant) et l'entrevue directe des plus proches parents. L'IRM pré-mortem est également collectée.
Protocole
Ce protocole a été approuvé par le Cleveland Clinic Institutional Review Board et suit les lignes directrices du comité d'éthique de la recherche humaine de la Cleveland Clinic.
1. IRM In Situ
- Emmenez le corps donneur à la suite d'IRM et effectuez un protocole d'imagerie par IRM de 2 h à l'installation d'imagerie de la SP. Effectuez une IRM sur un imageur 3 T ou 7 T.
REMARQUE: La priorité est donnée au 3T car la majorité des données héritées ont été effectuées sur 3 T, mais lorsqu'elles ne sont pas disponibles, l'imagerie est réalisée avec 7T. Les séquences de base désignées sont exécutées pour tous les cas (tableau 1) et d'autres séquences qui dépendent des intérêts de recherche actuels sont effectuées si le temps le permet (contraint par la fixation des tissus moins de 12 h après le décès). Le tableau 1 décrit les séquences de base.
2. Autopsie
REMARQUE: Après l'IRM in situ, le corps est transporté à la morgue pour l'extraction du cerveau et de la moelle épinière par un disducteur et le traitement des tissus par les membres du laboratoire.
- Effectuez les étapes suivantes avant l'arrivée du corps à la morgue. Deux heures avant, préparer 3 L de 4 % de paraformaldéhyde (PFA) et étiqueter les contenants et les sacs pour le stockage des tissus. Préparer 3 L de 8% PFA et diluer 1,5 L de 8% PFA à 4% PFA. Placez les 8 % restants de PFA dans 4 oC pour le jour 2.
- Avant de vous rendre à la morgue, remplissez 2 glacières à 50 % de glace sèche (de gros blocs brisés pour s'adapter et de petites pastilles).
- À la morgue, remplir un contenant en acier inoxydable à mi-chemin avec du 2-méthylbutane et de la glace sèche et couvrir d'un couvercle en vue de la congélation du tissu.
- Peser et photographier le cerveau une fois enlevé par le diététiste.
- Placer n'importe quelle dura attachée dans un récipient rempli de PFA.
- Séparez le cervelet et le tronc cérébral du cerveau et photographiez le cerveau.
- Identifiez les nerfs optiques, le chiasme et les voies et séparez-les à l'aide d'une sonde et d'une pince à épiler. Reséquez la structure avec un scalpel.
REMARQUE: Le segment distal d'un côté du nerf optique est marqué à l'aide de l'encre Higgins pour l'identification. - Séparez les hémisphères cérébraux longitudinalement et photographiez chaque hémisphère individuellement.
- Encrez le cortex moteur primaire (PMC) pour l'hémisphère gauche, rephotographiez-le et placez-le dans un récipient de 3,3 L pour une fixation à longue fixation. Documentez l'heure de début pour la fixation du cerveau.
- Le PMC pour l'hémisphère droit peut être encré ou excisé.
- En cas d'excisé, retirez d'abord les méninges de couverture.
- Re-photographie encré ou excisée PMC.
- Si le CMP est excisé, couper en 6 sections de taille égale.
- Encrez l'aspect rostral de chaque section.
- Placez les sections impaires dans des contenants remplis de PFA pour une fixation courte.
- Congelez-les les sections numérotées et placez-les dans des sacs de congélation scellés dans des #1 plus frais.
- Couper l'hémisphère droit antérieur à postérieur en sections coronales de 1 cm d'épaisseur.
- Documenter les anomalies brutes (p. ex. la coupe de l'artefact, l'hémorragie et les lésions).
- Placez les sections impaires dans des contenants remplis de PFA pour une fixation courte.
- Congelez-les les sections numérotées et placez-les dans des sacs de congélation scellés.
- Document fin du temps de fixation du cerveau.
- Séparer le tronc cérébral du cervelet et le placer dans un récipient rempli de PFA pour une fixation courte.
- Séparez les hémisphères céréveleux longitudinalement.
- Couper chaque hémisphère en 4 sections sagittales tout aussi épaisses.
- Photographiez des vues médiales et latérales.
- Placer les tranches hémisphériques céréminées gauches dans un récipient rempli de PFA pour une fixation courte.
- Congelez les tranches hémisphériques céréavétaires droites et placez-les dans des sacs de congélation scellés dans des #1 plus frais.
- Obtenir la moelle épinière avec des racines nerveuses du diététiste.
- Retirer la moelle épinière dura mater et stocker le dura dans un récipient avec PFA.
- Séparer les racines nerveuses antérieures et postérieures gauches et droites. Couper les racines nerveuses antérieures et postérieures gauches coupées de la moelle épinière et les placer dans un récipient rempli de PFA pour une fixation courte.
- Couper les bonnes racines nerveuses antérieures et postérieures de la moelle épinière, congeler, les placer dans des sacs de congélation scellés, puis les placer dans des #2 plus frais.
- Photographiez les 20 cm les plus caudales de la moelle épinière. Documenter l'emplacement de l'agrandissement lombaire.
- Couper les sections transversales de 2 cm du cordon qui vont du caudal au rostral.
- Encrez l'aspect rostral de chaque section coupée.
- Placez les sections impaires dans des contenants remplis de PFA pour une fixation courte.
- Congelez les sections numérotées, placez-les dans des sacs de congélation scellés, puis placez-les dans des #2 plus frais.
- Documentez l'heure de début pour la fixation de la moelle épinière et les anomalies grossières.
- Photographiez la partie rostrale restante de la moelle épinière.
- Documenter la position de l'élargissement cervical. Suivez les étapes 2.13.5-2.13.8 pour la moelle épinière restante.
- Après la morgue, placez les tissus congelés dans des boîtes étiquetées dans des congélateurs de -80 oC. Conserver les tissus fixes à 4 oC.
- À 24 h après l'autopsie (jour 2) diluer les 8 % restants PFA à 4%.
- Remplacer 4 % de PFA dans des contenants de fixation par du PFA fraîchement dilué de 4 %.
- À 60 h après l'autopsie préparer des solutions de 2,5% de glutaraldéhyde dans 4% PFA de glutaraldéhyde, PFA, dH2O et tampon Sorenson (préparé par le mélange dans l'ordre: 0,2 M phosphate tampon pH 7.4, polyvinylpyrolidone 1% w/v, saccharose 30% w/v, et l'éthylène glycol 30 % v/v).
- Retirez les PFA usagés de 4 % des contenants à fixation courte.
- Rincez le tissu dans le tampon de Sorenson et placez-le dans une solution de cryoprotection (glycérol 20 %, 0,4 M saïd Sorenson 20 % et 0,02 % d'azide de sodium en dH2O).
- Photographiez des tranches de cerveau à courte durée déterminée, du cervelet, du tronc cérébral et du cortex moteur (le cas échéant).
- Avec une lame de scalpel coupée 2 mm d'épaisseur sections transversales de chaque section de la moelle épinière de 2 cm à court fixe.
- Placer les sections dans des flacons de scintillation de 2 ml et remplir avec une solution de 2,5 % de glutaraldéhyde dans 4 % de PFA.
- Remettre la section restante à la fiole de scintillation originale de 20 ml. Rincer la section avec le tampon de Sorenson et remplacer par une solution cryoprotection.
3. Pathologie
REMARQUE: Les tranches à courte fixe de l'hémisphère droit ainsi que de l'hémisphère gauche à long fixe (placé en PFA à 4 % pendant plusieurs mois) sont soit coupées en sections de 30 m (appelées free-floating) ou intégrées dans de la paraffine et coupées en sections de 12 à 14 m (appelées sections paraffine). Ces sections sont traitées habituellement avec la protéine de protéolipid (PLP) pour détecter des lésions démyélinisantes et le complexe d'histocompatibilité majeur II (MHC-II) pour l'activité immunisée utilisant la méthode de diaminobenzidine (DAB). Ces protocoles ont été standardisés et utilisés dans plusieurs publications2,3,4,5,6,7,8,9 , 10 Ans et plus , 11 Ans, états-unis ( , 12.
-
Free-Floating (30 m) DAB-Avidin-Biotin Complex (ABC) Tissu Staining
- Retirez les sections de la solution de cryostockage, transférez les sections dans une assiette de six puits et lavez-les 3x pendant 5 min chacune dans 2 ml de 1x phosphate tamponné pH 7.0 (PBS). Lors du transfert au puits suivant dans la plaque de six puits utiliser des soins de ne pas déchirer le tissu. Pendant chaque étape de lavage et d'incubation, placez la plaque de six puits sur un shaker et laissez le tissu secouer doucement.
REMARQUE: Les sections de tissus incubées en plus petits volumes et dans de plus grandes plaques (c.-à-d. des plaques de 12 et 24 puits) ont tendance à présenter des déchirures de surface et de bord. - Effectuer la récupération d'antigène par des sections de micro-ondes dans un bécher en verre contenant environ 30 ml de tampon de citrate de 10 mM (pH 6,0). Assurez-vous que les tissus ne sont pas pliés en manipulant avec un pinceau et des sections de micro-ondes pendant 2 à 3 minutes ou jusqu'à ce que le tampon de citrate commence à bouillir. Laisser refroidir les sections à température ambiante (20 min).
- Transférer les sections dans une assiette de six puits et laver les sections 3x pendant 5 min chacune dans 2 ml de PBS/0,3% Triton X-100. Bloquer les peroxidases endogènes en couvant des sections dans 2 ml de 3 % H2O2/0,3 % Triton X-100/PBS pendant 30 min à température ambiante (RT).
- Laver les sections 3x pendant 5 min chacune dans 2 ml de PBS/0,3% Triton X-100. Sections de bloc dans 2 ml de sérum normal de chèvre de 3%/0.3% Triton X-100/1x PBS pendant 1 h à RT.
- Incuber des sections pendant la nuit à 5 jours (selon l'anticorps) dans des anticorps primaires dirigés contre les microglies et les épitopes de myéline pour détecter l'inflammation (MHCII) et la démyélinisation (PLP) (voir le tableau des matériaux)à 4 oC.
REMARQUE: Assurez-vous que les sections ne sont pas pliées lors de l'incubation dans cette étape ou les étapes suivantes, car cela conduira à des zones dans les sections étant vide de tache. - Laver les sections 3x pendant 5 min chacune dans 2 ml de 1x PBS. Ensuite, incuber des sections dans des anticorps biotinylated secondaires (voir le tableau des matériaux) pendant 1 h à RT. Préparer la solution du complexe Avidin-Biotine (ABC) pendant l'incubation environ 45 minutes avant la prochaine étape de lavage pour permettre aux complexes ABC de se former.
- Laver les sections 3x pendant 5 min chacune dans 2 ml de 1x PBS. Puis incuber les sections dans ABC pour 1 h à RT.
- Laver les sections en 2 ml de 1x PBS trois fois pendant 5 min chacune. Incuber les sections dans le DAB filtré (2 mL/puits/section) contenant H2O2 (1:500 dilution de 30 % H2O2 dans DAB) jusqu'à ce que la couleur se développe adéquatement (3 à 8 min).
- Laver les sections 3x pendant 5 min chacune dans 2 ml de 1x PBS. Pour améliorer le signal (facultatif), osmiquer à l'aide de 0,04% OsO4 (30 s).
- Laver les sections trois fois pendant 5 min chacune dans 1x PBS. Individuellement, transférez chaque section de la plaque de six puits à un petit récipient plein de 1x PBS et placez la section de tissu sur une lame de verre aussi plate que possible.
- Soulevez doucement la glissière hors du PBS tout en veillant à ce que la section tissulaire soit aussi plate que possible. À l'aide de deux pinceaux, aplatir délicatement et étirer le tissu sur la glissière et tamponner l'excès d'eau avec du papier essuie-tout. Montez les sections de tissu avec du glycérol (ou un support de montage équivalent) et scellez la couverture avec du vernis à ongles transparent.
- Retirez les sections de la solution de cryostockage, transférez les sections dans une assiette de six puits et lavez-les 3x pendant 5 min chacune dans 2 ml de 1x phosphate tamponné pH 7.0 (PBS). Lors du transfert au puits suivant dans la plaque de six puits utiliser des soins de ne pas déchirer le tissu. Pendant chaque étape de lavage et d'incubation, placez la plaque de six puits sur un shaker et laissez le tissu secouer doucement.
4. Sections hémisphériques intégrées à la paraffine : DAB Staining
- Faire fondre la paraffine des lames dans un four à 60 oC pendant 5 à 10 min.
- Déparaffiniser les sections en couvant en xylène 3x pendant 5 min chacune.
- Réhydrater les tissus dans l'éthanol classé à 100 % (2x pour 5 min chacun), 95 % (2x pour 5 min), 70 % (2x pour 5 min chacun) et 50 % (1x pour 5 min chacun). Couvrez les diapositives dans PBS.
- Antigène récupérer par des diapositives à micro-ondes dans un bécher de 10 mM tampon de citrate (pH 6.0).
- Laver les glissières en 1x PBS (3x pour 5 min chacune) une fois refroidies à température ambiante. Bloquer les peroxidases endogènes en incuber les tissus dans 3 % H2O2/1 % Triton-X 100/PBS pendant 30 min.
- Laver le tissu en 1x PBS trois fois pendant 5 min chacun. Bloquer le tissu avec 6% de sérum de chèvre normal en PBS pendant 1 h.
- Incuber les sections dans l'anticorps primaire (voir le tableau des matériaux) en PBS à température ambiante (RT) pendant la nuit (max 20 h).
- Laver les sections 3x pendant 5 min chacune dans 1x PBS. Ensuite, incuber les sections dans les anticorps secondaires correspondants (voir le tableau des matériaux) en PBS pour 1 h à RT.
- Préparer la solution ABC environ 45 minutes avant la prochaine étape de lavage pendant l'incubation.
- Laver les sections 3x pendant 5 min chacune en 1x PBS, puis incuber en ABC pendant 1 h à RT.
- Laver la section 3x pendant 5 min chacune dans 1x PBS.
- Incuber les sections dans des sections filtrées (taille de pores filtre s'alintquant à 0,45 m) dAB contenant H2O2 (1:500 dilution de 30 % H2O2 en DAB) jusqu'à ce que la couleur se développe adéquatement (3 à 8 min).
- Laver les sections (3x 5 min) en 1x PBS. Pour améliorer le signal, osmicate à l'aide de 0,04% de tétroxyde d'osmium (OsO4; environ 30 s).
- Laver les sections (3x 5min) en 1x PBS.
- Déshydrater les tissus dans une série d'éthanol classé 50 % (1x 5min), 70 % (1x 5min), 95 % (2x 5min), 100 % (2x 5 min) et 100 % xylène (1x 5min). Laisser les xylènes s'évaporer.
- Sections de montage de montage rapide à base de toluène. Des formulations contenant des antioxydants sont recommandées pour prévenir le blanchiment des taches. Retirez l'excès de support des bords de glissière à l'égard d'un rasoir pour un stockage ultérieur.
5. Corrélations IRM/pathologie
REMARQUE: Pour corrélage MRI avec la pathologie, nous effectuons d'abord l'IRM ex vivo de l'hémisphère de cerveau intact à long fixe (étape 2.9 ci-dessus) dans une boîte réglable avec des marqueurs MRI-visibles indiquant des fentes de tranchement. Nous coupons ensuite le cerveau et photographions les tranches de 1 cm pour permettre la co-enregistrement des IRM in situ aux différentes tranches de cerveau. Nous pouvons ensuite effectuer des analyses guidées par IRM, où des régions d'intérêt (IRO) sont identifiées sur l'IRM pour diriger l'analyse des tissus. Nous pouvons également effectuer des analyses guidées par histopathologie, où les IRo sont identifiés sur les tissus (p. ex., lésions de la matière blanche, matière blanche sans démyélinisation, etc.) et se caractérisent ensuite par les mesures d'IRM colocalisées (tableau1).
-
Identification des IA à base d'IRM
NOTE: Dans des études précédentes, nous avons identifié LES ROIs en matière blanche11,12,13,14,15 et la matière grise16,17, 18. L'exemple ci-dessous concerne l'analyse de la matière blanche.- Segment T2 lésions hyperintenses sur IRM in situ (à partir de l'étape 1.1), d'abord traitées par un algorithme automatique, puis corrigées manuellement par des utilisateurs expérimentés.
- Les lésions hypointenses de segment T1 dans les lésions de T2 comme voxels avec une intensité de signal inférieure ou égale à 80% de l'intensité de signal du tissu normal-apparaissant environnant de cerveau.
- Segmentez les zones hypointenses dans les cartes du ratio de transfert de magnétisation (MTR) avec un seuil de 80 %.
- Créez trois classifications à l'aide des segmentations ci-dessus : a) lésions T2 seulement qui sont anormales sur les scans T2-weighted/FLAIR mais normales sur les balayages T1-weighted ou MTR, (b) les lésions T2T1MTR, qui sont anormales sur toutes les tomodensitomes T2/FLAIR, T1-weighted, et MTR scans; c) matière blanche à apparence normale (NAWM), qui sont normales sur tous les scans T2-weighted/FLAIR, T1-weighted, et MTR.
REMARQUE: Notre sélection de tranches est basée sur l'existence des trois types de régions d'intérêt (T2-seulement, T2T1MTR, et NAWM) sur les mêmes tranches. - Calculez des intensités normalisées pour chaque retour sur investissement afin de minimiser la variabilité provenant de différents cerveaux et de différents emplacements cérébraux.
-
Co-enregistrement de l'IRM in situ aux tranches de cerveau
- Scanner l'hémisphère cérébral fixe dans une boîte de découpe personnalisée avec quatre rangées de marqueurs sensibles à l'IRM localisant les fentes où un couteau peut être inséré pour trancher le cerveau. Effectuer une acquisition 3D MPRAGE pondérée par T1 avec une résolution isotropique de 1 mm couvrant le cerveau fixe et tous les marqueurs.
REMARQUE: C'est ce qu'on appelle l'IRM post-fixation et n'est utilisé que comme une étape intermédiaire pour la co-enregistrement des IRM in situ aux tranches de cerveau. - Immédiatement après la numérisation, couper l'hémisphère cérébral dans des fentes situées à 1 cm l'une de l'autre, ce qui donne environ 15 tranches.
- Photographiez les tranches de cerveau sur les deux côtés antérieurs et postérieurs.
- Co-enregistrer l'IRM in situ et des photographies de tranches de cerveau avec les étapes suivantes.
- Pour la segmentation de la post-fixation et in situ MPRAGE, pré-traiter à la fois post-fixation et in situ MPRAGE MRIs pour l'intensité non-uniformité19.
- Segmentez le cerveau et quatre rangées de marqueurs du MPRAGE post-fixation prétraité.
- Segmentez l'hémisphère correspondant à l'IRM post-fixation20,21 du MPRAGE in situ pré-traité.
- Co-enregistrer les IRM in situ et post-fixation extraites du cerveau par le biais d'une série de processus d'enregistrement linéaire jusqu'à 12 degrés de liberté (enregistrement d'affine) à l'aide de FSL FLIRT22. Les composants de mise à l'échelle et de tonte expliquent l'effet du rétrécissement de fixation.
- Trouvez la direction normale du plan de découpe en minimisant la somme des intensités maximales projetées à l'aide des marqueurs segmentés. Ces angles de réorientation sont incorporés dans la matrice de transformation obtenue à partir de l'étape précédente.
- Associez visuellement des images IRM à des photographies de tranches de cerveau postérieures fixes à l'aide d'une visionneuse d'images interne qui permet de modifier la profondeur et l'orientation des vecteurs normaux. De petites modifications sont nécessaires parce que le crin age est imparfait.
- Appliquer la transformation de l'image AFFINE13 pour chaque tranche afin de transformer les IRM in situ en mêmes endroits de tranchage que les photographies des tranches de cerveau.
- Pour la segmentation de la post-fixation et in situ MPRAGE, pré-traiter à la fois post-fixation et in situ MPRAGE MRIs pour l'intensité non-uniformité19.
- Scanner l'hémisphère cérébral fixe dans une boîte de découpe personnalisée avec quatre rangées de marqueurs sensibles à l'IRM localisant les fentes où un couteau peut être inséré pour trancher le cerveau. Effectuer une acquisition 3D MPRAGE pondérée par T1 avec une résolution isotropique de 1 mm couvrant le cerveau fixe et tous les marqueurs.
Résultats
Comme mentionné ci-dessus, près de la moitié de l'hémisphère cérébral est congelé et disponible pour des études moléculaires utilisant l'ADN, l'ARN ou la protéine. Historiquement, les études utilisant les tissus cérébraux post-mortem ont été montrées pour être affectées par des conditions prémortem, l'âge, le sexe, le pH de tissu, l'intégrité d'ARNm (RIN), l'intervalle post mortem (PMI), la certitude diagnostique, l'utilisation de substances comorbides, et le traitement médicamenteux antérieur statut23. Basé sur des études utilisant des tissus cérébraux, l'ADN et les protéines semblent être affectés dans une moindre mesure par rapport à l'ARN. D'après notre expérience, l'isolement de l'ARN et l'analyse en aval se sont toutefois avérés les plus touchés par les conditions pré-mortem et l'intervalle post-mortem du tissu cérébral. Nous discutons donc de certaines des conditions à suivre pour effectuer l'analyse basée sur l'ARN à l'aide de tissus post mortem de la SP.
Pour toutes nos études, après que le cerveau soit recueilli à l'autopsie, il est tranché (1 cm d'épaisseur) puis soit fixé en 4% de paraformaldéhyde pour des études morphologiques ou rapidement congelé pour l'analyse biochimique. Tous les blocs de tissu sont caractérisés pour la démyélinisation par immunostaining utilisant PLP comme décrit ci-dessus. Un système d'analyse représentatif est indiqué à la figure 1. Les sections tissulaires sont examinées pour déterminer la présence de lésions de la matière blanche (figure 1A). Les régions sélectionnées sont tachées pour l'activité immunitaire (figure 1B) et la démyélinisation (figure 1C). Le tissu congelé est monté sur le cryostat (Figure 1D) et les sections congelées de 30 m sont coupées. Elle est suivie d'une collecte de 3 à 4 sections subséquentes, de la séparation des tissus adjacents et du stockage de l'ADN, de l'ARN ou de l'isolement des protéines. En utilisant ce protocole, nous avons réussi à isoler l'ADN24,25, ARN5,6,7,8,9 ainsi que des protéines26. Tandis que les résultats principaux de quelques-unes des études analysant l'ARN des cerveaux de SP sont discutés, voici quelques-unes des issues liées à l'analyse des cerveaux post mortem de SP d'ARN.
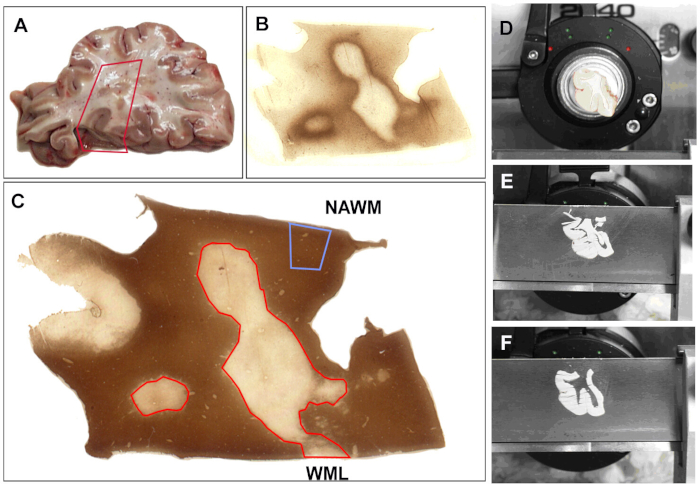
Figure 1 : Collecte d'échantillons pour l'analyse de l'ARNm. (A) Le tissu d'autopsie est sélectionné pour l'analyse. Des zones de tissu sont sélectionnées et une partie du tissu est excisée. Toutes les sections sont tachées d'anticorps de (B) MHC-II (Complexe d'histocompatibilité majeure (MHC) classe II HLA-DR CR3/43) pour détecter l'activité inflammatoire et avec (C) protéine protéolipidique (PLP) pour déterminer l'état de la myéline à l'aide de protocoles publiés. Basé sur le statut de myéline, le bloc est marqué par un scalpel (D). Les sections (60 m) sont coupées (E) et les zones qui ont déjà été notées sont enlevées, séparées en tubes et étiquetées (F). Les taches de PLP et de MHC-II sont répétées après toutes les 5 sections afin d'assurer une bonne collecte des tissus. La matière blanche apparaissant normale (NAWM) est notée et les lésions de matière blanche (WML) sont décrites en rouge. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Transection axonale dans les lésions de MS10. Un accent scientifique initial de ce programme était sur la caractérisation des composants cellulaires des lésions de white-matter démyélinisées. Parmi les antigènes localisés se trouvait les neurofilaments non phosphorylés (NF). La plupart des FN sont phosphorylés dans des axones myélinisés. Lors de la démyélinisation, les axones sont déphosphorylés. Nous avons détecté l'expression prévue des NF non phosphorylated dans les axones demyelinated. Dans les lésions aigues de SP, beaucoup de ces axones démyélinisés se sont terminées comme ampoules de rétraction axonal (Figure 2A), qui reflètent les extrémités proximales des axones transécutés. Les axones transectés dépassent 11 000 mm3 dans les lésions aigues par rapport aux régions normales adjacentes10. Ces observations ont contribué à catalyser un changement de paradigme dans la recherche sur la SP qui a poussé le domaine vers la caractérisation de la neurodégénérescence comme la principale cause d'incapacité neurologique permanente chez les personnes atteintes de SP.
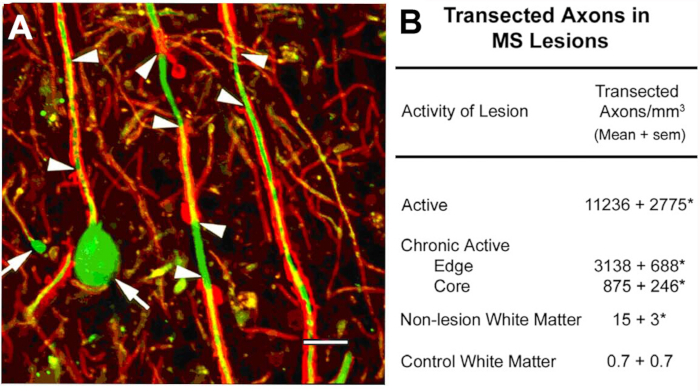
Figure 2 : Transection axonale pendant la démyélinisation inflammatoire. La transection axonale se produit pendant la démyélinisation inflammatoire (A, pointes de flèche) et induit la formation d'ovoïdes axonaux terminaux (A, flèches). Lorsqu'ils sont quantifiés (B), les axones transectés sont abondants dans les lésions de SP et semblent être en corrélation avec l'activité inflammatoire de la lésion. Panneau A reproduit à partir de Trapp et al.10 avec permission. Rouge : protéine protéolipidique, vert : Neurofilament anti-non phosphorylated. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Remyélinisation dans les cerveaux chroniques de SP3. La remyélinisation peut être robuste pendant les premiers stades de la SP. Beaucoup de lésions chroniques de SP, cependant, ne sont pas remyelinated. Nous avons étudié si la présence des cellules progénitrices d'oligodendrocyte (OPCs) ou la génération de nouveaux oligodendrocytes limite la remyélinisation des lésions chroniquement démyélinées de white-matière. Tandis que la densité d'OPC était souvent diminuée, ellesétaient présentes dans toutes les lésions chroniquement démyélinisés 3. Les oligodendrocytes nouvellement produits étaient également présents dans beaucoup de lésions chroniques de SP. Processus d'oligodendrocytes associés aux axones démyélinisés myélinisés, mais n'ont pas myélinisé (figure 3). Ces études indiquent que les CPVP et leur capacité à produire de nouveaux oligodendrocytes ne limitent pas la remyélinisation des lésions chroniques de la matière blanche. Nous avons émis l'hypothèse que les axones chroniquement démyélinisés, qui semblaient souvent dystrophiques, n'étaient pas réceptifs à la remyélinisation par les oligodendrocytes nouvellement produits.
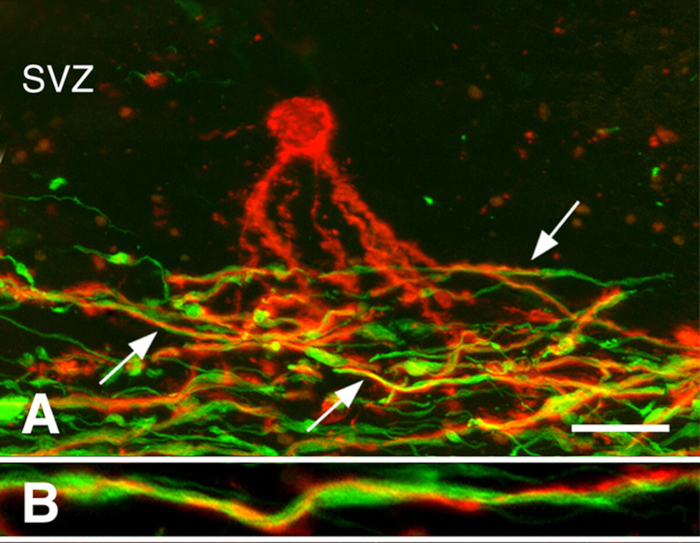
Figure 3 : Processus d'oligodendrocytes prémyélinés associés aux axones. Des micrographies confocales de lésions de SP tachées d'anticorps PLP (rouges dans les panneaux A, B) et d'anticorps neurofilament (verts dans les panneaux A, B) sont montrées. Un oligodendrocyte prémyélinisé (rouge dans le panneau A) dans la zone sous-ventriculaire (ZVS) a étendu les processus dans la région des axones démyélinisés (vert dans le panneau A) dans une lésion chronique de SP. Bon nombre de ces processus (flèches du panneau A) se sont enivrés autour des axones, comme le montre un grossissement plus élevé (panneau B). Les barres d'échelle représentent 20 m (A) et 5 m (B). Reproduit à partir de Chang et coll.3 avec la permission. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Dysfonctionnement mitochondrial dans MS6. Nous avons effectué une recherche impartiale pour les changements neuronaux de gène dans le cortex moteur rapidement gelé obtenu des patients chroniques de MilliSeconde (figure 4A). Une recherche impartiale de cet ensemble de données a permis d'identifier des réductions significatives de 23 ARNm mitochondriales codés par le nucléaire dans la SP (figure 4B). Des études d'identification utilisant l'immunocytochimie et l'hybridation in situ ont indiqué que ces gènes étaient fortement enrichis dans les neurones de projection corticale (figure 4C) et que les mitochondries isolées des axones de projection montrent la glycolyse réduite ( Figure 4D). Cet article a catalysé un foyer sur le dysfonctionnement mitochondrial et a réduit la production d'ATP en tant que contribuant important à la dégénérescence axonale dans la sP.
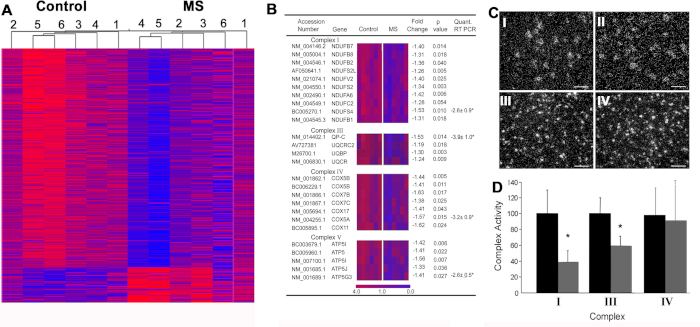
Figure 4 : Données sur microréseaux et techniques de validation en aval effectuées dans le cortex moteur de la SP. (A) Regroupement hiérarchique de transcriptions significativement modifiées provenant d'échantillons de cortex moteur de contrôle (C1-C6) et de SPMS (MS1-MS6), soutenant séparément les modèles d'expression génique liés à la maladie. Parmi les transcriptions diminuées dans le cortex moteur de La SP, vingt-six appartenaient à la chaîne de transport d'électrons (B). L'ARNm du complexe mitochondrial I (NDUFA6) a été diminué dans les neurones (n - 55-130) dans le cortex moteur de la SP (CII) par rapport au contrôle (CI), tandis que les densités d'ARNm PLP étaient similaires entre le contrôle (CIII) et le cortex cérébral De SP (CIV). L'activité des complexes de transport d'électrons I et III a été diminuée dans les fractions mitochondriales-enrichies du cortex moteur des patients de MilliS (n - 3) (D). Réimprimé de Dutta et coll.6 avec la permission. Les barres d'erreur représentent SEM; La barre d'échelle dans CI-IV est de 25 m. 'p 'lt; 0.05 Students's t-test. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Pathogenèse du dysfonctionnement cognitif dans MS8. Quarante à 60 % des patients atteints de SP ont un déclin cognitif et une fonction exécutive réduite. Nous avons identifié l'hippocampe, qui est un site fonctionnel de mémoire/apprentissage, comme un site commun pour la démyélinisation dans la SP. Nous avons ensuite comparé l'expression neuronale de gène dans l'hippocampi myélinisé et demyelinated et avons trouvé des réductions significatives dans les MRNAs neuronales codant des protéines impliquées dans la mémoire/l'apprentissage. Nous avons étendu ces données en démontrant que certains microARN sont augmentés dans l'hippocampe démyélinisé et que ces microARN peuvent diminuer l'expression des récepteurs de glutamate. Nous avons reproduit et étendu ces observations dans des modèles de rongeurs. Nous avons ensuite comparé l'expression neuronale de gène dans l'hippocampi myélinisé et demyelinated et avons trouvé des réductions significatives dans les protéines d'encodage neuronal d'ARNm impliquées dans la mémoire/apprentissage.
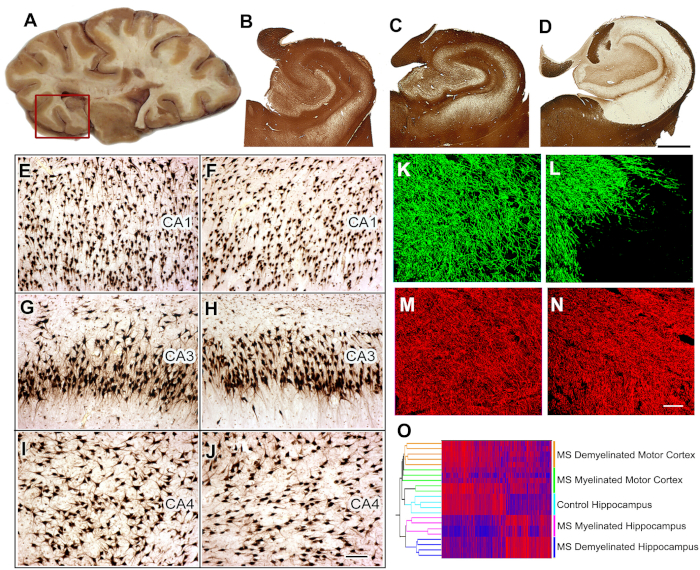
Figure 5 : Collection de tissus, analyse histologique et études d'expression génique dans l'hippocampe de la SP. Les tranches de cerveau contenant l'hippocampe sont sélectionnées pendant l'autopsie (A) et l'hippocampe et la région voisine sont enlevés (boîte rouge) pour une analyse plus approfondie. Immunostaining pour PLP a montré la préservation de la myéline dans tous les témoins (B) et 40% de MS hippocampi (C). Une démyélinisation étendue a été détectée chez 60 % des hippocampes de la SP (D). Par rapport au contrôle hippocampi (E, G, I), perte neuronale significative n'a pas été détectée dans les régions CA1, CA3, ou CA4 de l'hippocampe de la SP demyelinated (F, H, J) comme le montre l'immunohistochimie HuR. L'immunofluorescence à double étiquetage de la myéline (protéine de base de la myéline (MBP), verte) et des axones (SMI32, rouge) a montré une perte de myéline (L) avec une conservation relative des axones (N) dans l'hippocampe demyelinated MS par rapport à l'hippocampe témoin ( MBP, K; SMI32, M). Le double regroupement des niveaux d'expression de l'ARNm a disposé des échantillons en grappes discrètes en fonction de l'état de la myéline (myélinisé et démyélinisé) et de l'emplacement (hippocampe vs cortex moteur) (O). Les niveaux élevés d'ARNm sont indiqués par le rouge et le bleu dénote de faibles niveaux d'expression. Panneaux C-O Adapté de Dutta et coll.8 avec permission. B-D: 2 mm, E-J: 100 m, K-N: 50 m. S'il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
Les corrélations pathologiques des changements d'IRM12. Tandis que MRI est un indicateur évalué du diagnostic de SP et de la réponse au traitement, et est également un prédicteur de la progression de la maladie de SP, les corrélations pathologiques des changements de MRI sont mal comprises. Nos études d'IRM post mortem se sont concentrées sur deux IRM. Les ROIs de matière blanche cérébrale qui étaient seulement T2 hyperintense (T2 seulement) et ROIs qui ont eu une combinaison de l'hypointensité de T1, de l'hyperintensité de T2, et du rapport réduit de transfert de magnétisation (MTR) (T2T1MTR). Environ 45 % des ROI de matière blanche cérébrale T2-seulement étaient myélinisés, confirmant leur nature non spécifique. En revanche, 83 % des IA T2T1MTR étaient chroniquement démyélinisées et apparaissaient comme des trous noirs. Les valeurs T1 et MTR sont semi-quantitatives et leurs valeurs varient considérablement dans les ROC T2T1MTR. Si la perte de myéline est le seul contributeur à ces changements IRM, alors les valeurs doivent être constantes. Les axones démyélinisés gonflés se sont corrélés avec les valeurs t1 et MTR.
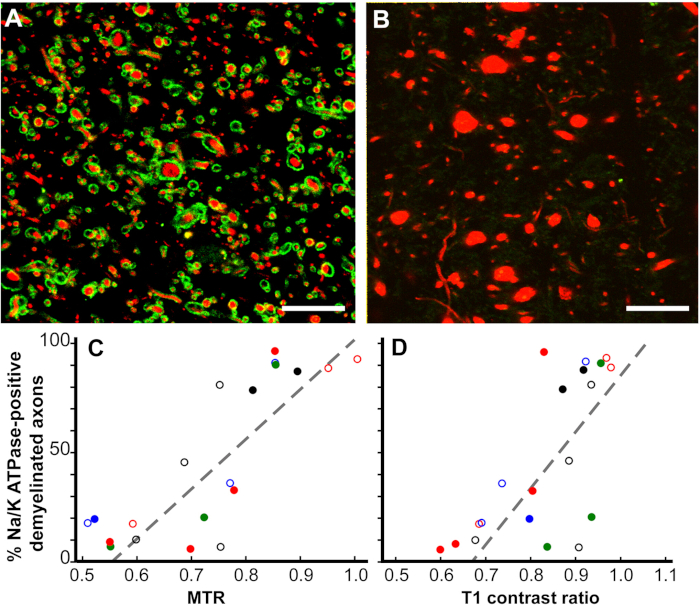
Figure 6 : Les ratios de transfert de magnétisation (MTR) et lesratios de contraste T1 se corrèlent linéairement avec le pourcentage d'axones positifs atPase de Na /K dans les lésions chroniques de La SP. Les lésions chroniquement démyélinisés tachées pour Na/Ket ATPase (vert) variaient de près de 100% (A) à zéro (B) dans le neurofilament (rouge). Beaucoup d'axonessans Na /Ket ATPase avaient des diamètres accrus (B). Une comparaison du pourcentaged'axones positifs atPase de Na /Kdans les lésions de SP chroniquement démyélinisés corrélées avec les ratios de contraste post mortem quantitatifs (p 'lt; 0.0001, C) et T1 ' Chaque point de données provient d'une lésion unique et chaque combinaison color-symbole unique désigne l'un des cerveaux étudiés. Barres d'écailles de 5 m. Reproduite à partir de Young et al.12 avec permission. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Neurodégénérescence indépendante de la démyélinisation11. Historiquement, la neurodégénérescence dans la SP a été pensé pour résulter de la démyélinisation. Les études d'imagerie cérébrale, cependant, ont soulevé la possibilité que la neurodégénérescence et la démyélinisation peuvent être des événements indépendants. Nous avons récemment identifié une sous-population de patients atteints de SP qui ont la démyélinisation de la moelle épinière et du cortex cérébral, mais pas de la matière blanche cérébrale. Nous avons inventé ce sous-type de SP comme SP myélocortical (MCMS). Les cas de MCMS ont fourni une plate-forme pour étudier la relation entre la démyélinisation de white-matière cérébrale et la perte neuronale corticale. Comparé aux cortices de contrôle, la perte neuronale corticale était sensiblement plus grande dans les cortices de MCMS que dans les cortices typiques de MS. Le tissu de cerveau de contrôle a été obtenu du département de pathologie à la clinique de Cleveland. Cette étude fournit la première preuve pathologique pour la neurodégénérescence en l'absence de démyélinisation.
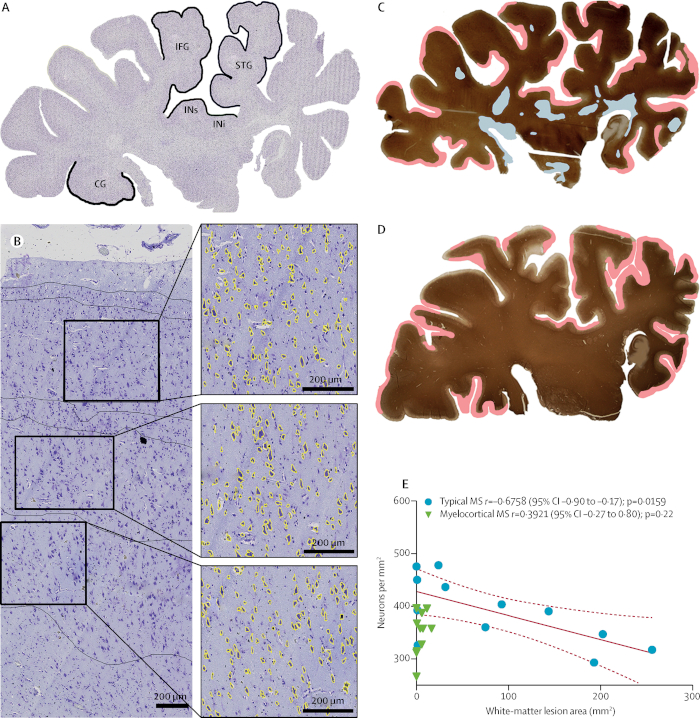
Figure 7 : Perte neuronale en l'absence de démyélinisation cérébrale de la matière blanche. Une césarienne violette tachée de l'hémisphérique coronal d'un individu classé comme ayant la SP typique (A). Des densités neuronales ont été comparées dans les couches corticales III, V, et VI dans chacune des cinq zones étiquetées. Les neurones dont la superficie est supérieure à 60 m2 (jaune) sont représentés dans une image représentative du cortex temporel supérieur (B). Étiquetage pour PLP et distribution de lésions démyélinisées (la démyélinisation de la matière blanche est mise en évidence en bleu; la démyélinisation subpiale est mise en évidence en rose) dans les sections hémisphériques des individus atteints de SP typique (C) et de SP myélocortical (D ) sont affichés. Une corrélation significative entre la densité neuronale corticale réduite et le volume accru de lésion de la matière blanche cérébrale a été trouvée dans la SP typique, mais pas dans la SP myélocorticale (E); les lignes pointillées indiquent un intervalle de confiance de 95 % (IC). IFG - gyrus frontal inférieur. STG - gyrus temporel supérieur. INi - insula inférieure. INs - insula supérieur. CG - gyrus cingulaire. Reproduit à partir de Trapp et al.11 avec la permission. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
| Durée de la séquence | Description de la séquence | Utilisation de séquence |
| 0:09 | Localizer | Localisation pour les séquences suivantes |
| 9h14 | Magnetisation 3D préparée écho de gradient rapide (MPRAGE) | Estimation volumétrique d'imagerie structurale des structures cérébrales |
| 5:14 | Récupération d'inversion atténuée 3D Fluide (FLAIR) | Identification des lésions Segmentation La ciénion Évaluation des lésions volumétriques |
| 2:35 | 2D T2 pondéré | Identification des lésions Segmentation La ciénion Évaluation des lésions volumétriques |
| 5:12 | Écho 3D dégradé rappelé avec transfert de magnétisation pré-impulsion , (MT-ON) | Mesure présumée de la teneur en myéline dans le tissu normal apparaissant et lesional |
| 5:12 | Écho 3D dégradé-rappelé sans transfert de magnétisation pré-impulsion , (MT-OFF) | |
| 0:27 | Diffusion Tensor Imaging (DTI) cartographie de terrain | Mesure de la diffusion de l'eau dans les tissus cérébraux pensé pour refléter l'intégrité des tissus cérébraux. |
| 10h27 | Diffusion Tensor Imaging (DTI) multi-coquille | |
| 13h18 | Diffusion Tensor Imaging (DTI) multi-coquille | |
| 39:48:00 | SOUS-TOTAL: NOYAU |
Tableau 1 : Protocole d'imagerie post mortem.
Discussion
Nous décrivons un protocole qui a été utilisé pour obtenir et traiter rapidement les tissus de plus de 150 personnes atteintes de SP. Une caractéristique importante de ce protocole est que les scientifiques qui utilisent le tissu sont également en charge d'établir le protocole et d'effectuer la collecte des tissus. Cela permet de répondre aux besoins scientifiques des projets de recherche individuels. Plusieurs aspects de ce protocole améliorent son utilité. Les patients sont généralement bien caractérisés avant la mort, comme beaucoup d'entre eux ont été suivis par des neurologues à notre centre. Une étape critique est le traitement des dons de tissus peu de temps après la mort, ce qui augmente la qualité du tissu congelé par rapport à certaines autres banques de cerveau. Cela permet des études moléculaires qui sont d'une grande valeur dans la description des changements dans les produits géniques transcriptionnels et translationnels, qui sont essentiels pour la justification des observations histologiques et immunocytochimiques. L'exploitation des données morphologiques/immunocytochimiques et moléculaires dans de multiples cas améliore la fiabilité des conclusions. Ceci est le mieux illustré par notre description des changements de gène mitochondrial dans le cortex cérébral et les changements neuronaux de gène dans l'hippocampi demyelinated. De nouveaux protocoles de profilage génétique sont en cours de développement à un rythme rapide et le tissu congelé dans notre banque devrait fournir de l'ARN de haute qualité pour l'analyse des tissus et des cellules individuelles.
Un autre aspect précieux de notre protocole est les tranches de cerveau à court fixe. Ces tissus sont coupés en sections flottantes de 30 m d'épaisseur. Ces sections sont idéales pour l'utilisation de la microscopie confocale pour analyser deux ou plusieurs antigènes en trois dimensions. Les bons exemples incluent l'interaction des processus prémyélinéins d'oligodendrocyte avec des axones dystrophiques dans les lésions chroniques de MS, aussi bien que l'identification des raccordements axonaux simples aux ampoules de rétraction axonale transectées. Cela contraste avec l'utilisation systématique de sections de paraffine de 7 m d'épaisseur, où les images 3D ne sont pas réalisables. Les tissus incorporés à la paraffine ont une grande valeur pour certaines questions, en particulier la quantification des densités neuronales dans les sections hémisphériques de 7 m d'épaisseur. Nos protocoles de traitement des tissus sont donc diversifiés et offrent une flexibilité pour assurer des tissus fixes et rapidement congelés.
Une autre caractéristique unique de notre protocole est l'IRM du cerveau in situ post mortem. Les IRM cérébrales sont un biomarqueur irremplaçable de la sP. Il est donc essentiel d'établir les corrélations pathologiques des signaux d'IRM anormaux. Nos études ont établi que les DEUX T2 seulement et les ROI T2T1MTR sont souvent myélinisés. Cette conclusion soutient la nécessité de modalités d'imagerie plus spécifiques qui distinguent de façon fiable entre la matière blanche cérébrale myélinisée et demyelinated. MrI semble être sensible pour la détection de la myéline, mais nos études démontrent que même une combinaison de T1/T2/MTR n'est pas spécifique pour identifier la myélinisation. Notre protocole post mortem fournit une plate-forme idéale pour tester la capacité de nouvelles modalités d'imagerie à distinguer entre la matière blanche cérébrale myélinisée et la matière blanche cérébrale démyélinisée. L'IRM fournit également le véhicule idéal pour la traduction des résultats scientifiques de base dans la pratique clinique, étant donné l'utilisation de l'IRM dans notre recherche translationnelle et son utilisation clinique répandue chez les patients vivants.
Bien que la coupe de tranches courtes et longues ainsi que les tranches congelées offre un avantage pour le traitement des tissus dans plusieurs modes pour différentes études, il ya quelques limites avec cette méthode. L'évaluation de l'ensemble d'une structure peut être limitée, car certaines parties peuvent être traitées différemment sur des tranches adjacentes. Le grand volume de la banque de tissus, cependant, offre la possibilité d'étudier une structure d'intérêt dans plusieurs sujets pour améliorer l'échantillonnage. Une autre limitation générale aux études utilisant des tissus post mortem est qu'ils sont transversaux. Les conclusions concernant le moment et la progression des changements doivent être interprétées dans ce contexte. Il peut y avoir un biais de sélection pour les patients qui font don de leurs tissus, ce qui peut limiter la généralisation des données à tous les patients atteints de SP. Puisque la plupart des donneurs meurent des complications de la SP avancée, il peut ne pas être approprié d'extrapoler les résultats de ces patients à ceux des stades précoces de la SP. Néanmoins, nous avons reçu des tissus de patients plus jeunes qui sont morts de maladies non liées à la SP (c.-à-d. infarctus aigu du myocarde, surdose de drogue, suicide). La portée de notre protocole n'inclut pas l'échantillonnage d'autres organes (p. ex. gastro-intestinaux et moelle osseuse) qui ont été impliqués dans la SP. Nous croyons que les forces du programme l'emportent largement sur ses limites.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d'intérêts.
Remerciements
Les auteurs tient également à remercier le Dr Christopher Nelson pour son aide éditoriale. Le programme d'autopsie est soutenu en partie par la subvention R35 NS097303 à BDT. Le travail dans le laboratoire de RD est soutenu par des subventions de NINDS (NS096148) et de la National Multiple Sclerosis Society, USA (RG 5298).
matériels
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| Biotinylated goat anti-mouse IgG | Vector Laboratories | BA-9200 | 1:500 dilution for hemispheric; 1:1,000 for 30µm free-floating. RRID: AB_2336171 |
| Biotinylated goat anti-rabbit IgG | Vector Laboratories | BA-1000 | 1:500 dilution. |
| Biotinylated goat anti-rat IgG | Vector Laboratories | BA-9400 | 1:500 dilution for hemispheric; 1:1,000 for 30µm free-floating. RRID: AB_2336208 |
| Glial fibrillary acid protein (GFAP) | Dako | Z0334 | 1:700 dilution for hemispheric. RRID: AB_10013382 |
| HuR, mouse IgG, 3A2 clone | Santa Cruz | SC-5261 | 1:500 for 30µm free floating. RRID: AB_627770 |
| Major histocompatibility complex (MHC) class II HLA-DR CR3/43 | Dako | Mo746 | 1:250 dilution for hemispheric; 1:500 for 30 µm free floating. RRID: AB_2313661 |
| Non-phosphorylated neurofilament (SMI32) | Biolegend | 801701 | 1:5,000 dilution for hemispheric; 1:2,500 for 30 µm free-floating. RRID: AB_2564642 |
| Phosphorylated neurofilament (SMI31) | Biolegend | 801601 | 1:5,000 dilution for hemispheric; 1:2,500 for 30 µm free-floating. RRID: AB_2564641 |
| Proteolipid protein (PLP) | Gift from Wendy Macklin | 1:250 dilution for IHC; alternative anti-PLP antibodies commercially available. | |
| Reagents | |||
| 125 mm filter paper | Whatman | 1452-125 | For filtering PFA. |
| 50% Glutaraldehyde | Electron Microscopy Sciences | 16320 | Electron microscopy grade. |
| Cytoseal | ThermoScientific | 8310-16 | |
| Ethylene glycol | Fisher Chemical | BP230-4 | |
| Glycerol | Sigma-Aldrich | G7893 | 400 mL/2 L Cryoprotection solution. |
| Millex-HV Syringe Filter Unit, 0.45 µm, PVDF, 33 mm, gamma sterilized | Millipore-Sigma | SLHV033RB | |
| Paraformaldehyde | Electron Microscopy Sciences | 19200 | Prills form. |
| Polyvinylpyrolidone (PVP-40) | Fisher Chemical | BP220-212 | |
| Sodium azide | Fisher Chemical | S227I | 2 g/2 L Sorenson's buffer. |
| Sodium phosphate dibasic | Sigma-Aldrich | S0876 | 98.8 g/2 L Sorenson's buffer. |
| Sodium phosphate mono basic monohydrate | Sigma-Aldrich | S9638 | 14.352 g/2 L Sorenson's buffer. |
| Sucrose | Sigma-Aldrich | PVP40-500G | |
| VectaStain ABC Kit | Vector Laboratories | PK-6100 | 1:1,000 dilution of A and B. RRID: AB_2336819 |
| Waterproof drawing black ink | Higgins | 44201 | |
| Xylene | Fisher Chemical | X3S | Histological grade. |
| Equipment | |||
| 3T MRI Magnetom Prisma | Siemens Healthineers | ||
| 7T MRI Agilent 830AS | Siemens Healthineers |
Références
- Trapp, B. D., Nave, K. A. Multiple sclerosis: an immune or neurodegenerative disorder?. Annual Review of Neuroscience. 31, 247-269 (2008).
- Chang, A., Nishiyama, A., Peterson, J., Prineas, J., Trapp, B. D. NG2-positive oligodendrocyte progenitor cells in adult human brain and multiple sclerosis lesions. Journal of Neuroscience. 20, 6404-6412 (2000).
- Chang, A., Tourtellotte, W. W., Rudick, R., Trapp, B. D. Premyelinating oligodendrocytes in chronic lesions of multiple sclerosis. New England Journal of Medicine. 346, 165-173 (2002).
- Chang, A., et al. Neurogenesis in the chronic lesions of multiple sclerosis. Brain. 131, 2366-2375 (2008).
- Chang, A., et al. Cortical remyelination: A new target for repair therapies in multiple sclerosis. Annals of Neurology. 72, 918-926 (2012).
- Dutta, R., et al. Mitochondrial dysfunction as a cause of axonal degeneration in multiple sclerosis patients. Annals of Neurology. 59, 478-489 (2006).
- Dutta, R., et al. Activation of the ciliary neurotrophic factor (CNTF) signalling pathway in cortical neurons of multiple sclerosis patients. Brain. 130, 2566-2576 (2007).
- Dutta, R., et al. Demyelination causes synaptic alterations in hippocampi from multiple sclerosis patients. Annals of Neurology. 69, 445-454 (2011).
- Dutta, R., et al. Hippocampal demyelination and memory dysfunction are associated with increased levels of the neuronal microRNA miR-124 and reduced AMPA receptors. Annals of Neurology. 73, 637-645 (2013).
- Trapp, B. D., et al. Axonal transection in the lesions of multiple sclerosis. New England Journal of Medicine. 338, 278-285 (1998).
- Trapp, B. D., et al. Cortical neuronal densities and cerebral white matter demyelination in multiple sclerosis: a retrospective study. Lancet Neurology. 17, 870-884 (2018).
- Young, E. A., et al. Imaging correlates of decreased axonal Na+/K+ ATPase in chronic multiple sclerosis lesions. Annals of Neurology. 63, 428-435 (2008).
- Fisher, E., et al. Imaging correlates of axonal swelling in chronic multiple sclerosis brains. Annals of Neurology. 62, 219-228 (2007).
- Moll, N. M., et al. Imaging correlates of leukocyte accumulation and CXCR4/CXCL12 in multiple sclerosis. Archieves of Neurology. 66, 44-53 (2009).
- Moll, N. M., et al. Multiple sclerosis normal-appearing white matter: pathology-imaging correlations. Annals of Neurology. 70, 764-773 (2011).
- Nakamura, K., Chen, J. T., Ontaneda, D., Fox, R. J., Trapp, B. D. T1-/T2-weighted ratio differs in demyelinated cortex in multiple sclerosis. Annals of Neurology. 82, 635-639 (2017).
- Chen, J. T., et al. Clinically feasible MTR is sensitive to cortical demyelination in MS. Neurology. 80, 246-252 (2013).
- Nakamura, K., Fox, R., Fisher, E. CLADA: cortical longitudinal atrophy detection algorithm. Neuroimage. 54, 278-289 (2011).
- Sled, J. G., Zijdenbos, A. P., Evans, A. C. A nonparametric method for automatic correction of intensity nonuniformity in MRI data. IEEE Transactions of Medical imaging. 17, 87-97 (1998).
- Fisher, E., Cothren, J. R. M., Tkach, J. A., Masaryk, T. J., Cornhill, J. F. Knowledge-based 3D segmentation of the brain in MR images for quantitative multiple sclerosis lesion tracking. Proc. SPIE 3034, Medical Imaging. , 19-25 (1997).
- Avants, B. B., Epstein, C. L., Grossman, M., Gee, J. C. Symmetric diffeomorphic image registration with cross-correlation: evaluating automated labeling of elderly and neurodegenerative brain. Medical Image Analysis. 12, 26-41 (2008).
- Jenkinson, M., Bannister, P., Brady, M., Smith, S. Improved optimization for the robust and accurate linear registration and motion correction of brain images. Neuroimage. 17, 825-841 (2002).
- Lewis, D. A. The human brain revisited: opportunities and challenges in postmortem studies of psychiatric disorders. Neuropsychopharmacology. 26, 143-154 (2002).
- Chomyk, A. M., et al. DNA methylation in demyelinated multiple sclerosis hippocampus. Scientific Reports. 7, 8696 (2017).
- Huynh, J. L., et al. Epigenome-wide differences in pathology-free regions of multiple sclerosis brains. Nature Neuroscience. , (2014).
- Ishii, A., et al. Human myelin proteome and comparative analysis with mouse myelin. Proceedings of the National Academy of Sciences. U. S. A. 106, 14605-14610 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon