このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ヘッドスペースガスクロマトグラフィーを用いたゼブラフィッシュ胚におけるエタノール濃度の定量
要約
この研究は、適切な暴露方法から胚処理およびエタノール分析へのヘッドスペースガスクロマトグラフィーを用いてゼブラフィッシュ胚のエタノールレベルを定量化するプロトコルを記述する。
要約
胎児アルコールスペクトル障害(FASD)は、顔面変形および神経障害を含むエタノール誘発発達欠陥の非常に可変的な連続体を記述する。複雑な病理を持つFASDは、毎年米国で生まれた約100人に1人の子供に影響を与えます。FASDの非常に可変的な性質のために、動物モデルはエタノール誘発開発欠陥の私達の現在の機械論的理解の重大な証明された。ゼブラフィッシュを使ってエタノールによる発達欠陥を調べることに焦点を当てた研究室が増えています。ゼブラフィッシュは、外部受精、遺伝的に引っ張り可能な半透明の胚を多数産生する。これにより、研究者は複数の遺伝的文脈でエタノール暴露のタイミングと投与量を正確に制御し、ライブイメージング技術を通じて胚性エタノール暴露の影響を定量化することができます。これは、遺伝学とヒトとの発達の両方の高度な保全と相まって、ゼブラフィッシュがエタノール催奇性の機械学的基礎を研究する強力なモデルであることが証明されている。しかし、エタノール暴露レジメンは、これらの研究全体でゼブラフィッシュデータの解釈を混乱させている異なるゼブラフィッシュ研究の間で変化している。ここでは、ヘッドスペースガスクロマトグラフィーを用いてゼブラフィッシュ胚のエタノール濃度を定量するプロトコルを示します。
概要
胎児アルコールスペクトル障害(FASD)は、胚性エタノール暴露1に関連する幅広い神経障害および頭蓋顔面異形について説明する。エタノール暴露および遺伝的背景のタイミングと投与量を含む複数の要因は、FASD2、3の変動に寄与する。人間では、これらの変数の複雑な関係は、FASDの病因を研究し、理解することは困難です。動物モデルは、エタノール催奇形性の機械論的基礎に関する我々の理解を深める上で極めて重要であることが証明されている。多種多様な動物モデルシステムがFASDの複数の側面を研究するために使用されており、結果はヒト4の暴露に見られるものと著しく一致している。げっ歯類モデルシステムは、マウスが最も一般的な5、6、7である、FASDの多くの側面を調べるために使用されます。この研究の大半は、初期エタノール暴露8に対する発達欠陥に焦点を当てているが、エタノールへの後の暴露は、同様に9の発達異常を引き起こすことが示されている。さらに、マウスの遺伝的能力は、FASD10,11の遺伝的基盤を調査する能力に大いに役立っています。マウスにおけるこれらの研究は、ソニックヘッジホッグ経路との遺伝子エタノール相互作用があることを強く示唆しています, レチノイン酸シグナル伝達,スーパーオキシドジスムターゼ, 一酸化窒素シンターゼI, Aldh2とFancd28,10, 11,12,13,14,15,16,17,18, 19,20,21.これらの研究は、動物モデルがFASDとその根本的なメカニズムに関する我々の理解を進めるために重要であることを示している。
ゼブラフィッシュは、エタノールの多くの側面を調べる強力なモデルシステムとして登場しました22,23.外的受精、高い胎児性、遺伝的な管への影響、および生きている画像化能力のために、ゼブラフィッシュは、エタノールのテラトジェネシスのタイミング、投与量、遺伝学などの因子を研究するのに理想的です。エタノールは、正確にステージされた胚に投与することができ、胚を画像化して、発生過程におけるエタノールの直接的な影響を調べることができます。開発の遺伝的プログラムはゼブラフィッシュとヒトの間で高度に保存されているため、FASDのヒト研究を導くのに役立つため、この研究は、ヒトに直接関連することができます24.ゼブラフィッシュはエタノールのテラトジェネシスを調べるために使用されてきたが、胚エタノール濃度を報告する際のコンセンサスの欠如は、ヒトとの比較を困難にする25.哺乳類システムでは、血中アルコール濃度は組織エタノールレベル26に直接相関する。ゼブラフィッシュ研究の多くは、循環系の完全な形成前に胚を治療する。検査する母体試料が存在しない場合、胚内のエタノール濃度を定量化するにはエタノール濃度を評価するプロセスが必要です。ここでは、ヘッドスペースガスクロマトグラフィーを用いて、現像するゼブラフィッシュ胚中のエタノール濃度を定量するプロセスについて説明する。
プロトコル
この手順で使用されるすべてのゼブラフィッシュ胚は、確立されたIACUCプロトコル27に従って飼育および飼育された。これらのプロトコルは、テキサス大学オースティン校とルイビル大学によって承認されました。
注:ゼブラフィッシュラインTg(fli1:EGFP)y1は、この研究で使用されました28.この手順で使用されるすべての水は、滅菌逆浸透水である。すべての統計分析はグラフパッドプリズムv8.2.1を使用して行われました。
1. 胚培地の作成
- 20xの胚培地を作るためには、NaClの17.5 g、KClの0.75g、CaCl2の2.9g、K2HPO 4の0.41g、NA2HPO4の0.142g、およびMgSO4·7H2 Oの4.9gを1Lの水に溶解させる。形成される白色の沈殿物は無視してください。これはメディアに影響しません。ストック液をフィルター殺菌し、4°Cで保管します。
- 働く胚培地溶液を作成するには、NaHCO3の1.2 gを20倍の胚培地ストックの1 Lに溶解し、19 Lの水を加える。28°Cで働く胚培地溶液を維持する。
2. 水変位を用いて胚体積を測定する
注: このプロトコルでは、24時間の受精後(hpf)胚(図1)が使用されます。体積測定に使用される胚は、エタノール分析には使用されません。
- 1.5 mLマイクロ遠心管に10個の胚と胚外液を250μLの体積で印を付けます(図2A)。250 μL 充填ラインに水を加えます(図 2 Bの染水を使用したサンプルを参照)。
- 手順 2.1 を繰り返して、そのコーションを除去した胚のレセプタクルを設定します。
- 絨毛膜を取り除くために、室温(RT)の室温(RT)で2mg/mLのプロテアーゼカクテルを含む100mmペトリ皿に胚を100mmペトリ皿に入れます。数分ごとに、静かに絨毛を壊すために胚を渦巻きます。
- すべての胚が絨毛から解放されたら、プロテアーゼカクテル/胚培地からデコリオネートされた胚を取り除き、新鮮な胚培地を含む新しい100mmペトリ皿に入れて胚を洗浄する。この洗浄ステップをもう 1 回繰り返します (合計 2 回の洗浄)。胚を新鮮な100mmペトリ皿に移します。
- 可能な限り小さい先端を使用し、胚を損傷することなく、p200マイクロピペッタ(図2C)を使用して胚の周りからすべての液体を慎重に取り除き、<0.1 mgの精度のスケールで水の重量を量る。10個の胚のサンプルの体積を決定するために、250μLから取り出した水の重量/体積(水の1mL=1g)を減算します。単一の胚の体積を決定するために、250 μLと除去された水の重量の差を10で割ります。
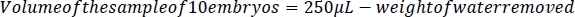
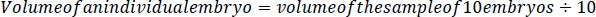
3. エタノールで胚を処理する
- 交配タンクから胚を集め、標準的な100mmペトリ皿に入れます。1ペトリ皿あたり100個以下の胚を数え、28.5°Cでインキュベートしてください。
注:コリオンを除去する場合(ステップ2.2)、エタノールを添加する前に除去する必要があります。 - 6 hpfで、胚培地または胚培地+1%エタノール(v/v)を含む新しい標準100mmペトリ皿に最大100個の胚を加える。蓋をするが、ペトリ皿を密封しないでください。18時間、または胚が24hpfの発生時点に達するまで、28.5 °Cに設定された低い臨時インキュベーターに胚を置きます。
4. ヘッドスペースガスクロマトグラフィー用胚処理前のワークフローの準備
- すべてのタンパク質を変性させ、エタノール代謝を防ぐために、水中の5 M NaCl(サンプルチューブあたり450μLが必要)の溶液を作ります。胚培地中の2mg/mLの濃度でプロテアーゼカクテル(材料表)を作ります。
- 各サンプルに1.5mLマイクロ遠心チューブと2mLガスクロマトグラフバイアルをラベル付けします。下記のエタノール規格に加えて、空気、水、5 M NaCl/プロテアーゼカクテルブランクの場合、追加の2 mLガスクロマトグラフバイアルをラベル付けします。
- p200マイクロピペットを2つ50μLに設定し、3つ目は200μLに設定します。p1000マイクロピペットは450μL、p2マイクロピペットは2μLに設定されています。ペトリ皿から1.5 mLマイクロ遠心管チューブに胚を移すために使用されるガラスピペットの場合、ピペットチップを素早く炎を通して通過させ、ピペットに引き込むときに胚を損傷しないように端を滑らかにします。
5. ヘッドスペースガスクロマトグラフィー用胚処理
注:その合唱中の胚と以前にそれらの塩素から取り除かれた胚の両方は、希釈因子の計算における一貫性のために同じように扱われる。
- 50 μLに設定された2つのp200マイクロピペットを使用して、プロテアーゼカクテル溶液を1つに50μL引き込み、50μLの水を2番目に引き込みます。
- ガラスピペットおよびマイクロピペッタを使用して、1.5 mLマイクロ遠心管内に10個の胚(ステップ3.2から)をすばやく入れ、キャップを閉じます(図2Aに記載)。検査対象のすべてのサンプル、コントロール、エタノール処理された胚について繰り返します。
- 200 μLに設定されたp200マイクロピペットを使用して、キャップを素早く開き、残りの胚培地をすべて取り除きます(図2Cに記載されています)。50μLの水を含むピペットをチューブに素早く入れ、素早く(胚に損傷を与えないように)加え、水を取り除きます。待機中のピペッタから50μLのプロテアーゼカクテル溶液を素早く追加し、チューブキャップを閉じます(図2D)。
注: このプロセスは、一度に 1 つずつ実行します。 - サンプルをRTに10分間座らせて、プロテアーゼカクテルが絨毛膜を分解できるようにします。次に、5 M NaCl の 450 μL を素早く追加し、チューブ キャップを閉じます (図 2E)。サンプルを10分間ボルテックスします。処理を高速化するには、ミキサーをセットアップして複数のサンプルを同時に回転させます。
注:24 hpfより古い胚を持つチューブにシリカビーズ混合物(2サイズ、0.5mmおよび1mmビーズ)の少量(約100μL)を加えます。古い胚では、脊索は均質化される期間に関係なくそのまま残ります。 - 10分間均質化した後、2 μLの均質化された胚上清を素早く除去し、ガスクロマトグラフバイアルに加えます。バイアルをポリテトラフルオロエチレンキャップで素早く密封します。
6. 媒体およびエタノール規格の準備
- メディア標準を準備するには、5 M NaCl/プロテアーゼカクテル溶液でメディアを10倍に希釈します。各サンプルの2μLをガスクロマトグラフバイアルに加え、ポリテトラフルオロエチレンキャップで密封します。
- エタノール標準を準備するには、5M NaCl/proteaseカクテル溶液中に100%エタノールの連続希釈液を作成し、0.3125、0.625、1.25、2.5、5、10、20、および40mMの濃度にします。ガスクロマトグラフバイアルに各標準の2μLを加え、ポリテトラフルオロエチレンキャップで密封します。
7. ヘッドスペースガスクロマトグラフの準備
メモ:このセットアップとプロトコルは、使用するガスクロマトグラフに応じて変更する必要があります。ヘッドスペースガスクロマトグラフィーは、分離のためではなく、エタノールレベルを定量するために使用されます。
- オートサンプラーのヒーターを58°Cに設定し、電源を入れます。ヒーターが58°Cに達し、ガスクロマトグラフを供給する空気と水素ガスラインをオンにします(エタノールを定量するために使用される炎イオン化用)。
メモ:psiは、メーカーの仕様に従ってクロマトグラフを正しく動作するように設定する必要があります。ヘリウムラインがオンで、適切なpsiに設定されていることを確認します。 - 中隔の場合、注入されたサンプルの数が 100 を指定していないことを確認します。射出繊維の場合、注入されたサンプルの数が 500 以下ではないことを確認してください。
注: どちらかが注入量を超えている場合は、テスト サンプルを実行する前に変更する必要があります。 - 解析ソフトウェアの電源を入れ、ワークステーションが正しくセットアップされていることを確認します。ラボ/部門の基準に従ってすべてのデータを保存します。実行するサンプルの新しいサンプル リストを作成します。
- 起動方法を開始し、サンプルを実行する前に炎イオン化検出器が安定するのを待ちます。安定したら、ソフトウェア起動方法を実行してファイバをクリーニングします。
8. ヘッドスペースガスクロマトグラフィーを用いたサンプル測定
- 起動方法が完了したら、サンプルリストにサンプルごとに 1 つの新しい行を作成します。分析ソフトウェアの方法メニューから、負荷436電流spmeエタノール2013 3分rgラン2_5min吸収する。サンプル・リストの各サンプルの METH。
- 空気、水、5 M NaCl/プロテアーゼカクテルブランクから始めて、サンプルリストに記入してください。その後、0.3125から40 mMまでの順に規格を入力します。空気、水、5 M NaCl/プロテアーゼカクテルブランクの第2ラウンドで基準に従ってください。
- 試験されるすべての均質化された胚上清サンプルを、最も低いものから最高の予測エタノール濃度まで入力します。空気、水、および5 M NaCl/プロテアーゼカクテルブランクの第3ラウンドと最終ラウンドに入ることによって終了します。
- サンプルが入力された順序で、オートサンプラーにガスクロマトグラフバイアルを追加します。サンプルを 10 ~ 15 分間暖めます。
- すべてのサンプルと最後のブランクが実行されたら、サンプル・リストに最終サンプルを追加してスタンバイを実行して、ソフトウェアのシャットダウン方式をアクティブにします。METH.サンプルの実行中に取得したすべてのデータをバックアップします。オートサンプラーヒーター、水素タンク、クロマトグラフ温度が30°Cに達した後にのみ、空気タンクの電源を切ってください。ワックスカラムを保存するためにヘリウムタンクをオンのままにします。
9. サンプルエタノールピーク積分とサンプル濃度分析
注: 9.3 からのすべての値は、すべての関係式が事前に入力された Excel ファイルで計算されました。
- シャットダウン方法が完了したら、[クロマトグラムを開く] をクリックします。結果を含むフォルダを開きます。サンプルは、このプログラムに自動的に統合されます。
- 結果では、正しいピークが統合されていることを確認します(エタノールピークは2~2.5)。すべてのサンプルが確認されたら、結果を印刷またはエクスポートします。
- エタノール規格のピーク高さをグラフにプロットします。エタノール規格の傾き、Y 切片、R2の値を計算します(R2は 0.99 を> にする必要があります)。
注: これらの値は、サンプルピーク高からエタノール濃度を決定するために使用されます。 - 各サンプルについて、エタノール規格のY切片からサンプルのピーク高さを引きます。この値をエタノール規格の傾きで除算し、GCバイアル中の各サンプルのエタノール値を求める。
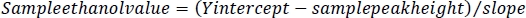
- 胚中のエタノール濃度を計算するために、まず各サンプルの希釈倍率を計算する。このプロトコルのステップ2.3で計算された体積測定を行い、体積測定値に500μLを加えた値で割ります。これは、胚処理中に各サンプルに添加された5 M NaCl/プロテアーゼカクテル溶液を表します(ステップ5.3および5.4)。
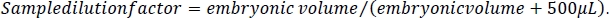
- このサンプル希釈倍率を用いて、各サンプルのサンプルエタノール値を掛ける。結果はmM濃度になります。メディアエタノール値に希釈率10を掛けて、メディア参照サンプルを計算します。
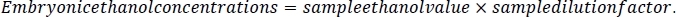
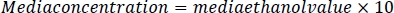
結果
血中エタノール濃度は、完全に形成された循環系を欠いているため、初期の胚ゼブラフィッシュでは決定できません。ゼブラフィッシュ胚中のエタノール濃度のレベルを決定するために、エタノールレベルは均質化された胚組織から直接測定される。胚性エタノール濃度を適切に測定するには、胚量を考慮する必要があります。胚(卵黄付)は、胎児の体液で囲まれた絨毛膜(卵殻)の中に位置し...
ディスカッション
開発モデルシステムとして、ゼブラフィッシュは環境要因が開発に及ぼす影響を研究するのに理想的です。彼らは、エタノール研究で正確なタイミングと投与パラダイムを可能にする外部受精胚の多数を生成します。これは、ライブイメージング能力と人間との遺伝的および発達的保全と組み合わせることで、ゼブラフィッシュを気象学研究のための強力なモデルシステムにします。記載さ?...
開示事項
著者たちは開示するものは何もない。
謝辞
この記事で発表された研究は、国立衛生研究所/国立歯科頭蓋顔面研究所(NIH/NIDCR)R01DE020884からJ.K.E.への以前の助成金によって支えられていました。 国立衛生研究所/アルコール乱用・アルコール依存症研究所(NIH/NIAAA)F32AA021320からC.B.L.への、国立衛生研究所/国立アルコール乱用研究所(NIH/NIAAA)R00AA023560からC.B.L.ガスクロマトグラフ分析を提供し、支援してくれたルーベン・ゴンザレスに感謝します。ティアナ・オンティヴェロスとジーナ・ノーブルズ博士の執筆支援に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Air | Provided by contract to the university | ||
| Analytical Balance | VWR | 10204-962 | |
| AutoSampler, CP-8400 | Varian | Gas Chromatograph Autosampler | |
| Calcium Chloride | VWR | 97062-590 | |
| Ethanol | Decon Labs | 2701 | |
| Gas chromatograph vial with polytetrafluoroethylene/silicone septum and plastic cap 2 mL | Agilent | 8010-0198 | Can reuse the vials after cleaning, but not the caps/septa |
| Gas Chromatograph, CP-3800 | Varian | ||
| Helium | Provided by contract to the university | ||
| HP Innowax capillary column | Agilent | 19095N-123I | 30 m x 0.53 mm x 1.0 μm film thick |
| Hyrdogen | Provided by contract to the university | ||
| Magnesium Sulfate (Heptahydrate) | Fisher Scientific | M63-500 | |
| Microcentrifuge tube 1.5 mL | Fisher Scientific | 2682002 | |
| Micropipette tips 10 μL | Fisher Scientific | 13611106 | |
| Micropipette tips 1000 μL | Fisher Scientific | 13611127 | |
| Micropipette tips 200 μL | Fisher Scientific | 13611112 | |
| Petri dishes 100 mm | Fisher Scientific | FB012924 | |
| Pipetman L p1000L Micropipette | Gilson | FA10006M | |
| Pipetman L p200L Micropipette | Gilson | FA10005M | |
| Pipetman L p2L Micropipette | Gilson | FA10001M | |
| Polytetrafluoroethylene/silicone septum and plastic cap | Agilent | 5190-7021 | Replacement caps/septa for gas chromatograph vials |
| Potassium Chloride | Fisher Scientific | P217-500 | |
| Potassium Phosphate (Dibasic) | VWR | BDH9266-500G | |
| Pronase | VWR | 97062-916 | |
| Silica Beads .5 mm | Biospec Products | 11079105z | |
| Silica Beads 1.0 mm | Biospec Products | 11079110z | |
| Sodium Bicarbonate | VWR | BDH9280-500G | |
| Sodium Chloride | Fisher Scientific | S271-500 | |
| Sodium Phosphate (Dibasic) | Fisher Scientific | S374-500 | |
| Solid-phase microextraction fiber assembly Carboxen/Polydimethylsiloxane | Millipore Sigma | 57343-U | Replacement fibers |
| Star Chromatography Workstation | Varian | Chromatography software | |
| Thermogreen Low Bleed (LB-2) Septa | Millipore Sigma | 23154 | Replacement inlet septa |
参考文献
- Elliott, E. J., Payne, J., Morris, A., Haan, E., Bower, C. Fetal alcohol syndrome: a prospective national surveillance study. Archive of Diseases in Childhood. 93 (9), 732-737 (2008).
- Cudd, T. A. Animal model systems for the study of alcohol teratology. Experimental Biology and Medicine. 230 (6), 389-393 (2005).
- Williams, J. F., Smith, V. C. Committee on Substance Abuse. Fetal Alcohol Spectrum Disorders. Pediatrics. 136 (5), 1395-1406 (2015).
- Patten, A. R., Fontaine, C. J., Christie, B. R. A comparison of the different animal models of fetal alcohol spectrum disorders and their use in studying complex behaviors. Frontiers in Pediatrics. 2, 93 (2014).
- Petrelli, B., Weinberg, J., Hicks, G. G. Effects of prenatal alcohol exposure (PAE): insights into FASD using mouse models of PAE. Biochemistry and Cell Biology. 96 (2), 131-147 (2018).
- Mayfield, J., Arends, M. A., Harris, R. A., Blednov, Y. A. Genes and Alcohol Consumption: Studies with Mutant Mice. International Review Neurobiology. 126, 293-355 (2016).
- Marquardt, K., Brigman, J. L. The impact of prenatal alcohol exposure on social, cognitive and affective behavioral domains: Insights from rodent models. Alcohol. 51, 1-15 (2016).
- Sulik, K. K. Genesis of alcohol-induced craniofacial dysmorphism. Experimental Biology and Medicine. 230 (6), 366-375 (2005).
- Lipinski, R. J., et al. Ethanol-induced face-brain dysmorphology patterns are correlative and exposure-stage dependent. PLoS One. 7 (8), 43067 (2012).
- Eberhart, J. K., Parnell, S. The genetics of fetal alcohol spectrum disorders. Alcoholism: Clinical and Experimental Research. 40 (6), 1154-1165 (2016).
- Becker, H. C., Diaz-Granados, J. L., Randall, C. L. Teratogenic actions of ethanol in the mouse: a minireview. Pharmacology, Biochemistry and Behavior. 55 (4), 501-513 (1996).
- Ahlgren, S. C., Thakur, V., Bronner-Fraser, M. Sonic hedgehog rescues cranial neural crest from cell death induced by ethanol exposure. Proceedings of the National Academy of Sciences of the United States of America. 99 (16), 10476-10481 (2002).
- Loucks, E. J., Ahlgren, S. C. Deciphering the role of Shh signaling in axial defects produced by ethanol exposure. Birth Defects Research Part A: Clinical and Molecular Teratology. 85 (6), 556-567 (2009).
- Hong, M., Krauss, R. S. Cdon mutation and fetal ethanol exposure synergize to produce midline signaling defects and holoprosencephaly spectrum disorders in mice. PLoSGenetics. 8 (10), 1002999 (2012).
- Aoto, K., Shikata, Y., Higashiyama, D., Shiota, K., Motoyama, J. Fetal ethanol exposure activates protein kinase A and impairs Shh expression in prechordal mesendoderm cells in the pathogenesis of holoprosencephaly. Birth Defects Research Part A: Clinical and Molecular Teratology. 82 (4), 224-231 (2008).
- Deltour, L., Ang, H. L., Duester, G. Ethanol inhibition of retinoic acid synthesis as a potential mechanism for fetal alcohol syndrome. The FASEB Journal. 10 (9), 1050-1057 (1996).
- Wentzel, P., Eriksson, U. J. Ethanol-induced fetal dysmorphogenesis in the mouse is diminished by high antioxidative capacity of the mother. Toxicological Sciences. 92 (2), 416-422 (2006).
- Karacay, B., Mahoney, J., Plume, J., Bonthius, D. J. Genetic absence of nNOS worsens fetal alcohol effects in mice. II: microencephaly and neuronal losses. Alcoholism: Clinical and Experimental Research. 39 (2), 221-231 (2015).
- Bonthius, D. J., Winters, Z., Karacay, B., Bousquet, S. L., Bonthius, D. J. Importance of genetics in fetal alcohol effects: null mutation of the nNOS gene worsens alcohol-induced cerebellar neuronal losses and behavioral deficits. Neurotoxicology. 46, 60-72 (2015).
- Bonthius, D. J., et al. Deficiency of neuronal nitric oxide synthase (nNOS) worsens alcohol-induced microencephaly and neuronal loss in developing mice. Brain Research. Developmental Brain Research. 138 (1), 45-59 (2002).
- Langevin, F., Crossan, G. P., Rosado, I. V., Arends, M. J., Patel, K. J. Fancd2 counteracts the toxic effects of naturally produced aldehydes in mice. Nature. 475 (7354), 53-58 (2011).
- Lovely, C. B., Fernandes, Y., Eberhart, J. K. Fishing for Fetal Alcohol Spectrum Disorders: Zebrafish as a Model for Ethanol Teratogenesis. Zebrafish. 13 (5), 391-398 (2016).
- Fernandes, Y., Buckley, D. M., Eberhart, J. K. Diving into the world of alcohol teratogenesis: a review of zebrafish models of fetal alcohol spectrum disorder. Biochemistry and Cell Biology. 96 (2), 88-97 (2018).
- McCarthy, N., et al. Pdgfra protects against ethanol-induced craniofacial defects in a zebrafish model of FASD. Development. 140 (15), 3254-3265 (2013).
- Lovely, C. B., Nobles, R. D., Eberhart, J. K. Developmental age strengthens barriers to ethanol accumulation in zebrafish. Alcohol. 48 (6), 595-602 (2014).
- Harris, R. A., Trudell, J. R., Mihic, S. J. Ethanol's molecular targets. Science Signaling. 1 (28), (2008).
- Westerfield, M. . The Zebrafish Book: A guide for the laboratory use of zebrafish Danio (Brachydanio) rerio. , (1993).
- Lawson, N. D., Weinstein, B. M. In vivo imaging of embryonic vascular development using transgenic zebrafish. Developmental Biology. 248 (2), 307-318 (2002).
- Hagedorn, M., Kleinhans, F. W., Artemov, D., Pilatus, U. Water Distribution and permeability of zebrafish embryos, Brachydanio rerio. Journal of Experimental Zoology. 278 (6), 356-371 (1997).
- Lippi, G., et al. The alcohol used for cleansing the venipuncture site does not jeopardize blood and plasma alcohol measurement with head-space gas chromatography and an enzymatic assay. Biochemia Medica. 27 (2), 398-403 (2017).
- Poklis, J. L., Wolf, C. E., Peace, M. R. Ethanol concentration in 56 refillable electronic cigarettes liquid formulations determined by headspace gas chromatography with flame ionization detector (HS-GC-FID). Drug Testing and Analysis. 9 (10), 1637-1640 (2017).
- Heit, C., et al. Quantification of Neural Ethanol and Acetaldehyde Using Headspace GC-MS. Alcoholism: Clinical and Experimental Research. 40 (9), 1825-1831 (2016).
- Chun, H. J., Poklis, J. L., Poklis, A., Wolf, C. E. Development and Validation of a Method for Alcohol Analysis in Brain Tissue by Headspace Gas Chromatography with Flame Ionization Detector. Journal of Analytical Toxicology. 40 (8), 653-658 (2016).
- Schlatter, J., Chiadmi, F., Gandon, V., Chariot, P. Simultaneous determination of methanol, acetaldehyde, acetone, and ethanol in human blood by gas chromatography with flame ionization detection. Human and Experimental Toxicology. 33 (1), 74-80 (2013).
- Schier, C. J., Mangieri, R. A., Dilly, G. A., Gonzales, R. A. Microdialysis of ethanol during operant ethanol self-administration and ethanol determination by gas chromatography. Journal of Visualized Experiments. (67), e4142 (2012).
- Adalsteinsson, E., Sullivan, E. V., Mayer, D., Pfefferbaum, A. In vivo quantification of ethanol kinetics in rat brain. Neuropsychopharmacology. 31 (12), 2683-2691 (2006).
- Quertemont, E., Green, H. L., Grant, K. A. Brain ethanol concentrations and ethanol discrimination in rats: effects of dose and time. Psychopharmacology. 168 (3), 262-270 (2003).
- Flentke, G. R., Klinger, R. H., Tanguay, R. L., Carvan, M. J., Smith, S. M. An evolutionarily-conserved mechanism of calcium-dependent neurotoxicity. Alcoholism: Clinical and Experimental Research. 38 (5), 1255-1265 (2014).
- Reimers, M. J., Flockton, A. R., Tanguay, R. L. Ethanol- and acetaldehyde-mediated developmental toxicity in zebrafish. Neurotoxicology and Teratology. 26 (6), 769-781 (2004).
- Zhang, C., Ojiaku, P., Cole, G. J. Forebrain and hindbrain development in zebrafish is sensitive to ethanol exposure involving agrin, Fgf, and sonic hedgehog function. Birth Defects Research Part A: Clinical and Molecular Teratology. 97 (1), 8-27 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved