Method Article
「大子広場」の合理化されたサンプリングと栽培
要約
オイコプレウラ・ジオカは、生物学の様々な分野でのチュニケートモデル生物です。我々は、動物および藻類飼料のサンプリング方法、種同定、培養セットアップ、および培養プロトコルについて述べる。文化システムの強化に役立つ重要な要因を強調し、考えられる問題と解決について議論します。
要約
オイコプレウラ・ジオカは、フィルター供給能力、迅速な生成時間、保存初期の開発、およびコンパクトなゲノムを備えたプランクトニック・コルデートです。これらの理由から、海洋生態学的研究、進化発生生物学、ゲノミクスにとって有用なモデル生物と考えられています。研究は、多くの場合、動物資源の安定供給を必要とするため、信頼性の高い、低メンテナンスの培養システムを確立することが有用です。ここでは、O.ジオカ文化を確立するためのステップバイステップの方法について説明します。潜在的なサンプリング部位の選択方法、収集方法、標的動物同定、培養システムのセットアップ方法について説明する。私たちは、独自の経験に基づいてトラブルシューティングのアドバイスを提供します。我々はまた、強固な文化システムを維持するのに役立つ重要な要因を強調する。ここで提供される文化プロトコルはO.dioica用に最適化されていますが、サンプリング技術と培養のセットアップが他の脆弱な遠視無脊椎動物を維持するための新しいアイデアを刺激することを願っています。
概要
モデル生物は、開発、遺伝学、生理学に関する問題を含む多くの生物学的問題に取り組んできました。さらに、追加のモデル生物は新しい発見を促進し、したがって、自然の理解を深めるために重要である1,,2.海洋動物プランクトンは、海洋生態系3、4、5、64,5において重要な役割3を果たす生物の多様なグループである6。その豊富さと生態学的重要性にもかかわらず、プランクトンチュニケートのようなゼラチン性生物は、その透明性と脆弱さがフィールドコレクションと識別を77,8に挑戦させるため、プランクトン生物多様性研究では過小評価されることが多い。適応されたサンプリング技術と実験室培養は、植物の詳細な観察を可能にする、プランクトニックチュニケート99、10、11、1210,11,12の生物学における知識を促進している。
ラーバセアン(虫垂家)は、世界中で約70種の記載された種を含む自由に泳ぐ海洋チュニケートのクラス8、1313である。彼らは動物プランクトンコミュニティ内で最も豊富なグループの一つであるとして 14,,15,,16,,17,幼虫は、魚の幼虫などの大きなプランクトン生物のための主要な食料源を表す18,,19.ascidiansとは異なり、セシルチュニケート-幼虫はオタマジャクシのような形態を保持し、生涯を通じてプランクトニックなまま20.各動物は、家として知られている自作の複雑なフィルター給餌構造の中に住んでいます。彼らは尾21の起伏のある動きを通して水流を作り出すことによって、家の中に微粒子を蓄積する。詰まった家屋は一日を通して廃棄され、そのうちのいくつかは炭素凝集体を形成し、最終的には海底22に沈む。したがって、幼虫は世界的な炭素フラックス23において大きな役割を果たす。ほとんどの種は、水柱13の上100m以内の遠洋地帯に生息すると報告されている。しかし、巨大な幼虫バソシノエウスは300 m24の深さに生息することが知られています。カリフォルニア州モントレー湾のバソコルカエウスに関する研究は、動物がマイクロプラスチックの生物学的ベクターとしても機能することを明らかにし、海洋におけるマイクロプラスチックの垂直輸送および流通における虫垂家の役割を理解する上で潜在的な重要性を示唆した。
幼虫の一種であるオイコプレウラ・ジオカは、近年、いくつかの顕著な特徴により、モデル生物として注目を集めています。それは一般的に世界中の海で報告されています。海岸海域26に特に豊富に存在し、海岸からのサンプリングが容易です。長期的な安定した培養は、自然と人工海水27、28、2928,29の両方で可能です。27温度依存生成時間は、実験室条件で4〜9日と短い。年間を通じて300個の卵を生産できる女性一人一人と高い胎児性を持っています。チュニケートとして、それは、chordateの進化を理解するための重要な系統的位置を占める30,,31.70 Mbでは、O.dioicaは、すべてのchordates32の中で最も小さな同定されたゲノムを有する。幼虫の中で、O.ジオカは、これまで33の非雌雄同種の唯一の記載である。
実験室で成長した微細藻類との最初の成功したO.ジオカ文化は、Paffenhöfer34によって報告されました。同期モーターとパドルを使用したオリジナルの培養プロトコルは、フェノーとゴルスキー35によって開発され、後に複数の研究所で採用されました。最近では、Fujiiら36は人工海水中でのO.ジオカ培養を報告し、堅牢な培養システムとフィールドコレクションはBouquetららによって記述され、簡便で手頃な価格のシステムのための最適化されたプロトコルがMarti-Solansららによって報告された。伝統的なオイコプレラ文化システムとは別に、二重チューブ飼育タンクを備えた新たに報告されたデザインも、オイコプレウラspを培養する可能性を秘めています。37.
サルス国際海洋分子生物学センター27、バルセロナ大学29、大阪大学28、および私たち自身の観測で、主要なオイコプレラ研究グループが開発したプロトコルの組み合わせに基づいて、O.dioica単一培養を推進するための詳細なプロトコルを提示します。29以前に発表された培養プロトコルでは、藻類培地の組成、ショアサンプリング技術、オイコプレラ同定に関する詳細な情報は大まかに説明され、多くのあいまいさを残した。ここでは、ビデオプロトコルの視覚情報の助けを借りて、私たちは簡単なステップバイステップの方法で、最初からO.dioica文化を設定するために必要なすべての重要な情報を組み立てました。私たちは、O.ディオイカを、最も困難なステップの1つである別の一般的に報告された種、O.ロンジカウダと区別する方法を説明します。既存の文化システムは、世界各地でのO.dioicaの栽培に適用可能ですが、地域の環境条件に基づくプロトコル調整の重要性を強調しています。提示された情報は、広く公開されたデータと経験を通じて得られた知識を組み合わせたものです。現在のプロトコルは、文化をゼロから確立することに興味を持つ研究者に最適です。
プロトコル
1. O. ジオイカ文化施設
- 水フィルターシステム(図1)
- 深さ2~3mの港から天然海水を集めろ。砂フィルター(細孔サイズ1.4mm)を通して海水を渡し、実験室の共有貯水池タンクに輸送します。共有貯留タンクの水質を維持するために水を循環させるためにキャニスターフィルターを使用してください。
- 培養室では、磁気駆動ポンプ付きの100 Lリザーバータンク、5μmおよび1μmのポリプロピレン巻きカートリッジフィルター、およびUV滅菌器(100V)からなるマルチステップフィルターシステムを設置します(図1)。
- 共有貯水池タンクから培養室の貯留槽に海水を移します。25 μmのフィルターユニット(図1A,B)を通して海水を通し、培養室の貯留タンクに入ります。海水を一晩5μmのフィルターで循環させ、動物の開発を妨げる可能性のある粒子を徹底的に除去します。
注: メッシュ サイズが大きい追加のフィルタ(25~50 μm)は、サイズの大きいパーティクルが小さいメッシュ サイズでカートリッジ フィルタを詰まらせるのを防ぐのに便利です。ろ過された海水(fSW)は翌朝使用する準備ができています。
-
オイコプレラ培養ユニット (図2)
- 5または10 Lの円形、透明なプラスチックビーカーで動物を維持します。
- 培養ビーカーを、厚さ5mmの透明なアクリル表面板を備えた安定した2レベルのステンレス製の棚ユニット(L x W x H = 150 cm x 45 cm x 90 cm)に置きます。
- アクリル表面の下に白色蛍光灯を置き、ビーカーの底から動物を照らします。
- ビーカーの後ろに黒いプラスチックシートを置きます。黒いシートはコントラストを作成し、透明動物の可視化を高めます。
- 同期電気モーターをアクリルパドル(L x H = 8 cm x 27 cm)に接続します(補足ファイル2)。シェルフユニットの長さに沿って走る平行レールから培養ビーカーのパドルを一時停止します(図2A)。
- モーターのスイッチを入れ、ビーカーに15 RPMで穏やかな円形の動きを生成します。
注意:セルロースハウスの動物は中立的に浮力があります。しかし、水循環は、卵、幼虫、藻類の食べ物を吊り下げ、培養ビーカーに均等に分配するのに役立ちます。
- 自動ドージングポンプ(オプション)
注:自動給餌ユニットは、特に週末の間に、人員配置の要件を減らします。- メーカーの指示に従って自動ドージングポンプから分配液の量を較正します。
- 藻類の貯蔵所として50 mLの管を使用してください。
- 50 mLチューブのキャップに5mmの穴を2つ開けて、航空会社のチューブを通過します。一方のチューブを標準的な水槽エアポンプに接続して気泡を導入し、もう一方のチューブをドージングポンプの入口口に導入します(図2B)。
注:気泡の薄い流れを導入すると、藻類がチューブの底に落ち着くのを防ぐのに役立ちます。 - 特定の日に分配される藻類飼料の時間と量をプログラムします。
- 藻場駅
- シェルビングユニット(L x W x H = 90 cm x 46 cm x 115 cm)を使用して、藻類の作業培養物を含む4つの1つのLラウンドボトムフラスコを配置します(ステップ2.1参照)。
- フラスコの後ろに蛍光灯を置くことによって、作業文化をバックライトします。
- 2ホールのゴムストッパー付きシールフラスコ。
- ゴム栓を通して1 mLの使い捨てピペットを渡します。航空会社のチューブを使用して、ピペットを水槽のエアポンプに接続します。フラスコに気泡の流れを導入します。
2. マイクロガルフード
- 藻類文化の活性化
注:3つの微細種、チャエトセロスカルシトランス、イソクリシスsp.、リノモナスレチクラタ、シアノバクテリアの1種、シネココッカスsp.の3つの培養(ストック、サブ、および作業文化)を維持します。ストックとサブカルチャはバックアップとして使用されます。作業文化は、毎日の給餌のために使用されます。- 微細藻類およびシアノバクテリアの培養に必要な試薬を準備する(表1)。
- ストック培養を開始するために、オートクレーブ(121°C、25分)100 mLのエルレンマイヤーフラスコで60〜80 mLのfSWを開始します。無菌接種は、修飾されたコンウェイ培地27および微細藻類の指定量(表2)例えば、C.カルシトランスのストック培養物を接種するために、60mLの海水をオートクレーブ、無菌で30μLのビタミンおよび溶液A、15μLのケイ酸ナトリウム、60μLのストレプトマイシン、および30μLのC.カルシトランを前のストック培養から受け入れた。
注:R.レチチュラータは、あまりにも多くの光にさらされると、赤みを帯びたピンクからオランジッシュブラウンに変わります。彼らは透明から薄いピンクに変わり始めたら、光から離れてそれらを移動します。 - 連続照明で17°Cに設定インキュベーターでストック文化を維持します。約10日後、藻類の成長を示すように色が変化する(図3)。色が表示されたら、4 °Cに移動して最長1ヶ月間保管します。
- クリーンベンチで、在庫文化からサブカルチャーを無菌的に接種する(表2)。連続照明で17 °Cでインキュベート。藻類の色が現れた後、2週間までインキュベーターに保存し続けます。
- サブカルチャーから作業文化を接種する (表 2)。ゴム製キャップでフラスコを密封し、1 mL使い捨てピペットを挿入します。フラスコを藻場に移動し、8時間の光周期で室温で維持します。一定のエアーレーションを供給する。4日ごとに労働文化を更新します。
- 1日2回、渦巻いてストックとサブカルチャーをかき混ぜます。
注:固体培地上の藻類文化の長期保存と凍結保存は、それぞれ3ヶ月と1年まで可能です。
- 藻類成長曲線の作成 (オプション)
注:供給量の正確な評価は、O.dioicaの安定した文化を維持するために重要です。我々は、2つの主要な藻類食品種、チャエトセロスカルシトランスとイソクリシスspの成長曲線を作成しました。- C.カルシトランスとイソクリシスsp.ワーキングカルチャーを準備する(表2)。
- 各種の作業培養について、サンプルを3回ずつサンプリングし、分光光度計を用いて660nmで吸光度を測定する。各作業文化から三度分の平均測定値を取ります。
- 自動セルカウンターのメーカーの指示に従って、カウント用の藻類サンプルを準備します。各サンプルを 3 回カウントします。各サンプルに存在するセルの総数を決定するには、3 つのカウントの平均を取ります。
- 約50の平均測定値が記録されるまで、毎日カウントを続けます。
- 両方の藻類の成長曲線を作成します (図 4)。
3. 野生のオイコプレラ属のフィールドコレクション。
- 修正されたプランクトンネット (図 5)
注:Oikopleura spp.のサンプリングを成功させるための鍵は、重み付けされた非フィルタリングタラエンドを持つプランクトンネットのゆっくりとした牽引です。図5は、修正されたプランクトンネットの概略図を示す。- ハンドヘルドプランクトンネットのタラエンドを、修正された500 mLスクリュートップウォッシュボトルに交換します。
- 水と動物がタラの端に入ることができるように、洗浄ボトルの直径4 cmのネジトップに直径3cmの穴を開けます。
- プランクトンネットの端にボトルキャップを装着します。電気テープでしっかりと包みます。ステンレス製のホースクランプでキャップをさらに固定します。
- ジップタイで修正されたタラの端の外側に70 gの重量を取り付けます。
- 安全リーシュを取り付けて、タラの端をさらに固定します。
- コレクション サイトの選択 (図 6)
注: すべてのサンプルコレクションは、OISTフィールドワーク安全委員会によって承認されました。場所によっては、オイコプレラ属の存在に季節変動が生じる可能性があります(図6)。激しい暴風雨などの極端な気象イベントの直後にサンプリングを避けます。- マップ Web サイトの衛星表示を使用して、サンプリング候補のサイトを特定します。車で簡単にアクセスでき、プランクトンが溜まりがちな湾や海のドロップオフの近くに位置する港や釣り桟橋に焦点を当てました:日本沖縄の金湾にある石川港(GPS:26°25'39.3"N 127°49'56.6"E)。
- 各サイトの海岸のアクセス可能性と安全性を評価するには、潜在的なサンプリング場所をご覧ください。必要に応じて、地方自治体から収集許可を取得します。
- サンプリング手順
- プランクトンネットを海に投げ込み、タラの端が水面下1〜2m下に沈むことを許可します。
- 50-100 cm s-1で手でネットを水平に牽引する。2~5分前後に歩いて引き続きおります。より多くの植物プランクトンがある場合は短い牽引で、港の植物プランクトンの豊富さによって牽引時間を調整します。
注:幼虫は壊れやすい動物です。ネットの速い牽引または繰り返し鋳造は、タラの端に閉じ込められた動物に損傷を与える可能性があります。 - ネットをそっと持ち上げます。タラの端の内容物を500 mLの丸いガラス瓶にゆっくりと移します。完全に空気の泡を避けるために海水とサンプルボトルを充填します。
メモ:オイコプレラspp.の存在は、黒い背景に対してサンプルボトルを見ることによって確認することができます。ほとんどの動物は、収集されている間、彼らの家を放棄します。そのため、種レベルの同定には顕微鏡観察が必要である。 - 3本の500mLボトルが回収されるまでサンプリングを繰り返します。
- 動物が自然に存在する物理的なパラメータの範囲を記録するためにCTDプロファイラーを使用して塩分、温度、およびクロロフィルを測定します。
- 実験室の設定で動物を順応するためにバケツに表面海水の10-15 Lを収集します。
4. 動物の隔離と識別 (図 7,図 8)
-
オイコプレラ属識別
注:オイコプレウラsppに似ているかもしれない他のプランクトン生物は、一見すると、チェエトグナス、フリティラリアspp.、線虫、黄身嚢を持つ魚の幼虫、およびシオナspp.幼虫が含まれます。- 動物を実験室の状態に順応させるために、各500 mLサンプルを、実験室で維持されたサンプリング場所とろ過海水(fSW)から1:1比の表面海水を含む10 Lビーカーに移す(図7A,B)。プランクトンサンプルの濃度に応じてビーカーの体積を5~10Lに調整します。
注:プランクトンサンプルに不要な破片が含まれている場合は、粗いフィルタ(メッシュサイズ〜600 μm)を通して10 Lビーカーに転送します。 - 同期電気モーター(15 RPM)に取り付けられたパドルを使用し、プランクトンを一晩サスペンションに保ちます(ステップ1.2.5)。
- 球形の半透明の家の中で尾を起伏させる長さ1〜2mmのオタマジャクシ型の動物を探すことによって、オイコプレウラ属を特定します。一部の動物は、家なしで一時的に自由に泳いでいるかもしれません。鈍い端のピペットを使用して空のペトリ皿に〜5匹の動物をそっと移します。
- 属の識別のために、穏やかに転送ピペットで家を突くことによって、彼らの家から動物を追い出します。
- 20-40x暗視野顕微鏡下で家のない動物を観察し、オイコプレラ属のppを確認する(図8)。
- 動物を実験室の状態に順応させるために、各500 mLサンプルを、実験室で維持されたサンプリング場所とろ過海水(fSW)から1:1比の表面海水を含む10 Lビーカーに移す(図7A,B)。プランクトンサンプルの濃度に応じてビーカーの体積を5~10Lに調整します。
-
O. ジオカ識別
注:O.dioicaは、完全に成熟した男性と女性、または尾の遠位半分に位置する2つの大きな脊索下細胞の存在によって視覚的に識別することができます。2つの脊節下細胞間の距離は、個体間で異なる場合があります。- 次に、卵(図8A)または精子で満たされた生殖腺を持つ完全に成熟したオイコプレラがあるかどうかを確認してください(図8B)。動物が卵子または精子のみを所有している場合は、唯一の非雌同同体種であるO.dioicaであるため、ステップ4.2.3にスキップしてください。
- 動物が未熟な場合(図8C)、尾の端にある2つの脊帯下細胞を探します(図8D)。
- 種が確認されたら、新しいペトリ皿に移します。10〜20個体が種レベルで確認されるまで、ステップ4.1.3-4.2.2を繰り返します。
注:簡単に識別するために、fSWで0.015%トリカインメタンスルホン酸塩(MS222)を含むペトリ皿中の動物を麻酔します。 - O.ディオイカが見つからない場合は、ビーカーを1日か2日吊り下げておいてください。成長し続け、検出しやすくなる未熟なO.dioicaがあるかもしれません。1 週間後に何も表示されない場合は、サンプルを破棄して、もう一度サンプリングを試みます。
5. O.ジオイカの栽培プロトコル
- フィールド収集サンプルからO.ジオカ単一培養を行う(図7)
注:藻類の食べ物は、働く文化から毎日調製され、各単一培養ビーカーは、それぞれ午前9時、午後12時、午後5時に1日3回供給されます(ステップ5.2を参照)。動物は23°Cで維持される。このような状況下で、沖縄O.ディオイカのライフサイクルは4日間です(図7C)。- O.dioicaの単一培養を開始するには、120匹の動物を分離し、5 Lの新鮮なfSWを含む新しいビーカーに移す(図7B,C)。
- 翌朝、黄色の生殖腺を持つ完全に成熟した男性と、金色の球体として現れる卵を持つメスを探します(図8A,B)。
- 15人の男性と30人の女性を、5 mLの鈍いエンドピペットを備えた新鮮なfSWの2.5 Lを含む新しいビーカーに優しく移して産卵ビーカーを作ります。
注:男性と女性が十分でない場合は、できるだけ多くの大人を1 LのfSWを含むビーカーに移し、自然にスポーンさせてください。手動移動中の動物への物理的ストレスを最小限に抑えるために、それらはゆっくりと水面下でシフォンされ、放出されるべきである。 - 動物は次の世代を開始するために自然に産卵してみましょう。尾の幼虫は受精後約3時間後に現れるはずです。
注:産卵は、完全に成熟した動物が家を放棄し、表面水に向かって泳ぎ、遊技を放出することによって行われます。成功した受精は、産卵ビーカーの底から海水の5-10 mLを抽出し、顕微鏡下で切断した卵子を同定することによって確認することができる。 - 最初の朝の産卵後(1日目)には、膨らんだ家を持つ新世代の動物がビーカーに現れるはずです。500 mL ハンドヘルドビーカーを使用して、産卵ビーカーの内容物を7.5 Lの新鮮なfSWを含む新しいビーカーに静かに移します(合計10 L)。飛び散る動きを避けるために、角度で注ぎます。
- 2日目の朝(2日目)に、150匹の動物を5Lの新鮮なfSWを含む新しいビーカーに手動で移す。
- 3日目の朝(3日目)に、120匹の動物を新しいビーカーに手動で移し、5 Lの新鮮なfSWを持つ。
注:動物の発達を同期させるためには、2日目と3日目の手動転送中に、同じようなサイズの個人を選択することが重要です。1回の移動で最大10匹の動物を振り込むことができます。 - 4日目(4日目)の朝には、完全に成熟した動物が現れるはずです。ステップ 5.1.3 を繰り返して、ライフサイクルを閉じます。
注:自動給餌ポンプは、培養スタッフの存在なしに週末の午後5時に動物に供給するように設定することができます。
- 働く文化からの藻類の食べ物の毎日の準備
- 660 nmでの作業培養物の吸光度を測定する。
- 毎日の摂食チャートに基づいて、特定のサイズの動物に対して何個の藻類細胞を供給する必要があるかを調べる(表3)。
- 藻類の成長曲線(図4)を使用して、以下の方程式を解き、特定の日に必要な藻類(mL)の量を計算します。
- 特定の日と給餌時間に必要な特定の藻類の体積を計算するには、次の式を使用します。
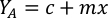
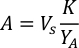
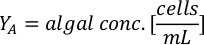
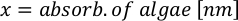
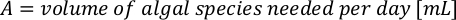
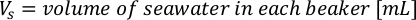
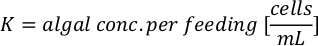
ここでYAは特定の日の藻類濃度であり、Aは供給ごとに必要な藻類の体積である。さらに、YAとxの間の線形関係は、切片(c)と傾き(m)の値を図4に示す。K値については、表 3 を参照してください。 - 例えば、5 L培養で維持される3日目の動物の9 AM給餌時および0.234の藻類吸光度(660nmで測定)で必要なIsochrysis sp.の体積を計算するために、次のように計算した。
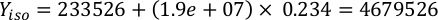
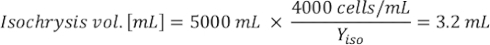
注:これらの方程式をスプレッドシートに保存して、吸光度の測定値、動物のサイズ、および培養海水の体積(補足ファイル1)に基づいて毎日の給餌量が自動的に計算されるようにします。
- 特定の日と給餌時間に必要な特定の藻類の体積を計算するには、次の式を使用します。
- 計算された藻類の体積を50mLチューブに移し、遠心分離機を5000 x gで50°Cで5分間移動します。
- 上清を取り除く。チューブを元のボリュームに新鮮なfSWで戻し、古い藻類培地を交換します。
- 次の飼料に使用できるまで、調理済みの食品を冷蔵庫に保管します。翌朝新しい食べ物が準備された後、古い藻類の食べ物を捨てます。
- 活性炭(オプション)
注:水質を維持するために、各培養ビーカーに活性炭10gを添加しています。炭は4回まで再利用することができる。炭粉塵が培養ビーカーに入るのを避けるために、炭袋をゆっくりと開けます。- 容器内の活性炭を約700g移動します。淡水(FW)に48時間浸し、底に落ち着くようにします。
- 残留炭ダストを除去するためにFWでリンス。
- 15-20分間、FWで炭を沸騰させます。
- ほとんどの炭塵が取り除かれるまですすいで、水が透明になります。
- fSWを含む2 Lビーカーにきれいな炭を保管してください。ほこりが入るのを防ぐためにビーカーを覆います。
- 動物を移す前に、新しいビーカーに木炭を加えます。
結果
オイコプレウラは、ボートまたは港から、非濾過タラエンドを備えた100μmメッシュプランクトンネットのゆっくりとした穏やかな牽引によって収集することができる(図5)。動物の脆弱な性質のために、サンプル瓶に閉じ込められたエアポケットによる網の荒い取り扱いや飛散など、物理的なストレスを引き起こす可能性のある動きを避けることが重要です。
地元のオイコプレラ集団の季節パターンと、サンプリング部位における水の物理的特性の変動を理解することが重要です。2015年から2019年の間のサンプリングでは、石川のO.dioicaと沖縄の金港の存在に一貫した季節変動が明らかになった(図6)。表面海水の温度が大きな要因のようです。O.ジオカは、表面海水が≥28°Cに達したときに支配的な種であり、O.ロンディカウダは24°Cと27°Cの間の温度でO.ディオイカと共存しました。しかし、O.ロンジカウダは23°C以下(図6A)を支配した。連続した数日間の豪雨後のサルニシティの漸進的変化は、O.ダイアイカの豊富さと相関しなかった(図6B)。
上述のサンプリング手順を使用して、私たちが回収したO.dioicaの大部分は、4日間のライフサイクルの2日目から3日目の間でした(図7C)。成熟した雄は、生殖腺の黄色の着色によって認識されたのに対し、雌の生殖腺は直径70〜80μmの卵から金をきらめいた(図8A,B)。未熟なO.ジオアイカは、尾部に2つの脊帯下細胞によって確認された(図8D)。地元の海域のもう一つの支配的な種、O.ロンジカウダは、サイズと形態が似ていました。以下の基準を使用して、O.ロンディカウダとO.dioica38、39、4039,40を区別するために使用しました:尾部の脊椎下細胞の欠如、幹内のウェルムの存在、および雌雄同体生殖腺の存在(図8E,F)。38異なるテール形態は、O.ロンディカウダとO.ディオイカを区別するのにも有用です。家のない無傷の裸の動物が横方向に向かったとき、O.ロンギタウダの尾はより少ない曲率でよりまっすぐで、O.ディオイカのそれと比較して「硬い」外観を与えました。
安定したオイコプレラ培養システムを確立する3つの最も重要な要素は、(i)高い水質を維持し、(ii)最適な摂食体制を特定し、(iii)十分な数の男性と女性を含む産卵ビーカーを設置することです。マルチステップフィルターシステム(図1)の導入により、水質と培養の安定性が向上しました。人工海水にはろ過システムは必要ありません。しかし、天然海水のコスト、可用性、利便性は、海岸の近くに位置するラボのためのより良いオプションになります。摂食体制を確立するために、温度と光条件は大きく異なるため、個々の実験室の設定に適用される藻類の成長曲線を測定することをお勧めします。我々は、藻類の供給濃度および組成物27を最適化するために、以前に公表された供給スケジュールと成長曲線を組み合わせた(図4)。我々はまた、藻類の新鮮な供給を維持するために厳格な藻類接種スケジュールに従う(表2)。自動給餌システムにより、培養スタッフがいなくても、毎日の給餌スケジュールを一貫して維持することができます(図2B)。
最適な海水と給餌条件が達成されたら、2.5 LのfSWで15人の男性と30人の女性を持つ産卵ビーカーを作ることによって新しい世代を始めることが重要です。これにより、2日目に150匹、3日目に120匹、産卵のために4日目に45人の成熟した成人を隔離するのに十分な、翌朝1日目の動物の良好な濃度を保証します。4日目に男性と女性が十分でない場合は、できるだけ多くの成熟した個人を1 LのfSWに収集して移送し、次の世代に引き継ぐのに十分な幼虫がいることを期待して自然に産卵させます。提供されたプロトコルに従って、O.dioicaのライフサイクルは23°Cで4日間である(図7C)。私たちは、20世代以上続いたO.dioicaの6つの独立した野生集団を確実に確立しました。
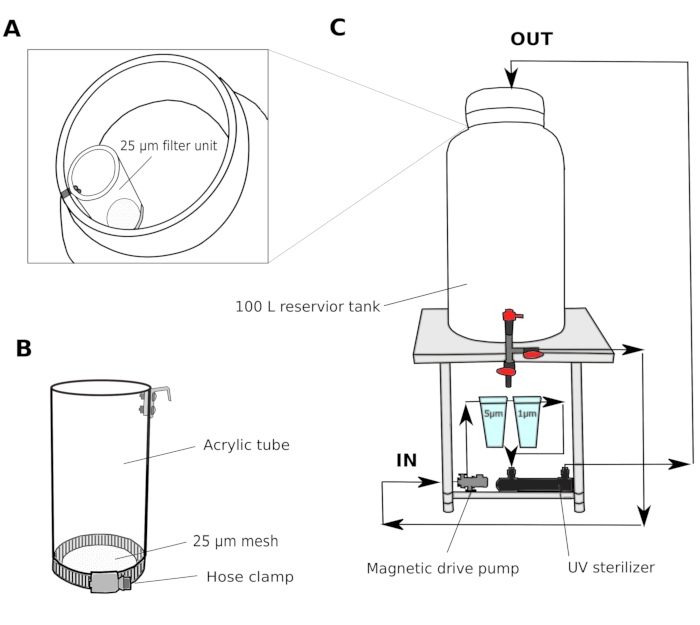
図1:海水フィルターシステムの概略図
(A および B)海水は、最初は25μmのフィルターユニットを通して濾過されてから、貯留槽に入ります(C)磁気駆動ポンプは、貯留タンクから海水を引き出すために使用されます。海水は、貯留タンクに戻る前に、2つのポリプロピレンフィルターとUV滅菌装置を通して押されます。この図の大きなバージョンを表示するには、ここをクリックしてください。
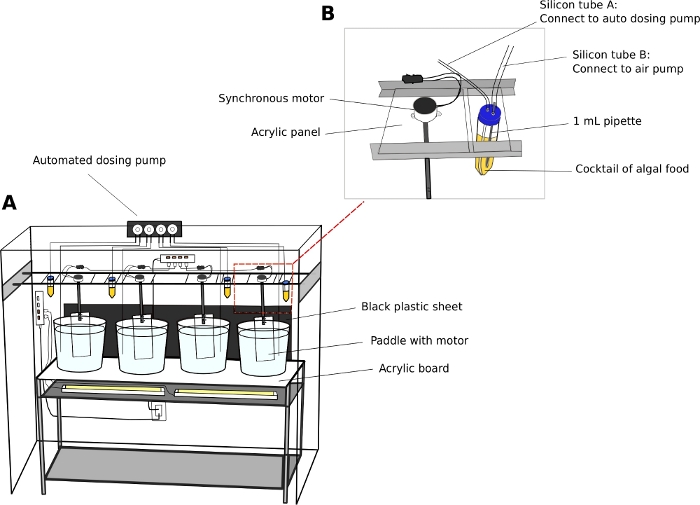
図2:O.ディオイカの文化システム.
(A) 培養システムの概要 (B) 自動ドージングポンプ用同期モータと藻類貯留層のクローズアップ図。シリコンチューブA及びBの内径はそれぞれ2mm及び4mmである。この図の大きなバージョンを表示するには、ここをクリックしてください。

図3: O. dioicaのストックカルチャ .
左からC.カルシトランス、イソクリシスsp.、シネココッカスsp、およびR.レチクラタは、連続光下で17°Cで約10日間成長した後である。この図の大きなバージョンを表示するには、ここをクリックしてください。
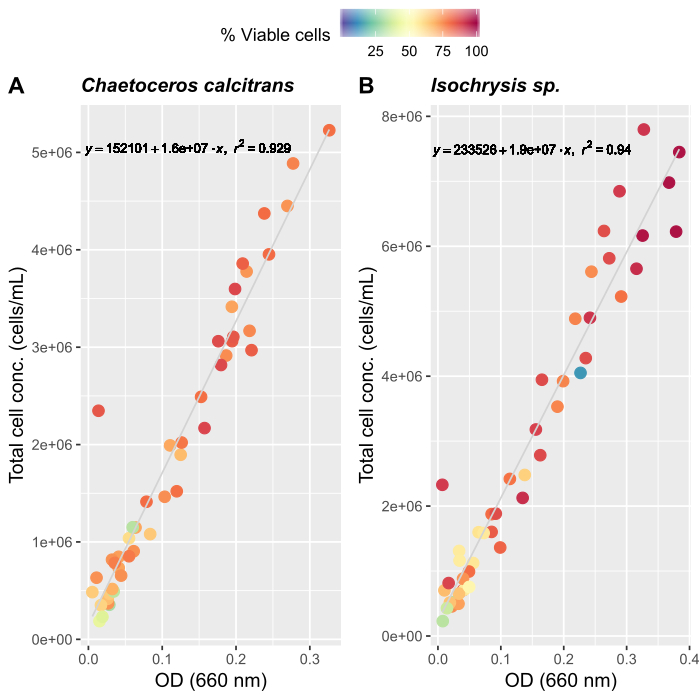
図4:主要な食品種の2種、C.カルシトランス及びイソクリシスspの藻類成長曲線。
660 nmの光学密度(OD)の散乱プロットと(A)Cカルシトランスおよび(B)イソクリシスspの総細胞濃度。各点は3つの測定値の平均を表します。細胞カウンターを使用して、生存細胞の割合と総細胞濃度(細胞/mL)を決定しました。測定は20日間(n=47)記録した。この図の大きなバージョンを表示するには、ここをクリックしてください。
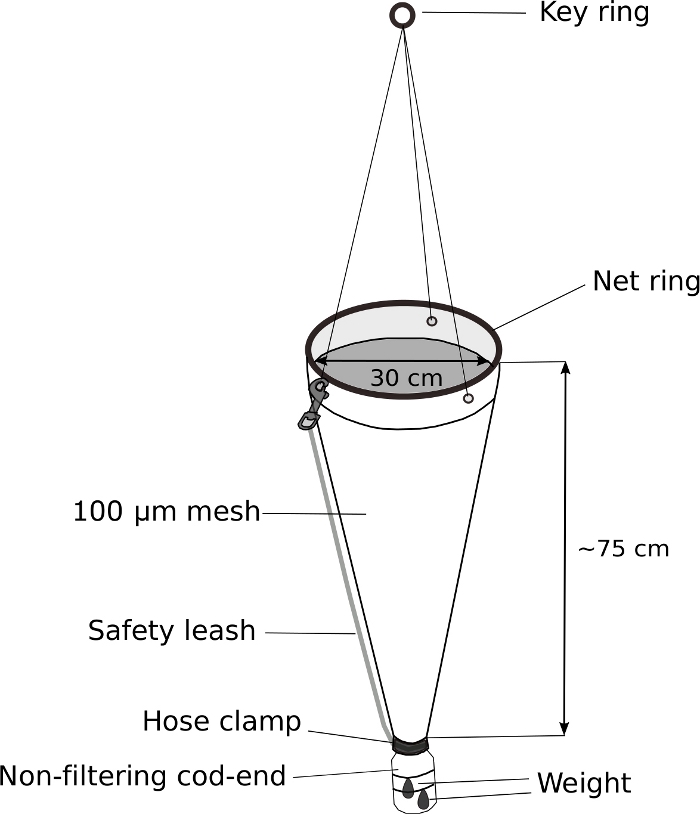
図5:オイコプレラサンプリング用のプランクトンネットを修正。
ハンドヘルドプランクトンネット(100 μmメッシュ)のタラエンドは、500 mLの洗浄ボトルに交換されます。70gの重量はタラの端に付す。約5mのロープがキーリングに取り付けられています。安全リーシュは、さらにタラの端を確保するために取り付けられています。この図の大きなバージョンを表示するには、ここをクリックしてください。
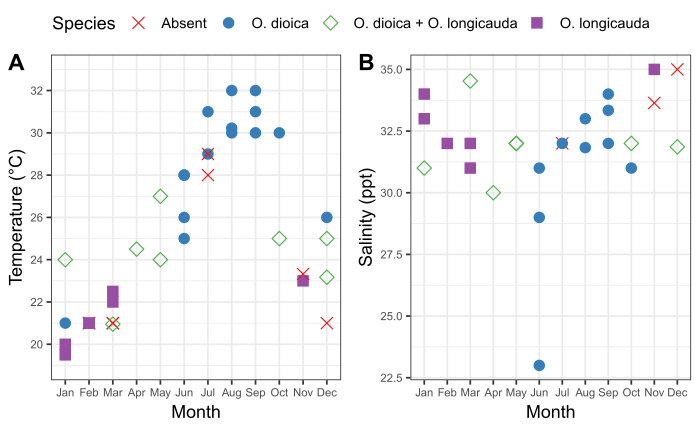
図6 沖縄のO.ディオイカの季節性
石川(A)温度の季節変化と(B)石川(26°25'39.3"N 127°49'56.6"E)とKin(26°26'40.2"N 127 550.2"N 127 550.00.30"E19)の季節変化に関連するO.ディオイカとO.ロンギカウダの有無50匹以上の動物を手動で数えた場合、各種は存在として記録された。表面水の温度と分量測定を記録した。この図の大きなバージョンを表示するには、ここをクリックしてください。
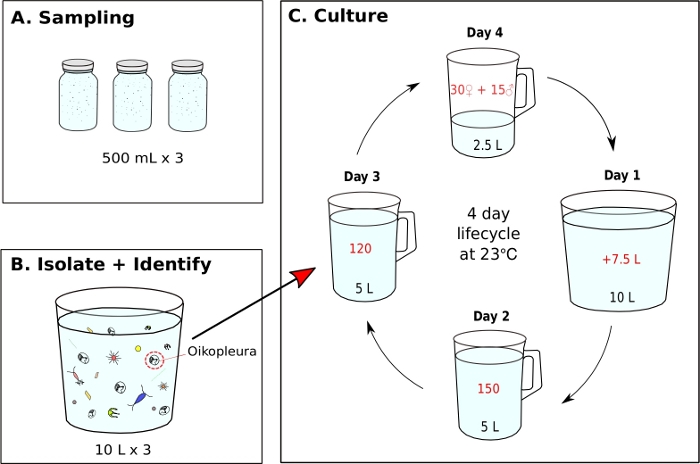
図7:O.ジオイカ単一培養を起用するフローチャート。
(A)3、500 mLプランクトンサンプルをサンプリング部位から採取する(B)各サンプル瓶が希釈され、O.ジオカはプランクトンの残りの部分から分離される(C)O.ジオカの単一培養は、120Day 3動物を5Lの新鮮な濾過された海水(fSW)を含む新しいビーカーに手動で移すことによって開始される。A30人の女性、15人の男性、2.5 Lの新鮮なfSWを含む産卵ビーカーを設置します。最初の朝の産卵後(Day1)は、新世代の動物と共に産卵ビーカーを7.5 Lの新鮮なfSWを含むビーカーに慎重に空にします。2日目の産卵後(2日目)に、150匹の動物を5L新鮮なfSWを含むビーカーに移す。産卵後3日目(3日目)に、120匹の動物を5L新鮮なfSWを含むビーカーに移す。最終日(4日目)には、次世代に備えて、30人の女性、15人の男性、2.5 Lの新鮮なfSWを含む新しい産卵ビーカーを設置しました。動物は23°Cで4日間のライフサイクルを持っています。この図の大きなバージョンを表示するには、ここをクリックしてください。
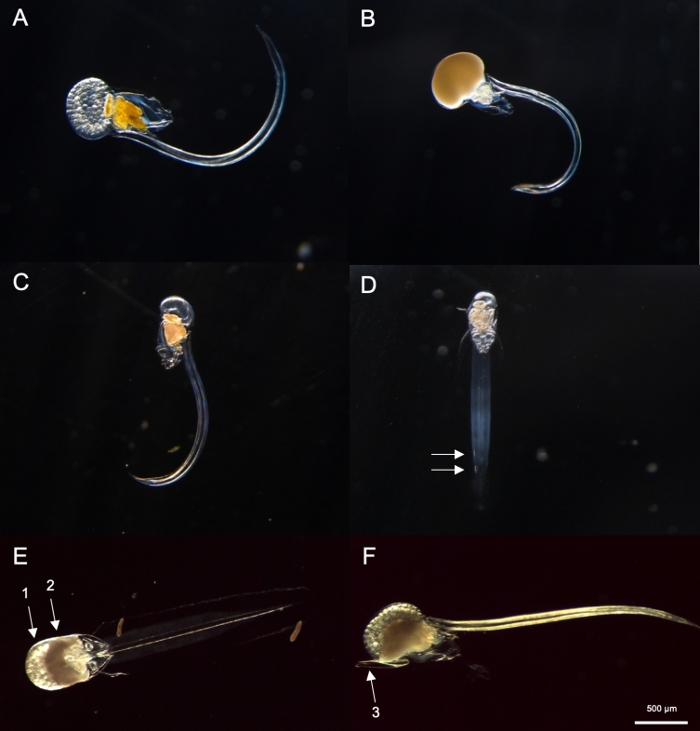
図8:オイコプレウラ属の同定(A-D:O.ディオイカ、E、F:O.ロンギカウダ)。
(A)卵子を持つ女性O.ジオアイカ(B)精子を有するオスのジオイカ(C)未熟O.ジオイカの横方向図(D)白い矢印で示された2つのサブ脊椎細胞を有する未熟O.ジオイカの側腹図(E)卵を運ぶ成熟したO.ロンディショーダの腹側図(矢1)と精子(2)(F)オロングベリアの横方向図この図の大きなバージョンを表示するには、ここをクリックしてください。
| 試薬 | 化学製品 | 量 | 最終vol. (mL) | 殺菌 | 株式 /オープン |
| ソリューション A | ナ2EDTA | 45g | 1000 | オートクレーブ | -20 °C/4°C |
| 名野3 | 100g | ||||
| H3BO3 | 33.6 g | ||||
| NaH2PO4 | 20g | ||||
| MnCl2·4H2O | 0.36 g | ||||
| フェクル3·6H2O | 1.3 g | ||||
| ソリューション B | 1.0 mL | ||||
| ソリューション B | ZnCl2 | 2.1 g | 1000 | オートクレーブ | 4 °C/4°C |
| コクル2·6H2O | 2.0 g | ||||
| (NH4)6Mo7O24·4H2O | 0.9 g | ||||
| CuSO4·5H2O | 2.0 g | ||||
| *HCl | -- mL | ||||
| ビタミン | ティアミン (B1)·Hcl | 200 mg | 1000 | オートクレーブ | -20 °C/4°C |
| ビオチン | 1 mg | ||||
| コバラミン (B12) | 1 mg | ||||
| ケイ酸ナトリウム | ナ2SiO3 | 5% | 1000 | 0.22 μm フィルター | 4 °C/4°C |
| ストレプトマイシン | C21H39N7O12 | 25 mg/mL | 50 | 0.22 μm フィルター | -20 °C / -20 °C |
表1:藻類の維持に必要な試薬のレシピ溶液Bに対してリストされたすべての化学物質を溶解した後、濁りのない溶液が明らかになるまでHClを添加する。すべての試薬は、オートクレーブ(120°C、25分)または0.22 mフィルターの使用により滅菌されます。ビタミンストックを除くすべての試薬は、指定された化学物質を添加した後に殺菌されます。ビタミンストックの場合は、まず水をオートクレーブし、次に記載された化学物質を溶解します。ストックおよび開いた試薬の保管温度がリストされています。
| カルチャタイプ | 藻類のspp. | ASW (mL) | ビタミン | ソリューション A | ケイ酸ナトリウム | ストレプトマイシン | 藻類(mL)/カルチャータイプ | インキュベート/ストア | 周波数 |
| ストックカルチャー | チェト | 60 | 1/2000 | 1/2000 | 1/4000 (茶人のみ) | 1/1000 (Syn以外のすべて) | 0.03 / 在庫 | 17°C/4°C | 隔週 |
| Iso | 60 | 0.03 / 在庫 | |||||||
| Rhino | 80 | 0.06 / 在庫 | |||||||
| Syn | 60 | 0.03 / 在庫 | |||||||
| サブカルチャー | チェト | 500 | 1/2000 | 1/2000 | 1/4000 (茶人のみ) | 1/1000 (Syn以外のすべて) | 10 /在庫 | 17°C/17°C | 毎 週 |
| Iso | 500 | 10 /在庫 | |||||||
| Rhino | 500 | 20 /在庫 | |||||||
| Syn | 500 | 10 /在庫 | |||||||
| 労働文化 | チェト | 400 | 1/2000 | 1/2000 | 1/4000 (茶人のみ) | 1/1000 (Syn以外のすべて) | 100 /サブ | RM/RM | 4日ごと |
| Iso | 400 | 100 /サブ | |||||||
| Rhino | 400 | 150 /サブ | |||||||
| Syn | 400 | 100 /サブ |
表2:3種の藻類培養型の維持のための指示オートクレーブ海水を含むフラスコに指定量のサプリメントを追加します。各フラスコを指定量の藻類培養物で接種する。指定温度で藻類培養物をインキュベートして保存します。前のストックカルチャーから新しいストック文化とサブカルチャーを接種し、以前のサブカルチャーから新しい労働文化を取り入れました。新しいストック文化、サブカルチャー、ワーキングカルチャーを2週間、1週間、4日ごとに接種する。このスケジュールは、O.ディオイカ文化の約10ビーカーに十分な食べ物を提供します。バックアップとして各藻類文化タイプの2-3セットを維持します。RM - 室温。
| 日 | 藻類のspp. | 午前9時と午後5時 | 午後12時 |
| 1 | チェト | — | — |
| Iso | 1000 | 2000 | |
| Syn | 20,000 | 40,000 | |
| 2 | チェト | 1000 | 2000 |
| Iso | 2000 | 2000 | |
| Rhino | 1000 | 1000 | |
| 3 | チェト | 3000 | 4000 |
| Iso | 3000 | 4000 | |
| Rhino | 1500 | 1500 | |
| 4 | チェト | 1000 | 2000 |
| Iso | 1000 | 2000 | |
| Rhino | 1000 | 1000 |
表3:ブーケら27から摂食1回あたりの藻類濃度を修飾した。沖縄O.ジオイカの4日間のライフサイクルで、藻類濃度(細胞mL-1)と毎日の摂食に使用される藻類種。
補足ファイル1:毎日のフィードチャート。各培養ビーカーの毎日の供給量は、毎日の藻類吸光度測定(OD)、動物の大きさ(Day)、および各培養ビーカーにおける海水の体積(SW vol.)に入った後に自動的に計算される。R.レチクルタおよびシネココッカスspの成長曲線は、ブーケら27から適応した。このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル2:アクリルパドルに同期モータを接続する方法。六角レンチを使用して、モーターにパドルをしっかりとねじ込みます。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
O.ジオカ文化の確立の柔軟性を促進するためには、動物の自然の生息地を理解することが重要です。季節データは、実験室の培養条件を導くために使用できる物理的パラメータの範囲に関する情報を提供します。また、動物の豊富さの季節変動を理解するのに役立ちます。沖縄では、O.ディオイカが6月から10月まで最も確実に見つかる。しかし、東京湾では、2月と10月41日に人口がピークに達します。O.ジオカの培養は20°C以下27、28、2928,29で報告されることが多いが、沖縄O.ジオカは20°Cを超える温度でより良い生存率を示す。27沖縄の海面水の最低温度が~20°Cであるということで説明できるかもしれません(図6)。O.ジオカの豊富さも植物プランクトンの花42と捕食者の豊富さ43、44の影響を44受けるかもしれません。O.ジオカがどこで収集されているかに関係なく、地元の人々の季節性を理解することは、サンプリングと培養の成功のチャンスを最大化します。
適切な季節と場所を考えると、ネットサンプリングは最小限の労力で多数のオイコプレラを収集する効果的な方法です。小さいメッシュサイズ(60〜70 μm)のプランクトンネットは、動物のすべての段階を収集するためにも使用することができます。完全に成熟した動物は、おそらくライフサイクルの終わりにその脆弱性のために、ネットで見られることはめったにありません。したがって、種同定後のサンプリングは、脊体下細胞の顕微鏡観察によって達成される。成熟した個体は、通常、動物が実験室で成長し続けるにつれて、サンプリング後1〜2日に現れる。ネット サンプリングは効率的ですが、異なる状況で代替サンプリング方法が必要になる場合があります。例えば、都市部付近でのネットサンプリングは、植物プランクトンを大量に集めることが可能で、オイコプレウラを隔離することが困難である。このような場合には、港の向こうの領域から水面海水またはボートサンプリングを収集するための簡単なバケットサンプリングをお勧めします。結果は、連続した日の雨による食前の漸進的変化がO.ディオイカの豊富さに影響を与えなかったことを示した。しかし、熱帯低気圧などの極端な気象事象の直後に海岸をサンプリングすることは避けるべきです。これらの事象は、保護された水域45,46,46に突然の急激な生物地球化学的変化を引き起こす。雨水流出は、汚染物質、堆積物、過剰な栄養素を運び、濁度を増加させ、水質を低下させる47.オイコプレウラのようなフィルター給餌プランクトンは、摂食のモードと限られた移動性のためにこれらの変化の影響を受けやすいかもしれません。このような状況では、局所的な条件が正常に戻るまで数日間サンプリングを延期することをお勧めします。
O.dioicaのような小さなフィルター供給生物を維持するためには、多段階フィルタシステムの導入が不可欠です。不十分に濾過された海水(例えば、以前の培養系では25μmのメッシュ)を使用すると、特に夏期には植物プランクトンの豊富さが高いため、培養が不安定になることが多かった。いくつかの植物プランクトンは、O.ジオカの成長に有益であるが、他のがO.ジオイカ胚48の異常な発達を引き起こす可能性のあるビオトキシンを産生する。さらに、Chaetoceros spp.のような高濃度の珪藻は、家を詰まらせ、効率的な給餌を防ぐことができる長いセタエを所有することができるので、O.ディオイカの成長に潜在的に有害である49。我々は頻繁にC.カルシトランスセタエによって詰まっている小動物の家を観察しました。したがって、2日目以上の動物にのみC.カルシトランスを供給します(表3)。
ここでは問題ではありませんでしたが、O.dioicaの小規模な長期培養は、遺伝的ボトルネックのために人口規模の急激な低下を経験する可能性があります。このような場合、マルティ・ソランらは29世代ごとに新しい野生の個人を文化に加えることを推奨しています。
オイコプレラ文化システムは柔軟です。1週間以内に安定した文化を確立することができます。O.dioicaの長期培養は、非専門機器を備えた控えめな予算で可能です。オイコプレウラの5~10ビーカーのメンテナンスに必要な日々の労力は、一般的に2人で2時間未満です。O.ジオイカは、天然海水28にアクセスできない人に有益である人工海水で維持することもできる。藻類食品の長期保存は、固体培養および凍結保存29を使用して可能である。さらに、O.ジオイカ精子は凍結保存することができ、そして1年以上生存可能であり続ける50年。これらの要因はすべて、文化を容易に再確立できることを意味します。最後に、プレユーロブラキアspの偶発的な培養での過去の経験.オイコプレウラのために開発された培養システムは、潜在的に脆弱な遠洋生物のより広範なコミュニティに拡張することができることを示唆している可能性があります。
O.dioicaは、様々な生物学的分野に対する強力な洞察を提供し続けています。地域の季節性、細心の文化システム、そして少数の献身的な個人を理解することで、効果的な文化をほとんど努力して確立することができます。オイコプレウラ培養システムは、このユニークな海洋帯腺の生態学、開発、ゲノミクス、および進化に関する幅広い生物分野を調査するための基礎資源を提供します。
開示事項
著者は宣言するものは何もない。
謝辞
ガース・イルズリーが文化システムの確立を支援してくれたことに感謝しています。我々は、須山律子とシルヴァン・ギロの早期サンプリングと種同定の取り組みに対する貢献を認める。西田博樹、大沼武志、表胸達也さんの皆様には、地元の培養システムの初期設立や動物や微細文化の共有など、幅広いサポートと指導を受け、感謝の気持ちを抱いています。また、ダニエル・チュラウト、ジャン=マリー・ブーケ、アン・アースヨルド、クリスティアン・カニェストロ、アルフォンソ・フェランデス=ロルダンのサンプリングと培養に関する専門知識を共有してくれたことに感謝します。ジャイ・デントン、チャールズ・プレッシー、ジェフリー・ジョリーは原稿に貴重なフィードバックを提供しました。シャーロット・ウェストは藻類計算のための一般化された方程式を策定した。最後に、OISTの資金、メアリー・コリンズ、OISTフィールドワーク安全委員会に対し、安全なサンプリング手順に関するアドバイス、培養・サンプリング装置の建設に関するOIST機械店のスタッフ、海水を供給してくれた藤田浩一に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Activated charcoal | Sigma | C2764-2.5KG | |
| Alluminum pulley | Rainbow Products | 10604-10607 | |
| Biotin | Sigma | B4501-100MG | |
| Boric acid | Wako | 021-02195 | |
| Cobalamin (B12) | Sigma | V2876-100MG | |
| Cobalt(II) chloride hexahydrate | Wako | 036-03682 | |
| Copper(II) sulfate pentahydrate | Wako | 039-04412 | |
| Disodium edetate hydrate | Wako | 044-29525 | |
| Hexaammonium heptamolybdate tetrahydrate | Wako | 019-03212 | |
| Hexagon wrench | Anex | No.6600 | |
| Hydrochloric acid | Wako | 080-01066 | |
| Iron(III) chloride hexahydrate | Wako | 091-00872 | |
| Jebao programmable auto dosing pump | Jebao | DP-4 | |
| Magnet pump | REI-SEA | RMD-201 | |
| Manganese(II) chloride tetrahydrate | Wako | 134-15302 | |
| Polypropylene wound cartridge filter | Advantec | TCW-10N-PPS | |
| TCW-5N-PPS | |||
| TCW-1N-PPS | |||
| Screwless terminal block | SATO PARTS | SL4500 | |
| Simple plankton net | RIGO, Japan | 5512-C | |
| Sodium metasilicate | Sigma | 307815-1KG | |
| Sodium nitrate | Wako | 195-02545 | |
| Sodium phosphate monobasic anhydrous | MP Biomedicals | 194740 | |
| Streptomycin sulfate salt | Sigma | S6501-25G | |
| Synchronous electric motor | Servo | D5N6Z15M | |
| Thiamin hydrochloride | Wako | 201-00852 | |
| UV sterilizer | Iwaki | UVF-1000 | |
| Zinc chloride | MP Biomedicals | 194858 |
参考文献
- Travis, J. Is It What We Know or Who We Know? Choice of Organism and Robustness of Inference in Ecology and Evolutionary Biology (American Society of Naturalists Presidential Address). The American Naturalist. 167 (3), 303-314 (2006).
- Jenner, R. A., Wills, M. A. The choice of model organisms in evo-devo. Nature Reviews Genetics. 8 (4), 311-314 (2007).
- Irigoien, X., Huisman, J., Harris, R. P. Global biodiversity patterns of marine phytoplankton and zooplankton. Nature. 429 (6994), 863-867 (2004).
- Wilson, S., Ruhl, H., Smith, J. Zooplankton fecal pellet flux in the abyssal northeast Pacific: A 15 year time-series study. Limnology and Oceanography. 58 (3), 881-892 (2013).
- Steinberg, D. K., Lomas, M. W., Cope, J. S. Long-term increase in mesozooplankton biomass in the Sargasso Sea: Linkage to climate and implications for food web dynamics and biogeochemical cycling. Global Biogeochemical Cycles. 26 (1), 1004 (2012).
- Lombard, F., Kiørboe, T. Marine snow originating from appendicularian houses: Age-dependent settling characteristics. Deep Sea Research Part I: Oceanographic Research Papers. 57 (10), 1304-1313 (2010).
- Fenaux, R., Bone, Q. . The Biology of Pelagic Tunicates. , 251-264 (1998).
- Hopcroft, R. R., Gorsky, G., Youngbluth, M. J., Deibel, D. . Response of Marine Ecosystems to Global Change: Ecological Impact of Appendicularians. , 45-57 (2005).
- Walters, T. L., Gibson, D. M., Frischer, M. E. Cultivation of the Marine Pelagic Tunicate Dolioletta gegenbauri (Uljanin 1884) for Experimental Studies. Journal of Visualized Experiments. (150), e59832 (2019).
- Deibel, D. Feeding mechanism and house of the appendicularian Oikopleura vanhoeffeni. Marine Biology. 93 (3), 429-436 (1986).
- Spada, F., et al. Molecular patterning of the oikoplastic epithelium of the larvacean tunicate Oikopleura dioica. Journal of Biological Chemistry. 276 (23), 20624-20632 (2001).
- Flood, P. R., Gorsky, G., Youngbluth, M. J., Deibel, D. . Response of Marine Ecosystems to Global Change: Ecological Impact of Appendicularians. , 59-85 (2005).
- Tokioka, T. Studies on the distribution of appendicularians and some thaliaceans of the North Pacific, with some morphological notes. Publication of the Seto Marine Biological Laboratory. (8), 351-443 (1960).
- Alldredge, A. L. Discarded appendicularian houses as sources of food, surface habitats, and particulate organic matter in planktonic environments. Limnology and Oceanography. 21 (1), 14-24 (1976).
- Clarke, C., Roff, J. C. Abundance and biomass of herbivorous zooplankton off Kingston, Jamaica, with estimates of their annual production. Estuarine, Coastal and Shelf Science. 31 (4), 423-437 (1990).
- Hopcroft, R. R., Roff, J. C. Zooplankton growth rates: extraordinary production by the larvacean Oikopleura dioica in tropical waters. Journal of Plankton Research. 17 (2), 205-220 (1995).
- Hopcroft, R. R., Roff, J. C. Production of tropical larvaceans in Kingston Harbour, Jamaica: are we ignoring an important secondary producer. Journal of Plankton Research. 20 (3), 557-569 (1998).
- Mochioka, N., Iwamizu, M. Diet of anguilloid larvae: leptocephali feed selectively on larvacean houses and fecal pellets. Marine Biology. 125 (3), 447-452 (1996).
- Sakaguchi, S. O., et al. Morphological identity of a taxonomically unassigned cytochrome c oxidase subunit i sequence from stomach contents of juvenile chum salmon determined using polymerase chain reaction. Fisheries Science. 83 (5), 757-765 (2017).
- Fenaux, R., Bone, Q. . The Biology of Pelagic Tunicates. , 25-34 (1998).
- Sato, R., Tanaka, Y., Ishimaru, T. House production by Oikopleura dioica (Tunicata, Appendicularia) under laboratory conditions. Journal of Plankton Research. 23 (4), 415-423 (2001).
- Flood, R., Deibel, D., Bone, Q. . The Biology of Pelagic Tunicates. , 105-124 (1998).
- Alldredge, A., Gorsky, G., Youngbluth, M. J., Deibel, D. . Response of Marine Ecosystems to Global Change: Ecological Impact of Appendicularians. , 309-326 (2005).
- Katija, K., Sherlock, R. E., Sherman, A. D., Robison, B. H. New technology reveals the role of giant larvaceans in oceanic carbon cycling. Science Advances. 3 (5), 1602374 (2017).
- Katija, K., Choy, C. A., Sherlock, R. E., Sherman, A. D., Robison, B. H. From the surface to the seafloor: How giant larvaceans transport microplastics into the deep sea. Science Advances. 3 (8), 1700715 (2017).
- Hidaka, K. Species composition and horizontal distribution of the appendicularian community in waters adjacent to the Kuroshio in winter-early spring. Plankton and Benthos Research. 3 (3), 152-164 (2008).
- Bouquet, J. M., et al. Culture optimization for the emergent zooplanktonic model organism Oikopleura dioica. Journal of Plankton Research. 31 (4), 359-370 (2009).
- Nishida, H. Development of the appendicularian Oikopleura dioica: culture, genome, and cell lineages. Development, Growth & Differentiation. 50, 239-256 (2008).
- Martí-Solans, J., et al. Oikopleura dioica culturing made easy: A Low-Cost facility for an emerging animal model in Evo Devo. Genesis. 53 (1), 183-193 (2015).
- Holland, L. Z. Tunicates. Current Biology. 26 (4), 146-152 (2016).
- Delsuc, F., Brinkmann, H., Chourrout, D., Philippe, H. Tunicates and not cephalochordates are the closest living relatives of vertebrates. Nature. 439 (7079), 965-968 (2006).
- Seo, H. C., et al. Miniature genome in the marine chordate Oikopleura dioica. Science. 294 (5551), 2506 (2001).
- Fredriksson, G., Olsson, R. The subchordal cells of Oikopleura dioica and O. albicans (Appendicularia, Chordata). Acta Zoologica. 72 (4), 251-256 (1991).
- Paffenhöfer, G. A. The cultivation of an appendicularian through numerous generations. Marine Biology. 22 (2), 183-185 (1973).
- Fenaux, R., Gorsky, G. Nouvelle technique d'élevage des appendiculaires. Rapports et Procés-Verbaux des Réunions-Commission Internationale pour l'Exploration Scientifique de la Mer Méditerranée. 29, 291-292 (1985).
- Fujii, S., Nishio, T., Nishida, H. Cleavage pattern, gastrulation, and neurulation in the appendicularian, Oikopleura dioica. Development Genes and Evolution. 218 (2), 69-79 (2008).
- Patry, W. L., Bubel, M., Hansen, C., Knowles, T. Diffusion tubes: a method for the mass culture of ctenophores and other pelagic marine invertebrates. PeerJ. 8, 8938 (2020).
- Fenaux, R. The classification of Appendicularia (Tunicata): history and current state. Memoires de I'Institut oceanographique. , (1993).
- Shiga, N., Chihara, M., Murano, M. . Illustrated Guide to Marine Plankton in Japan. , 1393-1414 (1997).
- Gorsky, G., Castellani, C., Castellani, C., Edwards, M. . Marine Plankton: A practical guide to ecology, methodology, and taxonomy. , 599-606 (2017).
- Sato, R., Ishibashi, Y., Tanaka, Y., Ishimaru, T., Dagg, M. J. Productivity and grazing impact of Oikopleura dioica (Tunicata, Appendicularia) in Tokyo Bay. Journal of Plankton Research. 30 (3), 299-309 (2008).
- Nakamura, Y., Suzuki, K., Suzuki, S. Y., Hiromi, J. Production of Oikopleura dioica (Appendicularia) following a picoplankton 'bloom'in a eutrophic coastal area. Journal of Plankton Research. 19 (1), 113-124 (1997).
- Nakamura, Y. Blooms of tunicates Oikopleura spp. and Dolioletta gegenbauri in the Seto Inland Sea, Japan, during summer. Hydrobiologia. 385 (1-3), 183-192 (1998).
- Uye, S. I., Ichino, S. Seasonal variations in abundance, size composition, biomass and production rate of Oikopleura dioica (Fol)(Tunicata: Appendicularia) in a temperate eutrophic inlet. Journal of Experimental Marine Biology and Ecology. 189 (1-2), 1-11 (1995).
- Tsuchiya, K., et al. Phytoplankton community response and succession in relation to typhoon passages in the coastal waters of Japan. Journal of Plankton Research. 36 (2), 424-438 (2014).
- Lopez-Lopez, L., et al. Effects of typhoons on gelatinous carnivore zooplankton off Northern Taiwan. Cahiers de Biologie Marine. 53, 349-355 (2012).
- Ares, &. #. 1. 9. 3. ;., et al. Extreme storm-induced run-off causes rapid, context-dependent shifts in nearshore subtropical bacterial communities. bioRxiv. , (2019).
- Torres-Águila, N. P., et al. Diatom bloom-derived biotoxins cause aberrant development and gene expression in the appendicularian chordate Oikopleura dioica. Communications Biology. 1 (1), 1-11 (2018).
- Troedsson, C., Frischer, M. E., Nejstgaard, J. C., Thompson, E. M. Molecular quantification of differential ingestion and particle trapping rates by the appendicularian Oikopleura dioica as a function of prey size and shape. Limnology and Oceanography. 52 (1), 416-427 (2007).
- Ouchi, K., Nishino, A., Nishida, H. Simple procedure for sperm cryopreservation in the larvacean tunicate Oikopleura dioica. Zoological Science. 28 (1), 8-11 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved