Method Article
Optimierte Probenahme und Kultivierung des pelagischen Kosmopolitischen Larvacean, Oikopleura dioica
In diesem Artikel
Zusammenfassung
Oikopleura dioica ist ein Tunika-Modellorganismus in verschiedenen Bereichen der Biologie. Wir beschreiben Probenahmemethoden, Artenidentifikation, Kultivierungsaufbau und Kultivierungsprotokolle für die Tiere und Algenfutter. Wir heben Schlüsselfaktoren hervor, die zur Stärkung des Kultursystems beigetragen haben, und diskutieren die möglichen Probleme und Lösungen.
Zusammenfassung
Oikopleura dioica ist ein planktonisches Chordate mit außergewöhnlicher Filter-Fütterungsfähigkeit, schneller Erzeugungszeit, konservierter früher Entwicklung und einem kompakten Genom. Aus diesen Gründen gilt er als nützlicher Modellorganismus für marine ökologische Studien, evolutionäre Entwicklungsbiologie und Genomik. Da die Forschung oft eine stetige Versorgung mit tierischen Ressourcen erfordert, ist es sinnvoll, ein zuverlässiges, wartungsarmes Kultursystem aufzubauen. Hier beschreiben wir eine Schritt-für-Schritt-Methode zur Etablierung einer O. dioica-Kultur. Wir beschreiben, wie potenzielle Probenahmestellen, Sammelmethoden, Zieltieridentifikation und die Einrichtung des Kultivierungssystems ausgewählt werden. Wir beraten Sie bei der Fehlerbehebung auf der Grundlage unserer eigenen Erfahrungen. Wir heben auch kritische Faktoren hervor, die dazu beitragen, ein robustes Kultursystem aufrechtzuerhalten. Obwohl das hier bereitgestellte Kulturprotokoll für O. dioicaoptimiert ist, hoffen wir, dass unsere Probenahmetechnik und unser Kulturaufbau neue Ideen für die Aufrechterhaltung anderer fragiler pelagischer Wirbellose inspirieren werden.
Einleitung
Modellorganismen haben bei der Behandlung vieler biologischer Fragen, einschließlich der Fragen im Zusammenhang mit Entwicklung, Genetik und Physiologie, eine entscheidende Rolle dabei geleistet. Darüber hinaus erleichtern zusätzliche Modellorganismen neue Entdeckungen und sind daher entscheidend, um ein besseres Verständnis der Natur zu erreichen1,2. Marine Zooplankton sind verschiedene Gruppen von Organismen, die eine wichtige Rolle in Ozean-Ökosystemespielen 3,4,5,6. Trotz ihrer Fülle und ökologischen Bedeutung sind gelatinöse Organismen wie planktonische Tunikaten in Plankton-Biodiversitätsstudien oft unterrepräsentiert, weil ihre Transparenz und Fragilität die Feldsammlung und -identifikation zu einer Herausforderung macht7,8. Angepasste Probenahmeverfahren und Laborkultivierung ermöglichen eine genauere Beobachtung der Tiere in vitro, was das Wissen in der Biologie der planktonischen Tunikaten9,10,11,12gefördert hat.
Larvaceans (Appendicularians) sind eine Klasse von freischwimmenden Meerestunika, die rund 70 beschriebene Arten weltweitumfassen 8,13. Da sie eine der am häufigsten vorkommenden Gruppen innerhalb der Zooplanktongemeinschaften14,15,16,17sind, stellen Larven eine primäre Nahrungsquelle für größere planktonische Organismen wie Fischlarven18,19dar. Im Gegensatz zu Ascidians behalten die sessile Tunikaten-Larvaceane eine Kaulquappen-ähnliche Morphologie und bleiben planktonisch ihr ganzes Leben lang20. Jedes Tier lebt in einer selbst gebauten, komplizierten Filter-Fütterungsstruktur, die als Haus bekannt ist. Sie akkumulieren Partikel in ihren Häusern, indem sie Wasserströmungen durch die wellige Bewegung ihrer Schwänze erzeugen21. Verstopfte Häuser werden den ganzen Tag über entsorgt, von denen einige Kohlenstoffaggregate bilden und schließlich auf den Meeresboden sinken22; Daher spielen Larven eine wichtige Rolle beim globalen Kohlenstofffluss23. Die meisten Arten leben berichten, in der pelagischen Zone innerhalb der oberen 100 m der Wassersäule13zu leben; jedoch ist der riesige Larven Bathochordaeus bekannt, die Tiefen von 300 m24bewohnen. Eine Studie über Bathochordaeus in Monterey Bay, Kalifornien, ergab, dass die Tiere auch als biologischer Vektor von Mikroplastik dienen, was auf eine potenzielle Bedeutung für das Verständnis der Rolle von Appendicularians beim vertikalen Transport und vertrieb von Mikroplastik in den Ozeanenhindeutet 25.
Oikopleura dioica, eine Larvenart, hat in den letzten Jahren aufgrund mehrerer bemerkenswerter Eigenschaften als Modellorganismus auf sich aufmerksam gemacht. Es wird häufig in den Weltmeeren berichtet. Es ist besonders reichlich inKüstengewässern 26, die einfache Probenahme von der Küste ermöglicht. Langfristige, stabile Kultivierung ist sowohl mit natürlichem als auch künstlichem Meerwasser27,28,29möglich. Die temperaturabhängigen Erzeugungszeiten sind unter Laborbedingungen bis zu 4-9 Tage. Es hat eine hohe Fruchtbarkeit mit jedem Weibchen in der Lage, >300 Eier das ganze Jahr über zu produzieren. Als Tunikatnimmt es eine wichtige phylogenetische Position für das Verständnis der Chordate-Evolution30,31. Mit 70 Mb hat O. dioica das kleinste identifizierte Genom unter allen Chordaten32. Unter den Larvaceanen ist O. dioica die einzige bisher beschriebene nicht-hermaphroditische Art33.
Die erste erfolgreiche O. dioica Kultur mit im Labor angebauten Mikroalgen berichtete Paffenhöfer34. Das ursprüngliche Kulturprotokoll mit Synchronmotoren und Paddeln wurde von Fenaux und Gorsky35 entwickelt und später von mehreren Laboratorien übernommen. In jüngerer Zeit berichteten Fujii et al.36 über die Kultivierung von O. dioica im künstlichen Meerwasser, ein robustes Kultursystem und eine Feldsammlung wurden von Bouquet et al.27 beschrieben und ein optimiertes Protokoll für ein vereinfachtes, erschwingliches System wurde von Marti-Solans et al.29berichtet. Neben dem traditionellen Oikopleura-Kultursystem hat ein neu gemeldetes Design mit einem Doppelrohr-Aufzuchttank auch das Potenzial, Oikopleura sp zu kultizieren. 37.
Wir präsentieren ein detailliertes Protokoll zur Initiierung einer O. dioica Monokultur auf der Grundlage einer Kombination von Protokollen, die von großen Oikopleura-Forschungsgruppen am Sars International Centre for Marine Molecular Biology27, der Universität Barcelona29, der Osaka University28und unseren eigenen Beobachtungen entwickelt wurden. In zuvor veröffentlichten Kulturprotokollen wurden detaillierte Informationen über die Zusammensetzung von Algenmedien, Küstenprobentechniken und Oikopleura-Identifikation nur grob beschrieben, was eine Menge Unklarheiten hinterließ. Hier haben wir mit Hilfe visueller Informationen im Videoprotokoll alle wichtigen Informationen zusammengestellt, die notwendig sind, um eine O. dioica-Kultur von Grund auf auf einfache, schrittweise Weise aufzubauen. Wir beschreiben, wie man O. dioica von einer anderen häufig gemeldeten Art, O. longicauda, unterscheidet, die einer der anspruchsvollsten Schritte ist. Obwohl die bestehenden Kultursysteme für den weltweiten Anbau von O. dioica anwendbar sind, unterstreichen wir die Bedeutung der Protokollanpassung auf der Grundlage lokaler Umweltbedingungen. Die präsentierten Informationen kombinieren weit veröffentlichte Daten sowie Erfahrungserfahrungen. Das aktuelle Protokoll ist ideal für Forscher geeignet, die eine Kultur von Grund auf neu aufbauen möchten.
Protokoll
1. O. dioica Kulturanlage
- Wasserfiltersystem (Abbildung 1)
- Sammeln Sie natürliches Meerwasser aus einem Hafen in 2-3 m Tiefe. Passieren Sie das Meerwasser durch einen Sandfilter (Porengröße 1,4 mm) und transportieren Sie zu einem gemeinsamen Reservoirtank im Labor. Verwenden Sie einen Kanisterfilter, um das Wasser zu zirkulieren, um die Wasserqualität im gemeinsamen Reservoirtank zu erhalten.
- Richten Sie in einem Kulturraum ein mehrstufiges Filtersystem ein, das aus einem 100-L-Behältertank mit einer Magnetantriebspumpe, 5 m und 1 m Polypropylen-Wundpatronenfiltern und einem UV-Sterilisator (100 V) besteht (Abbildung 1).
- Übertragen Sie das Meerwasser aus dem gemeinsamen Reservoirtank in den Kulturraum-Reservoirtank. Passieren Sie das Meerwasser durch eine 25-mm-Filtereinheit (Abbildung 1A,B), bevor Sie den Tank des Kulturraumbehälters betreten. Zirkulieren Sie das Meerwasser über Nacht durch 5 und 1 m Filter, um Partikel gründlich zu entfernen, die die Entwicklung von Tieren behindern könnten.
HINWEIS: Ein zusätzlicher Filter mit einer größeren Maschenöffnung (25-50 m) ist nützlich, um zu verhindern, dass größere Partikel die Patronenfilter mit kleineren Maschenöffnungen verstopfen. Das gefilterte Meerwasser (fSW) ist am nächsten Morgen einsatzbereit.
-
Oikopleura Kultivierungseinheit (Abbildung 2)
- Halten Sie Tiere in 5 oder 10 L runden, transparenten Plastikbechern.
- Stellen Sie Kulturbecher auf ein stabiles, zweistufiges Edelstahlregal (L x B x H = 150 cm x 45 cm x 90 cm) mit einer 5 mm dicken, transparenten Acryl-Oberflächenplatte.
- Positionieren Sie weiße Leuchtstofflampen unter der Acryloberfläche, um die Tiere vom Boden der Becher zu beleuchten.
- Legen Sie eine schwarze Plastikfolie hinter die Becher. Das schwarze Blatt schafft Kontrast und verbessert die Visualisierung der transparenten Tiere.
- Synchrone Elektromotoren an Acrylpaddel anschließen (L x H = 8 cm x 27 cm) (Zusatzdatei 2). Die Paddel in den Kulturbechern von parallelen Schienen, die entlang der Länge des Regals verlaufen, hängen (Abbildung 2A).
- Schalten Sie die Motoren ein, um eine sanfte kreisförmige Bewegung in den Bechern bei 15 Umdrehungen pro Minute zu erzeugen.
HINWEIS: Die Tiere in ihren Zellulosehäusern sind neutral auftriebsvoll; Die Wasserzirkulation hilft jedoch, Eier, Larven und Algennahrung zu halten, die in den Kulturbechern ausgesetzt und gleichmäßig verteilt werden.
- Automatische Dosierpumpe (Optional)
HINWEIS: Eine automatische Zuführeinheit reduziert den Personalbedarf, insbesondere an den Wochenenden.- Kalibrieren Sie das Volumen der Dosierflüssigkeit aus einer automatischen Dosierpumpe gemäß den Anweisungen des Herstellers.
- Verwenden Sie 50 ml Rohre als Algenreservoirs.
- Bohren Sie zwei 5 mm Löcher auf die Kappen von 50 ml Rohren, um durch Airline-Schläuche zu passieren. Schließen Sie ein Rohr an eine Standard-Aquarium-Luftpumpe an, um Luftblasen einzuführen, und das andere Rohr an den Einlassanschluss der Dosierpumpe (Abbildung 2B).
HINWEIS: Die Einführung eines dünnen Stroms von Luftblasen trägt dazu bei, dass Algen nicht auf dem Boden der Rohre absetzen. - Programmieren Sie die Zeit und das Volumen des Algenfutters, das an einem bestimmten Tag abgegeben werden soll.
- Algenstation
- Verwenden Sie ein Regal (L x B x H = 90 cm x 46 cm x 115 cm), um vier 1 L runde Bodenkolben mit Algenarbeitskulturen zu platzieren (siehe Schritt 2.1).
- Beleuchten Sie die Arbeitskulturen, indem Sie Leuchtstofflampen hinter die Kolben stellen.
- Dichtungskolben mit Zwei-Loch-Gummistopfen.
- Passieren Sie eine 1 ml Einwegpipette durch den Gummistopfen. Verwenden Sie Airline-Schläuche, um die Pipette an eine Aquarienluftpumpe anzuschließen. Führen Sie einen Strom von Luftblasen in den Kolben ein.
2. Mikroalgennahrung
- Initiierung von Algenkulturen
HINWEIS: Bewahren Sie drei Gruppen von Kulturen (Bestands-, Unter- und Arbeitskulturen) für drei Mikroalgenarten, Chaetoceros calcitrans, Isochrysis sp., Rhinomonas reticulata, und eine Art von Cyanobakterien, Synechococcus sp.. Bestand und Subkulturen werden als Back-ups verwendet. Die Arbeitskultur wird für die tägliche Fütterung verwendet.- Bereiten Sie Reagenzien für die Kultivierung von Mikroalgen und Cyanobakterien vor (Tabelle 1).
- Um die Bestandskultur zu initiieren, Autoklav (121 °C, 25 min) 60 – 80 ml fSW in einem 100 mL Erlenmeyer Kolben. Aseptisch impfen angegebene Menge an modifizierten Conway Medium27 und Mikroalgen (Tabelle 2). Zum Beispiel, um eine Bestandskultur von C. calcitrans, Autoklav 60 ml Meerwasser zu impfen, aseptisch 30 l des Vitamins und der Lösung A, 15 l Natriumsilikat, 60 l Streptomycin und 30 l C. Calcitran aus der vorherigen Bestandskultur zu impfen.
HINWEIS: R. reticulata wechselt von rötlich-rosa zu orangisch-braun, wenn er zu viel Licht ausgesetzt ist. Bewegen Sie sie weg vom Licht, sobald sie begonnen haben, sich von klar zu hellrosa zu drehen. - Halten Sie die Bestandskultur in einem Inkubator bei 17 °C mit kontinuierlicher Beleuchtung aufrecht. Nach etwa 10 Tagen ändert sich die Farbe der Kultur, um das Algenwachstum anzuzeigen (Abbildung 3). Sobald die Farben erscheinen, verschieben Sie sie auf 4 °C für die langfristige Lagerung für bis zu 1 Monat.
- Auf einer sauberen Bank, aseptisch impfen eine Subkultur aus der Aktienkultur (Tabelle 2). Bei 17 °C mit kontinuierlicher Beleuchtung inkubieren. Nachdem Algenfarben erscheinen, weiterhin im Inkubator bis zu 2 Wochen zu speichern.
- Arbeitskultur aus der Subkultur impfen (Tabelle 2). Versiegeln Sie den Kolben mit einer Gummikappe und legen Sie 1 ml Einwegpipette ein. Bewegen Sie den Kolben zur Algenstation und halten Sie ihn bei Raumtemperatur mit einer Fotoperiode von 8 h. Versorgung mit ständiger Belüftung. Erneuern Sie die Arbeitskultur alle 4 Tage.
- Stock und Subkulturen zweimal täglich durch Wirbeln umrühren.
HINWEIS: Langfristige Lagerung der Algenkultur auf festen Medien und Kryokonservierung sind bis zu 3 Monate bzw. 1 Jahr bzw.29möglich.
- Erstellen von Algenwachstumskurven (optional)
HINWEIS: Genaue Bewertung der Fütterungsmenge ist wichtig, um eine stabile Kultur von O. dioicazu erhalten. Wir haben Wachstumskurven für zwei primäre Algenfutterarten erstellt, Chaetoceros calcitrans und Isochrysis sp.- Vorbereiten von C. calcitrans und Isochrysis sp. Arbeitskulturen (Tabelle 2).
- Für jede Art der Arbeitskultur drei verschiedene Zeiten proben und Absorptionen bei 660 nm mit einem Spektralphotometer messen. Nehmen Sie die durchschnittlichen Messungen der Triplicate aus jeder Arbeitskultur.
- Nach den Anweisungen des Herstellers für einen automatisierten Zellzähler, bereiten Sie Algenproben für die Zählung. Zählen Sie jede Probe dreimal. Nehmen Sie den Durchschnitt von drei Zählungen, um die Gesamtzahl der Zellen zu bestimmen, die in jeder Probe vorhanden sind.
- Zählen Sie weiterhin täglich, bis etwa 50 durchschnittliche Messungen aufgezeichnet werden.
- Erstellen Sie Wachstumskurven für beide Algenarten (Abbildung 4).
3. Feldsammlung von wilden Oikopleura spp.
- Geändertes Planktonnetz (Abbildung 5)
HINWEIS: Der Schlüssel zur erfolgreichen Probenahme von Oikopleura spp. ist das langsame Abschleppen eines Planktonnetzes mit einem gewichteten, nicht filternden Kabeljau-Ende. Abbildung 5 zeigt ein schematisches Diagramm eines modifizierten Planktonnetzes.- Ersetzen Sie das Kabeljau-Ende eines handgehaltenen Planktonnetzes durch eine modifizierte 500 ml Schraub-Top-Waschflasche.
- Bohren Sie ein Loch mit einem Durchmesser von 3 cm in die Schraube mit einem Durchmesser von 4 cm, damit Wasser und Tiere in das Kabeljau-Ende gelangen können.
- Montieren Sie den Flaschenverschluss am Ende des Planktonnetzes. Wickeln Sie es fest mit Elektroband. Sichern Sie die Kappe weiter mit einer Edelstahl-Schlauchklemme.
- Befestigen Sie ein Gewicht von 70 g an der Außenseite des modifizierten Kabeljau-Ends mit Reißverschlüssen.
- Befestigen Sie die Sicherheitsleine, um das Kabeljau-Ende weiter zu sichern.
- Auswählen von Sammelstellen (Abbildung 6)
HINWEIS: Alle Probensammlungen wurden vom OIST Fieldwork Safety Committee genehmigt. Je nach Standort kann es zu saisonalen Schwankungen in Gegenwart von Oikopleura spp. treten (Abbildung 6). Vermeiden Sie Probenahmen unmittelbar nach extremen Wetterereignissen wie schweren Regenstürmen.- Verwenden Sie die Satellitenansicht auf einer Kartenwebsite, um potenzielle Stichprobenstandorte zu identifizieren. Wir konzentrierten uns auf Häfen und Fischerstege, die leicht mit dem Auto erreichbar sind und sich in Buchten oder in der Nähe von Meerestropfen befinden, wo plankton sich ansammeln: Ishikawa-Hafen in Kin Bay, Okinawa, Japan (GPS: 26°25'39.3"N 127°49'56.6"E).
- Besuchen Sie potenzielle Probenahmestellen, um die Erreichbarkeit und Sicherheit der einzelnen Standorte zu bewerten. Erhalten Sie bei Bedarf eine Sammelgenehmigung von den lokalen Behörden.
- Probenahmeverfahren
- Das Planktonnetz ins Meer werfen und das Kabeljau-Ende 1-2 m unter der Wasseroberfläche sinken lassen.
- Schleppen Sie das Netz horizontal von Hand bei 50-100 cm s-1. Weiter schleppen, indem Sie für 2-5 Minuten hin und her gehen. Passen Sie die Abschleppzeit entsprechend der Fülle von Phytoplankton im Hafen an, mit kürzerem Schleppen, wenn es mehr Phytoplankton gibt.
HINWEIS: Larvaceans sind zerbrechliche Tiere. Schnelles Abschleppen oder wiederholtes Gießen des Netzes könnte Tiere schädigen, die im Kabeljau-Ende gefangen sind. - Heben Sie das Netz vorsichtig an. Den Inhalt des Kabeljau-Endes langsam in eine 500 ml Runde Glasflasche übertragen. Füllen Sie die Probenflasche vollständig mit Meerwasser, um Luftblasen zu vermeiden.
HINWEIS: Das Vorhandensein von Oikopleura spp. kann durch das Betrachten von Probenflaschen vor schwarzem Hintergrund bestätigt werden. Die meisten Tiere verlassen ihre Häuser, während sie gesammelt werden. Daher ist eine mikroskopische Beobachtung für die Identifizierung auf Artenebene erforderlich. - Wiederholen Sie die Probenahme, bis drei 500 ml Flaschen gesammelt werden.
- Messen Sie Salzgehalt, Temperatur und Chlorophyll a mit einem CTD-Profiler, um den Bereich der physikalischen Parameter aufzuzeichnen, in denen Tiere natürlich sind.
- Sammeln Sie 10-15 L Oberflächenmeerwasser in einem Eimer, um Tiere im Labor zu akklimatisieren.
4. Isolierung und Kennzeichnung von Tieren (Abbildung 7, Abbildung 8)
-
Oikopleura spp.
HINWEIS: Andere planktonische Organismen, die Oikopleura spp. auf den ersten Blick ähneln können, sind Chaetognath, Fritillaria spp., Nematoden, Fischlarven mit Dottersäcken und Ciona spp. larven.- Um die Tiere an Laborbedingungen zu gewöhnen, übertragen Sie jede 500 ml Probe in ein 10-L-Becherglas mit einem Verhältnis von 1:1 oberflächenhaltigem Meerwasser aus dem Probenahmeort und gefiltertem Meerwasser (fSW), das im Labor gehalten wird (Abbildung 7A,B). Passen Sie das Volumen des Bechers auf 5-10 L an, abhängig von der Konzentration der Planktonprobe.
HINWEIS: Wenn die Planktonprobe unerwünschten Schmutz enthält, durchlaufen Sie einen Grobfilter (Maschenöffnung 600 m), bevor Sie in einen 10-L-Becher übertragen werden. - Verwenden Sie ein Paddel, das an einem synchronen Elektromotor (15 Umdrehungen pro Minute) befestigt ist, und halten Sie das Plankton über Nacht in Suspension (Schritt 1.2.5).
- Identifizieren Sie Oikopleura spp. durch die Suche nach 1-2 mm langen, Kaulquappen-förmigen Tieren, die ihre Schwänze in einem kugelförmigen, lichtdurchlässigen Haus wellen. Einige Tiere können vorübergehend frei schwimmen ohne die Häuser. Mit einer stumpfen Pipette pro-Ende-Pipette 5 Tiere vorsichtig auf eine leere Petrischale übertragen.
- Zur Gattungsidentifikation vertreiben Sie Tiere aus ihren Häusern, indem Sie das Haus sanft mit einer Transferpipette bewerfen.
- Beobachten Sie hauslose Tiere unter einem 20-40x Dunkelfeldmikroskop und bestätigen Sie Oikopleura spp (Abbildung 8).
- Um die Tiere an Laborbedingungen zu gewöhnen, übertragen Sie jede 500 ml Probe in ein 10-L-Becherglas mit einem Verhältnis von 1:1 oberflächenhaltigem Meerwasser aus dem Probenahmeort und gefiltertem Meerwasser (fSW), das im Labor gehalten wird (Abbildung 7A,B). Passen Sie das Volumen des Bechers auf 5-10 L an, abhängig von der Konzentration der Planktonprobe.
-
O. dioica-Identifikation
HINWEIS: O. dioica kann visuell durch das Vorhandensein von vollreifen Männchen und Weibchen oder zwei großen subchordalen Zellen identifiziert werden, die sich auf der distalen Hälfte ihrer Schwänzebefinden. Der Abstand zwischen zwei subchordalen Zellen kann zwischen Individuen variieren.- Als nächstes überprüfen Sie, ob es eine voll ausgereifte Oikopleura mit einer Miteier gefüllten Gonade gibt (Abbildung 8A) oder Spermien (Abbildung 8B). Wenn das Tier nur Eier oder Spermien besitzt, überspringen Sie Schritt 4.2.3, da es O. dioicaist, die einzige beschriebene nicht-hermaphroditische Art.
- Wenn das Tier unreif ist (Abbildung 8C), suchen Sie nach zwei subchordalen Zellen am Ende seines Schwanzes (Abbildung 8D).
- Sobald die Art bestätigt ist, übertragen Sie sie auf eine neue Petrischale. Wiederholen Sie die Schritte 4.1.3-4.2.2, bis 10-20 Individuen auf Artenebene bestätigt werden.
HINWEIS: Zur leichteren Identifizierung sollen Tiere in einer Petrischale mit 0,015 % Tricainmetmetsulfonat (MS222) in fSW anbeet werden. - Wenn keine O. dioica gefunden wird, halten Sie die Becher für ein oder zwei Tage ausgesetzt. Es könnte unreife O. dioica, die weiter wachsen und leichter zu erkennen werden. Wenn nach einer Woche keine sampeln, verwerfen Sie die Probe, und versuchen Sie erneut, das Sampling durchzuführen.
5. Anbauprotokoll für O. dioica
- Initiierung einer O. dioica Monokultur aus einer Feldentnahmeprobe (Abbildung 7)
HINWEIS: Algennahrung wird täglich aus Arbeitskulturen zubereitet und jeder Monokulturbecher wird dreimal täglich um 9.00, 12.00 Uhr bzw. 17.00 Uhr gefüttert (siehe Schritt 5.2). Die Tiere werden bei 23 °C gehalten. Unter diesen Bedingungen beträgt der Lebenszyklus von Okinawa O. dioica 4 Tage (Abbildung 7C).- Um eine Monokultur von O. dioicazu initiieren, isolieren Sie 120 Tiere und übertragen Sie auf ein neues Becherglas mit 5 L frischem fSW (Abbildung 7B,C).
- Achten Sie am nächsten Morgen auf vollreife Männchen mit gelben Gonaden und Weibchen mit Eiern, die als goldene Kugeln erscheinen (Abbildung 8A,B).
- Machen Sie einen Laichbecher, indem Sie 15 Männchen und 30 Weibchen sanft auf einen neuen Becher mit 2,5 l frischem fSW mit einer 5 ml stumpfen Endpipette übertragen.
HINWEIS: Wenn es nicht genügend Männchen und Weibchen gibt, übertragen Sie so viele Erwachsene wie möglich auf einen Becher, der 1 L fSW enthält, und lassen Sie sie natürlich laichen. Um die körperliche Belastung der Tiere während des manuellen Transfers zu minimieren, sollten sie langsam abgezweit und unter der Wasseroberfläche freigesetzt werden. - Lassen Sie die Tiere auf natürliche Weise laichen, um die nächste Generation zu initiieren. Schwanzlarven sollten ca. 3 Stunden nach der Befruchtung auftreten.
HINWEIS: Das Laichen wird von vollausgereiften Tieren durchgeführt, die ihre Häuser verlassen, in Richtung Oberflächenwasser schwimmen und ihre Gameten freisetzen. Eine erfolgreiche Befruchtung kann durch Extraktion von 5-10 ml Meerwasser vom Grund des Laichbechers und Identifizierung von Eiern mit Spaltungen unter dem Mikroskop bestätigt werden. - Am ersten Morgen nach dem Laichen (Tag 1) sollte eine neue Generation von Tieren mit aufgeblasenen Häusern im Becher erscheinen. Verwenden Sie einen 500 ml Handbecher, um den Inhalt des Laichbechers vorsichtig in einen neuen Becher mit 7,5 l frischem fSW (insgesamt 10 L) zu übertragen. Gießen Sie in einem Winkel, um eine Spritzbewegung zu vermeiden.
- Am zweiten Morgen (Tag 2) werden 150 Tiere manuell in ein neues Becherglas mit 5 L frischem fSW überführen.
- Am dritten Morgen (Tag 3) werden 120 Tiere manuell in ein neues Becherglas mit 5 L frischem fSW überführen.
HINWEIS: Um die Entwicklung von Tieren zu synchronisieren, ist es wichtig, Personen mit ähnlichen Größen während der manuellen Übertragung an Tag 2 und 3 auszuwählen. Maximal 10 Tiere können in einem einzigen Transfer abgeschöpft werden. - Am vierten Morgen (Tag 4) sollten voll gereifte Tiere erscheinen. Wiederholen Sie Schritt 5.1.3, um den Lebenszyklus zu schließen.
HINWEIS: Eine automatische Fütterungspumpe kann eingestellt werden, um die Tiere am Wochenende um 17:00 Uhr zu füttern, ohne dass es sich um das Kultivierungspersonal handele.
- Tägliche Zubereitung von Algenfutter aus der Arbeitskultur
- Messen Sie die Absorption der Arbeitskultur bei 660 nm.
- Auf der Grundlage der Daily Feeding Chart, finden Sie heraus, wie viele Algenzellen für die Tiere von spezifischer Größe gefüttert werden müssen (Tabelle 3).
- Lösen Sie anhand der Algenwachstumskurven (Abbildung 4) die folgenden Gleichungen, um das Anmaßungsvolumen der Algennahrung (ml) zu berechnen, das an einem bestimmten Tag benötigt wird.
- Um das Volumen einer bestimmten Alge zu berechnen, die für einen bestimmten Tag und eine bestimmte Fütterungszeit benötigt wird, verwenden Sie die folgende Gleichung:
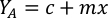
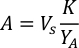
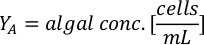
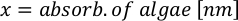
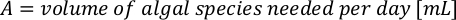
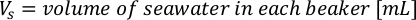
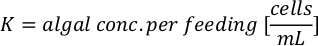
Wobei YA die Algenkonzentration an einem bestimmten Tag und A das Algenvolumen ist, das pro Fütterung benötigt wird. Darüber hinaus ist die lineare Beziehung zwischen YA zu x, die Werte für Intercept (c) und Neigung (m) in Abbildung 4dargestellt. Siehe Tabelle 3 K für K-Werte. - Um beispielsweise das Volumen der Isochrysis sp. zu berechnen, die bei einer Fütterung von Tag-3-Tieren benötigt wird, die in einer 5-L-Kultur gehalten werden, und mit einer Algenabsorption von 0,234 (gemessen bei 660 nm), wurde Folgendes berechnet:
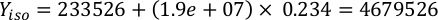
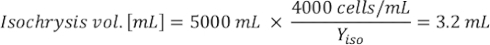
HINWEIS: Speichern Sie diese Gleichungen in einer Kalkulationstabelle, so dass die tägliche Fütterungsmenge automatisch auf der Grundlage von Absorptionsmessungen, der Größe der Tiere und dem Volumen des Kulturwassers (Zusatzdatei 1) berechnet wird.
- Um das Volumen einer bestimmten Alge zu berechnen, die für einen bestimmten Tag und eine bestimmte Fütterungszeit benötigt wird, verwenden Sie die folgende Gleichung:
- Übertragen Sie das berechnete Algenvolumen auf 50 ml-Rohre, Zentrifuge bei 5000 x g für 5 min bei 20 °C.
- Entfernen Sie den Überstand. Füllen Sie die Rohre bis zum ursprünglichen Volumen wieder mit frischem fSW und ersetzen Sie alte Algenmedien.
- Vorbereitete Lebensmittel im Kühlschrank aufbewahren, bis sie für das nächste Futter verwendet werden können. Entsorgen Sie die alten Algenfutter, nachdem am nächsten Morgen neue Nahrung zubereitet wurde.
- Aktivkohle (Optional)
HINWEIS: 10 g Aktivkohle wird jedem Kulturbecher hinzugefügt, um die Wasserqualität zu erhalten. Die Holzkohle kann bis zu viermal wiederverwendet werden. Öffnen Sie den Holzkohlebeutel langsam, um zu verhindern, dass Holzkohlestaub in die Kulturbecher gelangt.- Übertragen Sie 700 g Aktivkohle in einen Behälter. 48 Stunden in süßwasser-wasser (FW) einweichen und sich auf dem Boden niederlassen.
- Spülen Sie mit FW, um Restkohlestaub zu entfernen.
- Holzkohle in FW für 15-20 min kochen. Von der Hitze entfernen und abkühlen lassen.
- Spülen, bis die meisten Holzkohlestaub entfernt wird, und das Wasser wird klar.
- Saubere Holzkohle in 2 L Becher mit fSW lagern. Bedecken Sie das Becherglas, um das Eindringen von Staub zu verhindern.
- Fügen Sie jedem neuen Becher Holzkohle hinzu, bevor Sie die Tiere übertragen.
Ergebnisse
Oikopleura kann von einem Boot oder von einem Hafen durch langsames, sanftes Abschleppen eines 100 m Mesh-Planktonnetzes mit einem nicht filternden Kabeljau-Ende gesammelt werden (Abbildung 5). Aufgrund der Zerbrechlichkeit der Tiere ist es wichtig, jede Bewegung zu vermeiden, die körperliche Belastungen verursachen könnte, wie z. B. grobe Handhabung des Netzes oder Spritzen aufgrund einer eingeschlossenen Lufttasche im Probenglas.
Es ist wichtig, das saisonale Muster der lokalen Oikopleura-Populationen sowie die damit einhergehenden Schwankungen der physikalischen Eigenschaften des Wassers an einer Probenahmestelle zu verstehen. Die Probenahme zwischen 2015 und 2019 ergab eine konstante saisonale Variation in Anwesenheit von O. dioica in Ishikawa und Kin Häfen in Okinawa (Abbildung 6). Die Oberflächentemperatur des Meerwassers scheint ein wichtiger Faktor zu sein. O. dioica war die vorherrschende Art, als das Oberflächenmeerwasser 28 °C erreichte und O. longicauda mit O. dioica bei Temperaturen zwischen 24 °C und 27 °C koexistierte; O. longicauda dominierte jedoch unter 23 °C (Abbildung 6A). Allmähliche Veränderung des Salzgehalts nach mehreren aufeinanderfolgenden Tagen mit starkem Regen korrelierte nicht mit der Fülle von O. dioica (Abbildung 6B).
Mit den oben beschriebenen Probenahmeverfahren waren die meisten O. dioica, die wir zurückgewonnen haben, zwischen Tag 2 und 3 ihres 4-Tage-Lebenszyklus (Abbildung 7C). Reife Männchen wurden durch die gelbe Färbung der Gonaden erkannt, während weibliche Gonaden Gold aus Eiern schimmerten, die einen Durchmesser von 70-80 m hatten(Abbildung 8A,B). Unreife O. Dioica wurden durch zwei subchordale Zellen an ihren Schwänzen bestätigt (Abbildung 8D). Eine andere dominante Art in den lokalen Gewässern, O. longicauda, waren in Größe und Morphologie ähnlich. Wir verwendeten die folgenden Kriterien, um O. longicauda von O. dioica38,39,40zu unterscheiden: ein Mangel an subchordalen Zellen im Schwanz, das Vorhandensein von Velum im Stamm und das Vorhandensein einer Hermaphrodit-Gonade ( Abbildung8E,F). Die unterschiedlichen Schwanzmorphologien sind auch nützlich, um O. longicauda von O. dioicazu unterscheiden. Als ein intaktes nacktes Tier ohne hausisch seitlich ausgerichtet war, war der Schwanz von O. longicauda gerader mit weniger Krümmung, was ihm ein "steiferes" Aussehen im Vergleich zu dem von O. dioicagab.
Die drei wichtigsten Faktoren für die Etablierung eines stabilen Oikopleura-Kultursystems sind (i) die Aufrechterhaltung einer hohen Wasserqualität, (ii) die Identifizierung des optimalen Fütterungsregimes und (iii) die Einrichtung eines Laichbechers mit einer ausreichenden Anzahl von Männchen und Weibchen. Die Einführung eines mehrstufigen Filtersystems (Abbildung 1) verbesserte die Wasserqualität und -stabilität der Kultur. Ein Filtersystem ist für künstliches Meerwasser nicht erforderlich; Die Kosten, die Verfügbarkeit und der Komfort des natürlichen Meerwassers machen es jedoch zu einer besseren Option für Labore in Küstennähe. Um das Fütterungsregime festzulegen, empfehlen wir die Messung von Algenwachstumskurven, die für einzelne Laboreinstellungen gelten, da Temperatur- und Lichtverhältnisse sehr unterschiedlich sind. Wir kombinierten die Wachstumskurven mit zuvor veröffentlichten Fütterungsplänen, um die Algenfutterkonzentrationen und -zusammensetzungen zu optimieren27 (Abbildung 4). Wir folgen auch einem strengen Zeitplan für die Algenimpfung, um eine frische Versorgung mit Algennahrung aufrechtzuerhalten (Tabelle 2). Das automatisierte Fütterungssystem ermöglicht es uns, einen einheitlichen Tagesablauf ohne das Vorhandensein von Kultivierungspersonal einzuhalten (Abbildung 2B).
Sobald optimale Meerwasser- und Fütterungsbedingungen erreicht sind, ist es wichtig, neue Generationen zu initiieren, indem ein Laichbecher mit 15 Männchen und 30 Weibchen in 2,5 L fSW entsteht. Dies gewährleistet eine gute Konzentration der Tage-1-Tiere am nächsten Morgen, was ausreicht, um 150 Tiere an Tag 2, 120 an Tag 3 und 45 reife Erwachsene am 4. Tag zum Laichen zu isolieren. Wenn es an Tag 4 nicht genügend Männchen und Weibchen gibt, sammeln und übertragen Sie so viele reife Individuen wie möglich auf 1 L fSW und lassen Sie sie natürlich in der Hoffnung laichen, dass es genügend Larven gibt, um auf die nächste Generation zu gehen. Nach dem bereitgestellten Protokoll beträgt der Lebenszyklus von O. dioica 4 Tage bei 23 °C (Abbildung 7C). Wir haben zuverlässig sechs unabhängige Wildpopulationen von O. dioicaetabliert, die alle mehr als 20 Generationen dauerten.
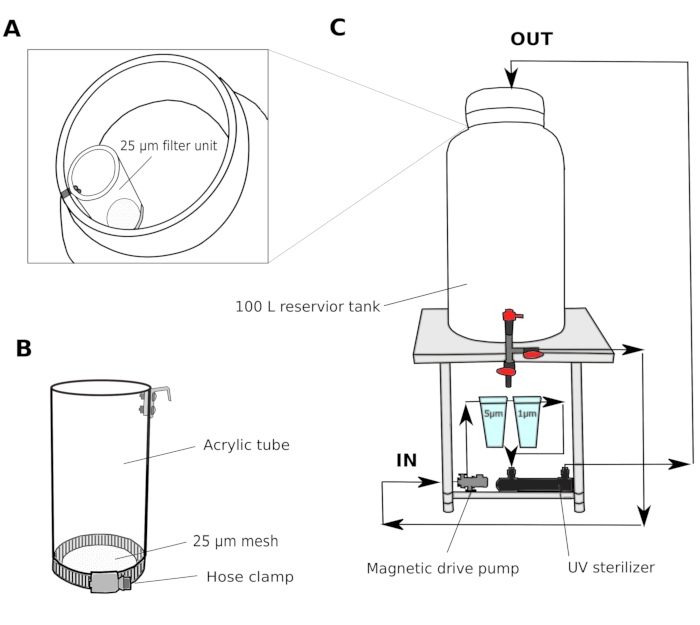
Abbildung 1: Schematic des Meerwasserfiltersystems.
(A und B) Meerwasser wird zunächst durch eine 25-mm-Filtereinheit gefiltert, bevor sie in den Reservoirtank (C) eindringt. Das Meerwasser wird dann durch zwei Polypropylenfilter und einen UV-Sterilisator geschoben, bevor es in den Reservoirtank zurückkehrt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
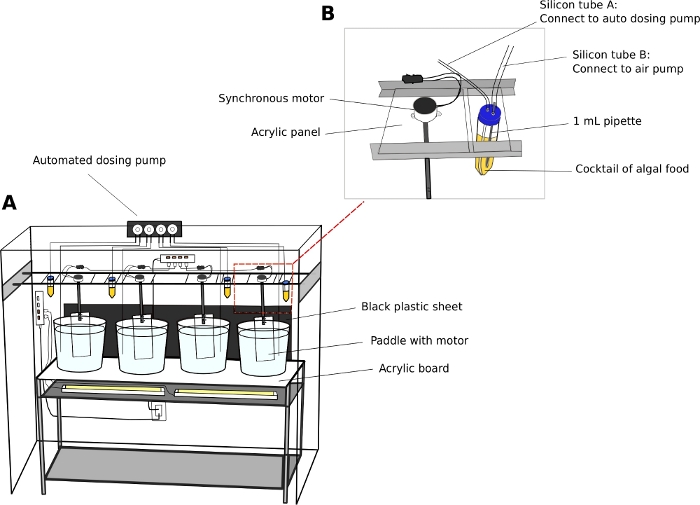
Abbildung 2: Kultursystem für O. dioica.
(A) Übersicht über das Kultursystem (B) Nahansicht des Synchronmotors und Algenreservoirs für die automatisierte Dosierpumpe. Die Innendurchmesser von Siliziumrohr A und B betragen 2 mm bzw. 4 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Bestandskulturen für O. dioica.
Von links- C. calcitrans, Isochrysis sp., Synechococcus sp. und R. reticulata nach 17 °C unter Dauerlicht für 10 Tage. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
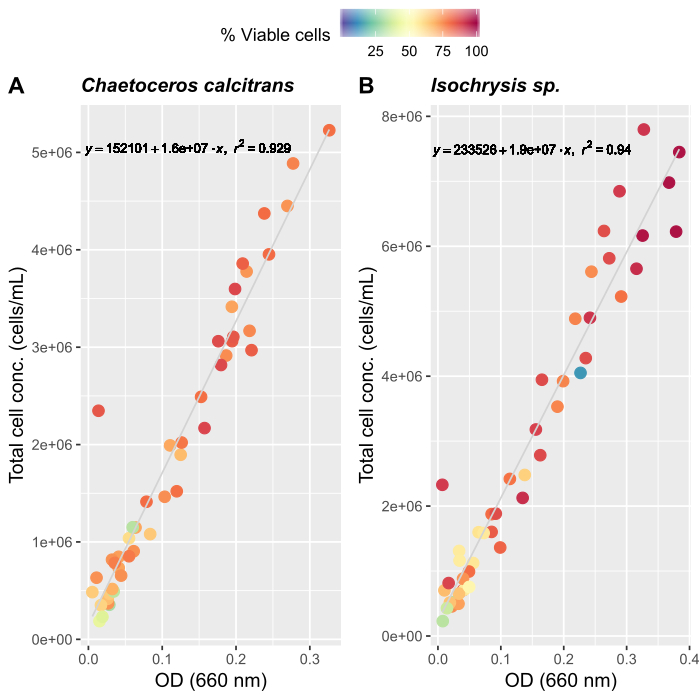
Abbildung 4: Algenwachstumskurve für zwei der wichtigsten Nahrungsarten, C. calcitrans und Isochrysis sp..
Streudiagramme der optischen Dichte (OD) bei 660 nm und der Gesamtzellkonzentration für (A) C. calcitrans und (B) Isochrysis sp.. Jeder Punkt stellt den Durchschnitt von drei Messungen dar. Ein Zellzähler wurde verwendet, um den Prozentsatz lebensfähiger Zellen und der Gesamten zellkonzentrationen (Zellen/ml) zu bestimmen. Messungen wurden 20 Tage lang aufgezeichnet (n = 47). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
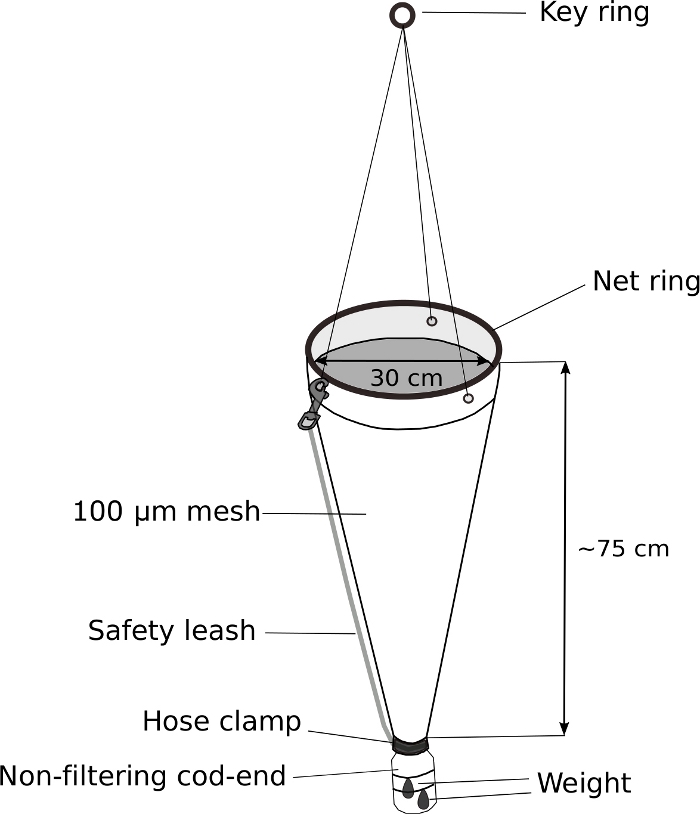
Abbildung 5: Modifiziertes Planktonnetz für die Oikopleura-Probenahme.
Das Kabeljau-Ende eines handgehaltenen Planktonnetzes (100 m Mesh) wird durch eine 500 ml Waschflasche ersetzt. Am Kabeljau-Ende wird ein Gewicht von 70 g angesetzt. Am Schlüsselring sind ca. 5 m Seil befestigt. Zur weiteren Sicherung des Kabeljaus wird eine Sicherheitsleine angebracht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
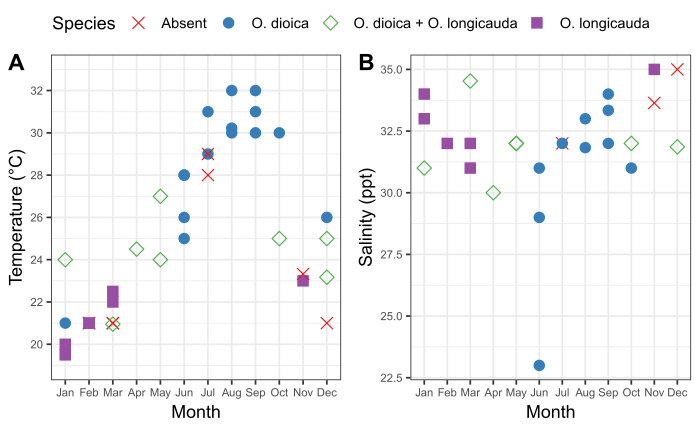
Abbildung 6: Saisonalität von O. dioica in Okinawa.
Vorhandensein und Fehlen von O. dioica und O. longicauda in Bezug auf saisonale Veränderungen der (A) Temperatur und (B) Salzgehalt in Häfen in Ishikawa (26°25'39.39.3"N 127°49'56.6"E) und Kin (26°26'40.2"N 127°55'00.3"E) zwischen 2015-2019. Jede Art wurde als vorhanden erfasst, wenn mehr als 50 Tiere manuell gezählt wurden. Temperatur- und Salzgehaltsmessungen des Oberflächenwassers wurden aufgezeichnet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
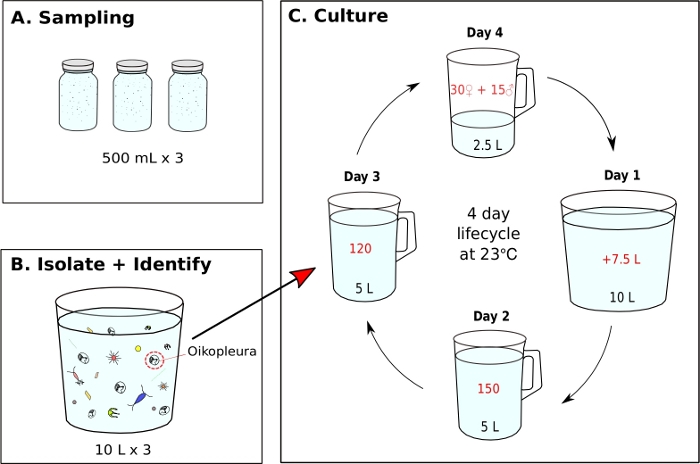
Abbildung 7: Flussdiagramm zum Initiieren von O. dioica-Monokultur.
(A) Drei, 500 ml Planktonproben werden von einer Probenahmestelle entnommen (B) Jedes Probenglas wird verdünnt und O. dioica wird vom Rest von Plankton isoliert (C) Eine Monokultur von O. dioica wird durch manuelle Übertragung von 120 Tagen 3 Tieren in ein neues Becherglas mit 5 L frischem gefiltertem Meerwasser (fSW) eingeleitet. Richten Sie einen Laichbecher mit 30 Weibchen, 15 Männchen und 2,5 l frischem fSW ein. Der erste Morgen nach dem Laichen (Tag1) entleert vorsichtig den Laichbecher mit der neuen Tiergeneration in einem Becher mit 7,5 l frischem fSW. Am zweiten Tag nach dem Laichen (Tag 2) 150 Tiere in einen Becher mit 5 L frischem fSW überführen. Am dritten Tag nach dem Laichen (Tag 3) 120 Tiere in einen Becher mit 5 L frischem fSW überführen. Am letzten Tag (Tag 4) wurde ein neuer Laichbecher mit 30 Weibchen, 15 Männchen und 2,5 L frischen fSW zur Vorbereitung der nächsten Generation aufgestellt. Die Tiere haben einen 4-tägigen Lebenszyklus bei 23 °C. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
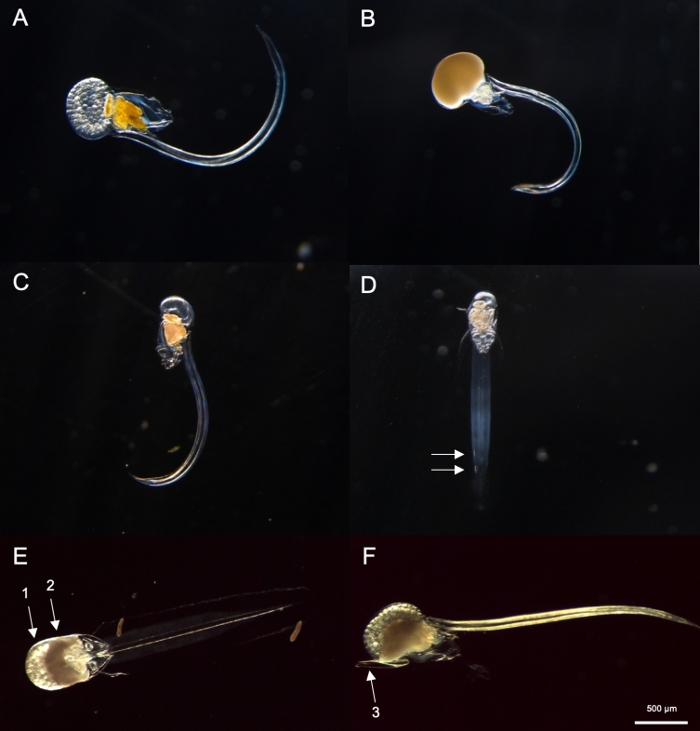
Abbildung 8: Identifizierung von Oikopleura spp. (A-D: O. dioica, E und F: O. longicauda).
(A) Weibliche O. Dioica mit Eiern (B) Männliche O. dioica mit Sperma (C) Seitenansicht der unreifen O. dioica (D) Ventralansicht der unreifen O. dioica mit zwei subchordalen Zellen, die mit weißen Pfeilen angezeigt sind (E) Ventralansicht der reifen O. longicauda tragenden Eier (Pfeil 1) und Sperma (Pfeil 2) (F) Seitenansicht von O. longicauda zeigt Velum (Pfeil 3). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Reagenzien | Chemische Produkte | Menge | Finale Vol. (mL) | Sterilisation | Lager / Geöffnet |
| Lösung A | Na2EDTA | 45 g | 1000 | Autoklaven | -20 °C / 4 °C |
| NaNO3 | 100 g | ||||
| H3BO3 | 33,6 g | ||||
| NaH2PO4 | 20 g | ||||
| MnCl24H2O | 0,36 g | ||||
| FeCl3bei 6H2O | 1,3 g | ||||
| Lösung B | 1,0 ml | ||||
| Lösung B | ZnCl2 | 2,1 g | 1000 | Autoklaven | 4 °C / 4 °C |
| CoCl2bei 6H2O | 2,0 g | ||||
| (NH4)6Mo7O24bei 4H2O | 0,9 g | ||||
| CuSO4bei 5H2O | 2,0 g | ||||
| *HCl | -- mL | ||||
| Vitamin | Thiamin (B1) Hcl | 200 mg | 1000 | Autoklaven | -20 °C / 4 °C |
| Biotin | 1 mg | ||||
| Cobalamin (B12) | 1 mg | ||||
| Natriumsilikat | Na2SiO3 | 5% | 1000 | 0,22 m Filter | 4 °C / 4 °C |
| Streptomycin | C21H39N7O12 | 25 mg/ml | 50 | 0,22 m Filter | -20 °C / -20 °C |
Tabelle 1: Rezept von Reagenzien, die für die Erhaltung von Algennahrung erforderlich sind. Nach auflösung aller für Lösung B aufgeführten Chemikalien wird HCl hinzugefügt, bis die Lösung ohne Trübung klar wird. Alle Reagenzien werden entweder durch Autoklavieren (120 °C, 25 min) oder durch Verwendung eines 0,22 m Filters sterilisiert. Alle Reagenzien mit Ausnahme der Vitaminvorräte werden nach Zugabe der spezifizierten Chemikalie sterilisiert. Für die Vitaminvorräte das Wasser zuerst autoklavieren und dann die gelistete Chemikalie auflösen. Lagertemperaturen für Lager und geöffnete Reagenzien sind aufgeführt.
| Kulturtyp | Algenspp. | ASW (mL) | Vitamin | Lösung A | Natriumsilikat | Streptomycin | Algen (mL) / Kulturtyp | Inkubieren / Speichern | Frequenz |
| Aktienkultur | Chaeto | 60 | 1/2000 | 1/2000 | 1/4000 (Nur Chaeto) | 1/1000 (Alle außer Syn) | 0,03 / Lager | 17°C / 4°C | Zweiwöchentlich |
| Iso | 60 | 0,03 / Lager | |||||||
| Nashorn | 80 | 0,06 / Lager | |||||||
| Syn | 60 | 0,03 / Lager | |||||||
| Subkultur | Chaeto | 500 | 1/2000 | 1/2000 | 1/4000 (Nur Chaeto) | 1/1000 (Alle außer Syn) | 10 / Lager | 17°C / 17°C | Wöchentliche |
| Iso | 500 | 10 / Lager | |||||||
| Nashorn | 500 | 20 / Lager | |||||||
| Syn | 500 | 10 / Lager | |||||||
| Arbeitskultur | Chaeto | 400 | 1/2000 | 1/2000 | 1/4000 (Nur Chaeto) | 1/1000 (Alle außer Syn) | 100 / sub | RM / RM | Alle 4 Tage |
| Iso | 400 | 100 / sub | |||||||
| Nashorn | 400 | 150 / sub | |||||||
| Syn | 400 | 100 / sub |
Tabelle 2: Anleitung zur Aufrechterhaltung von drei Algenkulturtypen. Fügen Sie die angegebene Menge an Ergänzungen zu Kolben, die autoklaviertes Meerwasser enthalten. Impfen Sie jeden Kolben mit der angegebenen Menge an Algenkultur. Algenkulturen bei bestimmten Temperaturen inkubieren und lagern. Impfen Sie neue Aktienkultur und Subkultur aus der vorherigen Aktienkultur und neue Arbeitskultur aus der vorherigen Subkultur. Impfen Sie alle zwei Wochen, eine Woche bzw. vier Tage neue Aktienkultur, Subkultur und Arbeitskultur. Dieser Zeitplan bietet genug Nahrung für ca. 10 Becher der O. dioica Kultur. Bewahren Sie 2 – 3 Sätze jedes Algenkulturtyps als Back-Ups auf. RM – Raumtemperatur.
| Tag | Algenspp. | 9.00 und 17.00 Uhr | 12 UHR |
| 1 | Chaeto | — | — |
| Iso | 1000 | 2000 | |
| Syn | 20,000 | 40,000 | |
| 2 | Chaeto | 1000 | 2000 |
| Iso | 2000 | 2000 | |
| Nashorn | 1000 | 1000 | |
| 3 | Chaeto | 3000 | 4000 |
| Iso | 3000 | 4000 | |
| Nashorn | 1500 | 1500 | |
| 4 | Chaeto | 1000 | 2000 |
| Iso | 1000 | 2000 | |
| Nashorn | 1000 | 1000 |
Tabelle 3: Algenkonzentration pro Fütterung - modifiziert aus Bouquet et al.27. Algenkonzentrationen (Zellen mL-1) und Algenarten, die während des 4-tägigen Lebenszyklus von Okinawa O. dioica zur täglichen Fütterung verwendet werden.
Ergänzende Datei 1: Tägliche Fütterungstabelle. Die täglichen Fütterungsmengen für jeden Kulturbecher werden automatisch berechnet, nachdem die täglichen Algenabsorptionsmessungen (OD), die Größe der Tiere (Tag) und das Volumen des Meerwassers (SW vol.) in jedem Kulturbecher eingegeben wurden. Die Wachstumskurven von R. reticulata und Synechococcus sp. wurden von Bouquet et al.27adaptiert. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Datei 2: Wie man Synchronmotor mit Acrylpaddel verbindet. Schrauben Sie das Paddel mit einem Sechskantschlüssel fest an den Motor. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Um die Flexibilität bei der Etablierung der O. dioica-Kultur zu erleichtern, ist es wichtig, den natürlichen Lebensraum der Tiere zu verstehen. Saisonale Daten liefern Informationen über die Bereiche der physikalischen Parameter, die verwendet werden können, um Laborkultivierungsbedingungen zu leiten. Es hilft auch, saisonale Schwankungen in der Fülle von Tieren zu verstehen. In Okinawa wird O. dioica am zuverlässigsten von Juni bis Oktober gefunden. In der Bucht von Tokio erreicht die Bevölkerungszahl jedoch im Februar und41.Oktober ihren Höhepunkt. Obwohl die Kultivierung von O. dioica oft bei 20 °C oder niedriger27,28,29berichtet wird, zeigt Okinawan O. dioica ein besseres Überleben bei Temperaturen über 20 °C; dies könnte dadurch erklärt werden, dass die minimale Oberflächentemperatur des Meerwassers in Okinawa 20 °C beträgt (Abbildung 6). Die Fülle von O. dioica könnte auch durch Phytoplanktonblüten42 und RaubtierFülle43,44beeinflusst werden. Unabhängig davon, wo O. dioica gesammelt werden, maximiert das Verständnis der Saisonalität der lokalen Bevölkerung die Chance auf Probenahme und Kultivierung.
Angesichts der geeigneten Jahreszeit und Lage ist die Netzprobe eine effektive Möglichkeit, eine große Anzahl von Oikopleura mit minimalem Aufwand zu sammeln. Planktonnetze mit einer kleineren Maschenweite (60-70 m) können auch verwendet werden, um alle Stufen der Tiere zu sammeln. Vollreife Tiere sind selten im Netz zu finden, vielleicht aufgrund ihrer Fragilität am Ende des Lebenszyklus. Daher wird die Artenidentifikation, gefolgt von einer Probenahme, durch mikroskopische Beobachtung von subchordalen Zellen erreicht. Ältere Individuen erscheinen in der Regel ein oder zwei Tage nach der Probenahme, da die Tiere im Labor weiter wachsen. Obwohl die Netto-Probenahme effizient ist, können unter verschiedenen Umständen alternative Probenahmemethoden erforderlich sein. Zum Beispiel können Netzproben in der Nähe von städtischen Gebieten eine große Anzahl von Phytoplankton sammeln, was es schwierig macht, Oikopleurazu isolieren. In solchen Fällen wird eine einfache Eimerprobenahme zur Erfassung von Oberflächenmeerwasser oder Bootsproben aus Gebieten außerhalb des Hafens empfohlen. Die Ergebnisse zeigten, dass die allmähliche Veränderung des Salzgehalts aufgrund der aufeinanderfolgenden Regentage die Fülle von O. dioicanicht beeinflusste; Uferproben unmittelbar nach extremen Wetterereignissen wie tropischen Wirbelstürmen sollten jedoch vermieden werden. Diese Ereignisse verursachen plötzliche und drastische biogeochemische Veränderungen in einem geschützten Gewässer45,46. Der Regenwasserabfluss kann Schadstoffe, Sedimente und überschüssige Nährstoffe transportieren, die die Trübung erhöhen und die Wasserqualität senken47. Filter-Fütterung Plankton, wie Oikopleura, kann besonders anfällig für diese Veränderungen aufgrund ihrer Art der Fütterung und eingeschränkte Mobilität. In einem solchen Fall empfehlen wir, die Probenahme um einige Tage zu verschieben, bis sich die örtlichen Bedingungen wieder normalisieren.
Die Einführung eines mehrstufigen Filtersystems ist für die Erhaltung kleiner, filterfressender Organismen wie O. dioicaunerlässlich. Mit schlecht gefiltertem Meerwasser (z. B. einem 25-mm-Netz im vorherigen Kultursystem) war die Kultur vor allem im Sommer oft instabil, was möglicherweise auf die höhere Fülle an Phytoplankton zurückzuführen ist. Obwohl einige Phytoplankton sind vorteilhaft für O. dioica Wachstum, andere produzieren Biotoxine, die abnormale Entwicklung von O. dioica Embryonen verursachen können48. Darüber hinaus ist eine hohe Konzentration von Diatomen wie Chaetoceros spp. potenziell schädlich für das O. dioica Wachstum, da sie lange Setae besitzen können, die das Haus verstopfen und eine effiziente Fütterung verhindern können49. Wir beobachteten häufig Häuser von Kleintieren, die von C. calcitrans setae verstopft wurden; Daher füttern wir Jetzt C. calcitrans nur noch an Tiere an Tag 2 und älter (Tabelle 3).
Obwohl es hier kein Problem war, kann die kleine langfristige Kultivierung von O. dioica aufgrund eines genetischen Engpasses plötzliche Bevölkerungsrückgänge erleben; in solchen Fällenempfehlen die Beiden, alle 20 Generationen neue wilde Individuen in die Kultur einzuspeisen.
Das Oikopleura-Kultursystem ist flexibel. Innerhalb einer Woche kann eine stabile Kultur aufgebaut werden. Eine langfristige Kultivierung von O. dioica ist mit einem bescheidenen Budget mit nicht spezialisierter Ausrüstung möglich. Der tägliche Aufwand für die Wartung von 5-10 Bechern von Oikopleura ist in der Regel weniger als 2 Stunden mit 2 Personen. O. dioica kann auch in künstlichem Meerwasser gehalten werden, was für diejenigen, die keinen Zugang zu natürlichem Meerwasser haben, von Vorteil ist28. Langfristige Lagerung von Algennahrung ist mit Feststoffkultur und Kryokonservierungmöglich 29. Darüber hinaus kann O. dioica Sperma kryokonserviert werden, und lebensfähig bleiben für mehr als ein Jahr50. All diese Faktoren bedeuten, dass Kulturen leicht wiederhergestellt werden können. Schließlich, vergangenheitErfahrung mit versehentlicher Kultivierung von Pleurobrachia sp. könnte darauf hindeuten, dass das für Oikopleura entwickelte Kultivierungssystem potenziell auf eine breitere Gemeinschaft empfindlicher pelagischer Organismen ausgedehnt werden könnte.
O. dioica liefert weiterhin kraftvolle Einblicke in verschiedene biologische Felder. Ein Verständnis der lokalen Saisonalität, ein akribisches Kultursystem und ein paar engagierte Individuen ermöglichen es, mit wenig Aufwand eine effektive Kultur zu etablieren. Das Oikopleura-Kultursystem bietet die Basisressourcen, um eine breite Palette biologischer Bereiche in Bezug auf Ökologie, Entwicklung, Genomik und Evolution dieses einzigartigen Marinechorats zu untersuchen.
Offenlegungen
Der Autor hat nichts zu erklären.
Danksagungen
Wir danken Garth Ilsley für seine Unterstützung beim Aufbau des Kultursystems. Wir würdigen die Beiträge von Ritsuko Suyama und Sylvain Guillot zu den Bemühungen um frühe Probenahme und Artenidentifizierung. Ein besonderer Dank gilt Hiroki Nishida, Takeshi Onuma und Tatsuya Omotezako für ihre großzügige Unterstützung und Beratung durchweg, einschließlich der Ersteinrichtung des lokalen Kultivierungssystems und des Teilens von Tieren und Mikroalgenkultur. Wir danken auch Daniel Chourrout, Jean-Marie Bouquet, Anne Aasjord, Cristian Caéestro und Alfonso Ferréndez-Roldén für den Austausch ihrer Expertise in den Bereichen Sampling und Kultivierung. Jai Denton, Charles Plessy und Jeffrey Jolly gaben unschätzbares Feedback zu dem Manuskript. Charlotte West formulierte eine verallgemeinerte Gleichung für die Algenberechnung. Abschließend danken wir OIST für die Finanzierung, Mary Collins und dem OIST Fieldwork Safety Committee für die Beratung zu sicheren Probenahmeverfahren, den Mitarbeitern der OIST-Maschinenwerkstatt für den Bau von Kultivierungs- und Probenahmegeräten und Koichi Toda für die Lieferung von Meerwasser.
Materialien
| Name | Company | Catalog Number | Comments |
| Activated charcoal | Sigma | C2764-2.5KG | |
| Alluminum pulley | Rainbow Products | 10604-10607 | |
| Biotin | Sigma | B4501-100MG | |
| Boric acid | Wako | 021-02195 | |
| Cobalamin (B12) | Sigma | V2876-100MG | |
| Cobalt(II) chloride hexahydrate | Wako | 036-03682 | |
| Copper(II) sulfate pentahydrate | Wako | 039-04412 | |
| Disodium edetate hydrate | Wako | 044-29525 | |
| Hexaammonium heptamolybdate tetrahydrate | Wako | 019-03212 | |
| Hexagon wrench | Anex | No.6600 | |
| Hydrochloric acid | Wako | 080-01066 | |
| Iron(III) chloride hexahydrate | Wako | 091-00872 | |
| Jebao programmable auto dosing pump | Jebao | DP-4 | |
| Magnet pump | REI-SEA | RMD-201 | |
| Manganese(II) chloride tetrahydrate | Wako | 134-15302 | |
| Polypropylene wound cartridge filter | Advantec | TCW-10N-PPS | |
| TCW-5N-PPS | |||
| TCW-1N-PPS | |||
| Screwless terminal block | SATO PARTS | SL4500 | |
| Simple plankton net | RIGO, Japan | 5512-C | |
| Sodium metasilicate | Sigma | 307815-1KG | |
| Sodium nitrate | Wako | 195-02545 | |
| Sodium phosphate monobasic anhydrous | MP Biomedicals | 194740 | |
| Streptomycin sulfate salt | Sigma | S6501-25G | |
| Synchronous electric motor | Servo | D5N6Z15M | |
| Thiamin hydrochloride | Wako | 201-00852 | |
| UV sterilizer | Iwaki | UVF-1000 | |
| Zinc chloride | MP Biomedicals | 194858 |
Referenzen
- Travis, J. Is It What We Know or Who We Know? Choice of Organism and Robustness of Inference in Ecology and Evolutionary Biology (American Society of Naturalists Presidential Address). The American Naturalist. 167 (3), 303-314 (2006).
- Jenner, R. A., Wills, M. A. The choice of model organisms in evo-devo. Nature Reviews Genetics. 8 (4), 311-314 (2007).
- Irigoien, X., Huisman, J., Harris, R. P. Global biodiversity patterns of marine phytoplankton and zooplankton. Nature. 429 (6994), 863-867 (2004).
- Wilson, S., Ruhl, H., Smith, J. Zooplankton fecal pellet flux in the abyssal northeast Pacific: A 15 year time-series study. Limnology and Oceanography. 58 (3), 881-892 (2013).
- Steinberg, D. K., Lomas, M. W., Cope, J. S. Long-term increase in mesozooplankton biomass in the Sargasso Sea: Linkage to climate and implications for food web dynamics and biogeochemical cycling. Global Biogeochemical Cycles. 26 (1), 1004 (2012).
- Lombard, F., Kiørboe, T. Marine snow originating from appendicularian houses: Age-dependent settling characteristics. Deep Sea Research Part I: Oceanographic Research Papers. 57 (10), 1304-1313 (2010).
- Fenaux, R., Bone, Q. . The Biology of Pelagic Tunicates. , 251-264 (1998).
- Hopcroft, R. R., Gorsky, G., Youngbluth, M. J., Deibel, D. . Response of Marine Ecosystems to Global Change: Ecological Impact of Appendicularians. , 45-57 (2005).
- Walters, T. L., Gibson, D. M., Frischer, M. E. Cultivation of the Marine Pelagic Tunicate Dolioletta gegenbauri (Uljanin 1884) for Experimental Studies. Journal of Visualized Experiments. (150), e59832 (2019).
- Deibel, D. Feeding mechanism and house of the appendicularian Oikopleura vanhoeffeni. Marine Biology. 93 (3), 429-436 (1986).
- Spada, F., et al. Molecular patterning of the oikoplastic epithelium of the larvacean tunicate Oikopleura dioica. Journal of Biological Chemistry. 276 (23), 20624-20632 (2001).
- Flood, P. R., Gorsky, G., Youngbluth, M. J., Deibel, D. . Response of Marine Ecosystems to Global Change: Ecological Impact of Appendicularians. , 59-85 (2005).
- Tokioka, T. Studies on the distribution of appendicularians and some thaliaceans of the North Pacific, with some morphological notes. Publication of the Seto Marine Biological Laboratory. (8), 351-443 (1960).
- Alldredge, A. L. Discarded appendicularian houses as sources of food, surface habitats, and particulate organic matter in planktonic environments. Limnology and Oceanography. 21 (1), 14-24 (1976).
- Clarke, C., Roff, J. C. Abundance and biomass of herbivorous zooplankton off Kingston, Jamaica, with estimates of their annual production. Estuarine, Coastal and Shelf Science. 31 (4), 423-437 (1990).
- Hopcroft, R. R., Roff, J. C. Zooplankton growth rates: extraordinary production by the larvacean Oikopleura dioica in tropical waters. Journal of Plankton Research. 17 (2), 205-220 (1995).
- Hopcroft, R. R., Roff, J. C. Production of tropical larvaceans in Kingston Harbour, Jamaica: are we ignoring an important secondary producer. Journal of Plankton Research. 20 (3), 557-569 (1998).
- Mochioka, N., Iwamizu, M. Diet of anguilloid larvae: leptocephali feed selectively on larvacean houses and fecal pellets. Marine Biology. 125 (3), 447-452 (1996).
- Sakaguchi, S. O., et al. Morphological identity of a taxonomically unassigned cytochrome c oxidase subunit i sequence from stomach contents of juvenile chum salmon determined using polymerase chain reaction. Fisheries Science. 83 (5), 757-765 (2017).
- Fenaux, R., Bone, Q. . The Biology of Pelagic Tunicates. , 25-34 (1998).
- Sato, R., Tanaka, Y., Ishimaru, T. House production by Oikopleura dioica (Tunicata, Appendicularia) under laboratory conditions. Journal of Plankton Research. 23 (4), 415-423 (2001).
- Flood, R., Deibel, D., Bone, Q. . The Biology of Pelagic Tunicates. , 105-124 (1998).
- Alldredge, A., Gorsky, G., Youngbluth, M. J., Deibel, D. . Response of Marine Ecosystems to Global Change: Ecological Impact of Appendicularians. , 309-326 (2005).
- Katija, K., Sherlock, R. E., Sherman, A. D., Robison, B. H. New technology reveals the role of giant larvaceans in oceanic carbon cycling. Science Advances. 3 (5), 1602374 (2017).
- Katija, K., Choy, C. A., Sherlock, R. E., Sherman, A. D., Robison, B. H. From the surface to the seafloor: How giant larvaceans transport microplastics into the deep sea. Science Advances. 3 (8), 1700715 (2017).
- Hidaka, K. Species composition and horizontal distribution of the appendicularian community in waters adjacent to the Kuroshio in winter-early spring. Plankton and Benthos Research. 3 (3), 152-164 (2008).
- Bouquet, J. M., et al. Culture optimization for the emergent zooplanktonic model organism Oikopleura dioica. Journal of Plankton Research. 31 (4), 359-370 (2009).
- Nishida, H. Development of the appendicularian Oikopleura dioica: culture, genome, and cell lineages. Development, Growth & Differentiation. 50, 239-256 (2008).
- Martí-Solans, J., et al. Oikopleura dioica culturing made easy: A Low-Cost facility for an emerging animal model in Evo Devo. Genesis. 53 (1), 183-193 (2015).
- Holland, L. Z. Tunicates. Current Biology. 26 (4), 146-152 (2016).
- Delsuc, F., Brinkmann, H., Chourrout, D., Philippe, H. Tunicates and not cephalochordates are the closest living relatives of vertebrates. Nature. 439 (7079), 965-968 (2006).
- Seo, H. C., et al. Miniature genome in the marine chordate Oikopleura dioica. Science. 294 (5551), 2506 (2001).
- Fredriksson, G., Olsson, R. The subchordal cells of Oikopleura dioica and O. albicans (Appendicularia, Chordata). Acta Zoologica. 72 (4), 251-256 (1991).
- Paffenhöfer, G. A. The cultivation of an appendicularian through numerous generations. Marine Biology. 22 (2), 183-185 (1973).
- Fenaux, R., Gorsky, G. Nouvelle technique d'élevage des appendiculaires. Rapports et Procés-Verbaux des Réunions-Commission Internationale pour l'Exploration Scientifique de la Mer Méditerranée. 29, 291-292 (1985).
- Fujii, S., Nishio, T., Nishida, H. Cleavage pattern, gastrulation, and neurulation in the appendicularian, Oikopleura dioica. Development Genes and Evolution. 218 (2), 69-79 (2008).
- Patry, W. L., Bubel, M., Hansen, C., Knowles, T. Diffusion tubes: a method for the mass culture of ctenophores and other pelagic marine invertebrates. PeerJ. 8, 8938 (2020).
- Fenaux, R. The classification of Appendicularia (Tunicata): history and current state. Memoires de I'Institut oceanographique. , (1993).
- Shiga, N., Chihara, M., Murano, M. . Illustrated Guide to Marine Plankton in Japan. , 1393-1414 (1997).
- Gorsky, G., Castellani, C., Castellani, C., Edwards, M. . Marine Plankton: A practical guide to ecology, methodology, and taxonomy. , 599-606 (2017).
- Sato, R., Ishibashi, Y., Tanaka, Y., Ishimaru, T., Dagg, M. J. Productivity and grazing impact of Oikopleura dioica (Tunicata, Appendicularia) in Tokyo Bay. Journal of Plankton Research. 30 (3), 299-309 (2008).
- Nakamura, Y., Suzuki, K., Suzuki, S. Y., Hiromi, J. Production of Oikopleura dioica (Appendicularia) following a picoplankton 'bloom'in a eutrophic coastal area. Journal of Plankton Research. 19 (1), 113-124 (1997).
- Nakamura, Y. Blooms of tunicates Oikopleura spp. and Dolioletta gegenbauri in the Seto Inland Sea, Japan, during summer. Hydrobiologia. 385 (1-3), 183-192 (1998).
- Uye, S. I., Ichino, S. Seasonal variations in abundance, size composition, biomass and production rate of Oikopleura dioica (Fol)(Tunicata: Appendicularia) in a temperate eutrophic inlet. Journal of Experimental Marine Biology and Ecology. 189 (1-2), 1-11 (1995).
- Tsuchiya, K., et al. Phytoplankton community response and succession in relation to typhoon passages in the coastal waters of Japan. Journal of Plankton Research. 36 (2), 424-438 (2014).
- Lopez-Lopez, L., et al. Effects of typhoons on gelatinous carnivore zooplankton off Northern Taiwan. Cahiers de Biologie Marine. 53, 349-355 (2012).
- Ares, &. #. 1. 9. 3. ;., et al. Extreme storm-induced run-off causes rapid, context-dependent shifts in nearshore subtropical bacterial communities. bioRxiv. , (2019).
- Torres-Águila, N. P., et al. Diatom bloom-derived biotoxins cause aberrant development and gene expression in the appendicularian chordate Oikopleura dioica. Communications Biology. 1 (1), 1-11 (2018).
- Troedsson, C., Frischer, M. E., Nejstgaard, J. C., Thompson, E. M. Molecular quantification of differential ingestion and particle trapping rates by the appendicularian Oikopleura dioica as a function of prey size and shape. Limnology and Oceanography. 52 (1), 416-427 (2007).
- Ouchi, K., Nishino, A., Nishida, H. Simple procedure for sperm cryopreservation in the larvacean tunicate Oikopleura dioica. Zoological Science. 28 (1), 8-11 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten