Method Article
Оптимизированная выборка и культивирование пелагической космополитической Ларвасеан, Ойкоплеура диойка
В этой статье
Резюме
Oikopleura dioica является туникат модель организма в различных областях биологии. Мы описываем методы отбора проб, идентификацию видов, культивирование установки и культивирование протоколов для животных и водорослей корма. Мы выделяем ключевые факторы, которые помогли укрепить систему культуры и обсудить возможные проблемы и резолюции.
Аннотация
Oikopleura dioica - это планктонный хордат с исключительной способностью к подаче фильтров, быстрым временем генерации, сохранением раннего развития и компактным геномом. По этим причинам он считается полезным модельным организмом для морских экологических исследований, эволюционной биологии развития и геномики. Поскольку исследования часто требуют постоянного снабжения животными ресурсами, полезно создать надежную систему культуры с низким уровнем обслуживания. Здесь мы описываем пошаговый метод создания культуры O. dioica. Мы описываем, как выбрать потенциальные места отбора проб, методы сбора, целевую идентификацию животных и настройку системы культивирования. Мы предоставляем советы по устранению неполадок, основываясь на собственном опыте. Мы также выделяем критические факторы, которые помогают поддерживать надежную систему культуры. Хотя культурный протокол, представленный здесь, оптимизирован для O. dioica,мы надеемся, что наша техника отбора проб и культура установки будет вдохновлять новые идеи для поддержания других хрупких пелагических беспозвоночных.
Введение
Модельные организмы сыграли важную роль в решении многих биологических вопросов, включая вопросы, связанные с развитием, генетикой и физиологией. Кроме того, дополнительные модельные организмы способствуют новым открытиям и, следовательно, имеют решающее значение для достижения более глубокого понимания природы1,2. Морской зоопланктон представляют собой различные группы организмов, которые играют важную роль в океанических экосистемах3,,4,,5,,6. Несмотря на их изобилие и экологическое значение, желатиновые организмы, такие как планктонные туникаты, часто недопредставлены в исследованиях биоразнообразия планктона, потому что их прозрачность и хрупкость делают сбор поля и идентификациюсложными 7,8. Адаптированные методы отбора проб и лабораторное культивирование позволяют более внимательно наблюдать за животными in vitro, что способствовало знанию в биологии планктонных туникат9,,10,,11,,12.
Larvaceans (Аппендикулярные) являются класс свободного плавания морских туникат, состоящий из около 70 описанных видов во всем мире8,13. Поскольку они являются одной из наиболее распространенных групп в зоопланктонных сообществ14,15,16,17, larvaceans представляют собой основной источник пищи для крупных планктонных организмов, таких как личинки рыб18,19. В отличие от асцидий-sessile tunicates-larvaceans сохранить головастик, как морфология и остаются планктонные на протяжении всей своей жизни20. Каждое животное живет внутри самостроя, замысловатого фильтра кормления структуры, известной как дом. Они накапливают частицы в своих домах, создавая водные потоки через волнообразное движение их хвостов21. Забитые дома отбрасываются в течение дня, некоторые из которых образуют углеродные агрегаты и в конечном итоге опускаются на морское дно22; таким образом, larvaceans играют важную роль в глобальном потоке углерода23. Большинство видов, как сообщается, живут в пелагической зоне в верхней 100 м от водной колонки13; однако, гигантский ларвакейский Bathochordaeus, как известно, населяют глубины 300 м24. Исследование на Bathochordaeus в Монтерей-Бей, Калифорния показало, что животные также служат в качестве биологического вектора микропластика, предлагая потенциальную важность в понимании роли апендикулярных в вертикальном транспорте и распределении микропластика в океанах25.
Oikopleura dioica, вид larvacean, привлекает внимание в последние годы в качестве модели организма из-за нескольких замечательных характеристик. Об этом обычно сообщается во всех океанах мира. Особенно обильный в прибрежных водах26,что позволяет легко отбирать пробы с берега. Долгосрочное, стабильное культивирование возможно как с естественной, так и с искусственной морскойводой 27,,28,,29. Температурное время генерации в лабораторных условиях превышает 4-9 дней. Он имеет высокую плодовитость с каждой женщиной, способной производить 300 яиц в течение года. Как туникат, он занимает важное филогенетическое положение для понимания хорда эволюции30,31. На 70 Мб, O. dioica имеет самый маленький идентифицированный геном среди всех хордат32. Среди larvaceans, O. dioica является единственным описанным не-гермафродитических видов до сих пор33.
Первый успешный O. dioica культуры с лабораторно выращенных микроводорослей было сообщено Paffenh'fer34. Оригинальный протокол культуры с использованием синхронных двигателей и весла был разработан Fenaux и Gorsky35, а затем принят несколькими лабораториями. Совсем недавно Fujii et al.36 сообщили о том, что компания O. dioica культивирует искусственную морскую воду, надежную систему культуры и полевую коллекцию были описаны Bouquet et al.27, а оптимизированный протокол для упрощенной доступной системы был зарегистрирован Марти-Соланс и др.29. Помимо традиционной системы культуры Oikopleura, недавно сообщили дизайн с двойной трубки воспитания танк также имеет потенциал для культуры Oikopleura sp. 37.
Мы представляем подробный протокол для инициирования монокультуры O. dioica на основе сочетания протоколов, разработанных крупными исследовательскими группами Oikopleura в Международном центре морской молекулярной биологииСарса 27, Университет Барселоны29, Университет Осаки28, и наши собственные наблюдения. В ранее опубликованных протоколах культуры, подробная информация о составе водорослей средств массовой информации, методы отбора проб на берегу, и Oikopleura идентификации были лишь грубо описаны, оставляя много двусмысленности. Здесь, с помощью визуальной информации в видео-протоколе, мы собрали всю важную информацию, необходимую для создания культуры O. dioica с нуля в простой, шаг за шагом образом. Мы описываем, как отличить O. dioica от другого обычно сообщаемого вида, O. longicauda, который является одним из самых сложных шагов. Хотя существующие системы культуры применимы для выращивания O. dioica во всем мире, мы подчеркиваем важность корректировки протокола, основанной на местных экологических условиях. Представленная информация сочетает в себе широко опубликованные данные, а также знания, полученные на основе опыта. Текущий протокол идеально подходит для исследователей, заинтересованных в создании культуры с нуля.
протокол
1. О. Диойка культурный центр
- Система фильтрации воды(рисунок 1)
- Собирайте естественную морскую воду из гавани на глубине 2-3 м. Пройдите морскую воду через песчаный фильтр (поры размером 1,4 мм) и транспортируют в общий резервуар в лаборатории. Используйте фильтр канистры для циркуляции воды для поддержания качества воды в общем резервуаре резервуара.
- В комнате культуры, создать многоступенчатую систему фильтра, состоящую из резервуара 100 л с магнитным насосом привода, 5 мкм и 1 м фильтры полипропилена раны картриджа, и УФ стерилизатор (100 V) (Рисунок 1).
- Передача морской воды из общего резервуара в резервуар для культуры резервуара. Перед входом в резервуар водохранилища в комнату культуры пройдите через 25-мкм фильтровальный блок(рисунок 1A,B)перед входом в резервуар водохранилища. Циркулируйте морскую воду через 5 и 1 мкм фильтры на ночь, чтобы тщательно удалить частицы, которые потенциально могут препятствовать развитию животных.
ПРИМЕЧАНИЕ: Дополнительный фильтр с большим размером сетки (25-50 мкм) полезен для предотвращения более крупных частиц от засорения картриджа фильтры с меньшими размерами сетки. Фильтрованная морская вода (fSW) готова к использованию на следующее утро.
-
Oikopleura культивирования единицы (Рисунок 2)
- Поддерживайте животных в 5 или 10 l круглых, прозрачных пластиковых стаканов.
- Поместите культурные стаканы на устойчивый двухуровневый блок стеллажей из нержавеющей стали (L x W x H 150 см х 45 см х 90 см) с толщиной 5 мм, прозрачной акриловой поверхностной доской.
- Позиция белые флуоресцентные огни под акриловой поверхностью, чтобы осветить животных со дна стаканов.
- Поместите черный пластиковый лист за стаканы. Черный лист создает контраст и улучшает визуализацию прозрачных животных.
- Подключите синхронные электродвигатели к акриловым веслам (L x H 8 см х 27 см) (Дополнительный файл 2). Приостановить весла в культуре стаканы от параллельных рельсов работает по длине стеллажей единицы (Рисунок 2A).
- Включите двигатели для создания нежного кругового движения в стаканах при 15 об/мин.
ПРИМЕЧАНИЕ: животные в их целлюлозных домах нейтрально плавучей; однако, циркуляция воды помогает держать яичка, личинки, и водоросли, котор нужно приостановить и равномерно распределить в стаканах культуры.
- Автоматический просеющий насос (необязательно)
ПРИМЕЧАНИЕ: Автоматическое кормление снижает кадровые потребности, особенно в выходные дни.- Откалибровать объем дозирования жидкости из автоматического дозирования насоса в соответствии с инструкциями производителя.
- Используйте 50 мЛ труб в качестве водорослей.
- Просверлите два 5-мм отверстия на крышках 50 мЛ труб, чтобы пройти через авиационные трубки. Подключите одну трубку к стандартному аквариумный воздушный насос, чтобы ввести пузырьки воздуха, а другую трубку к входу порт dosing насоса(Рисунок 2B).
ПРИМЕЧАНИЕ: Введение тонкого потока пузырьков воздуха помогает предотвратить водоросли от урегулирования на дне труб. - Программа времени и объема водорослей корма, которые будут обойтись в данный день.
- Водоросли станции
- Используйте стеллаж (L x W x H 90 cm x 46 cm x 115 cm) для размещения четырех 1 л круглых нижних колб, содержащих водоросли рабочих культур (см. шаг 2.1).
- Назад-осветите рабочие культуры, поместив флуоресцентные лампы за флягами.
- Тюленье колбы с двухлунными резиновыми пробками.
- Пройдите 1 мЛ одноразовый пипетки через резиновую пробку. Используйте авиационные трубки для подключения пипетки к аквариуму воздушного насоса. Введите поток пузырьков воздуха в колбе.
2. Микроалгалная пища
- Инициирование водорослей культур
ПРИМЕЧАНИЕ: Поддерживать три набора культур (запас, суб-, и рабочие культуры) для трех микроалгалных видов, Chaetoceros кальцитранс, Isochrysis sp., Rhinomonas reticulata, и один вид цианобактерий, Synechococcus sp.. Фондовые и субкультуры используются в качестве резервных копий. Рабочая культура используется для ежедневного кормления.- Подготовка реагентов, необходимых для выращивания микроводорослей и цианобактерий(таблица 1).
- Для инициирования фондовой культуры, автоклав (121 градусов по Цельсию, 25 мин) 60 - 80 мл fSW в колбе 100 мл Эрленмейера. Асептически привито указанное количество модифицированного среднего27-го и микроводорослей Конвея(таблица 2). Например, прививать стоковую культуру C. calcitrans, автоклав 60 мл морской воды, алептически привить 30 мл каждого витамина и раствора А, 15 мл силиката натрия, 60 мл стрептомицина и 30 л кальцитрана от предыдущей культуры запасов.
ПРИМЕЧАНИЕ: R. reticulata превращается из красновато-розового в оранговато-коричневый при воздействии слишком много света. Переместить их от света, как только они начали свою очередь, от ясного к светло-розовый. - Поддержание культуры запасов в инкубаторе, установленном при 17 градусах Цельсия с непрерывным освещением. Примерно через 10 дней культура меняет цвет, чтобы указать рост водорослей(рисунок 3). Как только цвета появляются, переместите их на 4 градусов по Цельсию для длительного хранения на срок до 1 месяца.
- На чистой скамейке, aseptically привить субкультуры от фондовой культуры (Таблица 2). Инкубировать при 17 градусов по Цельсию с непрерывным освещением. После появления водорослей продолжайте хранить их в инкубаторе до 2 недель.
- Прививать рабочую культуру от субкультуры(Таблица 2). Уплотните колбу резиновой крышкой и вставьте 1 мЛ одноразовый пипетку. Переместите колбу на станцию водорослей и поддерживать при комнатной температуре с 8 h фотопериод. Поставка с постоянной аэрацией. Обновляем рабочую культуру каждые 4 дня.
- Перемешать акции и субкультуры два раза в день, закрученного.
ПРИМЕЧАНИЕ: Долгосрочное хранение водорослей культуры на твердых носителях и криоконсервация возможны до 3 месяцев и 1 год, соответственно29.
- Создание кривых роста водорослей (необязательно)
ПРИМЕЧАНИЕ: Точная оценка количества кормления имеет важное значение для поддержания стабильной культуры O. dioica. Мы создали кривые роста для двух основных видов водорослей, Chaetoceros calcitrans и Isochrysis sp.- Подготовка C. calcitrans и Isochrysis sp. рабочие культуры (Таблица 2).
- Для каждого вида рабочей культуры, образец три отдельных раз и измерения абсорбции на 660 нм с помощью спектрофотометра. Возьмите средние измерения трипликатов из каждой рабочей культуры.
- Следуя инструкциям производителя для автоматизированного счетчика ячейки, подготовьте образцы водорослей для подсчета. Подсчитайте каждый образец три раза. Возьмите в среднем три счета, чтобы определить общее количество клеток, присутствующих в каждом образце.
- Продолжайте подсчитывать ежедневно, пока не будет зарегистрировано примерно 50 средних измерений.
- Создание кривых роста для обоих видов водорослей(рисунок 4).
3. Полевой сбор дикого Ойкоплеура сппа.
- Модифицированная сеть планктона(рисунок 5)
ПРИМЕЧАНИЕ: Ключом к успешной выборке Oikopleura spp. является медленный буксировка планктонной сети с взвешенным, нефильтровающим треской. На рисунке 5 показана схематическая диаграмма модифицированной планктонной сети.- Замените треску-конец ручной сети планктона с модифицированной 500-мл винт-топ мытья бутылки.
- Просверлите отверстие диаметром 3 см в винт-топ диаметром 4 см в бутылке для мытья, чтобы вода и животные, чтобы войти в треску-конец.
- Fit крышка бутылки в конце планктона сети. Оберните его плотно с электрической лентой. Закрепите крышку дальше с зажимом шланга из нержавеющей стали.
- Прикрепите 70 г веса к внешней стороне модифицированной трески-конец с застежкой-молнией.
- Прикрепите поводок безопасности для дальнейшего обеспечения трески-конец.
- Выбор сайтов сбора (Рисунок 6)
ПРИМЕЧАНИЕ: Все коллекции образцов были одобрены Комитетом по безопасности полевых работ OIST. Там могут быть сезонные изменения в присутствии Oikopleura spp. в зависимости от местоположения(Рисунок 6). Избегайте отбора проб сразу после экстремальных погодных явлений, таких как сильные ливни.- Используйте спутниковый вид на веб-сайте карты для определения потенциальных мест отбора проб. Мы сосредоточились на гаванях и рыболовных причалах, которые легко доступны на автомобиле и расположены внутри заливов или вблизи океана высадки, где планктон, как правило, накапливаются: Исикава гавани в Кин-Бей, Окинава, Япония (GPS: 26'25'39.3"N 127'49'56.6"E).
- Посетите потенциальные места отбора проб для оценки береговой доступности и безопасности каждого объекта. Получить разрешение на сбор от местных органов власти по мере необходимости.
- Процедура отбора проб
- Бросьте планктон сети в море и позволяют трески конец тонуть 1-2 м ниже поверхности воды.
- Буксировать сеть горизонтально вручную при 50-100 смс -1. Продолжайте буксировки, идя вперед и назад в течение 2-5 минут. Отрегулируйте время буксировки в зависимости от обилия фитопланктона в гавани, с более коротким буксиром, когда есть больше фитопланктона.
ПРИМЕЧАНИЕ: Larvaceans хрупкие животные. Быстрый буксировки или повторного литья сети может повредить животных, оказавшихся в трески конца. - Аккуратно поднимите сетку. Медленно перенесите содержимое трески в круглую стеклянную бутылку 500 мл. Полностью заполните образец бутылки с морской водой, чтобы избежать пузырьков воздуха.
ПРИМЕЧАНИЕ: Присутствие Oikopleura spp. может быть подтверждено путем просмотра образцов бутылок на черном фоне. Большинство животных покидают свои дома во время сбора. Поэтому для идентификации на уровне видов необходимы микроскопические наблюдения. - Повторите отбор проб до сбора трех бутылок объемом 500 мл.
- Измерьте соленость, температуру и хлорофилл с помощью профилировщика CTD для записи диапазона физических параметров, где животные естественным образом существуют.
- Соберите 10-15 л поверхностной морской воды в ведро для акклиматизации животных в лабораторных условиях.
4. Изоляция животных и идентификация (Рисунок 7, Рисунок 8)
-
Oikopleura spp.
ПРИМЕЧАНИЕ: Другие планктонные организмы, которые могут напоминать Oikopleura spp. на первый взгляд включают chaetognaths, Fritillaria spp., нематод, личинок рыб с желтками-мешками, и личинки Ciona spp.- Для акклиматизации животных к лабораторным условиям, передача каждого образца 500 мЛ на 10 Л стакан, содержащий 1:1 соотношение поверхностных морских вод от места отбора проб и фильтрованной морской воды (fSW), поддерживаемой в лаборатории(рисунок 7A,B). Отрегулируйте объем стакана до 5-10 л в зависимости от концентрации образца планктона.
ПРИМЕЧАНИЕ: Если образец планктона содержит нежелательный мусор, пробежаться через грубый фильтр (размер сетки 600 мкм) перед переходом на 10 Л стакан. - Используйте весло, прикрепленное к синхронному электромотору (15 об/мин) и держите планктон в подвеске на ночь (шаг 1.2.5).
- Определите Oikopleura spp., ища 1-2 мм в длину, головастикообразных животных волнистые хвосты внутри сферической, полупрозрачный дом. Некоторые животные могут временно свободно плавать без домов. Аккуратно перенесите животных No5 в пустую чашку Петри, используя тупой конец пипетки.
- Для идентификации рода, выселить животных из своих домов, мягко тыкать дом с передачи пипетка.
- Наблюдайте домашних животных под 20-40x темным полем микроскопом и подтвердите Oikopleura spp(рисунок 8).
- Для акклиматизации животных к лабораторным условиям, передача каждого образца 500 мЛ на 10 Л стакан, содержащий 1:1 соотношение поверхностных морских вод от места отбора проб и фильтрованной морской воды (fSW), поддерживаемой в лаборатории(рисунок 7A,B). Отрегулируйте объем стакана до 5-10 л в зависимости от концентрации образца планктона.
-
Идентификация O. dioica
ПРИМЕЧАНИЕ: O. dioica может быть визуально идентифицирована по присутствию полностью зрелых самцов и самок или двух крупных подборальных клеток, расположенных на дистальной половине их хвостов.. Расстояние между двумя подборными клетками может варьироваться между людьми.- Далее, проверьте, есть ли полностью созрел Oikopleura с гонадом заполнены яйцами (Рисунок 8A) или спермы (Рисунок 8B). Если животное обладает только яйцами или спермой, пропустите шаг 4.2.3, как это O. dioica, только описанные не-гермафродитических видов.
- Если животное незрело(Рисунок 8C), ищите две подборные клетки в конце хвоста(Рисунок 8D).
- Как только вид подтвердится, перенесите его в новую чашку Петри. Повторите шаги 4.1.3-4.2.2 до тех пор, пока 10-20 особей не подтвердятся на уровне видов.
ПРИМЕЧАНИЕ: Для облегчения идентификации, обезболивать животных в чашке Петри, содержащей 0,015% tricaine метансульфонат (MS222) в fSW. - Если не O. dioica найдены, держать стаканы приостановлено на дополнительный день или два. Там может быть незрелых O. dioica, которые будут продолжать расти и стать легче быть обнаружены. Если никто не появится через неделю, отбросьте образец и повторите отбор проб.
5. Протокол культивирования O. dioica
- Инициирование монокультуры O. dioica из поля, собранного образца(рисунок 7)
ПРИМЕЧАНИЕ: Водоросли ежедневно готовятся из рабочих культур, и каждый монокультурный стакан кормят три раза в день в 9 утра, 12 вечера и 5 вечера, соответственно (см. шаг 5.2). Содержание животных при 23 градусах Цельсия. В этих условиях, Окинава O. dioica жизненного цикла составляет 4 дней (Рисунок 7C).- Чтобы инициировать монокультуру O. dioica, изолировать 120 животных и перейти на новый стакан, содержащий 5 Л свежего fSW (Рисунок 7B, C).
- На следующее утро ищите полностью зрелых самцов с желтыми гонадами и самок с яйцами, которые появляются как золотые сферы(рисунок 8A,B).
- Сделать нерестовой стакан, аккуратно переведя 15 самцов и 30 самок на новый стакан, содержащий 2,5 л свежего fSW с 5-м л тупой конец пипетки.
ПРИМЕЧАНИЕ: Если Есть не хватает мужчин и женщин, передать как можно больше взрослых, как это возможно, чтобы стакан, содержащий 1 Л fSW и пусть они икру естественно. Чтобы свести к минимуму физические нагрузки на животных во время ручного переноса, их следует медленно откачивать и выпускать под поверхностью воды. - Пусть животные нерестятся естественным образом, чтобы инициировать следующее поколение. Хвостатые личинки должны появиться примерно через 3 часа после оплодотворения.
ПРИМЕЧАНИЕ: Нерест осуществляется полностью созревшими животными, покидая свои дома, плавая к поверхностной воде и выпуская свои гаметы. Успешное оплодотворение может быть подтверждено путем извлечения 5-10 мл морской воды со дна нерестилища и выявления яиц с расщеплениями под микроскопом. - В первое утро после нереста (День 1), новое поколение животных с надутыми домами должны появиться в стакане. Используйте ручной стакан 500 мЛ, чтобы аккуратно перенести содержимое нерестового стакана в новый стакан, содержащий 7,5 л свежего fSW (что составляет в общей сложности 10 л). Налейте под углом, чтобы избежать брызг движения.
- На второе утро (День 2), вручную перенесите 150 животных на новый стакан, содержащий 5 Л свежего fSW.
- На третье утро (День 3), вручную передачи 120 животных на новый стакан с 5 Л свежего fSW.
ПРИМЕЧАНИЕ: Для синхронизации развития животных, важно выбрать лиц с аналогичными размерами во время ручной передачи на день 2 и 3. Не более 10 животных могут быть откачаными в одной передаче. - На четвертое утро (День 4), полностью созрели животные должны появиться. Повторите шаг 5.1.3, чтобы закрыть жизненный цикл.
ПРИМЕЧАНИЕ: Автоматизированный насос кормления может быть установлен, чтобы кормить животных в 5 вечера по выходным без присутствия культивирования персонала.
- Ежедневная подготовка водорослей из рабочей культуры
- Измерьте абсорбции рабочей культуры на 660 нм.
- Основываясь на ежедневной диаграмме кормления, узнайте, сколько водорослевых клеток необходимо кормить для животных определенного размера(Таблица 3).
- Использование кривых роста водорослей(рисунок 4),решить уравнения ниже, чтобы вычислить объем водорослей пищи (mL), необходимых на данный день.
- Для расчета объема определенных водорослей, необходимых для определенного дня и времени кормления, используйте следующее уравнение:
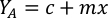
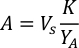
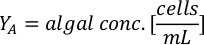
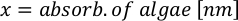
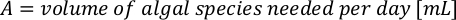
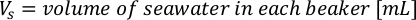
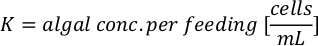
ГдеA Y является водорослей концентрации на данный день и является объем водорослей, необходимых для кормления. Кроме того, на рисунке 4показаны линейные отношения между YA и x,значения для перехвата(c)инаклона (м). Обратитесь к таблице 3 для значений K. - Например, для расчета объема Isochrysis sp. необходимо в 9 утра кормления день 3 животных поддерживается в 5 L культуры и с водорослей абсорбции 0,234 (измеряется на 660 нм), было вычислено следующее:
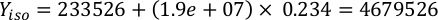
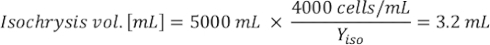
ПРИМЕЧАНИЕ: Храните эти уравнения в электронной таблице, чтобы ежедневное количество кормления автоматически вычисляется на основе измерений абсорбции, размера животных и объема культуры морскойводы (Дополнительный файл 1).
- Для расчета объема определенных водорослей, необходимых для определенного дня и времени кормления, используйте следующее уравнение:
- Перенесите расчетный объем водорослей в 50 мЛ труб, центрифуга на 5000 х г в течение 5 мин при 20 градусов по Цельсию.
- Удалите супернатант. Заполните трубки обратно до первоначального объема со свежим fSW, заменив старые водоросли средств массовой информации.
- Храните приготовленную еду в холодильнике до готовности к использованию для следующего корма. Откажитесь от старой пищи водорослей после того, как на следующее утро готовится новая еда.
- Активированный уголь (по желанию)
ПРИМЕЧАНИЕ: 10 г активированного угля добавляется в каждый стакан культуры для поддержания качества воды. Древесный уголь можно использовать повторно до четырех раз. Откройте мешок древесного угля медленно, чтобы избежать древесного угля пыли от входа в культуру стаканы.- Передача 700 г активированного угля в контейнер. Замочите в пресной воде (FW) в течение 48 часов и дайте им осесть на дне.
- Промыть с FW для удаления остаточной древесной древесной пыли.
- Отварить уголь в FW в течение 15-20 мин. Снимите с огня и дайте остыть.
- Промыть, пока большинство древесного угля пыль удаляется, и вода становится ясной.
- Храните чистый уголь в 2 L стакан, содержащий fSW. Обложка стакан, чтобы предотвратить попадание пыли.
- Добавьте древесный уголь в каждый новый стакан перед передачей животных.
Результаты
Oikopleura могут быть собраны из лодки или из гавани медленно, нежный буксировки 100 мкм сетки планктона сети с нефильтровочной трески конец (Рисунок 5). Из-за хрупкого характера животных, важно, чтобы избежать любых движений, которые могут вызвать физические нагрузки, такие как грубое обращение с сетью или брызг из-за захваченных воздушный карман в банке образца.
Важно понимать сезонную структуру местных популяций ойкоплеура, а также сопутствующие колебания физических характеристик воды на месте отбора проб. Выборка в период с 2015 по 2019 год выявила последовательные сезонные колебания в присутствии O. dioica в гавани Исикава и Кин на Окинаве(рисунок 6). Температура морской воды поверхности, как представляется, является одним из основных факторов. O. dioica был доминирующим видом, когда поверхностная морская вода достигала 28 градусов по Цельсию, а О. Лонгикауда сосуществовал с О. диойкой при температурах между 24 и 27 градусами Цельсия; тем не менее, О. лонгикуда доминировал ниже 23 градусов по Цельсию(рисунок 6A). Постепенное изменение солености после нескольких дней подряд проливных дождей не коррелирует с обилием O. dioica (рисунок 6B).
Используя процедуры отбора проб, описанные выше, большинство O. dioica мы восстановили были между 2-м и 3-го дня их 4-дневного жизненного цикла (Рисунок 7C). Зрелые самцы были признаны желтой окраской гонад, в то время как самки гонад мерцали золотом из яиц диаметром 70-80 мкм (рисунок 8A,B). Незрелые O. dioica были подтверждены двумя подборными клетками на хвостах(рисунок 8D). Другой доминирующий вид в местных водах, O. longicauda, были похожи по размеру и морфологии. Мы использовали следующие критерии, чтобы отличить O. longicauda от O. dioica38,39,40: отсутствие подборных клеток в хвосте, наличие velum в багажнике, и наличие гермодита гонад(рисунок 8E, F). Различные морфологии хвоста также полезны для различения O. longicauda от O. dioica. Когда нетронутой голый животное без дома был ориентирован на поздно, хвост О. longicauda был более прямой с меньшей кривизны, придав ему "жесткий" внешний вид по сравнению с O. dioica.
Три наиболее важных фактора для создания стабильной системы культуры Ойкоплеура: i) поддержание высокого качества воды, ii) определение оптимального режима кормления и (iii) создание нерестилища с достаточным количеством самцов и самок. Внедрение многоступенчатой системы фильтров(рисунок 1)улучшило качество воды и стабильность культуры. Система фильтрации не требуется для искусственной морской воды; однако, стоимость, доступность и удобство естественной морской воды делает его лучшим вариантом для лабораторий, расположенных вблизи побережья. Для установления режима кормления мы рекомендуем измерять кривые роста водорослей, которые применяются к отдельным лабораторным условиям, так как температурные и световые условия сильно различаются. Мы объединили кривые роста с ранее опубликованными графиками кормления для оптимизации концентраций водорослей и композиций27 (рисунок 4). Мы также следуем строгому графику прививки водорослей, чтобы поддерживать свежие запасы водорослей(Таблица 2). Автоматизированная система кормления позволяет нам поддерживать согласованный ежедневный график кормления без присутствия культивируемого персонала(рисунок 2B).
Как только оптимальные условия морской воды и кормления будут достигнуты, важно инициировать новые поколения, создавая нерестовой стакан с 15 самцами и 30 самками в 2,5 л fSW. Это обеспечивает хорошую концентрацию животных День 1 на следующее утро, что достаточно, чтобы изолировать 150 животных на второй день, 120 на 3-й день и 45 зрелых взрослых на 4-й день для нереста. Если Есть не хватает мужчин и женщин на день 4, собирать и передавать как можно больше зрелых лиц, как это возможно, чтобы 1 L fSW и пусть они икру естественно в надежде, что там будет достаточно личинок, чтобы нести на следующее поколение. В соответствии с предоставленным протоколом, жизненный цикл O. dioica составляет 4 дня при 23 градусов по Цельсию(рисунок 7C). Мы надежно создали шесть независимых диких популяций O. dioica,все из которых длились более 20 поколений.
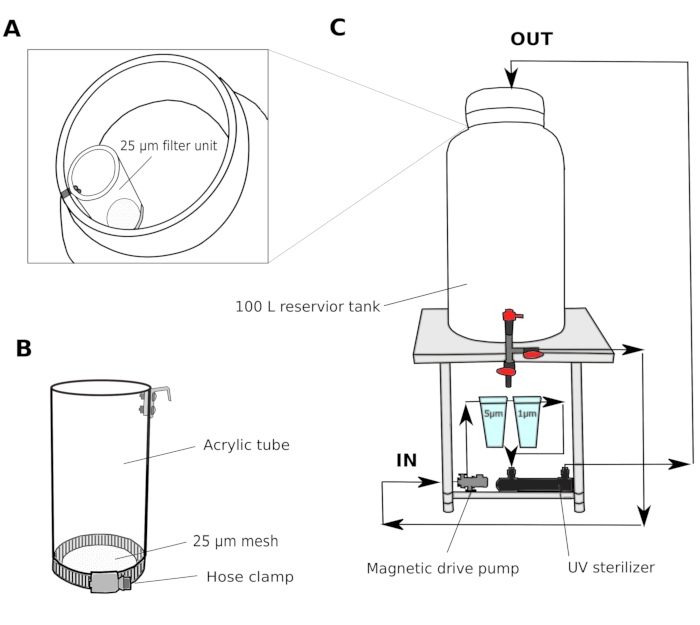
Рисунок 1: Схема системы фильтрации морской воды.
(A и B) Морская вода первоначально фильтруется через 25-м фильтровальный блок перед входом в резервуар(C) Магнитный привод насос используется для рисования морской воды из резервуара бака. Затем морская вода проталкивается через два полипропиленовых фильтра и УФ-стерилизатор, прежде чем вернуться в резервуар резервуара. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.
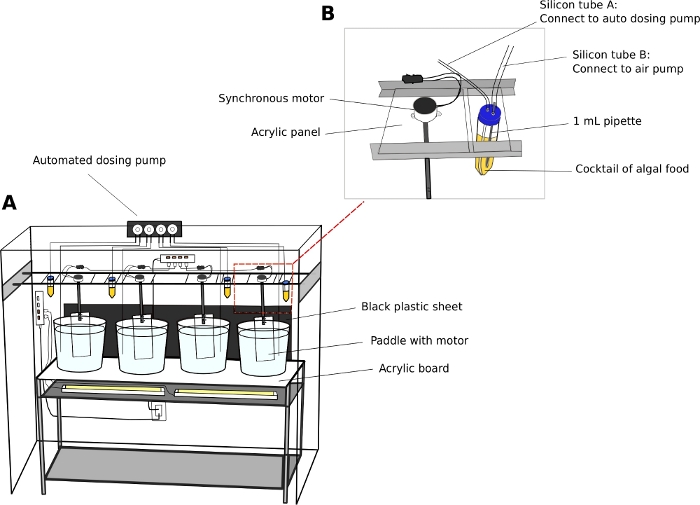
Рисунок 2: Система культуры для O. dioica.
(A) Обзор системы культуры(B) Крупным планом зрения синхронного двигателя и водорослей резервуар для автоматизированного прокачки насоса. Внутренние диаметры кремниевых труб А и В составляют 2 мм и 4 мм соответственно. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.

Рисунок 3: Фондовые культуры для O. dioica.
Слева - C. calcitrans, Isochrysis sp., Synechococcus sp., и R. reticulata после того, как выращивается при 17 градусах Цельсия при непрерывном освещении в течение 10 дней. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.
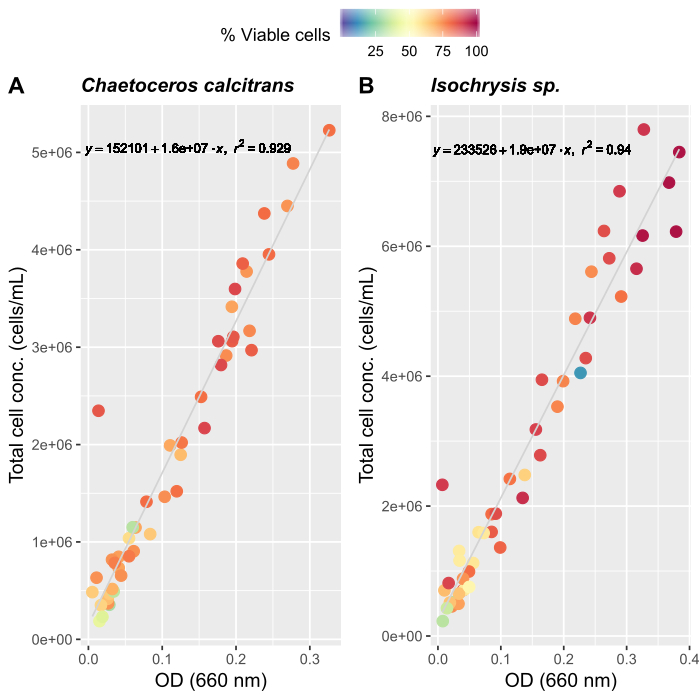
Рисунок 4: Кривая роста водорослей для двух основных видов продуктов питания, C. calcitrans и Isochrysis sp..
Рассеяние участков оптической плотности (OD) на 660 нм и общей концентрации клеток для (A) C. calcitrans и(B) Isochrysis sp. Каждая точка представляет собой среднее значение трех измерений. Для определения процента жизнеспособных клеток и общей концентрации клеток (клетки/мЛ) использовался счетчик клеток. Измерения были зарегистрированы в течение 20 дней (n No 47). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.
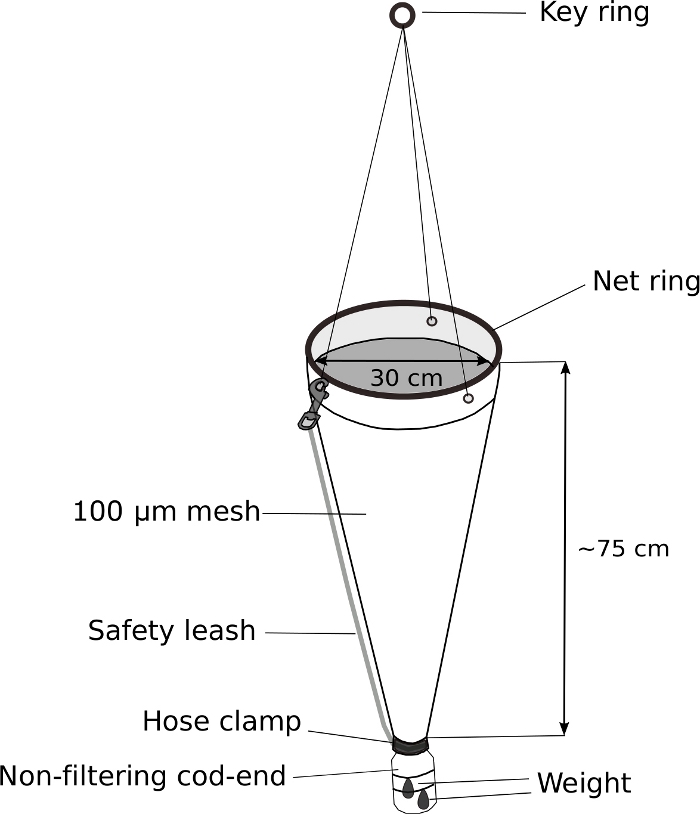
Рисунок 5: Модифицированная сеть планктона для отбора проб Ойкоплеура.
Треска-конец ручной сети планктона (100 мкм сетки) заменяется 500 мл стиральная бутылка. Вес 70 г крепится к треске. К брелоку крепится около 5 м веревки. Поводка безопасности крепится для дальнейшего обеспечения трески-конец. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.
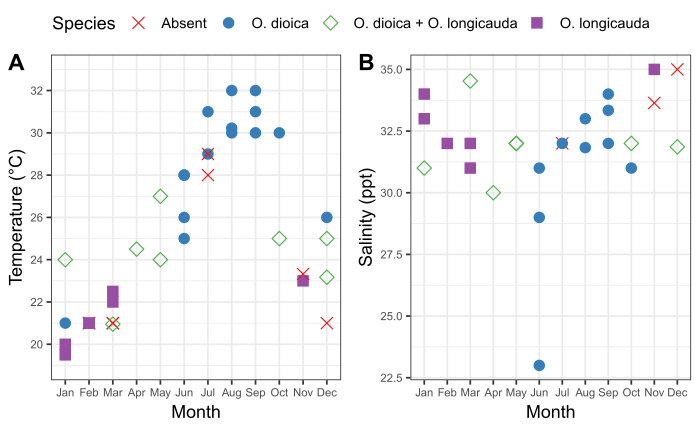
Рисунок 6: Сезонность O. dioica на Окинаве.
Наличие и отсутствие О. Диойки и О. longicauda в связи с сезонными изменениями в (A) Температура и (B) соленость в гаванях в Исикава (26'25'39.3"N 127'49'56.. 6"E) и Кин (26'26'40.2"N 127'55'00.3"E) между 2015-2019. Каждый вид был зарегистрирован в качестве настоящего, если более 50 животных были подсчитаны вручную. Зафиксированы измерения температуры и солености поверхностных вод. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.
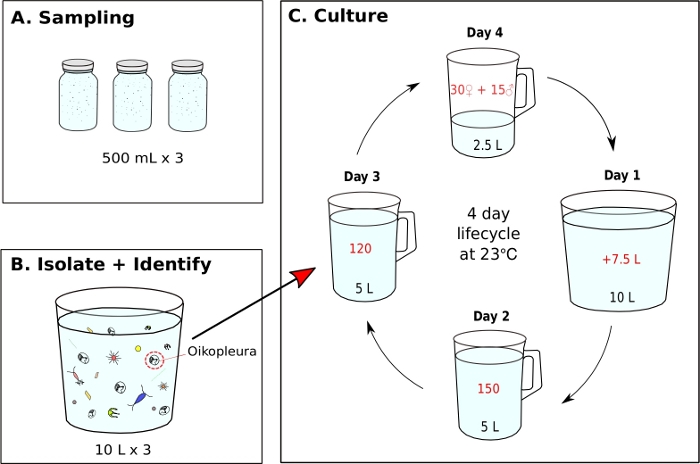
Рисунок 7: Диаграмма потока для инициирования монокультуры O. dioica.
(A) Три, 500 мЛ образцы планктона собираются из участка выборки (B) Каждый образец банку разбавляется и O. dioica изолирован от остальной планктона (C) Монокультура O. dioica инициируется вручную передачи 120 День 3 животных на новый стакан, содержащий 5 L свежей фильтрованной морской воды (fSW). Настройка нерестового стакана, содержащего 30 самок, 15 самцов и 2,5 л свежего fSW. Первое утро после нереста (Day1), тщательно опорожняющий стакан с новым поколением животных в стакан, содержащий 7,5 л свежего fSW. На второй день после нереста (День 2), передача 150 животных в стакан, содержащий 5 Л свежих FSW. На третий день после нереста (День 3), передача 120 животных в стакан, содержащий 5 Л свежих fSW. В заключительный день (День 4), создать новый нерестовый стакан, содержащий 30 женщин, 15 мужчин и 2,5 л свежего fSW в рамках подготовки следующего поколения. У животных 4-дневный жизненный цикл при 23 градусов по Цельсию. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.
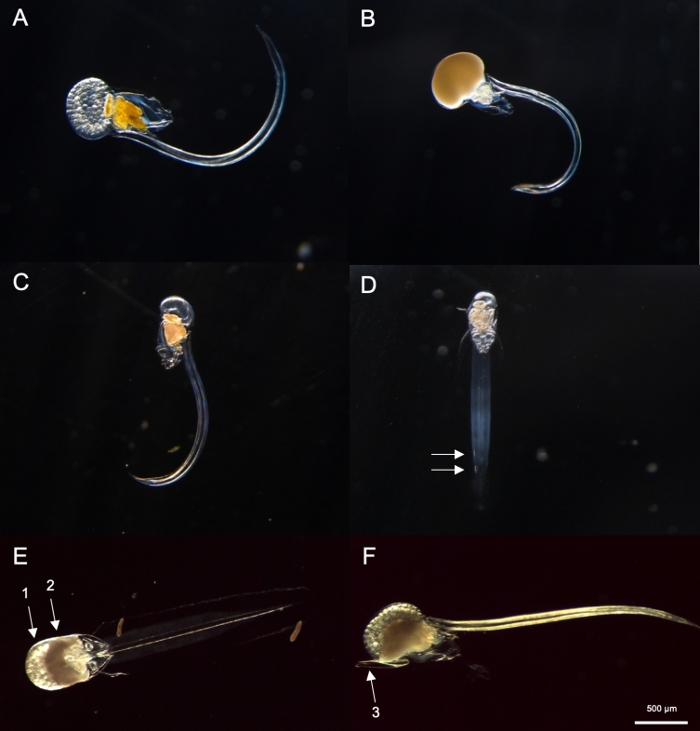
Рисунок 8: Идентификация Oikopleura spp. (A-D: O. dioica, E и F: O. longicauda).
(A) Самка О. dioica с яйцами (B) Мужской O. dioica со спермой (C) Боковой вид незрелых O. dioica (D) Ventral зрения незрелых O. dioica с двумя подборными клетками, указанными с белыми стрелками (E) Ventral зрения зрелых O. longicauda проведения яйцеклеток (стрелка 1) и спермы (стрелка 2) (F) Боковой вид O. longicauda показ velum (стрелка). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.
| Реагентов | Химические продукты | Сумма | Окончательный vol. (mL) | Стерилизации | Фондовый / Открыт |
| Решение A | Na2ЭДТА | 45 г | 1000 | Автоклаве | -20 C / 4 C |
| НаНО3 | 100 г | ||||
| H3BO3 | 33,6 г | ||||
| 2PO4 | 20 г | ||||
| MnCl2No4H2O | 0,36 г | ||||
| FeCl3No6H2O | 1,3 г | ||||
| Решение B | 1,0 мл | ||||
| Решение B | 0Cl2 | 2,1 г | 1000 | Автоклаве | 4 кк / 4 кк |
| КоКл26Н2O | 2,0 г | ||||
| (NH4)6Mo7O244H2O | 0,9 г | ||||
| CuSO4No5H2O | 2,0 г | ||||
| ЗКЛ | -- mL | ||||
| Витамин | Тиамин (B1) Hcl | 200 мг | 1000 | Автоклаве | -20 C / 4 C |
| Биотин | 1 мг | ||||
| Кобаламин (B12) | 1 мг | ||||
| Силикат натрия | Na2SiO3 | 5% | 1000 | 0,22 мкм фильтр | 4 кк / 4 кк |
| Стрептомицина | C21H39N7O12 | 25 мг/мл | 50 | 0,22 мкм фильтр | -20 C / -20 градусов по Цельсию |
Таблица 1: Рецепт реагентов, необходимых для поддержания водорослей. После растворения всех химических веществ, перечисленных для раствора B, HCl добавляется до тех пор, пока раствор не станет ясным без мутности. Все реагенты стерилизованы либо автоклавингом (120 градусов по Цельсию, 25 мин), либо с помощью фильтра 0,22 м. Все реагенты, кроме запасов витаминов, стерилизованы после добавления указанного химического вещества. Для запасов витамина, автоматически построить воду, а затем растворить перечисленных химических веществ. Температура хранения запасов и открытых реагентов указаны.
| Тип культуры | Водоросль спп. | ASW (mL) | Витамин | Решение A | Силикат натрия | Стрептомицина | Водоросли (mL) / Тип культуры | Инкубация / Магазин | Частота |
| Фондовая культура | Чето | 60 | 1/2000 | 1/2000 | 1/4000 (Только Чаето) | 1/1000 (Все, кроме Syn) | 0,03 / акции | 17 градусов по Цельсию / 4 градуса по Цельсию | Раз в две недели |
| Iso | 60 | 0,03 / акции | |||||||
| Носорог | 80 | 0,06 / акции | |||||||
| Syn | 60 | 0,03 / акции | |||||||
| Субкультура | Чето | 500 | 1/2000 | 1/2000 | 1/4000 (Только Чаето) | 1/1000 (Все, кроме Syn) | 10 / акции | 17 градусов по Цельсию / 17 градусов по Цельсию | Еженедельно |
| Iso | 500 | 10 / акции | |||||||
| Носорог | 500 | 20 / акции | |||||||
| Syn | 500 | 10 / акции | |||||||
| Культура труда | Чето | 400 | 1/2000 | 1/2000 | 1/4000 (Только Чаето) | 1/1000 (Все, кроме Syn) | 100 / к югу | RM / RM | Каждые 4 дня |
| Iso | 400 | 100 / к югу | |||||||
| Носорог | 400 | 150 / к югу | |||||||
| Syn | 400 | 100 / к югу |
Таблица 2: Инструкция по обслуживанию трех типов водорослей культуры. Добавьте указанное количество добавок к флягам, содержащим автоклавированную морскую воду. Прививать каждую колбу с указанным количеством водорослей культуры. Инкубировать и хранить водоросли культур при определенных температурах. Прививать новую культуру акций и субкультуру от прежней фондовой культуры, а также новую культуру труда из предыдущей субкультуры. Прививать новую культуру акций, субкультуру и культуру труда каждые две недели, одну неделю и четыре дня соответственно. Этот график обеспечивает достаточно пищи для примерно 10 стаканов O. dioica культуры. Поддерживать 2 - 3 наборы каждого типа водорослей культуры в качестве резервных копий. RM - комнатная температура.
| День | Водоросль спп. | 9 УТРА и 5 вечера | 12 ВЕЧЕРА |
| 1 | Чето | — | — |
| Iso | 1000 | 2000 | |
| Syn | 20,000 | 40,000 | |
| 2 | Чето | 1000 | 2000 |
| Iso | 2000 | 2000 | |
| Носорог | 1000 | 1000 | |
| 3 | Чето | 3000 | 4000 |
| Iso | 3000 | 4000 | |
| Носорог | 1500 | 1500 | |
| 4 | Чето | 1000 | 2000 |
| Iso | 1000 | 2000 | |
| Носорог | 1000 | 1000 |
Таблица 3: Концентрация водорослей на кормление- изменено от Bouquet et al.27. Концентрации водорослей (клетки mL-1)и водорослей видов, используемых для ежедневного кормления в течение 4-дневного жизненного цикла Окинава O. dioica.
Дополнительный файл 1: Ежедневная диаграмма кормления. Ежедневные суммы кормления для каждого стакана культуры автоматически рассчитываются после ввода ежедневных измерений абсорбции водорослей (OD), размера животных (День) и объема морской воды (SW vol.) в каждом стакане культуры. Кривые роста R. reticulata и Synechococcus sp. были адаптированы из Bouquet et al.27. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 2: Как подключить синхронный двигатель к акриловой весло. Плотно привинчивайся к веслом к мотору с помощью шестиугольного ключа. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Для облегчения гибкости в создании культуры O. dioica важно понимать естественную среду обитания животных. Сезонные данные предоставляют информацию о диапазонах физических параметров, которые могут быть использованы для руководства лабораторных условий культивирования. Это также помогает в понимании сезонных колебаний в изобилии животных. На Окинаве, O. dioica наиболее надежно найти с июня по октябрь. Тем не менее, в Токийском заливе, население пик в феврале и октябре41. Хотя культивирование O. dioica часто сообщается при температуре 20 градусов по Цельсию или ниже27,28,29, Okinawan O. dioica показывает лучшую выживаемость при температурах выше 20 градусов по Цельсию; это может быть объяснено тем фактом, что минимальная температура поверхностной морской воды на Окинаве составляет 20 градусов по Цельсию(рисунок 6). Обилие O. dioica также может быть под влиянием фитопланктона цветет42 и хищник изобилия43,44. Независимо от того, где O. dioica собраны, понимание сезонности местного населения максимизирует шансы выборки и культивирования успеха.
Учитывая соответствующий сезон и место, чистая выборка является эффективным способом сбора большого количества Oikopleura с минимальными усилиями. Для сбора всех этапов животного могут быть использованы планктонные сети с меньшим размером сетки (60-70 мкм). Полностью зрелые животные редко встречаются в сети, возможно, из-за их хрупкости в конце жизненного цикла. Таким образом, идентификация видов с последующей выборкой достигается путем микроскопического наблюдения подборальных клеток. Зрелые люди обычно появляются один или два дня после отбора проб, как животные продолжают расти в лаборатории. Хотя чистая выборка эффективна, альтернативные методы отбора проб могут быть необходимы в различных обстоятельствах. Например, чистая выборка вблизи городских районов может собрать большое количество фитопланктона, что затрудняет изоляцию Ойкоплеуры. В таких случаях рекомендуется простой отбор проб ведер для сбора поверхностного морского воды или пробы лодки из районов за пределами гавани. Результаты показали, что постепенное изменение солености из-за последовательных дней дождя не повлияло на обилие O. dioica; однако следует избегать отбора проб на берегах сразу же после экстремальных погодных явлений, таких, как тропические циклоны. Эти события вызывают внезапные и радикальные биогеохимические изменения в защищенном водоеме45,,46. Сток ливневых вод может нести загрязняющие вещества, отложения и избыток питательных веществ, которые повышают мутность и более низкое качествоводы 47. Планктон, питающийся фильтром, такой как Oikopleura,может быть особенно восприимчив к этим изменениям из-за их способа кормления и ограниченной подвижности. В таких обстоятельствах мы рекомендуем отложить отбор проб на несколько дней, пока местные условия не нормализутся.
Внедрение многоступенчатой системы фильтров имеет важное значение для поддержания малых, фильтр-кормления организмов, таких как O. dioica. Используя плохо отфильтрованную морскую воду (например, сетку размером 25 мкм в прежней системе культуры) культура часто была нестабильной, особенно в летнее время, что потенциально объясняется более высоким изобилием фитопланктона. Хотя некоторые фитопланктона полезны для роста O. dioica, другие производят биотоксины, которые могут вызвать аномальное развитие эмбрионов O. dioica 48. Кроме того, высокая концентрация диатомовых, таких как Chaetoceros spp. потенциально вредны для роста O. dioica, поскольку они могут обладать длинными сетами, которые могут засорить дом и предотвратить эффективное кормление49. Мы часто наблюдали, как дома мелких животных забиты C. calcitrans setae; Поэтому мы теперь кормим C. calcitrans только животным в День 2 и старше(Таблица 3).
Хотя это не было проблемой здесь, небольшие долгосрочные культивирования O. dioica может испытывать внезапное падение численности населения из-за генетического узкого места; в таких случаях, Марти-Соланс и др.29 рекомендуют добавлять новых диких людей в культуру каждые 20 поколений.
Система культуры Ойкоплеура является гибкой. Стабильная культура может быть установлена в течение недели. Долгосрочное культивирование O. dioica возможно на скромный бюджет с неспециалистным оборудованием. Ежедневные усилия, необходимые для обслуживания 5-10 стаканов Oikopleura, как правило, менее 2 часов с 2 человек. O. dioica также может поддерживаться в искусственной морской воде, что полезно для тех, кто не имеет доступа к естественной морскойводе 28. Долгосрочное хранение водорослей можно использовать с помощью твердой культуры и криоконсервации29. Кроме того, O. dioica спермы может быть криоконсерваны, и остаются жизнеспособными в течение более года50. Все эти факторы означают, что культуры могут быть легко восстановлены. Наконец, прошлый опыт с случайной культивирования Pleurobrachia SP. может предположить, что система культивирования, разработанная для Ойкоплеуры, потенциально может быть распространена на более широкое сообщество хрупких пелагических организмов.
O. dioica продолжает давать мощные знания о различных биологических областях. Понимание местной сезонности, тщательной системы культуры, и несколько преданных своему делу людей позволяют эффективной культуры, которые будут созданы с небольшим усилием. Система культуры Ойкоплеура предоставляет базовые ресурсы для изучения широкого спектра биологических областей, связанных с экологией, развитием, геномикой и эволюцией этого уникального морского хордата.
Раскрытие информации
Автору нечего декларировать.
Благодарности
Мы благодарны Гарту Ильсли за его поддержку в создании системы культуры. Мы признаем вклад Рицуко Суямы и Сильвена Гийо в усилия по раннему отбору проб и идентификации видов. Особая благодарность благодаря Хироки Нисида, Такеши Онума и Тацуя Омотезако за их щедрую поддержку и руководство во всем, в том числе первоначальное создание местной системы культивирования и обмена животными и микроалгалной культурой. Мы также благодарим Даниэля Чоррута, Юан-Мари Буке, Анну Аасорд, Кристиана Каньестро и Альфонсо Феррендес-Ролдана за то, что они поделились своим опытом в области отбора проб и культивирования. Джай Дентон, Чарльз Плесси и Джеффри Джолли предоставили бесценную обратную связь по рукописи. Шарлотта Уэст сформулировала обобщенное уравнение для расчета водорослей. Наконец, мы благодарим OIST за финансирование, Мэри Коллинз и OIST Fieldwork Комитет по безопасности за консультации по безопасным процедурам отбора проб, сотрудники OIST машинного цеха для строительства культивирования и отбора проб оборудования, и Koichi Тода для доставки морской воды.
Материалы
| Name | Company | Catalog Number | Comments |
| Activated charcoal | Sigma | C2764-2.5KG | |
| Alluminum pulley | Rainbow Products | 10604-10607 | |
| Biotin | Sigma | B4501-100MG | |
| Boric acid | Wako | 021-02195 | |
| Cobalamin (B12) | Sigma | V2876-100MG | |
| Cobalt(II) chloride hexahydrate | Wako | 036-03682 | |
| Copper(II) sulfate pentahydrate | Wako | 039-04412 | |
| Disodium edetate hydrate | Wako | 044-29525 | |
| Hexaammonium heptamolybdate tetrahydrate | Wako | 019-03212 | |
| Hexagon wrench | Anex | No.6600 | |
| Hydrochloric acid | Wako | 080-01066 | |
| Iron(III) chloride hexahydrate | Wako | 091-00872 | |
| Jebao programmable auto dosing pump | Jebao | DP-4 | |
| Magnet pump | REI-SEA | RMD-201 | |
| Manganese(II) chloride tetrahydrate | Wako | 134-15302 | |
| Polypropylene wound cartridge filter | Advantec | TCW-10N-PPS | |
| TCW-5N-PPS | |||
| TCW-1N-PPS | |||
| Screwless terminal block | SATO PARTS | SL4500 | |
| Simple plankton net | RIGO, Japan | 5512-C | |
| Sodium metasilicate | Sigma | 307815-1KG | |
| Sodium nitrate | Wako | 195-02545 | |
| Sodium phosphate monobasic anhydrous | MP Biomedicals | 194740 | |
| Streptomycin sulfate salt | Sigma | S6501-25G | |
| Synchronous electric motor | Servo | D5N6Z15M | |
| Thiamin hydrochloride | Wako | 201-00852 | |
| UV sterilizer | Iwaki | UVF-1000 | |
| Zinc chloride | MP Biomedicals | 194858 |
Ссылки
- Travis, J. Is It What We Know or Who We Know? Choice of Organism and Robustness of Inference in Ecology and Evolutionary Biology (American Society of Naturalists Presidential Address). The American Naturalist. 167 (3), 303-314 (2006).
- Jenner, R. A., Wills, M. A. The choice of model organisms in evo-devo. Nature Reviews Genetics. 8 (4), 311-314 (2007).
- Irigoien, X., Huisman, J., Harris, R. P. Global biodiversity patterns of marine phytoplankton and zooplankton. Nature. 429 (6994), 863-867 (2004).
- Wilson, S., Ruhl, H., Smith, J. Zooplankton fecal pellet flux in the abyssal northeast Pacific: A 15 year time-series study. Limnology and Oceanography. 58 (3), 881-892 (2013).
- Steinberg, D. K., Lomas, M. W., Cope, J. S. Long-term increase in mesozooplankton biomass in the Sargasso Sea: Linkage to climate and implications for food web dynamics and biogeochemical cycling. Global Biogeochemical Cycles. 26 (1), 1004 (2012).
- Lombard, F., Kiørboe, T. Marine snow originating from appendicularian houses: Age-dependent settling characteristics. Deep Sea Research Part I: Oceanographic Research Papers. 57 (10), 1304-1313 (2010).
- Fenaux, R., Bone, Q. . The Biology of Pelagic Tunicates. , 251-264 (1998).
- Hopcroft, R. R., Gorsky, G., Youngbluth, M. J., Deibel, D. . Response of Marine Ecosystems to Global Change: Ecological Impact of Appendicularians. , 45-57 (2005).
- Walters, T. L., Gibson, D. M., Frischer, M. E. Cultivation of the Marine Pelagic Tunicate Dolioletta gegenbauri (Uljanin 1884) for Experimental Studies. Journal of Visualized Experiments. (150), e59832 (2019).
- Deibel, D. Feeding mechanism and house of the appendicularian Oikopleura vanhoeffeni. Marine Biology. 93 (3), 429-436 (1986).
- Spada, F., et al. Molecular patterning of the oikoplastic epithelium of the larvacean tunicate Oikopleura dioica. Journal of Biological Chemistry. 276 (23), 20624-20632 (2001).
- Flood, P. R., Gorsky, G., Youngbluth, M. J., Deibel, D. . Response of Marine Ecosystems to Global Change: Ecological Impact of Appendicularians. , 59-85 (2005).
- Tokioka, T. Studies on the distribution of appendicularians and some thaliaceans of the North Pacific, with some morphological notes. Publication of the Seto Marine Biological Laboratory. (8), 351-443 (1960).
- Alldredge, A. L. Discarded appendicularian houses as sources of food, surface habitats, and particulate organic matter in planktonic environments. Limnology and Oceanography. 21 (1), 14-24 (1976).
- Clarke, C., Roff, J. C. Abundance and biomass of herbivorous zooplankton off Kingston, Jamaica, with estimates of their annual production. Estuarine, Coastal and Shelf Science. 31 (4), 423-437 (1990).
- Hopcroft, R. R., Roff, J. C. Zooplankton growth rates: extraordinary production by the larvacean Oikopleura dioica in tropical waters. Journal of Plankton Research. 17 (2), 205-220 (1995).
- Hopcroft, R. R., Roff, J. C. Production of tropical larvaceans in Kingston Harbour, Jamaica: are we ignoring an important secondary producer. Journal of Plankton Research. 20 (3), 557-569 (1998).
- Mochioka, N., Iwamizu, M. Diet of anguilloid larvae: leptocephali feed selectively on larvacean houses and fecal pellets. Marine Biology. 125 (3), 447-452 (1996).
- Sakaguchi, S. O., et al. Morphological identity of a taxonomically unassigned cytochrome c oxidase subunit i sequence from stomach contents of juvenile chum salmon determined using polymerase chain reaction. Fisheries Science. 83 (5), 757-765 (2017).
- Fenaux, R., Bone, Q. . The Biology of Pelagic Tunicates. , 25-34 (1998).
- Sato, R., Tanaka, Y., Ishimaru, T. House production by Oikopleura dioica (Tunicata, Appendicularia) under laboratory conditions. Journal of Plankton Research. 23 (4), 415-423 (2001).
- Flood, R., Deibel, D., Bone, Q. . The Biology of Pelagic Tunicates. , 105-124 (1998).
- Alldredge, A., Gorsky, G., Youngbluth, M. J., Deibel, D. . Response of Marine Ecosystems to Global Change: Ecological Impact of Appendicularians. , 309-326 (2005).
- Katija, K., Sherlock, R. E., Sherman, A. D., Robison, B. H. New technology reveals the role of giant larvaceans in oceanic carbon cycling. Science Advances. 3 (5), 1602374 (2017).
- Katija, K., Choy, C. A., Sherlock, R. E., Sherman, A. D., Robison, B. H. From the surface to the seafloor: How giant larvaceans transport microplastics into the deep sea. Science Advances. 3 (8), 1700715 (2017).
- Hidaka, K. Species composition and horizontal distribution of the appendicularian community in waters adjacent to the Kuroshio in winter-early spring. Plankton and Benthos Research. 3 (3), 152-164 (2008).
- Bouquet, J. M., et al. Culture optimization for the emergent zooplanktonic model organism Oikopleura dioica. Journal of Plankton Research. 31 (4), 359-370 (2009).
- Nishida, H. Development of the appendicularian Oikopleura dioica: culture, genome, and cell lineages. Development, Growth & Differentiation. 50, 239-256 (2008).
- Martí-Solans, J., et al. Oikopleura dioica culturing made easy: A Low-Cost facility for an emerging animal model in Evo Devo. Genesis. 53 (1), 183-193 (2015).
- Holland, L. Z. Tunicates. Current Biology. 26 (4), 146-152 (2016).
- Delsuc, F., Brinkmann, H., Chourrout, D., Philippe, H. Tunicates and not cephalochordates are the closest living relatives of vertebrates. Nature. 439 (7079), 965-968 (2006).
- Seo, H. C., et al. Miniature genome in the marine chordate Oikopleura dioica. Science. 294 (5551), 2506 (2001).
- Fredriksson, G., Olsson, R. The subchordal cells of Oikopleura dioica and O. albicans (Appendicularia, Chordata). Acta Zoologica. 72 (4), 251-256 (1991).
- Paffenhöfer, G. A. The cultivation of an appendicularian through numerous generations. Marine Biology. 22 (2), 183-185 (1973).
- Fenaux, R., Gorsky, G. Nouvelle technique d'élevage des appendiculaires. Rapports et Procés-Verbaux des Réunions-Commission Internationale pour l'Exploration Scientifique de la Mer Méditerranée. 29, 291-292 (1985).
- Fujii, S., Nishio, T., Nishida, H. Cleavage pattern, gastrulation, and neurulation in the appendicularian, Oikopleura dioica. Development Genes and Evolution. 218 (2), 69-79 (2008).
- Patry, W. L., Bubel, M., Hansen, C., Knowles, T. Diffusion tubes: a method for the mass culture of ctenophores and other pelagic marine invertebrates. PeerJ. 8, 8938 (2020).
- Fenaux, R. The classification of Appendicularia (Tunicata): history and current state. Memoires de I'Institut oceanographique. , (1993).
- Shiga, N., Chihara, M., Murano, M. . Illustrated Guide to Marine Plankton in Japan. , 1393-1414 (1997).
- Gorsky, G., Castellani, C., Castellani, C., Edwards, M. . Marine Plankton: A practical guide to ecology, methodology, and taxonomy. , 599-606 (2017).
- Sato, R., Ishibashi, Y., Tanaka, Y., Ishimaru, T., Dagg, M. J. Productivity and grazing impact of Oikopleura dioica (Tunicata, Appendicularia) in Tokyo Bay. Journal of Plankton Research. 30 (3), 299-309 (2008).
- Nakamura, Y., Suzuki, K., Suzuki, S. Y., Hiromi, J. Production of Oikopleura dioica (Appendicularia) following a picoplankton 'bloom'in a eutrophic coastal area. Journal of Plankton Research. 19 (1), 113-124 (1997).
- Nakamura, Y. Blooms of tunicates Oikopleura spp. and Dolioletta gegenbauri in the Seto Inland Sea, Japan, during summer. Hydrobiologia. 385 (1-3), 183-192 (1998).
- Uye, S. I., Ichino, S. Seasonal variations in abundance, size composition, biomass and production rate of Oikopleura dioica (Fol)(Tunicata: Appendicularia) in a temperate eutrophic inlet. Journal of Experimental Marine Biology and Ecology. 189 (1-2), 1-11 (1995).
- Tsuchiya, K., et al. Phytoplankton community response and succession in relation to typhoon passages in the coastal waters of Japan. Journal of Plankton Research. 36 (2), 424-438 (2014).
- Lopez-Lopez, L., et al. Effects of typhoons on gelatinous carnivore zooplankton off Northern Taiwan. Cahiers de Biologie Marine. 53, 349-355 (2012).
- Ares, &. #. 1. 9. 3. ;., et al. Extreme storm-induced run-off causes rapid, context-dependent shifts in nearshore subtropical bacterial communities. bioRxiv. , (2019).
- Torres-Águila, N. P., et al. Diatom bloom-derived biotoxins cause aberrant development and gene expression in the appendicularian chordate Oikopleura dioica. Communications Biology. 1 (1), 1-11 (2018).
- Troedsson, C., Frischer, M. E., Nejstgaard, J. C., Thompson, E. M. Molecular quantification of differential ingestion and particle trapping rates by the appendicularian Oikopleura dioica as a function of prey size and shape. Limnology and Oceanography. 52 (1), 416-427 (2007).
- Ouchi, K., Nishino, A., Nishida, H. Simple procedure for sperm cryopreservation in the larvacean tunicate Oikopleura dioica. Zoological Science. 28 (1), 8-11 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены