Method Article
2光子顕微鏡を使用して、糸球体プロセスに対する慢性片側尿管閉塞の影響を定量化
要約
ここでは、表面糸球体を有するミュンヘンWistar Fromterラットにおける2光子顕微鏡を使用して、糸球体の動態と機能に対する長期の尿管閉塞の影響を定量化するプロトコルを紹介します。
要約
腎臓の動的生理機能を探索するために、適切な動物疾患モデルに新しい顕微鏡法を適用することは依然として課題です。表面糸球体を有するラットは、生体内2光子顕微鏡を使用して生理学的および病態生理学的プロセスを調査するユニークな機会を提供します。糸球体毛細血管血流の定量化、および薬物、透過性、および炎症に応答した血管収縮および拡張は、研究できるプロセスのほんの一部です。さらに、トランスジェニックラット、すなわち蛍光色素および他の分子バイオマーカーアプローチで標識された足細胞は、タンパク質間相互作用および特定の分子変化の影響を直接監視および定量するためのより高い分解能を提供する。
生後4週間後に表面糸球体が欠損するマウスでは、数週間の片側尿管閉塞(UUO)を使用して表面糸球体を誘導しています。この誘導モデルではベースライン研究ができないため、生理学的条件下で表面糸球体を有するミュンヘンヴィスターフレムター(MWF)ラットのUUOモデルで糸球体プロセスに対するUUOの効果を定量化しました。5週間以上のUUOモデルは、総腎形態、尿細管周囲および糸球体微小血管系、ならびに尿細管上皮の構造および機能に有意な変化を誘発した。糸球体および尿細管周囲赤血球(RBC)の流れは、おそらく糸球体および尿細管周囲毛細血管内の白血球(WBC)の付着の有意な増加により、有意に減少しました(p < 0.01)。アルブミンの糸球体ふるい係数は、未処理のMWFの0.015±0.002から5週齢のUUO MWFラットの0.045±0.05に増加しました。UUOを12週間投与すると、アルブミンの表面糸球体密度と糸球体ふるい係数(GSC)がさらに増加しました。糸球体全体でろ過された蛍光アルブミンは、近位尿細管に再吸収されませんでした。これらのデータは、UUOを使用して表面糸球体を誘導すると、正常な糸球体プロセスと疾患の変化を研究および解釈する能力が制限されることを示唆しています。
概要
糸球体プロセス、特に足細胞生物学を理解することは、50年以上の目標でした。表面糸球体を有するミュンヘンWistarラットは、生理学的および病理学的プロセスの多くの側面を理解するために、マイクロパンクチャー研究を含むこれらの研究において中心的な役割を果たしてきました1,2,3。糸球体成分を生体内に研究するための顕微鏡法の利用は、この毒性曝露を最小限に抑え、浸透深さを増加させる2光子顕微鏡法の出現まで、光毒性の影響のために制限されていました1,2。コンピュータのハードウェアとソフトウェアの急速な進歩に加えて、これにより、単一の設定で何時間もの3次元(3D)および4次元(時間)の研究が可能になりました1,4,5。
糸球体毛細血管血流の定量化、薬物に応答した血管収縮および拡張、透過性、ならびに透過性および炎症に対する電荷の影響は、研究されてきた糸球体プロセスのほんの一部です。さらに、近位尿細管のS1セグメントが識別可能であり、S1およびS2尿細管上皮の挙動の違いを定量化することができる1,4。マウスでの研究は、特にマウストランスジェニック施設の普遍的な利用可能性により、糸球体疾患プロセスの分子生物学の理解に急速な進歩をもたらしました。個々のタンパク質は、特にタンパク尿に関して、ノックアウト研究における糸球体機能障害の原因です6,7,8。しかし、糸球体イメージング研究のためのマウスモデルの利用は、研究された多数の系統において糸球体が表面から100μm以上下にあるため、制限されていました9。
これにより、研究者はマウスモデルを開発および利用し、研究可能な表面糸球体をもたらしました。最も一般的なモデルは、完全なUUO10,11,12の使用です。延長されたUUO期間の終わりに、マウス腎臓には多数の表面糸球体が存在し、研究することができ、研究されている13,14。これらのマウス研究では、糸球体生物学に対する長期UUOの影響を決定するためのベースラインまたは対照研究はありませんでした。.これは急速な線維症と皮質破壊をもたらす重度で長期にわたる損傷モデルであるため10,11,12、糸球体のプロセスと機能に影響を与えると仮定しました。この質問に答えるために、表面糸球体を有するミュンヘンウィスターフロムター(MWF)ラットを使用して対照/ベースラインパラメータを研究し、ベースライン所見を5週間のUUO後のMWFラットの糸球体研究と比較しました。また、UUO後に表面糸球体を持たないSprague Dawley(SD)ラットについても研究しました。この知見は、MWFラットとSDラットのUUOを5週間投与すると、実際に表面糸球体の数が増加することを示している。しかし、これらは糸球体の血流、炎症、および高分子の透過性とサイズに著しい変化を伴う異常な糸球体でした。
プロトコル
すべての実験は実験動物の世話と使用のためのガイドに従い、インディアナ大学医学部の動物管理と使用委員会によって承認されました。
1.UUO手術のためのミュンヘンウィスターフレムターまたはSDラットの準備
- イソフルオラン(5%誘導、1.5〜2.5%維持)を使用してラットを麻酔し、次に、ヨウ素ベースまたはクロルヘキシジンベースのスクラブとアルコールの両方で円を描くように手術領域を数回剃毛、洗浄、消毒します。疼痛管理のために長時間作用型/徐放性鎮痛剤を適用する 施設のIACUCガイドラインに従って。
- メスを使用して正中線に沿って切開します。左腎臓を見つけて、周囲の腹膜器官から解放します。
- 腎動脈、腎静脈、尿管で構成される腎茎を注意深く見つけます。尿管を他の構造から分離し、繊細な構造を損傷しないように注意してください。
- 細かい鉗子を使用して、尿管の周りに3-0縫合糸を慎重にループさせ、引き裂かないように注意しながら結びます。この手順を最初の結び目の両側で数ミリメートル繰り返して、2番目の結び目を結び、完全な障害物を確保します。
- 手順が完了したら、連続する筋肉層を慎重に閉じます。最後の層を閉じる前に、完全に閉じる前に、2 mLの温かい滅菌0.9%生理食塩水を腹部に追加します。外科用ステープルで外皮を閉じます。
- 疼痛管理のために長時間作用型/徐放性鎮痛剤を適用し、施設内のIACUCガイドラインに従って回復を注意深く観察します。.その後定期的に監視し、5週目の終わりにイメージングの準備をします。
2. テキサスレッドラット血清アルブミン(TR-RSA)の合成
- ラット血清アルブミン100 mgを計量し、pH 8.4の0.1 M重炭酸ナトリウムバッファー6.67 mLに50 mLのコニカルチューブに溶解します。.
- 5 mgのテキサスレッド-X-スクシンイミジルエステルのバイアルに、100 μLのジメチルホルムアミド(DMF、高品質)を加え、すべての色素が溶解するまでボルテックスします。
- ラット血清アルブミン溶液を低/中程度の設定のボルテクサーに置き、溶液量が開いたチューブの上部よりかなり下で回転するようにします。
- チューブがボルテックスされている間に溶解した染料を追加します。
- 50 mLのコニカルチューブを取り、ホイルで包み、チューブをロッカーまたはローラーに置き、室温(RT)で1時間ゆっくりと攪拌します。
- 0.9%NaClの5Lバケットに、穏やかな攪拌下で攪拌バーを付け、適切な50 kDa分子量カットオフ透析器のメンブレンを濡らします(クリップ付きのメンブレン、密閉されたメンブレンチューブ、または透析カセットがすべて適しています)。
- TR-RSA溶液を膜システムにロードし、システムに通常含まれている浮選アタッチメントに取り付けます。5 L容器に0.9%生理食塩水/TR-RSAを入れ、攪拌プレート上で穏やかに攪拌しながら4°C(冷蔵室内)で一晩置きます。次の36時間で透析溶液を少なくとも3回交換します。
- 膜が膨潤すると、現在透明なTR-RSA溶液の体積が増加します。元の100 mgを体積で割っておおよその濃度を得る:色素:タンパク質の比率は1:1になります。適切な容量に分注し、長期保存のために凍結乾燥します。
3. 倒立顕微鏡による2光子生体内イメージングの準備
- 50 mmのカバーガラス底皿(カバーガラス直径40 mm)のカバーを取り外し、端に沿って内側の底に8枚のオートクレーブテープを置きます。片面4個を使用してピラミッド型の空の窓を作り、オートクレーブテープとの周辺との接触を維持しながら、外装された腎臓がこのスペースにぴったりと収まるようにすることで、動きを最小限に抑えることができます。ラットのサイズに応じて間隔を調整して、腎臓との最良の接触を確保します。
- 50mmのカバーガラスボトムディッシュの両側に1つのサーマルパッドを置きます。ウォーミングパッドがステージを覆っていることを確認してください。
- 0.75倍ズームと1.5倍ズームで40倍の水浸対物レンズを使用して、それぞれ30倍と60倍の画像を生成し、低倍率と高倍率の画像を可能にします。必要に応じて、チューブに水滴が吸い付くのを防ぐために、下向きの角度で対物レンズの上部に到達できるPE-200チューブの長い部分を備えた1 mLシリンジを使用して対物レンズに水を追加します。
- 2%のレーザー透過率を使用し、青、緑、赤の検出器を所定のレベルに設定して、研究間の画像の一貫性を確保します。参照レーザーの励起波長を800 nmに設定すると( 材料の表を参照)、この研究で使用されるすべての蛍光色素を効率的に励起します。
- 外部(スキャン解除されていない)検出器を使用して、光電子増倍管(PMT)(420-490 nm、ゲイン950)を使用して青色発光を収集します。
- Hyd検出器を使用して、グリーンエミッション(500〜550 nm、ゲイン100)をキャプチャします。
- Hyd検出器を使用して、赤色発光(590〜660 nm、ゲイン200)をキャプチャします。
- PMT(青色放射)のオフセットを調整して、組織の空白領域の数ピクセルのみがゼロになるようにします。
注意: 緑と赤の放射用のHyD検出器には、自動オフセット調整機能があります。ゲインのみ設定できます。 - ビット深度を 12 ビットに設定して、画像に白黒の間で 4,096 の強度のスケールを与えます。
注意: ボーマンの空間内で低強度の放射を確実に収集するために、検出器の下限(PMTでのオフセット)をこれらの値を除外しないように設定する必要があります。感度設定が低すぎる場合は、視覚的な警告マーカーがこれを示します。これらの値には、強度値 0 が与えられます。
- 約6 mgのTexas-Red-X-Rat 血清アルブミンを総容量 1 mL に希釈し、溶液を 1 mL シリンジにロードし、ステップ 9.1 で Hoechst 33342 を注入した後、ステップ 4.1 で留置 i.v カテーテルに置きます。.
4. 生体内2光子イメージングのための外科的準備
- 事前に麻酔をかけたラットを、静脈アクセスライン(大腿骨または頸静脈)を横にして、剃毛した左脇腹をテーブル上で平らにまっすぐに向けます。後足と同様に、前足が互いに接触していることを確認してください。
- 肋骨のすぐ下の左脇腹をそっと触診して、腎臓が腹部の自然な位置を決定するのを感じます。必要に応じて、剃った領域に沿って永久マーカーを使用して線を引き、腎臓の中心を鼻から尾の方向に二等分します。
- 一対の歯付き鉗子を使用して、皮膚をつかんで上に持ち上げ、一対の止血剤で永久マーカーラインをつまんで下にある血管系を押しつぶし、外科用ハサミで切開する際の出血を防ぎます。出血を最小限に抑えるために、薄い外側の筋肉層に対してこれを繰り返します。
- 薄い内腹部の筋肉層を最終的に切開するには、腎臓を触診してサイズと位置を推定します。一対の鉗子で内側の筋肉層を注意深く持ち上げ、腎臓の推定サイズの約1/3の止血剤で腎臓の上の皮膚を二等分する線を押しつぶします。
- 鉗子で筋肉層のグリップを維持し、最後の切開を行います。
注:縫合糸で部分的に閉じる必要がある大きくなりすぎるよりも、切開を小さくし、必要に応じて拡張する方が良いです。 - 周囲の脂肪で腎臓をそっとつかみます。両手に鉗子を付けた両手を使用して、ハンドオーバーハンド技術を使用して腎臓の脂肪をつかんで保持し、下向きに作業することにより、腎臓の下極の脂肪をつかむように働きます。
- 片手で腎臓の下極の脂肪をしっかりと握り、脂肪をそっと引っ張り、必要に応じて、切開部から腎臓を非常に穏やかに絞ります。腎臓が通過しにくい場合は、切開を広げてください。
5.イメージングのためのラットの位置決め
- 露出した腎臓を皿の端に慎重に置き、腎臓の腹側がカバーガラスに接触し、背側が端から反対側を向くようにわずかに回転させます。
- 動きをさらに最小限に抑えるには、2つの滅菌2 x 2ガーゼパッドを取り、生理食塩水で湿らせ、腎臓の背側に詰めて、腎臓の腹部と端との接触を強化します。
- デュアルパスローダミン/FITCキューブを使用して、落射蛍光照明下で顕微鏡接眼レンズを通して見ます。動きが検出された場合は、位置を微調整し、ガーゼを慎重に調整して、腎臓の下に押し込まないようにします。動きをさらに減らすには、ラットを少し転がして、胸部が皿からさらに離れるようにします。
6. 定量分析のための画像取得
- 落射蛍光照明を使用して腎臓の表面をスキャンし(ステップ5.3)、電動ステージコントローラーに関連するソフトウェア(最新のシステムの特徴)を使用して糸球体の位置をマークします。
- 2光子照明下の各カラーチャネルについて、背景画像として機能する各マークされた糸球体の上部の浅い3Dボリュームを取ります。イメージングソフトウェア の表示 オプションで擬似カラーパレットを使用して、糸球体毛細血管ループの背景蛍光のかすかな強度をよりよく視覚化します。
- 表在血管を焦点として、蛍光アルブミンをゆっくりと注入し、全身分布による蛍光の上昇と下降を観察する時間を与えます。十分なTR-RSAを注入して、尿細管周囲血管系および毛細血管ループの飽和度をわずかに下回る強度を達成します。
注:腎灌流が正常な場合、通常、材料の注入から血流に現れるまでに5秒の遅延があります。 - ステップ6.2でマークおよび画像化されたすべての糸球体の3Dボリューム(1μm間隔)を取得する前に、約10分待ちます。
注:シモンセンのミュンヘンウィスターラットは表面糸球体が少ないです。しかし、MWラットのFrömter系統は表面糸球体の数が多いため、最大10個の糸球体を画像化できることがよくあります。 - 研究の終わりにイソフルランの過剰摂取を介してラットを安楽死させる。安楽死を確実にするために二重気胸切除術を行います。
7.糸球体透過性の計算
- 顕微鏡システムに関連付けられた画像表示ソフトウェアを使用して、画像を12ビットのRAW画像にエクスポートして、処理と分析を行います。
- バックグラウンド3Dボリュームと、循環蛍光アルブミンを含む生の3Dボリュームをロードします。糸球体内の最も明るい表面毛細管ループがあり、周囲のボーマンのカプセルの端に十分なスペースがある3Dボリュームで焦点面を見つけます。
- 視覚的なランドマークを使用して、背景ボリュームにあるのと同じ焦点面を見つけます。キャピラリーループ内の領域とボーマン空間内の領域を選択し、それぞれの平均強度値に注意してください。これらの強度値を背景値として使用します。
- アルブミン含有画像のボーマン空間内の領域(少なくとも20 x 20ピクセルの領域)の輪郭を描き、強度の読み取り値をメモします(ボウマンの空間強度の最もクリーンな測定を保証するために、毛細管ループまたはボーマンのカプセルに隣接していない領域を選択してください)。描画された領域を他の 2 つの領域に移動して、ボーマン空間内の平均強度の平均値を取得します。
- キャピラリーループセクション内で最も明るいプラズマ蛍光強度を選択し、この領域を円で囲みます。 しきい値 機能を使用して、明るい値(通常は毛細管ループ壁の端にあります)を強調表示し、RBCシャドウの循環を回避し、値を記録します。
注:血液内の要因は血漿蛍光レベルの過小評価を引き起こすため、最も明るい領域を選択することが重要です。 - スプレッドシートに値を入力し、式(1)を使用してGSCを計算します。
GSC = (1)
(1)
8. ラインスキャン機能を用いた表面糸球体毛細血管ループと腎血管系における赤血球流量の計算
- 適切な血管(毛細血管ループまたは管周囲血管)を見つけます。参照される画像取得ソフトウェア(材料表を参照)のラインスキャン機能では、容器が垂直である必要があるため、rotate機能を使用して画像を回転させます。
- 容器が回転して平らになったら、取得メニューのXT機能を選択します。4,000行をスキャンするように設定します。検査する容器を横切って線を置きます。焦点面が画像化するセグメントの最大直径にあることを確認します。
- カラー合成画像を左クリックし、[ スナップショットを撮る] を選択して、ラインスキャンが撮影された領域の参照画像を生成します。すぐに[ 開始 ]ボタンをクリックして、船舶のラインスキャンをキャプチャします。
- RBCの流量を決定するには、ラインスキャンを画像処理ソフトウェアにインポートします(材料の表を参照)。[メジャー]ドロップダウンメニューの下にある[リージョン統計の表示]ダイアログボックスを開きます。単一線描画ツールを選択し、RBC シャドウの傾きに一致する線を描画します。幅と高さの値をメモします。
注:幅に対して取得されたピクセル値は距離に対応します。高さのピクセルは時間に対応します。 - 次の式(式(2))を使用して速度を計算します。
マイクロメートル/秒単位の赤血球流量 =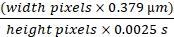 (2)
(2)
注:これは、参照された顕微鏡での60倍の倍率と400Hzのスキャンレートでの取得パラメータに対応します( 材料の表を参照)。- 少なくとも 5 回の計算を行い、それらを平均して、各ラインスキャンの速度を報告します。
注:これらのパラメータは、顕微鏡システムのピクセル寸法と取得速度に依存します。
- 少なくとも 5 回の計算を行い、それらを平均して、各ラインスキャンの速度を報告します。
9. 糸球体毛細血管ループにおけるWBC閉塞の計算
- Hoechst 33342核染色剤(ラット体重~8 μg/kg)を留置静脈アクセスラインを介して投与し、毛細血管ループに留まっている白血球を特定します。
注:使用可能な深さは、特に短波長の青色発光の場合、光子散乱とヘモグロビンによる吸収のために制限されます。 - 糸球体をイメージングフィールドの中心に配置し、糸球体表面から始まる3Dデータセットを取得し、データを少なくとも30〜35μmで終了します。Z方向に1μmのステップサイズを使用します。
- 青いヘキストチャネルとテキサスレッドアルブミンチャネルを比較することにより、WBCを特定します。毛細血管ループ内の赤色色素の除外と対応する核染色を探して、WBCを確実に識別します。 白血球が3つの光学切片にわたって静止しているように見える場合は、白血球を「接着」として定義します。糸球体の上部から1μm間隔で撮影したオカレンス/10個の光学切片として値を報告します。
10.表面糸球体におけるルーロー形成の存在をスコアリングする
- 手順 9.3 と同じ手順に従って、3D データ セットを取得します。毛細管ループに沿って移動するにつれて解離に抵抗するパケットに積み重ねられたRBCとして現れるルーローフォーメーションを探します。赤色蛍光色素を使用すると、より長い波長の赤色発光の光子散乱が少ないため、より深い深さで構造をよりよく視覚化できます。糸球体の上部から1μm間隔で撮影したオカレンス/25個の光学切片として値を報告します。
11.糸球体の分離
- 標準的なふるい分け技術を使用して、新鮮な腎臓から糸球体の3つのグループを分離し、90%近くの純度のラット糸球体をもたらします15。
- 腎臓皮質を冷たいリン酸緩衝生理食塩水(PBS)に入れ、複数の細かいはさみまたはかみそりの刃を使用して細かく刻みます。
- ミンチ組織を100 μmの滅菌セルストレーナーに加え、5 mLシリンジプランジャーと50〜100 mLのコールドPBSを使用してゆっくりと押し込みます。
注:糸球体が通過している間、ほとんどの尿細管は保持されます。 - 濃縮糸球体画分を70 μmのフィルターに置き、冷たいPBSで広範囲に洗浄します。100〜200 mLの冷たいPBSでフィルターを洗浄して、残りの細管のほとんどを取り除きます。
- 1〜2 mLのコールドPBSを使用してフィルターから糸球体を収集し、遠心分離機(10,000 × g、2分、4°C)し、RNAが分離されるまで液体窒素でスナップフリーズします。
注:位相差顕微鏡で測定された糸球体の純度は>90%であり、収量は2つの腎臓から約10mgです。
12. 糸球体RNA単離
- RNA単離試薬を使用して凍結糸球体ペレットをホモジナイズし、400 μLの試薬を添加し、200 μLのピペットチップを使用してペレットを分割した後、RT16で短時間ボルテックスと5分間インキュベートします。
- 40 μLの1-ブロモ-3-クロロプロパン(BCP)を加え、15秒間ボルテックスし、RTで15分間保持します。
- 12,000 × g、15分、4°Cで遠心分離します。 水層を取り除き、下層を等量の70%エタノールで希釈し、スピンカラムに直接ロードします( 材料の表を参照)。
- 洗浄後、それぞれをカラムに添加し、続いて12,000 x g、15秒、26°Cで遠心分離することからなる[合計3、最初の2つは500 μLのRPE(塩の痕跡を除去するためのエタノールによる独自の穏やかな洗浄バッファー、500 μLの80%EtOHで3回目の洗浄]、15 μLのH2 を添加してRNAを溶出するOと遠心分離機、洗浄に関しては。RNAの濃度と純度を確認し、RNAサンプルをナノストリング分析用のコア施設に輸送します17,18。
注:総RNA収量は約1〜2μgです。ここでは、24個のサンプルに30 ng/μLで200 ngのRNAが含まれていました。
13. ナノストリング解析
注:ナノストリング技術は、色分けされたプローブペアを利用する標的分子のデジタル検出と直接分子バーコードに基づいています。キャプチャプローブは3'末端にビオチン部分を運び、レポータープローブは5'末端に信号を運びます。
- NanoString遺伝子プローブペアとコードセットをミシガン州立大学のゲノムコア施設に発送し、NanoStringの指示に従って使用します。
注:カラーコードには6つの位置があり、各位置は4色のいずれかにすることができ、データ収集中にそれぞれを個別に解決および識別できる多種多様なタグを可能にします。 - 顕微鏡対物レンズとCCDカメラを使用して視野を収集し、バーコードカウントを集計して表示する独自のナノストリングnCounterデジタルアナライザを使用して、ゲノムコア施設のスタッフが収集したデータを取得します。
- 生データをナノストリングのnSolverソフトウェアにインポートして分析します。デフォルト設定を使用して正規化されたデータを正規化し、マニュアルで説明されているようにグループ間でデータを比較します。
注:目的は、UUOモデル19、腎臓病17、20、21、22、23、24、25、26から皮質組織で変化することが以前に示された遺伝子変化を監視することでした。推奨される陽性対照および陰性対照を含む合計126の遺伝子を、各糸球体群(CONT、SHAM、UUO)で分析した。
結果
糸球体の3つの群を、ラット糸球体の純度が90%に近い標準的なふるい分け技術を用いて単離した15。最初の糸球体群は、左腎尿管クランプを5週間受けたSDラットの左腎臓、UUO(雄5名、雌3例)であった。第2の糸球体群は、同じラット、CONT(雄5名、雌3名)からの対側対照腎臓から単離された。糸球体の第3群はSHAM手術を受けたSDラットから単離し、左腎臓は5週間後の糸球体単離に用いた(雄4名、雌4名)。
形態学的変化
画像診断のために閉塞した腎臓の外在化により、通常の約4倍の大きく肥大した腎臓が明らかになり、液体で満たされた腎臓内部から薄い上皮が見えました。落射蛍光照明とFITC/ローダミンデュアルパスキューブを使用した20倍の対物レンズを通じて、最も明白な変化は、管状上皮の薄化と管状全長に沿った管状内腔の均一な崩壊でした。組織像はよく説明されており、UUO10、11、12の1週間で重症です。MWFラットおよびSDラットの表面で見える糸球体の数は、片側尿管閉塞の5週間後に増加しました。図 1A は、UUO モデルの作成に使用した方法を示しています。右腎臓は手つかずであり、ラットに適切な糸球体濾過率を提供します。20倍の対物レンズ(363 μm x 363 μm)を用いて野当たりの糸球体の数をカウントし、図1Bのグラフに示した。MWFラットの表面糸球体の数は、未処理ラットの1.08±0.11 /フィールドから、5週間のUUO群±2.97 0.65 /フィールドに増加しました。SDラットは、UUOの5週間後に表面糸球体を持たない状態から2.02±0.37 /野に変化しました。
TR-RSA(赤色)、10 kDaカスケードブルーデキストラン(10 kDa-CB)、およびHoechst 33342を注入した後、これらのラットの生体内2光子画像を撮影して核(シアン)を標識しました。これらは、正常なMWFラット(図1C)、UUOの5週間後のMWFラット(図1D)、およびUUOの5週間後のSDラット(図1E)について示されている。これらの画像は、管状上皮に起こる劇的な変化を強調しています。近位尿細管リソソームは、未処理のMWFおよびSDラットでは通常小さな点状のオレンジ色の蓄積物であり、収縮した管状細胞の大部分を満たす大きな特異な液胞構造になります。TR-RSAアルブミンで概説されているように、血管系はまっすぐに見え、多くの血管では流れる赤血球がなく、流れる血漿のみを示しました。腎臓の固定により、皮質が薄くなり、1ミリメートル以下の厚さの繊維状の皮膚になっていることが明らかになりました。これらの観察結果は、このモデルを使用した初期の文献と一致しています3,10,11,12。
腎血管動態と糸球体透過性の変化
腎血流は、未治療ラットと比較して、5週間のUUO MWF群とSD群の両方で有意に減少しました(図2)。偽手術MWFラットの尿細管周囲RBC流速は885 ± 25 μm/sでした。5週間のUUO MWFラットおよびSDラットの尿細管周囲赤血球流量は、それぞれ250 ± 100 μm / sおよび200 ± 125 μm / sに減少しました。これらの値は、RBC速度を計算するために尿細管周囲血管全体のラインスキャンを収集することによって計算されました。 図 2D に、これらのデータのグラフを示します。
糸球体毛細血管ループ内のRBC速度は、未処理のMWFと比較して、5週間のUUO MWFおよびSDラットで有意に低下しました(図3)。多くの場合、糸球体は流れる赤血球を全く欠く毛細血管ループを有することが判明した。 毛細管ループ赤血球の流量は、それぞれ1,405 ± 425 μm/s、250 ± 220 μm/s ±、および190 ± 200 μm/sまたは未処理のMWF、5週間のUUO MWF、および5週間のUUO SDラットであった(図3D)。5週間のUUOグループの毛細血管ループ内では、赤血球の流れが遅いため、流れを遅くするか遮断するかのいずれかで、付着性白血球の存在が明らかになり、部分的または全体的な閉塞の下流で血漿流のみが視覚化されました。この観察を定量化するために、3Dボリュームで見つかった付着性WBCの数をカウントし、3Dボリュームの深さ10μmごとに発生するように正規化しました。接着した白血球の構造は、Hoechst 33342からのシアン核色素蛍光を使用して識別できました。残念ながら、青色発光光の光子散乱が大きいため、糸球体体積の1μmステップで撮影された、上から上位10の光学切片への核によるWBCの信頼性の高い識別が制限されていました。未処理のMWFラットは、1μmステップの体積で撮影した、上から0.125±0.05WBCs/10個の光学切片未満でしたが、この数は5週間のUUO MWFラットと5週間のUUO SDラットでそれぞれ0.5±3.25±0.7に増加しました(図3E)。
5週間のUUOグループにおける赤血球流量の減少も説明できる別の血管の変化は、ルーロー形成(「スタックコイン」構成で接着されているグループ化されたRBC、 図3Fの挿入図を参照)の定期的な出現でした。ルーローフォーメーションはよりゆっくりと流れ、付着したWBCによって止めることができます。未処理のWMFラットは、糸球体毛細血管に実質的にルーロー形成がなく、1μmステップで撮影した上から25の光学切片あたり0.05±0.05の発生しかありません。5週間のUUO MWFラットとSDラットでは、1μmステップで撮影したところ、上から25の光学切片あたり2.27±0.46と1.46±0.73が顕著に増加しました(図3F)。
UUOで見られる糸球体RBC流量の減少に加えて、アルブミン透過性の増加が見られました。糸球体間のアルブミン透過性にはより大きな不均一性があった。時折、ボーマン空間内のアルブミン蓄積は、はっきりと見えるほど強烈でした(図4B、アスタリスク)。アルブミンの糸球体ふるい係数は、未処理のMWFでは0.015±0.002に増加し、5週間のUUO MWFでは0.045±0.05、5週間のUUO SDラットでは0.052±0.075に増加した。
近位尿細管機能の変化
興味深いことに、ろ過されたアルブミンは、UUO後の近位尿細管細胞では検出できませんでした。S1セグメントは通常、未処置のMWFラットの生理学的条件下でここに示すように、大量のアルブミン27、28、29、30をエンドサイトーゼします(図5A)。これと同じ取り込みは、UUOの5週間後のMWFまたはSD PTでは見られませんでした(図5B、C)。TR-RSA注入後45〜60分の間に画像化された糸球体周囲の近位尿細管は、アルブミンの存在(1)または不在(0)のいずれかについてスコアリングされました。生理学的条件下では、S1セグメントはアルブミンに熱心に結合して内在化し、アルブミンはほとんどまたはまったく遠位尿細管に到達したり、管を集めたりしないことに注意することが重要です。したがって、後者の近位尿細管セグメントにアルブミンが含まれていない可能性があり、その結果、アルブミン取り込みの分数陽性が1.0未満になるのは当然のことです。図5Dは、近位尿細管アルブミン取り込みのスコアリングからの結果をグラフに示す。未処理のMWFは、0.556±0.126の近位尿細管分数取り込み値を有していた。5週間のUUO MWFラットとSDラットはどちらも、それぞれ0.049±0.126および0.00 ±0.00と有意に低い値を示した。
研究は、12週間のUUO MWFラットでも完了しました(表1)。12週間のUUOは、表面糸球体を誘導するためのマウス研究に使用される標準時間です。3匹のUUO雄ラットを画像化し、糸球体密度はさらに増加し、これらのラットでは20倍野あたり6.16±1.83糸球体になりました。RBCの流速は293 ± 67 μm/s、WBCの接着は1.47 ± 1.12であり、いずれも5週間のUUOデータと同様であった。アルブミンのGSCも5週間UUOラットと比較して0.109±0.04に増加した。
慢性UUOによって誘発される糸球体mRNAの変化
表2 は、すべての遺伝子(プローブ)を、それらのグループ化された発現および標準偏差値と共に示す。注、遺伝子は、プロトコルセクション13のノートに記載されているUUOを含む、腎臓病の変化に関する以前の文書に基づいて分析のために選択されました。 図6 は、対照糸球体または偽糸球体と比較したUUO糸球体のほとんどの遺伝子の遺伝子発現の劇的な変化を強調するデータのヒートマップです。
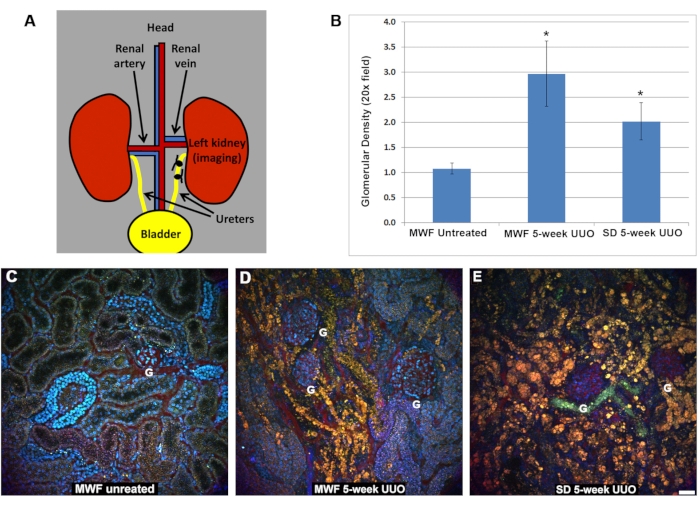
図1:MWFラットにおける5週間のUUO後のSDラットにおける表面糸球体数の増加と表面糸球体の誘導 。 (A)左腎臓の尿管を腎動脈と静脈から慎重に解放してから、外科用縫合糸を使用して2つのネクタイで閉塞させた手術図。(B)UUO前およびUUO後5週間のMWFラットに存在する表面糸球体の数の増加と、通常は表面糸球体を持たないSDラットの表面糸球体の数を示すグラフ。MWFラットの表面糸球体の数は、未治療ラットの1.08±0.11 /フィールドから、5週間UUO群の2.97±0.65 /フィールドに増加しました。SDラットは、表面糸球体を持たない状態から2.02 ± 0.37/野になりました。3次元再構成画像は、未治療のMWF(C)、5週間UUO後のMWF(D)、および5週間後のUUO(E)の腎表面を示しています。小さな個々のリソソームから大きな異常な体に合体した大きなオレンジ色の液胞構造の出現に注意してください。SDラットの5週間のUUOは、 C で見られ、部分的に Dに見られる正常な尿細管上皮に似た領域をもたらさなかった。血管系は一部の領域でまっすぐになっているように見え、多くの領域では、血漿を流すが赤血球を流すことができない部分的な閉塞がありました。(n = 1群3匹の雄ラット)スケールバー= 40μm。エラーバーは標準偏差を示します。略語:UUO =片側尿管閉塞;SD =スプレイグドーリー;MWF = ミュンヘン・ヴィスター・フレームター;G =糸球体;赤血球=赤血球。 この図の拡大版を表示するには、ここをクリックしてください。
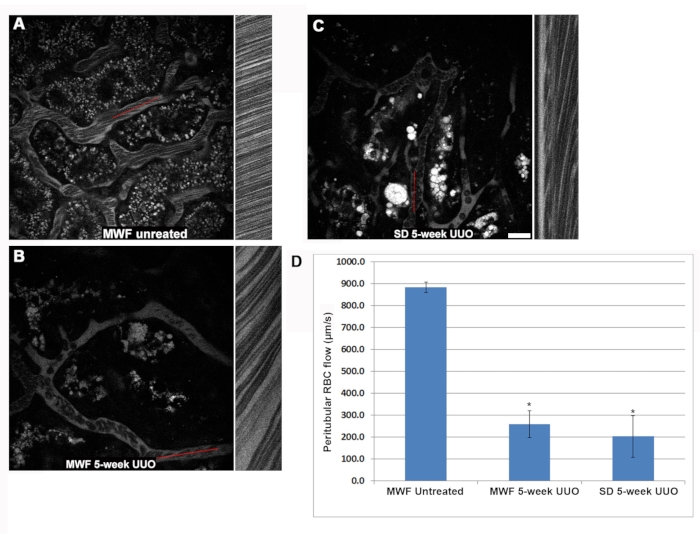
図2:5週間のUUO後の表在性尿細管周囲血管系内のRBC流量の減少。ラインスキャンを管周囲血管に集め、赤血球の流速をμm/sで決定しました。簡単に言うと、A、B、Cに示す赤い基準線は、同じピクセルの広い領域を繰り返しスキャンした小さな領域を表し、顕微鏡が取得できるよりも速く移動する流れるRBCによって引き起こされる歪みを視覚化するために列に積み重ねられた画像。参照図に隣接する列はラインスキャンで、RBC歪みの傾きを使用して速度を計算します(x軸=距離、y軸=時間)。ここでは、勾配が徐々に急勾配になるほど、ラインスキャン領域で長く残るため、RBC速度が遅くなります。MWF(B)およびSD(C)ラットの5週間UUO画像と比較した、未処理のMWFラット(A)におけるRBCの出現の違いに注意してください。3つのラット群のRBC流速をDに示す。未処理のMWFにおける尿細管周囲赤血球流量は平均885 ± μm/sであった。これらの値は、MWFラットおよびSDラットのUUOの5週間後に、それぞれ250 ± 100 μm / sおよび200 ± 125 μm / sに大幅に低下しました。スケールバー= 20μm、n = 3群の雄ラット。エラーバーは標準偏差を示します。略語:UUO =片側尿管閉塞;SD =スプレイグドーリー;MWF = ミュンヘン・ヴィスター・フレームター;RBC =赤血球;WBC =白血球。この図の拡大版を表示するには、ここをクリックしてください。
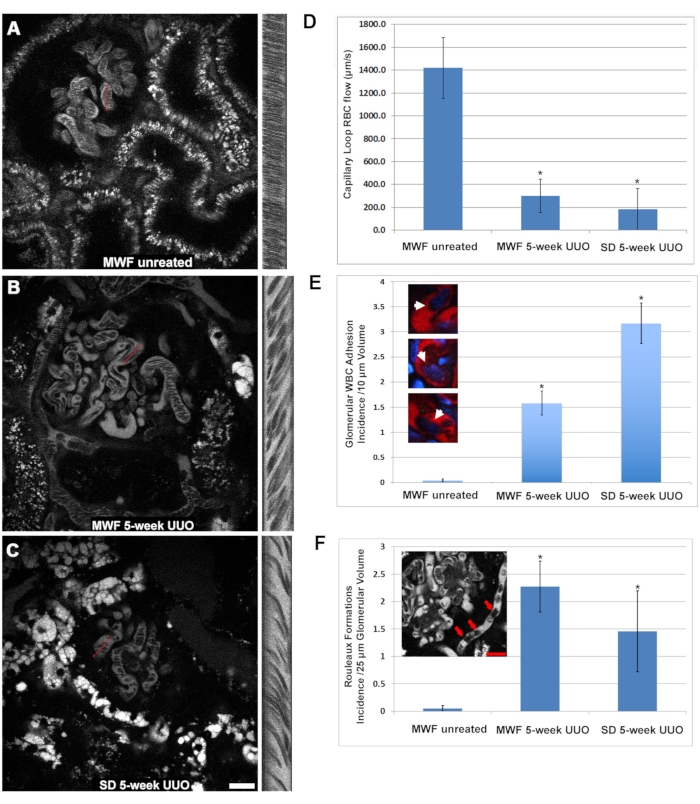
図3:糸球体毛細血管ループRBCフローの有意な減少と5週間のUUOによるWBC接着の活性化の誘導。 糸球体毛細血管血流の変化を調べるために、尿細管周囲赤血球の流れを決定するために使用されたのと同じラインスキャンアプローチが使用されました。パネル A、 B、 およびC は、 図2 と同様のレイアウトを示し、それぞれ偽操作MWF、5週間UUO MWF、および5週間UUO SDの糸球体に焦点を当てています。(D)偽手術MWFラットの毛細血管ループにおける生理学的に高いRBC流量を明らかにするグラフは、平均1,405±425 μm/s±425、5週間UUO MWFラットおよび5週間UUO SDラットでそれぞれ250 ± 220 μm/sおよび190 ± 200 μm/sに減少した。糸球体毛細血管ループを調べると、糸球体を通して集束している間、付着したWBCが容易に見えました。個々の糸球体の3次元光学切片を採取し、1μm離れた最初の10個の光学切片を使用して、付着性WBCの数を測定しました。 未処理のMWFラットは、その体積に目に見えるWBCがほとんどなく、1μmステップで撮影された上から平均0.125±0.05WBC / 10光学切片未満でした。5週間のUUO MWFおよびSDラットでは、これらの数は、1μmステップで撮影された上から0.7WBC / 10光学切片±それぞれ0.5±0.5および3.25に増加しました。これらの結果は、パネル Eのグラフに示されており、カラーインサートはWBCが毛細血管ループを閉塞していることを示しています。ルーロー層(矢印、パネル Fの挿入図)は、「スタックコイン」構成でしっかりと結合されたRBCとして表示され、血流の乱れの中でも束ねられたグループをほぼ保持します。これらの病理学的構造は、糸球体内のより深いところで容易に識別できた。偽手術MWFラットは、これらの構造をほとんど欠いておらず、糸球体体積の1μmステップで撮影された、上から25の光学切片で0.05±0.05回しか発生しませんでした。対照的に、MWFラットとSDラットの両方で5週間のUUOは、1μmステップで撮影された上からそれぞれ2.27±0.46および1.46±0.73/25光学切片の発生で、ルーロー形成の顕著な増加を示した。スケールバー= 20 μm、n = グループあたり3匹のオスラット。エラーバーは標準偏差を示します。略語:UUO =片側尿管閉塞;SD =スプレイグドーリー;MWF = ミュンヘン・ヴィスター・フレームター;RBC =赤血球;WBC =白血球。 この図の拡大版を表示するには、ここをクリックしてください。
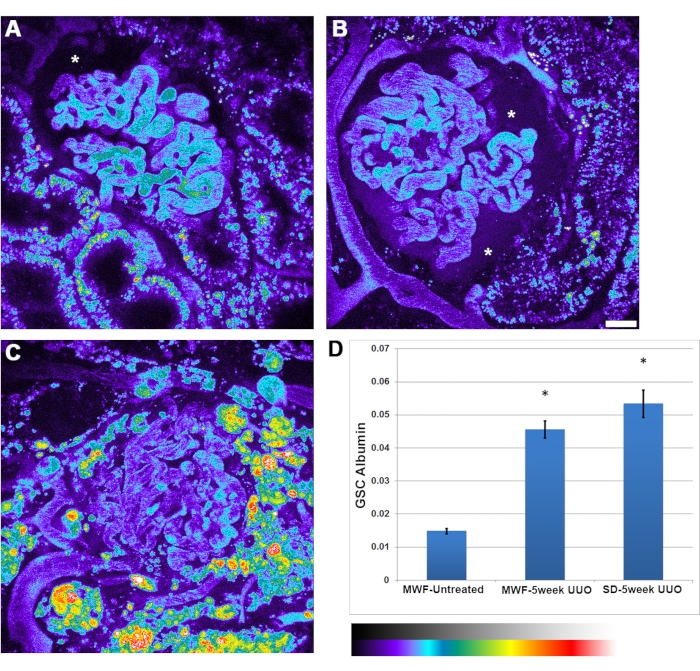
図4:5週間のUUO後の糸球体毛細血管アルブミン透過性の有意な増加。 パネル A、 B、および C は、未処理のMWF、5週間のUUO MWF、および5週間のUUO SDラットにおけるラット血清アルブミンチャネルの3Dボリュームの疑似カラー画像をそれぞれ示す。画像は疑似カラーパレットで表示され、ボーマンの空間、特にパネル B (アスタリスク)で見られるかなりの量のフィルタリングされたアルブミンを強調しています。(A)ボーマンの空間(アスタリスク)は、未治療のMWFラットに通常見られる、目には識別できない正常なレベルのアルブミンを示しています。糸球体の画像は、アルブミン投与後に撮影されたものからバックグラウンド蛍光値を差し引くために、アルブミン注入前に撮影されました。(D)未処理のMWFラットにおけるアルブミンの糸球体ふるい係数のグラフで、値は0.015±0.002です。この値は、5週間UUO MWFラットでは0.045±0.05、5週間UUO SDラットでは0.052±0.075と有意に増加した。このパラメータは、ボーマン空間の蛍光強度をプラズマ値で割った比率の値であり、関連する測定単位はありません。スケールバー= 20μm、n = 3群の雄ラット。擬似色強度スケールは、パネル Dの下にあります。エラーバーは標準偏差を示します。略語:UUO =片側尿管閉塞;SD =スプレイグドーリー;MWF = ミュンヘン・ヴィスター・フレームター;RBC =赤血球;WBC =白血球。 この図の拡大版を表示するには、ここをクリックしてください。
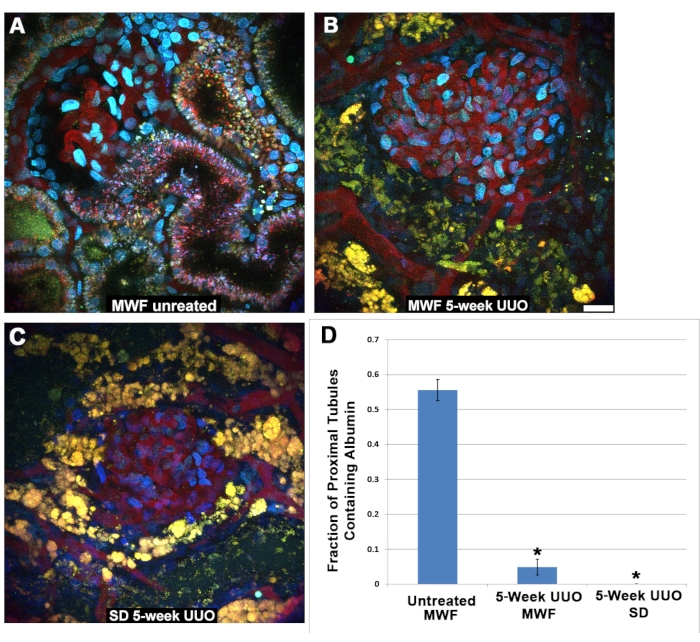
図5:5週間のUUO後の近位尿細管の機能低下。 (A)TR-RSAとカスケードブルーデキストランの注入から40分後に撮影された正常なミュンヘンウィスターフレムターラットからの表在性糸球体とS1セグメントの画像。TR-RSAの内在化は、S1セグメントと近位尿細管に見られます。対照的に、5週間のUUOを受けたMWFラット(B)およびSDラット(C)は、TR-RSAの取り込みが最小限またはまったくない、ひどく変化した近位尿細管を示します。.通常は小さく、点状の自己蛍光リソソーム(A)は、大きくて液胞の黄橙色構造になり、多くの場合、3次元データセットでは見られない管状内腔が完全に崩壊します。(C)通常はいかなる形態の自己蛍光も欠く遠位尿細管には、現在、自己蛍光蓄積が含まれています。注入後45〜60分に撮影した同様の画像で糸球体周囲の近位尿細管をスコアリングすると、アルブミン取り込みについて、偽手術MWF群と5週間UUO群の間に有意差が見られました。未処理のMWFラットは、0.556±0.126の近位尿細管分数取り込み値を有していた。5週間のUUO MWFラットとSDラットはどちらも、それぞれ0.049±0.126および0.00 ±0.00と有意に低い値を示した。スケールバー= 20μm、n = 3群あたり3匹の雄ラット。エラーバーは標準偏差を示します。略語:UUO =片側尿管閉塞;SD =スプレイグドーリー;MWF = ミュンヘン・ヴィスター・フレームター;RBC =赤血球;WBC =白血球;TR-RSA = Texas Red ラット血清アルブミン。この図の拡大版を表示するには、ここをクリックしてください。
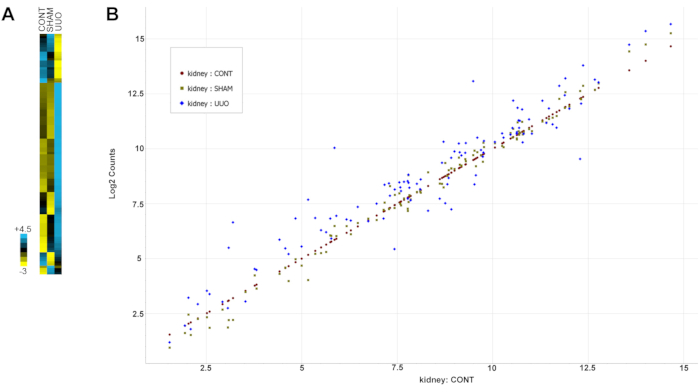
図6:UUOによる遺伝子発現の変化 。 (A)データのヒートマップ。(B)散布図のすべてのデータについて正規化された遺伝子変化。対照腎臓における遺伝子の発現を低発現から高発現までプロットし、SHAMおよびUUO腎臓の両方からの遺伝子を対照発現レベルと比較した。対照遺伝子の対角線値に近い遺伝子データポイントは、両方のグループで同様の発現レベルを示し、対角線より上または下のデータポイントは、それぞれ発現レベルが高いまたは低いことを示します。SHAM遺伝子は、より可変的なUUO遺伝子よりも対照対角発現に近いクラスターであることに注意してください。略称:UUO =片側性尿管閉塞。 この図の拡大版を表示するには、ここをクリックしてください。
表1:UUOの5週間から12週間への傷害の進行。 各時点での3匹の雄MWFラットと3匹のSD雄ラットにおける5週間および12週間のUUOイメージングパラメータの比較。5週間のデータは前の図と同じです。糸球体密度の増加と、UUOを継続したアルブミンのGSCに注意してください。略語:UUO =片側尿管閉塞;SD =スプレイグドーリー;MWF = ミュンヘン・ヴィスター・フレームター;GSC =糸球体ふるい分け係数。 この表をダウンロードするには、ここをクリックしてください。
表2:UUOおよび対照ラット由来の糸球体における炎症マーカーの分析。 遺伝子プローブペアとコードセットは、NanoStringの指示に従って設計および使用されました。100を超える遺伝子に加えて、Nanostringによって指定されたポジティブコントロールとネガティブコントロールが分析されました。グループ化された発現およびSD値を有する全ての遺伝子(プローブ)を表に示す。図 6A はデータのヒートマップであり、 図6B は散布図のすべてのデータの遺伝子変化を示しています。コントロールとSHAMの類似性、およびUUOのほとんどの遺伝子の明確な変化に注意してください。略語:UUO =片側尿管閉塞;SD =標準偏差。 この表をダウンロードするには、ここをクリックしてください。
ディスカッション
糸球体生理学の研究は、多くの異なるアプローチ、特にマイクロパンクチャーの使用、孤立した糸球体の灌流、および顕微鏡検査を見てきました。ミュンヘンWistarラット、FromterおよびSimonsen株における表面糸球体の利用可能性は、 in vivo 動的研究を可能にした。この技術を採用する研究者にとって重要な注意点の1つは、組織内の自己蛍光が一貫しているように、研究間で一貫した画像を維持するために取得パラメータを設定する必要があることです。デュアルパスフルオレセイン/ローダミン落射蛍光キューブを利用し、ゲイン設定を緑と赤の発光チャンネルに調整して、接眼レンズを通して見られるものをコンピューター画面上で模倣することで、異なる顕微鏡システム間でも自家蛍光で一貫したカラーシグネチャが保証されます。
Fromter株は、総糸球体数が減少し、~75%正常であり、男性は12週齢頃に高血圧を自発的に発症し、進行性のタンパク尿とそれに続く限局性糸球体硬化症を伴い、最終的には腎不全で死亡するため、広く使用されています12。これらのラットの使用と、光毒性の低減、浸透深度の改善、および複数の蛍光プローブを同時に観察できる2光子顕微鏡の追加により、新しい発見への道が開かれました1,4,5。コンピュータのハードウェアとソフトウェアの開発により、定量データは現在、すべての2光子実験室の標準となっています。複数の定量的手法が開発され、生理学的および疾患条件下での糸球体、近位尿細管、血管、および間質プロセスに適用されています1、4、5、27、28、29、30。
トランスジェニックマウス生成施設は、腎臓の生理学と病理学の研究に新しい次元を追加し、これが2光子顕微鏡と組み合わされて、腎臓の構造と機能における特定の遺伝子産物の重要性をさらに明らかにするのは時間の問題でした。しかし、マウス糸球体は、非常に若いマウスを除いて、腎臓の表面から100μm以上に位置しています9。二光子顕微鏡は、分解能として20〜50μmの深さで行うのが最適であり、その後、放出された光の光散乱とヘモグロビンとの相互作用からの吸収により、蛍光強度が急速に減少します。そのため、表面糸球体を誘導する必要があった。一般的に使用されるアプローチは、12週間の長期の片側閉塞モデルです。これらのモデルではベースラインの決定ができないため、UUOの効果を調査中のプロセスから分離することはできません。
MWFラットを使用して、ベースライン糸球体機能を次のUUOと比較することができます。このUUOモデルは、炎症と急速な線維症を誘発することが知られており、CKDと線維症の研究に使用されています10、11、12。予想通り、MWFラットとSDラットの両方で表面糸球体が増加しました。さらに、MWFラットとSDラットについてUUO後に得られた定量結果は非常に同等でした。ここで記録された血流の減少は、UUO後の顕微鏡データと微小穿刺データ3を比較して以前に報告されていました。また、尿細管組織像と間質組織像が著しく変化し、PTはほとんど機能せず、ここで報告されているように、アルブミンエンドサイトーシスが不足していることもよく知られていました。図2および図3の研究は、糸球体および尿細管周囲毛細血管における赤血球体流量の劇的な減少とWBC接着の増強を示しています。流量の減少は、WBC接着およびルーロー形成による毛細管閉塞による可能性が高い。
炎症をさらに評価するために、アルブミン透過性を定量化し、10倍に増加することを示しました。さらに、単離された糸球体は、さまざまな腎臓病状態における腎臓炎症で増加することが以前に知られている多くの遺伝子のmRNA発現が増加したことを示しました17、19、20、21、22、23、24、25、26.糸球体表面密度とアルブミン透過性の増加は、12週間のUUOデータによって示されるように、進行性であった。本データは、糸球体がUUOモデルにおいて著しい構造的損傷、炎症、および分子変化を受けることを直接示した最初のデータである。結果は、UUO後の羊腎臓生検を分析した腎臓組織全体の以前の研究と一致しており、複数の炎症マーカーが上昇していることを発見しました19。本結果は、以前は皮質組織についてのみ知られていた糸球体内に顕著な炎症が存在することを示している。
現在のデータは、12週間後のヒドロネフローゼと正常な糸球体の間で接着分子発現、補体沈着、および好中球浸潤に変化が見られなかったマウスでの以前の研究とは異なります31。さらに、ヒッキー研究所は、マウスの糸球体における免疫反応を研究するために12週間のUUOモデルを使用しました。彼らは、4週齢のマウス糸球体と閉塞後糸球体の間で好中球の浸潤に違いは見られませんでした32,33。これらの後の研究は、閉塞した腎臓の骨盤から尿が排出された後に実施されました。閉塞の原因となる体液を人工的に除去することなく、生体内の糸球体機能に対するUUOの効果を決定したかったため、これを行いませんでした。最後に、マウスでのUUOの使用は、表面下100μmを超える糸球体のイメージングに置き換えられています。可能ですが、分解能と強度のトレードオフがあり、50 μm34を超えるとどちらも大幅に低下します。
提示された結果は、組織学的変化、管状糸球体の形成、炎症、線維症、血行動態に関する既存の文献からのデータを1つまとめても驚くべきことではありません10,11,12。WBC接着、ルーロー形成、糸球体分子炎症マーカー、アルブミン透過性の増加など、提示されたデータは、このUUOモデルで5週間でも進行中であり、12週間でも存在する広範な炎症をさらに示しています。明らかに、慢性UUOは生理学的状態ではなく、表面糸球体を誘導するためのUUOの使用は傷害モデルを表しています。生理学的条件下で表面糸球体を有するMWFラットは、損傷が発生するにつれて縦断的に研究することができる。トランスジェニックラットを生成することは可能であり、多くの研究者が特定の質問をするためにバイオセンサーを使用してそれらを作成しています。特に、ウィスコンシン医科大学は現在、MWFラットのコロニーを持っており、生理学的および病理学的条件下で糸球体プロセスを研究する目的でトランスジェニックラットを製造しています。これらのMWFラットは、正常、罹患、および遺伝子組み換えラットの糸球体プロセスを研究する絶好の機会を提供します。
開示事項
著者には利益相反はありません。
謝辞
この研究は、国立糖尿病・消化器・腎臓病研究所助成金RO1DK091623およびP30DK079312(BAMへ)の支援を受けました。ナノストリング分析を実施してくれたミシガン州立大学の研究技術支援施設(RTSF)のゲノミクスコアファシリティのスタッフに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 70 µm sterile cell strainer | Corning | #421751 | |
| 100 µm sterile cell strainer | Corning | #421752 | |
| CA Micro scissors Model 1C300 | Electron Microscopy Sciences | Cat# 72930 | |
| Electric heating pad | Sunbeam | Kroger | |
| Handling Forceps | Electron Microscopy Sciences | Cat# 72962 | |
| Kelly Hemostatic Forceps (straight) | Electron Microscopy Sciences | Cat#72930 | |
| Leica Dive SP-8 Multi-Photon Inverted Microscope | Leica Microsystems | Note: Version 7.1r1 | |
| MaiTai DeepSee titanium-sapphire laser | Spectra-Physics | NA | |
| Mayo Dissecting Scissors | Electron Microscopy Sciences | Cat# 78180-1C3 | |
| Metamorph Image processing Software | Molecular Dynamics | Cat# 78266-04 | |
| Microsoft Excel | Microsoft Corportation | 2007 version | |
| Quant-iT RNA Assay Kit | Invitrogen/ThermoFisher | Q33140 | |
| Reptitherm Undertank Heater | Zoomed | Amazon | |
| RNeasy MinElute Cleanup Kit (Spin columns) | Qiagen | 74204 | |
| RPE buffer | Qiagen | 1018013 | |
| Strate-Line Autoclave Tape | Fisher Scientific | Cat# 11-889-1 | |
| TRI Reagent | Sigma | T9424 | |
| Willco-dish Coverslip Bottom Dishes (50 mm/40 mm coverslip) | Electron Microscopy Sciences | Cat# 70665-07 |
参考文献
- Dunn, K. W., Molitoris, B. A., Dagher, P. C. The Indiana O'Brien center for advanced renal microscopic analysis. American Journal of Physiology-Renal Physiology. 320 (5), 671-682 (2021).
- Dunn, K. W., et al. Functional studies of the kidney of living animals using multicolor two-photon microscopy. American Journal of Physiology-Cell Physiology. 283 (3), 905-916 (2002).
- Eisenbach, G., Liew, J., Boylan, J., Manz, N., Muir, P. Effect of angiotensin on the filtration of protein in the rat kidney: a micropuncture study. Kidney International. 8 (2), 80-87 (1975).
- Sandoval, R. M., Molitoris, B. A. Intravital multiphoton microscopy as a tool for studying renal physiology and pathophysiology. Methods. 128, 20-32 (2017).
- Sandoval, R. M., Molitoris, B. A., Palygin, O. Fluorescent imaging and microscopy for dynamic processes in rats. Methods in Molecular Biology. 2018, 151-175 (2019).
- Huber, T., et al. Molecular basis of the functional podocin-nephrin complex: mutations in the NPHS2 gene disrupt nephrin targeting to lipid raft microdomains. Human Molecular Genetics. 12 (24), 3397-3405 (2003).
- Kawachi, H., Koike, H., Kurihara, H., Sakai, T., Shimizu, F. Cloning of rat homologue of podocin: expression in proteinuric states and in developing glomeruli. Journal of the American Society of Nephrology JASN. 14 (1), 46-56 (2003).
- Roselli, S., et al. Early glomerular filtration defect and severe renal disease in podocin-deficient mice. Molecular and Cellular Biology. 24 (2), 550-560 (2004).
- Schießl, I., Bardehle, S., Castrop, H. Superficial nephrons in BALB/c and C57BL/6 mice facilitate in vivo multiphoton microscopy of the kidney. PloS One. 8 (1), 52499 (2013).
- Chevalier, R., Forbes, M., Thornhill, B. Ureteral obstruction as a model of renal interstitial fibrosis and obstructive nephropathy. Kidney International. 75 (11), 1145-1152 (2009).
- Forbes, M., Thornhill, B., Chevalier, R. Proximal tubular injury and rapid formation of atubular glomeruli in mice with unilateral ureteral obstruction: a new look at an old model. American Journal of Physiology. Renal physiology. 301 (1), 110-117 (2011).
- Yang, H. -. C., Zuo, Y., Fogo, A. B. Models of chronic kidney disease. Drug Discovery Today. Disease Models. 7 (1-2), 13-19 (2010).
- Hackl, M. J., et al. Tracking the fate of glomerular epithelial cells in vivo using serial multiphoton imaging in new mouse models with fluorescent lineage tags. Nature Medicine. 19 (12), 1661-1666 (2013).
- Kitching, A., Kuligowski, M., Hickey, M. In vivo imaging of leukocyte recruitment to glomeruli in mice using intravital microscopy. Methods in Molecular Biology. 466, 109-117 (2009).
- Savin, V. J., Terreros, D. A. Filtration in single isolated mammalian glomeruli. Kidney International. 20 (2), 188-197 (1981).
- Chomczynski, P., Sacchi, N. The single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction: twenty-something years on. Nature Protocols. 1 (2), 581-585 (2006).
- El Karoui, K., et al. Endoplasmic reticulum stress drives proteinuria-induced kidney lesions via Lipocalin 2. Nature Communications. 7, 10330 (2016).
- VA, M., et al. Multiplexed measurements of gene signatures in different analytes using the Nanostring nCounter Assay System. BMC Research Notes. 2, 80 (2009).
- Springer, A., et al. A combined transcriptome and bioinformatics approach to unilateral ureteral obstructive uropathy in the fetal sheep model. The Journal of Urology. 187 (2), 751-756 (2012).
- Braun, F., Becker, J., Brinkkoetter, P. Live or let die: Is there any cell death in podocytes. Seminars in Nephrology. 36 (3), 208-219 (2016).
- Kim, W. The role of angiopoietin-1 in kidney disease. Electrolyte & Blood Pressure E & BP. 6 (1), 22-26 (2008).
- Liu, F., Zhuang, S. Role of receptor tyrosine kinase signaling in renal fibrosis. International Journal of Molecular Sciences. 17 (5), 972 (2016).
- Martini, S., et al. Integrative biology identifies shared transcriptional networks in CKD. Journal of the American Society of Nephrology: JASN. 25 (11), 2559-2572 (2014).
- Mühlberger, I., et al. Integrative bioinformatics analysis of proteins associated with the cardiorenal syndrome. International Journal of Nephrology. 2011, 809378 (2010).
- Satirapoj, B., et al. Periostin: novel tissue and urinary biomarker of progressive renal injury induces a coordinated mesenchymal phenotype in tubular cells. Nephrology, Dialysis, Transplantation. 27 (7), 2702-2711 (2012).
- Fengxin, Z., et al. Numb contributes to renal fibrosis by promoting tubular epithelial cell cycle arrest at G2/M. Oncotarget. 7 (18), 25604-25619 (2016).
- Sandoval, R. M., Molitoris, B. A. Quantifying glomerular permeability of fluorescent macromolecules using 2-photon microscopy in Munich Wistar rats. Journal of Visualized Experiments: JoVE. (74), e50052 (2013).
- Russo, L. M., et al. Impaired tubular uptake explains albuminuria in early diabetic nephropathy. Journal of the American Society of Nephrology: JASN. 20 (3), 489-494 (2009).
- Russo, L. M., et al. The normal kidney filters nephrotic levels of albumin retrieved by proximal tubule cells: retrieval is disrupted in nephrotic states. Kidney International. 71 (6), 504-513 (2007).
- Sandoval, R. M., Wang, E., Molitoris, B. A. Finding the bottom and using it: Offsets and sensitivity in the detection of low intensity values in vivo with 2-photon microscopy. Intravital. 2 (1), 23674 (2014).
- Kuligowski, M. P., Kitching, A. R., Hickey, M. J. Leukocyte recruitment to the inflamed glomerulus: a critical role for platelet-derived P-selectin in the absence of rolling. Journal of Immunology. 176 (11), 6991-6999 (2006).
- Devi, S., et al. Multiphoton imaging reveals a new leukocyte recruitment paradigm in the glomerulus. Nature Medicine. 19 (1), 107-112 (2013).
- Finsterbusch, M., et al. Patrolling monocytes promote intravascular neutrophil activation and glomerular injury in the acutely inflamed glomerulus. Proceedings of the National Academy of Sciences of the United States of America. 113 (35), 5172-5181 (2016).
- Shroff, U. N., Gyarmati, G., Izuhara, A., Deepak, S., Peti-Peterdi, J. A new view of macula densa cell protein synthesis. American Journal of Physiology. Renal Physiology. 321 (6), 689-704 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved