Method Article
Uso de microscopía de 2 fotones para cuantificar los efectos de la obstrucción ureteral unilateral crónica en los procesos glomerulares
En este artículo
Resumen
Aquí, presentamos un protocolo utilizando microscopía de 2 fotones en ratas Munich Wistar Fromter con glomérulos de superficie para cuantificar los efectos de la obstrucción ureteral prolongada en la dinámica y función glomerular.
Resumen
La aplicación de nuevos métodos de microscopía a modelos adecuados de enfermedades animales para explorar la fisiología dinámica del riñón sigue siendo un desafío. Las ratas con glomérulos superficiales brindan una oportunidad única para investigar procesos fisiológicos y fisiopatológicos utilizando microscopía intravital de 2 fotones. La cuantificación del flujo sanguíneo capilar glomerular y la vasoconstricción y dilatación en respuesta a fármacos, permeabilidad e inflamación son solo algunos de los procesos que se pueden estudiar. Además, las ratas transgénicas, es decir, los podocitos marcados con colorantes fluorescentes y otros enfoques de biomarcadores moleculares, proporcionan una mayor resolución para monitorear y cuantificar directamente las interacciones proteína-proteína y los efectos de alteraciones moleculares específicas.
En ratones, que carecen de glomérulos superficiales después de las cuatro semanas de edad, se ha utilizado la obstrucción ureteral unilateral (UUO) durante varias semanas para inducir glomérulos superficiales. Como este modelo de inducción no permite estudios basales, cuantificamos los efectos de la UUO en los procesos glomerulares en el modelo UUO en ratas Wistar Frömter (MWF) de Múnich, que tienen glomérulos superficiales en condiciones fisiológicas. El modelo UUO durante cinco semanas o más indujo alteraciones significativas en la morfología renal macroscópica, la microvasculatura peritubular y glomerular, así como la estructura y función de los epitelios tubulares. El flujo glomerular y peritubular de glóbulos rojos (RBC) disminuyó significativamente (p < 0,01), probablemente debido al aumento significativo en la adhesión de glóbulos blancos (WBC) dentro de los capilares glomerulares y peritubulares. El coeficiente de tamizado glomerular de la albúmina aumentó de 0,015 ± 0,002 en MWF no tratados a 0,045 ± 0,05 en ratas UUO MWF de 5 semanas de edad. Doce semanas de UUO dieron lugar a aumentos adicionales en la densidad glomerular de superficie y el coeficiente de tamizado glomerular (GSC) para la albúmina. La albúmina fluorescente filtrada a través de los glomérulos no fue reabsorbida por los túbulos proximales. Estos datos sugieren que el uso de UUO para inducir glomérulos superficiales limita la capacidad de estudiar e interpretar los procesos glomerulares normales y las alteraciones de la enfermedad.
Introducción
Comprender los procesos glomerulares, especialmente la biología de los podocitos, ha sido un objetivo durante más de 50 años. Las ratas Wistar de Munich con glomérulos superficiales han desempeñado un papel central en estos estudios, incluidos los estudios de micropunción, para comprender numerosos aspectos de los procesos fisiológicos y patológicos 1,2,3. La utilización de microscopía para estudiar los componentes glomerulares por vía intravital fue limitada debido a los efectos de la fototoxicidad hasta el advenimiento de la microscopía de 2 fotones que minimizó esta exposición tóxica y aumentó la profundidad de penetración 1,2. Junto con los rápidos avances en hardware y software de computadora, esto ha permitido estudios tridimensionales (3D) y cuatridimensionales (tiempo) durante horas en un solo entorno 1,4,5.
La cuantificación del flujo sanguíneo capilar glomerular, la vasoconstricción y la dilatación en respuesta a los fármacos, la permeabilidad y los efectos de la carga sobre la permeabilidad y la inflamación son solo algunos de los procesos glomerulares que se han estudiado. Además, el segmento S1 del túbulo proximal es identificable, y las diferencias en el comportamiento del epitelio tubular S1 y S2 pueden cuantificarse 1,4. Los estudios en ratones, especialmente con la disponibilidad universal de instalaciones transgénicas de ratón, han llevado a rápidos avances en la comprensión de la biología molecular de los procesos de enfermedad glomerular. Las proteínas individuales son responsables de la disfunción glomerular en estudios knockout, especialmente con respecto a la proteinuria 6,7,8. Sin embargo, la utilización de modelos de ratón para estudios de imagen glomerular ha sido limitada ya que los glomérulos están a más de 100 μm por debajo de la superficie en las numerosas cepas estudiadas9.
Esto ha llevado a los investigadores a desarrollar y utilizar modelos de ratón que resultan en glomérulos superficiales que pueden ser estudiados. El modelo más común es el uso de UUO completo10,11,12. Al final del período prolongado de UUO, hay numerosos glomérulos superficiales en riñones de ratones que pueden ser y han sido estudiados13,14. No ha habido ningún estudio basal o de control en estos estudios con ratones para determinar los efectos de la UUO prolongada en la biología glomerular. Como este es un modelo severo y prolongado de lesión que resulta en fibrosis rápida y destrucción cortical10,11,12, planteamos la hipótesis de que habría efectos sobre los procesos glomerulares y la función. Para responder a esta pregunta, se utilizaron ratas Munich Wistar Fromter (MWF) con glomérulos de superficie para estudiar los parámetros de control / basales, y el hallazgo basal se comparó con estudios glomerulares en ratas MWF después de cinco semanas de UUO. También estudiamos ratas Sprague Dawley (SD) que no tienen glomérulos superficiales después de UUO. Los hallazgos indican que 5 semanas de UUO en ratas MWF y SD aumentan el número de glomérulos superficiales. Sin embargo, estos fueron glomérulos anormales con cambios marcados en el flujo sanguíneo glomerular, inflamación y permeabilidad y tamaño de las macromoléculas.
Protocolo
Todos los experimentos siguieron la Guía para el Cuidado y Uso de Animales de Laboratorio y fueron aprobados por el Comité de Cuidado y Uso de Animales de la Facultad de Medicina de la Universidad de Indiana.
1. Preparación del Munich Wistar Frömter o rata SD para la cirugía UUO
- Anestesiar a la rata usando isofluorano (5% de inducción, 1.5-2.5% de mantenimiento), luego afeitar, lavar y desinfectar el área quirúrgica varias veces con un exfoliante a base de yodo o clorhexidina y alcohol. Aplicar analgésico de acción prolongada / liberación lenta para el manejo del dolor según las pautas institucionales de IACUC.
- Haga una incisión a lo largo de la línea media con un bisturí; Localice el riñón izquierdo y libérelo de los órganos peritoneales circundantes.
- Localice cuidadosamente el pedículo renal, que comprende la arteria renal, la vena renal y el uréter. Separe el uréter de las otras estructuras, tomando precauciones para no dañar la delicada estructura.
- Usando fórceps finos, enrolle cuidadosamente una sutura 3-0 alrededor del uréter y átela, teniendo cuidado de no romperla. Repita este procedimiento unos milímetros a cada lado del primer nudo para atar un segundo nudo y asegurar una obstrucción completa.
- Una vez completado el procedimiento, cierre con cuidado las capas musculares sucesivas. Antes de cerrar la capa final, agregue 2 ml de solución salina tibia y estéril al 0,9% en el abdomen antes de cerrarla por completo. Cierre la piel externa con grapas quirúrgicas.
- Aplique analgésico de acción prolongada / liberación lenta para el manejo del dolor y observe la recuperación de cerca según las pautas institucionales de IACUC. Monitoree periódicamente a partir de entonces y prepárese para obtener imágenes al final de la quinta semana.
2. Síntesis de albúmina sérica de rata roja de Texas (TR-RSA)
- Pesar 100 mg de albúmina sérica de rata y disolverla en 6,67 ml de tampón de bicarbonato de sodio 0,1 M a pH 8,4 en un tubo cónico de 50 ml.
- A un vial de 5 mg de éster Texas Red-X-succinimidyl, agregue 100 μL de dimetilformamida (DMF, alta calidad) y vortex hasta que se disuelva todo el colorante.
- Coloque la solución de albúmina sérica de rata en un vórtice a un ajuste bajo/medio, de modo que el volumen de la solución gire muy por debajo de la parte superior del tubo abierto.
- Agregue el tinte disuelto mientras el tubo está siendo vortexed.
- Tome el tubo cónico de 50 ml, envuélvalo en papel de aluminio, coloque el tubo en cualquier balancín o rodillo y agite lentamente durante 1 h a temperatura ambiente (RT).
- En un cubo de 5 L de NaCl al 0,9% con una barra de agitación suave, humedezca las membranas de un dializador de corte de peso molecular adecuado de 50 kDa (una membrana con clips, tubos de membrana cerrados o casetes de diálisis son adecuados).
- Cargue la solución TR-RSA en el sistema de membrana y conéctela a los accesorios de flotación que normalmente se incluyen con el sistema. Colocar el envase de 5 L con solución salina al 0,9%/TR-RSA durante la noche a 4 °C (en una cámara frigorífica) con agitación suave sobre una placa de agitación. Cambie la solución de diálisis al menos tres veces durante las próximas 36 h.
- La hinchazón de la membrana aumentará el volumen de la solución TR-RSA ahora clara. Divide los 100 mg originales por el volumen para obtener una concentración aproximada: la relación colorante:proteína será de 1:1. Alícuota en volúmenes adecuados y liofilizar para su almacenamiento a largo plazo.
3. Preparación para imágenes intravitales de 2 fotones en un microscopio invertido
- Retire la cubierta de un plato inferior de cubreobjetos de 50 mm (con un cubreobjetos de 40 mm de diámetro) y coloque 8 piezas de cinta de autoclave en la parte inferior interior junto al borde. Haga una ventana vacía en forma de pirámide, utilizando 4 piezas por lado para permitir que el riñón exteriorizado encaje cómodamente en este espacio mientras mantiene el contacto periférico con la cinta del autoclave, lo que ayuda a minimizar el movimiento. Ajuste el espaciado de acuerdo con el tamaño de la rata para asegurar el mejor contacto con el riñón.
- Coloque 1 almohadilla térmica a cada lado del plato inferior del cubreobjetos de 50 mm. Asegúrese de que la almohadilla de calentamiento cubra el escenario.
- Utilice un objetivo de inmersión en agua de 40x con un zoom de 0,75x y un zoom de 1,5x para generar imágenes de 30x y 60x, respectivamente, lo que permite imágenes de menor y mayor aumento. Si es necesario, agregue agua al objetivo usando una jeringa de 1 ml con una pieza larga de tubo PE-200 que pueda alcanzar la parte superior del objetivo en un ángulo hacia abajo para evitar que la gota de agua baje por el tubo.
- Utilice una transmisividad láser al 2%, con detectores azules, verdes y rojos ajustados a niveles predeterminados para asegurar la consistencia en las imágenes entre los estudios. Establezca la longitud de onda de excitación en 800 nm en el láser al que se hace referencia (consulte la Tabla de materiales), lo que excitará eficientemente todos los fluoróforos utilizados en este estudio.
- Utilice detectores externos (no descapotables) para recoger las emisiones azules utilizando un tubo fotomultiplicador (PMT) (420-490 nm, ganancia 950).
- Utilice un detector Hyd para capturar emisiones verdes (500-550 nm, ganancia 100).
- Utilice un detector Hyd para capturar las emisiones rojas (590-660 nm, ganancia 200).
- Ajuste el desplazamiento en el PMT (emisiones azules) para que solo unos pocos píxeles en las áreas en blanco del tejido tengan un valor de cero.
NOTA: Los detectores HyD para las emisiones verdes y rojas tienen ajuste automático de compensación; Solo se puede establecer la ganancia. - Establezca la profundidad de bits en 12 bits para dar a las imágenes una escala de intensidad de 4.096 entre blanco y negro.
NOTA: Es necesario establecer los límites inferiores de los detectores (compensados en PMT) para no excluir estos valores para garantizar la recolección de las emisiones de baja intensidad dentro del espacio de Bowman. Si el ajuste de sensibilidad es demasiado bajo, los marcadores de advertencia visual lo indicarán; A estos valores se les asigna un valor de intensidad de cero.
- Diluir aproximadamente 6 mg de albúmina sérica Texas-Red-X-Rat hasta un volumen total de 1 ml, cargar la solución en una jeringa de 1 ml y colocar en el catéter intravenoso permanente en el paso 4.1 después de la infusión de Hoechst 33342 en el paso 9.1.
4. Preparación quirúrgica para imágenes intravitales de 2 fotones
- Coloque la rata preanestesiada con una línea de acceso venoso permanente (femoral o yugular) de lado con el flanco izquierdo afeitado hacia arriba plano y recto sobre la mesa. Asegúrese de que las patas delanteras se toquen entre sí, al igual que las patas traseras.
- Palpe suavemente el flanco izquierdo justo debajo de las costillas para sentir el riñón para determinar la posición natural en el abdomen. Si es necesario, dibuje una línea usando un marcador permanente a lo largo del área afeitada, dividiendo el centro del riñón en una orientación de nariz a cola.
- Usando un par de pinzas dentadas, agarre la piel y levántela hacia arriba para facilitar el pellizco de la línea marcador permanente con un par de hemostáticos para aplastar la vasculatura subyacente y prevenir el sangrado al hacer la incisión con un par de tijeras quirúrgicas. Repita esto para la capa delgada del músculo externo para minimizar el sangrado.
- Para hacer la incisión final de la capa delgada interna del músculo abdominal, repalpar el riñón para estimar el tamaño y la posición. Levante cuidadosamente la capa muscular interna con un par de fórceps y aplaste una línea que divide la piel por encima del riñón con los hemostáticos que es aproximadamente 1/3 del tamaño estimadodel riñón.
- Manteniendo el agarre en la capa muscular con los fórceps, haga la incisión final.
NOTA: Es mejor hacer una incisión más pequeña y expandirla según sea necesario que hacerla demasiado grande, lo que requerirá un cierre parcial con una sutura. - Agarre suavemente el riñón por la grasa circundante. Usando ambas manos con fórceps en cada mano, trabaje para agarrar la grasa en el polo inferior del riñón mediante el uso de una técnica de mano sobre mano para agarrar y sostener la grasa renal, trabajando hacia abajo.
- Teniendo un agarre firme sobre la grasa en el polo inferior del riñón con una mano, tire suavemente de la grasa y, si es necesario, apriete muy suavemente el riñón a través de la incisión. Si el riñón no pasa fácilmente, ensanche la incisión.
5. Posicionamiento de la rata para obtener imágenes
- Coloque con cuidado el riñón expuesto contra el borde del plato, con una ligera rotación para que el lado abdominal del riñón entre en contacto con el cubreobjetos y el lado dorsal esté mirando hacia afuera del borde.
- Para minimizar aún más el movimiento, tome dos almohadillas de gasa estériles de 2 x 2, humedézcalas con solución salina y empaquételas contra el lado dorsal del riñón, reforzando el contacto del lado abdominal del riñón con el borde.
- Mire a través del ocular del microscopio bajo iluminación de epifluorescencia usando un cubo de Rhodamine/FITC de doble paso. Si se detecta movimiento, haga ajustes menores en la posición y ajuste cuidadosamente la gasa, asegurándose de que no empuje debajo del riñón. Para reducir aún más el movimiento, haga rodar la rata ligeramente, de modo que el tórax esté más lejos del plato.
6. Adquisición de imágenes para análisis cuantitativo
- Escanee la superficie del riñón usando iluminación de epifluorescencia (paso 5.3) y marque la(s) posición(es) de los glomérulos usando el software asociado con el controlador de etapa motorizado (una característica de los sistemas modernos).
- Para cada canal de color bajo iluminación de 2 fotones, tome un volumen 3D poco profundo de la parte superior de cada glomérulo marcado, que servirá como imágenes de fondo. Utilice una paleta de pseudocolores en la opción de visualización del software de imágenes para visualizar mejor las débiles intensidades de la fluorescencia de fondo de los bucles capilares glomerulares.
- Usando un vaso sanguíneo superficial como punto focal, infunda lentamente la albúmina fluorescente, dando tiempo para observar el aumento y la disminución de la fluorescencia debido a la distribución sistémica. Infundir suficiente TR-RSA para lograr una intensidad en la vasculatura peritubular y los asas capilares que está justo por debajo de la saturación.
NOTA: Normalmente hay un retraso de 5 s entre la infusión de material y su aparición en el torrente sanguíneo cuando la perfusión renal es normal. - Espere aproximadamente 10 minutos antes de adquirir volúmenes 3D (intervalos de 1 μm) para todos los glomérulos marcados y fotografiados del paso 6.2.
NOTA: Las ratas Munich Wistar de Simonsen tienen menos glomérulos superficiales. Sin embargo, como la cepa Frömter de ratas MW tiene un mayor número de glomérulos superficiales, a menudo se pueden visualizar hasta 10 glomérulos. - Eutanasia a la rata a través de una sobredosis de isoflurano al final del estudio. Realizar una neumotoracotamía dual para asegurar la eutanasia.
7. Cálculo de la permeabilidad glomerular
- Utilizando el software de visualización de imágenes asociado con el sistema de microscopio, exporte las imágenes a imágenes RAW de 12 bits para su procesamiento y análisis.
- Cargue los volúmenes 3D de fondo y el volumen 3D sin procesar que contiene la albúmina fluorescente circulante. Localice el plano focal en el volumen 3D con el bucle capilar superficial más brillante en los glomérulos con suficiente espacio hasta el borde de la cápsula de Bowman circundante.
- Usando puntos de referencia visuales, localice el mismo plano focal que se encuentra en el volumen de fondo. Seleccione una región en el bucle capilar y una dentro del espacio de Bowman anotando los valores de intensidad promedio de cada una. Utilice estos valores de intensidad como valores de fondo.
- Delinee una región (al menos 20 x 20 píxeles de área) dentro del espacio de Bowman en la imagen que contiene albúmina y anote la lectura de intensidad (seleccione un área que no esté adyacente a un bucle capilar o a la cápsula de Bowman para asegurar la medición más limpia de las intensidades espaciales de Bowman). Mueva la región dibujada sobre otras dos regiones para tomar un valor promedio para la intensidad promedio dentro del Espacio de Bowman.
- Seleccione la intensidad fluorescente de plasma más brillante dentro de la sección del bucle capilar y marque esta región. Usando la función de umbral , resalte los valores brillantes (generalmente ubicados en los bordes de las paredes del bucle capilar), evite la circulación de sombras RBC y registre el valor.
NOTA: Como los factores dentro de la sangre causarán una subestimación de los niveles de fluorescencia plasmática, es importante seleccionar las áreas más brillantes. - Introduzca los valores en una hoja de cálculo para calcular la SGC utilizando Eq (1):
SGC = (1)
(1)
8. Cálculo del flujo de glóbulos rojos en asas capilares glomerulares superficiales y vasculatura renal utilizando una función de linescan
- Encuentre un vaso apropiado (ya sea un asa capilar o un vaso peritubular). Como la función de escaneo lineal en el software de adquisición de imágenes referenciado (consulte la Tabla de materiales) requiere que el recipiente sea perpendicular, gire la imagen utilizando la función de rotación .
- Una vez que el recipiente esté girado y acostado, seleccione la función XT en el menú de adquisición . Configurado para escanear 4.000 líneas. Coloque la línea a través del recipiente a examinar; Asegúrese de que el plano focal esté en el diámetro máximo del segmento que se va a fotografiar.
- Haga clic izquierdo en la imagen compuesta en color y seleccione Tomar instantánea para generar una imagen de referencia del área donde se tomó el escaneo de líneas. Haga clic inmediatamente en el botón Inicio para capturar el escaneo lineal del buque.
- Para determinar el caudal RBC, importe los lineales en el software de procesamiento de imágenes (consulte la Tabla de materiales). Abra el cuadro de diálogo Mostrar estadísticas de región en el menú desplegable Medir . Seleccione la herramienta de dibujo de una sola línea y dibuje una línea que coincida con la pendiente de las sombras RBC. Tenga en cuenta los valores de ancho y alto.
NOTA: Los valores de píxeles obtenidos para el ancho corresponderán a la distancia; Los píxeles de altura corresponden al tiempo. - Utilice la siguiente fórmula (Eq (2)) para calcular la velocidad.
Caudal de glóbulos rojos en μm/s =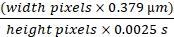 (2)
(2)
NOTA: Esto corresponde a los parámetros de adquisición con un aumento de 60x y una velocidad de escaneo de 400 Hz con el microscopio de referencia (consulte la Tabla de materiales).- Haga al menos cinco cálculos y promedie para informar la velocidad de cada línea de escaneo.
NOTA: Estos parámetros dependerán de la dimensión de píxeles y la velocidad de adquisición del sistema de microscopio.
- Haga al menos cinco cálculos y promedie para informar la velocidad de cada línea de escaneo.
9. Cálculo de la oclusión leucocitos en asas capilares glomerulares
- Administrar la tinción nuclear Hoechst 33342 (a ~8 μg/kg de peso de rata) a través de una línea de acceso venoso permanente para identificar glóbulos blancos alojados en los bucles capilares.
NOTA: La profundidad utilizable será limitada debido a la dispersión de fotones y la absorción por la hemoglobina, especialmente para emisiones azules de longitud de onda más corta. - Centrar un glomérulo en el campo de imágenes y tomar un conjunto de datos 3D que comience en la superficie glomerular y termine los datos al menos de 30 a 35 μm. Utilice un tamaño de paso de 1 μm en la dirección Z.
- Identificar los glóbulos blancos comparando el canal azul Hoechst con el canal de albúmina Texas Red; buscar la exclusión de tinte rojo en el asa capilar y una tinción nuclear correspondiente para identificar positivamente los glóbulos blancos. Defina los glóbulos blancos como "adheridos" si aparecen estáticos en 3 secciones ópticas. Informar los valores como ocurrencia/10 secciones ópticas desde la parte superior del glomérulo, tomadas a intervalos de 1 μm.
10. Puntuación de la presencia de formaciones de Rouleaux en glomérulos superficiales
- Siga las mismas instrucciones para el paso 9.3 y adquiera un conjunto de datos 3D. Busque formaciones de Rouleaux que aparecen como glóbulos rojos apilados en paquetes que resisten la disociación a medida que se mueven a lo largo de los bucles capilares. Utilice un fluoróforo rojo para una mejor visualización de la estructura a mayores profundidades debido a la menor dispersión de fotones para las emisiones rojas de longitud de onda más larga. Informar los valores como ocurrencia/25 secciones ópticas desde la parte superior del glomérulo, tomadas a intervalos de 1 μm.
11. Aislamiento de glomérulos
- Aislar tres grupos de glomérulos de riñones frescos utilizando una técnica de tamizado estándar que da como resultado una pureza cercana al 90% de los glomérulos de rata15.
- Coloque la corteza renal en solución salina tamponada con fosfato frío (PBS) y pique con múltiples tijeras finas o cuchillas de afeitar.
- Agregue el tejido picado a un colador de células estériles de 100 μm y empújelo suavemente con un émbolo de jeringa de 5 ml y 50-100 ml de PBS frío.
NOTA: La mayoría de los túbulos se retienen mientras pasan los glomérulos. - Coloque la fracción de glomérulos enriquecidos en un filtro de 70 μm y lávelos extensamente con PBS frío. Lave el filtro con 100-200 ml de PBS frío para eliminar la mayoría de los túbulos restantes.
- Recoja los glomérulos del filtro utilizando 1-2 ml de PBS frío, centrifugadora (10,000 × g, 2 min, 4 ° C) y congélelos rápidamente en nitrógeno líquido hasta el aislamiento de ARN.
NOTA: La pureza glomerular determinada por microscopía de contraste de fase es del >90%, y el rendimiento es de aproximadamente 10 mg de 2 riñones.
12. Aislamiento de ARN glomerular
- Homogeneizar el gránulo congelado utilizando el reactivo de aislamiento de ARN añadiendo 400 μL del reactivo y rompiendo el pellet con una punta de pipeta de 200 μL, seguido de un breve vórtice y 5 minutos de incubación a RT16.
- Añadir 40 μL de 1-bromo-3-cloropropano (BCP), vórtice durante 15 s, y mantener a RT durante 15 min.
- Centrifugadora a 12.000 × g, 15 min, 4 °C. Retire la capa acuosa, diluya la capa inferior con un volumen igual de etanol al 70% y cárguela directamente en una columna de centrifugado (consulte la Tabla de materiales).
- Después de los lavados, cada uno consistente en añadir la solución respectiva a la columna seguida de centrifugación a 12.000 x g, 15 s, 26 °C [3 en total, primeros 2 con 500 μL de RPE (tampón de lavado suave patentado con etanol para eliminar trazas de sales,3º lavado con 500 μL de EtOH al 80%], eluye el ARN mediante la adición de 15 μL deH2 O y centrífuga, como para los lavados. Compruebe la concentración y pureza del ARN y transporte las muestras de ARN a la instalación central para el análisis de Nanostring17,18.
NOTA: El rendimiento total de ARN es de aproximadamente 1-2 μg. Aquí, las 24 muestras contenían 200 ng de ARN a 30 ng / μL.
13. Análisis de nanocuerdas
NOTA: La tecnología de nanocuerdas se basa en la detección digital y el código de barras molecular directo de moléculas objetivo que utilizan pares de sondas codificadas por colores. La sonda Capture lleva una fracción de biotina en el extremo 3', y la sonda Reporter lleva la señal en su extremo 5'.
- Envíe los pares de sondas de genes Nanostring y CodeSets a la Instalación Central Genómica del Estado de Michigan y utilícelos según las indicaciones de NanoString.
NOTA: Hay seis posiciones para los códigos de color, y cada posición puede ser uno de los cuatro colores, lo que permite una gran diversidad de etiquetas que se pueden resolver e identificar individualmente durante la recopilación de datos. - Obtenga los datos recopilados por el personal de la instalación de Genomic Core utilizando el analizador digital patentado Nanostring nCounter, que recopila campos de visión utilizando un objetivo de microscopio y una cámara CCD y tabula y muestra los recuentos de códigos de barras.
- Importe los datos sin procesar al software nSolver de Nanostring para su análisis. Normalice los datos normalizados utilizando su configuración predeterminada y compare los datos entre grupos como se describe en su manual.
NOTA: El objetivo fue monitorear los cambios genéticos previamente mostrados alterados en el tejido cortical de un modelo UUO19, enfermedad renal 17,20,21,22,23,24,25,26. Se analizaron un total de 126 genes, incluidos los controles positivos y negativos recomendados, en cada grupo de glomérulos (CONT, SHAM Y UUO).
Resultados
Se aislaron tres grupos de glomérulos utilizando una técnica de tamizado estándar que da como resultado una pureza cercana al 90% de los glomérulos de rata15. El primer grupo de glomérulos fue del riñón izquierdo de ratas SD que se sometieron a una pinza del uréter renal izquierdo durante 5 semanas, UUO (5 machos, 3 hembras). El segundo grupo de glomérulos se aisló del riñón de control contralateral de la misma rata, CONT (5 machos, 3 hembras). El tercer grupo de glomérulos se aisló de ratas SD que se sometieron a cirugía SHAM, y el riñón izquierdo se utilizó para el aislamiento de glomérulos después de 5 semanas, SHAM (4 machos, 4 hembras).
Alteraciones morfológicas
La externalización del riñón obstruido para obtener imágenes reveló un riñón muy agrandado, aproximadamente cuatro veces el tamaño normal, con epitelios delgados visibles a través del interior del riñón lleno de líquido. A través de un objetivo de 20x, utilizando iluminación de epifluorescencia y un cubo de doble paso FITC/Rhodamine , el cambio más evidente fue el adelgazamiento del epitelio tubular y el colapso uniforme de los lúmenes tubulares a lo largo de toda la longitud tubular. La histología ha sido bien descrita y es grave por una semana de UUO10,11,12. El número de glomérulos visibles en la superficie en ratas MWF y SD aumentó después de cinco semanas de obstrucción unilateral del uréter. La figura 1A muestra el método utilizado para crear el modelo UUO. El riñón derecho está intacto y proporciona una tasa de filtración glomerular adecuada para la rata. El número de glomérulos por campo utilizando un objetivo de 20x (363 μm x 363 μm) se contó y se mostró en un gráfico en la Figura 1B. El número de glomérulos de superficie en ratas MWF aumentó de 1,08 ± 0,11/campo en ratas no tratadas a 2,97 ± 0,65/campo en el grupo de UUO de cinco semanas. Las ratas SD pasaron de no tener glomérulos superficiales a 2,02 ± 0,37/campo después de 5 semanas de UUO.
Se tomaron imágenes intravitales de 2 fotones de estas ratas después de la inyección con TR-RSA (rojo), un dextrano azul en cascada de 10 kDa (10 kDa-CB) y Hoechst 33342 para etiquetar los núcleos (cian). Estos se muestran para ratas MWF normales (Figura 1C), ratas MWF después de cinco semanas de UUO (Figura 1D) y ratas SD después de cinco semanas de UUO (Figura 1E). Estas imágenes resaltan alteraciones dramáticas que ocurren en el epitelio tubular. Los lisosomas del túbulo proximal, que normalmente son pequeñas acumulaciones punteadas de color naranja en ratas MWF y SD no tratadas, se convierten en grandes estructuras vacuolares singulares que llenan la mayor parte de la célula tubular reducida. Como se describe en la albúmina TR-RSA, la vasculatura apareció enderezada y, en muchos vasos, desprovista de glóbulos rojos fluidos, mostrando solo plasma en curso. La fijación de los riñones reveló que la corteza se había adelgazado en una piel fibrosa no más gruesa que un milímetro. Estas observaciones concuerdan con la literatura temprana utilizando este modelo 3,10,11,12.
Alteraciones en la dinámica vascular renal y permeabilidad glomerular
El flujo sanguíneo renal se redujo significativamente en los grupos UUO MWF y SD de cinco semanas en comparación con las ratas no tratadas (Figura 2). Las ratas MWF operadas con simulacro tenían un flujo peritubular de glóbulos rojos de 885 ± 25 μm/s. El flujo peritubular de glóbulos rojos en ratas UUO MWF y SD de cinco semanas disminuyó a 250 ± 100 μm/s y 200 ± 125 μm/s, respectivamente. Estos valores se calcularon mediante la recolección de exploraciones de línea a través de vasos peritubulares para calcular la velocidad de los glóbulos rojos. La figura 2D muestra un gráfico de estos datos.
La velocidad de los glóbulos rojos dentro de los asas capilares glomerulares disminuyó significativamente en las ratas UUO MWF y SD de cinco semanas en comparación con las MWF no tratadas (Figura 3). En muchos casos, se encontró que los glomérulos tenían asas capilares completamente desprovistas de glóbulos rojos fluidos. Las tasas de flujo de glóbulos rojos del asa capilar fueron de 1.405 ± 425 μm/s, 250 ± 220 μm/s ± y 190 ± 200 μm/s o MWF no tratado, UUO MWF de cinco semanas y ratas UUO SD de cinco semanas, respectivamente (Figura 3D). Dentro de los bucles capilares de los grupos UUO de cinco semanas, el flujo lento de los glóbulos rojos reveló la presencia de glóbulos blancos adherentes, ya sea ralentizando el flujo o bloqueándolo, con solo el flujo plasmático visualizado aguas abajo de la obstrucción parcial o total. Para cuantificar esta observación, se contó el número de glóbulos blancos adherentes encontrados en un volumen 3D y luego se normalizó a la ocurrencia por cada 10 μm de profundidad de volumen 3D. La estructura de la célula blanca adherida se podía discernir utilizando la fluorescencia de colorante nuclear cian de Hoechst 33342. Desafortunadamente, la mayor dispersión de fotones de las luces emisoras de azul limitó la identificación confiable de los glóbulos blancos por sus núcleos a las 10 secciones ópticas superiores desde la parte superior, tomadas a pasos de 1 μm de volumen glomerular. Las ratas MWF no tratadas tenían menos de 0.125 ± 0.05 WBC / 10 secciones ópticas desde la parte superior, tomadas a un volumen de pasos de 1 μm, mientras que este número aumentó a 1.5 ± 0.5 y 3.25 ± 0.7 en ratas UUO MWF de 5 semanas y UUO SD de 5 semanas, respectivamente (Figura 3E).
Otra alteración vascular que también puede explicar la reducción del flujo de glóbulos rojos en los grupos de UUO de 5 semanas fue la aparición regular de formaciones de Rouleaux (glóbulos rojos agrupados que se adhieren en una configuración de "moneda apilada", ver recuadro de la Figura 3F). Las formaciones de Rouleaux fluyen más lentamente y pueden ser detenidas por un WBC adherente. Las ratas WMF no tratadas prácticamente no tienen formaciones de Rouleaux en sus capilares glomerulares, teniendo solo 0.05 ± 0.05 ocurrencias por 25 secciones ópticas desde la parte superior, tomadas a pasos de 1 μm. Las ratas UUO MWF y SD de cinco semanas tuvieron un marcado aumento en las formaciones de Rouleaux 2.27 ± 0.46 y 1.46 ± 0.73 por 25 secciones ópticas comenzando desde la parte superior, tomadas a pasos de 1 μm, respectivamente (Figura 3F).
Además de la reducción en las tasas de flujo de glóbulos rojos glomerulares observada con UUO, se observó un aumento en la permeabilidad a la albúmina. Hubo mayor heterogeneidad en la permeabilidad a la albúmina entre los glomérulos. Ocasionalmente, la acumulación de albúmina dentro del Espacio de Bowman era lo suficientemente intensa como para ser claramente vista (Figura 4B, asterisco). El coeficiente de tamizado glomerular de la albúmina aumentó de 0,015 ± 0,002 en MWF no tratados, a 0,045 ± 0,05 en MWF UUO de 5 semanas y 0,052 ± 0,075 en ratas UUO SD de cinco semanas.
Función alterada del túbulo proximal
Curiosamente, la albúmina filtrada no pudo detectarse en las células del túbulo proximal después de UUO. El segmento S1 normalmente endocitosis grandes cantidades de albúmina27,28,29,30, como se muestra aquí en condiciones fisiológicas en ratas MWF no tratadas (Figura 5A). Esta misma captación no se pudo ver en el MWF o SD PT después de 5 semanas de UUO (Figura 5B, C). Los túbulos proximales que rodean los glomérulos fotografiados entre 45 y 60 min después de la infusión de TR-RSA se calificaron para detectar la presencia (1) o ausencia (0) de albúmina. Es importante tener en cuenta que en condiciones fisiológicas, el segmento S1 se une ávidamente e internaliza la albúmina con poca o ninguna albúmina que alcanza los túbulos distales o los conductos colectores. Por lo tanto, es lógico pensar que los últimos segmentos del túbulo proximal pueden no contener albúmina, lo que resulta en una positividad fraccional para la absorción de albúmina de menos de 1.0. La Figura 5D muestra un gráfico con los resultados de la puntuación de la captación de albúmina del túbulo proximal. El MWF no tratado tuvo un valor de captación fraccional del túbulo proximal de 0,556 ± 0,126. Tanto las ratas UUO MWF como SD a cinco semanas tuvieron valores significativamente más bajos de 0.049 ± 0.126 y 0.00 ±0.00, respectivamente.
Los estudios también se completaron en ratas UUO MWF de 12 semanas (Tabla 1). Doce semanas de UUO es el tiempo estándar utilizado para estudios con ratones para inducir glomérulos de superficie. Se obtuvieron imágenes de tres ratas macho UUO, y la densidad glomerular aumentó aún más a 6,16 ± 1,83 glomérulos por campo 20x en estas ratas. La tasa de flujo RBC fue de 293 ± 67 μm / s, la adhesión de WBC fue de 1.47 ± 1.12, ambos similares a los datos de UUO de 5 semanas. El GSC de albúmina también aumentó en comparación con las ratas UUO de 5 semanas a 0.109 ± 0.04.
Alteraciones glomerulares del ARNm inducidas por el UUO crónico
La Tabla 2 muestra todos los genes (sondas) con su expresión agrupada y valores de desviación estándar. Tenga en cuenta que los genes se seleccionaron para el análisis en función de la documentación previa de alteración en la enfermedad renal, incluida la UUO como se describe en la nota de la sección 13 del protocolo. La Figura 6 es un mapa de calor de los datos que destaca los cambios dramáticos en la expresión génica para la mayoría de los genes en los glomérulos UUO en comparación con los glomérulos de control o simulados.
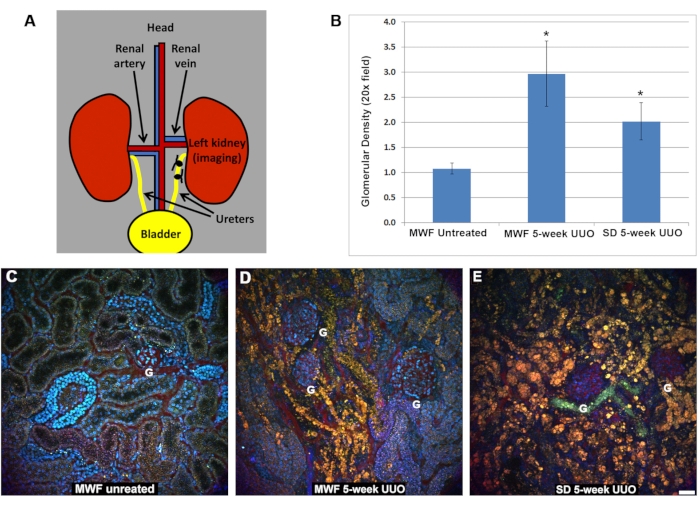
Figura 1: Aumento en el número de glomérulos superficiales e inducción de glomérulos de superficie en ratas SD después de UUO de 5 semanas en ratas MWF. (A) Un diagrama quirúrgico del uréter en el riñón izquierdo liberado cuidadosamente de la arteria renal y la vena antes de ser ocluido con dos lazos usando sutura quirúrgica. (B) Un gráfico que indica el aumento en el número de glomérulos de superficie presentes en ratas MWF antes y cinco semanas después de UUO junto con el número de glomérulos de superficie en ratas SD, que normalmente no tienen glomérulos de superficie. El número de glomérulos superficiales en ratas MWF aumentó de 1,08 ± 0,11/campo en ratas no tratadas a 2,97 ± 0,65/campo en el grupo de UUO de 5 semanas. Las ratas SD pasaron de no tener glomérulos superficiales a 2,02 ± 0,37/campo. Las imágenes tridimensionales reconstruidas muestran la superficie renal para MWF (C), MWF después de 5 semanas de UUO (D) y SD después de cinco semanas de UUO (E). Tenga en cuenta la aparición de grandes estructuras vacuolares de color naranja que se han fusionado a partir de pequeños lisosomas individuales en grandes cuerpos anormales. La UUO de 5 semanas en ratas SD no dio lugar a áreas parecidas al epitelio tubular normal visto en C y parcialmente en D. La vasculatura parecía enderezada en algunas regiones y, en muchas, tenía oclusiones parciales que permitían que fluyeran plasma pero no glóbulos rojos. (n = 3 ratas macho por grupo) Barras de escala = 40 μm. Las barras de error indican la desviación estándar. Abreviaturas: UUO = obstrucción ureteral unilateral; SD = Sprague-Dawley; MWF = Munich Wistar Frömter; G = glomérulo; RBC = glóbulos rojos. Haga clic aquí para ver una versión más grande de esta figura.
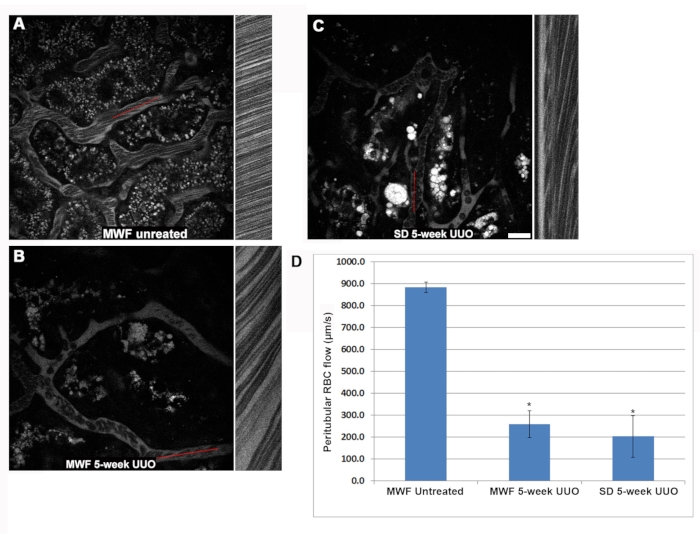
Figura 2: Reducción del flujo de glóbulos rojos dentro de la vasculatura peritubular superficial después de 5 semanas de UUO. Los lineses se recolectaron en vasos sanguíneos peritubulares para determinar la velocidad del flujo de glóbulos rojos en μm/s. Brevemente, las líneas de referencia rojas que se muestran en A, B y C representan una pequeña región en la que se escaneó repetidamente la misma área de ancho de píxeles, y las imágenes se apilan en una columna para visualizar la distorsión causada por los glóbulos rojos que fluyen, que viajan más rápido de lo que el microscopio puede adquirirlos. La columna adyacente a la figura de referencia es el lineal, con la pendiente de la distorsión RBC que se utiliza para calcular la velocidad (eje x = distancia y eje y = tiempo). Aquí, las pendientes progresivamente más pronunciadas corresponden a velocidades RBC más lentas, ya que permanecen más largas en la región de linescan. Tenga en cuenta la diferencia en la apariencia de los glóbulos rojos en ratas MWF no tratadas (A) en comparación con las imágenes UUO de cinco semanas para las ratas MWF (B) y SD (C). Las velocidades de flujo RBC para los tres grupos de ratas se muestran en D. El flujo peritubular de glóbulos rojos en MWF no tratados promedió 885 ± μm/s. Estos valores disminuyeron significativamente cinco semanas después de la UUO en ratas MWF y SD a 250 ± 100 μm / s y 200 ± 125 μm / s, respectivamente. Barra de escala = 20 μm, n = 3 ratas macho por grupo. Las barras de error indican la desviación estándar. Abreviaturas: UUO = obstrucción ureteral unilateral; SD = Sprague-Dawley; MWF = Munich Wistar Frömter; RBC = glóbulo rojo; WBC = glóbulo blanco. Haga clic aquí para ver una versión más grande de esta figura.
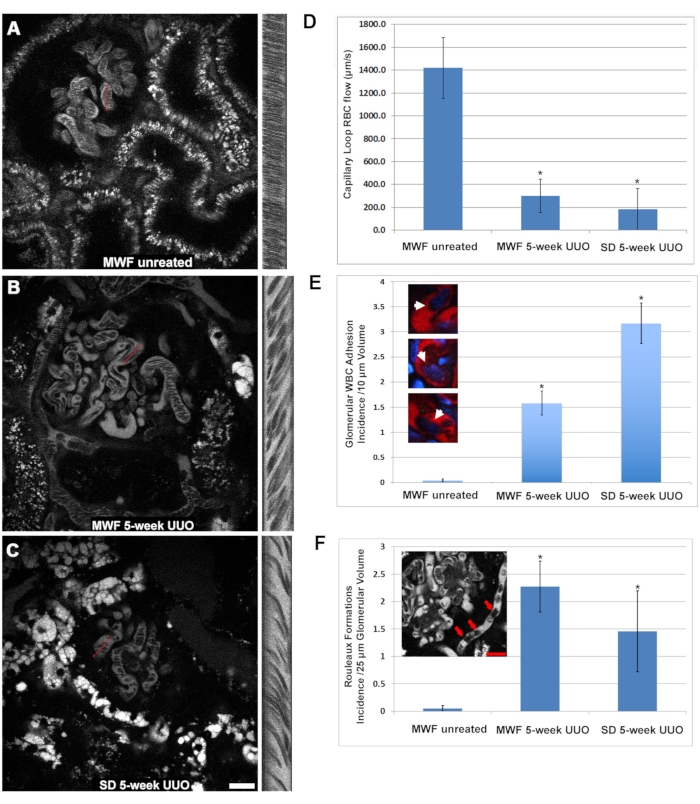
Figura 3: Reducción significativa en el flujo de glóbulos rojos del asa capilar glomerular y activación inducida de la adhesión de leucocitos por UUO de 5 semanas. El mismo enfoque de exploración lineal utilizado para determinar el flujo de glóbulos rojos peritubulares se utilizó para investigar alteraciones en el flujo sanguíneo capilar glomerular. Los paneles A, B y C muestran un diseño similar al de la Figura 2 y se centran en un glomérulo en MWF operado con simulación, UUO MWF de cinco semanas y UUO SD de cinco semanas, respectivamente. (D) Un gráfico que revela la tasa de flujo de glóbulos rojos fisiológicamente alta en los bucles capilares de ratas MWF operadas con simulacro con un promedio de 1.405 ± 425 μm / s ± 425, disminuyó a 250 ± 220 μm / s y 190 ± 200 μm / s para las ratas UUO MWF de 5 semanas y UUO SD de 5 semanas, respectivamente. Al examinar los asas capilares glomerulares, los glóbulos blancos adherentes fueron fácilmente visibles mientras se enfocaban a través del glomérulo. Se tomaron secciones ópticas tridimensionales de glomérulos individuales, y las primeras 10 secciones ópticas, separadas por 1 μm, para medir el número de glóbulos blancos adherentes. Las ratas MWF no tratadas prácticamente no tenían glóbulos blancos visibles en sus volúmenes, con un promedio de menos de 0,125 ± 0,05 glóbulos blancos / 10 secciones ópticas desde la parte superior, tomadas a pasos de 1 μm. En ratas UUO MWF y SD de 5 semanas, estos números aumentaron a 1.5 ± 0.5 y 3.25 ± 0.7 WBC / 10 secciones ópticas desde la parte superior, tomadas a pasos de 1 μm, respectivamente. Estos resultados se muestran en el gráfico del panel E, con inserciones de color que muestran glóbulos blancos que ocluyen bucles capilares. Las formaciones de Rouleaux (flechas, insertadas en el panel F) aparecen como glóbulos rojos estrechamente unidos en una configuración de "moneda apilada" que conserva en gran medida su agrupación agrupada incluso en la turbulencia del flujo sanguíneo. Estas estructuras patológicas eran fácilmente discernibles a mayores profundidades dentro del glomérulo. Las ratas MWF operadas por simulacro carecían en gran medida de estas estructuras, teniendo solo 0.05 ± 0.05 ocurrencias a 25 secciones ópticas de la parte superior, tomadas a pasos de 1 μm de volumen glomerular. En contraste, el UUO de 5 semanas en ratas MWF y SD tuvo un marcado aumento en las formaciones de Rouleaux con ocurrencias de 2.27± 0.46 y 1.46 ± secciones ópticas de 0.73/25 desde la parte superior, tomadas a pasos de 1 μm, respectivamente. Barras de escala = 20 μm, n = 3 ratas macho por grupo. Las barras de error indican la desviación estándar. Abreviaturas: UUO = obstrucción ureteral unilateral; SD = Sprague-Dawley; MWF = Munich Wistar Frömter; RBC = glóbulo rojo; WBC = glóbulo blanco. Haga clic aquí para ver una versión más grande de esta figura.
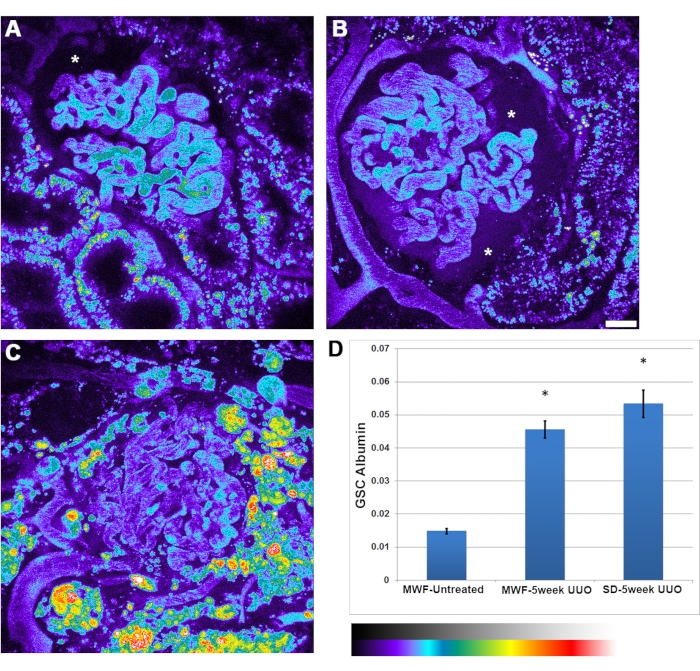
Figura 4: Aumento significativo de la permeabilidad a la albúmina capilar glomerular después de la UUO de 5 semanas. Los paneles A, B y C muestran imágenes pseudocolor de un volumen 3D para el canal de albúmina sérica de rata en ratas MWF no tratadas, UUO MWF de 5 semanas y UUO SD de cinco semanas, respectivamente. Las imágenes se presentan en una paleta de pseudocolores para resaltar la cantidad apreciable de albúmina filtrada que se ve en el espacio de Bowman, particularmente en el panel B (asterisco). (A) El espacio de Bowman (asterisco) muestra el nivel normal de albúmina típicamente visto en ratas MWF no tratadas, indiscernible para el ojo. Las imágenes de glomérulos se tomaron antes de la infusión de albúmina para restar los valores de fluorescencia de fondo de los tomados después de la administración de albúmina. (D) Un gráfico con el coeficiente de tamizado glomerular para albúmina en ratas MWF no tratadas, con un valor de 0,015 ± 0,002. Este valor aumentó significativamente a 0.045± 0.05 en ratas UUO MWF de 5 semanas y 0.052 ± 0.075 en ratas UUO SD de cinco semanas. Este parámetro es un valor relativo de las intensidades fluorescentes del espacio de Bowman dividido por el valor del plasma y no tiene una unidad de medida asociada. Barra de escala = 20 μm, n = 3 ratas macho por grupo. La escala de intensidad de pseudocolor se encuentra debajo del panel D. Las barras de error indican la desviación estándar. Abreviaturas: UUO = obstrucción ureteral unilateral; SD = Sprague-Dawley; MWF = Munich Wistar Frömter; RBC = glóbulo rojo; WBC = glóbulo blanco. Haga clic aquí para ver una versión más grande de esta figura.
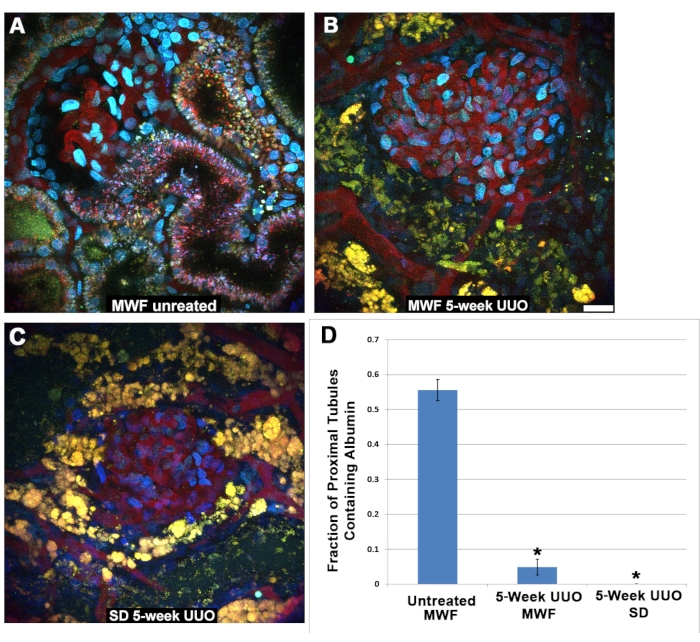
Figura 5: Función reducida en túbulos proximales después de la UUO de 5 semanas. (A) Una imagen de un glomérulo superficial y el segmento S1 de una rata Wistar Frömter normal de Munich tomada 40 minutos después de la infusión de TR-RSA y dextrano azul en cascada. La internalización del TR-RSA se puede ver en el segmento S1 y el túbulo proximal. En marcado contraste, las ratas MWF (B) y las ratas SD (C), sometidas a UUO de 5 semanas, muestran túbulos proximales severamente alterados con una absorción mínima o nula de TR-RSA. Los lisosomas autofluorescentes (A) normalmente pequeños y punteados se convierten en estructuras grandes, vacuolares de color amarillo-naranja, a menudo con un colapso completo de la luz tubular, que no se puede encontrar en los conjuntos de datos tridimensionales. (C) Los túbulos distales normalmente desprovistos de cualquier forma de autofluorescencia ahora contienen acumulaciones autofluorescentes. La puntuación de los túbulos proximales que rodean los glomérulos en imágenes similares tomadas 45-60 minutos después de la infusión, para la absorción de albúmina, mostró una diferencia significativa entre el grupo MWF operado con simulacro y ambos grupos de UUO de 5 semanas. Las ratas MWF no tratadas tuvieron un valor de captación fraccional del túbulo proximal de 0,556 ± 0,126. Tanto las ratas UUO MWF como SD a cinco semanas tuvieron valores significativamente más bajos de 0.049 ± 0.126 y 0.00 ±0.00, respectivamente. Barra de escala = 20 μm, n = 3 ratas macho por grupo. Las barras de error indican la desviación estándar. Abreviaturas: UUO = obstrucción ureteral unilateral; SD = Sprague-Dawley; MWF = Munich Wistar Frömter; RBC = glóbulo rojo; WBC = glóbulo blanco; TR-RSA = albúmina sérica de rata roja de Texas. Haga clic aquí para ver una versión más grande de esta figura.
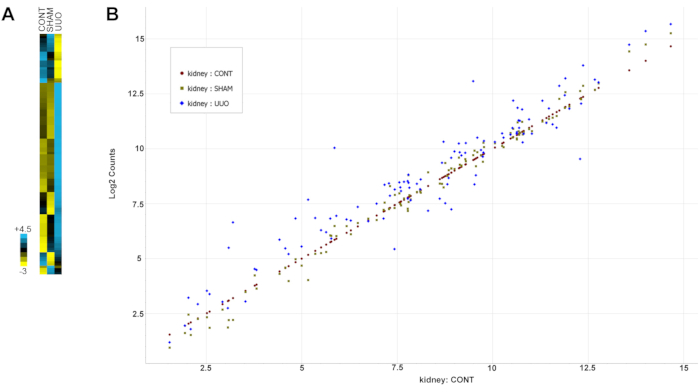
Figura 6: Alteraciones de la expresión génica con UUO . (A) Un mapa de calor de los datos. (B) Cambios genéticos normalizados para todos los datos en un diagrama de dispersión. La expresión de genes en los riñones de control se trazó de baja a alta expresión, y los genes de los riñones SHAM y UUO se compararon con los niveles de expresión de control. Los puntos de datos genéticos que caen cerca del valor diagonal de los genes de control indican niveles de expresión similares para ambos grupos, mientras que los puntos de datos por encima o por debajo de la diagonal indican niveles de expresión más altos o más bajos, respectivamente. Tenga en cuenta que los genes SHAM se agrupan más cerca de la expresión diagonal de control que los genes UUO, que son más variables. Abreviatura: UUO = obstrucción ureteral unilateral. Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1: Progresión de la lesión de 5 a 12 semanas de UUO. Comparación de los parámetros de imagen UUO de 5 y 12 semanas en tres ratas MWF macho y tres ratas macho SD en cada punto de tiempo. Los datos de cinco semanas son los mismos que en las cifras anteriores. Nótese el aumento de la densidad glomerular y de la GSC para la albúmina con UUO continuada. Abreviaturas: UUO = obstrucción ureteral unilateral; SD = Sprague-Dawley; MWF = Munich Wistar Frömter; GSC = coeficiente de tamizado glomerular. Haga clic aquí para descargar esta tabla.
Tabla 2: Análisis de marcadores de inflamación en glomérulos de UUO y ratas control. Los pares de sondas genéticas y CodeSets fueron diseñados y utilizados según las indicaciones de NanoString. Se analizaron más de 100 genes, además de controles positivos y negativos según lo especificado por Nanostring. Todos los genes (sondas) con su expresión agrupada y valores de SD se muestran en la tabla. La Figura 6A es un mapa de calor de los datos, mientras que la Figura 6B presenta los cambios genéticos para todos los datos en un diagrama de dispersión. Tenga en cuenta las similitudes entre los controles y SHAM y los distintos cambios para la mayoría de los genes en el UUO. Abreviaturas: UUO = obstrucción ureteral unilateral; DE = desviación estándar. Haga clic aquí para descargar esta tabla.
Discusión
El estudio de la fisiología glomerular ha visto muchos enfoques diferentes, especialmente el uso de micropunción, perfusión de glomérulos aislados y microscopía. La disponibilidad de glomérulos superficiales en ratas Wistar de Múnich, cepas Fromter y Simonsen, ha permitido estudios dinámicos in vivo . Una nota importante para los investigadores que adoptan esta tecnología es la necesidad de establecer parámetros de adquisición para mantener imágenes consistentes entre los estudios, de modo que la autofluorescencia en el tejido permanezca constante. Utilizar un cubo de epifluorescencia de fluoresceína/rodamina de doble paso y ajustar la configuración de ganancia a los canales de emisión verde y rojo para imitar en la pantalla de la computadora lo que se ve a través de los oculares asegurará una firma de color consistente en la autofluorescencia incluso entre diferentes sistemas de microscopio.
La cepa de Fromter ha sido ampliamente utilizada ya que tiene un número reducido de glomérulos totales, ~75% normal, y los varones desarrollan espontáneamente hipertensión alrededor de las 12 semanas de edad, con proteinuria progresiva y posterior esclerosis glomerular focal, muriendo finalmente de insuficiencia renal12. El uso de estas ratas y la adición de microscopía de 2 fotones con su fototoxicidad reducida, profundidad de penetración mejorada y la capacidad de ver múltiples sondas fluorescentes simultáneamente allanaron el camino para nuevos descubrimientos 1,4,5. Con el desarrollo de hardware y software informático, los datos cuantitativos son ahora el estándar para todos los laboratorios de 2 fotones. Se han desarrollado múltiples técnicas cuantitativas y aplicadas a procesos glomerulares, tubulales proximales, vasculares e intersticiales en condiciones fisiológicas y de enfermedad 1,4,5,27,28,29,30.
Las instalaciones generadoras de ratones transgénicos agregaron una nueva dimensión al estudio de la fisiología y patología renal, y era solo cuestión de tiempo hasta que esto se combinara con microscopía de 2 fotones para delinear aún más la importancia de productos genéticos específicos en la estructura y función renal. Sin embargo, los glomérulos de ratón, excepto en ratones muy jóvenes, se encuentran a más de 100 μm de la superficie del riñón9. La microscopía de dos fotones se realiza mejor a una profundidad de entre 20 y 50 μm como resolución, y la intensidad de fluorescencia disminuye rápidamente a partir de entonces debido a la dispersión de la luz emitida y la absorción de la interacción con la hemoglobina. Por lo tanto, fue necesario inducir glomérulos superficiales. El enfoque comúnmente utilizado es un modelo de obstrucción unilateral prolongada durante 12 semanas. Como estos modelos no permiten determinaciones de línea de base, no es posible separar los efectos de la UUO del proceso que se está estudiando.
Usando ratas MWF, se puede comparar la función glomerular basal con la siguiente UUO. Se sabe que este modelo UUO induce inflamación y una tasa rápida de fibrosis y se ha utilizado para estudiar la ERC y la fibrosis10,11,12. Como se esperaba, hubo un aumento en los glomérulos superficiales tanto en las ratas MWF como en SD. Además, los resultados cuantitativos obtenidos después de UUO para las ratas MWF y SD fueron muy comparables. La reducción en el flujo sanguíneo registrada aquí había sido reportada previamente comparando datos microscópicos después de UUO con datos de micropunción3. También era bien sabido que la histología tubular e intersticial está marcadamente alterada, y los TP son en su mayoría no funcionales, como se informa aquí, con una falta de endocitosis de albúmina. Los estudios en la Figura 2 y la Figura 3 muestran una reducción dramática en la tasa de flujo de glóbulos rojos en capilares glomerulares y peritubulares y una mayor adhesión de leucocitos. Las reducciones en el flujo probablemente se deban al bloqueo capilar de la adhesión de leucocitos y las formaciones de rouleaux.
Para evaluar aún más la inflamación, cuantificamos la permeabilidad a la albúmina y mostramos que aumenta diez veces. Además, los glomérulos aislados mostraron que la expresión del ARNm aumentó para muchos genes previamente conocidos por aumentar la inflamación renal en una variedad de estados de enfermedad renal 17,19,20,21,22,23,24,25,26 . Los aumentos en la densidad superficial glomerular y la permeabilidad a la albúmina fueron progresivos, como lo muestran los datos de UUO de 12 semanas. Los datos actuales son los primeros en mostrar directamente que los glomérulos sufren daños estructurales significativos, inflamación y cambios moleculares en el modelo UUO. Los resultados son consistentes con un estudio anterior de tejido renal completo que analizó biopsias de riñón de ovejas después de UUO, encontrando múltiples marcadores de inflamación elevados19. Los resultados actuales indican que existe una marcada inflamación dentro de los glomérulos, previamente conocida solo para el tejido cortical.
Los datos actuales difieren de estudios anteriores en ratones donde no se encontraron cambios en la expresión de la molécula de adhesión, la deposición del complemento y la infiltración de neutrófilos entre los glomérulos posthidronefróticos y normales de 12 semanas31. Además, el laboratorio de Hickey utilizó el modelo UUO de 12 semanas para estudiar las reacciones inmunes en glomérulos de ratones. No encontraron diferencias en la infiltración de neutrófilos entre los glomérulos de ratón de cuatro semanas de edad y los glomérulos postobstructivos32,33. Estos estudios posteriores se realizaron después de que la pelvis del riñón obstruido se drenó de orina. No hicimos esto porque queríamos determinar el efecto de UUO sobre la función glomerular como sería in vivo, sin eliminar artificialmente el líquido que causa la obstrucción. Finalmente, el uso de UUO en ratones está siendo reemplazado por glomérulos de imágenes a más de 100 μm debajo de la superficie. Si bien es posible, hay una compensación de resolución e intensidad, ambas se reducen significativamente a medida que uno va más allá de 50 μm34.
Los resultados presentados no son sorprendentes si se juntan los datos de la literatura existente sobre cambios histológicos, formación de glomérulos atubulares, inflamación, fibrosis, hemodinámica10,11,12. Los datos presentados, incluida la adhesión de leucocitos, las formaciones de rouleaux, los marcadores de inflamación molecular glomerular y el aumento de la permeabilidad a la albúmina, indican además la extensa inflamación que está en curso en este modelo UUO incluso a las cinco semanas y también presente a las doce semanas. Claramente, la UUO crónica no es un estado fisiológico, y el uso de UUO para inducir glomérulos superficiales representa un modelo de lesión. Las ratas MWF, que tienen glomérulos superficiales en condiciones fisiológicas, pueden estudiarse longitudinalmente a medida que se produce una lesión. Es posible generar ratas transgénicas, y numerosos investigadores las están creando con biosensores para hacer preguntas específicas. En particular, el Colegio Médico de Wisconsin ahora tiene una colonia de ratas MWF y ha hecho ratas transgénicas con el propósito de estudiar procesos glomerulares en condiciones fisiológicas y patológicas. Estas ratas MWF ofrecen una gran oportunidad para estudiar procesos glomerulares en ratas normales, enfermas y genéticamente alteradas.
Divulgaciones
Los autores no tienen conflictos de intereses.
Agradecimientos
Este trabajo fue apoyado por el Instituto Nacional de Diabetes y Enfermedades Digestivas y Renales Subvenciones RO1DK091623 y P30DK079312 (a B.A.M.). Agradecemos al personal de la Instalación Central de Genómica de la Instalación de Apoyo a la Tecnología de Investigación (RTSF) de la Universidad Estatal de Michigan por realizar el análisis de Nanostring.
Materiales
| Name | Company | Catalog Number | Comments |
| 70 µm sterile cell strainer | Corning | #421751 | |
| 100 µm sterile cell strainer | Corning | #421752 | |
| CA Micro scissors Model 1C300 | Electron Microscopy Sciences | Cat# 72930 | |
| Electric heating pad | Sunbeam | Kroger | |
| Handling Forceps | Electron Microscopy Sciences | Cat# 72962 | |
| Kelly Hemostatic Forceps (straight) | Electron Microscopy Sciences | Cat#72930 | |
| Leica Dive SP-8 Multi-Photon Inverted Microscope | Leica Microsystems | Note: Version 7.1r1 | |
| MaiTai DeepSee titanium-sapphire laser | Spectra-Physics | NA | |
| Mayo Dissecting Scissors | Electron Microscopy Sciences | Cat# 78180-1C3 | |
| Metamorph Image processing Software | Molecular Dynamics | Cat# 78266-04 | |
| Microsoft Excel | Microsoft Corportation | 2007 version | |
| Quant-iT RNA Assay Kit | Invitrogen/ThermoFisher | Q33140 | |
| Reptitherm Undertank Heater | Zoomed | Amazon | |
| RNeasy MinElute Cleanup Kit (Spin columns) | Qiagen | 74204 | |
| RPE buffer | Qiagen | 1018013 | |
| Strate-Line Autoclave Tape | Fisher Scientific | Cat# 11-889-1 | |
| TRI Reagent | Sigma | T9424 | |
| Willco-dish Coverslip Bottom Dishes (50 mm/40 mm coverslip) | Electron Microscopy Sciences | Cat# 70665-07 |
Referencias
- Dunn, K. W., Molitoris, B. A., Dagher, P. C. The Indiana O'Brien center for advanced renal microscopic analysis. American Journal of Physiology-Renal Physiology. 320 (5), 671-682 (2021).
- Dunn, K. W., et al. Functional studies of the kidney of living animals using multicolor two-photon microscopy. American Journal of Physiology-Cell Physiology. 283 (3), 905-916 (2002).
- Eisenbach, G., Liew, J., Boylan, J., Manz, N., Muir, P. Effect of angiotensin on the filtration of protein in the rat kidney: a micropuncture study. Kidney International. 8 (2), 80-87 (1975).
- Sandoval, R. M., Molitoris, B. A. Intravital multiphoton microscopy as a tool for studying renal physiology and pathophysiology. Methods. 128, 20-32 (2017).
- Sandoval, R. M., Molitoris, B. A., Palygin, O. Fluorescent imaging and microscopy for dynamic processes in rats. Methods in Molecular Biology. 2018, 151-175 (2019).
- Huber, T., et al. Molecular basis of the functional podocin-nephrin complex: mutations in the NPHS2 gene disrupt nephrin targeting to lipid raft microdomains. Human Molecular Genetics. 12 (24), 3397-3405 (2003).
- Kawachi, H., Koike, H., Kurihara, H., Sakai, T., Shimizu, F. Cloning of rat homologue of podocin: expression in proteinuric states and in developing glomeruli. Journal of the American Society of Nephrology JASN. 14 (1), 46-56 (2003).
- Roselli, S., et al. Early glomerular filtration defect and severe renal disease in podocin-deficient mice. Molecular and Cellular Biology. 24 (2), 550-560 (2004).
- Schießl, I., Bardehle, S., Castrop, H. Superficial nephrons in BALB/c and C57BL/6 mice facilitate in vivo multiphoton microscopy of the kidney. PloS One. 8 (1), 52499 (2013).
- Chevalier, R., Forbes, M., Thornhill, B. Ureteral obstruction as a model of renal interstitial fibrosis and obstructive nephropathy. Kidney International. 75 (11), 1145-1152 (2009).
- Forbes, M., Thornhill, B., Chevalier, R. Proximal tubular injury and rapid formation of atubular glomeruli in mice with unilateral ureteral obstruction: a new look at an old model. American Journal of Physiology. Renal physiology. 301 (1), 110-117 (2011).
- Yang, H. -. C., Zuo, Y., Fogo, A. B. Models of chronic kidney disease. Drug Discovery Today. Disease Models. 7 (1-2), 13-19 (2010).
- Hackl, M. J., et al. Tracking the fate of glomerular epithelial cells in vivo using serial multiphoton imaging in new mouse models with fluorescent lineage tags. Nature Medicine. 19 (12), 1661-1666 (2013).
- Kitching, A., Kuligowski, M., Hickey, M. In vivo imaging of leukocyte recruitment to glomeruli in mice using intravital microscopy. Methods in Molecular Biology. 466, 109-117 (2009).
- Savin, V. J., Terreros, D. A. Filtration in single isolated mammalian glomeruli. Kidney International. 20 (2), 188-197 (1981).
- Chomczynski, P., Sacchi, N. The single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction: twenty-something years on. Nature Protocols. 1 (2), 581-585 (2006).
- El Karoui, K., et al. Endoplasmic reticulum stress drives proteinuria-induced kidney lesions via Lipocalin 2. Nature Communications. 7, 10330 (2016).
- VA, M., et al. Multiplexed measurements of gene signatures in different analytes using the Nanostring nCounter Assay System. BMC Research Notes. 2, 80 (2009).
- Springer, A., et al. A combined transcriptome and bioinformatics approach to unilateral ureteral obstructive uropathy in the fetal sheep model. The Journal of Urology. 187 (2), 751-756 (2012).
- Braun, F., Becker, J., Brinkkoetter, P. Live or let die: Is there any cell death in podocytes. Seminars in Nephrology. 36 (3), 208-219 (2016).
- Kim, W. The role of angiopoietin-1 in kidney disease. Electrolyte & Blood Pressure E & BP. 6 (1), 22-26 (2008).
- Liu, F., Zhuang, S. Role of receptor tyrosine kinase signaling in renal fibrosis. International Journal of Molecular Sciences. 17 (5), 972 (2016).
- Martini, S., et al. Integrative biology identifies shared transcriptional networks in CKD. Journal of the American Society of Nephrology: JASN. 25 (11), 2559-2572 (2014).
- Mühlberger, I., et al. Integrative bioinformatics analysis of proteins associated with the cardiorenal syndrome. International Journal of Nephrology. 2011, 809378 (2010).
- Satirapoj, B., et al. Periostin: novel tissue and urinary biomarker of progressive renal injury induces a coordinated mesenchymal phenotype in tubular cells. Nephrology, Dialysis, Transplantation. 27 (7), 2702-2711 (2012).
- Fengxin, Z., et al. Numb contributes to renal fibrosis by promoting tubular epithelial cell cycle arrest at G2/M. Oncotarget. 7 (18), 25604-25619 (2016).
- Sandoval, R. M., Molitoris, B. A. Quantifying glomerular permeability of fluorescent macromolecules using 2-photon microscopy in Munich Wistar rats. Journal of Visualized Experiments: JoVE. (74), e50052 (2013).
- Russo, L. M., et al. Impaired tubular uptake explains albuminuria in early diabetic nephropathy. Journal of the American Society of Nephrology: JASN. 20 (3), 489-494 (2009).
- Russo, L. M., et al. The normal kidney filters nephrotic levels of albumin retrieved by proximal tubule cells: retrieval is disrupted in nephrotic states. Kidney International. 71 (6), 504-513 (2007).
- Sandoval, R. M., Wang, E., Molitoris, B. A. Finding the bottom and using it: Offsets and sensitivity in the detection of low intensity values in vivo with 2-photon microscopy. Intravital. 2 (1), 23674 (2014).
- Kuligowski, M. P., Kitching, A. R., Hickey, M. J. Leukocyte recruitment to the inflamed glomerulus: a critical role for platelet-derived P-selectin in the absence of rolling. Journal of Immunology. 176 (11), 6991-6999 (2006).
- Devi, S., et al. Multiphoton imaging reveals a new leukocyte recruitment paradigm in the glomerulus. Nature Medicine. 19 (1), 107-112 (2013).
- Finsterbusch, M., et al. Patrolling monocytes promote intravascular neutrophil activation and glomerular injury in the acutely inflamed glomerulus. Proceedings of the National Academy of Sciences of the United States of America. 113 (35), 5172-5181 (2016).
- Shroff, U. N., Gyarmati, G., Izuhara, A., Deepak, S., Peti-Peterdi, J. A new view of macula densa cell protein synthesis. American Journal of Physiology. Renal Physiology. 321 (6), 689-704 (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados