Method Article
2光子ホログラフィック顕微鏡を用いた神経活動の評価と操作
要約
神経活動の異常に伴う精神神経疾患の病態解明を目指し、高い時空間分解能で神経活動を可視化・評価・操作できる2光子ホログラフィック顕微鏡を開発しました。
要約
近年の光バイオイメージングやオプトジェネティクスの進歩により、生きた動物における細胞活動を含む生命現象の可視化と操作が可能になりました。神経科学の分野では、学習や記憶などの脳機能に関わる詳細な神経活動が明らかになり、この活動を人工的に操作して脳機能を発現させることも可能になりました。しかしながら、従来の2光子Ca2+ イメージングによる神経活動の評価は、時間分解能が低いという課題があった。また、従来の光遺伝学による光ファイバーを介した神経活動の操作は、同じ遺伝的背景を持つニューロンの活動を同時に制御することしかできず、個々のニューロンの活動を制御することは困難です。この問題を解決するために、我々は最近、オプトジェネティクスとフェムト秒赤外線レーザービームを修飾できるデジタルホログラフィック技術を組み合わせることにより、生物学的応用のための高時空間分解能の顕微鏡を開発しました。ここでは、サンプルの調製や2光子ホログラフィック顕微鏡の操作など、神経活動の可視化、評価、操作のためのプロトコルについて説明します(図1)。これらのプロトコルは、神経活動に関する正確な時空間情報を提供し、神経活動の異常につながる精神神経疾患の病態解明に役立つ可能性があります。
概要
二光子Ca2+イメージングは、神経活動の評価に有用な技術です。正常な動物の行動や記憶に必要な神経活動だけでなく1,2だけでなく、神経精神疾患のマウスモデルで発生する異常な神経活動3,4を特定するためにも使用できます。この技術は、脳機能の神経基盤を解明するために使用されてきました。しかし、高解像度で高品質な画像を提供することはできますが、その時間分解能は電気生理学的方法1,3よりも低くなります。
オプトジェネティクスは、神経科学者が脳機能を理解する方法を革新するのに役立ちました5。技術的な限界を考えると、光遺伝学的研究の大部分は、低い空間分解能の活性化スキームを使用しており、それに応じて実行できる神経活動の操作の種類を制限しています。しかし、より細かい時空間スケールで神経活動を操作することは、神経計算と神経精神障害の病因をより完全に理解するのに役立つ可能性があります。フェムト秒近赤外線レーザービームを成形できる空間的に正確なホログラフィック技術は、この課題を克服することを約束し、以前は不可能だったいくつかの新しい実験クラスを開きます6,7。この技術により、神経科学者は、これまで手の届かない感覚、認知、行動の神経コードの基本的な側面と病理を明らかにすることができます。
ホログラフィック投影は、個々の細胞および機能ネットワークに選択的にアクセスするための所望の光パターンの生成を含む。in vivo実験では、生きている脳の標的細胞への最適な光透過率が必要です。赤外光は生体組織の奥深くまで浸透し、非線形2光子励起(2PE)8,9,10に使用できます。したがって、ホログラフィック投影と2PEを組み合わせた2光子ホログラフィック顕微鏡を使用して、神経活動を評価および操作して、in vivoの細胞および機能ネットワークを調べることができます。近年の2光子ホログラフィック顕微鏡の生物学的応用により、視覚野11,12、嗅球13、海馬14における学習に必要な神経活動や回路が解明されてきている。
世界中の多くの研究所が、ホログラフィック刺激システムを使用してエキサイティングな結果と改善を報告しています15、16、17、18、19、20、21、22、23。ここで説明するシステムでは、ホログラフィック刺激システムは、従来の顕微鏡のアドオンデバイスとして構築できます。位相のみの空間光変調器(SLM)は、平面波面を任意の形状に変調するための重要なデバイスであり、干渉効果を使用して焦点の強度と位置を制御します。図2は、ホログラフィック刺激とイメージング光路を示しています。第1の光路はポイントスキャンイメージングモード用で、スキャンヘッドと画像検出器で構成されています。第2の光路は、1040nmの波長を有するホログラフィック刺激用であり、SLM1からなる。第3の光路は波長920nmのホログラフィック照明用で、SLM2とイメージセンサーで構成されています。ホログラフィックイメージングモードは、サンプル内の複数のポイントを照らすことによって、複数の関心領域からの強度を記録することができます。このようにして、記録速度を毎秒数百フレームに上げることができる。ポイントスキャンイメージングまたはホログラフィック照明イメージングを実現するために、920nmレーザーは、3:7の固定比率のビームスプリッターによって2つのパスに分割されました。全ての光学素子は、600mm×600mmの寸法を有する光学ブレッドボード上に位置合わせされた。変調された光は顕微鏡体の側面にある光ポートから入り、点走査された撮像光は顕微鏡体の上部にあるスキャンヘッドを通って入射した。これらの光は対物レンズのすぐ上に統合され、サンプル面に焦点を作成しました。さらに、カスタムメイドのソフトウェアにより、通常のワークフローをシンプルで一貫性のあるものにすることができました。
この記事では、ホログラフィック刺激または照明を使用して神経活動を測定し、ニューロン間の機能的接続性を評価するための完全なプロトコルを紹介します。デモンストレーションのために、マウス脳の一次体性感覚皮質(S1HL)の後肢領域を対象とした脳手術と、2光子ホログラフィック顕微鏡を使用して神経活動を評価および操作する方法について説明します。実験手順は4つの部分に分かれています。まず、ヘッドプレートを歯科用セメントを用いてマウスの頭蓋骨に固定した。次に、jGCaMP8fまたはGCaMP6m-P2A-ChRmineを発現するウイルスベクターをS1HLに定位的に注入した。第三に、ホログラフィック刺激または照明システムを較正した。第四に、これら2つのタンパク質の術後の回復と発現後、 in vivo Ca2+ イメージングを実施し、2光子ホログラフィック顕微鏡でニューロン間の神経活動と機能的接続を評価しました。
プロトコル
すべての実験プロトコルは、名古屋大学大学院医学系研究科動物管理・使用委員会で承認されました(承認番号:M220295-003)。
1.ヘッドプレート埋め込み(図1A)
- 麻酔薬(74 mg / kgケタミンと10 mg / kgキシラジンの混合物)を腹腔内に投与して、マウスに麻酔をかけます。.ペダル反射を評価して、マウスの麻酔状態を頻繁にチェックしてください。
- 麻酔後、マウスを定位固定装置に入れます。ヘッドプレートを埋め込んだときに角膜が乾燥するのを防ぐために、目の軟膏( 材料の表を参照)を塗布します。
- 手術部位を剃り、ポビドンヨードまたはクロルヘキシジンスクラブを交互に3回投与した後、70%アルコールワイプで皮膚を消毒します。頭蓋骨を慎重に露出させ、綿棒で拭きます。
注:すべての手術器具は滅菌する必要があり、すべての手順はそれに応じて実行する必要があります。残っている破片(髪の毛や乾燥した血液など)は炎症反応を引き起こします。.したがって、破片は、滅菌水または70%アルコールで湿らせた綿棒を使用してステレオスコープで取り除く必要があります。 - 定位座標(前部と後部= 0.5 mm、内側と外側= 1.5 mm)を使用して開頭術の中心を見つけ、マーカーペンでラベルを付けます。
- 頭蓋骨の中央にカスタムメイドのヘッドプレートを配置します。次に、歯科用セメント( 材料表を参照)を塗布して頭蓋骨にしっかりと固定します。ヘッドプレートが頭蓋骨の前面と背面にしっかりと接触するまで、軽い圧力をかけます。
注:このステップは完了するまでに約20分かかり、2光子イメージング中の脳内のモーションアーチファクトを減らすために重要です。ヘッドプレートの寸法は20mm×40mm×1mmで、一方の端部が長さ15mm、隣接する2つの辺が長さ3mm、残りの2辺が長さ10mmのホームプレート形状の開口部があります。 - アクリルベースの歯科用接着性レジンセメントを次のように混ぜ合わせます:半分のスプーンの粉末、3滴の液体、および1滴の触媒( 材料の表を参照)。乾燥を防ぐために、この混合歯科用接着性レジンセメントをマウスの頭蓋骨表面にヘッドプレートで塗布します。
- 麻酔から回復するまで、マウスを暖かいケージに入れます。胸骨横臥を維持するのに十分な意識を取り戻すまで、マウスを放置しないでください。.
2.手術とアデノ随伴ウイルス(AAV)注射(図1B)
- 頭板移植の1日後に頭蓋骨から歯科用接着性レジンセメントを除去せずに開頭術またはウイルス注入を行います。
注:この手順では、麻酔(74 mg / kgケタミンと10 mg / kgキシラジンの混合物)をマウスの腹腔内に投与します。. - 脳浮腫を避けるために、手術の1時間前にデキサメタゾンリン酸ナトリウム(1.32 mg / kg)を腹腔内投与します。.
- 加熱パッドで体温を維持しながら、気化器(麻酔送達システム)を使用して1%イソフルラン麻酔でヘッドプレートでマウスを麻酔します。角膜の乾燥を防ぐために目の軟膏を塗ります。
- ステレオスコープの下で、歯科用ドリルを使用して直径約2mmの円形開頭術を行います。脳の損傷を減らすために、一定のわずかな動きと軽い下向きの圧力で歯科用ドリルを慎重に操作してください。
- 吸引システムを使用して骨片を数回取り除きます。骨片を取り除いた後、人工脊髄液(ACSF)溶液を使用して、脳表面に残っている破片を取り除き、洗い流します。炎症反応を抑制するために、この洗浄手順を数回繰り返します。
注:ACSF溶液(140 mM NaCl、2.5 mM KCl、5 mM HEPES、2.0 mM CaCl 2、および1.0 mM MgCl2)は、試薬を溶解してろ過した後、4°Cで1か月間保存しました(孔径= 0.22 μm)。 - 圧力注入システム( 材料表を参照)を使用して、適切な圧力(4ミリ秒のパルスで約10 PSI)を設定し、先端直径10〜20 μmのガラスキャピラリー(マイクロピペットプーラーで調製)から500 nLのAAV溶液を10分間注入します。
- ガラス毛細血管内のAAV溶液のレベルが徐々に低下するかどうかを確認することにより、AAV溶液が脳に投与されているかどうかを判断します。
- 逆流を防ぐために、ガラスキャピラリーをさらに10分間そのままにしておきます。3回繰り返して、合計1.5μLのAAV溶液を脳に投与します。
- 層2/3(L2/3)錐体細胞の神経活動を評価および操作するには、AAV溶液(Ca2+イメージングの場合:AAV2 / 1-Syn-jGCaMP8f-WPRE、1.28 × 10 14ベクターゲノム/ mL、生理食塩水で1:1に希釈、オプトジェネティクスによるCa2+イメージング:AAV2 / 8-CaMKII-GCaMP6m-P2A-ChRmine-Kv2.1-WPRE、1.73 × 10 14ベクターゲノム/ mL、生理食塩水で1:1に希釈)を野生型マウスの一次体性感覚皮質の後足領域に注入します(S1、 ブレグマから後方0.5 mm、横方向に1.5 mm、表面から150 μmの深さを中心とする)。
注:AAV溶液は、jGCaMP8fおよびGCaMP6m-P2A-ChRmine発現のイメージングの2〜3週間前および1〜2週間前に注射する必要があります。 - マイクロピペットを使用してS1の脳表面に2%(w / v)の低融点アガロースを塗布した後、2つのカバーメガネで開頭術の上にガラス窓を置きます。2つのカバーガラス(直径2.0 mmの小と直径4.5 mmの大、 材料の表を参照)をUV硬化型接着剤で取り付けます。
- カバーガラスを液体のままアガロースに押し付けます。これにより、アガロース中の気泡の形成が防止される。頭蓋窓の端を歯科用および接着性レジンセメントでシールします(図1C)。
- 脳定位固定装置からマウスを取り外し、ケージに戻します。マウスを暖かいケージに入れ、麻酔から完全に回復するまで他の動物と一緒にケージに戻らないでください。生存手術中は無菌状態を慎重に維持してください。
- 手術後の最初の72時間は、一般的な行動を観察してマウスの健康状態を確認します。一般的な行動に異常がある場合は、抗炎症剤や鎮痛剤を皮下注射してください。
3.ホログラフィック刺激または照明システムの準備(図3)
- 赤色蛍光スライド(キャストアクリル基板)の表面をサンプル平面に配置して、ホログラフィック刺激システムを較正します。顕微鏡を弱い励起光でライブイメージングモードにし、calibration_GUI.mファイルを実行します。パラメータペインを確認し、[ 保存 ]ボタンをクリックします。
- ステップ1ペインの [Zスキャン ]ボタンをクリックします。各平面から2μm離れた21の軸面すべてに3つのランダムなスポットを自動的に生成します。
- スライドバーを動かしてライブ画像を確認します。スポットが最も小さく、最も明るく表示される完璧な平面を見つけて、[ 保存 ]ボタンをクリックします。これにより、デジタルホログラムのオフセット球面が自動的に生成されます。
注意: 最も明るい蛍光スポットが見つからない場合は、スキャン範囲の最小値と最大値を変更して、再試行してください。 - 手順 2 ウィンドウの [ 移動 ] ボタンをクリックし、左側の四角形の 6 つのスポットをクリックします。ライブ画像を確認してください。識別可能な蛍光スポットが 6 つある場合は、編集ボックスに x 軸と y 軸を入力し、[ 保存 ] ボタンをクリックします。これにより、ホログラフィック刺激とイメージングシステム間のキャリブレーションを調整するためのアフィン変換係数が自動的に生成されます。
注: 軸ペア番号とクリックしたスポット番号は、順番に一致させる必要があります。よくわからない場合、または画像にスポットがない場合は、再試行して一意のスポットパターンを生成するか、視野(FOV)の中心付近の狭い範囲を選択してください。 - ステップ3ペインの[ スキャン ]ボタンをクリックします。441個のデジタルホログラムを生成し、21×21ステップでFOV全体でシングルスポットスキャンを実行します。
- まずはリストボックスでパターンを変えながら画像を確認します。次に、レーザー出力を調整して、イメージングデバイスのダイナミックレンジ内のスポット画像を取得します(たとえば、過度に飽和した画像を避けるため)。
- 続いて、編集ボックスで間隔時間を調整します。間隔時間は、記録間隔時間の 2 倍以上である必要があります。最後に、イメージングデバイスを記録モードにして、[ 再生 ]ボタンをクリックします。再生が完了すると、コマンドウィンドウに「表示OK」文字列が表示されます。記録を停止し、最大強度法を使用して記録された連続画像を積み重ねます。
- ステップ4ペインで[ WMの生成 ]をクリックし、上からスタック画像を選択します。次に、calibration_GUIウィンドウを閉じます。各スポットの不均衡な強度を補正するために、ウェイトマップが自動的に生成されます。
注:より詳細な説明については、 2を参照してください。Matlabコードはここからダウンロードできます(https://github.com/ZenKG/SLM_control)。
4. ホログラフィック照明付きイメージセンサを用いたCa2+ イメージング(図4)
- AAVを注入したマウスをヘッドプレート付き顕微鏡下に置きます(図1D)。
注:この手順の間、マウスは覚醒状態で拘束されますが、不快な刺激から逃れることができます。 - ホログラフィック顕微鏡と、25倍の対物レンズで920 nmに調整されたモードロックされたTi:サファイアレーザーを使用して、2光子イメージング(ポイントスキャンモード)を実行します( 材料表を参照)。
- 市販のイメージングソフトウェアの電源を入れます(「 材料表」を参照)。ライブイメージングモードでは、画像検出器の電圧( 材料の表を参照)とイメージングレーザーの出力を調整して、jGCaMP8fを発現するニューロンの明るさを最適化します。このタンパク質を発現しているニューロンの画像をキャプチャします。
注意: イメージングレーザーの強度(920 nm)は20〜30 mWです。FOVは、皮質表面から100〜150μmの深さで512μm×512μmであった。 - ホログラフィック照明でjGCaMP8fを発現する特定のニューロンを照らすには、SLMcontrol.mスクリプトファイルを実行します。参照画像をクリックし、上記で取得した 画像 を選択します。次に、[ スポット ]ボタンをクリックして、マウスを連続クリックして画像内のニューロン上の特定のピクセルを選択します(図4A)。選択が完了したら、キーボードの Enter ボタンを押して確定します。
注意: デジタルホログラムは自動的に計算され、SLMに表示されます。このパターンは、リスト ボックスをクリックして再確認することもできます。SLMによって生成された単一スポットの空間分解能は、横方向で約1.2 μm、光軸に沿って~8.3 μmでした。開口数(1.1)の高い対物レンズを使用して、より局所的なホログラフィック刺激を実現しました。 表1 は、ホログラフィック刺激の空間分解能に関する以前の報告およびこのシステムを要約したものである。 - イメージセンサを使用して高い時間分解能で神経活動を検出するには( 材料表を参照)、画像取得を実行する前に、露光時間、イメージング領域、およびビニング(図4B)を設定します(図4C)。
注:1つのニューロンを継続的に刺激するホログラフィック照明レーザー(920 nm)の強度は2 mWであり、これは神経活動を検出するのに十分です。たとえば、イメージングのフレームレートを100Hzにするには、露光時間を9ms、イメージング領域を400μm×400μm、ビニングを4にします。 - 実験後、マウスをホームケージに戻します。
5. ホログラフィック顕微鏡を用いたオプトジェネティクスによる2光子イメージング(ポイントスキャンモード)(図2)
- 手順 4.1 と 4.2 を繰り返します。
- 市販のイメージングソフトウェアの電源を入れます(「 材料表」を参照)。ライブイメージングモードでは、画像検出器の電圧( 材料の表を参照)とイメージングレーザーの出力を調整して、GCaMP6m-P2A-ChRmineを発現するニューロンの明るさを最適化します。これらのタンパク質を発現しているニューロンの画像をキャプチャします(図1E)。
- 手順 4.4 を繰り返します。
- L2/3ニューロン内の機能的接続を調べるには、SLMを使用して光遺伝学的刺激のホログラフィックパターン(ChRmine;1,040 nm)を生成し、それを2光子Ca2+イメージング(GCaMP6m;920 nm、512 × 512ピクセル、2 Hzまたは30 Hz、2倍デジタルズーム、ポイントスキャンモード;図 4D-H)。
- このプロトコルでは、イメージングレーザーの強度を920 nm、10〜20 mWに設定し、FOVを皮質表面から100〜150 μmの深さで測定した256 μm×256 μmに設定します。ピクセル滞留時間を、2 Hz の場合は 1.5 μs、30 Hz の場合は 100 ns に設定します。
- 単一のホログラフィック刺激がニューロンにカルシウム応答を引き起こしたかどうかを確認するには、イメージングフレームレートとして2Hzと30Hzの両方を使用します。単一のニューロンを刺激するホログラフィック刺激レーザー(1,040 nm)の強度を、神経活動を誘導するのに十分な10 mWに設定します(図4D)。
注:SLMによって生成される単一スポットの空間分解能は、横方向で約1.2μm、光軸に沿って~8.3μmです。横方向のアクセス可能な体積の範囲は、軸方向に約500μm×500μm、100μm程度です。さらに、2 Hzまたは30 HzのイメージングフレームレートでのCa2+ イメージングにより、1つのニューロンだけでなく、複数のニューロンを同時にホログラフィックで刺激できることを確認しました(図4E)。
- 次のプロトコルで画像取得を実行します:ベースライン期間10秒後、50ミリ秒の持続時間で、1,040 nmで10のホログラフィック刺激で920 nmのCa2+応答を同時にイメージングします(0.125 Hz)。すべての実験が完了した後、マウスは安楽死させる。
注:Ca2+トランジェントが存在する場合、ホログラフィック刺激によって誘発され、刺激後1秒以内にピークが現れます(図4F-H)。
6. 機能コネクティビティの画像解析と評価(図4)
- ImageJを使用して、手順4.5または5.5で保存した生の画像を開きます。焦点面の変位を補正するには、ImageJ プラグインの TurboReg を使用します。
注意: TurboRegによる補正が不十分な場合は、CaImAn(http://github.com / simonsfoundation)を使用して焦点面の変位を補正することをお勧めします。 - 神経活動を評価するには、自動アルゴリズム(CaImAn)を使用してL2/3の関心領域(ROI)を決定します。ベースライン蛍光強度(F0)および閾値を定義した後にCa2+過渡現象を検出および分析する。
注:F0は、ベースラインイメージング期間中に取得された蛍光強度の35番目のパーセンタイル値です。Ca2+トランジェントはΔF/F 0(ΔF = F-F0)で表され、Fは瞬時蛍光シグナルです。Δ F値がF0から2 S.D.を超える場合、有意なCa2+過渡現象を評価します。 - L2/3ニューロンの機能的結合を定義するには、標的ニューロンを刺激し、それに応じて刺激されたニューロンおよび周囲のニューロンにおけるGCaMP6m応答を測定します(図4F-H)。
結果
ここで説明する方法を使用して得られた代表的な記録が提示されます。 生体内 ホログラフィック顕微鏡を使用したCa2+ イメージングは、ヘッドプレートの埋め込みとAAV注入からデータ取得まで完了するまでに2〜4週間かかります。したがって、安定した結果を得るためには、脳内の運動アーチファクトを減らすことが重要です。ヘッドプレートの移植(ステップ1.5)と頭蓋窓の配置(ステップ2.9)は、このプロセスの非常に重要なステップです。さらに、カルシウム指示薬とオプシンを同時に発現するAAV(AAV2/8-CaMKII-GCaMP6m-P2A-ChRmine-Kv2.1)を選択することも重要です(ステップ2.8)。
図4Aは、カスタムメイドのMATLABスクリプトを使用して取得したニューロン画像のホログラフィック照明のスポットを示しています。ホログラフィック照明でjGCaMP8fを発現するニューロンの照射に成功すれば、図4Cに示すように、イメージセンサでCa2+トレースを得ることができます(図4B)。
ニューロン間の機能的連結性は、図4Eに示すように、ホログラフィック刺激を用いて評価した(図4D)。ニューロン間の機能的連結性は疼痛モデルマウス24の病因において変化する神経回路特性の1つであるため、それを評価するための簡単な手順を記載する。図4Fは、GCaMP6mを用いて可視化されたS1HLにおけるL2/3ニューロンの典型的な画像を示す。1つのニューロン(オレンジ色の円)がホログラフィックで刺激されると、別のニューロン(赤い円)が同時にアクティブになりました。したがって、ニューロン間の機能的結合の数は1つであった(図4G)。
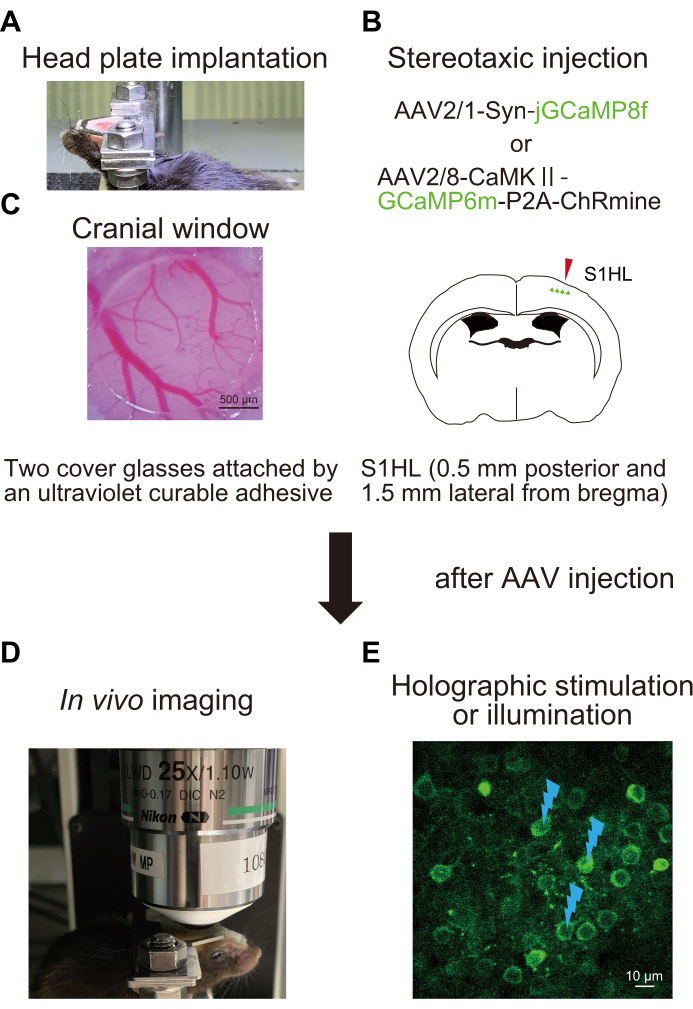
図1:実験手順の概略図。 (A)頭蓋骨へのヘッドプレートの固定。(B)一次体性感覚皮質(S1HL)の後足領域へのAAVの定位注射。(C)頭蓋窓の移植。神経活動を評価および操作するために、ホログラフィック刺激(E)を用いて、覚醒マウス(D)においてin vivoCa2+イメージングが行われる。フラッシュマークは、ホログラフィック刺激または照明を示します。この図の拡大版を表示するには、ここをクリックしてください。
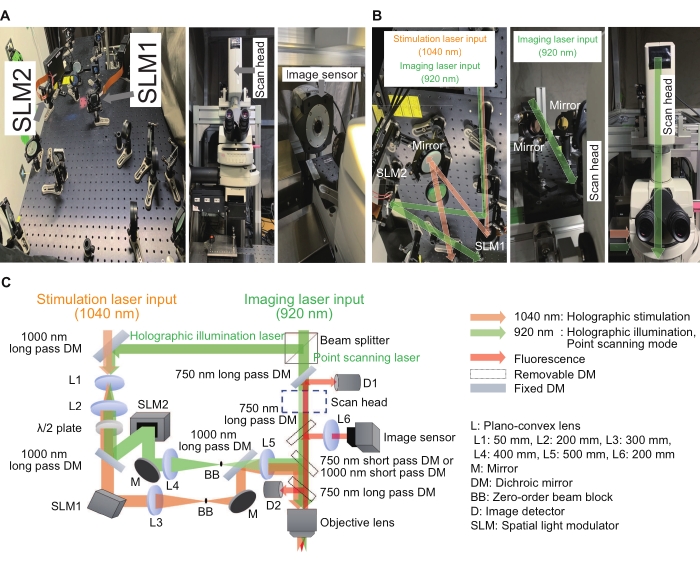
図2:ホログラフィック顕微鏡に使用したシステム 。 (A)イメージセンサー(右)を用いた顕微鏡(中央)付近のホログラフィック刺激・照明光路(左)の画像。(B)これらは、それぞれのSLMの周りのホログラフィック刺激および照明光路(左と右)とスキャンヘッドの周りのポイントスキャン光路(中央と右)の拡大画像です。(C)刺激およびイメージング光路の概略図。位相のみのSLMを使用してデジタルホログラムを表示し、ビームエキスパンダー(L1とL2の組み合わせ)と4fリレーシステム(ホログラフィック刺激用のL3とL4の組み合わせ、ホログラフィック照明用のL4とL5の組み合わせ)がそれぞれのSLMの前後に配置され、各デジタルホログラムが水浸対物レンズの出口瞳孔で確実に画像化されるようにします。 画像サイズがわずかに不足しています。残留ゼロ次成分を抑制するために、中間面にビームブロックを配置します。 この図の拡大版を表示するには、ここをクリックしてください。
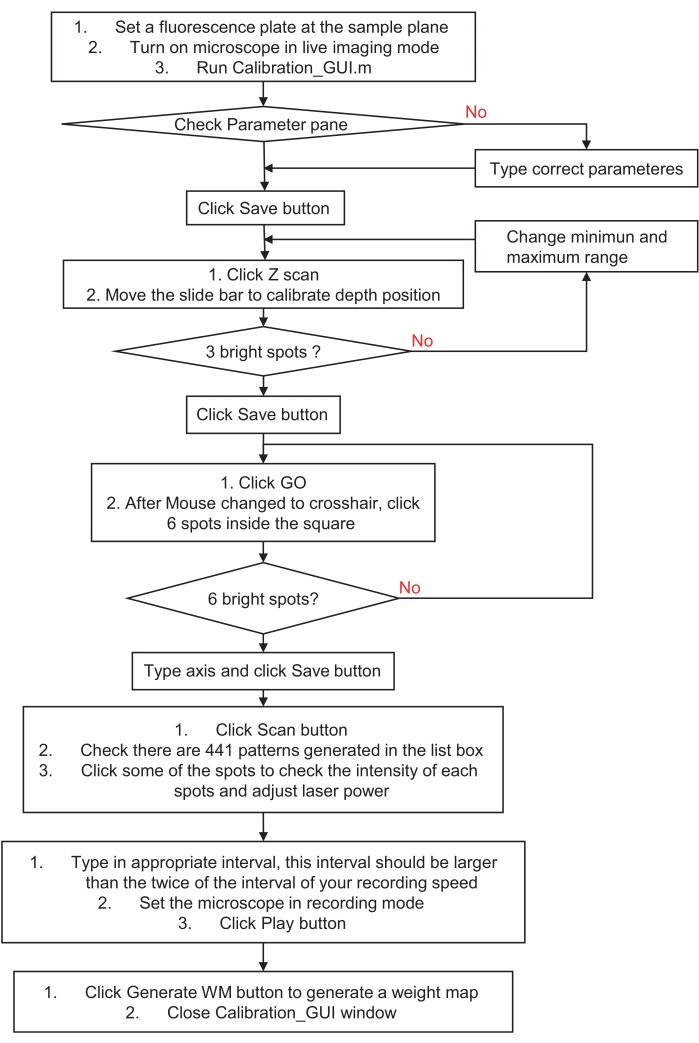
図3:ホログラフィック刺激または照明システムを較正する方法のフローチャート。 このフローチャートは、ホログラフィック刺激または照明システムを試料空間および画像化システムに較正するステップを説明する。詳細な手順については、ステップ3「ホログラフィック刺激または照明システムの準備」にアクセスし、サンプルプログラムをダウンロードしてください。 この図の拡大版を表示するには、ここをクリックしてください。
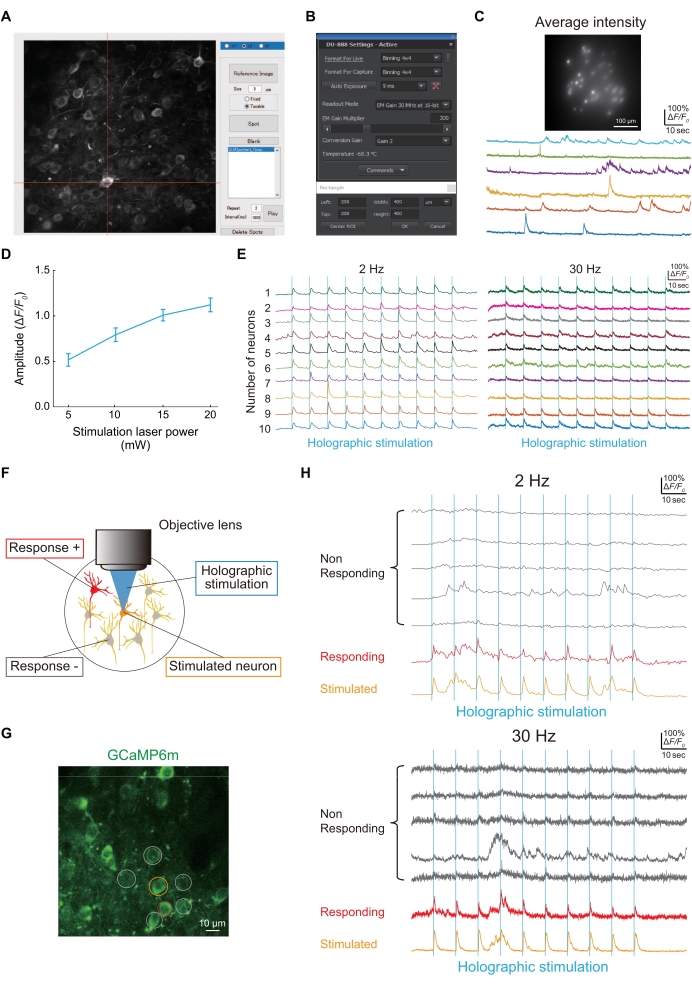
図4:ホログラフィック顕微鏡を用いたイメージングと機能的接続の代表的な結果 。 (A)jGCaMP8fまたはGCaMP6m-P2A-ChRmineを発現する特定のニューロンを照らすために、ニューロンの画像をキャプチャし、カスタムメイドのMATLABスクリプトを使用してニューロン上にスポットを形成します。(B)イメージセンサーの設定(露光時間、撮像領域、ビニング)。(C)ホログラフィック照明とイメージセンサーを用いた100HzイメージングにおけるjGCaMP8fを発現するニューロンの代表画像と痕跡。(D)このグラフは、各レーザーパワーでのホログラフィック刺激(1,040 nm)に対する神経応答を示しています(2 Hzイメージングフレームレート[n = 16]でニューロンを発現するGCaMP6m-P2A-ChRmineからのデータ)。エラーバーは平均の標準誤差を示します。(E)2 Hz(左)および30 Hz(右)のイメージングフレームレートでの10個の異なるニューロンのホログラフィック刺激(青い垂直線)中の代表的なCa2+ トレース。2 Hzおよび30 Hz Ca2+ トレースでは、同じ色が同じニューロンを示します。(F)ニューロン間の機能的接続を評価する模式図。オレンジ色のニューロンが刺激されると、赤色のニューロンが同時に応答し、これらのニューロン間に機能的な接続があることを示します。(G)WTスケールバー=10μmでGCaMP6mを発現するS1HLニューロンの典型的な画像。 (H)2 Hz(上)および30 Hz(下)のイメージングフレームレートでのホログラフィック刺激(青い垂直線)中の典型的なCa2+ トレース。刺激されたニューロンはオレンジ色で囲まれ、応答ニューロンは赤で囲まれ、応答しないニューロンは灰色で囲まれています。ホログラフィック刺激に対する神経応答性は、2Hzと30Hzの両方のイメージング速度で検出できます。 この図の拡大版を表示するには、ここをクリックしてください。
| 私たちのセットアップ 6 | プラカシュ、R.ら25 | マーシェル、J.H.他12 | ロビンソン、N.T.M.他14 | |
| 横方向の解像度 | 1.2ミクロン | 1.27 μm | ― | 2.22ミクロン |
| 軸方向分解能 | 8.3ミクロン | 56.86 マイクロメートル | 15.5 μm | 10.26 μm |
| 対物レンズ/絞り数 | 25倍速/1.1倍 | 20倍/0.5倍 | 16倍速/0.8倍 | 16倍速/0.8倍 |
表1:ホログラフィック刺激の空間分解能に関する以前の報告とこのシステムの要約。 横方向の分解能、軸方向の分解能、および測定中に使用された対物レンズについて説明します。
ディスカッション
脳機能を理解するためには、神経活動のダイナミクスを抽出し、脳機能の根底にある神経回路を正確に評価する必要があります。さらに、この神経回路がどのように変化しているかを明らかにすることは、精神神経疾患の病態解明に不可欠です。実際、アルツハイマー病4 や脆弱X症候群26 のマウスモデルや白質機能障害3のマウスでは神経活動が上昇することが知られている。さらに、炎症性疼痛のマウスモデルでは、神経活動とニューロン間の機能的接続性の同期の増加が症状24と関連している。2光子ホログラフィック顕微鏡は、神経回路を理解するために必要な個々のニューロンの活動とニューロン間の機能的接続を同時に観察することができます。口径数=1.1、波長1,040nmの25倍対物レンズを使用しました。理論上の点像分布関数は、横方向に0.5μm、軸方向に1.7μmの半値の全幅を持つガウス分布です。ただし、実際の開口数は1.1未満であり、蛍光ビーズで測定されたスポットサイズは横方向に1.2μm、軸方向に8.3μmです。ニューロンの直径が約15μmで、キャリブレーション誤差が3μm以内であることを考えると、ターゲティングは一般的に良好です。しかしながら、軸方向の細胞は、より長いスポットサイズ6の影響を受け得る。ここでは、ウイルス注入、手術、ホログラフィック刺激または照明システムのキャリブレーション、および顕微鏡システムを使用して生きたマウスの神経活動を評価および操作するためのイメージングプロトコルについて説明しました。
ヘッドプレートの移植やウイルス注入から、ホログラフィック顕微鏡を使用したin vivo Ca2+イメージングのデータ収集まで、すべての実験手順を完了するには2〜4週間かかります。このプロセスは複雑で面倒であり、実験の最終的な成功は、術後の炎症の影響を受ける頭蓋窓の状態、Ca2+インジケーターとオプシンの適切な選択、取得した画像のモーションアーチファクトを修正できるかどうかなど、複数の要因に依存します。特に、結果を成功させるには2つのステップが重要です。1つ目は、ヘッドプレートの固定と手術に関するものです。ヘッドプレートを歯科用セメントでマウスヘッドにしっかりと固定することが重要です。さらに、手術中は冷たいACSFを使用して骨片や凝固した血液を繰り返し洗浄することが重要です。この手順を順守すると炎症が軽減されるため、脳の免疫系に関与する細胞であるミクログリアのダイナミクスを、それらのプロセスや棘、またはニューロンの微細構造を活性化することなく観察することに成功しました27,28。第2の問題は、神経活動の評価と操作です。我々は、1つのニューロンでCa2+指示薬とオプシンを同時に発現させるためにAAV2/8-CaMKII-GCaMP6m-P2A-ChRmine-Kv2.1を選択しました。これは、異なるAAVタイプの1つのニューロンを効率的に感染させることが難しいためです。この選択のもう一つの理由は、ChRmineが2光子レーザー12を用いて1,040nmで神経活動を効率的に活性化できることである。最近、クライオ電子顕微鏡で得られた構造情報に基づいて構造を変異させることで、ChRmineの機能が向上することが報告されており29、神経科学分野の標的機能解析に有用であると考えられています。これらの問題を踏まえると、ホログラフィック顕微鏡を用いて神経活動を読み取ったり情報を書き込んだりする際に、神経細胞を評価・操作するための効果的な方法を共有する必要があります。
近年のイメージングやオプトジェネティクスの進歩により、学習や記憶などの脳機能に関わる詳細な神経活動が明らかになり、この神経活動を人工的に操作して脳機能を発現させることが可能である30。しかし、従来の神経活動操作法は、脳内に光ファイバーを挿入し、オプシン発現細胞群を同時に刺激するため侵襲性が高く、時間的・空間的な精度で神経活動を操作することが不可能でした。本手法では、脳内の特定の神経細胞のみを刺激することで神経活動を操作できるため、特定の刺激パターンと高い時空間分解能で神経活動を操作することができます。さらに、ニューロン間の機能的接続は、脳スライス実験31を使用して少数のニューロンでのみ評価できることに注意することが重要です。しかし、この技術により、生きている動物の複数のニューロンを同時に評価することができます。
現在のホログラフィック顕微鏡の主な制限の1つは、マウスの頭を固定する必要があるため、マウスの動作が制限されることです。最近、小型化された2光子顕微鏡が開発され32、デバイスのさらなる小型化に伴い、ホログラフィック刺激によるin vivoCa2+イメージングが自由移動マウスで可能になる可能性があります。さらに、この顕微鏡の可能性は、イメージングの時間分解能を向上させ、それを高感度の電位感受性蛍光タンパク質と組み合わせることによって拡大することができる33。
開示事項
著者は宣言する利益相反はありません。
謝辞
本研究は、科学研究費補助金 新学術領域研究(19H04753, 19H05219, 25110732 to H. W.)、科学研究費補助金 学術変革領域研究(A)(20H05899 to H. W., 20H05886 to O. M., 21H05587 to D. K.) 国際共同研究推進(B)(20KK0170 to H. W.)、科学研究費補助金 基盤研究(B)(18H02598 to H. W.) 科学研究費補助金 基盤研究(A) (21H04663 から O. M), 若手研究 (20K15193 から X. Q), JST CREST 課題 JPMJCR1755, JST A-STEP 課題番号 JPMJTR204C
資料
| Name | Company | Catalog Number | Comments |
| 25x Objective | Nikon | N25X-APO-MP | Objective |
| A1MP | Nikon | A1MP | Microscope |
| AnesII | Bio machinery | AnesII | Anesthesia delivery system |
| C2 plus | Nikon | C2 plus | Microscope |
| DECADRON Phosphate Injection | Aspen | 21N024 | Avoid cerebral edema |
| Dental Drill | Jota | C1.HP.005 | Dental drill |
| Electric Microinjector | NARISHIGE | IM-31 | Pressure injection system |
| FEATHERS | FEARGER | FA-10 | Shaving |
| G-CEM ONE ADHESIVE ENHANCING PRIMER | GC | 2110271 | Resin cement primer for dental adhesion |
| G-CEM ONE neo | GC | 43093 | Resin cement for dental adhesion |
| Glass Capillary with Filament | NARISHIGE | GDC-1 | Glass capillary |
| Image Detector | Hamamatsu | H10770PA-40 | GaAsP photocathode photomultiplier tube |
| Imaging Software | Nikon | NISelements | Imaging software |
| Isoflurane Inhalation Solution | Pfizer | 229KAR | Anesthetics |
| iXon EMCCD Camera | Andor | iXon Life 888 | Image sensor |
| Ketamine | daiitisannkyou | s9-018506 | Anesthetics |
| Leica-M60 | Leica | M60 | Stereoscope |
| Linicon | Linicon | LV-125 | Vacuum pump |
| Mode-locked Ti:sapphire Chameleon Ultra II laser | Coherent | Chameleon Discovery NX | Femtosecond laser |
| Mos-Cure | U-VIX | mini 365 | Portable LED UV Light Source |
| PEN Bright | SHOFU INC. | PEN Bright | Dental light curing unit |
| Puller | SUTTER instaument | P-97 | Puller |
| Stereotaxic Instrument (for Mice) | NARISHIGE | SR-6M-H | Stereotaxic instrument |
| Stereotaxic Micromanipulator | NARISHIGE | SM-15R | Stereotaxic micromanipulator |
| Super-Bond CATALYST V | SUN MEDICAL | 8070 | Dental adhesive resin cement |
| Super-Bond Dental Adhesive Monomer | SUN MEDICAL | 8071 | Dental adhesive monomer |
| Super-Bond Teeth Color Polymer Powder | SUN MEDICAL | 145052000 | Teeth color polymer powder |
| Tarivid Ophthalmic Ointment 0.3% | Santen Pharmaceutical | TRN3952 | Eye ointment |
| UlTIMATE XL | NSK | Y141446 | Dental laboratory micromotor control unit |
| UV Curing Optical Adhesives | THORLABS | NOA61 | UV Curing Optical Adhesives |
| Xylazine | Bayer | KP0F2BK | Anesthetics |
参考文献
- Masamizu, Y., et al. Two distinct layer-specific dynamics of cortical ensembles during learning of a motor task. Nature Neuroscience. 17 (7), 987-994 (2014).
- Peters, A. J., Chen, S. X., Komiyama, T. Emergence of reproducible spatiotemporal activity during motor learning. Nature. 510 (7504), 263-267 (2014).
- Kato, D., et al. Motor learning requires myelination to reduce asynchrony and spontaneity in neural activity. Glia. 68 (1), 193-210 (2020).
- Busche, M. A., et al. Tau impairs neural circuits, dominating amyloid-β effects, in Alzheimer models in vivo. Nature Neuroscience. 22 (1), 57-64 (2019).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8 (9), 1263-1268 (2005).
- Quan, X., Kato, D., Daria, V., Matoba, O., Wake, H. Holographic microscope and its biological application. Neuroscience Research. 179, 57-64 (2022).
- Adesnik, H., Abdeladim, L. Probing neural codes with two-photon holographic optogenetics. Nature Neuroscience. 24 (10), 1356-1366 (2021).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nature Methods. 2 (12), 932-940 (2005).
- Svoboda, K., Denk, W., Kleinfeld, D., Tank, D. W. In vivo dendritic calcium dynamics in neocortical pyramidal neurons. Nature. 385 (6612), 161-165 (1997).
- Carrillo-Reid, L., Han, S., Yang, W., Akrouh, A., Yuste, R. Controlling visually guided behavior by holographic recalling of cortical ensembles. Cell. 178 (2), 447-457 (2019).
- Marshel, J. H., et al. Cortical layer-specific critical dynamics triggering perception. Science. 365 (6453), (2019).
- Gill, J. V., et al. Precise holographic manipulation of olfactory circuits reveals coding features determining perceptual detection. Neuron. 108 (2), 382-393 (2020).
- Robinson, N. T. M., et al. Targeted activation of hippocampal place cells drives memory-guided spatial behavior. Cell. 183 (6), 1586-1599 (2020).
- Packer, A. M., Russell, L. E., Dalgleish, H. W., Häusser, M. Simultaneous all-optical manipulation and recording of neural circuit activity with cellular resolution in vivo. Nature Methods. 12 (2), 140-146 (2015).
- Mardinly, A. R., et al. Precise multimodal optical control of neural ensemble activity. Nature Neuroscience. 21 (6), 881-893 (2018).
- Yang, W., Carrillo-Reid, L., Bando, Y., Peterka, D. S., Yuste, R. Simultaneous two-photon imaging and two-photon optogenetics of cortical circuits in three dimensions. Elife. 7, 32671 (2018).
- Forli, A., et al. Two-photon bidirectional control and imaging of neuronal excitability with high spatial resolution in vivo. Cell Reports. 22 (11), 3087-3098 (2018).
- Pégard, N. C., et al. Three-dimensional scanless holographic optogenetics with temporal focusing (3D-SHOT). Nature Communications. 8 (1), 1228 (2017).
- Dal Maschio, M., Donovan, J. C., Helmbrecht, T. O., Baier, H. Linking neurons to network function and behavior by two-photon holographic optogenetics and volumetric imaging. Neuron. 94 (4), 774-789 (2017).
- Russell, L. E., et al. All-optical interrogation of neural circuits in behaving mice. Nature Protocols. 17 (7), 1579-1620 (2022).
- Oron, D., Papagiakoumou, E., Anselmi, F., Emiliani, V. Two-photon optogenetics. Progress in Brain Research. 196, 119-143 (2012).
- Hernandez, O., et al. Three-dimensional spatiotemporal focusing of holographic patterns. Nature Communications. 7, 11928 (2016).
- Okada, T., et al. Pain induces stable, active microcircuits in the somatosensory cortex that provide a therapeutic target. Science Advances. 7 (12), 8261 (2021).
- Prakash, R., et al. Two-photon optogenetic toolbox for fast inhibition, excitation and bistable modulation. Nature Methods. 9 (12), 1171-1179 (2012).
- Gonçalves, J. T., Anstey, J. E., Golshani, P., Portera-Cailliau, C. Circuit level defects in the developing neocortex of Fragile X mice. Nature Neuroscience. 16 (7), 903-909 (2013).
- Akiyoshi, R., et al. Microglia enhance synapse activity to promote local network synchronization. eNeuro. 5 (5), (2018).
- Haruwaka, K., et al. Dual microglia effects on blood brain barrier permeability induced by systemic inflammation. Nature Communications. 10 (1), 5816 (2019).
- Kishi, K. E., et al. Structural basis for channel conduction in the pump-like channelrhodopsin ChRmine. Cell. 185 (4), 672-689 (2022).
- Deisseroth, K. Optogenetics: 10 years of microbial opsins in neuroscience. Nature Neuroscience. 18 (9), 1213-1225 (2015).
- Ko, H., et al. The emergence of functional microcircuits in visual cortex. Nature. 496 (7443), 96-100 (2013).
- Zong, W., et al. Large-scale two-photon calcium imaging in freely moving mice. Cell. 185 (7), 1240-1256 (2022).
- Villette, V., et al. ultrafast two-photon imaging of a high-gain voltage indicator in awake behaving mice. Cell. 179 (7), 1590-1608 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved