Method Article
Avaliação e manipulação da atividade neural utilizando microscopia holográfica de dois fótons
Neste Artigo
Resumo
Desenvolvemos um microscópio holográfico de dois fótons capaz de visualizar, avaliar e manipular a atividade neural usando alta resolução espaço-temporal, com o objetivo de elucidar a patogênese de transtornos neuropsiquiátricos associados à atividade neural anormal.
Resumo
Avanços recentes em bioimagem óptica e optogenética têm possibilitado a visualização e manipulação de fenômenos biológicos, incluindo atividades celulares, em animais vivos. No campo da neurociência, a atividade neural detalhada relacionada às funções cerebrais, como aprendizagem e memória, foi agora revelada, e tornou-se viável manipular artificialmente essa atividade para expressar funções cerebrais. Entretanto, a avaliação convencional da atividade neural por imagens de Ca2+ de dois fótons tem o problema da baixa resolução temporal. Além disso, a manipulação da atividade neural pela optogenética convencional através da fibra óptica só pode regular simultaneamente a atividade de neurônios com o mesmo background genético, dificultando o controle da atividade de neurônios individuais. Para resolver esta questão, desenvolvemos recentemente um microscópio com alta resolução espaço-temporal para aplicações biológicas, combinando optogenética com tecnologia holográfica digital que pode modificar feixes de laser infravermelho de femtossegundo. Descrevemos protocolos para visualização, avaliação e manipulação da atividade neural, incluindo a preparação de amostras e operação de um microscópio holográfico de dois fótons (Figura 1). Esses protocolos fornecem informações espaço-temporais precisas sobre a atividade neural, que podem ser úteis para elucidar a patogênese de transtornos neuropsiquiátricos que levam a anormalidades na atividade neural.
Introdução
A imagem com Ca2+ de dois fótons é uma técnica útil para a avaliação da atividade neural. Ele pode ser usado para identificar não apenas a atividade neural necessária para o comportamento e a memória em animais normais1,2 mas também uma atividade neuronal anormal que ocorre em modelos murinos de transtornos neuropsiquiátricos 3,4. A técnica tem sido utilizada para elucidar as bases neurais das funções cerebrais. Entretanto, embora possa fornecer imagens de alta resolução e qualidade, sua resolução temporal é inferior à do método eletrofisiológico 1,3.
A optogenética tem ajudado a inovar a forma como os neurocientistas entendem a função cerebral5. Dadas as limitações técnicas, a maioria das pesquisas optogenéticas tem utilizado esquemas de ativação com baixa resolução espacial, limitando os tipos de manipulações da atividade neural que podem ser realizadas adequadamente. No entanto, a manipulação da atividade neural em escalas espaço-temporais mais finas pode ser potencialmente útil para uma compreensão mais completa da computação neural e da patogênese dos transtornos neuropsiquiátricos. A tecnologia holográfica espacialmente precisa que pode moldar feixes de laser infravermelho próximo a femtossegundos promete superar esse desafio e abre várias novas classes experimentais que antes eram impossíveis 6,7. Essa tecnologia permite que os neurocientistas descubram os aspectos fundamentais e patologias dos códigos neurais sensoriais, cognitivos e comportamentais que estão além do alcance.
A projeção holográfica envolve a geração de padrões de luz desejados para acessar células individuais e redes funcionais seletivamente. Experimentos in vivo requerem transmissão de luz ideal para células-alvo no cérebro vivo. A luz infravermelha penetra mais profundamente no tecido vivo e pode ser usada para excitação não linear de dois fótons (2PE)8,9,10. Assim, a microscopia holográfica de dois fótons, que combina projeção holográfica e 2PE, pode ser usada para avaliar e manipular atividades neurais para sondar redes celulares e funcionais in vivo. Aplicações biológicas recentes da microscopia holográfica de dois fótons têm elucidado a atividade neural e os circuitos necessários para o aprendizado no córtex visual 11,12, bulbo olfatório13 e hipocampo14.
Inúmeros laboratórios em todo o mundo têm relatado resultados e melhorias empolgantes utilizando seus sistemas de estimulação holográfica 15,16,17,18,19,20,21,22,23. No sistema aqui descrito, o sistema de estimulação holográfica pode ser construído como um dispositivo complementar para um microscópio convencional. O modulador de luz espacial somente de fase (SLM) é o dispositivo chave para modular uma frente de onda plana para qualquer forma, e o efeito de interferência é usado para controlar a intensidade e a localização dos focos. A Figura 2 mostra a estimulação holográfica e as imagens dos trajetos luminosos. O primeiro caminho de luz é para o modo de imagem de varredura pontual e consiste em uma cabeça de varredura e detectores de imagem. O segundo caminho de luz é para estimulação holográfica com comprimento de onda de 1040 nm e consiste em um SLM1. O terceiro caminho de luz é para iluminação holográfica com comprimento de onda de 920 nm e consiste em um SLM2 e um sensor de imagem. O modo de imagem holográfica pode registrar intensidades de várias regiões de interesse, iluminando vários pontos na amostra. Desta forma, a velocidade de gravação pode ser aumentada para algumas centenas de quadros por segundo. Para obter imagens de varredura pontual ou imagem de iluminação holográfica, o laser de 920 nm foi dividido em dois caminhos por um divisor de feixe com uma proporção fixa de 3:7. Todos os elementos ópticos foram alinhados sobre uma protoboard óptica com dimensões de 600 mm × 600 mm. A luz modulada entrou pela porta de luz no lado do corpo microscópico, enquanto a luz de imagem de varredura de ponto entrou pela cabeça de varredura no topo do corpo microscópico. Essas luzes foram integradas logo acima da lente objetiva e criaram focos no plano da amostra. Além disso, o software feito sob medida permitiu que o fluxo de trabalho regular fosse simples e consistente.
Neste artigo, um protocolo completo é apresentado para o uso de estimulação holográfica ou iluminação para medir a atividade neural e avaliar a conectividade funcional entre neurônios. Para fins de demonstração, descrevemos aqui uma cirurgia cerebral visando a área dos membros posteriores do córtex somatossensorial primário (S1HL) do cérebro de camundongos e um método para avaliar e manipular a atividade neural usando microscopia holográfica de dois fótons. O procedimento experimental é dividido em quatro partes. Primeiro, a placa cefálica foi fixada ao crânio do camundongo com cimento dental. Segundo, um vetor viral expressando jGCaMP8f ou GCaMP6m-P2A-ChRmine foi estereotaticamente injetado no S1HL. Terceiro, o sistema holográfico de estimulação ou iluminação foi calibrado. Quarto, após a recuperação pós-operatória e expressão dessas duas proteínas, imagens in vivo de Ca2+ foram realizadas para avaliar a atividade neural e a conectividade funcional entre neurônios com microscopia holográfica de dois fótons.
Protocolo
Todos os protocolos experimentais foram aprovados pelos Comitês de Cuidados e Uso de Animais da Escola de Pós-Graduação em Medicina da Universidade de Nagoya (número de aprovação: M220295-003).
1. Implantação da placa cefálica (Figura 1A)
- Administrar o anestésico (uma mistura de 74 mg/kg de quetamina e 10 mg/kg de xilazina) por via intraperitoneal para anestesiar o rato. Verifique o estado anestésico do mouse com frequência, avaliando os reflexos pediosos.
- Após a anestesia, coloque o mouse em um instrumento estereotáxico. Aplique uma pomada ocular (consulte Tabela de Materiais) para evitar que a córnea seque quando a placa da cabeça for implantada.
- Depilar a área cirúrgica e desinfetar a pele com três rodadas alternadas de esfoliação com iodopovidona ou clorexidina, seguidas de toalhetes com álcool a 70%. Exponha cuidadosamente o crânio e limpe-o com cotonetes.
NOTA: Todos os instrumentos cirúrgicos devem ser esterilizados, e todos os procedimentos devem ser realizados de acordo. Qualquer detrito remanescente (por exemplo, cabelo ou sangue seco) causa reações inflamatórias. Portanto, qualquer detrito deve ser removido sob um estereoscópio usando cotonetes umedecidos com água estéril ou álcool 70%. - Utilizar as coordenadas estereotáxicas - anterior e posterior = 0,5 mm, medial e lateral = 1,5 mm do bregma - para encontrar o centro da craniotomia e marcá-lo com caneta marcadora.
- Coloque uma placa de cabeça personalizada no centro do crânio. Em seguida, aplique cimento dentário (ver Tabela de Materiais) para fixá-lo firmemente ao crânio. Aplique uma leve pressão até que a placa da cabeça faça contato firme com a frente e a parte de trás do crânio.
NOTA: Esta etapa leva aproximadamente 20 minutos para ser concluída e é crítica para reduzir artefatos de movimento no cérebro durante imagens de dois fótons. As dimensões da placa de cabeça são de 20 mm × 40 mm × 1 mm com uma abertura em forma de home plate com uma borda de 15 mm de comprimento, dois lados adjacentes de 3 mm de comprimento e os dois lados restantes de 10 mm de comprimento. - Misture um cimento de resina adesivo dental à base de acrílico da seguinte forma: meia colher de pó, três gotas de líquido e uma gota de catalisador (consulte a Tabela de Materiais). Para evitar a secagem, aplique este cimento de resina adesivo dental misto na superfície intacta do crânio do rato com a placa da cabeça.
- Coloque o rato numa gaiola quente até recuperar da anestesia. Não deixe o rato sozinho até que ele tenha recuperado a consciência suficiente para manter a decúbito esternal.
2. Cirurgia e injeção do vírus adenoassociado (AAV) (Figura 1B)
- Realizar craniotomia ou injeção viral sem remoção do cimento adesivo dentário de resina do crânio 1 dia após o implante da placa cefálica.
NOTA: Administrar anestesia (uma mistura de 74 mg/kg de quetamina e 10 mg/kg de xilazina) por via intraperitoneal ao rato durante este procedimento. - Para evitar edema cerebral, administrar fosfato sódico de dexametasona (1,32 mg/kg) por via intraperitoneal 1 h antes da cirurgia.
- Anestesiar o camundongo com a placa cefálica com anestesia com isoflurano a 1% usando um vaporizador (sistema de administração de anestesia), mantendo a temperatura corporal com uma almofada de aquecimento. Aplique uma pomada ocular para evitar o ressecamento da córnea.
- Sob um estereoscópio, realizar uma craniotomia circular de aproximadamente 2 mm de diâmetro utilizando uma broca odontológica. Para reduzir os danos cerebrais, opere a broca dentária cuidadosamente com movimentos leves constantes e leve pressão para baixo.
- Remova os fragmentos ósseos várias vezes usando um sistema de sucção. Depois de remover os fragmentos ósseos, use uma solução de líquido espinhal artificial (ACSF) para remover e lavar quaisquer detritos remanescentes na superfície cerebral. Repita este procedimento de limpeza várias vezes para suprimir as reações inflamatórias.
NOTA: A solução de ACSF (NaCl 140 mM, KCl 2,5 mM, HEPES 5 mM, CaCl2 2,0 mM e MgCl2 1,0 mM) foi armazenada a 4 °C por 1 mês após o reagente ser dissolvido e filtrado (tamanho dos poros = 0,22 μm). - Usando um sistema de injeção de pressão (ver Tabela de Materiais), ajuste a pressão apropriada (cerca de 10 PSI em pulsos com duração de 4 ms) para injetar 500 nL de solução de AAV através de um capilar de vidro com um diâmetro de ponta de 10-20 μm (preparado com um puxador de micropipeta) por 10 min.
- Determine se a solução de AAV está sendo administrada ao cérebro, verificando se o nível da solução de AAV no capilar de vidro diminui gradualmente.
- Deixe o capilar de vidro no lugar por mais 10 minutos para evitar o refluxo. Repetir três vezes para administrar um total de 1,5 μL de solução de AAV no cérebro.
- Para avaliar e manipular a atividade neural em células piramidais da camada 2/3 (L2/3), injetar uma solução de AAV (para imagens de Ca 2+: AAV2/1-Syn-jGCaMP8f-WPRE a 1,28 ×10 14 genomas vetoriais/mL, diluída 1:1 em solução salina; para imagens de Ca2+ com optogenética: AAV2/8-CaMKII-GCaMP6m-P2A-ChRmine-Kv2.1-WPRE a 1,73 × 1014 genomas vetoriais/mL, diluídos 1:1 em solução salina) na área da pata traseira do córtex somatossensorial primário de camundongos selvagens (S1, centrado a 0,5 mm posterior e 1,5 mm lateral do bregma, a 150 μm de profundidade da superfície).
NOTA: A solução de AAV deve ser injetada em 2-3 semanas e 1-2 semanas antes da obtenção de imagens para expressão de jGCaMP8f e GCaMP6m-P2A-ChRmine, respectivamente. - Após uma aplicação de agarose de baixo derretimento a 2% (p/v) na superfície cerebral de S1 usando uma micropipeta, colocar uma janela de vidro sobre a craniotomia com dois vidros de cobertura. Fixe os dois vidros de cobertura (pequeno diâmetro de 2,0 mm e grande diâmetro de 4,5 mm; ver Tabela de Materiais) com adesivo curável por UV.
- Pressione o vidro da tampa contra a agarose enquanto ela ainda estiver líquida; Isso evita a formação de bolhas de ar na agarose. Selar as bordas da janela craniana com cimento resinoso dentário e adesivo (Figura 1C).
- Retire o mouse do instrumento estereotáxico e devolva-o à sua gaiola. Coloque o rato numa gaiola quente e não regresse à gaiola com outros animais até que tenha recuperado totalmente da anestesia. Manter cuidadosamente condições estéreis durante a cirurgia de sobrevivência.
- Para as primeiras 72 h após a cirurgia, verifique o estado de saúde do rato observando o comportamento geral. Se houver alguma anormalidade no comportamento geral, injetar agentes anti-inflamatórios e analgésicos por via subcutânea.
3. Preparação para o sistema holográfico de estimulação ou iluminação (Figura 3)
- Calibrar o sistema de estimulação holográfica colocando a superfície de uma lâmina de fluorescência vermelha (substrato acrílico fundido) no plano da amostra. Coloque o microscópio no modo de imagem ao vivo com uma luz de excitação fraca e execute o arquivo calibration_GUI.m. Verifique o painel de parâmetros e clique no botão Salvar .
- Clique no botão Z Scan no painel da etapa 1. Ele irá gerar automaticamente três pontos aleatórios em todos os 21 planos axiais, 2 μm de distância de cada plano.
- Mova a barra de slides e verifique a imagem ao vivo. Encontre um plano perfeito onde os pontos aparecem menores e mais brilhantes e, em seguida, clique no botão Salvar . Isso gerará automaticamente uma frente de onda esférica deslocada para o holograma digital.
Observação : se você não conseguir encontrar os pontos de fluorescência mais brilhantes, altere os valores mínimo e máximo do intervalo de varredura e tente novamente. - Clique no botão Ir no painel da etapa 2 e, em seguida, clique em seis pontos no quadrado esquerdo. Confira a imagem ao vivo. Se houver seis pontos de fluorescência distinguíveis, digite seus eixos x e y nas caixas de edição e clique no botão Salvar . Isso gerará automaticamente coeficientes de transformada afim para coordenar a calibração entre a estimulação holográfica e o sistema de imagem.
NOTA: O número do par de eixos e o número do ponto clicado devem ser correspondidos em ordem. Se não tiver certeza, ou se não houver pontos em sua imagem, tente novamente e gere um padrão de ponto exclusivo ou escolha um intervalo menor ao redor do centro do campo de visão (FOV). - Clique no botão Digitalizar no painel da etapa 3. Ele gerará 441 hologramas digitais para realizar a varredura de ponto único em todo o FOV em 21 × 21 etapas.
- Primeiro, verifique as imagens ao alterar padrões na caixa de listagem. Em seguida, ajuste a potência do laser para obter imagens pontuais dentro da faixa dinâmica do dispositivo de imagem (por exemplo, para evitar imagens excessivamente saturadas).
- Posteriormente, ajuste o tempo de intervalo na caixa de edição; O tempo de intervalo deve ser mais de duas vezes o tempo de intervalo de gravação. Finalmente, coloque o dispositivo de imagem no modo de gravação e clique no botão Reproduzir . Se a reprodução for concluída, haverá cadeias de caracteres "exibir OK" mostradas na janela de comando. Pare de gravar e empilhar imagens sequenciais gravadas usando o método de intensidade máxima.
- Clique em Gerar WM no painel da etapa 4 e escolha uma imagem empilhada acima. Em seguida, feche a janela calibration_GUI. Ele irá gerar automaticamente um mapa de peso para compensar a intensidade desequilibrada em cada ponto.
NOTA: Para uma descrição mais detalhada, consulte 2; o código Matlab pode ser baixado aqui (https://github.com/ZenKG/SLM_control).
4. Imagem de Ca2+ usando um sensor de imagem com iluminação holográfica (Figura 4)
- Coloque o camundongo injetado com AAV com uma placa cefálica sob o microscópio (Figura 1D).
NOTA: Durante este procedimento, o rato é contido no estado de vigília, mas é capaz de escapar a estímulos desconfortáveis. - Realize imagens de dois fótons (modo de varredura por pontos) usando um microscópio holográfico e um laser de Ti:safira bloqueado por modo sintonizado em 920 nm com uma objetiva de 25x (consulte a Tabela de Materiais).
- Ligue o software de imagem comercial (consulte a Tabela de Materiais). No modo de imagem ao vivo, ajuste a tensão do detector de imagem (consulte a Tabela de Materiais) e a potência do laser de imagem para otimizar o brilho dos neurônios que expressam jGCaMP8f. Capturar imagens dos neurônios que expressam essa proteína.
NOTA: A intensidade do laser de imagem (920 nm) é de 20-30 mW. O FOV foi de 512 μm × 512 μm a uma profundidade de 100-150 μm da superfície cortical. - Para iluminar neurônios específicos expressando jGCaMP8f com iluminação holográfica, execute o arquivo de script SLMcontrol.m. Clique na Imagem de Referência e escolha a imagem adquirida acima. Em seguida, clique no botão Spot para escolher pixels específicos nos neurônios na imagem clicando continuamente com o mouse (Figura 4A). Se a seleção estiver concluída, pressione o botão Enter no teclado para finalizá-la.
NOTA: O holograma digital é calculado automaticamente e exibido no SLM. Esse padrão também pode ser revisitado clicando em uma caixa de listagem. A resolução espacial de um único ponto gerado pelo MLS foi de aproximadamente 1,2 μm ao longo da direção transversal e ~8,3 μm ao longo do eixo óptico. Utilizamos uma lente objetiva de alta abertura numérica (1,1) para obter estimulação holográfica mais localizada. A Tabela 1 resume os relatos anteriores e este sistema com relação à resolução espacial da estimulação holográfica. - Para detectar atividade neural com alta resolução temporal usando um sensor de imagem (ver Tabela de Materiais), defina o tempo de exposição, a área de imagem e o binning (Figura 4B) antes de realizar a aquisição da imagem (Figura 4C).
NOTA: A intensidade do laser de iluminação holográfica (920 nm) que estimula continuamente um neurônio é de 2 mW, o que é suficiente para detectar a atividade neural. Por exemplo, para atingir uma taxa de quadros de 100 Hz para geração de imagens, o tempo de exposição é de 9 ms, a área de imagem é de 400 μm × 400 μm e o binning é de 4. - Após o experimento, devolva o camundongo à sua gaiola inicial.
5. Imagem de dois fótons (modo varredura pontual) com optogenética utilizando microscópio holográfico (Figura 2)
- Repita as etapas 4.1 e 4.2.
- Ligue o software de imagem comercial (consulte a Tabela de Materiais). No modo de imagem ao vivo, ajuste a tensão do detector de imagem (consulte Tabela de Materiais) e o poder do laser de imagem para otimizar o brilho dos neurônios que expressam GCaMP6m-P2A-ChRmine. Capturar imagens dos neurônios que expressam essas proteínas (Figura 1E).
- Repita a etapa 4.4.
- Para investigar a conectividade funcional dentro dos neurônios L2/3, use um SLM para gerar padrões holográficos de estimulação optogenética (ChRmine; 1.040 nm) e combiná-lo com imagens de Ca 2+ de dois fótons (GCaMP6m; 920 nm, 512 × 512 pixels, 2 Hz ou 30 Hz, zoom digital de2x, modo de varredura de pontos; Figura 4D-H).
- Para esse protocolo, definir a intensidade do laser de imagem para 920 nm, a 10-20 mW, e o FOV como 256 μm × 256 μm medido a uma profundidade de 100-150 μm da superfície cortical. Defina o tempo de permanência do pixel em 1,5 μs para 2 Hz ou 100 ns para 30 Hz.
- Para ver se um único estímulo holográfico causou uma resposta de cálcio nos neurônios, use 2 Hz e 30 Hz como taxa de quadros da imagem. Definir a intensidade do laser de estimulação holográfica (1.040 nm) que estimula um único neurônio a 10 mW, o que é suficiente para induzir a atividade neural (Figura 4D).
NOTA: A resolução espacial de um único ponto gerado pelo SLM é de aproximadamente 1,2 μm ao longo da direção transversal e ~8,3 μm ao longo do eixo óptico. A faixa de volume acessível na direção lateral é em torno de 500 μm × 500 μm e 100 μm na direção axial. Confirmamos ainda, com imagens de Ca2+ a 2 Hz ou 30 Hz, que não apenas um neurônio, mas vários neurônios podem ser estimulados holograficamente simultaneamente (Figura 4E).
- Realizar aquisição de imagens com o seguinte protocolo: imagear simultaneamente a resposta de Ca2+ a 920 nm com 10 estímulos holográficos a 1.040 nm com intervalos de 8 s (0,125 Hz) por uma duração de 50 ms após um período basal de 10 s. Depois que todos os experimentos são concluídos, os camundongos são eutanasiados.
OBS: Os transientes Ca2+, se presentes, foram evocados por estimulação holográfica, com seu pico aparecendo dentro de 1 s após a estimulação (Figura 4F-H).
6. Análise de imagens e avaliação da conectividade funcional (Figura 4)
- Abra as imagens raw salvas nas etapas 4.5 ou 5.5 usando o ImageJ. Para compensar o deslocamento do plano focal, use o plug-in ImageJ TurboReg.
NOTA: Se a correção com TurboReg não for suficiente, recomenda-se usar CaImAn (http://github.com/simonsfoundation) para corrigir o deslocamento do plano focal. - Para avaliar a atividade neural, determine as regiões de interesse (ROIs) em L2/3 usando um algoritmo automatizado (CaImAn). Detectar e analisar os transientes de Ca2+ após definir a intensidade de fluorescência basal (F0) e o valor limite.
NOTA: F0 é o valor percentil 35 da intensidade da fluorescência adquirida durante o período de imagem basal. Os transientes Ca2+ são denotados por Δ F/F 0 (Δ F = F-F0), onde F é o sinal de fluorescência instantânea. Se o valor de Δ F for superior a 2 S.D. de F0, avaliamos um transiente significativo de Ca2+. - Definir conectividade funcional em neurônios L2/3, estimular neurônios-alvo e medir respostas GCaMP6m em neurônios estimulados e adjacentes, de acordo (Figura 4F-H).
Resultados
Registros representativos obtidos pelo método aqui descrito são apresentados. In vivo A imagem de Ca2+ usando microscopia holográfica requer 2-4 semanas para ser concluída desde o implante da placa cefálica e injeção de AAV até a aquisição de dados. Portanto, para obter resultados estáveis, é importante reduzir os artefatos de movimento no cérebro. O implante da placa cefálica (passo 1.5) e a colocação da janela craniana (passo 2.9) são etapas muito importantes nesse processo. Além disso, também é importante selecionar um AAV (AAV2/8-CaMKII-GCaMP6m-P2A-ChRmine-Kv2.1) que expresse simultaneamente indicador de cálcio e opsina em um único neurônio (passo 2.8).
A Figura 4A mostra um ponto para a iluminação holográfica de uma imagem de neurônio adquirida usando um script MATLAB personalizado. Se a iluminação holográfica iluminasse com sucesso os neurônios que expressam jGCaMP8f, traços de Ca2+ poderiam ser obtidos com um sensor de imagem (Figura 4B), como mostrado na Figura 4C.
A conectividade funcional entre os neurônios foi avaliada por meio de estimulação holográfica (Figura 4D), como mostra a Figura 4E. Como a conectividade funcional entre neurônios é uma das propriedades dos circuitos neurais que se encontra alterada na patogênese de um camundongo modelo de dor24, descrevemos um procedimento simples para avaliá-la. A Figura 4F mostra uma imagem típica de neurônios L2/3 em S1HL visualizada usando GCaMP6m. Quando um neurônio (círculo laranja) foi estimulado holograficamente, outro neurônio (círculo vermelho) estava simultaneamente ativo; assim, o número de conectividades funcionais entre os neurônios foi de um (Figura 4G).
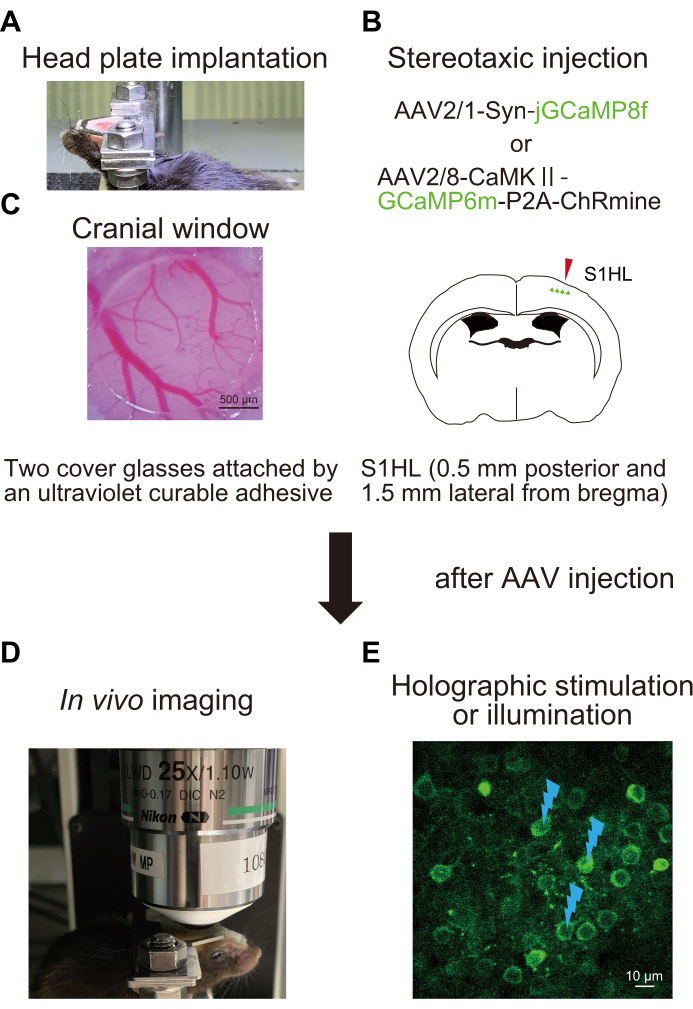
Figura 1: Esquema do procedimento experimental . (A) Fixação da placa cefálica ao crânio. (B) Injeção estereotáxica de AAV na área da pata posterior do córtex somatossensorial primário (S1HL). (C) Implante da janela craniana. Para avaliar e manipular a atividade neural, imagens in vivo de Ca2+ são realizadas em camundongos acordados (D) com estimulação holográfica (E). Marcas de flash indicam estimulação holográfica ou iluminação. Clique aqui para ver uma versão maior desta figura.
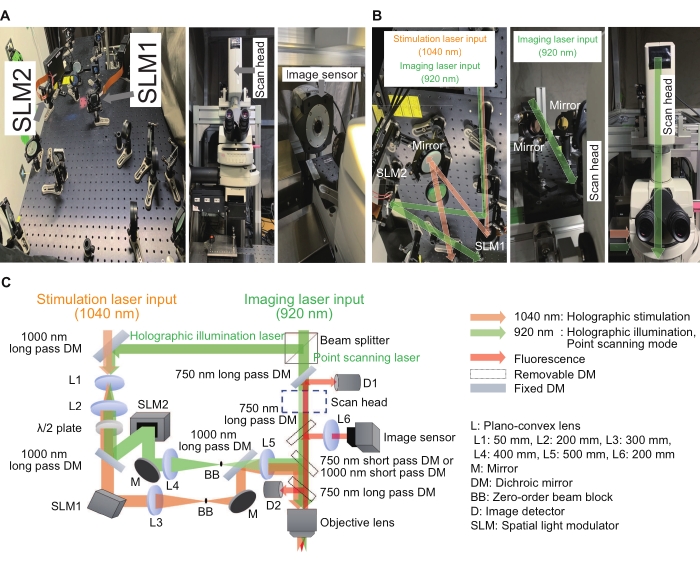
Figura 2: Sistema utilizado para o microscópio holográfico. (A) Imagens dos caminhos holográficos de estimulação e iluminação da luz (esquerda) próximo ao microscópio (meio) com sensor de imagem (direita). (B) São imagens ampliadas de estimulação holográfica e iluminação, caminhos de luz ao redor dos respectivos SLMs (esquerda e direita) e um ponto de varredura do caminho da luz ao redor de uma cabeça de varredura (meio e direita). (C) Um esquema das vias ópticas de estimulação e imagem. SLMs somente de fase são usados para exibir hologramas digitais, e um expansor de feixe (uma combinação de L1 e L2) e um sistema de relé 4f (uma combinação de L3 e L4 para estimulação holográfica e L4 e L5 para iluminação holográfica) são colocados antes e depois dos respectivos SLMs para garantir que cada holograma digital seja fotografado na pupila de saída de uma lente objetiva de imersão em água, com tamanho de imagem ligeiramente subpreenchido. Para suprimir componentes residuais de ordem zero, um bloco de feixe é colocado no plano intermediário. Clique aqui para ver uma versão maior desta figura.
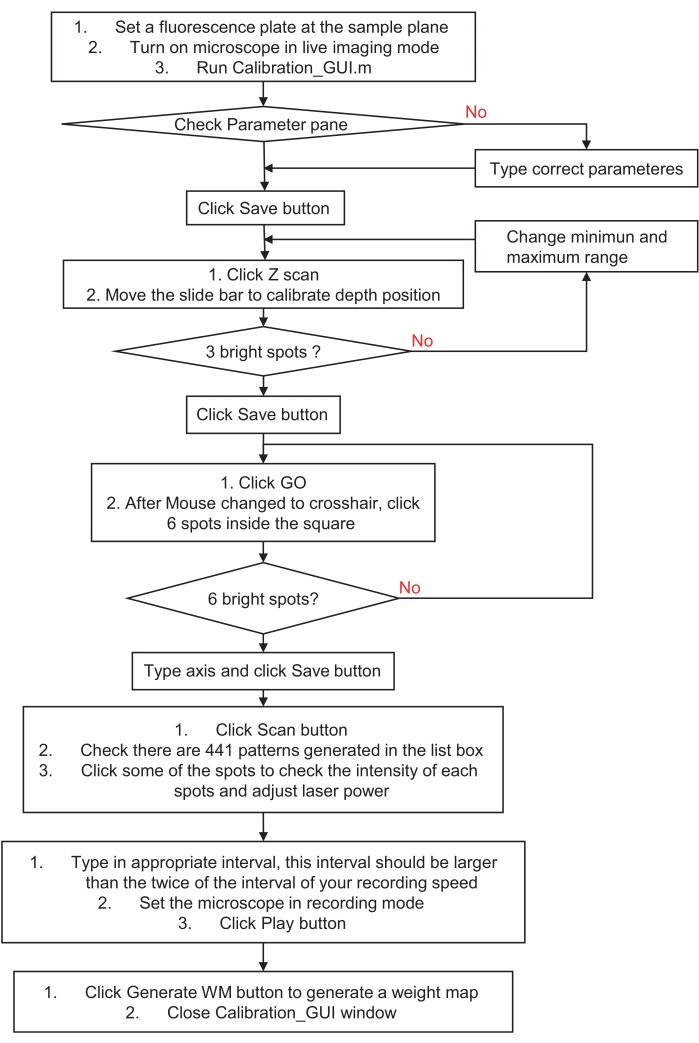
Figura 3: Fluxograma de como calibrar o sistema holográfico de estimulação ou iluminação. Este fluxograma descreve as etapas para calibrar um sistema holográfico de estimulação ou iluminação para o espaço da amostra e o sistema de imagem. Visite a etapa 3, preparação para o sistema de estimulação holográfica ou iluminação, para obter instruções detalhadas e baixar um programa de amostra. Clique aqui para ver uma versão maior desta figura.
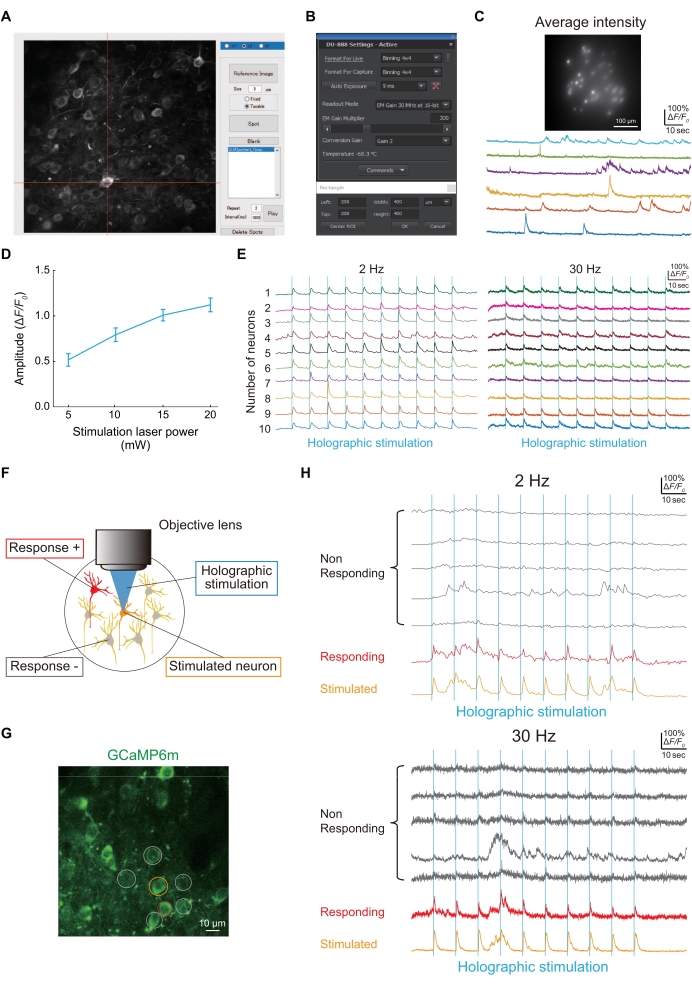
Figura 4: Resultados representativos de imagem e conectividade funcional usando um microscópio holográfico . (A) Para iluminar neurônios específicos expressando jGCaMP8f ou GCaMP6m-P2A-ChRmine, a imagem dos neurônios é capturada e, em seguida, um ponto é formado no neurônio usando um script MATLAB personalizado. (B) A configuração do sensor de imagem (tempo de exposição, área de imagem e binning). (C) Imagem representativa e traços de neurônios expressando jGCaMP8f em imagens de 100 Hz com iluminação holográfica e sensor de imagem. (D) Este gráfico mostra a resposta neural à estimulação holográfica (1.040 nm) em cada potência do laser (dados de GCaMP6m-P2A-ChRmine expressando neurônios a 2 Hz frame rate [n = 16]). As barras de erro indicam o erro padrão da média. (E) Traços representativos de Ca2+ durante estimulação holográfica (linhas verticais azuis) de 10 neurônios diferentes a taxas de quadros de imagem de 2 Hz (esquerda) e 30 Hz (direita). Nos traços de 2 Hz e 30 Hz Ca2+ , a mesma cor indica o mesmo neurônio. (F) Diagrama esquemático avaliando conexões funcionais entre neurônios. Quando o neurônio laranja é estimulado, os neurônios vermelhos respondem ao mesmo tempo, indicando que há conectividade funcional entre esses neurônios. (G) Imagem típica de neurônios S1HL expressando GCaMP6m em WT. Barra de escala = 10 μm. (H) Traços típicos de Ca2+ durante estimulação holográfica (linhas verticais azuis) a taxas de quadros de imagem de 2 Hz (superior) e 30 Hz (inferior). O neurônio estimulado é circundado em laranja, os neurônios que respondem são circundados em vermelho e os neurônios que não respondem são circundados em cinza. A responsividade neural à estimulação holográfica pode ser detectada nas velocidades de imagem de 2 Hz e 30 Hz. Clique aqui para ver uma versão maior desta figura.
| Nossa configuração 6 | Prakash, R. et al.25 | Marshel, J. H. et al.12 | Robinson, N. T. M. et al.14 | |
| Resolução lateral | 1,2 μm | 1,27 μm | ― | 2,22 μm |
| Resolução axial | 8,3 μm | 56,86 μm | 15,5 μm | 10,26 μm |
| Lente objetiva/Abertura numérica | 25x/1,1 | 20x/0,5 | 16x/0,8 | 16x/0,8 |
Tabela 1: Resumo dos relatos anteriores e deste sistema para a resolução espacial da estimulação holográfica. A resolução lateral, a resolução axial e a lente objetiva utilizada durante a mensuração são descritas.
Discussão
Para entender a função cerebral, é necessário avaliar com precisão os circuitos neurais subjacentes à função cerebral, extraindo a dinâmica da atividade neural. Além disso, é essencial identificar como essa circuitaria neural é alterada para elucidar a patogênese dos transtornos neuropsiquiátricos. De fato, sabe-se que a atividade neural é elevada em modelos murinos de doença de Alzheimer4 e síndrome do X frágil26 e camundongos com função da substância branca prejudicada3. Além disso, em um modelo murino de dor inflamatória, o aumento da sincronização da atividade neural e da conectividade funcional entre os neurônios está associado aos sintomas24. A microscopia holográfica de dois fótons permite observar simultaneamente a atividade dos neurônios individuais e as conexões funcionais entre os neurônios, o que é necessário para a compreensão dos circuitos neurais. Utilizou-se objetiva de 25x com abertura numérica = 1,1 com comprimentos de onda de 1.040 nm. A função teórica de dispersão pontual é uma distribuição gaussiana com largura total na metade máxima de 0,5 μm lateralmente e 1,7 μm axialmente. No entanto, a abertura numérica real é menor que 1,1, e o tamanho do ponto medido em um cordão de fluorescência é de 1,2 μm lateralmente, e 8,3 μm axialmente. Dado que o diâmetro do neurônio é de aproximadamente 15 μm e o erro de calibração está dentro de 3 μm, o direcionamento é geralmente bom. No entanto, células no sentido axial podem ser afetadas pelo maior tamanho da mancha6. Aqui, descrevemos a injeção viral, cirurgia, calibração de sistemas holográficos de estimulação ou iluminação e protocolos de imagem para avaliação e manipulação da atividade neural em camundongos vivos usando nosso sistema de microscopia.
Leva de 2 a 4 semanas para concluir todos os procedimentos experimentais, desde o implante da placa cefálica e injeção do vírus até a aquisição de dados para obtenção de imagens in vivo de Ca2+ usando microscopia holográfica. O processo é complexo e trabalhoso, e o sucesso final do experimento depende de múltiplos fatores, incluindo a condição da janela craniana, que é afetada pela inflamação pós-operatória, a escolha adequada do indicador Ca2+ e opsina, e se artefatos de movimento nas imagens adquiridas podem ser corrigidos. Em particular, duas etapas são importantes para um resultado bem-sucedido. A primeira diz respeito à fixação e cirurgia da lâmina cefálica; É crucial que a placa cefálica seja firmemente fixada à cabeça do rato com cimento dentário. Além disso, é importante limpar repetidamente fragmentos ósseos e sangue coagulado usando ACSF frio durante a cirurgia. Como a adesão a esse procedimento reduz a inflamação, observamos com sucesso a dinâmica da micróglia, células responsáveis pelo sistema imunológico cerebral, sem ativar seus processos e espinhas ou as microestruturas dos neurônios27,28. A segunda questão é a avaliação e manipulação da atividade neural. Escolhemos AAV2/8-CaMKII-GCaMP6m-P2A-ChRmine-Kv2.1 para expressar o indicador Ca2+ e opsina em um neurônio simultaneamente. Isso ocorre porque é difícil infectar eficientemente um neurônio com diferentes tipos de AAV. Outra razão para essa escolha foi que a ChRmine pode ativar eficientemente a atividade neural a 1.040 nm usando um laser de dois fótons12. Recentemente, tem sido relatado que a ChRmine, ao mutar sua estrutura com base em informações estruturais obtidas por microscopia crioeletrônica, melhora sua função29, o que é considerado útil para a análise da função-alvo no campo da neurociência. À luz dessas questões, é necessário compartilhar métodos eficazes para avaliar e manipular neurônios ao ler a atividade neural e escrever informações usando microscopia holográfica.
Avanços recentes em imagem e optogenética têm revelado a detalhada atividade neural envolvida em funções cerebrais, como aprendizagem e memória, sendo possível manipular artificialmente essa atividade neural para expressar funções cerebrais30. No entanto, os métodos convencionais de manipulação da atividade neural são altamente invasivos devido à inserção de fibras ópticas no cérebro e porque um grupo de células que expressam opsina é estimulado simultaneamente, impossibilitando a manipulação da atividade neural com precisão temporal e espacial. Nosso método pode manipular a atividade neural estimulando apenas neurônios específicos no cérebro, permitindo assim a manipulação da atividade neural com padrões de estimulação específicos e alta resolução espaço-temporal. Além disso, é importante notar que a conectividade funcional entre neurônios só pode ser avaliada em um pequeno número de neurônios usando experimentos de fatiamento cerebral31; No entanto, esta técnica permite a avaliação simultânea de múltiplos neurônios em animais vivos.
Uma das principais limitações dos microscópios holográficos atuais é a necessidade de fixar a cabeça do rato, o que limita o comportamento do rato. Recentemente, um microscópio miniaturizado de dois fótons foi desenvolvido32 e, com a miniaturização adicional do dispositivo, imagens in vivo de Ca2+ com estimulação holográfica podem ser possíveis em camundongos em movimento livre. Além disso, o potencial desse microscópio poderia ser expandido melhorando a resolução temporal das imagens e combinando-a com proteínas fluorescentes sensíveis à voltagem altamente sensíveis33.
Divulgações
Os autores declaram não haver conflitos de interesse.
Agradecimentos
Este trabalho foi apoiado por Grants-in-Aid for Scientific Research on Innovative Areas (19H04753, 19H05219 e 25110732 para H. W.), Grants-in-Aid for Transformative Research Areas (A) (20H05899 to H. W., 20H05886 to O. M. e 21H05587 to D. K.), Fostering Joint International Research (B) (20KK0170 to H. W.), Grant-in-Aid for Scientific Research (B) (18H02598 to H. W.), Grant-in-Aid for Scientific Research (A) (21H04663 to O. M.), Grant-in-Aid for Early-Career Scientists (20K15193 to X. Q.), JST CREST Grant Number JPMJCR1755, Japan, e JST A-STEP Grant Number JPMJTR204C.
Materiais
| Name | Company | Catalog Number | Comments |
| 25x Objective | Nikon | N25X-APO-MP | Objective |
| A1MP | Nikon | A1MP | Microscope |
| AnesII | Bio machinery | AnesII | Anesthesia delivery system |
| C2 plus | Nikon | C2 plus | Microscope |
| DECADRON Phosphate Injection | Aspen | 21N024 | Avoid cerebral edema |
| Dental Drill | Jota | C1.HP.005 | Dental drill |
| Electric Microinjector | NARISHIGE | IM-31 | Pressure injection system |
| FEATHERS | FEARGER | FA-10 | Shaving |
| G-CEM ONE ADHESIVE ENHANCING PRIMER | GC | 2110271 | Resin cement primer for dental adhesion |
| G-CEM ONE neo | GC | 43093 | Resin cement for dental adhesion |
| Glass Capillary with Filament | NARISHIGE | GDC-1 | Glass capillary |
| Image Detector | Hamamatsu | H10770PA-40 | GaAsP photocathode photomultiplier tube |
| Imaging Software | Nikon | NISelements | Imaging software |
| Isoflurane Inhalation Solution | Pfizer | 229KAR | Anesthetics |
| iXon EMCCD Camera | Andor | iXon Life 888 | Image sensor |
| Ketamine | daiitisannkyou | s9-018506 | Anesthetics |
| Leica-M60 | Leica | M60 | Stereoscope |
| Linicon | Linicon | LV-125 | Vacuum pump |
| Mode-locked Ti:sapphire Chameleon Ultra II laser | Coherent | Chameleon Discovery NX | Femtosecond laser |
| Mos-Cure | U-VIX | mini 365 | Portable LED UV Light Source |
| PEN Bright | SHOFU INC. | PEN Bright | Dental light curing unit |
| Puller | SUTTER instaument | P-97 | Puller |
| Stereotaxic Instrument (for Mice) | NARISHIGE | SR-6M-H | Stereotaxic instrument |
| Stereotaxic Micromanipulator | NARISHIGE | SM-15R | Stereotaxic micromanipulator |
| Super-Bond CATALYST V | SUN MEDICAL | 8070 | Dental adhesive resin cement |
| Super-Bond Dental Adhesive Monomer | SUN MEDICAL | 8071 | Dental adhesive monomer |
| Super-Bond Teeth Color Polymer Powder | SUN MEDICAL | 145052000 | Teeth color polymer powder |
| Tarivid Ophthalmic Ointment 0.3% | Santen Pharmaceutical | TRN3952 | Eye ointment |
| UlTIMATE XL | NSK | Y141446 | Dental laboratory micromotor control unit |
| UV Curing Optical Adhesives | THORLABS | NOA61 | UV Curing Optical Adhesives |
| Xylazine | Bayer | KP0F2BK | Anesthetics |
Referências
- Masamizu, Y., et al. Two distinct layer-specific dynamics of cortical ensembles during learning of a motor task. Nature Neuroscience. 17 (7), 987-994 (2014).
- Peters, A. J., Chen, S. X., Komiyama, T. Emergence of reproducible spatiotemporal activity during motor learning. Nature. 510 (7504), 263-267 (2014).
- Kato, D., et al. Motor learning requires myelination to reduce asynchrony and spontaneity in neural activity. Glia. 68 (1), 193-210 (2020).
- Busche, M. A., et al. Tau impairs neural circuits, dominating amyloid-β effects, in Alzheimer models in vivo. Nature Neuroscience. 22 (1), 57-64 (2019).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8 (9), 1263-1268 (2005).
- Quan, X., Kato, D., Daria, V., Matoba, O., Wake, H. Holographic microscope and its biological application. Neuroscience Research. 179, 57-64 (2022).
- Adesnik, H., Abdeladim, L. Probing neural codes with two-photon holographic optogenetics. Nature Neuroscience. 24 (10), 1356-1366 (2021).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nature Methods. 2 (12), 932-940 (2005).
- Svoboda, K., Denk, W., Kleinfeld, D., Tank, D. W. In vivo dendritic calcium dynamics in neocortical pyramidal neurons. Nature. 385 (6612), 161-165 (1997).
- Carrillo-Reid, L., Han, S., Yang, W., Akrouh, A., Yuste, R. Controlling visually guided behavior by holographic recalling of cortical ensembles. Cell. 178 (2), 447-457 (2019).
- Marshel, J. H., et al. Cortical layer-specific critical dynamics triggering perception. Science. 365 (6453), (2019).
- Gill, J. V., et al. Precise holographic manipulation of olfactory circuits reveals coding features determining perceptual detection. Neuron. 108 (2), 382-393 (2020).
- Robinson, N. T. M., et al. Targeted activation of hippocampal place cells drives memory-guided spatial behavior. Cell. 183 (6), 1586-1599 (2020).
- Packer, A. M., Russell, L. E., Dalgleish, H. W., Häusser, M. Simultaneous all-optical manipulation and recording of neural circuit activity with cellular resolution in vivo. Nature Methods. 12 (2), 140-146 (2015).
- Mardinly, A. R., et al. Precise multimodal optical control of neural ensemble activity. Nature Neuroscience. 21 (6), 881-893 (2018).
- Yang, W., Carrillo-Reid, L., Bando, Y., Peterka, D. S., Yuste, R. Simultaneous two-photon imaging and two-photon optogenetics of cortical circuits in three dimensions. Elife. 7, 32671 (2018).
- Forli, A., et al. Two-photon bidirectional control and imaging of neuronal excitability with high spatial resolution in vivo. Cell Reports. 22 (11), 3087-3098 (2018).
- Pégard, N. C., et al. Three-dimensional scanless holographic optogenetics with temporal focusing (3D-SHOT). Nature Communications. 8 (1), 1228 (2017).
- Dal Maschio, M., Donovan, J. C., Helmbrecht, T. O., Baier, H. Linking neurons to network function and behavior by two-photon holographic optogenetics and volumetric imaging. Neuron. 94 (4), 774-789 (2017).
- Russell, L. E., et al. All-optical interrogation of neural circuits in behaving mice. Nature Protocols. 17 (7), 1579-1620 (2022).
- Oron, D., Papagiakoumou, E., Anselmi, F., Emiliani, V. Two-photon optogenetics. Progress in Brain Research. 196, 119-143 (2012).
- Hernandez, O., et al. Three-dimensional spatiotemporal focusing of holographic patterns. Nature Communications. 7, 11928 (2016).
- Okada, T., et al. Pain induces stable, active microcircuits in the somatosensory cortex that provide a therapeutic target. Science Advances. 7 (12), 8261 (2021).
- Prakash, R., et al. Two-photon optogenetic toolbox for fast inhibition, excitation and bistable modulation. Nature Methods. 9 (12), 1171-1179 (2012).
- Gonçalves, J. T., Anstey, J. E., Golshani, P., Portera-Cailliau, C. Circuit level defects in the developing neocortex of Fragile X mice. Nature Neuroscience. 16 (7), 903-909 (2013).
- Akiyoshi, R., et al. Microglia enhance synapse activity to promote local network synchronization. eNeuro. 5 (5), (2018).
- Haruwaka, K., et al. Dual microglia effects on blood brain barrier permeability induced by systemic inflammation. Nature Communications. 10 (1), 5816 (2019).
- Kishi, K. E., et al. Structural basis for channel conduction in the pump-like channelrhodopsin ChRmine. Cell. 185 (4), 672-689 (2022).
- Deisseroth, K. Optogenetics: 10 years of microbial opsins in neuroscience. Nature Neuroscience. 18 (9), 1213-1225 (2015).
- Ko, H., et al. The emergence of functional microcircuits in visual cortex. Nature. 496 (7443), 96-100 (2013).
- Zong, W., et al. Large-scale two-photon calcium imaging in freely moving mice. Cell. 185 (7), 1240-1256 (2022).
- Villette, V., et al. ultrafast two-photon imaging of a high-gain voltage indicator in awake behaving mice. Cell. 179 (7), 1590-1608 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados