Method Article
Valutazione e manipolazione dell'attività neurale mediante microscopia olografica a due fotoni
In questo articolo
Riepilogo
Abbiamo sviluppato un microscopio olografico a due fotoni in grado di visualizzare, valutare e manipolare l'attività neurale utilizzando un'alta risoluzione spaziotemporale, con l'obiettivo di chiarire la patogenesi dei disturbi neuropsichiatrici associati ad attività neurale anormale.
Abstract
I recenti progressi nella bioimaging ottica e nell'optogenetica hanno permesso la visualizzazione e la manipolazione di fenomeni biologici, comprese le attività cellulari, negli animali viventi. Nel campo delle neuroscienze, è stata ora rivelata un'attività neurale dettagliata relativa alle funzioni cerebrali, come l'apprendimento e la memoria, ed è diventato possibile manipolare artificialmente questa attività per esprimere le funzioni cerebrali. Tuttavia, la valutazione convenzionale dell'attività neurale mediante imaging a due fotoni Ca2+ ha il problema della bassa risoluzione temporale. Inoltre, la manipolazione dell'attività neurale da parte dell'optogenetica convenzionale attraverso la fibra ottica può regolare solo simultaneamente l'attività dei neuroni con lo stesso background genetico, rendendo difficile controllare l'attività dei singoli neuroni. Per risolvere questo problema, abbiamo recentemente sviluppato un microscopio con un'alta risoluzione spaziotemporale per applicazioni biologiche combinando l'optogenetica con la tecnologia olografica digitale in grado di modificare i raggi laser infrarossi a femtosecondi. Qui, descriviamo i protocolli per la visualizzazione, la valutazione e la manipolazione dell'attività neurale, compresa la preparazione di campioni e il funzionamento di un microscopio olografico a due fotoni (Figura 1). Questi protocolli forniscono informazioni spaziotemporali accurate sull'attività neurale, che possono essere utili per chiarire la patogenesi dei disturbi neuropsichiatrici che portano ad anomalie nell'attività neurale.
Introduzione
L'imaging a due fotoni Ca2+ è una tecnica utile per la valutazione dell'attività neurale. Può essere utilizzato per identificare non solo l'attività neurale richiesta per il comportamento e la memoria negli animali normali1,2 ma anche un'attività neuronale anormale che si verifica in modelli murini di disturbi neuropsichiatrici 3,4. La tecnica è stata utilizzata per chiarire le basi neurali delle funzioni cerebrali. Tuttavia, sebbene possa fornire immagini ad alta risoluzione e di alta qualità, la sua risoluzione temporale è inferiore a quella del metodo elettrofisiologico 1,3.
L'optogenetica ha contribuito a innovare il modo in cui i neuroscienziati comprendono la funzione cerebrale5. Date le limitazioni tecniche, la maggior parte della ricerca optogenetica ha utilizzato schemi di attivazione con bassa risoluzione spaziale, limitando così i tipi di manipolazioni dell'attività neurale che possono essere eseguite di conseguenza. Tuttavia, manipolare l'attività neurale su scale spazio-temporali più fini può potenzialmente essere utile per una comprensione più completa del calcolo neurale e della patogenesi dei disturbi neuropsichiatrici. La tecnologia olografica spazialmente precisa in grado di modellare i raggi laser a femtosecondi vicino all'infrarosso promette di superare questa sfida e apre diverse nuove classi sperimentali che in precedenza erano impossibili 6,7. Questa tecnologia consente ai neuroscienziati di scoprire gli aspetti fondamentali e le patologie dei codici neurali sensoriali, cognitivi e comportamentali che sono stati fuori portata.
La proiezione olografica comporta la generazione di modelli di luce desiderati per accedere selettivamente alle singole cellule e reti funzionali. Gli esperimenti in vivo richiedono una trasmissione ottimale della luce per colpire le cellule nel cervello vivente. La luce infrarossa penetra più in profondità nel tessuto vivente e può essere utilizzata per l'eccitazione non lineare a due fotoni (2PE)8,9,10. Pertanto, la microscopia olografica a due fotoni, che combina la proiezione olografica e 2PE, può essere utilizzata per valutare e manipolare le attività neurali per sondare le reti cellulari e funzionali in vivo. Recenti applicazioni biologiche della microscopia olografica a due fotoni hanno chiarito l'attività neurale e i circuiti necessari per l'apprendimento nella corteccia visiva11,12, nel bulbo olfattivo 13 e nell'ippocampo 14.
Numerosi laboratori in tutto il mondo hanno riportato risultati e miglioramenti entusiasmanti utilizzando i loro sistemi di stimolazione olografica 15,16,17,18,19,20,21,22,23. Nel sistema qui descritto, il sistema di stimolazione olografica può essere costruito come dispositivo aggiuntivo per un microscopio convenzionale. Il modulatore di luce spaziale di sola fase (SLM) è il dispositivo chiave per modulare un fronte d'onda piano a qualsiasi forma e l'effetto di interferenza viene utilizzato per controllare l'intensità e la posizione dei fuochi. La Figura 2 mostra la stimolazione olografica e i percorsi luminosi di imaging. Il primo percorso della luce è per la modalità di imaging a scansione puntuale ed è costituito da una testina di scansione e rilevatori di immagini. Il secondo percorso della luce è per la stimolazione olografica con una lunghezza d'onda di 1040 nm ed è costituito da un SLM1. Il terzo percorso della luce è per l'illuminazione olografica con lunghezza d'onda di 920 nm ed è costituito da un SLM2 e un sensore di immagine. La modalità di imaging olografico può registrare intensità da più regioni di interesse illuminando più punti nel campione. In questo modo, la velocità di registrazione può essere aumentata a poche centinaia di fotogrammi al secondo. Per ottenere immagini a scansione puntuale o immagini di illuminazione olografica, il laser a 920 nm è stato diviso in due percorsi da un beam splitter con un rapporto fisso di 3:7. Tutti gli elementi ottici erano allineati su una breadboard ottica con dimensioni di 600 mm × 600 mm. La luce modulata entrava attraverso la porta luminosa sul lato del corpo microscopico, mentre la luce di imaging a scansione puntuale entrava attraverso la testina di scansione nella parte superiore del corpo microscopico. Queste luci sono state integrate appena sopra la lente dell'obiettivo e hanno creato fuochi nel piano campione. Inoltre, il software personalizzato ha permesso al normale flusso di lavoro di essere semplice e coerente.
In questo articolo, viene presentato un protocollo completo per l'uso della stimolazione olografica o dell'illuminazione per misurare l'attività neurale e valutare la connettività funzionale tra i neuroni. A scopo dimostrativo, descriviamo qui un intervento chirurgico cerebrale mirato all'area degli arti posteriori della corteccia somatosensoriale primaria (S1HL) del cervello del topo e un metodo per valutare e manipolare l'attività neurale utilizzando la microscopia olografica a due fotoni. La procedura sperimentale è divisa in quattro parti. In primo luogo, la piastra della testa è stata fissata al cranio del topo usando cemento dentale. In secondo luogo, un vettore virale che esprime jGCaMP8f o GCaMP6m-P2A-ChRmine è stato iniettato stereotassicamente nell'S1HL. In terzo luogo, il sistema di stimolazione olografica o di illuminazione è stato calibrato. In quarto luogo, dopo il recupero postoperatorio e l'espressione di queste due proteine, è stato eseguito l'imaging in vivo Ca2+ per valutare l'attività neurale e la connettività funzionale tra i neuroni con microscopia olografica a due fotoni.
Protocollo
Tutti i protocolli sperimentali sono stati approvati dai comitati per la cura e l'uso degli animali della Nagoya University Graduate School of Medicine (numero di approvazione: M220295-003).
1. Impianto della piastra della testa (Figura 1A)
- Somministrare l'anestetico (una miscela di 74 mg/kg di ketamina e 10 mg/kg di xilazina) per via intraperitoneale per anestetizzare il topo. Controllare frequentemente lo stato anestetico del mouse valutando i riflessi del pedale.
- Dopo l'anestesia, posizionare il mouse in uno strumento stereotassico. Applicare un unguento per gli occhi (vedere la tabella dei materiali) per evitare che la cornea si secchi quando viene impiantata la piastra della testa.
- Rasare l'area chirurgica e disinfettare la pelle con tre cicli alternati di scrub allo iodio povidone o clorexidina seguiti da salviette imbevute di alcool al 70%. Esporre accuratamente il cranio e pulirlo con tamponi di cotone.
NOTA: Tutti gli strumenti chirurgici devono essere sterilizzati e tutte le procedure devono essere eseguite di conseguenza. Eventuali detriti residui (ad esempio, capelli o sangue secco) provocano reazioni infiammatorie. Pertanto, eventuali detriti devono essere rimossi sotto uno stereoscopio usando tamponi di cotone inumiditi con acqua sterile o alcool al 70%. - Utilizzare le coordinate stereotassiche - anteriore e posteriore = 0,5 mm, mediale e laterale = 1,5 mm dal bregma - per trovare il centro della craniotomia ed etichettarla con un pennarello.
- Posiziona una piastra per la testa su misura al centro del cranio. Quindi, applicare il cemento dentale (vedi Tabella dei materiali) per fissarlo saldamente al cranio. Applicare una leggera pressione fino a quando la piastra della testa non entra in contatto con la parte anteriore e posteriore del cranio.
NOTA: questo passaggio richiede circa 20 minuti per essere completato ed è fondamentale per ridurre gli artefatti di movimento nel cervello durante l'imaging a due fotoni. Le dimensioni della piastra di testa sono 20 mm × 40 mm × 1 mm con un'apertura a forma di piastra domestica con un bordo lungo 15 mm, due lati adiacenti lunghi 3 mm e i restanti due lati lunghi 10 mm. - Mescolare insieme un cemento in resina adesiva dentale a base acrilica come segue: mezzo cucchiaio di polvere, tre gocce di liquido e una goccia di catalizzatore (vedi Tabella dei materiali). Per evitare l'essiccazione, applicare questo cemento in resina adesiva dentale mista sulla superficie intatta del cranio del topo con la piastra della testa.
- Metti il topo in una gabbia calda fino a quando non si è ripreso dall'anestesia. Non lasciare il topo incustodito fino a quando non ha riacquistato sufficiente coscienza per mantenere la reclinazione sternale.
2. Chirurgia e iniezione di virus adeno-associati (AAV) (Figura 1B)
- Eseguire craniotomia o iniezione virale senza rimuovere il cemento in resina adesiva dentale dal cranio 1 giorno dopo l'impianto della piastra della testa.
NOTA: Somministrare l'anestesia (una miscela di 74 mg/kg di ketamina e 10 mg/kg di xilazina) per via intraperitoneale al topo durante questa procedura. - Per evitare edema cerebrale, somministrare desametasone sodio fosfato (1,32 mg/kg) per via intraperitoneale 1 ora prima dell'intervento.
- Anestetizzare il mouse con la piastra frontale con anestesia isoflurana all'1% utilizzando un vaporizzatore (sistema di erogazione dell'anestesia) mantenendo la temperatura corporea con una piastra riscaldante. Applicare un unguento per gli occhi per prevenire l'essiccazione corneale.
- Sotto uno stereoscopio, eseguire una craniotomia circolare di circa 2 mm di diametro utilizzando un trapano dentale. Per ridurre i danni cerebrali, utilizzare il trapano dentale con attenzione con un leggero movimento costante e una leggera pressione verso il basso.
- Rimuovere i frammenti ossei più volte utilizzando un sistema di aspirazione. Dopo aver rimosso i frammenti ossei, utilizzare una soluzione di liquido spinale artificiale (ACSF) per rimuovere e lavare eventuali detriti rimasti sulla superficie del cervello. Ripetere questa procedura di pulizia più volte per sopprimere le reazioni infiammatorie.
NOTA: La soluzione ACSF (140 mM NaCl, 2,5 mM KCl, 5 mM HEPES, 2,0 mM CaCl 2 e 1,0 mM MgCl2) è stata conservata a 4 °C per 1 mese dopo che il reagente è stato sciolto e filtrato (dimensione dei pori = 0,22 μm). - Utilizzando un sistema di iniezione a pressione (vedi Tabella dei materiali), impostare la pressione appropriata (circa 10 PSI in impulsi con una durata di 4 ms) per iniettare 500 nL di soluzione AAV attraverso un capillare di vetro con un diametro della punta di 10-20 μm (preparato con un estrattore di micropipette) per 10 minuti.
- Determinare se la soluzione AAV viene somministrata al cervello controllando se il livello della soluzione AAV nel capillare di vetro diminuisce gradualmente.
- Lasciare il capillare di vetro in posizione per altri 10 minuti per evitare il riflusso. Ripetere tre volte per somministrare un totale di 1,5 μL di soluzione AAV nel cervello.
- Per valutare e manipolare l'attività neurale nelle cellule piramidali dello strato 2/3 (L2/3), iniettare una soluzione AAV (per l'imaging Ca 2+: AAV2/1-Syn-jGCaMP8f-WPRE a 1,28 × 10 14 genomi vettoriali/ml, diluiti 1:1 in soluzione salina; per imaging Ca2+ con optogenetica: AAV2/8-CaMKII-GCaMP6m-P2A-ChRmine-Kv2.1-WPRE a 1,73 × 1014 genomi vettoriali/ml, diluiti 1:1 in soluzione salina) nell'area della zampa posteriore della corteccia somatosensoriale primaria di topi wild-type (S1, centrato a 0,5 mm posteriormente e 1,5 mm lateralmente dal bregma, 150 μm di profondità dalla superficie).
NOTA: La soluzione AAV deve essere iniettata a 2-3 settimane e 1-2 settimane prima dell'imaging per l'espressione di jGCaMP8f e GCaMP6m-P2A-ChRmine, rispettivamente. - Dopo un'applicazione di agarosio a basso punto di fusione al 2% (p/v) sulla superficie cerebrale di S1 utilizzando una micropipetta, posizionare una finestra di vetro sopra la craniotomia con due vetri di copertura. Fissare i due vetri di copertura (piccolo diametro 2,0 mm e grande diametro 4,5 mm; vedi Tabella dei materiali) con adesivo polimerizzabile UV.
- Premere il vetro di copertura contro l'agarosio mentre è ancora liquido; Ciò impedisce la formazione di bolle d'aria nell'agarosio. Sigillare i bordi della finestra cranica con cemento dentale e resina adesiva (Figura 1C).
- Rimuovere il mouse dallo strumento stereotassico e rimetterlo nella sua gabbia. Metti il topo in una gabbia calda e non tornare nella gabbia con altri animali fino a quando non si è completamente ripreso dall'anestesia. Mantenere attentamente le condizioni sterili durante l'intervento chirurgico di sopravvivenza.
- Per le prime 72 ore dopo l'intervento chirurgico, controllare lo stato di salute del topo osservando il comportamento generale. Se ci sono anomalie nel comportamento generale, iniettare per via sottocutanea agenti antinfiammatori e analgesici.
3. Preparazione per il sistema di stimolazione olografica o di illuminazione (Figura 3)
- Calibrare il sistema di stimolazione olografica posizionando la superficie di un vetrino a fluorescenza rossa (substrato acrilico colato) sul piano del campione. Posizionare il microscopio in modalità Live Imaging con una luce di eccitazione debole ed eseguire calibration_GUI.m file. Controllare il riquadro dei parametri e fare clic sul pulsante Salva .
- Fare clic sul pulsante Z Scan nel riquadro del passaggio 1. Genererà automaticamente tre punti casuali in tutti i 21 piani assiali, a 2 μm di distanza da ciascun piano.
- Sposta la barra di scorrimento e controlla l'immagine dal vivo. Trova un piano perfetto in cui i punti appaiono più piccoli e luminosi, quindi fai clic sul pulsante Salva . Questo genererà automaticamente un fronte d'onda sferico sfalsato per l'ologramma digitale.
NOTA: se non si riescono a trovare i punti di fluorescenza più luminosi, modificare i valori minimo e massimo dell'intervallo di scansione e riprovare. - Fare clic sul pulsante Vai nel riquadro del passaggio 2 e quindi fare clic su sei punti nel riquadro sinistro. Controlla l'immagine dal vivo. Se sono presenti sei punti di fluorescenza distinguibili, digitare gli assi x e y nelle caselle di modifica e fare clic sul pulsante Salva . Ciò genererà automaticamente coefficienti di trasformazione affine per coordinare la calibrazione tra la stimolazione olografica e il sistema di imaging.
NOTA: il numero di coppia dell'asse e il numero di spot selezionato devono essere abbinati in ordine. Se non sei sicuro, o se non ci sono macchie nell'immagine, riprova e genera un modello di punti univoco o scegli un intervallo più piccolo attorno al centro del campo visivo (FOV). - Fare clic sul pulsante Scansione nel riquadro del passaggio 3. Genererà 441 ologrammi digitali per eseguire la scansione a punto singolo attraverso il FOV in 21 × 21 passaggi.
- Innanzitutto, controlla le immagini mentre modifichi i modelli nella casella di riepilogo. Quindi, regolare la potenza del laser per ottenere immagini spot all'interno della gamma dinamica del dispositivo di imaging (ad esempio, per evitare immagini eccessivamente sature).
- Successivamente, regolare il tempo di intervallo nella casella di modifica; Il tempo di intervallo deve essere più di due volte il tempo di intervallo di registrazione. Infine, metti il dispositivo di imaging in modalità di registrazione e fai clic sul pulsante Riproduci . Se il gioco viene completato, ci saranno stringhe "visualizza OK" visualizzate nella finestra di comando. Interrompi la registrazione e impila le immagini sequenziali registrate utilizzando il metodo di intensità massima.
- Fare clic su Genera WM nel riquadro del passaggio 4 e scegliere un'immagine in pila dall'alto. Quindi chiudere la finestra calibration_GUI. Genererà automaticamente una mappa del peso per compensare l'intensità sbilanciata in ogni punto.
NOTA: Per una descrizione più dettagliata, fare riferimento a 2; il codice Matlab può essere scaricato da qui (https://github.com/ZenKG/SLM_control).
4. Imaging Ca2+ utilizzando un sensore di immagine con illuminazione olografica (Figura 4)
- Posizionare il mouse iniettato con AAV con una piastra frontale sotto il microscopio (Figura 1D).
NOTA: Durante questa procedura, il mouse è trattenuto nello stato di veglia, ma è in grado di sfuggire a stimoli scomodi. - Eseguire l'imaging a due fotoni (modalità di scansione puntuale) utilizzando un microscopio olografico e un laser Ti:zaffiro bloccato in modalità sintonizzato su 920 nm con un obiettivo 25x (vedi Tabella dei materiali).
- Attivare il software di imaging commerciale (vedere Tabella dei materiali). Nella modalità live imaging, regolare la tensione del rilevatore di immagini (vedere Tabella dei materiali) e la potenza del laser di imaging per ottimizzare la luminosità dei neuroni che esprimono jGCaMP8f. Cattura le immagini dei neuroni che esprimono questa proteina.
NOTA: L'intensità del laser di imaging (920 nm) è 20-30 mW. Il FOV era 512 μm × 512 μm ad una profondità di 100-150 μm dalla superficie corticale. - Per illuminare neuroni specifici che esprimono jGCaMP8f con illuminazione olografica, eseguire il file di script SLMcontrol.m. Fare clic sull'immagine di riferimento e scegliere l'immagine acquisita sopra. Quindi, fare clic sul pulsante Spot per scegliere pixel specifici sui neuroni nell'immagine facendo clic continuamente con il mouse (Figura 4A). Se la selezione è completa, premere il pulsante Invio sulla tastiera per finalizzarla.
NOTA: L'ologramma digitale viene calcolato e visualizzato automaticamente sull'SLM. Questo modello può anche essere rivisitato facendo clic su una casella di riepilogo. La risoluzione spaziale di un singolo spot generato dall'SLM era di circa 1,2 μm lungo la direzione trasversale e ~8,3 μm lungo l'asse ottico. Abbiamo usato un obiettivo ad alta apertura numerica (1,1) per ottenere una stimolazione olografica più localizzata. La tabella 1 riassume i rapporti precedenti e questo sistema rispetto alla risoluzione spaziale della stimolazione olografica. - Per rilevare l'attività neurale con un'elevata risoluzione temporale utilizzando un sensore di immagine (vedere Tabella dei materiali), impostare il tempo di esposizione, l'area di imaging e il binning (Figura 4B) prima di eseguire l'acquisizione dell'immagine (Figura 4C).
NOTA: L'intensità del laser di illuminazione olografica (920 nm) che stimola continuamente un neurone è di 2 mW, che è sufficiente per rilevare l'attività neurale. Ad esempio, per ottenere una frequenza fotogrammi di 100 Hz per l'imaging, il tempo di esposizione è di 9 ms, l'area di imaging è di 400 μm × 400 μm e il binning è 4. - Dopo l'esperimento, riporta il topo nella sua gabbia di casa.
5. Imaging a due fotoni (modalità di scansione puntuale) con optogenetica utilizzando un microscopio olografico (Figura 2)
- Ripetere i passaggi 4.1 e 4.2.
- Attivare il software di imaging commerciale (vedere Tabella dei materiali). Nella modalità live imaging, regolare la tensione del rilevatore di immagini (vedere Tabella dei materiali) e la potenza del laser di imaging per ottimizzare la luminosità dei neuroni che esprimono GCaMP6m-P2A-ChRmine. Cattura immagini dei neuroni che esprimono queste proteine (Figura 1E).
- Ripetere il passaggio 4.4.
- Per studiare la connettività funzionale all'interno dei neuroni L2/3, utilizzare un SLM per generare modelli olografici di stimolazione optogenetica (ChRmine; 1.040 nm) e combinarlo con l'imaging Ca 2+ a due fotoni (GCaMP6m; 920 nm, 512 × 512 pixel, 2 Hz o 30 Hz, zoom digitale2x, modalità di scansione puntuale; Figura 4D-H).
- Per questo protocollo, impostare l'intensità del laser di imaging a 920 nm, a 10-20 mW, e il FOV come 256 μm × 256 μm misurato a una profondità di 100-150 μm dalla superficie corticale. Impostare il tempo di permanenza dei pixel a 1,5 μs per 2 Hz o 100 ns per 30 Hz.
- Per vedere se un singolo stimolo olografico ha causato una risposta al calcio nei neuroni, utilizzare sia 2 Hz che 30 Hz come frame rate di imaging. Impostare l'intensità del laser di stimolazione olografica (1.040 nm) che stimola un singolo neurone a 10 mW, che è sufficiente per indurre l'attività neurale (Figura 4D).
NOTA: La risoluzione spaziale di un singolo spot generato dall'SLM è di circa 1,2 μm lungo la direzione trasversale e ~8,3 μm lungo l'asse ottico. L'intervallo di volume accessibile in direzione laterale è di circa 500 μm × 500 μm e 100 μm in direzione assiale. Abbiamo inoltre confermato con l'imaging Ca2+ a frame rate di imaging a 2 Hz o 30 Hz che non solo un neurone, ma più neuroni possono essere stimolati olograficamente simultaneamente (Figura 4E).
- Eseguire l'acquisizione di immagini con il seguente protocollo: visualizzare simultaneamente la risposta Ca2+ a 920 nm con 10 stimoli olografici a 1.040 nm con intervalli di 8 s (0,125 Hz) per una durata di 50 ms dopo un periodo basale di 10 s. Dopo che tutti gli esperimenti sono stati completati, i topi vengono eutanasiati.
NOTA: I transitori Ca2+, se presenti, sono stati evocati dalla stimolazione olografica, con il loro picco che appare entro 1 s dopo la stimolazione (Figura 4F-H).
6. Analisi delle immagini e valutazione della connettività funzionale (Figura 4)
- Aprire le immagini raw salvate nei passaggi 4.5 o 5.5 utilizzando ImageJ. Per compensare lo spostamento del piano focale, utilizzare il plug-in ImageJ TurboReg.
NOTA: Se la correzione con TurboReg non è sufficiente, si consiglia di utilizzare CaImAn (http://github.com/simonsfoundation) per correggere lo spostamento del piano focale. - Per valutare l'attività neurale, determinare le regioni di interesse (ROI) in L2/3 utilizzando un algoritmo automatizzato (CaImAn). Rilevare e analizzare i transitori Ca2+ dopo aver definito l'intensità di fluorescenza basale (F0) e il valore di soglia.
NOTA: F0 è il 35° percentile dell'intensità di fluorescenza acquisita durante il periodo di imaging basale. I transitori Ca2+ sono indicati con Δ F/F 0 (Δ F = F-F0), dove F è il segnale di fluorescenza istantanea. Se il valore di Δ F è superiore a 2 S.D. da F0, valutiamo un transitorio Ca2+ significativo. - Per definire la connettività funzionale nei neuroni L2/3, stimolare i neuroni bersaglio e misurare le risposte GCaMP6m nei neuroni stimolati e circostanti, di conseguenza (Figura 4F-H).
Risultati
Vengono presentate registrazioni rappresentative ottenute con il metodo qui descritto. In vivo L'imaging Ca2+ mediante microscopia olografica richiede 2-4 settimane per essere completato dall'impianto della piastra frontale e dall'iniezione di AAV all'acquisizione dei dati. Pertanto, per ottenere risultati stabili, è importante ridurre gli artefatti di movimento nel cervello. L'impianto della piastra cranica (fase 1.5) e il posizionamento della finestra cranica (fase 2.9) sono passaggi molto importanti in questo processo. Inoltre, è anche importante selezionare un AAV (AAV2/8-CaMKII-GCaMP6m-P2A-ChRmine-Kv2.1) che esprima simultaneamente indicatore di calcio e opsina in un singolo neurone (fase 2.8).
La Figura 4A mostra un punto per l'illuminazione olografica di un'immagine neuronale acquisita utilizzando uno script MATLAB personalizzato. Se l'illuminazione olografica illumina con successo i neuroni che esprimono jGCaMP8f, le tracce di Ca2+ potrebbero essere ottenute con un sensore di immagine (Figura 4B), come mostrato in Figura 4C.
La connettività funzionale tra i neuroni è stata valutata utilizzando la stimolazione olografica (Figura 4D), come mostrato nella Figura 4E. Poiché la connettività funzionale tra i neuroni è una delle proprietà dei circuiti neurali che viene alterata nella patogenesi di un topo modello di dolore24, descriviamo una semplice procedura per valutarla. La Figura 4F mostra un'immagine tipica dei neuroni L2/3 in S1HL visualizzata usando GCaMP6m. Quando un neurone (cerchio arancione) veniva stimolato olograficamente, un altro neurone (cerchio rosso) era simultaneamente attivo; quindi, il numero di connettività funzionale tra i neuroni era uno (Figura 4G).
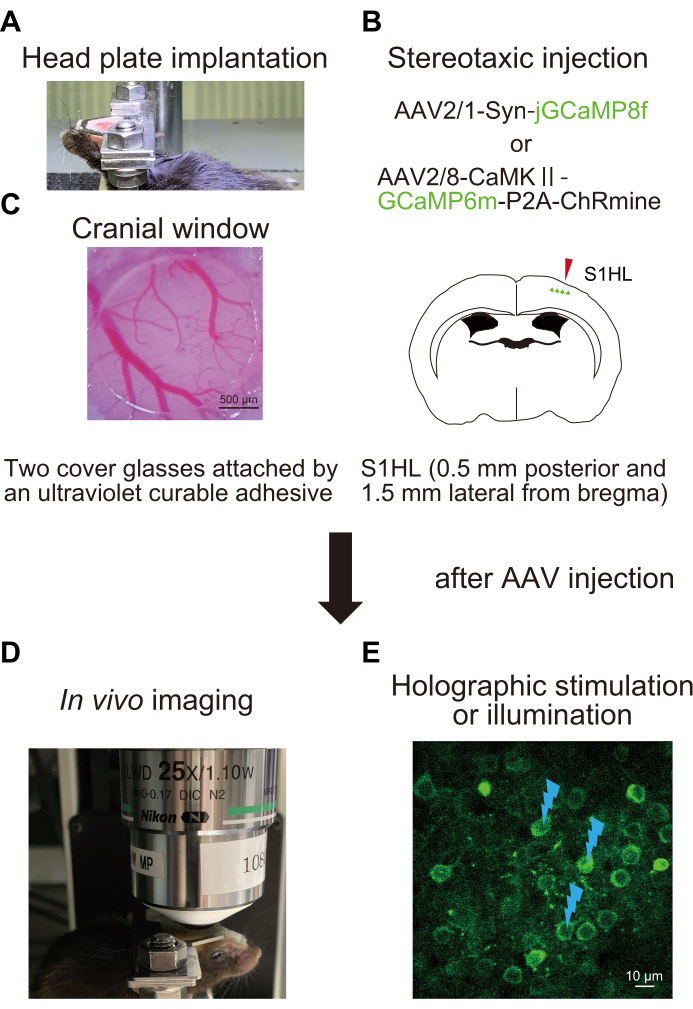
Figura 1: Schema schematico della procedura sperimentale . (A) Fissazione della piastra di testa al cranio. (B) Iniezione stereotassica di AAV nell'area della zampa posteriore della corteccia somatosensoriale primaria (S1HL). (C) Impianto della finestra cranica. Per valutare e manipolare l'attività neurale, l'imaging in vivo Ca2+ viene eseguito in topi svegli (D) con stimolazione olografica (E). I segni del flash indicano la stimolazione olografica o l'illuminazione. Fare clic qui per visualizzare una versione ingrandita di questa figura.
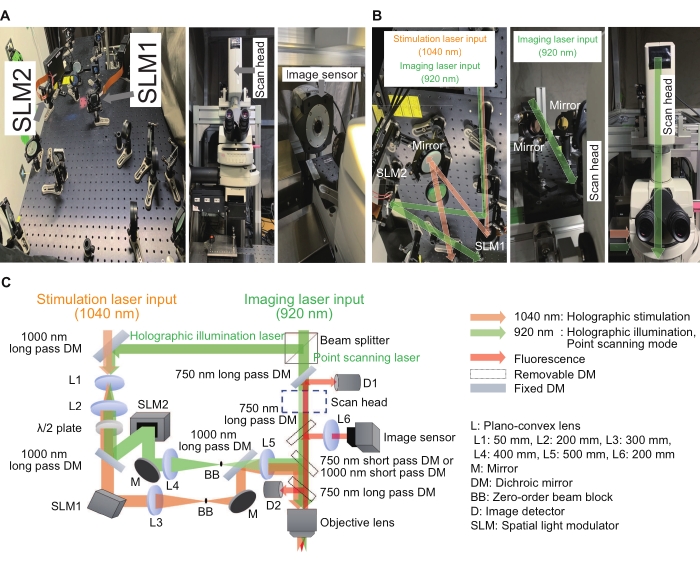
Figura 2: Sistema utilizzato per il microscopio olografico. (A) Immagini dei percorsi della luce olografica di stimolazione e illuminazione (a sinistra) vicino al microscopio (al centro) con un sensore di immagine (a destra). (B) Si tratta di immagini ingrandite di percorsi di luce di stimolazione olografica e illuminazione attorno ai rispettivi SLM (sinistra e destra) e un percorso di luce a scansione puntiforme attorno a una testa di scansione (al centro e a destra). (C) Uno schema dei percorsi ottici di stimolazione e imaging. Gli SLM di sola fase vengono utilizzati per visualizzare ologrammi digitali e un espansore del fascio (una combinazione di L1 e L2) e un sistema di relè 4f (una combinazione di L3 e L4 per la stimolazione olografica e L4 e L5 per l'illuminazione olografica) sono posizionati prima e dopo i rispettivi SLM per assicurarsi che ogni ologramma digitale sia ripreso alla pupilla di uscita di una lente obiettivo ad immersione in acqua, con dimensioni dell'immagine leggermente sotto-riempite. Per sopprimere i componenti residui di ordine zero, un blocco del fascio viene posizionato sul piano intermedio. Fare clic qui per visualizzare una versione ingrandita di questa figura.
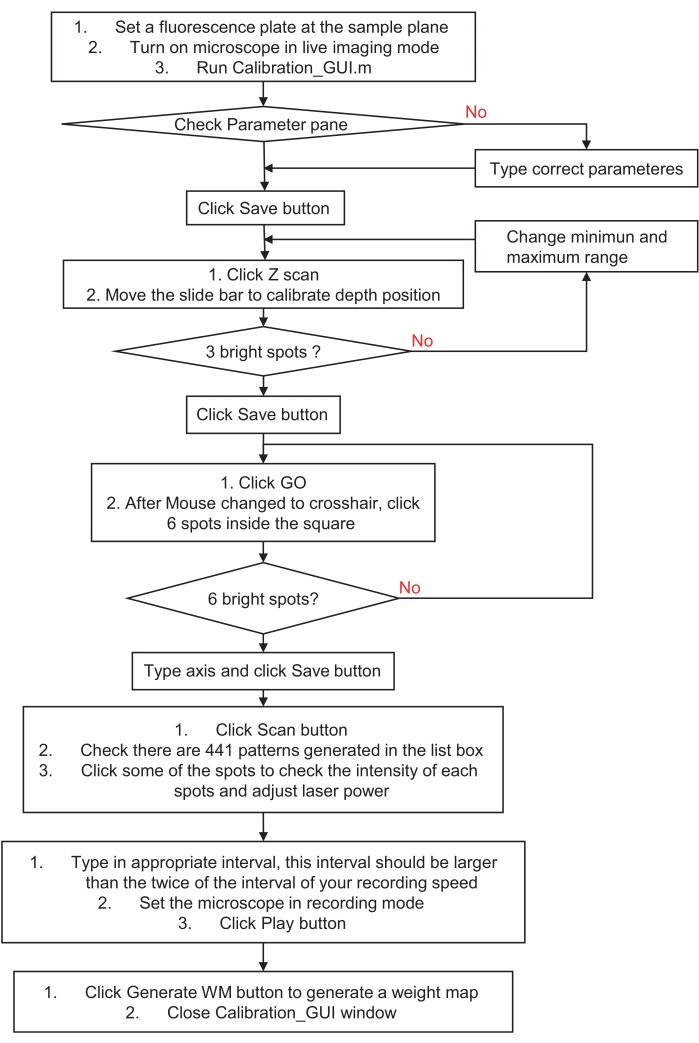
Figura 3: Diagramma di flusso di come calibrare il sistema di stimolazione olografica o di illuminazione. Questo diagramma di flusso descrive i passaggi per calibrare un sistema di stimolazione olografica o di illuminazione nello spazio del campione e nel sistema di imaging. Si prega di visitare il passaggio 3, preparazione per la stimolazione olografica o il sistema di illuminazione, per istruzioni dettagliate e scaricare un programma di esempio. Fare clic qui per visualizzare una versione ingrandita di questa figura.
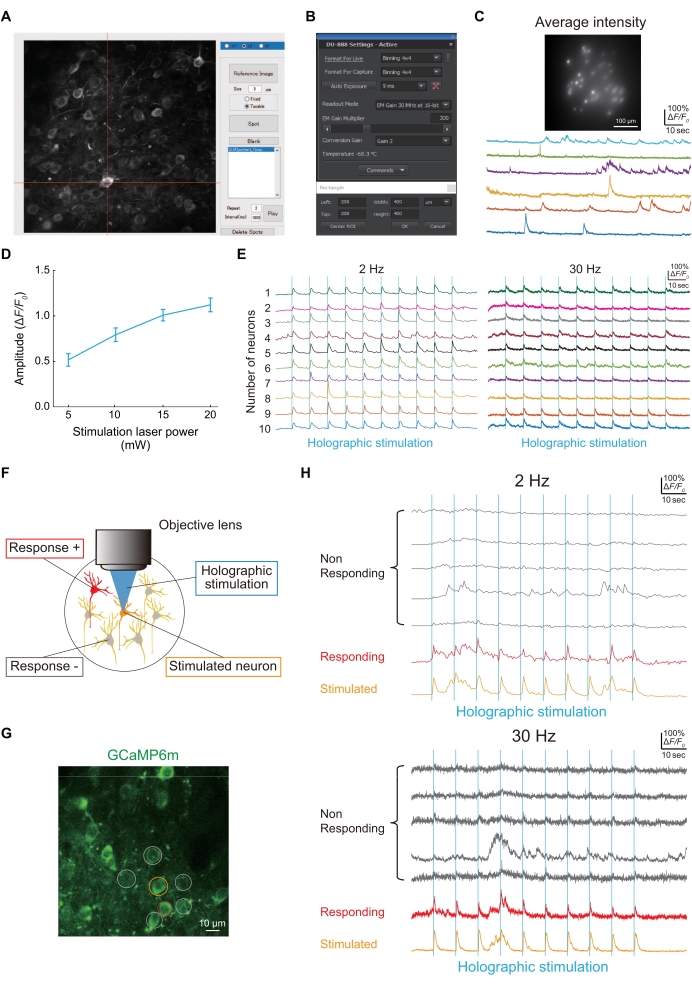
Figura 4: Risultati rappresentativi dell'imaging e della connettività funzionale utilizzando un microscopio olografico . (A) Per illuminare neuroni specifici che esprimono jGCaMP8f o GCaMP6m-P2A-ChRmine, viene catturata l'immagine dei neuroni e quindi si forma un punto sul neurone utilizzando uno script MATLAB personalizzato. (B) L'impostazione del sensore di immagine (tempo di esposizione, area di imaging e binning). (C) Immagine rappresentativa e tracce di neuroni che esprimono jGCaMP8f in imaging a 100 Hz con illuminazione olografica e un sensore di immagine. (D) Questo grafico mostra la risposta neurale alla stimolazione olografica (1.040 nm) a ciascuna potenza laser (dati da GCaMP6m-P2A-ChRmine che esprimono neuroni a 2 Hz frame rate di imaging [n = 16]). Le barre di errore indicano l'errore standard della media. (E) Tracce rappresentative di Ca2+ durante la stimolazione olografica (linee verticali blu) di 10 diversi neuroni a frame rate di imaging a 2 Hz (a sinistra) e 30 Hz (a destra). Nelle tracce di 2 Hz e 30 Hz Ca2+ , lo stesso colore indica lo stesso neurone. (F) Diagramma schematico che valuta le connessioni funzionali tra i neuroni. Quando il neurone arancione viene stimolato, i neuroni rossi rispondono allo stesso tempo, indicando che esiste una connettività funzionale tra questi neuroni. (G) Un'immagine tipica dei neuroni S1HL che esprimono GCaMP6m in WT. Barra di scala = 10 μm. (H) Tracce tipiche di Ca2+ durante la stimolazione olografica (linee verticali blu) a frame rate di imaging a 2 Hz (superiore) e 30 Hz (inferiore). Il neurone stimolato è cerchiato in arancione, i neuroni rispondenti sono cerchiati in rosso e i neuroni non rispondenti sono cerchiati in grigio. La reattività neurale alla stimolazione olografica può essere rilevata a velocità di imaging sia a 2 Hz che a 30 Hz. Fare clic qui per visualizzare una versione ingrandita di questa figura.
| Il nostro allestimento 6 | Prakash, R. et al. 25 | Marshel, J. H. et al. 12 | Robinson, N. T. M. et al. 14 | |
| Risoluzione laterale | 1,2 μm | 1,27 μm | ― | 2,22 μm |
| Risoluzione assiale | 8,3 μm | 56,86 μm | 15,5 μm | 10,26 μm |
| Obiettivo obiettivo/apertura numerica | 25x/1,1 | 20x/0,5 | 16x/0,8 | 16x/0,8 |
Tabella 1: Riassunto delle relazioni precedenti e di questo sistema per la risoluzione spaziale della stimolazione olografica. Vengono descritti la risoluzione laterale, la risoluzione assiale e la lente dell'obiettivo utilizzata durante la misurazione.
Discussione
Per comprendere la funzione cerebrale, è necessario valutare con precisione i circuiti neurali alla base della funzione cerebrale estraendo la dinamica dell'attività neurale. Inoltre, è essenziale identificare come questo circuito neurale viene alterato per chiarire la patogenesi dei disturbi neuropsichiatrici. Infatti, è noto che l'attività neurale è elevata nei modelli murini di Alzheimer4 e sindrome dell'X fragile26 e topi con funzione della sostanza bianca compromessa3. Inoltre, in un modello murino di dolore infiammatorio, l'aumento della sincronizzazione dell'attività neurale e della connettività funzionale tra i neuroni è associato ai sintomi24. La microscopia olografica a due fotoni ci consente di osservare simultaneamente l'attività dei singoli neuroni e le connessioni funzionali tra i neuroni, necessaria per comprendere i circuiti neurali. Abbiamo usato un obiettivo 25x con apertura numerica = 1,1 con lunghezze d'onda di 1.040 nm. La funzione teorica di diffusione puntuale è una distribuzione gaussiana con larghezza completa a metà massimo di 0,5 μm lateralmente e 1,7 μm assialmente. Tuttavia, l'apertura numerica effettiva è inferiore a 1,1 e la dimensione dello spot misurata su un cordone di fluorescenza è di 1,2 μm lateralmente e 8,3 μm assialmente. Dato che il diametro del neurone è di circa 15 μm e l'errore di calibrazione è entro 3 μm, il targeting è generalmente buono. Tuttavia, le celle nella direzione assiale possono essere influenzate dalla dimensione dello spot più lunga6. Qui, abbiamo descritto l'iniezione virale, la chirurgia, la calibrazione dei sistemi di stimolazione olografica o di illuminazione e i protocolli di imaging per valutare e manipolare l'attività neurale nei topi vivi utilizzando il nostro sistema di microscopia.
Ci vogliono 2-4 settimane per completare tutte le procedure sperimentali, dall'impianto della piastra frontale e l'iniezione del virus all'acquisizione dei dati per l'imaging in vivo Ca2+ utilizzando la microscopia olografica. Il processo è complesso e laborioso e il successo finale dell'esperimento dipende da molteplici fattori, tra cui la condizione della finestra cranica, che è influenzata dall'infiammazione postoperatoria, la scelta corretta dell'indicatore Ca2+ e dell'opsina e se gli artefatti di movimento nelle immagini acquisite possono essere corretti. In particolare, due passaggi sono importanti per un risultato positivo. Il primo riguarda la fissazione della piastra frontale e la chirurgia; È fondamentale che la piastra della testa sia fissata saldamente alla testa del topo con cemento dentale. Inoltre, è importante pulire ripetutamente i frammenti ossei e il sangue coagulato usando ACSF freddo durante l'intervento chirurgico. Poiché l'aderenza a questa procedura riduce l'infiammazione, abbiamo osservato con successo la dinamica della microglia, le cellule responsabili del sistema immunitario del cervello, senza attivare i loro processi e spine o le microstrutture dei neuroni27,28. Il secondo problema è la valutazione e la manipolazione dell'attività neurale. Abbiamo scelto AAV2/8-CaMKII-GCaMP6m-P2A-ChRmine-Kv2.1 per esprimere l'indicatore Ca2+ e l'opsina in un neurone contemporaneamente. Questo perché è difficile infettare efficacemente un neurone con diversi tipi di AAV. Un altro motivo di questa scelta è che ChRmine può attivare in modo efficiente l'attività neurale a 1.040 nm utilizzando un laser a due fotoni12. Recentemente, è stato riportato che ChRmine, mutando la sua struttura sulla base di informazioni strutturali ottenute dalla microscopia crioelettronica, migliora la sua funzione29, che è considerata utile per l'analisi della funzione target nel campo delle neuroscienze. Alla luce di questi problemi, è necessario condividere metodi efficaci per valutare e manipolare i neuroni durante la lettura dell'attività neurale e la scrittura di informazioni utilizzando la microscopia olografica.
I recenti progressi nell'imaging e nell'optogenetica hanno rivelato l'attività neurale dettagliata coinvolta nelle funzioni cerebrali come l'apprendimento e la memoria, ed è possibile manipolare artificialmente questa attività neurale per esprimere le funzioni cerebrali30. Tuttavia, i metodi convenzionali per la manipolazione dell'attività neurale sono altamente invasivi a causa dell'inserimento di fibre ottiche nel cervello e perché un gruppo di cellule che esprimono opsina viene stimolato simultaneamente, rendendo impossibile manipolare l'attività neurale con precisione temporale e spaziale. Il nostro metodo può manipolare l'attività neurale stimolando solo specifici neuroni nel cervello, consentendo così la manipolazione dell'attività neurale con specifici modelli di stimolazione e alta risoluzione spaziotemporale. Inoltre, è importante notare che la connettività funzionale tra i neuroni può essere valutata solo in un piccolo numero di neuroni utilizzando esperimenti di fette di cervello31; Tuttavia, questa tecnica consente la valutazione simultanea di più neuroni negli animali vivi.
Uno dei principali limiti degli attuali microscopi olografici è la necessità di fissare la testa del mouse, che limita il comportamento del mouse. Recentemente, è stato sviluppato un microscopio miniaturizzato a due fotoni32 e, con l'ulteriore miniaturizzazione del dispositivo, l'imaging in vivo Ca2+ con stimolazione olografica può essere possibile nei topi in movimento libero. Inoltre, il potenziale di questo microscopio potrebbe essere ampliato migliorando la risoluzione temporale dell'imaging e combinandola con proteine fluorescenti altamente sensibili alla tensione33.
Divulgazioni
Gli autori non hanno conflitti di interesse da dichiarare.
Riconoscimenti
Questo lavoro è stato sostenuto da sovvenzioni in aiuto per la ricerca scientifica su aree innovative (19H04753, 19H05219 e 25110732 a H. W.), sovvenzioni in aiuto per aree di ricerca trasformativa (A) (20H05899 a H. W., 20H05886 a O. M. e 21H05587 a D. K.), Promozione della ricerca internazionale congiunta (B) (20KK0170 a H. W.), sovvenzione in aiuto per la ricerca scientifica (B) (18H02598 a H. W.), Sovvenzione per la ricerca scientifica (A) (21H04663 a O. M.), sovvenzione per scienziati all'inizio della carriera (da 20K15193 a X. Q.), JST CREST numero di sovvenzione JPMJCR1755, Giappone e JST A-STEP numero di sovvenzione JPMJTR204C.
Materiali
| Name | Company | Catalog Number | Comments |
| 25x Objective | Nikon | N25X-APO-MP | Objective |
| A1MP | Nikon | A1MP | Microscope |
| AnesII | Bio machinery | AnesII | Anesthesia delivery system |
| C2 plus | Nikon | C2 plus | Microscope |
| DECADRON Phosphate Injection | Aspen | 21N024 | Avoid cerebral edema |
| Dental Drill | Jota | C1.HP.005 | Dental drill |
| Electric Microinjector | NARISHIGE | IM-31 | Pressure injection system |
| FEATHERS | FEARGER | FA-10 | Shaving |
| G-CEM ONE ADHESIVE ENHANCING PRIMER | GC | 2110271 | Resin cement primer for dental adhesion |
| G-CEM ONE neo | GC | 43093 | Resin cement for dental adhesion |
| Glass Capillary with Filament | NARISHIGE | GDC-1 | Glass capillary |
| Image Detector | Hamamatsu | H10770PA-40 | GaAsP photocathode photomultiplier tube |
| Imaging Software | Nikon | NISelements | Imaging software |
| Isoflurane Inhalation Solution | Pfizer | 229KAR | Anesthetics |
| iXon EMCCD Camera | Andor | iXon Life 888 | Image sensor |
| Ketamine | daiitisannkyou | s9-018506 | Anesthetics |
| Leica-M60 | Leica | M60 | Stereoscope |
| Linicon | Linicon | LV-125 | Vacuum pump |
| Mode-locked Ti:sapphire Chameleon Ultra II laser | Coherent | Chameleon Discovery NX | Femtosecond laser |
| Mos-Cure | U-VIX | mini 365 | Portable LED UV Light Source |
| PEN Bright | SHOFU INC. | PEN Bright | Dental light curing unit |
| Puller | SUTTER instaument | P-97 | Puller |
| Stereotaxic Instrument (for Mice) | NARISHIGE | SR-6M-H | Stereotaxic instrument |
| Stereotaxic Micromanipulator | NARISHIGE | SM-15R | Stereotaxic micromanipulator |
| Super-Bond CATALYST V | SUN MEDICAL | 8070 | Dental adhesive resin cement |
| Super-Bond Dental Adhesive Monomer | SUN MEDICAL | 8071 | Dental adhesive monomer |
| Super-Bond Teeth Color Polymer Powder | SUN MEDICAL | 145052000 | Teeth color polymer powder |
| Tarivid Ophthalmic Ointment 0.3% | Santen Pharmaceutical | TRN3952 | Eye ointment |
| UlTIMATE XL | NSK | Y141446 | Dental laboratory micromotor control unit |
| UV Curing Optical Adhesives | THORLABS | NOA61 | UV Curing Optical Adhesives |
| Xylazine | Bayer | KP0F2BK | Anesthetics |
Riferimenti
- Masamizu, Y., et al. Two distinct layer-specific dynamics of cortical ensembles during learning of a motor task. Nature Neuroscience. 17 (7), 987-994 (2014).
- Peters, A. J., Chen, S. X., Komiyama, T. Emergence of reproducible spatiotemporal activity during motor learning. Nature. 510 (7504), 263-267 (2014).
- Kato, D., et al. Motor learning requires myelination to reduce asynchrony and spontaneity in neural activity. Glia. 68 (1), 193-210 (2020).
- Busche, M. A., et al. Tau impairs neural circuits, dominating amyloid-β effects, in Alzheimer models in vivo. Nature Neuroscience. 22 (1), 57-64 (2019).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8 (9), 1263-1268 (2005).
- Quan, X., Kato, D., Daria, V., Matoba, O., Wake, H. Holographic microscope and its biological application. Neuroscience Research. 179, 57-64 (2022).
- Adesnik, H., Abdeladim, L. Probing neural codes with two-photon holographic optogenetics. Nature Neuroscience. 24 (10), 1356-1366 (2021).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nature Methods. 2 (12), 932-940 (2005).
- Svoboda, K., Denk, W., Kleinfeld, D., Tank, D. W. In vivo dendritic calcium dynamics in neocortical pyramidal neurons. Nature. 385 (6612), 161-165 (1997).
- Carrillo-Reid, L., Han, S., Yang, W., Akrouh, A., Yuste, R. Controlling visually guided behavior by holographic recalling of cortical ensembles. Cell. 178 (2), 447-457 (2019).
- Marshel, J. H., et al. Cortical layer-specific critical dynamics triggering perception. Science. 365 (6453), (2019).
- Gill, J. V., et al. Precise holographic manipulation of olfactory circuits reveals coding features determining perceptual detection. Neuron. 108 (2), 382-393 (2020).
- Robinson, N. T. M., et al. Targeted activation of hippocampal place cells drives memory-guided spatial behavior. Cell. 183 (6), 1586-1599 (2020).
- Packer, A. M., Russell, L. E., Dalgleish, H. W., Häusser, M. Simultaneous all-optical manipulation and recording of neural circuit activity with cellular resolution in vivo. Nature Methods. 12 (2), 140-146 (2015).
- Mardinly, A. R., et al. Precise multimodal optical control of neural ensemble activity. Nature Neuroscience. 21 (6), 881-893 (2018).
- Yang, W., Carrillo-Reid, L., Bando, Y., Peterka, D. S., Yuste, R. Simultaneous two-photon imaging and two-photon optogenetics of cortical circuits in three dimensions. Elife. 7, 32671 (2018).
- Forli, A., et al. Two-photon bidirectional control and imaging of neuronal excitability with high spatial resolution in vivo. Cell Reports. 22 (11), 3087-3098 (2018).
- Pégard, N. C., et al. Three-dimensional scanless holographic optogenetics with temporal focusing (3D-SHOT). Nature Communications. 8 (1), 1228 (2017).
- Dal Maschio, M., Donovan, J. C., Helmbrecht, T. O., Baier, H. Linking neurons to network function and behavior by two-photon holographic optogenetics and volumetric imaging. Neuron. 94 (4), 774-789 (2017).
- Russell, L. E., et al. All-optical interrogation of neural circuits in behaving mice. Nature Protocols. 17 (7), 1579-1620 (2022).
- Oron, D., Papagiakoumou, E., Anselmi, F., Emiliani, V. Two-photon optogenetics. Progress in Brain Research. 196, 119-143 (2012).
- Hernandez, O., et al. Three-dimensional spatiotemporal focusing of holographic patterns. Nature Communications. 7, 11928 (2016).
- Okada, T., et al. Pain induces stable, active microcircuits in the somatosensory cortex that provide a therapeutic target. Science Advances. 7 (12), 8261 (2021).
- Prakash, R., et al. Two-photon optogenetic toolbox for fast inhibition, excitation and bistable modulation. Nature Methods. 9 (12), 1171-1179 (2012).
- Gonçalves, J. T., Anstey, J. E., Golshani, P., Portera-Cailliau, C. Circuit level defects in the developing neocortex of Fragile X mice. Nature Neuroscience. 16 (7), 903-909 (2013).
- Akiyoshi, R., et al. Microglia enhance synapse activity to promote local network synchronization. eNeuro. 5 (5), (2018).
- Haruwaka, K., et al. Dual microglia effects on blood brain barrier permeability induced by systemic inflammation. Nature Communications. 10 (1), 5816 (2019).
- Kishi, K. E., et al. Structural basis for channel conduction in the pump-like channelrhodopsin ChRmine. Cell. 185 (4), 672-689 (2022).
- Deisseroth, K. Optogenetics: 10 years of microbial opsins in neuroscience. Nature Neuroscience. 18 (9), 1213-1225 (2015).
- Ko, H., et al. The emergence of functional microcircuits in visual cortex. Nature. 496 (7443), 96-100 (2013).
- Zong, W., et al. Large-scale two-photon calcium imaging in freely moving mice. Cell. 185 (7), 1240-1256 (2022).
- Villette, V., et al. ultrafast two-photon imaging of a high-gain voltage indicator in awake behaving mice. Cell. 179 (7), 1590-1608 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon