Method Article
慢性心臓ペーシングの並進ウサギモデル
要約
前臨床試験で人工ペーシングと心不全発症に利用できる長期心臓ペーシングの低侵襲レポリンモデルを紹介します。
要約
心臓ペーシングの動物モデルは、新しいデバイスのテスト、人工的にペースの速い心臓のリズムの病態生理学の研究、および不整脈誘発心筋症とその後の心不全の研究に有益です。現在、そのようなモデルはごくわずかしか利用できず、ほとんどの場合、広範なリソースが必要です。我々は、不整脈誘発性心不全を研究する可能性のある小型哺乳類における新しい実験的心臓ペーシングモデルを報告する。
全身吸入麻酔下にあるニュージーランドの白ウサギ6匹(平均体重3.5 kg)で頸部を解剖し、右外頸静脈 から ペーシングリードを1本挿入した。透視ガイダンスを使用して、リードをさらに右心室頂点に進め、そこで受動固定を使用して安定化しました。その後、心臓ペースメーカーを接続し、皮下ポケットに埋めました。
ペースメーカーの植え込みは成功し、治癒は良好でした。ウサギの解剖学的構造は鉛の配置に適しています。断続的なペーシングによる6か月の追跡期間中、平均感知心筋電位は6.3 mV(最小:2.8 mV、最大:12 mV)であり、測定された平均リードインピーダンスは744 Ω(最小:370 Ω、最大:1014 Ω)でした。ペーシングスレッショルドは当初0.8V±0.2Vで、フォローアップ中は安定していました。
この本研究は、小型哺乳類モデルで成功した経静脈心臓ペーシングを提示する最初の研究です。サイズと組織の脆弱性にもかかわらず、調整付きの人間サイズの機器は慢性心臓ペーシングに安全に使用できるため、この革新的なモデルは、不整脈誘発心筋症の発症とその結果としての心不全の病態生理学の研究に適しています。
概要
心不全研究および心臓ペーシング開発において、トランスレーショナルモデルは前臨床試験のために頻繁に必要とされる1。さらに、新しいデバイス、材料、および鉛の精製は、臨床使用の前に潜在的な合併症についてテストする必要があります。したがって、心臓ペーシングモデルは、人工的にペースを合わせた心臓リズムの分析や、心機能に対するそれらの病態生理学的影響の研究など、幅広い用途があります2,3。心臓ペーシングまたは頻脈誘発心筋症の実験では、さまざまな動物サイズのモデルを利用することができ、高速ペーシングから数週間以内に心不全が発症します1,3,4,5。
以前の研究では、このような用途での大型動物モデル(ブタ、イヌ、ヒツジ)の使用が報告されています2,3,6。ただし、これらのモデルの入手可能性は限られており、動物の手術と取り扱いに膨大なリソースが必要です。対照的に、小型哺乳類の使用は上記の懸念に対処し、その結果、最適で手頃な研究モデルとして役立つ可能性があります。しかし、小型哺乳類の心臓ペーシング研究はめったに報告されておらず、これは繊細な解剖学的構造、組織の脆弱性、および必要なペーシング率が高いことが原因である可能性があります7,8,9,10,11,12。
小型哺乳類ペースメーカーの研究では、外部ペースメーカー11、12またはワイヤレス顕微鏡ペーシングデバイス5、7、8、9を備えた部分的に埋め込まれたペーシングリードの手術モデルのみが使用されていますが、私たちの知る限り、完全に埋め込まれた人間サイズの経静脈ペースメーカーシステムの使用は今日まで報告されていません。レポリンモデルの以前の証拠は、数週間にわたる速い心拍数でのペーシングが心筋うつ病につながることを示しています11,12。この論文は、ウサギへのヒトサイズのペースメーカーの埋め込みに成功したことを示す、最初の実用的に実行可能な小型哺乳類モデルを提示します。記載された方法論は、心臓ペーシングの臨床的に関連するモデルを提示することを目的としており、頻脈またはペーシング誘発心筋症およびその結果としての心不全病態生理学のヒト研究に密接に変換することができます2,11,12。
プロトコル
この実験プロトコルは、カレル大学第一医学部の施設動物専門家委員会によってレビューおよび承認され、チェコ共和国プラハのカレル大学第一医学部生理学教室の大学実験研究所で、残虐行為からの動物の保護に関する法律第246/1992号に従って実施されました。すべての動物は、2011年に全米アカデミーズプレスが発行した実験動物の世話と使用のためのガイド、第8版に従って治療および世話をされました。すべての手順は、認可された獣医師の存在下で、そして指導の下で、標準的な獣医の慣習に従って行われました。6匹のニュージーランドの白ウサギがこの一連の実験に含まれました。ペースメーカー着床当日の平均体重は1kg±3.5kgであった。すべての値は、SEM±平均値として表され、必要に応じて、最小値と最大値の範囲で表されます。0.05< P 値が有意であると考えられた。テクニックの習得を成功させるには、動物の麻酔と手術の基本的なスキルが必要です。心臓ペーシングの経験が推奨されますが、必須ではありません。
1.術前ケア
- ウサギが少なくとも2週間収容施設に順応し、手術当日の動物の取り扱いと管理を容易にするために、人間の接触と操作に慣れるようにします。
- 動物に干し草と干し草ベースのペレットウサギの餌を与えます。定期的に新鮮な水を供給してください。
- 最適な食事摂取量や苦痛の欠如など、バイタル(体温、呼吸数)と全体的な状態の短い毎日のチェックを実行します。
2.麻酔、前投薬、モニタリング
- 30分の絶食後、前投薬を投与します:ブプレノルフィン(0.01-0.04 mg / kg IM)、ミダゾラム(0.3-0.6 mg / kg IM)、メデトミジン(0.03-0.06 mg / kg IM)、およびケタミン(5-10 mg / kg IM)。.
- 静脈内薬物適用のために辺縁耳静脈にカニューレを挿入します。血液学的および生化学的分析のために、少量のチューブ(0.5 mL)を使用して血液サンプルを収集します。
- 首(手術部位)と手足の右頸部でシェーバーを使用してウサギの皮膚を剃り、ECGモニタリング用の電極を取り付けます。ウサギの皮膚は刺激を受けやすく、小さな涙がよく見られるため、注意して剃ってください。
- 低体温を防ぐために動物を加熱パッドの上に置きます。
- 麻酔プロトコルに従って、パルスオキシメータによってECG、直腸体温、酸素飽和度などの生命機能を監視します。
- 動物の口と鼻にマスクをかぶせ、動物の顔の周りにゴム製のシールで固定します。動物の目を乾燥から保護するために軟膏を使用してください。
- 適切な鎮静を達成するために、フェイシャルマスク を介して 動物にイソフルラン(酸素と混合)を提供します。3.5%の濃度から始めて、角膜反射の抑制と運動痛の反応に関して、動物の反応に応じて必要に応じて減らします。
注意: 麻酔中の肺損傷のリスクを減らすために、自発換気が推奨されますが、低換気の場合に備えて、新生児の手動または自動人工呼吸器を準備しておく必要があります。 - すべての滅菌器具を準備します。
- 動物を透視テーブルに置きます。完全なX線個人用保護具を着用してください。
3.心室リード移植
- 外頸静脈の位置を確認し、皮膚上のその位置に印を付けます。
- ポビドンヨードを使用して領域全体を滅菌し、マークされた頸静脈領域の上に穴の開いた滅菌ドレープで手術部位を覆うことに進みます。
- マークされた頸静脈の上に平行に皮膚を切開します。外頸静脈の位置を特定し、隣接する線維組織と血管束から1 cmの長さを分離します。方向付けとその損傷を防ぐために頸動脈を見つけます。
- ペースメーカーを収容するために皮下組織にポケットを作成します。過度の出血や組織の損傷を防ぐために、鈍的解剖にはさみを使用してください。
- 隔離された血管セグメントの両端にゴムタイを使用して血管を固定し、血流を遮断します(図1)。
- 標準的なカットダウン技術を使用して、ブレードで血管壁の円周の約1/3のカットを行います。
- ベッセルピックを使用してカットを大きく開き、単一のパッシブペーシングリードをルーメンに導入します。
- 透視ガイダンスの下で、その先端をさらに右心室の頂点まで進めます(図2)。スタイレットを曲線に事前に成形し、それを使用してリードが三尖弁の輪を通過するように導きます。リードの先端がスタイレットで支えられていないことを確認して、リードが組織に触れたときに柔軟性と非外傷性を維持するようにします。
- ペーシングパラメータをテストします。心室リード感知信号とインピーダンスは安定している必要があり、ペーシングしきい値は低くなければなりません。隣接する筋肉の魅力があってはなりません(図3)。
- 保護ゴムスリーブの上にある繊維組織にステッチしてリードの位置を固定し、シルクタイを使用してリードの周りの血管内腔をシールします(図4)。
4.ペースメーカーの埋め込み
- ペースメーカーをペーシングリードに接続し、ネジを使用してIS-1コネクタを固定します。フォローアップ中に 非侵襲的ペーシング研究機能 (ステップ6を参照)を利用する場合は、ペースメーカーを 心房チャネルソケットに接続します。
- ペースメーカーとリードの余分な長さを事前に形成された皮下ポケットに埋めます(図5)。
- ポケットをポビドンヨードで洗い流します。モノフィラメント糸を用いて創傷の皮膚を縫合する。
- 目的のペーシングプログラムを設定し、ペーシングパラメータの最終チェックを実行します(図3)。
5.術後ケア
- 麻酔薬を撤回し、動物が適切な意識を取り戻すまで動物を注意深く観察します。
- アチパメゾール(0.01-0.03 mg / kg IM)を投与して、メデトミジンの作用を元に戻す。
- 意識が回復し、最適な体温が達成されたら、痛みを和らげるためにメロキシカム(0.4-0.6 mg / kg)を皮下投与します。.有効な疼痛評価尺度(例:.、ウサギのしかめっ面スケール)に従って痛みの緩和が適切でない場合は、6〜8時間後にブプレノルフィンを追加します。.
- メトクロプラミド(0.5-1 mg / kg IV)を投与して、さらなる胃腸のうっ滞を防ぎ、胃の運動性を刺激し、適切な食物摂取と便の生成が回復するまで1日あたり3回続けます。.
- 創傷が治癒するまで、広域スペクトルの静脈内抗生物質レジメンに従ってください(エンロフロキサシンは10〜20 mg / kg 2回/日あたり3〜7日間)。
- 動物を快適で身近な環境に移し、十分な意識を取り戻すまで観察します。完全に回復するまで、ウサギを他の動物の会社に戻さないでください。
- メロキシカム(0.4-0.6 mg / kg SC)投与を少なくとも5日間毎日維持します。.
- 安全でタイムリーな治癒を確実にするために、傷を定期的に監視してドレッシングします。
- 完全に治癒したら、処置の約14日後に、非吸収性の皮膚縫合糸を取り除きます。
- リモート問い合わせを実行し、ペーシングパラメータ(ペーシングしきい値、心筋センシング、リードインピーダンスなど)を定期的にチェックします。
注:取得された値は安定した傾向に従う必要があります。
6.ペーシングプロトコルとデータ収集
- ペースメーカーに問い合わせ、パラメータメニューで最小基本レートを選択してバックアップペーシングモードを設定します。
注:小動物に固有の高い心拍数とその高い変動性により、指定された要件に応じて、300〜400bpmの速度で継続的な人工ペーシングを実現できます。各ペースメーカーの問い合わせ中に断続的なペーシングを実現できます(手順6.4および 図6に従ってください)。 - ペーシングリードインピーダンスを連続的に記録します。ペースメーカープログラマーの 診断メニューで、 データ収集を開始します。
- 心筋電位を継続的に記録し、ペースメーカーの尋問によって毎週手動でチェックします。ペースメーカープログラマーのテストメニューの[センシング]タブで、ユニポーラおよびバイポーラ心筋電位の振幅を測定します。
- 尋問によってペーシングしきい値を定期的に(毎週)評価します。非侵襲的ペーシングスタディ([テスト]メニューで[NIPSを選択])機能を使用して、十分なペーシング速度でペーシングしきい値を測定します(図6)。さまざまな刺激時間(0.1ミリ秒から1.5ミリ秒)のペーシングしきい値を評価し、ボルトで表します。心臓内電図または表面ECGを使用して、ペーシング刺激出力がしきい値を超えたときの捕捉損失を決定します。
- 標準的な獣医の慣習に従ってすべての手順を実行し、各研究の完了時に施設の規制に従って動物を犠牲にし、剖検を行います。ペースメーカーとリードを移植し、炎症反応、バイオフィルム形成、および線維症について調べます。
注:このプロトコルでは、動物を安楽死させるために、深麻酔下でカリウムの過剰摂取が行われました。
結果
合計6匹の動物が研究に含まれました。すべての動物において、ペーシングリードは外頸静脈 を介して 右心室頂点に首尾よく埋め込まれた(補足図S1)。位置は透視法によって確認され、リードはゴムスリーブ上で隣接する組織に縫合された。X線イメージングによると、リードはペーシングプロトコル期間全体にわたってその位置を維持しました。付属のペースメーカーは外側頸部で触知可能であり、動物に明らかな問題を引き起こしませんでした。すべての創傷は完全に治癒し、局所的な合併症はありませんでした。
リードチップには、2つのチタン-白金電極(遠位半球リングと近位円筒リング電極)が電極間距離25mmで装備されていました(図2)。リード線は頂点に自由に進み、シリコン固定タインによって受動的に取り付けられました。これにより、先端電極からのユニポーラペーシングと、右心室に位置する両方の電極間のバイポーラペーシングが可能になりました。
代表的な心室心筋電位感知信号を図 3に示し、測定されたペーシングパラメータを表1および 図7に詳細に示す。処置時の平均感知心筋電位は5.6V±0.8mV(最小:2.8mV、最大:8mV)、リードインピーダンスは675 Ω ±74 Ω(最小:468 Ω、最大:951 Ω)、ペーシング閾値は0.8V±0.26V(最小:0.2V、最大:2.2V)であり、刺激持続時間は標準0.4msとした。
断続的なペーシングによる3か月と6か月の追跡後、平均感知心筋電位はそれぞれ7.4 mV±1.2 mV(最小:4.0 mV、最大:12.0 mV)および6.3 mV ±1.0 mV(最小:4.2 mV、最大:10.3 mV)でした。.平均リードインピーダンスは、それぞれ869 Ω ±32 Ω(最小:760 Ω、最大:975 Ω)および725 Ω ±96 Ω(最小:370 Ω、最大:1014 Ω)であり、ペーシングしきい値は1.2V±0.3V(最小:0.2V、最大:2.2V)、1.4V±0.3V(最小:0.5V、最大:2.3V)に変更されました。 それぞれ。この期間、すべてのパラメータの変化は統計的に有意ではなく(P > 0.05)、バイポーラおよびユニポーラパラメータは同等の傾向に従いました(図7 および 表1)。
1例は部分的な鉛の貫通のために早期に終了し、移植後2日目に急激なインピーダンス低下が観察されました。その後、追跡の2か月目に、閾値が徐々に上昇し、高出力のペーシングが筋肉の束縛を引き起こしました。動物は無症候性のままでしたが、剖検中に、ペーシングリードの先端が心筋下壁を通って心膜に約3 mmの長さで浸透していることがわかりました。出血や感染の兆候は観察されませんでした。
処置前、術後1日目、および術後7日目の平均白血球数は、それぞれ5.9 × 109 / L、7.37 × 10 9 / L、および7.42 × 10 9/ Lであり、平均ヘモグロビンレベルはそれぞれ105 g / L、113 g / L、および110 g / Lであり、平均血小板数は317 ×10 9 / Lでした。 それぞれ274×109 / L、および219×109 / L。検査値は、処置後の最初の週に有意な変化を示さなかった(P > 0.05 すべて)。顕微鏡評価では、ペーシングリードシリコン表面は繊維組織(約100μmの厚さ)で覆われていましたが、細胞は見つかりませんでした(図8)。
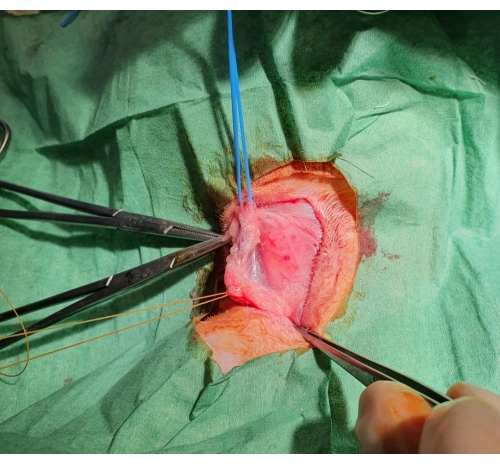
図1:外科的頸静脈解離。 皮膚を切断した後、皮下ポケットが形成され、頸静脈が露出し、遠位に結紮され、青い輪ゴムで近位に支持されます。 この図の拡大版を表示するには、ここをクリックしてください。
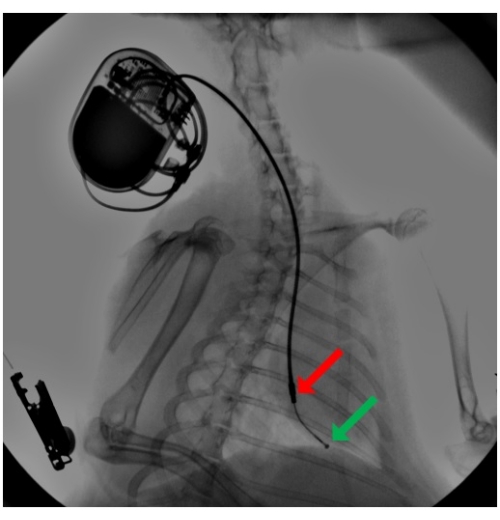
図2:ペースメーカーリード移植時の透視。 ペーシングリードは外頸静脈 を介して 導入され、事前に成形されたスタイレットを使用して、リードは右心室頂点に進み、そこでシリコンタインによる受動固定によって固定されます。取り付けられたペースメーカーは、首の部分の皮下ポケットに埋め込まれています。矢印は、遠位半球リング(緑)と近位円筒リング(赤)の電極を指しています。 この図の拡大版を表示するには、ここをクリックしてください。
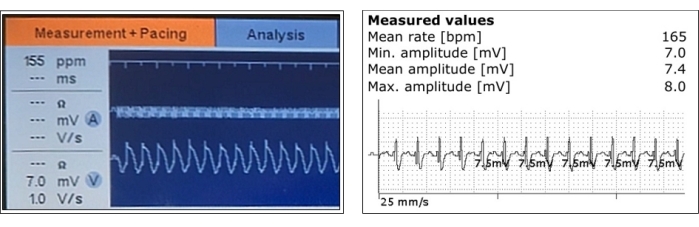
図3:感知された心室心筋電位の代表的な測定値。 心室センシングとその振幅測定は、ペーシングリードポジショニング後の急性期(左)とペースメーカー植え込み後(右)に示されています。 この図の拡大版を表示するには、ここをクリックしてください。
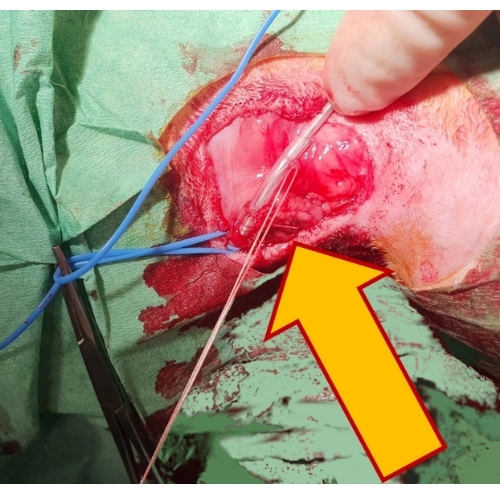
図4:ペーシングリードの固定。 ゴム製のスリーブ(矢印)上の2つの非吸収性縫合糸によってリードを下の組織に固定すると、リードが所定の位置に固定され、脱臼が防止されます。 この図の拡大版を表示するには、ここをクリックしてください。
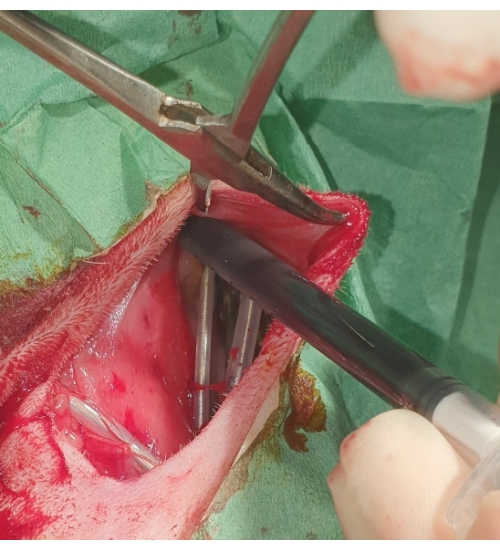
図5:ペースメーカーの配置。 ペースメーカーは皮下ポケットに埋め込まれ、ポビドンヨードで洗い流されます。 この図の拡大版を表示するには、ここをクリックしてください。
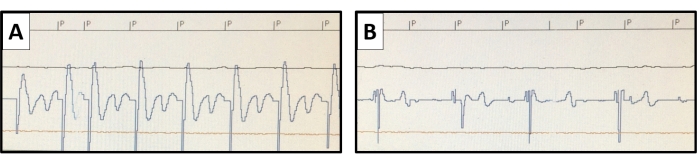
図6:ペーシングしきい値の測定。 ペースメーカーの非侵襲的ペーシング研究機能を使用して、ネイティブ心拍数よりも高いペーシングが行われます。ペーシング刺激はPでマークされています。ペーシングスレッショルドは、さまざまな刺激出力で評価されます。(A)心室捕捉の心内膜電位の代表例は、0.4msで0.8Vの出力で示されていますが、(B)は、0.4msで出力を0.6Vに低下させた状態で捕捉力の損失が見られます。 この図の拡大版を表示するには、ここをクリックしてください。
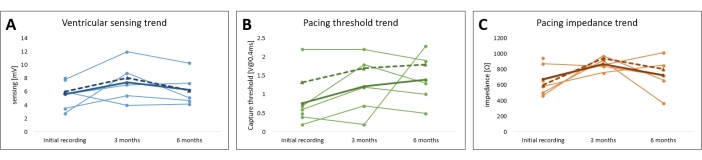
図7:レポリン心臓ペーシングモデルペーシングパラメータのフォローアップ。 すべての被験者について、(A)ペーシング閾値、(B)ペーシングインピーダンス、および(C)心筋センシングの傾向がプロットされます。平均ユニポーラ値(フルライン)とバイポーラ値(点線)は太字で示されています。 この図の拡大版を表示するには、ここをクリックしてください。
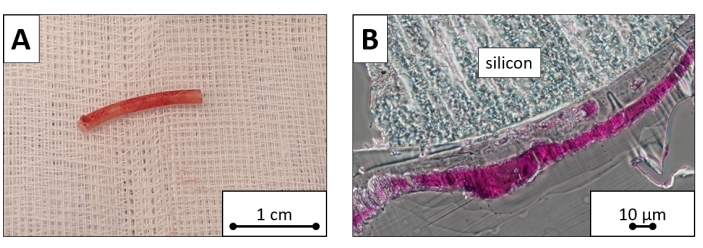
図8:移植されたペーシングリードサンプル。 外植ペーシングリードの心室部分カット。(A)巨視的画像および(B)トルイジンブルーで染色された顕微鏡像は、繊維組織の層で覆われたシリコン表面を明らかにする。スケールバー = (A )1 cm, (B) 10 μm. この図の拡大版を表示するには、ここをクリックしてください。
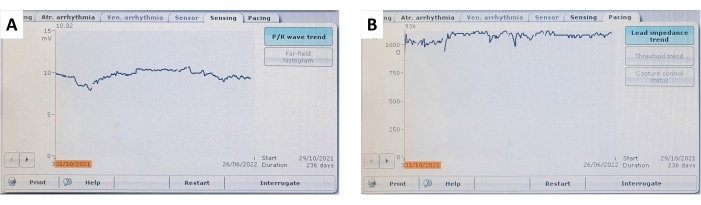
図9:心室センシングとリードインピーダンスの傾向。 (A)236日間のフォローアップにおける継続的かつ安定した心室心筋センシングおよび(B)心室リードインピーダンス傾向の代表例。 この図の拡大版を表示するには、ここをクリックしてください。
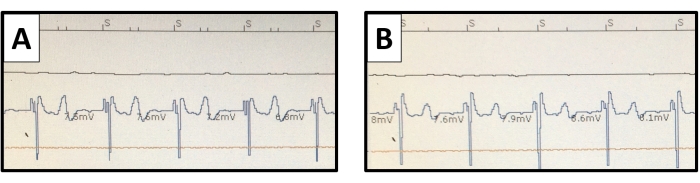
図10:心室心筋内膜電図。ペースメーカーの尋問で感知された心室電位は、(A)ユニポーラおよび(B)バイポーラ接続で描かれています。T波ポテンシャルはユニポーラ接続でより明確になりますが、過検出を引き起こしません。この図の拡大版を表示するには、ここをクリックしてください。
| 単極 | 手続き周辺 | フォローアップ | |||||||
| 3ヶ月 | 6ヶ月 | ||||||||
| 感知された心筋電位[mV] | 5.6 ± 0.8 | 7.4 ± 1.2 | 6.3 ± 1.0 | ||||||
| ペーシングスレッショルド [V、0.4ms] | 0.8 ± 0.3 | 1.2 ± 0.3 | 1.4 ± 0.3 | ||||||
| リードインピーダンス [Ω] | 675 ± 74 | 869 ± 32 | 725 ± 96 | ||||||
表1:レポリン心臓ペーシングモデルペーシングパラメータのフォローアップ。 感知された心筋電位、ペーシング閾値、およびリードインピーダンスの値は、3か月および6か月の追跡のSEM±平均として表されます。
補足図S1:ウサギに移植されたヒトサイズの経静脈ペーシングシステムの概略図。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
特定の制約にもかかわらず、小型哺乳類モデルは臨床研究に利点を提供します13。確立された方法論により、心臓ペーシングモデルは、大型動物モデルや臨床試験と比較して大幅に低いリソース要件で、広範囲の心血管疾患および循環器病態のシミュレーションに最適なプラットフォームを提供できます7,14。この論文は、ウサギの長期にわたる心臓ペーシングの革新的で低侵襲モデルを提示します。このプロトコルに従うことにより、小型哺乳類モデルにおいて、全長ペーシングリードを含む、完全に埋め込まれたフルサイズのヒトペースメーカーシステムを使用することが可能である。
ペースメーカーの植え込み時には、すべての動物において、右心室の頂点の安定した最適な位置にリードを配置することができました。侵襲的に測定されたペーシングパラメータは正常範囲内であり、大型動物実験またはヒト医学で一般的な値と同様でした2,3。右ウサギの心室における6.5mV±1.9mVの測定平均心筋電位は、標準的な植込み型ペースメーカーによって明確に認識されます。測定された最大ペーシングスレッショルドは2.5Vで、刺激持続時間は0.4msで、インピーダンスはフォローアップ中も正常範囲内にとどまりました。全体として、これらは最適なペーシングパラメータを表します。
フォローアップ中、ペーシングパラメータは、埋め込まれたペースメーカーに問い合わせることによって非侵襲的に検証され、これらのパラメータは図 7、 図9、および 表1に要約されています。心室センシングとリードインピーダンスは、6か月間にわたって有意な変化を示しませんでした。すべての被験者で平均したペーシングしきい値の増加傾向にもかかわらず、有意な変化は観察されず、研究全体を通してペーシングを安全に実施することができました。ペーシングパラメータのわずかな変動は、局所的な炎症反応または線維症に起因する可能性があり、ステロイド溶出物質を利用することで軽減できます。長期的なペーシング研究で使用するには、ペーシングパラメータを頻繁に監視および調整する必要があります。
血液分析では,移植後1週間の全身性炎症や貧血は認められなかった.処置前の血小板数の増加傾向は、追跡期間中も値が安定していたため、動物の取り扱いと鎮静によって引き起こされる急性ストレスに起因する可能性があります。ペースメーカー埋め込みの恐れられている合併症は、鉛の浸透です。特に小型哺乳類組織の脆弱性では、ペーシングパラメータが急激に変化すると浸透が疑われ、リードは常に適切な位置に注意深く操作する必要があることを強調する必要があります。X線画像で鉛の貫通を確認できます。急性心臓埋め込み型電子機器(CIED)関連の細菌感染は、死亡率と罹患率に大きく寄与する別の潜在的に重篤な合併症です15。したがって、感染率を減らし、ペーシングシステムの耐久性を延ばすために、新しい材料、ペーシング技術を研究し、改良を導くことが非常に重要です。提示された方法論は、そのような重要な実験研究のための適切な動物モデルを提供する。
Ryuらは、外科的に埋め込まれた心房ペーシングリードおよび外部パルス発生器を用いて進行性心不全を伴う心筋症を誘発した12。同様に、Freemanらは、持続的な心室ペーシングが3〜4週間にわたってウサギの心筋うつ病につながると結論付けました11。小動物のネイティブ心拍数が高いため、ペースメーカーは、完全にペースのリズムを維持するために、約300〜400 bpmの周波数をペーシングできる必要があります。これらのより高いペーシング頻度は週11,12にわたって進行性心不全につながるため、提示されたレポリンモデルは、結果として生じる心筋症の発症と調査に最適です。そのサイズを考慮すると、これらの小型モデルは、体液性または心筋組織の変化の評価などの特定のアプリケーションに最適です11,16。心エコー検査はさらに、レポリン心臓の寸法および収縮性を評価するために使用することができる12、17。比較すると、心不全のより大きな動物モデルには、冠循環または圧力-体積評価を含む詳細な侵襲的血行動態評価の可能性など、他の利点があります2。
ペーシング研究のためのレポリンモデルの具体的な選択は、その複数の利点に基づいていました。ウサギはこの手順によく耐え、人間サイズのペースメーカーシステムを受け取る能力を実証する最小の哺乳類の1つであり、他の大型動物よりも少ないリソースの展開を必要とします。一部の著者18は、小型哺乳類の生理機能は人間の生理機能を反映していない可能性があると考えていますが、これらの小型哺乳類で観察されたペーシングパラメータは、ヒトまたは大型動物で見られるものと非常に類似しており1,2,3,19、トランスレーショナル研究に容易に利用できることを意味します。
この小型哺乳類モデルにおけるリード留置とペースメーカーの埋め込み中に、大型動物モデルでの以前の実験との類似点に遭遇しましたが、有意差を指摘する必要があります。レポリン組織は壊れやすく、血管と心室の壁は薄いです。手順全体を通して穏やかな操作が必要です。リードチップは常にスタイレットでサポートされていないため、柔軟性があります。特に三尖弁を通過し、リード先端を右心室の頂点に配置する場合は、怪我をしないように細心の注意を払い、透視ガイダンスの下で操作を行う必要があります。チップを他の場所に配置することもできます。最適な術周囲パラメータを用いて右心房付属器と心室流出路の位置をテストしましたが、リードの安定性は限られている可能性があり、現在のデータは代替ペーシング部位をサポートできません。ウサギの外頸静脈は、単一のペーシングリードを挿入するのに適切なサイズです。複数のリードの移植が意図されている場合は、より大きな動物の使用をお勧めします。
心筋線維柱帯における鉛固定は、リード先端にシリコンタインを用いて受動的に行われた。我々の経験に基づいて、タンポナーデまたは胸部出血による組織損傷を防ぐために、薄い心筋層にねじ込まれたらせんによる能動固定の使用は避けなければならない。ウサギの右心室のサイズが小さいにもかかわらず、25 mm間隔で配置されたペーシング電極のペアにより、ユニポーラとバイポーラの両方のセンシングおよびペーシング構成が可能になりました(図10)。これにより、心臓ペーシング研究に汎用性を提供できます。
小型哺乳類18の高い天然心拍数のために、連続ペーシングは、埋め込み型ペースメーカのカスタムプログラミングによって達成することができる。あるいは、一般的な人間認定ペーシングシステムの単純な社内修正の方法を使用して、以前に詳細に説明したように、高速ペーシング周波数を得ることができます2、20。キャプチャの喪失は、ネイティブ心拍数が高い状態でもテストできる独自のアプローチである非侵襲的ペーシング研究機能を使用して評価されました。報告されたペーシングパラメータは定期的に測定された。埋め込まれたペースメーカーは、心筋電位とリードインピーダンスのセンシングを自動的かつ継続的に記録することができましたが、ネイティブ心拍数が高いため、ペーシングしきい値を手動で測定する必要がありました。したがって、継続的なペーシングが必要な場合は、キャプチャの損失を防ぐために頻繁な評価をお勧めします。
Gutrufらは以前、小動物モデルにおける高度に小型化されたワイヤレスのバッテリーフリーペースメーカーの使用を報告しました7。彼らの研究と比較して、ここで説明する人間サイズのペースメーカーの埋め込みは、革新的なリードテスト、臨床研究への密接な翻訳、および一般に入手可能な材料によるより広いアプリケーションの可能性を提供する異なるアプローチを表しています。Zhouらは、房室ブロックを治療するために胎児の心臓に経皮的に埋め込まれるように設計された小型心臓ペースメーカーの開発を発表しました。彼らは、そのような装置の実現可能性を確認するために成体ウサギ実験の使用を報告した9。他の人は以前に侵襲的処置のためのウサギ挿管の利点を報告しました。私たちの経験に基づいて、口腔鼻マスクで自発呼吸を維持するアプローチは、気道の操作によって引き起こされる合併症のリスクを最小限に抑えるため、このような短い手順により多くの利点があります。さらに、褥瘡による損傷も防ぐことができます。
研究プロトコルは慎重に準備され、含まれる動物の総数は適切でしたが、いくつかの制限を指摘する必要があります。ウサギの右心室のサイズが小さいため、複数のリード配置はできませんでした。右室流出路におけるリード先端の位置を試験してみたが,安定性に関する知見は限られており,かなり限定的であると予想している。ペーシングインピーダンスの傾向は、リード配置後最初の1週間以内に低下を示しました。これは局所的な炎症と軽度の線維症が原因である可能性がありますが、その後すぐにリードインピーダンスが回復し、安定性の傾向が継続的に維持されました。この研究では、シングルチャンバーペーシングシステムを使用しました。将来の研究では、片側頸静脈を通るペーシングリードのペアを進めることも調査する必要があります。これはこの研究ではテストされていませんが、右心房に2番目のリードを導入して安定させることができると考えています。
一般に、心臓ペーシングの動物モデルは、心臓血管研究において多くの用途があります。第一に、数週間にわたる非生理学的な高頻度でのペーシングは、以前に報告されているように頻脈誘発心筋症につながり、慢性心不全の病態生理学と治療の研究を可能にします2,3,11,12。さらに、洗練された材料と技術の研究は、提示されたレポリンモデルを利用することができ、中期的なペーシング研究に示唆される可能性があります。我々の知る限り、この研究は、複雑な心臓ペーシング実験のためのそのような小型哺乳類モデルの利点を実証した最初のものである21。結論として、記載された方法論では、組織の脆弱性および繊細な解剖学的構造にもかかわらず、ヒトサイズのペーシングシステムを小型哺乳動物に首尾よく移植することができる。トレーニング後、この手法は簡単に再現可能であり、心臓血管研究に幅広い用途があるペース頻脈のモデルの基礎を提供します。
開示事項
著者には利益相反はありません。
謝辞
著者は、マリア・キム、ヤナ・ボルテロヴァー、アリーナ・エールリコヴァー、マチェイ・フラコヴィナ、レオシュ・テイクル、ヤナ・ミシュコヴァー、テレザ・ヴァヴジーコヴァーのインスピレーション、仕事、技術サポートに対するアドバイスと支援に感謝の意を表します。この研究は、MH CZ-DRO(NNH、00023884)、IG200501助成金によって資金提供されました。
資料
| Name | Company | Catalog Number | Comments |
| Medication | |||
| atipamezole | Eurovet Animal Health, B.V. | Atipam | anesthetic |
| buprenorphine | Vetoquinol | Bupaq | analgetic |
| enrofloxacin | Krka | Enroxil | antibiotic |
| isoflurane | Baxter | Aerrane | anesthetic |
| ketamine hydrochloride | Richter Gedeon | Calypsol | anesthetic |
| medetomidine | Orion Corp. | Domitor | anesthetic |
| meloxicam | Cymedica | Melovem | analgetic |
| povidone iodine | Egis Praha | Betadine | disinfection |
| Silver Aluminium Aerosol | Henry Schein | 9003273 | tincture |
| Surgical materials | |||
| 2-0 Perma-Hand Silk | Ethicon | A185H | silk tie suture |
| 2-0 Vicryl | Ethicon | V323H | absorbable braided suture |
| 4-0 Monocryl | Ethicon | MCP494G | monofilament |
| BearHugger | 3M | BearHugger | heating pad |
| cauterizer | |||
| Metzenbaum scissors, lancet with #22 blade, DeBakey forceps, needle driver | basic surgical equipment | ||
| sterile drapes | |||
| Diagnostic devices | |||
| Acuson VF10-5 | Siemens Healthcare | sonographic vascular probe | |
| Acuson x300 | Siemens Healthcare | ultrasound system | |
| ESP C-arm | GE Healthcare | ESP | X-ray fluoro C-arm |
| Pacing devices | |||
| 400 | Medico | CAT400 | bipolar pacing lead |
| Effecta DR | Biotronic | 371199 | implantable pacemaker |
| ERA 3000 | Biotronic | 128828 | external pacemaker |
| ICS 3000 | Biotronic | 349528 | pacemaker programmer |
参考文献
- Power, J. M., Tonkin, A. M. Large animal models of heart failure. Australian and New Zealand Journal of Medicine. 29 (3), 395-402 (2008).
- Hála, P., et al. Tachycardia-induced cardiomyopathy as a chronic heart failure model in swine. Journal of Visualized Experiments. (132), e57030(2018).
- Powers, J. C., Recchia, F. Canine model of pacing-induced heart failure. Methods in Molecular Biology. 1816, 309-325 (2018).
- Whipple, G. H., Sheffield, L. T., Woodman, E. G., Theophilis, C., Friedman, S. Reversible congestive heart failure due to chronic rapid stimulation of the normal heart. Proceedings of the New England Cardiovascular Society. 20, 39-40 (1962).
- Laughner, J. I., et al. A fully implantable pacemaker for the mouse: From battery to wireless power. PLoS One. 8 (10), 76291(2013).
- Yue-Chun, L., et al. Establishment of a canine model of cardiac memory using endocardial pacing via internal jugular vein. BMC Cardiovascular Disorders. 10, 30(2010).
- Gutruf, P., et al. Wireless, battery-free, fully implantable multimodal and multisite pacemakers for applications in small animal models. Nature Communications. 10 (1), 5742(2019).
- Zhou, L., et al. A percutaneously implantable fetal pacemaker. Annual International Conference of the IEEE Engineering in Medicine and Biology Society. 2014, 4459-4463 (2014).
- Zhou, L., Chmait, R., Bar-Cohen, Y., Peck, R. A., Loeb, G. E. Percutaneously injectable fetal pacemaker: Electrodes, mechanical design and implantation. Annual International Conference of the IEEE Engineering in Medicine and Biology Society. 2012, 6600-6603 (2012).
- Jordan, C. P., et al. Minimally invasive resynchronization pacemaker: A pediatric animal model. The Annals of Thoracic Surgery. 96 (6), 2210-2213 (2013).
- Freeman, G. L., Colston, J. T. Myocardial depression produced by sustained tachycardia in rabbits. American Journal of Physiology. 262, 63-67 (1992).
- Ryu, K. H., et al. Force-frequency relations in the failing rabbit heart and responses to adrenergic stimulation. Journal of Cardiac Failure. 3 (1), 27-39 (1997).
- Hulsmans, M., et al. A miniaturized, programmable pacemaker for long-term studies in the mouse. Circulation Research. 123 (11), 1208-1219 (2018).
- Nishida, K., Michael, G., Dobrev, D., Nattel, S. Animal models for atrial fibrillation: Clinical insights and scientific opportunities. Europace. 12 (2), 160-172 (2010).
- Clementy, N., et al. Pacemaker complications and costs: A nationwide economic study. Journal of Medical Economics. 22 (11), 1171-1178 (2019).
- Armoundas, A. A., et al. Cellular and molecular determinants of altered Ca2+ handling in the failing rabbit heart: primary defects in SR Ca2+ uptake and release mechanisms. American Journal of Physiology-Heart and Circulatory Physiology. 292 (3), 1607-1618 (2007).
- Giraldo, A., Talavera López, J., Brooks, G., Fernández-Del-Palacio, M. J. Transthoracic echocardiographic examination in the rabbit model. Journal of Visualized Experiments. (148), e59457(2019).
- Spannbauer, A., et al. Large animal models of heart failure with reduced ejection fraction (HFrEF). Frontiers in Cardiovascular Medicine. 6, 117(2019).
- Byrne, M. J., et al. An ovine model of tachycardia-induced degenerative dilated cardiomyopathy and heart failure with prolonged onset. Journal of Cardiac Failure. 8 (2), 108-115 (2002).
- Hála, P., et al. Increasing venoarterial extracorporeal membrane oxygenation flow puts higher demands on left ventricular work in a porcine model of chronic heart failure. Journal of Translational Medicine. 18 (1), 75(2020).
- Riehle, C., Bauersachs, J. Small animal models of heart failure. Cardiovascular Research. 115 (13), 1838-1849 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved