Method Article
Modèle translationnel de stimulation cardiaque chronique chez le lapin
Dans cet article
Résumé
Nous présentons un modèle mini-invasif de stimulation cardiaque à long terme de la léporine qui peut être utilisé pour la stimulation artificielle et le développement de l’insuffisance cardiaque dans les études précliniques.
Résumé
Les modèles animaux de stimulation cardiaque sont utiles pour tester de nouveaux dispositifs, étudier la physiopathologie des rythmes cardiaques à rythme artificiel et étudier les cardiomyopathies induites par l’arythmie et l’insuffisance cardiaque subséquente. Actuellement, seuls quelques modèles de ce type sont disponibles, et ils nécessitent principalement des ressources importantes. Nous rapportons un nouveau modèle expérimental de stimulation cardiaque chez les petits mammifères avec le potentiel d’étudier l’insuffisance cardiaque induite par l’arythmie.
Chez six lapins blancs néo-zélandais (poids moyen: 3,5 kg) sous anesthésie générale par inhalation, la région jugulaire a été disséquée et une seule sonde de stimulation a été insérée via la veine jugulaire externe droite. À l’aide d’un guidage fluoroscopique, la sonde a été avancée jusqu’à l’apex ventriculaire droit, où elle a été stabilisée par fixation passive. Un stimulateur cardiaque a ensuite été connecté et enterré dans une poche sous-cutanée.
L’implantation du stimulateur cardiaque a réussi avec une bonne cicatrisation; L’anatomie du lapin est favorable au placement de la laisse. Pendant 6 mois de suivi avec stimulation intermittente, le potentiel myocardique moyen détecté était de 6,3 mV (min: 2,8 mV, max: 12 mV), et l’impédance moyenne de plomb mesurée était de 744 Ω (min: 370 Ω, max: 1014 Ω). Le seuil de stimulation était initialement de 0,8 V ± 0,2 V et est resté stable au cours du suivi.
Cette étude est la première à présenter une stimulation cardiaque transveineuse réussie dans un modèle de petit mammifère. Malgré la taille et la fragilité des tissus, l’instrumentation à taille humaine avec des ajustements peut être utilisée en toute sécurité pour la stimulation cardiaque chronique, et donc, ce modèle innovant est adapté pour étudier le développement de la cardiomyopathie induite par l’arythmie et la physiopathologie de l’insuffisance cardiaque qui en résulte.
Introduction
Dans la recherche sur l’insuffisance cardiaque et le développement de la stimulation cardiaque, des modèles translationnels sont fréquemment nécessaires pour les essais précliniques1. De plus, les nouveaux dispositifs, matériaux et raffinements de plomb doivent être testés pour détecter leurs complications potentielles avant leur utilisation clinique. Ainsi, les modèles de stimulation cardiaque ont un large éventail d’applications, y compris l’analyse des rythmes cardiaques artificiellement rythmés et l’étude de leurs effets physiopathologiques sur la fonction cardiaque 2,3. Les expériences de cardiomyopathie induite par la stimulation cardiaque ou la tachycardie peuvent utiliser des modèles de différentes tailles d’animaux, avec le développement d’une insuffisance cardiaque dans les semaines suivant une stimulation à taux élevé 1,3,4,5.
Des études antérieures ont rapporté l’utilisation de modèles animaux de grande taille - porcins, canins et ovins - dans de telles applications 2,3,6. Cependant, la disponibilité de ces modèles est limitée et ils nécessitent des ressources importantes pour la chirurgie et la manipulation des animaux. En revanche, l’utilisation de petits mammifères pourrait répondre aux préoccupations susmentionnées et, par conséquent, servir de modèle de recherche optimal et abordable. Cependant, des études de stimulation cardiaque sur de petits mammifères ont rarement été rapportées, ce qui pourrait être dû à leur anatomie délicate, à la fragilité des tissus et au taux de stimulation plus élevé requis 7,8,9,10,11,12.
Seuls des modèles chirurgicaux de sondes de stimulation partiellement implantées avec stimulateurs cardiaques externes11,12 ou des dispositifs de stimulation microscopiques sans fil 5,7,8,9 ont été utilisés dans des études sur des stimulateurs cardiaques de petits mammifères, mais à notre connaissance, l’utilisation de systèmes de stimulateurs cardiaques transveineux entièrement implantés et de taille humaine n’a pas été signalée à ce jour. Des preuves antérieures dans des modèles de léporine montrent que la stimulation rapide du cœur pendant des semaines conduit à la dépression myocardique11,12. Cet article présente le premier modèle de petit mammifère pratiquement viable, démontrant l’implantation réussie d’un stimulateur cardiaque de taille humaine chez le lapin. La méthodologie décrite vise à présenter un modèle cliniquement pertinent de stimulation cardiaque et peut être étroitement transposée aux études humaines de la cardiomyopathie induite par la tachycardie ou la stimulation et de la physiopathologie de l’insuffisance cardiaque qui en résulte 2,11,12.
Protocole
Ce protocole expérimental a été examiné et approuvé par le Comité institutionnel d’experts sur les animaux de la Première Faculté de médecine de l’Université Charles et exécuté au laboratoire expérimental de l’Université, Département de physiologie, Première Faculté de médecine, Université Charles de Prague (République tchèque), conformément à la loi no 246/1992 sur la protection des animaux contre la cruauté. Tous les animaux ont été traités et soignés conformément au Guide for the Care and Use of Laboratory Animals, 8e édition, publié par National Academies Press, 2011. Toutes les procédures ont été effectuées conformément aux conventions vétérinaires standard en présence et sous la direction d’un vétérinaire agréé. Six lapins blancs néo-zélandais ont été inclus dans cette série d’expériences. Leur poids corporel moyen était de 3,5 kg ± 1 kg le jour de l’implantation du stimulateur cardiaque. Toutes les valeurs sont exprimées en moyenne ± MEB et, le cas échéant, par fourchettes de valeurs minimales et maximales mesurées. Une valeur P < 0,05 a été jugée significative. Pour une maîtrise réussie de la technique, des compétences de base en anesthésie animale et en chirurgie sont nécessaires; Une expérience préalable de la stimulation cardiaque est conseillée, mais pas obligatoire.
1. Soins préopératoires
- Permettre aux lapins de s’acclimater à leur installation d’hébergement pendant au moins 2 semaines et se familiariser avec le contact humain et la manipulation pour faciliter la manipulation et la gestion des animaux le jour de la chirurgie.
- Nourrissez les animaux avec du foin et un régime de lapin granulé à base de foin. Fournir de l’eau fraîche à intervalles réguliers.
- Effectuez un bref contrôle quotidien de leurs signes vitaux (température corporelle, fréquence respiratoire) et de leur état général, y compris l’apport alimentaire optimal et l’absence de détresse.
2. Anesthésie, prémédication et surveillance
- Après 30 minutes de jeûne, administrer une prémédication : buprénorphine (0,01-0,04 mg/kg IM), midazolam (0,3-0,6 mg/kg IM), médétomidine (0,03-0,06 mg/kg IM) et kétamine (5-10 mg/kg IM).
- Insérez une canule dans la veine marginale de l’oreille pour l’application intraveineuse du médicament. Prélever des échantillons de sang à l’aide de tubes de faible volume (0,5 mL) pour les analyses hématologiques et biochimiques.
- Rasez la peau du lapin à l’aide d’un rasoir dans la région jugulaire droite du cou – le site chirurgical – et sur les membres pour fixer les électrodes pour la surveillance de l’ECG. Rasez-vous avec soin, car la peau des lapins est facilement sensible aux irritations et de petites larmes sont couramment observées.
- Placez l’animal sur un coussin chauffant pour prévenir l’hypothermie.
- Surveillez les fonctions vitales, y compris l’ECG, la température corporelle rectale et la saturation en oxygène par un oxymètre de pouls, conformément au protocole d’anesthésie.
- Placez un masque sur la bouche et le nez de l’animal et fixez-le par un joint en caoutchouc autour du visage de l’animal. Utilisez une pommade pour protéger les yeux de l’animal de la sécheresse.
- Pour obtenir une sédation adéquate, fournissez aux animaux de l’isoflurane (mélangé à de l’oxygène) via le masque facial. Commencez avec une concentration de 3,5% et réduisez au besoin en fonction des réponses de l’animal en termes de réflexe cornéen supprimé et de réponse à la douleur motrice.
REMARQUE: Pour réduire le risque de lésion pulmonaire pendant l’anesthésie, une ventilation spontanée est recommandée, mais un ventilateur manuel ou automatique néonatal doit être maintenu prêt en cas d’hypoventilation. - Préparez tous les instruments stériles.
- Placez l’animal sur une table de fluoroscopie. Portez un équipement de protection individuelle complet aux rayons X.
3. Implantation de sonde ventriculaire
- Localisez la veine jugulaire externe et marquez sa position sur la peau.
- Stérilisez toute la région à l’aide de povidone-iode et recouvrez le site de la chirurgie avec un champ stérile percé d’un trou sur la zone jugulaire marquée.
- Faites une incision sur la peau parallèle sur la veine jugulaire marquée. Localisez la veine jugulaire externe et isolez une longueur de 1 cm du tissu fibreux adjacent et du faisceau vasculaire. Trouvez l’artère carotide pour l’orientation et pour prévenir sa blessure.
- Créez une poche dans le tissu sous-cutané pour accueillir le stimulateur cardiaque. Utilisez des ciseaux pour la dissection contondante afin de prévenir les saignements excessifs et les lésions tissulaires.
- Fixez le vaisseau à l’aide d’une attache en caoutchouc aux deux extrémités du segment du vaisseau isolé et obstruez le flux sanguin (figure 1).
- En utilisant la technique de coupe standard, faites une coupe d’environ 1/3 de la circonférence de la paroi du navire avec une lame.
- Utilisez un pic de vaisseau pour ouvrir largement la coupe et introduire une seule sonde de stimulation passive dans la lumière.
- Sous guidage fluoroscopique, avancer davantage son extrémité jusqu’à l’apex du ventricule droit (Figure 2). Préformez un stylet en courbe et utilisez-le pour guider la sonde afin qu’elle passe l’anneau tricuspide. Assurez-vous que la pointe de la sonde n’est pas soutenue par le stylet afin que la sonde reste flexible et atraumatique lorsqu’elle touche le tissu.
- Testez les paramètres de stimulation. Le signal et l’impédance détectés par la sonde ventriculaire doivent être stables, et le seuil de stimulation doit être bas. Il ne devrait pas y avoir de fasciculation des muscles adjacents (Figure 3).
- Fixez la position de la sonde en la cousant sur un manchon protecteur en caoutchouc jusqu’au tissu fibreux sous-jacent et scellez la lumière du vaisseau autour de la sonde à l’aide d’une attache en soie (Figure 4).
4. Implantation d’un stimulateur cardiaque
- Connectez le stimulateur cardiaque au fil de stimulation et fixez le connecteur IS-1 à l’aide d’une vis. Si la fonction d’étude de stimulation non invasive (voir étape 6) doit être utilisée pendant le suivi, connectez le stimulateur cardiaque à la prise du canal auriculaire.
- Enterrez le stimulateur cardiaque et la longueur supplémentaire de la sonde dans la poche sous-cutanée préformée (Figure 5).
- Rincer la poche avec de la povidone iodée. Suturer la plaie cutanée à l’aide d’un fil monofilament.
- Définissez le programme de stimulation souhaité et effectuez une vérification finale des paramètres de stimulation (Figure 3).
5. Soins postopératoires
- Retirez les anesthésiques et observez attentivement l’animal jusqu’à ce qu’il retrouve une conscience adéquate.
- Administrer de l’atipamézole (0,01-0,03 mg/kg IM) pour inverser l’action de la médétomidine.
- Une fois la conscience rétablie et la température corporelle optimale atteinte, administrer du méloxicam (0,4-0,6 mg / kg) par voie sous-cutanée pour soulager la douleur. Ajouter de la buprénorphine après 6-8 h si le soulagement de la douleur n’est pas adéquat selon une échelle d’évaluation de la douleur valide (par exemple, échelle de grimace de lapin).
- Administrer du métoclopramide (0,5-1 mg/kg IV) pour prévenir la stase gastro-intestinale et stimuler la motilité gastrique et continuer 3 fois par jour jusqu’à ce que l’apport alimentaire et la production de selles soient rétablis.
- Suivre un régime antibiotique intraveineux à large spectre jusqu’à ce que les plaies soient cicatrisées (enrofloxacine à raison de 10-20 mg / kg 2x par jour pendant 3-7 jours).
- Transférez l’animal dans un environnement confortable et familier et observez-le jusqu’à ce qu’il retrouve suffisamment de conscience. Ne remettez pas le lapin en compagnie d’autres animaux avant qu’il ne soit complètement rétabli.
- Maintenir l’administration quotidienne de méloxicam (0,4-0,6 mg/kg SC) pendant au moins 5 jours.
- Surveillez et pansez les plaies régulièrement pour assurer une guérison sûre et rapide.
- Une fois complètement guéri, environ 14 jours après la procédure, retirez les sutures cutanées non résorbables.
- Effectuez des interrogatoires à distance et vérifiez régulièrement les paramètres de stimulation (c.-à-d. seuil de stimulation, détection du myocarde et impédance de la dérivation).
REMARQUE: Les valeurs obtenues doivent suivre une tendance stable.
6. Protocole de stimulation et collecte de données
- Interrogez le stimulateur cardiaque et définissez le mode de stimulation de secours en sélectionnant le taux de base minimal dans le menu Paramètres.
REMARQUE: En raison de la fréquence cardiaque élevée et de sa grande variabilité native des petits animaux, une stimulation artificielle continue peut être réalisée à une vitesse de 300 à 400 bpm, selon les exigences spécifiées. Une stimulation intermittente peut être obtenue lors de chaque interrogation du stimulateur cardiaque (suivez l’étape 6.4 et la figure 6). - Enregistrer l’impédance de la sonde de stimulation en continu; dans le menu Diagnostics du programmeur cardiaque, démarrez la collecte de données.
- Enregistrer le potentiel myocardique en continu et le vérifier manuellement chaque semaine en interrogeant le stimulateur cardiaque; dans le menu Test du programmeur cardiaque sous l’onglet Détection, mesurez les amplitudes du potentiel myocardique unipolaire et bipolaire.
- Évaluez le seuil de stimulation régulièrement (hebdomadairement) par interrogation. Utilisez la fonction d’étude de stimulation non invasive (sélectionnez NIPS dans le menu Test) pour mesurer le seuil de stimulation avec une cadence suffisante (Figure 6). Évaluez le seuil de stimulation pour différentes durées de stimulus (de 0,1 ms à 1,5 ms) et exprimez-le en volts. Utilisez les électrogrammes intracardiaques ou l’ECG de surface pour déterminer la perte de capture lorsque la sortie du stimulus de stimulation devient sous-seuil.
- Effectuer toutes les procédures selon les conventions vétérinaires standard, sacrifier l’animal selon les règlements institutionnels à la fin de chaque étude et effectuer une nécropsie. Plantez le stimulateur cardiaque et le plomb et examinez-les pour les réponses inflammatoires, la formation de biofilm et la fibrose.
NOTE: Une surdose de potassium a été administrée sous anesthésie profonde pour euthanasier les animaux dans ce protocole.
Résultats
Au total, six animaux ont été inclus dans l’étude. Chez tous les animaux, la sonde de stimulation a été implantée avec succès via la veine jugulaire externe dans l’apex ventriculaire droit (figure supplémentaire S1). La position a été vérifiée par fluoroscopie et le plomb a été cousu aux tissus adjacents sur un manchon en caoutchouc. Selon l’imagerie aux rayons X, le plomb a maintenu sa position pendant toute la période du protocole de stimulation. Le stimulateur cardiaque attaché était palpable dans la région latérale du cou, ne causant aucun problème évident à l’animal. Toutes les blessures ont guéri complètement et sans complications locales.
L’extrémité de plomb était équipée de deux électrodes en titane-platine — un anneau hémisphérique distal et une électrode cylindrique proximale — avec une distance interélectrode de 25 mm (figure 2). Les fils étaient librement avancés dans le sommet et y étaient passivement attachés par leurs dents de fixation en silicium. Cela a permis une stimulation unipolaire à partir de l’électrode d’extrémité et une stimulation bipolaire entre les deux électrodes situées dans le ventricule droit.
Un signal représentatif du potentiel myocardique ventriculaire détecté est représenté à la figure 3, et les paramètres de stimulation mesurés sont donnés en détail dans les tableaux 1 et 7. Au moment de la procédure, le potentiel myocardique moyen détecté était de 5,6 V ± 0,8 mV (min: 2,8 mV, max: 8 mV), l’impédance de plomb était de 675 Ω ± 74 Ω (min: 468 Ω, max: 951 Ω) et le seuil de stimulation était de 0,8 V ± 0,26 V (min: 0,2 V, max: 2,2 V), avec la durée du stimulus fixée à la norme de 0,4 ms.
Après un suivi de 3 mois et 6 mois avec stimulation intermittente, le potentiel myocardique moyen détecté était respectivement de 7,4 mV ± 1,2 mV (min : 4,0 mV, max : 12,0 mV) et de 6,3 mV ± 1,0 mV (min : 4,2 mV, max : 10,3 mV). L’impédance moyenne du plomb mesurée était de 869 Ω ± 32 Ω (min: 760 Ω, max: 975 Ω) et 725 Ω ± 96 Ω (min: 370 Ω, max: 1014 Ω), respectivement, et le seuil de stimulation est passé à 1,2 V ± 0,3 V (min: 0,2 V, max: 2,2 V) et à 1,4 V ± 0,3 V (min: 0,5 V, max: 2,3 V), respectivement. Tous les changements de paramètres n’étaient pas statistiquement significatifs au cours de cette période (P > 0,05), et les paramètres bipolaires et unipolaires ont suivi des tendances comparables (figure 7 et tableau 1).
Un cas a été interrompu prématurément en raison d’une pénétration partielle du plomb, qui s’est accompagnée d’une chute d’impédance abrupte observée le deuxième jour après l’implantation. Plus tard, au cours du deuxième mois de suivi, une augmentation progressive du seuil a été remarquée, et la stimulation sur un débit élevé a provoqué une fasciculation musculaire. L’animal est demeuré asymptomatique, mais pendant la nécropsie, on a constaté que l’extrémité de la sonde de stimulation avait pénétré à travers la paroi inférieure du myocarde dans le péricarde d’une longueur d’environ 3 mm. Aucun saignement et aucun signe d’infection n’ont été observés.
Avant l’intervention, le jour 1 après l’intervention et le jour 7 après l’intervention, le nombre moyen de globules blancs était de 5,9 × 10 9/L, 7,37 × 10 9/L et 7,42 × 10 9/L, respectivement, les taux moyens d’hémoglobine étaient de 105 g/L, 113 g/L et 110 g/L, respectivement, et le nombre moyen de plaquettes était de 317 × 10 9/L. 274 × 109/L et 219 × 109/L, respectivement. Les valeurs de laboratoire n’ont pas démontré de changements significatifs au cours de la première semaine suivant l’intervention (P > 0,05 pour tous). Selon une évaluation microscopique, la surface de silicium de plomb était recouverte de tissu fibreux (d’une épaisseur approximative de 100 μm), mais aucune cellule n’a été trouvée (figure 8).
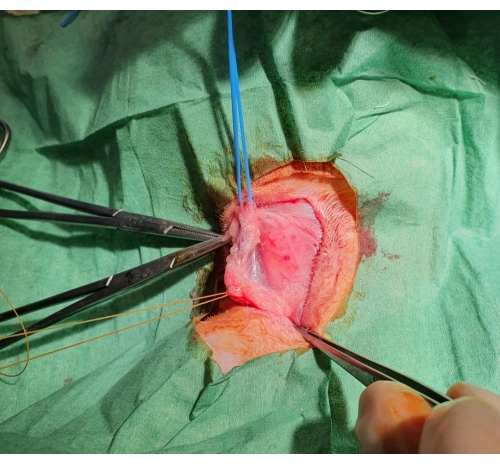
Figure 1 : Curage veineux jugulaire chirurgical. Une fois la peau coupée, une poche sous-cutanée se forme et la veine jugulaire est exposée, ligaturée distalement et soutenue par un élastique bleu à proximité. Veuillez cliquer ici pour voir une version agrandie de cette figure.
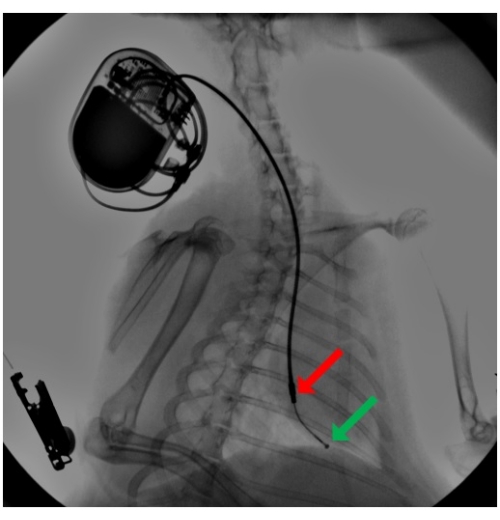
Figure 2 : Fluoroscopie pendant l’implantation du sonde du stimulateur cardiaque. Une sonde de stimulation est introduite par la veine jugulaire externe et, à l’aide d’un stylet préformé, la sonde avance vers l’apex ventriculaire droit, où elle est sécurisée par fixation passive par ses dents de silicium. Un stimulateur cardiaque attaché est enterré dans une poche sous-cutanée dans la région du cou. La flèche pointe vers l’anneau hémisphérique distal (vert) et les électrodes de l’anneau cylindrique proximal (rouge). Veuillez cliquer ici pour voir une version agrandie de cette figure.
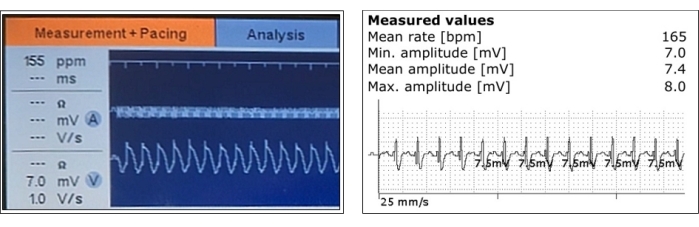
Figure 3 : Mesures représentatives des potentiels myocardiques ventriculaires détectés. La détection ventriculaire et ses mesures d’amplitude sont montrées pendant la phase aiguë après le positionnement de la sonde (à gauche) et après l’implantation du stimulateur cardiaque (à droite). Veuillez cliquer ici pour voir une version agrandie de cette figure.
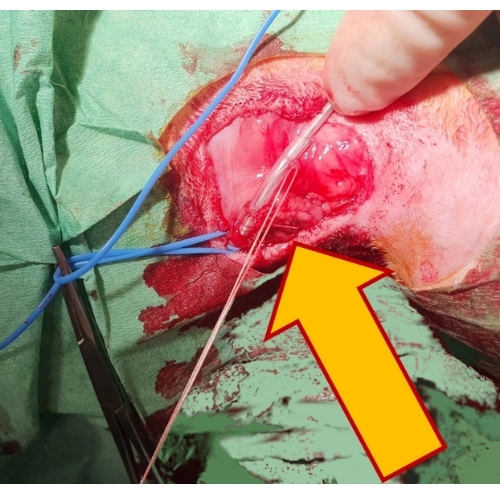
Figure 4 : Sécurisation du fil de stimulation. La fixation de la sonde par deux sutures non résorbables sur un manchon en caoutchouc (flèche) au tissu sous-jacent la maintient en position et empêche sa luxation. Veuillez cliquer ici pour voir une version agrandie de cette figure.
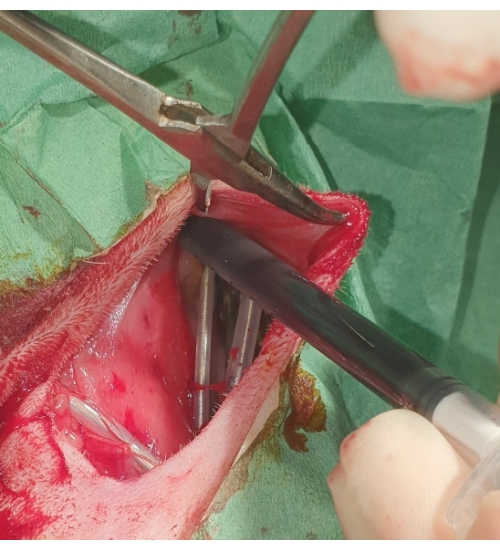
Figure 5 : Emplacement du stimulateur cardiaque. Le stimulateur cardiaque est enterré dans la poche sous-cutanée et rincé avec de la povidone iodée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
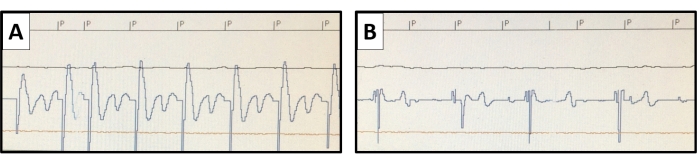
Figure 6 : Mesure du seuil de stimulation. En utilisant la fonction d’étude de stimulation non invasive du stimulateur cardiaque, une stimulation supérieure à la fréquence cardiaque native est effectuée. Les stimuli de stimulation sont marqués par P. Le seuil de stimulation est évalué en fonction de différents résultats de stimulation. (A) Un exemple représentatif du potentiel endocardique de la capture ventriculaire est présenté pour une sortie de 0,8 V à 0,4 ms, (B) mais une perte de capture est observée avec la sortie réduite à 0,6 V à 0,4 ms. Veuillez cliquer ici pour voir une version agrandie de cette figure.
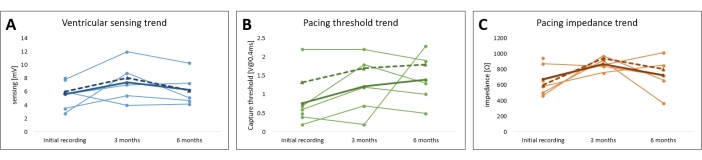
Figure 7 : Suivi des paramètres de stimulation du modèle de stimulation cardiaque de la léporine. Les tendances du seuil de stimulation (A), (B) de l’impédance de stimulation et (C) de la détection myocardique pour tous les sujets sont tracées. Les valeurs moyennes unipolaires (ligne complète) et bipolaires (ligne pointillée) sont indiquées en gras. Veuillez cliquer ici pour voir une version agrandie de cette figure.
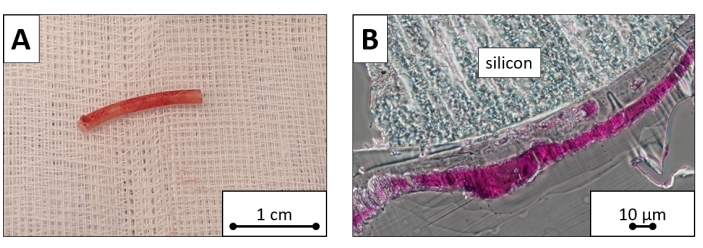
Figure 8 : Échantillon de plomb de stimulation explanté. Portion ventriculaire coupée du plomb de stimulation explanté. (A) L’image macroscopique et (B) l’image microscopique teinte au bleu de toluidine révèlent la surface de silicium recouverte d’une couche de tissu fibreux. Barres d’échelle = (A) 1 cm, (B) 10 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
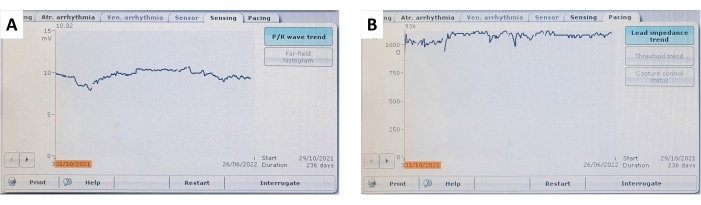
Figure 9 : Tendances de la détection ventriculaire et de l’impédance du plomb. Un exemple représentatif de (A) détection myocardique ventriculaire continue et stable et (B) tendances de l’impédance de sonde ventriculaire sur un suivi de 236 jours. Veuillez cliquer ici pour voir une version agrandie de cette figure.
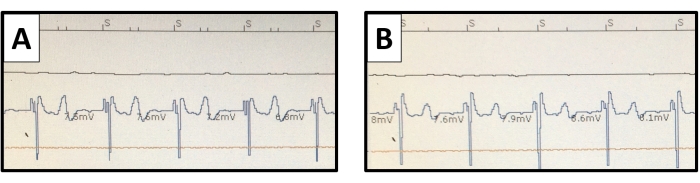
Figure 10 : Électrogrammes endomyocardiques ventriculaires. L’interrogation du stimulateur cardiaque détectée les potentiels ventriculaires est représentée avec (A) des connexions unipolaires et (B) bipolaires. Le potentiel d’onde T est plus distinct avec la connexion unipolaire mais ne provoque pas de surdétection. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Unipolaire | périprocédural | suivi | |||||||
| 3 mois | 6 mois | ||||||||
| Potentiel myocardique détecté [mV] | 5,6 ± 0,8 | 7,4 ± 1,2 | 6,3 ± 1,0 | ||||||
| Seuil de stimulation [V à 0,4 ms] | 0,8 ± 0,3 | 1,2 ± 0,3 | 1,4 ± 0,3 | ||||||
| Impédance de plomb [Ω] | 675 ± 74 | 869 ± 32 | 725 ± 96 | ||||||
Tableau 1 : Suivi des paramètres de stimulation du modèle de stimulation cardiaque de la léporine. Les valeurs du potentiel myocardique détecté, du seuil de stimulation et de l’impédance de la dérivation sont exprimées en moyenne ± MEB pour 3 mois et 6 mois de suivi.
Figure supplémentaire S1 : Schéma du système de stimulation transveineuse à taille humaine implanté chez un lapin. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Malgré leurs contraintes spécifiques, les modèles de petits mammifères offrent des avantages pour la recherche clinique13. Avec une méthodologie établie, les modèles de stimulation cardiaque peuvent fournir une plate-forme optimale pour la simulation d’un large éventail de maladies cardiovasculaires et d’états pathologiques circulatoires 7,14 avec des besoins en ressources significativement inférieurs à ceux des grands modèles animaux ou des essais cliniques. Cet article présente un modèle novateur et peu invasif de stimulation cardiaque de longue durée chez le lapin. En suivant ce protocole, il est possible d’utiliser un système de stimulateur cardiaque humain de taille normale entièrement implanté, y compris une sonde de stimulation pleine longueur, dans un modèle de petit mammifère.
Au moment de l’implantation du stimulateur cardiaque, nous avons pu positionner la sonde dans un endroit stable et optimal au sommet du ventricule droit chez tous les animaux. Les paramètres de stimulation mesurés de manière invasive se situaient dans des plages normales, semblables aux valeurs courantes dans les expériences sur les grands animaux ou la médecine humaine 2,3. Le potentiel myocardique moyen mesuré de 6,5 mV ± 1,9 mV dans le ventricule droit du lapin est clairement reconnu par un stimulateur cardiaque implantable standard. Le seuil de stimulation maximal mesuré était de 2,5 V, avec une durée de stimulus de 0,4 ms, et l’impédance est restée dans les plages normales pendant le suivi. Dans l’ensemble, ceux-ci représentent des paramètres de stimulation optimaux.
Au cours du suivi, les paramètres de stimulation ont été vérifiés de manière non invasive en interrogeant le stimulateur cardiaque implanté, et ces paramètres sont résumés à la figure 7, à la figure 9 et au tableau 1. La détection ventriculaire et l’impédance de la sonde n’ont pas démontré de changements significatifs sur 6 mois. Malgré une tendance à la hausse du seuil de stimulation moyen pour tous les sujets, aucun changement significatif n’a été observé, ce qui a permis d’effectuer la stimulation en toute sécurité tout au long de l’étude. La faible fluctuation des paramètres de stimulation peut être attribuée à des réponses inflammatoires locales ou à une fibrose et pourrait être atténuée en utilisant des matériaux à élution de stéroïdes. Pour une utilisation dans les études de stimulation à long terme, les paramètres de stimulation doivent être surveillés et ajustés fréquemment.
L’analyse sanguine n’a pas suggéré d’inflammation systémique ou d’anémie au cours de la première semaine après l’implantation. La tendance à l’augmentation de la numération plaquettaire avant l’intervention peut être attribuée au stress aigu causé par la manipulation et la sédation des animaux, car les valeurs sont restées stables pendant le suivi. Une complication redoutée de l’implantation d’un stimulateur cardiaque est la pénétration du plomb. Surtout avec la fragilité des tissus de petits mammifères, la pénétration doit être suspectée lorsque les paramètres de stimulation changent brusquement, et il faut souligner que le plomb doit toujours être manipulé avec précaution dans sa position appropriée. Une radiographie peut confirmer la pénétration du plomb. Une infection bactérienne aiguë associée à un dispositif électronique implantable cardiaque (CIED) est une autre complication potentiellement grave qui contribue de manière significative aux taux de mortalité et de morbidité15. Par conséquent, il est extrêmement important d’étudier de nouveaux matériaux, des techniques de stimulation et des raffinements de plomb pour réduire les taux d’infection et prolonger la durabilité des systèmes de stimulation. La méthodologie présentée fournit un modèle animal approprié pour une recherche expérimentale aussi vitale.
Ryu et al. ont induit une cardiomyopathie avec insuffisance cardiaque progressive à l’aide de sondes de stimulation auriculaire implantées chirurgicalement et d’un générateur d’impulsions externe12. De même, Freeman et coll. ont conclu qu’une stimulation ventriculaire soutenue entraîne une dépression myocardique chez les lapins pendant 3 à 4 semaines11. En raison de la fréquence cardiaque native élevée des petits animaux, le stimulateur cardiaque doit être capable de rythmer des fréquences d’environ 300 à 400 bpm pour maintenir un rythme complet. Comme ces fréquences de stimulation plus élevées conduisent à une insuffisance cardiaque progressive au cours des semaines11,12, le modèle de léporine présenté est optimal pour le développement et l’investigation de la cardiomyopathie qui en résulte. Compte tenu de leur taille, ces petits modèles sont idéaux pour des applications spécifiques telles que l’évaluation de modifications du tissu humoral ou myocardique11,16. L’échocardiographie peut également être utilisée pour évaluer les dimensions et la contractilité du cœur de léporine12,17. En comparaison, des modèles animaux plus grands d’insuffisance cardiaque présentent d’autres avantages, tels que la possibilité d’une évaluation hémodynamique invasive détaillée, y compris des évaluations de la circulation coronaire ou du volumede pression 2.
La sélection spécifique du modèle de léporine pour les études de stimulation était basée sur ses multiples avantages. Les lapins tolèrent bien la procédure, sont l’un des plus petits mammifères à démontrer leur capacité à recevoir un système de stimulateur cardiaque à taille humaine et nécessitent le déploiement de moins de ressources que les autres animaux plus gros. Certains auteurs18 croient que la physiologie des petits mammifères peut ne pas refléter celle des humains, mais nous avons constaté que les paramètres de stimulation observés chez ces petits mammifères sont assez similaires à ceux observés chez les humains ou les grands animaux 1,2,3,19, ce qui signifie qu’ils peuvent être facilement utilisés pour la recherche translationnelle.
Lors de la mise en place du plomb et de l’implantation du stimulateur cardiaque dans ce modèle de petits mammifères, nous avons rencontré des similitudes avec des expériences précédentes sur des modèles de grands animaux, mais les différences significatives doivent être soulignées. Les tissus léporiniques sont fragiles et les vaisseaux et les parois ventriculaires sont minces. Une manipulation douce est nécessaire pendant toute la procédure; La pointe de plomb doit toujours ne pas être prise en charge par le stylet, et donc flexible. En particulier lors du passage à travers l’anneau tricuspide et du positionnement de l’extrémité de la sonde à l’apex du ventricule droit, la manipulation doit être effectuée avec un soin extrême et sous guidage fluoroscopique pour éviter les blessures. Le positionnement de la pointe à d’autres endroits devrait également être possible. Nous avons testé les positions de l’appendice auriculaire et du canal ventriculaire droit avec des paramètres périprocéduraux optimaux, mais la stabilité du plomb peut être limitée et les données actuelles ne peuvent pas soutenir d’autres sites de stimulation. La veine jugulaire externe du lapin est dimensionnée de manière appropriée pour l’insertion d’une seule sonde de stimulation. Si l’implantation de plusieurs sondes est prévue, l’utilisation d’un animal plus grand peut être conseillée.
La fixation du plomb dans la trabéculation myocardique a été accomplie passivement avec des dents de silicium à l’extrémité du plomb. D’après notre expérience, l’utilisation de la fixation active par une hélice vissée dans la fine couche myocardique doit être évitée pour prévenir les lésions tissulaires dues à la tamponnade ou aux saignements thoraciques. Malgré la petite taille du ventricule droit du lapin, la paire d’électrodes de stimulation espacées de 25 mm a permis des configurations de détection et de stimulation unipolaires et bipolaires (figure 10). Cela peut offrir une polyvalence pour les études de stimulation cardiaque.
En raison de la fréquence cardiaque native élevée des petits mammifères18, une stimulation continue peut être obtenue par une programmation personnalisée du stimulateur cardiaque implantable. Alternativement, la méthode de modification interne simple d’un système de stimulation commun certifié par l’homme peut être utilisée pour obtenir des fréquences de stimulation à haut débit, comme décrit en détail précédemment 2,20. La perte de capture a été évaluée à l’aide de la fonction d’étude de stimulation non invasive, qui est une approche unique qui permet de tester même dans des conditions de fréquence cardiaque native élevée. Les paramètres de stimulation rapportés ont été mesurés régulièrement. Le stimulateur cardiaque implanté était capable d’enregistrer la détection des potentiels myocardiques et de l’impédance de la sonde automatiquement et en continu, mais le seuil de stimulation devait être mesuré manuellement en raison de la fréquence cardiaque native élevée. Par conséquent, si un rythme continu est nécessaire, des évaluations fréquentes sont recommandées pour éviter la perte de capture.
Gutruf et al. ont précédemment signalé l’utilisation de stimulateurs cardiaques hautement miniaturisés, sans fil et sans pile dans des modèles de petits animaux7. Par rapport à leurs études, l’implantation d’un stimulateur cardiaque à taille humaine décrite ici représente une approche différente qui offre la possibilité de tests de plomb innovants, d’une application étroite à la recherche clinique et d’applications plus larges avec des matériaux généralement disponibles. Zhou et al. ont présenté le développement d’un stimulateur cardiaque miniature conçu pour être implanté par voie percutanée dans le cœur fœtal pour traiter le bloc auriculo-ventriculaire. Ils ont rapporté l’utilisation d’expériences sur des lapins adultes pour confirmer la faisabilité d’un tel dispositif9. D’autres ont déjà signalé les avantages de l’intubation chez le lapin pour les procédures invasives. D’après notre expérience, l’approche consistant à maintenir la respiration spontanée avec un masque oro-nasal présente plus d’avantages pour des procédures aussi courtes car elle minimise le risque de complications causées par la manipulation des voies respiratoires. En outre, les lésions pulmonaires sous pression peuvent également être évitées.
Bien que le protocole de l’étude ait été préparé avec soin et que le nombre total d’animaux inclus ait été adéquat, plusieurs limites doivent être soulignées. La petite taille du ventricule droit du lapin ne permettait pas de placer plusieurs fils. Bien que nous ayons essayé de tester le positionnement de l’embout de plomb dans le couloir de sortie ventriculaire droit, nous avons une connaissance limitée de sa stabilité et nous nous attendons à ce qu’elle soit plutôt limitée. La tendance de l’impédance de stimulation a montré une baisse au cours de la première semaine suivant le placement du lead. Cela pourrait être dû à une inflammation locale et à une fibrose légère, mais peu de temps après, l’impédance du plomb a été restaurée et une tendance à la stabilité a été continuellement maintenue. Un système de stimulation à chambre unique a été utilisé dans cette étude. Dans les études futures, l’avancement d’une paire de sondes de stimulation à travers la veine jugulaire unilatérale devrait également être étudié. Bien que cela n’ait pas été testé dans cette étude, nous pensons qu’une deuxième sonde pourrait être introduite et stabilisée dans l’oreillette droite.
En général, les modèles animaux de stimulation cardiaque ont de nombreuses applications dans la recherche cardiovasculaire. Tout d’abord, la stimulation à des fréquences élevées non physiologiques sur plusieurs semaines conduit à une cardiomyopathie induite par la tachycardie, comme indiqué précédemment, et permet l’étude de la physiopathologie et du traitement de l’insuffisance cardiaque chronique 2,3,11,12. De plus, la recherche sur les matériaux et les technologies raffinés peut utiliser le modèle de léporine présenté, qui pourrait être suggéré pour des études de stimulation à moyen terme. À notre connaissance, cette étude est la première à démontrer les avantages d’un modèle de si petit mammifère pour des expériences complexes de stimulation cardiaque21. En conclusion, avec la méthodologie décrite, un système de stimulation à taille humaine peut être implanté avec succès chez les petits mammifères, malgré la fragilité des tissus et l’anatomie délicate. Après l’entraînement, cette technique est facilement reproductible et fournit une base pour des modèles de tachycardie rythmée avec de larges applications dans la recherche cardiovasculaire.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts.
Remerciements
Les auteurs remercient Maria Kim, Jana Bortelová, Alena Ehrlichová, Matěj Hrachovina, Leoš Tejkl, Jana Míšková et Tereza Vavříková pour leurs conseils, leur travail et leur soutien technique. Ce travail a été financé par MH CZ-DRO (NNH, 00023884), subvention IG200501.
matériels
| Name | Company | Catalog Number | Comments |
| Medication | |||
| atipamezole | Eurovet Animal Health, B.V. | Atipam | anesthetic |
| buprenorphine | Vetoquinol | Bupaq | analgetic |
| enrofloxacin | Krka | Enroxil | antibiotic |
| isoflurane | Baxter | Aerrane | anesthetic |
| ketamine hydrochloride | Richter Gedeon | Calypsol | anesthetic |
| medetomidine | Orion Corp. | Domitor | anesthetic |
| meloxicam | Cymedica | Melovem | analgetic |
| povidone iodine | Egis Praha | Betadine | disinfection |
| Silver Aluminium Aerosol | Henry Schein | 9003273 | tincture |
| Surgical materials | |||
| 2-0 Perma-Hand Silk | Ethicon | A185H | silk tie suture |
| 2-0 Vicryl | Ethicon | V323H | absorbable braided suture |
| 4-0 Monocryl | Ethicon | MCP494G | monofilament |
| BearHugger | 3M | BearHugger | heating pad |
| cauterizer | |||
| Metzenbaum scissors, lancet with #22 blade, DeBakey forceps, needle driver | basic surgical equipment | ||
| sterile drapes | |||
| Diagnostic devices | |||
| Acuson VF10-5 | Siemens Healthcare | sonographic vascular probe | |
| Acuson x300 | Siemens Healthcare | ultrasound system | |
| ESP C-arm | GE Healthcare | ESP | X-ray fluoro C-arm |
| Pacing devices | |||
| 400 | Medico | CAT400 | bipolar pacing lead |
| Effecta DR | Biotronic | 371199 | implantable pacemaker |
| ERA 3000 | Biotronic | 128828 | external pacemaker |
| ICS 3000 | Biotronic | 349528 | pacemaker programmer |
Références
- Power, J. M., Tonkin, A. M. Large animal models of heart failure. Australian and New Zealand Journal of Medicine. 29 (3), 395-402 (2008).
- Hála, P., et al. Tachycardia-induced cardiomyopathy as a chronic heart failure model in swine. Journal of Visualized Experiments. (132), e57030(2018).
- Powers, J. C., Recchia, F. Canine model of pacing-induced heart failure. Methods in Molecular Biology. 1816, 309-325 (2018).
- Whipple, G. H., Sheffield, L. T., Woodman, E. G., Theophilis, C., Friedman, S. Reversible congestive heart failure due to chronic rapid stimulation of the normal heart. Proceedings of the New England Cardiovascular Society. 20, 39-40 (1962).
- Laughner, J. I., et al. A fully implantable pacemaker for the mouse: From battery to wireless power. PLoS One. 8 (10), 76291(2013).
- Yue-Chun, L., et al. Establishment of a canine model of cardiac memory using endocardial pacing via internal jugular vein. BMC Cardiovascular Disorders. 10, 30(2010).
- Gutruf, P., et al. Wireless, battery-free, fully implantable multimodal and multisite pacemakers for applications in small animal models. Nature Communications. 10 (1), 5742(2019).
- Zhou, L., et al. A percutaneously implantable fetal pacemaker. Annual International Conference of the IEEE Engineering in Medicine and Biology Society. 2014, 4459-4463 (2014).
- Zhou, L., Chmait, R., Bar-Cohen, Y., Peck, R. A., Loeb, G. E. Percutaneously injectable fetal pacemaker: Electrodes, mechanical design and implantation. Annual International Conference of the IEEE Engineering in Medicine and Biology Society. 2012, 6600-6603 (2012).
- Jordan, C. P., et al. Minimally invasive resynchronization pacemaker: A pediatric animal model. The Annals of Thoracic Surgery. 96 (6), 2210-2213 (2013).
- Freeman, G. L., Colston, J. T. Myocardial depression produced by sustained tachycardia in rabbits. American Journal of Physiology. 262, 63-67 (1992).
- Ryu, K. H., et al. Force-frequency relations in the failing rabbit heart and responses to adrenergic stimulation. Journal of Cardiac Failure. 3 (1), 27-39 (1997).
- Hulsmans, M., et al. A miniaturized, programmable pacemaker for long-term studies in the mouse. Circulation Research. 123 (11), 1208-1219 (2018).
- Nishida, K., Michael, G., Dobrev, D., Nattel, S. Animal models for atrial fibrillation: Clinical insights and scientific opportunities. Europace. 12 (2), 160-172 (2010).
- Clementy, N., et al. Pacemaker complications and costs: A nationwide economic study. Journal of Medical Economics. 22 (11), 1171-1178 (2019).
- Armoundas, A. A., et al. Cellular and molecular determinants of altered Ca2+ handling in the failing rabbit heart: primary defects in SR Ca2+ uptake and release mechanisms. American Journal of Physiology-Heart and Circulatory Physiology. 292 (3), 1607-1618 (2007).
- Giraldo, A., Talavera López, J., Brooks, G., Fernández-Del-Palacio, M. J. Transthoracic echocardiographic examination in the rabbit model. Journal of Visualized Experiments. (148), e59457(2019).
- Spannbauer, A., et al. Large animal models of heart failure with reduced ejection fraction (HFrEF). Frontiers in Cardiovascular Medicine. 6, 117(2019).
- Byrne, M. J., et al. An ovine model of tachycardia-induced degenerative dilated cardiomyopathy and heart failure with prolonged onset. Journal of Cardiac Failure. 8 (2), 108-115 (2002).
- Hála, P., et al. Increasing venoarterial extracorporeal membrane oxygenation flow puts higher demands on left ventricular work in a porcine model of chronic heart failure. Journal of Translational Medicine. 18 (1), 75(2020).
- Riehle, C., Bauersachs, J. Small animal models of heart failure. Cardiovascular Research. 115 (13), 1838-1849 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon