Method Article
만성 심장 박동의 번역 토끼 모델
요약
우리는 전임상 연구에서 인공 조율 및 심부전 발달에 활용할 수 있는 장기 심장 조율의 최소 침습적 레포린 모델을 제시합니다.
초록
심장 박동의 동물 모델은 새로운 장치를 테스트하고, 인위적으로 진행되는 심장 박동의 병태생리학을 연구하고, 부정맥 유발 심근병증 및 후속 심부전을 연구하는 데 유용합니다. 현재 이러한 모델은 소수에 불과하며 대부분 광범위한 리소스가 필요합니다. 우리는 부정맥으로 인한 심부전을 연구할 가능성이 있는 작은 포유류에서 새로운 실험적 심장 조율 모델을 보고합니다.
6마리의 뉴질랜드 흰 토끼(평균 체중: 3.5kg)에서 전신 흡입 마취 하에 경정맥 부위를 해부하고 우측 외부 경정맥을 통해 단일 페이싱 리드를 삽입했습니다. 형광 투시 유도를 사용하여 리드는 우심실 정점으로 더 전진했으며 수동 고정을 사용하여 안정화되었습니다. 그런 다음 심장 박동기를 연결하여 피하 주머니에 묻었습니다.
심박 조율기 이식은 좋은 치유와 함께 성공적이었습니다. 토끼 해부학은 리드 배치에 유리합니다. 간헐적 페이싱으로 6개월의 추적 관찰 기간 동안 평균 감지 심근 전위는 6.3mV(최소: 2.8mV, 최대: 12mV)였으며 측정된 평균 리드 임피던스는 744 Ω(최소: 370 Ω, 최대: 1014 Ω)였습니다. 페이싱 임계값은 처음에 0.8V ± 0.2V였으며 후속 조치 동안 안정적으로 유지되었습니다.
이 현재 연구는 작은 포유류 모델에서 성공적인 경정맥 심장 조율을 제시한 최초의 연구입니다. 크기와 조직의 취약성에도 불구하고 조정이 가능한 인간 크기의 기기는 만성 심장 박동에 안전하게 사용할 수 있으므로 이 혁신적인 모델은 부정맥 유발 심근병증 및 그에 따른 심부전 병태생리학의 발달을 연구하는 데 적합합니다.
서문
심부전 연구 및 심장 조율 개발에서 전임상 검사에 중개 모델이 자주 필요합니다1. 또한 새로운 장치, 재료 및 납 정제는 임상적으로 사용하기 전에 잠재적인 합병증에 대해 테스트해야 합니다. 따라서, 심장 조율 모델은 인위적으로 진행된 심장 박동의 분석 및 심장 기능에 대한 병태생리학적 효과에 대한 연구를 포함하여 광범위한 응용 분야를 가지고 있다 2,3. 심장 페이싱- 또는 빈맥 유발 심근병증 실험은 다양한 동물 크기의 모델을 활용할 수 있으며, 고속 페이싱 1,3,4,5 후 몇 주 이내에 심부전이 발생한다.
이전 연구에서는 이러한 응용 분야에서 돼지, 송곳니 및 양과 같은 대형 동물 모델의 사용을 보고했습니다 2,3,6. 그러나 이러한 모델의 가용성은 제한적이며 동물 수술 및 취급을 위한 광범위한 자원이 필요합니다. 대조적으로, 작은 포유류의 사용은 위에서 언급 한 우려를 해결할 수 있으며 결과적으로 최적의 저렴한 연구 모델이 될 수 있습니다. 그러나 작은 포유류에 대한 심장 박동 연구는 거의 보고되지 않았으며, 이는 섬세한 해부학, 조직 취약성 및 7,8,9,10,11,12가 필요한 더 높은 조율 때문일 수 있습니다.
외부 심박 조율기(11,12) 또는 무선 현미경 조율 장치(5,7,8,9)가 있는 부분적으로 이식된 조율 리드의 수술 모델만이 소형 포유류 심박 조율기 연구에 사용되었지만, 우리가 아는 한, 완전히 이식된 인간 크기의 경정맥 심박 조율기 시스템의 사용은 현재까지 보고되지 않았습니다. 레포린 모델의 이전 증거에 따르면 몇 주 동안 빠른 심박수로 진행하면 심근 억제가 발생합니다11,12. 이 논문은 토끼에 인간 크기의 심박 조율기를 성공적으로 이식한 것을 보여주는 최초의 실질적으로 실행 가능한 소형 포유류 모델을 제시합니다. 설명된 방법론은 임상적으로 관련된 심장 조율 모델을 제시하는 것을 목표로 하며 빈맥 또는 박동성 심근병증 및 그에 따른 심부전 병태생리학에 대한 인간 연구와 밀접하게 번역될 수 있습니다 2,11,12.
프로토콜
이 실험 프로토콜은 찰스 대학교 제1의과대학 기관 동물 전문가 위원회의 검토 및 승인을 받았으며, 체코 프라하에 있는 찰스 대학교 제1의과대학 생리학과 대학 실험 실험실에서 법 No. 246/1992 Coll.에 따라 수행되었습니다. 모든 동물은 2011년 National Academies Press에서 발행한 Guide for the Care and Use of Laboratory Animals, 8판에 따라 치료 및 관리되었습니다. 모든 절차는 면허가 있는 수의사의 면전과 지도 하에 표준 수의학 협약에 따라 수행되었습니다. 6마리의 뉴질랜드 흰 토끼가 이 일련의 실험에 포함되었습니다. 그들의 평균 체중은 심박 조율기 이식 당일 3.5kg ± 1kg이었습니다. 모든 값은 SEM± 평균으로 표시되며 해당되는 경우 최소 및 최대 측정값 범위로 표시됩니다. 0.05< P 값이 유의한 것으로 간주되었습니다. 이 기술을 성공적으로 습득하려면 동물 마취 및 수술의 기본 기술이 필요합니다. 심장 박동에 대한 이전 경험이 권장되지만 필수는 아닙니다.
1. 수술 전 관리
- 토끼가 최소 2주 동안 주거 시설에 적응할 수 있도록 하고 수술 당일 동물의 취급 및 관리를 용이하게 하기 위해 인간의 접촉과 조작에 익숙해집니다.
- 동물에게 건초와 건초 기반 펠렛 토끼 사료를 먹이십시오. 정기적으로 신선한 물을 제공하십시오.
- 최적의 식이 섭취 및 고통 부재를 포함하여 활력(체온, 호흡수)과 전반적인 상태를 매일 짧게 확인하십시오.
2. 마취, 전처치 및 모니터링
- 30분 금식 후 부프레노르핀(0.01-0.04 mg/kg IM), 미다졸람(0.3-0.6 mg/kg IM), 메데토미딘(0.03-0.06 mg/kg IM) 및 케타민(5-10 mg/kg IM).
- 정맥 주사 약물 적용을 위해 가장자리 귀 정맥에 캐뉼라를 삽입합니다. 혈액학적 및 생화학적 분석을 위해 저용량 튜브(0.5mL)를 사용하여 혈액 샘플을 수집합니다.
- 목의 오른쪽 경정맥 부위 (수술 부위)와 팔다리에 면도기를 사용하여 토끼의 피부를 면도하여 ECG 모니터링을위한 전극을 부착하십시오. 토끼의 피부는 쉽게 자극을 받기 쉽고 작은 눈물이 흔히 보이기 때문에 조심스럽게 면도하십시오.
- 저체온증을 예방하기 위해 동물을 가열 패드에 올려 놓으십시오.
- 마취 프로토콜에 따라 맥박 산소 측정기로 ECG, 직장 체온 및 산소 포화도를 포함한 중요한 기능을 모니터링합니다.
- 동물의 입과 코에 마스크를 씌우고 동물의 얼굴 주위에 고무 씰로 고정합니다. 동물의 눈을 건조로부터 보호하기 위해 연고를 사용하십시오.
- 적절한 진정 작용을 얻으려면 안면 마스크를 통해 동물에게 이소 플루 란 (산소와 혼합)을 제공하십시오. 3.5 % 농도로 시작하여 억제 된 각막 반사 및 운동 통증 반응 측면에서 동물의 반응에 따라 필요에 따라 줄입니다.
알림: 마취 중 폐 손상의 위험을 줄이려면 자발적인 환기가 권장되지만 저환기의 경우 신생아 수동 또는 자동 인공호흡기를 준비해야 합니다. - 모든 멸균 기구를 준비하십시오.
- 동물을 형광 투시 테이블에 놓습니다. 전체 X-ray 개인 보호 장비를 착용하십시오.
3. 심실 납 이식
- 외부 경정맥을 찾아 피부에 그 위치를 표시하십시오.
- 포비돈 요오드를 사용하여 전체 부위를 소독하고 표시된 경정맥 부위에 구멍이있는 멸균 드레이프로 수술 부위를 덮으십시오.
- 표시된 경정맥 위에 평행하게 피부를 절개하십시오. 외부 경정맥을 찾아 인접한 섬유 조직과 혈관 다발에서 1cm 길이를 분리합니다. 방향을 잡고 부상을 예방하기 위해 경동맥을 찾으십시오.
- 심박 조율기를 수용하기 위해 피하 조직에 주머니를 만듭니다. 과도한 출혈과 조직 손상을 방지하기 위해 둔기 해부에 가위를 사용하십시오.
- 격리된 혈관 세그먼트의 양쪽 끝에 고무 타이를 사용하여 혈관을 고정하고 혈류를 차단합니다(그림 1).
- 표준 절단 기술을 사용하여 블레이드로 용기 벽 둘레의 약 1/3을 절단합니다.
- 용기 픽을 사용하여 절단면을 넓게 열고 단일 수동 페이싱 리드를 루멘에 도입합니다.
- 형광투시 유도 하에 팁을 우심실의 정점까지 더 전진시킵니다(그림 2). 탐침을 곡선으로 미리 성형하고 이를 사용하여 리드가 삼첨판 고리를 통과하도록 안내합니다. 리드의 끝이 스타일릿에 의해 지지되지 않도록 하여 조직을 만질 때 리드가 유연하고 비외상성을 유지하도록 합니다.
- 페이싱 매개변수를 테스트합니다. 심실 리드 감지 신호와 임피던스는 안정적이어야 하며 페이싱 임계값은 낮아야 합니다. 인접한 근육의 매혹이 없어야합니다 (그림 3).
- 보호용 고무 슬리브를 통해 밑에 있는 섬유 조직에 꿰매어 리드 위치를 고정하고 실크 타이를 사용하여 리드 주위의 용기 내강을 밀봉합니다(그림 4).
4. 심박 조율기 이식
- 심박 조율기를 페이싱 리드에 연결하고 나사를 사용하여 IS-1 커넥터를 고정합니다. 추적 관찰 중에 비침습적 페이싱 연구 기능 (6단계 참조)을 사용할 경우 심박 조율기를 심방 채널 소켓에 연결합니다.
- 심박 조율기와 여분의 리드 길이를 미리 형성된 피하 주머니에 묻습니다(그림 5).
- 포비돈 요오드로 주머니를 씻어 내십시오. 모노필라멘트 실을 사용하여 피부 상처를 봉합합니다.
- 원하는 페이싱 프로그램을 설정하고 페이싱 파라미터를 최종적으로 점검합니다(그림 3).
5. 수술 후 관리
- 마취제를 철회하고 적절한 의식을 회복 할 때까지 동물을주의 깊게 관찰하십시오.
- 아티파메졸(0.01-0.03 mg/kg IM)을 투여하여 메데토미딘의 작용을 되돌립니다.
- 의식이 회복되고 최적의 체온에 도달한 후 통증 완화를 위해 멜록시캄(0.4-0.6 mg/kg)을 피하 투여합니다. 유효한 통증 평가 척도(예: 토끼 찡그린 얼굴 척도)에 따라 통증 완화가 적절하지 않은 경우 6-8시간 후에 부프레노르핀을 추가합니다.
- 메토클로프라미드(0.5-1 mg/kg IV)를 투여하여 추가 위장 정체를 예방하고 위 운동성을 자극하고 적절한 음식 섭취와 대변 생성이 회복될 때까지 하루 3회 계속하십시오.
- 상처가 치유될 때까지 광범위한 정맥 항생제 요법을 따르십시오(엔로플록사신 10-20mg/kg 2회 3-7일 동안 하루 7회).
- 동물을 편안하고 친숙한 환경으로 옮기고 충분한 의식을 회복 할 때까지 관찰하십시오. 토끼가 완전히 회복 될 때까지 토끼를 다른 동물의 회사로 돌려 보내지 마십시오.
- 최소 5일 동안 매일 멜록시캄(0.4-0.6 mg/kg SC) 투여를 유지하십시오.
- 안전하고 시기 적절한 치유를 위해 정기적으로 상처를 모니터링하고 옷을 입습니다.
- 완전히 치유되면 시술 후 약 14 일 후에 비 흡수성 피부 봉합사를 제거하십시오.
- 원격 심문을 수행하고 페이싱 매개변수(예: 페이싱 임계값, 심근 감지 및 리드 임피던스)를 정기적으로 확인합니다.
참고: 얻은 값은 안정적인 추세를 따라야 합니다.
6. 페이싱 프로토콜 및 데이터 수집
- 심박 조율기를 조사하고 매개변수 메뉴에서 최소 기본 속도를 선택하여 백업 속도를 설정합니다.
알림: 작은 동물 고유의 높은 심박수와 높은 변동성으로 인해 지정된 요구 사항에 따라 300-400bpm의 속도로 지속적인 인공 페이싱을 달성할 수 있습니다. 각 심박 조율기 심문 중에 간헐적으로 속도를 낼 수 있습니다(6.4단계 및 그림 6 참조). - 페이싱 리드 임피던스를 지속적으로 기록하십시오. pacemaker 프로그래머 진단 메뉴에서 데이터 수집을 시작합니다.
- 심근 전위를 지속적으로 기록하고 심박 조율기의 심문으로 매주 수동으로 확인합니다. Senseing(감지) 탭의 Pacemaker Programmer Test(심박 조율기 프로그래머 테스트) 메뉴에서 단극 및 양극성 심근 전위 진폭을 측정합니다.
- 심문을 통해 정기적으로(매주) 속도 임계값을 평가합니다. 비침습적 페이싱 스터디(테스트 메뉴에서 NIPS 선택) 기능을 사용하여 충분한 페이싱 속도로 페이싱 임계값을 측정합니다(그림 6). 다양한 자극 지속 시간(0.1ms에서 1.5ms까지)에 대한 페이싱 임계값을 평가하고 볼트로 표현합니다. 심장 내 전기 측정 또는 표면 ECG를 사용하여 페이싱 자극 출력이 임계 이하가 될 때 캡처 손실을 결정합니다.
- 표준 수의학 협약에 따라 모든 절차를 수행하고, 각 연구가 완료되면서의 제도적 규정에 따라 동물을 희생시키고, 부검을 수행하십시오. 심박 조율기와 납을 이식하고 염증 반응, 생물막 형성 및 섬유증을 검사합니다.
참고: 이 프로토콜에서 동물을 안락사시키기 위해 깊은 마취 하에 칼륨 과다 복용을 했습니다.
결과
총 6마리의 동물이 연구에 포함되었습니다. 모든 동물에서, 페이싱 리드는 외부 경정맥을 통해 우심실 정점 내로 성공적으로 이식되었다 (보충 그림 S1). 위치는 형광투시법으로 확인되었고, 납은 고무 슬리브를 통해 인접한 조직에 꿰매어졌다. X선 영상에 따르면 리드는 전체 페이싱 프로토콜 기간 동안 위치를 유지했습니다. 부착된 심박 조율기는 측면 목 부위에서 만져볼 수 있어 동물에게 명백한 문제를 일으키지 않았습니다. 모든 상처는 국소 합병증없이 완전히 치유되었습니다.
리드 팁에는 2개의 티타늄-백금 전극(원위 반구형 링과 근위 원통형 링 전극)이 장착되어 있으며 전극 간 거리는 25mm입니다(그림 2). 리드는 정점으로 자유롭게 전진하고 실리콘 고정 타인에 의해 수동적으로 부착되었습니다. 이것은 팁 전극에서 단극 페이싱과 우심실에 위치한 두 전극 사이의 바이폴라 페이싱을 허용했습니다.
대표적인 심실 심근 전위 감지 신호가 도 3에 도시되어 있고, 측정된 페이싱 파라미터가 표 1 및 도 7에 상세히 제시되어 있다. 시술 당시 평균 감지 심근 전위는 5.6V ± 0.8mV(최소: 2.8mV, 최대: 8mV), 리드 임피던스는 675V Ω ± 74 Ω(최소: 468 Ω, 최대: 951 Ω), 페이싱 임계값은 0.8V ± 0.26V(최소: 0.2V, 최대: 2.2V)였으며 자극 기간은 표준 0.4ms로 설정되었습니다.
간헐적 페이싱으로 3개월 및 6개월의 추적 관찰 후, 평균 감지 심근 전위는 각각 7.4mV ± 1.2mV(최소: 4.0mV, 최대: 12.0mV) 및 6.3mV ± 1.0mV(최소: 4.2mV, 최대: 10.3mV)였습니다. 측정된 평균 리드 임피던스는 각각 32 Ω Ω ± 869V(최소: 760 Ω, 최대: 975 Ω) 및 725 Ω ± 96 Ω(최소: 370 Ω, 최대: 1014 Ω)였으며 페이싱 임계값은 1.2V ± 0.3V(최소: 0.2V, 최대: 2.2V) 및 1.4V ± 0.3V(최소: 0.5V, 최대: 2.3V)로 변경되었습니다. 각각. 모든 매개변수 변화는 이 기간 동안 통계적으로 유의하지 않았으며(P > 0.05), 양극성 및 단극성 매개변수는 유사한 경향을 따랐습니다(그림 7 및 표 1).
한 사례는 부분적인 납 침투로 인해 조기에 종료되었으며, 이는 이식 후 2일째에 관찰된 급격한 임피던스 강하를 나타냈습니다. 나중에, 추적 관찰의 두 번째 달 동안, 점진적인 역치 증가가 발견되었고, 높은 출력에 대한 페이싱은 근육 근막을 일으켰습니다. 동물은 무증상으로 남아 있었지만, 부검 중에 페이싱 리드의 끝이 심근 하벽을 통해 심낭으로 약 3mm 길이로 침투 한 것으로 밝혀졌습니다. 출혈이나 감염 징후는 관찰되지 않았습니다.
시술 전, 시술 후 1일째 및 시술 후 7일째에 평균 백혈구 수는 각각 10 9/L× 5.9, 10 9/L× 7.37 및 109/L 7.42 ×이었고, 평균 혈소판 수치는 각각 105g/L, 113g/L, 110g/L이었고, 평균 혈소판 수는 109/L× 317이었고, 각각 274 × 10 9/L, 219 × 109/L입니다. 실험실 값은 시술 후 첫 주 동안 유의미한 변화를 나타내지 않았습니다(P > 0.05 모두). 현미경 평가에서 페이싱 리드 실리콘 표면은 섬유 조직(대략 두께 100μm)으로 덮여 있었지만 세포는 발견되지 않았습니다(그림 8).
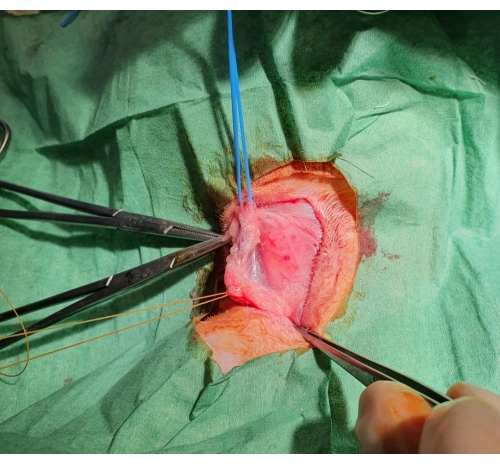
그림 1: 외과적 경정맥 절제술. 피부가 절단된 후 피하 주머니가 형성되고 경정맥이 노출되고 원위부로 결찰되고 근위부에 파란색 고무 밴드로 지지됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
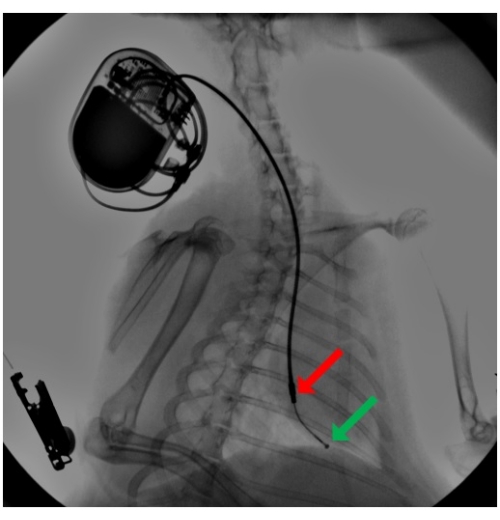
그림 2: 심박 조율기 리드 이식 중 형광투시법. 페이싱 리드는 외부 경정맥을 통해 도입되고 미리 형성된 스타일릿을 사용하여 리드는 우심실 정점으로 진행되어 실리콘 타인에 의한 수동 고정으로 고정됩니다. 부착 된 심박 조율기는 목 부위의 피하 주머니에 묻혀 있습니다. 화살표는 원위 반구형 링(녹색)과 근위 원통형 링(빨간색) 전극을 가리킵니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
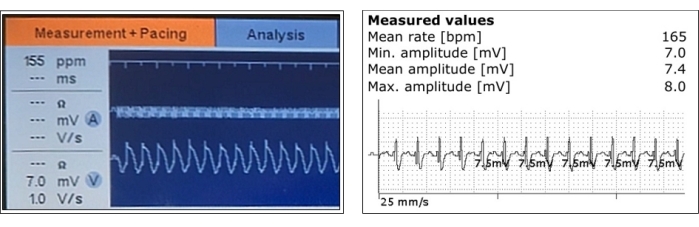
그림 3: 감지된 심실 심근 전위의 대표적인 측정. 심실 감지 및 진폭 측정은 페이싱 리드 포지셔닝 후(왼쪽)와 심박 조율기 이식 후(오른쪽) 급성기에 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
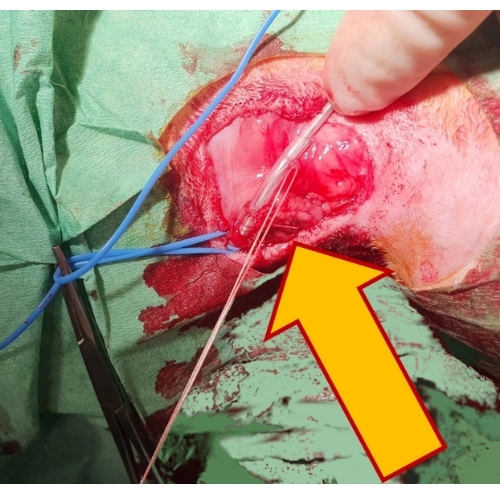
그림 4: 페이싱 리드 고정. 고무 슬리브(화살표) 위에 있는 두 개의 비흡수성 봉합사로 리드를 기본 조직에 고정하면 리드가 제자리에 고정되고 탈구를 방지할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
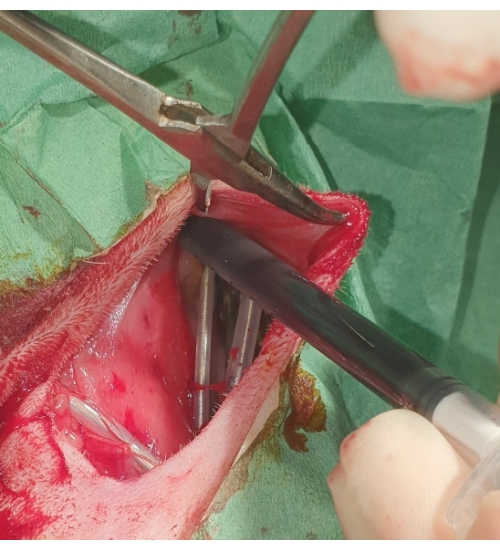
그림 5: 심박 조율기 배치. 심박 조율기는 피하 주머니에 묻히고 포비돈 요오드로 씻어냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
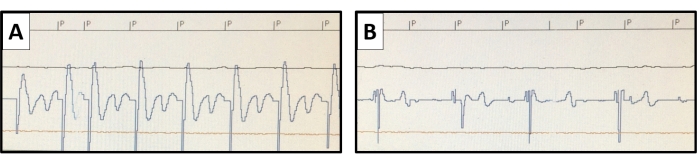
그림 6: 페이싱 임계값 측정. 심박 조율기의 비침습적 페이싱 연구 기능을 사용하여 기본 심박수보다 높은 페이싱을 수행합니다. 페이싱 자극은 P로 표시됩니다. 페이싱 임계값은 다양한 자극 출력으로 평가됩니다. (A) 심실 포획의 심내막 전위의 대표적인 예는 0.4ms에서 0.8V의 출력에 대해 표시되지만 (B) 0.4ms에서 0.6V로 감소된 출력으로 포획 손실이 나타납니다 . 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
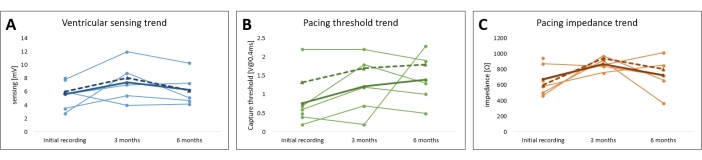
그림 7: leporine 심장 조율 모델 조율 매개변수의 후속 조치. 모든 피험자에 대한 (A) 페이싱 역치, (B) 페이싱 임피던스 및 (C) 심근 감지의 추세가 플롯됩니다. 평균 단극(full line)과 양극성 값(dotted line)은 굵은 글씨체로 표시되어 있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
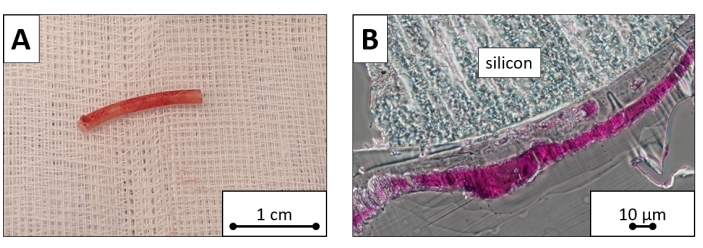
그림 8: Explanted 페이싱 리드 샘플. 심실 부분 절단, explanted, 페이싱 리드. (A) 톨루이딘 블루로 염색된 거시적 이미지 및 (B) 현미경 이미지는 섬유 조직 층으로 덮인 실리콘 표면을 나타냅니다. 스케일 바 = (A ) 1cm, (B) 10 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
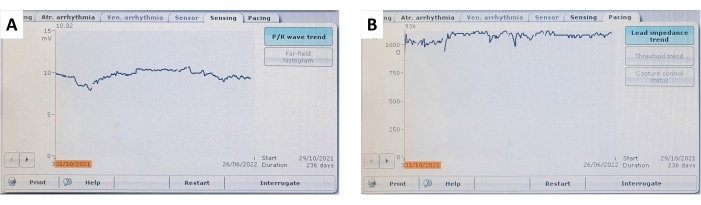
그림 9: 심실 감지 및 리드 임피던스 추세. (A) 지속적이고 안정적인 심실 심근 감지 및 (B) 236일의 추적 관찰 기간 동안 심실 리드 임피던스 경향의 대표적인 예입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
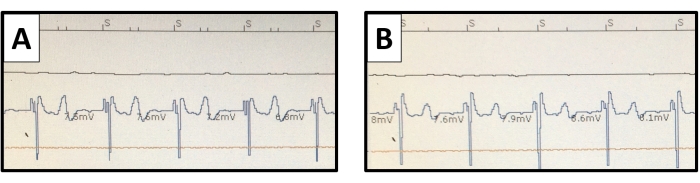
그림 10: 심실 심내막 전기사진. 심박 조율기 심문 감지 심실 전위는 (A) 단극 및 (B) 양극성 연결로 표시됩니다. T파 전위는 단극 연결에서 더 뚜렷하지만 과잉 감지를 일으키지 않습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 유 니 폴라 | 시술 전후 | 후속 조치 | |||||||
| 3 개월 | 6 개월 | ||||||||
| 감지된 심근 전위[mV] | 5.6 ± 0.8 | 7.4 ± 1.2 | 6.3 ± 1.0 | ||||||
| 페이싱 임계값 [V at 0.4 ms] | 0.8 ± 0.3 | 1.2 ± 0.3 | 1.4 ± 0.3 | ||||||
| 리드 임피던스 [Ω] | 675 ± 74 | 869 ± 32 | 725 ± 96 | ||||||
표 1: 레포린 심장 조율 모델 조율 매개변수의 후속 조치. 감지된 심근 전위, 페이싱 역치 및 리드 임피던스의 값은 추적 관찰 3개월 및 6개월 동안 평균 ± SEM으로 표현됩니다.
보충 그림 S1: 토끼에 이식된 인간 크기의 경정맥 페이싱 시스템의 개략도. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
특정 제약에도 불구하고, 작은 포유류 모델은 임상 연구에 이점을 제공한다13. 확립된 방법론을 통해 심장 조율 모델은 대규모 동물 모델이나 임상 시험에 비해 훨씬 낮은 리소스 요구량으로 광범위한 심혈관 질환 및 순환기 병리학적 상태7,14의 시뮬레이션을 위한 최적의 플랫폼을 제공할 수 있습니다. 이 논문은 토끼의 오래 지속되는 심장 박동에 대한 혁신적이고 최소 침습적 모델을 제시합니다. 이 프로토콜을 따르면 작은 포유류 모델에서 전체 길이 페이싱 리드를 포함하여 완전히 이식된 전체 크기의 인간 심박 조율기 시스템을 사용하는 것이 가능합니다.
심박 조율기 이식 당시 우리는 모든 동물의 우심실 정점에 있는 안정적이고 최적의 위치에 리드를 배치할 수 있었습니다. 침습적으로 측정된 페이싱 파라미터는 정상 범위 내에 있었으며, 이는 대규모 동물 실험이나 인간 의학에서 흔히 볼 수 있는 값과 유사했다 2,3. 우심실에서 6.5 mV ± 1.9 mV의 측정된 평균 심근 전위는 표준 이식형 심박 조율기에 의해 명확하게 인식됩니다. 측정된 최대 페이싱 임계값은 2.5V이고 자극 지속 시간은 0.4ms였으며 임피던스는 후속 조치 동안 정상 범위 내에 유지되었습니다. 전반적으로 이는 최적의 페이싱 매개변수를 나타냅니다.
추적 관찰 동안 주입된 심박 조율기를 조사하여 페이싱 매개변수를 비침습적으로 확인했으며 이러한 매개변수는 그림 7, 그림 9 및 표 1에 요약되어 있습니다. 심실 감지 및 납 임피던스는 6개월 동안 유의미한 변화를 나타내지 않았습니다. 모든 피험자에 걸쳐 평균화된 페이싱 임계값의 증가 추세에도 불구하고 유의미한 변화가 관찰되지 않아 전체 연구에서 페이싱을 안전하게 수행할 수 있었습니다. 페이싱 매개변수의 작은 변동은 국소 염증 반응 또는 섬유증에 기인할 수 있으며 스테로이드 용출 물질을 사용하여 완화할 수 있습니다. 장기 페이싱 연구에 사용하려면 페이싱 매개변수를 자주 모니터링하고 조정해야 합니다.
혈액 분석은 이식 후 첫 주 동안 전신 염증이나 빈혈을 시사하지 않았습니다. 시술 전 혈소판 수가 증가하는 경향은 추적 관찰 기간 동안 수치가 안정적으로 유지되었기 때문에 동물 취급 및 진정으로 인한 급성 스트레스에 기인할 수 있습니다. 심박 조율기 이식의 두려운 합병증은 납 침투입니다. 특히 작은 포유류 조직의 취약성으로 인해 페이싱 매개변수가 갑자기 변경될 때 침투를 의심해야 하며 리드는 항상 적절한 위치로 조심스럽게 조작되어야 한다는 점을 강조해야 합니다. X선 영상으로 납 침투를 확인할 수 있습니다. 급성 심장 이식형 전자 장치(CIED) 관련 세균 감염은 사망률과 이환율에 크게 기여하는 또 다른 잠재적으로 심각한 합병증이다15. 따라서 감염률을 줄이고 페이싱 시스템의 내구성을 확장하기 위해 새로운 재료, 페이싱 기술 및 리드 미세 조정을 연구하는 것이 매우 중요합니다. 제시된 방법론은 이러한 중요한 실험 연구에 적합한 동물 모델을 제공합니다.
Ryu et al. 외과적으로 이식된 심방 조율 리드와 외부 펄스 발생기를 사용하여 진행성 심부전을 동반한 유도 심근병증12. 유사하게, Freeman et al. 지속적인 심실 조율은 3-4주 동안 토끼에서 심근 억제를 유발한다고 결론지었다11. 작은 동물의 높은 기본 심박수로 인해 심박 조율기는 완전히 페이스된 리듬을 유지하기 위해 약 300-400bpm의 주파수를 조절할 수 있어야 합니다. 이러한 더 높은 페이싱 빈도는11,12주 동안 진행성 심부전으로 이어지기 때문에 제시된 레포린 모델은 결과적인 심근병증의 발병 및 조사에 최적입니다. 이들의 크기를 고려할 때, 이러한 소형 모델은 체액성 또는 심근 조직 변화의 평가와 같은 특정 용도에 이상적이다11,16. 심초음파는 레포린 심장의 치수 및 수축성을 평가하기 위해 추가로 사용될 수 있다12,17. 이에 비해 심부전의 대규모 동물 모델은 관상순환 또는 압력-부피 평가를 포함한 상세한 침습적 혈역학적 평가의 가능성과 같은 다른 장점이 있다2.
페이싱 연구를 위한 레포린 모델의 특정 선택은 여러 이점을 기반으로 했습니다. 토끼는 절차를 잘 견뎌내고, 인간 크기의 심박 조율기 시스템을받을 수있는 능력을 입증하는 가장 작은 포유류 중 하나이며, 다른 큰 동물보다 적은 자원을 배치해야합니다. 일부 저자18는 작은 포유류의 생리학이 인간의 생리학을 반영하지 않을 수 있다고 생각하지만, 우리는 이러한 작은 포유류에서 관찰되는 속도 매개변수가 인간이나 큰 동물에서 관찰되는 것과 매우 유사하다는 것을 발견했습니다 1,2,3,19, 이는 중개 연구에 쉽게 활용될 수 있음을 의미합니다.
이 작은 포유류 모델에서 납 배치 및 심박 조율기 이식 중에 우리는 대형 동물 모델에서 이전 실험과 유사점을 발견했지만 중요한 차이점을 지적해야 합니다. Leporine 조직은 깨지기 쉽고 혈관과 심실 벽은 얇습니다. 전체 절차 중에 부드러운 조작이 필요합니다. 리드 팁은 항상 스타일릿에 의해 지지되지 않아야 하므로 유연해야 합니다. 특히 삼첨판 고리를 통과하고 리드 팁을 우심실의 정점에 위치시킬 때 부상을 방지하기 위해 극도의 주의와 형광 투시 유도 하에 조작을 수행해야 합니다. 팁을 다른 위치에 배치하는 것도 가능해야 합니다. 최적의 시술 전후 매개변수로 우심방 부속기 및 심실 유출로 위치를 테스트했지만 납 안정성이 제한될 수 있으며 현재 데이터는 대체 페이싱 부위를 지원할 수 없습니다. 토끼의 외부 경정맥은 단일 페이싱 리드를 삽입하기에 적절한 크기입니다. 여러 리드를 이식하려는 경우 더 큰 동물을 사용하는 것이 좋습니다.
심근 섬유주에서 납 고정은 납 팁에 실리콘 타인을 사용하여 수동적으로 수행되었습니다. 우리의 경험에 비추어 볼 때, 탐폰이나 흉부 출혈로 인한 조직 손상을 예방하기 위해 얇은 심근층에 나사로 고정된 나선에 의한 능동 고정의 사용을 피해야 합니다. 토끼 우심실의 작은 크기에도 불구하고 25mm 간격으로 배치된 한 쌍의 페이싱 전극은 단극 및 양극 감지 및 페이싱 구성을 모두 허용했습니다(그림 10). 이것은 심장 조율 연구에 다양성을 제공할 수 있습니다.
작은 포유동물(18)의 높은 기본 심박수로 인해, 이식형 심박조율기의 맞춤형 프로그래밍에 의해 연속적인 페이싱이 달성될 수 있다. 대안적으로, 일반적인 인간-인증된 페이싱 시스템의 간단한 사내 수정의 방법은, 이전에 상세히 설명된 바와 같이, 고율 페이싱 주파수를 얻기 위해 사용될 수 있다(2,20). 캡처 손실은 비침습적 페이싱 연구 기능을 사용하여 평가되었으며, 이는 높은 기본 심박수 조건에서도 테스트할 수 있는 고유한 접근 방식입니다. 보고된 페이싱 매개변수는 정기적으로 측정되었습니다. 이식된 심박 조율기는 심근 전위와 리드 임피던스의 감지를 자동으로 지속적으로 기록할 수 있었지만 높은 기본 심박수로 인해 페이싱 임계값을 수동으로 측정해야 했습니다. 따라서 지속적인 페이싱이 필요한 경우 캡처 손실을 방지하기 위해 빈번한 평가가 권장됩니다.
Gutruf et al. 이전에 작은 동물 모델에서 초소형, 무선, 배터리가 필요 없는 심박 조율기를 사용했다고 보고했습니다 7. 그들의 연구와 비교할 때, 여기에 설명 된 인간 크기의 심박 조율기의 이식은 혁신적인 리드 테스트, 임상 연구에 대한 긴밀한 번역 및 일반적으로 사용 가능한 재료를 사용한 광범위한 응용 가능성을 제공하는 다른 접근 방식을 나타냅니다. Zhou et al. 방실 차단을 치료하기 위해 태아 심장에 경피적으로 이식하도록 설계된 소형 심장 박동기의 개발을 발표했습니다. 그들은 그러한 장치의 타당성을 확인하기 위해 성인 토끼 실험의 사용을보고했다9. 다른 사람들은 이전에 침습적 절차에 대한 토끼 삽관의 이점을보고했습니다. 우리의 경험에 비추어 볼 때, 구강 비강 마스크로 자발 호흡을 유지하는 접근 방식은기도 조작으로 인한 합병증의 위험을 최소화하기 때문에 짧은 절차에 더 많은 이점이 있습니다. 또한 욕창 손상도 예방할 수 있습니다.
연구 프로토콜이 신중하게 준비되었고 포함된 총 동물 수가 적절했지만 몇 가지 제한 사항을 지적해야 합니다. 토끼 우심실의 크기가 작기 때문에 여러 리드 배치가 허용되지 않았습니다. 우심실 유출로에서 납 팁의 위치를 테스트하려고 시도했지만 안정성에 대한 지식이 제한되어 있으며 다소 제한적일 것으로 예상합니다. 페이싱 임피던스 추세는 리드 배치 후 첫 주 이내에 하락을 보였습니다. 이것은 국소 염증과 경미한 섬유증 때문일 수 있지만 얼마 지나지 않아 납 임피던스가 회복되었고 안정성 추세가 지속적으로 유지되었습니다. 이 연구에서는 단일 챔버 페이싱 시스템이 사용되었습니다. 향후 연구에서는 편측 경정맥을 통해 한 쌍의 페이싱 리드를 진행시키는 것도 조사해야 합니다. 이 연구에서는 테스트되지 않았지만 우심방에 두 번째 리드가 도입되고 안정화될 수 있다고 믿습니다.
일반적으로 심장 박동의 동물 모델은 심혈관 연구에 많이 응용됩니다. 첫째, 몇 주에 걸쳐 비생리학적 고주파에서의 페이싱은 이전에 보고된 바와 같이 빈맥 유발 심근병증을 유발하고 만성 심부전의 병태생리학 및 치료에 대한 연구를 허용합니다 2,3,11,12. 또한, 정제된 재료 및 기술에 대한 연구는 제시된 레포린 모델을 활용할 수 있으며, 이는 중기 페이싱 연구에 제안될 수 있습니다. 우리가 아는 한, 이 연구는 복잡한 심장 조율 실험에 대한 이러한 작은 포유류 모델의 이점을 입증한 최초의 연구입니다21. 결론적으로, 설명된 방법론을 사용하면 조직의 취약성과 섬세한 해부학에도 불구하고 인간 크기의 페이싱 시스템을 작은 포유류에 성공적으로 이식할 수 있습니다. 훈련 후 이 기술은 쉽게 재현할 수 있으며 심혈관 연구에서 광범위하게 적용되는 페이싱된 빈맥 모델의 기초를 제공합니다.
공개
저자는 이해 상충이 없습니다.
감사의 말
저자는 Maria Kim, Jana Bortelová, Alena Ehrlichová, Matěj Hrachovina, Leoš Tejkl, Jana Míšková 및 Tereza Vavříková의 영감, 작업 및 기술 지원에 대한 조언과 도움에 감사드립니다. 이 작업은 MH CZ-DRO (NNH, 00023884), IG200501 보조금으로 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| Medication | |||
| atipamezole | Eurovet Animal Health, B.V. | Atipam | anesthetic |
| buprenorphine | Vetoquinol | Bupaq | analgetic |
| enrofloxacin | Krka | Enroxil | antibiotic |
| isoflurane | Baxter | Aerrane | anesthetic |
| ketamine hydrochloride | Richter Gedeon | Calypsol | anesthetic |
| medetomidine | Orion Corp. | Domitor | anesthetic |
| meloxicam | Cymedica | Melovem | analgetic |
| povidone iodine | Egis Praha | Betadine | disinfection |
| Silver Aluminium Aerosol | Henry Schein | 9003273 | tincture |
| Surgical materials | |||
| 2-0 Perma-Hand Silk | Ethicon | A185H | silk tie suture |
| 2-0 Vicryl | Ethicon | V323H | absorbable braided suture |
| 4-0 Monocryl | Ethicon | MCP494G | monofilament |
| BearHugger | 3M | BearHugger | heating pad |
| cauterizer | |||
| Metzenbaum scissors, lancet with #22 blade, DeBakey forceps, needle driver | basic surgical equipment | ||
| sterile drapes | |||
| Diagnostic devices | |||
| Acuson VF10-5 | Siemens Healthcare | sonographic vascular probe | |
| Acuson x300 | Siemens Healthcare | ultrasound system | |
| ESP C-arm | GE Healthcare | ESP | X-ray fluoro C-arm |
| Pacing devices | |||
| 400 | Medico | CAT400 | bipolar pacing lead |
| Effecta DR | Biotronic | 371199 | implantable pacemaker |
| ERA 3000 | Biotronic | 128828 | external pacemaker |
| ICS 3000 | Biotronic | 349528 | pacemaker programmer |
참고문헌
- Power, J. M., Tonkin, A. M. Large animal models of heart failure. Australian and New Zealand Journal of Medicine. 29 (3), 395-402 (2008).
- Hála, P., et al. Tachycardia-induced cardiomyopathy as a chronic heart failure model in swine. Journal of Visualized Experiments. (132), e57030(2018).
- Powers, J. C., Recchia, F. Canine model of pacing-induced heart failure. Methods in Molecular Biology. 1816, 309-325 (2018).
- Whipple, G. H., Sheffield, L. T., Woodman, E. G., Theophilis, C., Friedman, S. Reversible congestive heart failure due to chronic rapid stimulation of the normal heart. Proceedings of the New England Cardiovascular Society. 20, 39-40 (1962).
- Laughner, J. I., et al. A fully implantable pacemaker for the mouse: From battery to wireless power. PLoS One. 8 (10), 76291(2013).
- Yue-Chun, L., et al. Establishment of a canine model of cardiac memory using endocardial pacing via internal jugular vein. BMC Cardiovascular Disorders. 10, 30(2010).
- Gutruf, P., et al. Wireless, battery-free, fully implantable multimodal and multisite pacemakers for applications in small animal models. Nature Communications. 10 (1), 5742(2019).
- Zhou, L., et al. A percutaneously implantable fetal pacemaker. Annual International Conference of the IEEE Engineering in Medicine and Biology Society. 2014, 4459-4463 (2014).
- Zhou, L., Chmait, R., Bar-Cohen, Y., Peck, R. A., Loeb, G. E. Percutaneously injectable fetal pacemaker: Electrodes, mechanical design and implantation. Annual International Conference of the IEEE Engineering in Medicine and Biology Society. 2012, 6600-6603 (2012).
- Jordan, C. P., et al. Minimally invasive resynchronization pacemaker: A pediatric animal model. The Annals of Thoracic Surgery. 96 (6), 2210-2213 (2013).
- Freeman, G. L., Colston, J. T. Myocardial depression produced by sustained tachycardia in rabbits. American Journal of Physiology. 262, 63-67 (1992).
- Ryu, K. H., et al. Force-frequency relations in the failing rabbit heart and responses to adrenergic stimulation. Journal of Cardiac Failure. 3 (1), 27-39 (1997).
- Hulsmans, M., et al. A miniaturized, programmable pacemaker for long-term studies in the mouse. Circulation Research. 123 (11), 1208-1219 (2018).
- Nishida, K., Michael, G., Dobrev, D., Nattel, S. Animal models for atrial fibrillation: Clinical insights and scientific opportunities. Europace. 12 (2), 160-172 (2010).
- Clementy, N., et al. Pacemaker complications and costs: A nationwide economic study. Journal of Medical Economics. 22 (11), 1171-1178 (2019).
- Armoundas, A. A., et al. Cellular and molecular determinants of altered Ca2+ handling in the failing rabbit heart: primary defects in SR Ca2+ uptake and release mechanisms. American Journal of Physiology-Heart and Circulatory Physiology. 292 (3), 1607-1618 (2007).
- Giraldo, A., Talavera López, J., Brooks, G., Fernández-Del-Palacio, M. J. Transthoracic echocardiographic examination in the rabbit model. Journal of Visualized Experiments. (148), e59457(2019).
- Spannbauer, A., et al. Large animal models of heart failure with reduced ejection fraction (HFrEF). Frontiers in Cardiovascular Medicine. 6, 117(2019).
- Byrne, M. J., et al. An ovine model of tachycardia-induced degenerative dilated cardiomyopathy and heart failure with prolonged onset. Journal of Cardiac Failure. 8 (2), 108-115 (2002).
- Hála, P., et al. Increasing venoarterial extracorporeal membrane oxygenation flow puts higher demands on left ventricular work in a porcine model of chronic heart failure. Journal of Translational Medicine. 18 (1), 75(2020).
- Riehle, C., Bauersachs, J. Small animal models of heart failure. Cardiovascular Research. 115 (13), 1838-1849 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유